杂质研究及案例分析--药品审评中心
CDE培训课件杂质研究及案例分析课程

限度实验:至少应关注和验证专属性、检测限、耐用性
充分的方法验证
专属性研究
原料药合成中间体、粗品等的分离度考察 原料药及其制剂的强制破坏实验 制剂的辅料干扰实验 杂质加入实验 和药典方法或经论证的其它方法进行比较 峰纯度检查(二极管阵列检测、质谱检测)
前提:被仿品的杂质已得到充分研究,安全性已得到
论证
仿制药杂质研究的特点
杂质对比研究结果分析
杂质谱与被仿品一致或杂质种类较被仿品少,无超过鉴定 限度的新杂质;各杂质含量不超过被仿品
——试制品的杂质控制达到了研究目标 杂质谱与被仿品一致或杂质种类较被仿品少,无超过鉴定
限度的新杂质;但已知杂质含量超过了被仿品 ——改进工艺,降低杂质含量
..\..\化学药品指导原则\化学药物杂质研究技术指导原则.pdf
例:盐酸帕罗西汀
F
O
O
N , HCl , 1/2H2O
O
EP、USP收载,列出7个已知杂质A-G
HPLC法:控制杂质A(去氟物)0.3%,其它单一杂 质0.1%,总杂质不得过0.5%
手性HPLC控制杂质D(对映异构体)不得过0.2%
以EP标准中的检验方法及限度为参考依据,进行必要的方法 验证
试制样品杂质检查结果符合EP标准要求,无超过鉴定限度的 其它杂质——达到研究目标
若杂质谱与EP标准一致,但杂质量超过限度要求——完善工 艺(精制:优化工艺参数;控制起始原料及中间体质量)
出现超过鉴定限度(0.1%)的新杂质——鉴定结构,分析原 因,修改完善工艺,降低杂质量至0.1%以下。
HPLC法实验结果
杂质达7%以上
方法的比较研究显示,TLC法不适于本品的有关物质检查
国家食品药品监督局药品审评中心化学药品药学研究的技术要求及常见问题分析

幻灯片9.3
性状:药物特性和质量的表征
1、外观:色泽、嗅、味、结晶形状,一般稳定性情况 2、溶解度:采用药典凡例中分等级方式,溶剂可采用
极性不同与工艺相关的(尤其精制溶剂). 3、物理常数:熔 点:范围3-4℃ ,熔矩<2℃
比旋度:光学活性化合物的固有特性及 纯度。注意:温度、浓度对测 定影响。 药典规定:200C,589um
幻灯片4.2.1
制剂辅料的要求(药监注函568号文)
1、国家标准 (中国药典、部颁)
2、进口辅料 附进口许可证、质量标准及口岸检验报告
3、习用辅料,提供依据并制订相应的质量标准 4、特殊需要、用量较小辅料:指国外药典上收载,
国外制剂上使用过的辅料,提供依据,质量标准 和检验结果。 5、食品添加剂:提供依据,质量标准。 6、国内外未使用过辅料,按新辅料与制剂同时申报。
1、按中国药典规定进行波长校正,并报告 测定数据。
2、供试品制备: ⑴ 尽量采用易溶中性溶剂; ⑵ 发色团上存在酸性或碱性基因,化合 物可增加0.1N HCL、0.1N NaOH的水溶 液以观察吸收带移动情况。
幻灯片7.3(续)
紫外—可见吸收光谱(UV-VIS)分析要求
3、制图要求: ⑴ 录制紫外可见区的全部吸收峰,不得遗 漏,不得截止,最强吸收度不得高于1.0。 ⑵ 必要时可分段以不同浓度试样溶液录制 图谱。
幻灯片1
注册分类:
1、未在国内外上市销售的药品。 2、改变给药途径尚未在国内外上市销售的制剂。 3、已在国外上市销售但尚未在国内上市销售的药
品。 4、改变已上市销售盐类药物的酸根、碱基(或者
金属元素),但不改变其药理作用的原料药及其 制剂。 5、改变国内已上市销售药品的剂型,但不改变给 药途径的制剂。 6、已有国家药品标准的原料药或者制剂。
实验一 药物的杂质检查、阿司匹林的质量分析
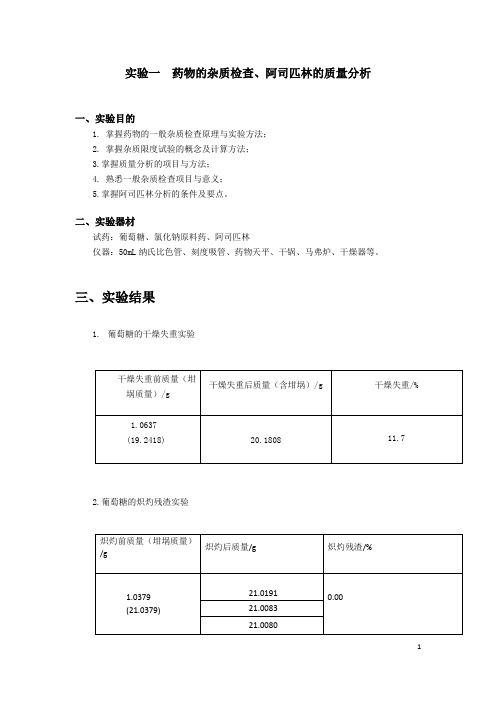
实验一药物的杂质检查、阿司匹林的质量分析
一、实验目的
1. 掌握药物的一般杂质检查原理与实验方法;
2. 掌握杂质限度试验的概念及计算方法;
3.掌握质量分析的项目与方法;
4. 熟悉一般杂质检查项目与意义;
5.掌握阿司匹林分析的条件及要点。
二、实验器材
试药:葡萄糖、氯化钠原料药、阿司匹林
仪器:50mL纳氏比色管、刻度吸管、药物天平、干锅、马弗炉、干燥器等。
三、实验结果
1.葡萄糖的干燥失重实验
2.葡萄糖的炽灼残渣实验
单位名称
药品检验报告书报告书编号:20121022
检验者:复核者:×××负责人:
单位名称
药品检验报告书报告书编号:20121023
检验结论:本品符合《中国药典》2010年版第二部的标准。
检验者:复核者:×××负责人:附图:
(1)
(2)
(3)
(4)
(5)
(6)
(7)
(8)
(9)
(10)。
药物杂质研究方法详解

药物杂质研究方法详解近年来,随着药物研究的不断深入以及杂质研究要求不断提高,杂质的分析技术以及研究方法正发生着重要的改变。
在对杂质建立分析方法时,清晰的杂质研究过程是方法建立的基础,而且选择合适的分析技术也至关重要。
杂质的来源分析药物中的杂质可能来源于药物生产以及销售等各个环节(图1)。
根据ICH 指导原则可将药物杂质分为有机杂质、无机杂质、残留溶剂以及其他杂质。
本文主要针对有机杂质进行探讨。
对药物杂质研究时引入“质量源于设计( Quality byDesign,QbD)”的理念,可在药物生产之前根据具体工艺的合成机制、起始物料及各中间体的基本结构,初步勾画出产品的杂质谱。
杂质来源分析是制定药物杂质控制策略的基础,尤其是在对毒性杂质来源分析时,应分析所有合成和生产工艺中的试剂、中间体、副产物,推测可能产生的潜在杂质以及分析实际存在的杂质。
在原料药合成结束后,药物的活性化合物虽然经过毒性分析已不含有“警示结构”(alerting structure),但是在生产过程中使用到含有警示结构的化合物则还需考虑其遗传毒性。
杂质的研究方法在药物研发过程中,药物杂质的分析是关键。
因此,在杂质研究中清晰的杂质结构研思路(如图2)以及合适的杂质分析技术可极大地缩短杂质研究时间,推动着药物研究的快速发展。
1、杂质前处理技术杂质的前处理是伴随着药物活性成分前处理而存在的,然而药物中杂质的含量低且其结构与主成分差异较大,因此常规药物活性成分的前处理和检测方法(如初始流动相溶解后直接进行HPLC-UV 分析)并不一定适用于药物杂质,应针对不同的样品选择不同的前处理技术。
(1)检测灵敏度低的样品对检测灵敏度低的样品通常使用衍生化的前处理方式,比如引入生色团产生紫外响应,或增加易离子化基团增加离子化效率等。
虽然常规衍生化方式能够满足日常检测的需求,但是为了实现对低浓度的基因杂质进行快速筛选和定量,可对传统的衍生化试剂进行改变以增加其专属性和灵敏度,也可使用气-固衍生化来弥补液-固衍生化的不足。
药审中心:有关物质分析方法学验证的项目及可接受标准

有关物质分析方法学验证的项目及可接受标准药审中心黄晓龙药品中的有关物质泛指在药品的生产与储存过程中产生的工艺杂质或降解产物。
本文结合国外一些大型药品研发企业在此方面的要求,提出了在对有关物质检查方法进行验证时的可接受标准,供国内的药品研发单位在进行研究时参考。
1.准确度该指标主要是通过回收率来反映。
验证时一般要求根据有关物质的定量限与质量标准中该杂质的限度分别配制三个浓度的供试品溶液各三份(例如某杂质的限度为0.2%,则可分别配制该杂质浓度为0.1%、0.2%和0.3%的杂质溶液),分别测定其含量,将实测值与理论值比较,计算回收率,并计算9个回收率数据的相对标准差(RSD)。
该项目的可接受标准为:各浓度下的平均回收率均应在80%-120%之间,如杂质的浓度为定量限,则该浓度下的平均回收率可放宽至70%-130%,相对标准差应不大于10%。
2.线性线性一般通过线性回归方程的形式来表示。
在定量限至一定的浓度范围内配制6份浓度不同的供试液,分别测定该杂质峰的面积,计算相应的含量。
以含量为横坐标(X),峰面积为纵坐标(Y),进行线性回归分析。
可接受的标准为:回归线的相关系数(R)不得小于0.990,Y轴截距应在100%响应值的25%以内,响应因子的相对标准差应不大于10%。
3.精密度1)重复性配制6份杂质浓度(一般为0.1%)相同的供试品溶液,由一个分析人员在尽可能相同的条件下进行测试,所得6份供试液含量的相对标准差应不大于15%。
2)中间精密度配制6份杂质浓度(一般为0.1%)相同的供试品溶液,分别由两个分析人员使用不同的仪器与试剂进行测试,所得12个含量数据的相对标准差应不大于20%。
4.专属性可接受的标准为:空白对照应无干扰,该杂质峰与其它峰应能完全分离,分离度不得小于2.0。
5.检测限杂质峰与噪音峰信号的强度比应不得小于3。
6.定量限杂质峰与噪音峰信号的强度比应不得小于10。
另外,配制6份最低定量限浓度的溶液,所测6份溶液杂质峰保留时间的相对标准差应不大于2.0%,峰面积的相对标准差应不大于5.0%。
我国仿制药杂质研究中常见问题分析_李雪梅

Analysis of common problems in the impurity research of chemical generics in China
LI Xue-mei,ZHANG Zhe-feng ( Center for Drug Evaluation,State of Food and Drug Administration,Beijing 100038,China)
[Abstract] Impurity research is the important content of generics research. Impurity research and control of chemical generics are one of the most important elements of drug safety and R&D risk control. In this paper,we analyzed the impurity problems in chemical generics,and put forward some suggestions for reference.
例 1:某一仿制药参照国家标准中有关物质检 查方法,规定 “记录色谱图至主成分保留时间的 2 倍”,但提供的质量研究和稳定性研究图谱均显示, 申报样品在主成分相对保留时间 2. 6 倍处有一大杂 质峰,说明其参照的国家标准中有关物质检测方法 不能有效控制申报产品的杂质。
另外,虽然有些申请人关注调节了记录仪的量程, 使所有杂质峰能显示,而未要求色谱峰的积分阈,会出 现微量杂质峰不被积分、灵敏度不符合要求等情况。
10.化药注射剂元素杂质研究

2μg/ml→3μg/ml • 纠正Ni吸入途径PDE
• 2017.06 加入ICH • 2020.01 发布第7号公告
*幻灯片中Q3D均指R1版本
3
一、前言
安全性评估
风险评估和 风险控制
2
二、风险评估
风
险
1 识别药品中已知和潜在元素杂质来源
100kg 8kg 0.2kg
1.44kg
0.24kg 1L 980L
单剂量处方 (1ml) 100mg 8mg 0.2mg
1.44mg
0.24mg 0.001ml 0.98ml
19
来源:ICH Q3D Training Package Module 8-2
六、案例-药品组分评估
风险评估
原料药
原料药由3个起始物料(SM)经五步反应合成
包装系统可能迁移至原料药和药品中的元素
• 直接接触药液容器/ 组件相容性研究
• 使用符合药典标 准的注射用水可 以降低风险
水
生产设备
原料药 • 有意添加的催化剂或无机试剂
• 包装系统相 容性研究
• 可能存在的元素
药品中 元素杂质
包装系统
辅料 • 同原料药
6
来源:ICH Q3D;参考:《化学药品注射剂仿制药质量和疗效一致性评价技术要求》
• 对于一些具有固有变异性的组分(如矿物来源辅料),还需要额外数据
风险评估总结
• 以表格和文字形式对评估考虑和结论进行总结
10
来源:ICH Q3D
三、风险控制
药品中元素杂质水平超过控制阈值,需采 取额外措施
变更生产工艺,通过纯化步骤,降低至控制阈值之下
药品研发如何确定杂质限度

中国医药报/2003年/12月/27日/第004版药品研发如何确定杂质限度国家食品药品监督管理局药品审评中心黄晓龙在药品研发中,如何证实药品安全有效应该是研发人员始终关注的问题;而药品质量的稳定可控又是保证其安全有效的前提与基础。
如果一个药品的质量不能达到稳定与可控,在使用时这一药品就不可能始终安全、有效,也就不能被批准上市。
保证药品质量稳定可控,药品的纯度是一个重点。
如何确定杂质的限度是药学研究人员与审评人员不能回避的关键问题,该限度的制订是否科学、合理,直接关系到药品的安全性与质量。
药品在临床使用中产生的不良反应除与该药品本身的药理活性有关外,也有一部分与药品中所混入的其它杂质有关。
例如,通过我国药学科技工作者数十年的努力,基本上确定青霉素等抗生素中的多聚物等高分子杂质是引起过敏的主要原因。
所以在研发过程中一定要对药品中的杂质进行全面研究,并将杂质完全准确地控制在一个合理的范围之内。
尽管杂质限度的确定对于药品研发非常重要,但国内药品研发的现实情况并不令人乐观。
从近几年的新药申报情况分析,在杂质的研究与限度确定方面存在着较多的问题,主要表现为:部分药品研究单位对杂质研究的重要性了解不深;标准中对杂质的控制不够全面与准确;制订杂质限度时考虑问题不够全面,很少考虑杂质对药品安全性的不良影响;即使在杂质的含量明显超出正常工艺所允许的范围时,也不注意对现有的处方与工艺进行必要的优化,以降低杂质的限度。
杂质的分类药品中的杂质一般分为三类:有机杂质、无机杂质及残留溶剂。
有机杂质是指在药品的生产与储存过程中产生的杂质,这些杂质可以是已知的、未知的、挥发性的或不挥发性的杂质,主要包括:降解产物、聚合物、原料药与辅料或内包材的反应产物、以及原料药制备过程中引入的起始原料、副产物、中间体、反应试剂、配位体与催化剂。
由于这些杂质的化学结构与产品分子类似或具渊源关系,所以通常称之为有关物质。
无机杂质是指在药品的生产过程中产生的杂质,这些杂质通常是已知的,主要包括:反应试剂、配位体与催化剂、重金属或其它残留的金属、无机盐、过滤助剂、活性炭等其它物质。
头孢菌素类仿制药的杂质谱研究共3篇

头孢菌素类仿制药的杂质谱研究共3篇头孢菌素类仿制药的杂质谱研究1头孢菌素类仿制药的杂质谱研究随着国内外药品市场的竞争日益激烈,仿制药的研发和生产已逐渐成为一种重要的药品开发途径。
头孢菌素类仿制药作为一种广泛使用的抗生素,在临床上应用广泛。
然而,在生产过程中可能会产生一些不纯的杂质,这些杂质可能对药物质量和药效产生影响。
因此,对头孢菌素类仿制药的杂质进行研究是非常重要的。
本文结合国内外相关研究,对头孢菌素类仿制药的杂质谱进行研究。
一、头孢菌素类仿制药的杂质头孢菌素类抗生素是一种广泛使用的药物类别,包括头孢菌素、头孢克洛、头孢唑林、头孢西丁等。
这些药物的结构特点为:它们的化学结构中含有3,4-二氧代呋咱环(β内酰胺环),又称为头孢菌素核心结构,具有较广的抗菌谱,对革兰阳性菌和革兰阴性菌均有一定的杀菌作用。
在头孢菌素类抗生素的生产中,可能会产生一些杂质。
常见的杂质有:对羟基苯甲酸酯、苯甲酸、脲酸、头孢西丁胺、3-acetylthioacetone、亚硝基头孢菌素、头孢菌素-S等。
其中,对羟基苯甲酸酯是一种比较常见的持久性有机污染物,因此在头孢菌素类仿制药中受到广泛关注。
二、头孢菌素类仿制药的杂质谱杂质谱对药物质量的控制有着非常重要的作用。
通过对药物中杂质的检测和分析,可以大大提高药品的质量和药效。
在头孢菌素类仿制药的杂质谱中,常用的检测技术包括高效液相色谱(HPLC)、毛细管电泳和质谱分析等。
其中,HPLC检测技术是最为常用的一种,它可以检测出头孢菌素类药物中的多种杂质,如对羟基苯甲酸酯、头孢西丁胺等。
同时,在HPLC检测中,还可以采用紫外检测器和荧光检测器等不同的检测方法。
另外,质谱分析技术也是一种非常有效的检测手段。
通过质谱分析技术,可以准确地分析出药物中的各种杂质,如3-acetylthioacetone、亚硝基头孢菌素等。
常用的质谱技术包括高分辨质谱(HRMS)、电喷雾质谱(ESI-MS)和飞行时间质谱(TOF-MS)等。
国家药品审评中心培训学习总结

国家药品审评中心培训学习总结国家药品审评中心培训学习总结国家药品审评中心培训学习总结202*年11月我作为一名外聘技术人员来到国家食品药品监督管理局药品审评中心参加药品审评培训学习,作为一名省级审评中心的工作人员,机遇难得,通过开始参加中心组织的基础培训课程,逐步了解了中心审评工作的程序和相关规范、技术要求和审评思路,认识到审评的重点是安全、有效和质量稳定可控;在随后一个多月部门安排的培训过程中,逐渐对药学专业的审评工作有了一定的认识,在审评中,我的指导老师及时点评我的报告,并把她们修改后的报告转发给我,通过对比两份报告以及与老师的当面交流,我对审评工作的理解加深,逐渐了解了一份高质量审评报告的两个基本要素:报告撰写内容的全面性、品种要点的突出性。
202*年1月,由于国家局整体工作的安排,我们外聘人员转入专项工作-过渡期品种集中审评。
过渡期品种集中审评是国家药品监督管理部门在一定的时间内,集中组织国内药学、医学专家和其他审评人员,按照药品注册的有关要求、程序和技术标准对202*年10月1日(即新修订《药品注册管理办法》实施日期)之前已受理但尚未完成审评的原《药品注册管理办法》所界定的中药注册分类8、9类注册申请和化学药品注册分类5、6类注册申请,包括同时按照注册分类3申报原料药、按照注册分类5或6申报制剂的化学药品进行的审评工作。
过渡期品种集中审评工作分两个阶段。
(1)比对资料阶段:对过渡期品种申报的药学、药理毒理以及临床试验资料进行比对,筛查出资料雷同、内容重复、数据编造的品种,着重解决申报资料的真实性问题。
(2)技术审评阶段:组织药学、医学和其他技术人员按照药品注册审评程序,以药品注册相关技术指导原则和审评要点为基础,进一步细化和完善技术标准,采取专家会议的方式集中进行技术审评,严格执行标准,统一把握尺度,着重解决申报品种的科学性问题。
作为化药专项组的一名成员参与了集中审评的两个阶段,使我认识到,做好药品注册研制现场核查和省级药监部门的初审工作是药品审评工作成功的重要保证。
有关物质限度

关于药品研发如何确定杂质限度的问题文发布者:来源:寻医问药网关于药品研发如何确定杂质限度的原因,关于药品研发如何确定杂质限度的相关知识。
国家食品药品监督管理局药品审评中心黄晓龙在药品研发中,如何证实药品安全有效应该是研发人员始终关注的问题;而药品质量的稳定可控又是保证其安全有效的前提与基础。
如果一个药品的质量不能锏轿榷ㄓ肟煽兀 谑褂檬闭庖灰┢肪筒豢赡苁贾瞻踩 ⒂行В 簿筒荒鼙慌?br>准上市。
保证药品质量稳定可控,药品的纯度是一个重点。
如何确定杂质的限度是药学研究人员与审评人员不能回避的关键问题,该限度的制订是否科学、合理,直接关系到药品的安全性与质量。
药品在临床使用中产生的不良反应除与该药品本身的药理活性有关外,也有一部分与药品中所混入的其它杂质有关。
例如,通过我国药学科技工作者数十年的努力,基本上确定青霉素等抗生素中的多聚物等高分子杂质是引起过敏的主要原因。
所以在研发过程中一定要对药品中的杂质进行全面研究,并将杂质完全准确地控制在一个合理的范围之内。
尽管杂质限度的确定对于药品研发非常重要,但国内药品研发的现实情况并不令人乐观。
从近几年的新药申报情况分析,在杂质的研究与限度确定方面存在着较多的问题,主要表现为:部分药品研究单位对杂质研究的重要性了解不深;标准中对杂质的控制不够全面与准确;制订杂质限度时考虑问题不够全面,很少考虑杂质对药品安全性的不良影响;即使在杂质的含量明显超出正常工艺所允许的范围时,也不注意对现有的处方与工艺进行必要的优化,以降低杂质的限度。
◆杂质的分类药品中的杂质一般分为三类:有机杂质、无机杂质及残留溶剂。
有机杂质是指在药品的生产与储存过程中产生的杂质,这些杂质可以是已知的、未知的、挥发性的或不挥发性的杂质,主要包括:降解产物、聚合物、原料药与辅料或内包材的反应产物、以及原料药制备过程中引入的起始原料、副产物、中间体、反应试剂、配位体与催化剂。
由于这些杂质的化学结构与产品分子类似或具渊源关系,所以通常称之为有关物质。
化药药物评价CTD申报资料中杂质研究的几个问题

20121226化药药物评价>>化药质量控制CTD申报资料中杂质研究的几个问题化药药学二部张哲峰成海平宁黎丽田洁摘要:杂质研究与控制是把控药品质量风险的重要内容之一,基于杂质谱分析的杂质控制是“质量源于设计”基本理念在杂质研究与控制中的具体实践,需要与CMC各项研究乃至药理毒理及临床安全性研究等环节关联思考、综合考虑,而不仅仅拘泥于提供准确的分析数据。
本文针对当前CTD申报资料中杂质研究方面存在的问题与不足,结合CTD过程控制和终点控制相结合、研究和验证相结合、全面系统的药品质量控制理念,探讨仿制药杂质研究与控制的基本逻辑思路,提出CTD申报资料中杂质研究与控制方面几个需要关注的问题。
关键词:杂质研究与控制杂质谱CTD格式杂质研究与控制是一项系统工程,需要以杂质谱分析为主线,安全性为核心,按照风险控制的策略,将杂质研究与CMC各项研究,乃至药理毒理及临床安全性研究等环节关联思考、综合考虑,而不仅仅拘泥于提供准确分析数据的传统思维,不是一项孤立的分析工作。
CTD(Common Technical Document)申报格式体现了过程控制和终点控制相结合、研究和验证相结合、全面系统的药品质量控制理念,更加符合杂质研究与控制的基本规律和逻辑思路。
自2011年4月起,药审中心陆续发布了多项有关CTD格式及技术审评的相关要求及电子刊物,对于国内研发单位正确理解CTD格式内含的基本精神起到了一定的促进作用,但就目前阶段的申报情况看,有些申报资料在杂质研究方面仍存在一些不足,仅仅是形式上的CTD 格式,尚未实质性贯彻CTD的基本逻辑思路。
以下是针对目前CTD申报资料中杂质研究相关问题的一些考虑。
1、CTD格式中杂质控制的考虑要体现在CMC的各个环节,而不是仅仅局限在“质量控制”模块。
如制剂的原辅料控制中,原辅料的选择与控制要考虑以符合制剂质量要求(杂质等)为核心,必要时进行精制处理并制定内控标准;关键工艺步骤及参数的确立、工艺开发过程等要考虑以杂质是否得到有效控制为重点关注之一;制剂相关特性中要体现与原研产品杂质谱等的对比情况;包材、贮藏条件以及有效期的确立等也要以杂质是否处于安全合理的可控范围内为核心等等。
药物中的杂质分析-杂质的来源和分类

---------------------------------------------------------------最新资料推荐------------------------------------------------------ 药物中的杂质分析-杂质的来源和分类药物中的杂质分析- - 杂质的来源和分类为了保证 APIs 及制剂的质量,必须在工艺开发、优化和工艺转化中必须仔细监控杂质。
法规和国际指导原则更加关注原料药中杂质的分离、鉴定和控制。
在本文的第一节,作者以具体实例列举了不同类型杂质和不同来源杂质的情况。
Definitionand sources of impurities 杂质的定义和来源不纯物可定义为目标成分与外来物的混合物或本身劣质的物质。
往往是最终的制备工艺对原料药的成本具有重大影响。
产量、物理特性、化学纯度是 API 生产、制剂处方、制剂生产中需要重点考虑的地方。
作为新药申请的一部分,申请人必须向 FDA 提交原料药和制剂的生产和过程控制。
如果生产批次不符合纯度和杂质质量标准要求,制造商必须进行返工,这不但会消耗原料药和其他资源,还会耽误其他批次原料药的生产,代价很高。
杂质的来源和类型可以通过原料药的生产工艺流程图来进行分析。
杂质的形成与生产工艺的每个阶段相互关联,如图 1 所示。
简而言之,任何影响原料药或成品纯度的物质都被可认为是杂质。
1/ 11杂质有各种来源,通常包括:起始原料(S)、中间体,倒数第二步中间体、副产物、转化产品、相互作用产物,有关物质、降解产物和互变异构体。
Startingmaterial(s) 起始物料图图 1 1 :s APIs 和成品杂质形成路径的示意图监管机构一直期望对用于生产 APIs 的起始物料中的杂质进行控制(1)。
API的起始物料可以是原料、中间体、或用于生产 API 及作为 API 重要结构部分的 API。
API的起始物料通常有确定的化学性质和结构(2)。
新版《药品注册管理办法》对仿制药的技术评价要求及案例分析.

总的目标:
引入仿制药概念目的是强调仿制药品与被仿制 药品的一致性(具有同样的活性成份,给药途径, 剂型,规格和相同的疗效),与国际上仿制药的 规则接轨; 引导申请人按照国际通行的研究方法,研制出 高质量的仿制药,为社会公众提供“优质优价” 而不是“低质低价”的仿制药品; 提高技术要求,设置技术门槛,有效遏制仿制 药过多,过滥,低水平重复的现象。
西咪替丁原料药存在A、B、C三种晶型,A晶型是 疗效最好毒副作用最小的晶型 ---泰胃美是全部A晶型
---国产品是A、B、C混晶
实例2:
格列本脲片
属于第二代磺脲类药物, 其降糖作用较强,容易在体内蓄积,
易出现低血糖反应。
国产格列本脲产品与原研产品在保持病人血糖 稳定方面差异很大,国产格列本脲的产品降血 糖效果波动很大。
射剂所用药材,由于产地不同,受土质、气候、采收季节等种 植条件影响,药材所含成分可存在差异,不同基源、不同药用 部位的同一药材有较大差别。
(2)干-鲜鱼腥草及其注射制剂存在差异:有的生产厂家用干 鱼腥草投料,是造成鱼腥草注射液质量不稳定的原因之一。
(3)辅料
吐温-80(聚山梨酯-80):助溶剂,提高药液澄明度。
原发厂产品经过系统 的非临床与临床研究,安 全有效性得到确认。 进口时对人种差异进行 了研究。
其次可考虑选用研究基 础较好、临床应用较为广 泛的非原发厂产品。
新法规下化药仿制药研究和评价中的关键 问题”研讨班问题解答
在本次研讨班中所定义的原研产品,是指全球 基于系统开发研究结果的支持而最早上市的厂 家所生产的产品,可以是进口药,也可以是该 厂在国内本地化生产的产品。 ---- 药品审评中心
格列本脲本身的化学性质独特,极难溶于水
国家药品审评中心

家
药
品
审
评
中
心
注射剂的无菌保证
与工艺研究
2008.10
国
家
药
品
审 评
药品管理法与药品生产
中
心
• 2001年2月28日修订的《药品管理法》第十条,
经修订后明确要求:
“药品必须按照〔原法规:工艺规程〕国家药品 标准和国务院药品监督管理部门批准的生产工 艺进行生产,…。改变影响药品质量的生产工 艺的,必须报原批准部门审核批准。〞
P=〔1-q〕n=〔1-0.05〕20 =0.359
即有35.9%的可能性,该批药品将会被判
定为无菌。
国
家
药
品 审
无菌检查特性数据表
评
中
心
中国药典现取样数为:20,如污染率为5%,从曲线 得,检出概率为64%。
国 家 药 品 审 评 中 心
如何保证注射剂
无菌合格呢?
国
家
药
品
审 评
质量控制的三种模式
• 首先要考虑被选剂型可采用的灭菌工艺的无菌 保证水平的上下。原则上首选剂型应能采用终 端灭菌工艺,并保证SAL不小于6。
• 对于有充分的依据证明不适宜采用终端灭菌工 艺且临床必需注射给药的品种,可考虑选择采
用无菌生产工艺的剂型。通常无菌生产工艺仅 限于粉针剂或局部小容量注射剂。
国
家
药
品
审 评
输液产品灭菌工艺的选择原则
以理化性质等硬指标来压无菌的软指标。
• 可最终灭菌产品一定要首选最终灭菌方式,以 保证产品的无菌特性。
• 无菌制造工艺的基本特征是:低安全+高成本。 应尽可能防止采用。
• 当灭菌可能会造成副产物等问题时,尽可能从 工艺上创造条件,使灭菌成为可行。
原料药中杂质的控制与案例分析--中国药品生物制品检定所--胡昌勤

抗生素室
杂质谱分析
头孢噻肟有关物质分子结构
抗生素室
头孢噻肟钠的合成工艺
抗生素室
2. 杂质E可以源于起始原料
3. 杂质E可以源于合成中的 任一中间过程
由于起始物头孢菌素C 含有DAO-CC、DACC和CC-LT等杂质, 在半合成步骤中发生 相同的反应,分别生 成DAO-ACA、DAACA和ACA-LT,进 而生成DAO-CTAX、 DA-CTAX和CTAXLT等杂质。
JCPS,2010,19(4):285–292
抗生素室
MEKC与HPLC测定头孢菌素有关 物质的互补性分析
MEKC具有较强的杂质分离能力,但其检 测限(LOD)较高。 借助于加速实验,将MEKC分离出的杂质 峰数目与HPLC分离出的含量大于MEKC LOD的杂质峰数目进行比较,当两者基本 相对时,可以认为HPLC方法具有较满意 的分离能力。
生产工艺杂质
抗生素室
光照稳定性评价
大多数喹喏酮类抗生素对光不稳定,什么是光降解杂质? 按随机取19批样品 UV灯下照射10天 比较光照前后各杂质含量的变化
0.250%
加替沙星注射剂光照稳定性
0.200%
0.150%
0.100%
0.050%
1
2 U1
3 4
0.000%
1
2
U1 3
4
8
U2
5
7
6
6
5
6
– 是否有杂质吸附到色谱柱上未被洗脱? – 是否有杂质在色谱柱上未被保留? – 是否所检测到的色谱峰存在共出峰?
抗生素室
原方法
在对各国药典方法比较的基础 上确定分析方法 新方法
化药仿制药制剂质量研究和稳定性研究审评常见问题及案例分析

第26页/共120页
三、分析方法建立与验证
技术要求
2、新药及仿制药对建立的分析方法均应 进行验证。仿制药“仿品种不是仿标 准”,已有的被仿制药质量标准中分析 方法只能作为仿制药研发过程中的参考, 在建立仿制药质量标准时仍需重新对建 立的质控项目分析方法进行验证
第21页/共120页
二、分析方法
如HPLC法仪器型号及编号;供试品、 对照品流动相、系统适用性溶液等的配 制方法;色谱条件色谱柱(型号)、柱长 度、内径、填料粒径、柱温、流速、检 测器、检测波长、运行时间、系统适用 性进样体积;具体操作,计算公式、拟 定限度等。
第22页/共120页
二、分析方法
技术要求:
主要内容
一、质量标准及制定依据常见问题及案例分 析 二、分析方法常见问题及案例分析 三、分析方法的建立和验证常见问题及案例 分析 四、溶出度与溶出曲线测定常见问题及案例 分析 五、杂质分析常见问题及案例分析 六、对照品常见问题及案例分析 七、稳定性研究常见问题及案例分析
第2页/共120页
前言
◆“仿已有国家标准的药品”调整为“仿与原研药 品质量和疗效一致的药品”。
第9页/共120页
质量标准(表格形式) ◆常见问题:
1、质量研究项目不全面;如非包衣片未研究脆碎度;刻 痕片做溶出曲线对比研究时未考虑整片和半片的对比情 况。
2、制剂通用检测项目未单独列出,仅写符合制剂通则项 下要求,如要求检测含量均匀度检查项的未单独列出。
3、研究未订入标准中的检测项目以及稳定性考察的“标 准中未规定的项目”未在质量标准中列出。
4、未简要说明放行标准与货架期标准限度相同/不同依据。
第10页/共120页
原料药杂质研究与控制浅析

10.化药注射剂元素杂质研究

9
来源:ICH Q3D
三、风险控制
根据ICH Q6A原则对元素杂质进行定期检查
• 当风险评估表明不用进行常规检查,但需要额外保证措施时,可以对药品 或药品组分进行定期检查
• 例:原料药合成最后步骤使用钯碳催化剂,三批生产规模样品中钯为24%、 19%、22%PDE(Option 2b) 虽然三批样品中钯低于控制阈值(30%PDE),但考虑到在合成最后步
骤引入,具有高风险(ICH Q11),可能会超出控制阈值。 最后定入原料药质量标准,进行定期检查(每10批进行检查)
申报资料
• 风险评估总结、必要数据及控制措施
没有发现风险 是最大的风险!
10
来源:ICH Q3D;ICH Q3D Training Package Module 6
四、案例-药品评估
评估
• 确认所有辅料生产中均未使用Hg、Cd、Li、 Sb、Cu
• 氯化钠:药典级(<1μg/g As和< 5μg/g Pb),引入<0.008μg/day As和 <0.04μg/day Pb,低于控制阈值
• 氯化钾:药典级(<10μg/g Pb),引入 <0.002μg/day Pb,低于控制阈值
其他
Al(FDA 21CFR§201.323肠外营养注射剂,大容量注射剂Al≤25μg/L, 小容量注射剂等Al≤25μg/L或标示最高量)
5
来源:ICH Q3D;参考:FDA 21CFR§201.323
二、风险评估
支持风险评估的信息及数据
• 先验知识
• 公开发表的文献
• 相似工艺的数据 • 供应商信息或数据 • 原辅料等药品组分的检验
1拟定商业工艺;2nd=未检出,即低于检测限,所有元素杂质检测限均为10-6μg/g 14
FDA药品审评和研究中心 (CDER)

FDA药品审评和研究中心 (CDER) 色谱方法验证审评指南1994.11 CMC 3目录. 绪言.色谱分类A.高效液相色谱 (HPLC)1.手性液相色谱2.离子交换色谱3.离子对/亲和色谱4.正相色谱5.反相色谱6.分子排阻色谱B.气相色谱 (GC)C.薄层色谱 (TLC).参考标准.药物及其制剂HPLC方法验证的参数A.准确性B.检出限和定量限C.线性D.精密度1.重复性a.进样重复性b.分析重复性2.组间精密度3.重现性E.范围F.回收率G.耐久性H.供试品溶液的稳定性I.专属性/选择性J.系统适用性规定和试验1.容量因子2.精密度/进样重复性3.相对保留时间4.分离度5.拖尾因子6.理论塔板数K.要点.注解和结论.致谢.参考文献色谱方法验证审评指南. 绪言本技术指南的目的是给审评人员审评验证色谱方法的, 该文件讨论色谱方法的要点和不足, 以便CDER的审评人员能够保证方法的良好性能,也使化学工作者了解为通过审评应给出的足够的信息。
国际协调会议(ICH)1993年定义的分析术语,已在这一指南中运用。
色谱方法通常用于原料、药物、药物制剂和生物体液中化合物的定性和定量。
涉及的成分包括手性的或非手性的药物、过程杂质、残留溶媒、附加剂如防腐剂、分解产物、从容器和密闭包装或制造过程中带入的可提取和可过滤的杂质、植物药中的农药和代谢物等。
试验方法的目的是得到可信赖的和准确的数据,无论是用于验收、出厂、稳定性或药物动力学研究。
得到的数据用于药品开发或批准后的定性和定量,试验包括原料的验收、药物和药物制剂的出厂、过程检验(In- process testing)的质量保证和失效期的建立。
方法的验证是由药品的开发者或使用者来检验其方法是否达到预期的可靠性、准确度和精密度的过程。
得到的数据成为方法的验证资料的一部分交给CDER.。
方法的验证对于完成机构满足档案要求不是一次性的,开发者和使用者都应验证其方法的耐用度或耐久性(ruggedness or robustness.),其他的分析者、用其它相当的仪器,在其它的日期或地点,在药品生产期限(有效期)全过程,方法都应能够重现。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
阿托伐他汀钙杂质研究
杂质限度要求 最大日剂量:口服80mg/天
报告限度
鉴定限度
质控限度
原料药
制剂
0.05%
0.1%
0.1%
0.2%
0.15%
0.25%
阿托伐他汀钙杂质研究
杂质控制方法比较
国家标准 原料药 方法 HPLC等度
EP7.1 HPLC梯度 手性HPLC法
USP33 同EP7.1
限度
总杂质2.0%
杂质ABCD均0.3%,其 它0.1%,总杂质1.5%。 对映体杂质E0.3%
未收载
同EP7.1
制剂
方法同上,总杂质3.0%
未收载
阿托伐他汀钙杂质研究
杂质谱分析 工艺杂质:杂质A(去氟阿托伐他汀) 杂质C(双氟阿托伐他汀)、杂质F、杂质G 工艺杂质及降解产物 杂质B(非对映异构体) 杂质E(对映异构体) 降解产物:杂质D(环氧化物) 杂质H(内酯化降解产物) EP中8个已知杂质结构
工艺杂质:工艺过程中引入的杂质,包括起始原料及可能 带入的杂质、中间体、副产物等
降解产物:药物降解产生,如水解、氧化、开环、聚合等 反应产物,与药物的结构特征密切相关
杂质研究的重要地位
★保证药品安全有效是研发及评价所要遵循的基 本原则 ★杂质研究是药学研究(CMC)的重要内容,同 时也直接涉及到药品的安全有效性
杂质谱分析
★可能的杂质
★原料药生产过程中可能引入的工艺杂质 ★原料药贮存过程中可能产生的降解产物 ★制剂生产、贮存过程中可能产生的降解产物
杂质谱分析
★依据合成工艺,分析可能产生的工艺杂质
起始原料及可能引入的杂质、中间体、副产物 例:盐酸曲美他嗪中哌嗪
OMe MeO MeO CHO
+
OMe N N MeO MeO N N
阿托伐他汀钙杂质研究
本品常用制备工艺为先分别合成主环和侧链,然后缩合、脱保 护、成盐。在常规条件下前述8个杂质均可能出现可作为杂质 研究的重要参考依据 需要注意存在的杂质并不限于前述8个已知杂质
H3C O
+
CH3 OH N
CO2
-
N
Ca2
OH , 3H2O
2
F
阿托伐他汀钙杂质研究
例:盐酸帕罗西汀
F
O O
O
N
, HCl , 1/2H2O
EP、USP收载,列出7个已知杂质A-G HPLC法:控制杂质A(去氟物)0.3%,其它单一杂 质0.1%,总杂质不得过0.5% 手性HPLC控制杂质D(对映异构体)不得过0.2%
例:盐酸帕罗西汀
F N CH 3
杂质G:遗传毒性杂质,为工艺杂质 EP、USP均规定该杂质不得过1ppm 具体品种:根据采用的工艺进行分析,是否存在该杂质 如果存在,应研究建立适当的方法进行控制, 限度:不得过1ppm
杂质对比研究结果分析
杂质谱与被仿品不一致,有超过鉴定限度的新杂质;且已 知杂质含量亦超过被仿品 ——改进工艺,降低杂质水平 工艺路线:起始原料,中间体质量控制;反应条件的控制; 精制方法等。
仿制药杂质研究的特点
杂质限度的确定
指导原则要求 被仿品质量标准(该质量标准是否完善) 被仿品实测结果(杂质种类、杂质含量) 试制样品研究结果(杂质种类、杂质含量) 相关文献资料
确定合理的杂质限度
核心是杂质的安全性
相关技术指导原则的要求(决策树) 论证杂质安全性的相关文献资料 杂质安全性研究资料 上市产品中杂质量不能超过进行安全性研究样品中杂质量 被仿药品的质量标准,杂质种类和水平(仿制药)
确定合理的杂质限度
原料药杂质限度
..\..\化学药品指导原则\化学药物杂质研究技术指导原则.pdf
杂质对比研究结果分析
杂质谱与被仿品一致或杂质种类较被仿品少,无超过鉴定 限度的新杂质;各杂质含量不超过被仿品 ——试制品的杂质控制达到了研究目标 杂质谱与被仿品一致或杂质种类较被仿品少,无超过鉴定 限度的新杂质;但已知杂质含量超过了被仿品 ——改进工艺,降低杂质含量
仿制药杂质研究的特点
杂质结构决策树
..\..\化学药品指导原则\化学药物杂质研究技术指导原则.pdf
仿制药杂质研究的特点
参考信息:被仿产品的相关信息(质量标准、实 测结果等) 目标:杂质水平不超过被仿产品 杂质对比研究:重要的研究手段
前提:被仿品的杂质已得到充分研究,安全性已得到
论证
仿制药杂质研究的特点
例:盐酸舍曲林
采用一种方法不能有效控制所有杂质 针对不同杂质,采用不同方法进行控制 HPLC法:杂质E(拆分试剂)0.2% GC法:杂质C和D总量0.8% 杂质A、B、F均0.2% 其它单一杂质0.1%,总杂质1.5% 手性HPLC,杂质G(对映异构体)1.5%
充分的方法验证
灵敏度(检测限)、专属性、定量限、线性、耐用性等
杂质对比研究结果分析
杂质谱与被仿品不一致,有超过鉴定限度的新杂质;但已 知杂质含量不超过被仿品 ——鉴定新杂质结构 ——分析其产生原因,改进工艺,降低杂质含量至鉴定限 度以下 ——若通过改进工艺,杂质含量不能降低至鉴定限度以下, 应根据杂质研究决策树,进行后续研究。
仿制药杂质研究的特点
原料药杂质研究思路 以EP标准中的检验方法及限度为参考依据,进行必要的方法 验证 试制样品杂质检查结果符合EP标准要求,无超过鉴定限度的 其它杂质——达到研究目标 若杂质谱与EP标准一致,但杂质量超过限度要求——完善工 艺(精制:优化工艺参数;控制起始原料及中间体质量) 出现超过鉴定限度(0.1%)的新杂质——鉴定结构,分析原 因,修改完善工艺,降低杂质量至0.1%以下。
杂质研究及案例分析
主讲人:张玉琥 讲习组成员:于红 成海平 药品审评中心 2011.5
提纲
一、前言 二、杂质研究的基本要求及研究思路 三、案例分析 四、小结
一、前言
一、杂质研究在药品研发中的地位 二、存在的主要问题和差距
杂质研究的重要地位
杂质—任何影响药物纯度的物质 包括有机杂质、无机杂质、残留溶剂 本讲主要讨论有机杂质 杂质来源—工艺杂质、降解产物等
若新杂质不超过质控限度(0.15%),且经鉴定结构明确不是毒性 杂质, 可订入质量标准中进行控制
定量实验:关注和验证准确度、精密度、专属性、定量限、线性、范 围、耐用性 限度实验:至少应关注和验证专属性、检测限、耐用性
充分的方法验证
专属性研究
原料药合成中间体、粗品等的分离度考察 原料药及其制剂的强制破坏实验 制剂的辅料干扰实验 杂质加入实验 和药典方法或经论证的其它方法进行比较 峰纯度检查(二极管阵列检测、质谱检测)
杂质谱分析
★基于结构特征,分析可能的降解产物
例:罗库溴铵中杂质C
O O O N HO N
+
OH O OHN N
+
HO
杂质谱分析
★通过强降解实验,分析研究降解产物
考察样品在酸、碱、高温、光照、氧化等因素影响下的降解产 物。 必要时,可根据情况进行以上因素综合存在时的强制降解实验。
★与理论分析结果进行对比
充分的方法验证
线性、定量限、检测限等
采用杂质进行相关试验
关注杂质紫外吸收特征,确定适宜的检测波长 关注杂质相应因子
例:盐酸左布比卡因注射液
CH3 N CHO 3 N CH3 H3C NH2 CH3
2照品比色法,400ppm 上市同品种:采用HPLC杂质对照品法 研制产品:方法学研究未针对该已知杂质进行验证
超过目标限度时的考虑
采取措施降低杂质至目标限度以下(首选)
完善精制方法 优化合成工艺 控制原料及中间体的纯度 变更合成路线 完善包装及贮藏条件(针对降解产物) 完善制剂处方工艺(针对降解产物)
进行杂质安全性研究
采用含有杂质的原料药或制剂 采用分离的杂质单体
超过目标限度时的考虑
TLC法实验结果
光照10天含量(UV法)下降10%,未检出杂质斑点 影响因素、加速和长期实验,样品均未检出杂质斑点
HPLC法实验结果
杂质达7%以上
方法的比较研究显示,TLC法不适于本品的有关物质检查
CP2010版,改用HPLC法
例:盐酸舍曲林
NH
有7个已知杂质A-G
, HCl
Cl
Cl
杂质A:非对映异构体 杂质B、C、D:工艺杂质 杂质E(扁桃酸):拆分试剂 杂质F:降解产物 杂质G:对映异构体
研究建立检查方法
★基础和经验
明确杂质检查的目标(基于杂质分析) 了解常用方法(例如HPLC、TLC、GC等)的特点 了解杂质和药物的特性 充分的文献调研 既往杂质分析的研究经验 方法的优化和调整 多种方法的相互比较、相互补充
研究建立检查方法
例:氟哌利多注射液
F N O N N O
BP及USP均采用HPLC法检查有关物质 BP限度:单一杂质0.25%,总杂质0.5% 原料药原国家标准,TLC法(除主斑点外不得有其它杂质斑点)
杂质谱分析
★研发过程中检测到的实际存在的杂质 对超过鉴定限度的杂质鉴定结构,分析研究其来源 工艺杂质? 降解产物? 其它来源?
杂质谱分析
