常见物质的物理性质归纳
常见物质的物理性质归纳

常见物质的物理性质归纳
常见物质的物理性质主要包括以下几个方面:
1. 电导率:物质导电能力的大小,常用于区分导体、绝缘体和半导体。
2. 密度:物质的质量与体积之比,表示物质的紧密程度。
3. 熔点和沸点:物质转变为液态和气态的温度。
4. 热容:物质吸热或释热的能力,即单位质量物质升高1度所需的热量。
5. 热导率:物质导热的能力,即单位时间内单位面积的热量通过物质的能力。
6. 界面张力:液体和气体或液体之间的表面张力,是液体分子因相互作用而表面不能膨胀或收缩的现象。
7. 扩散性:物质分子在空气或溶液中的自由移动能力。
8. 折射率:光线从一种介质射入另一种介质时,光线的传播方向发生了改变的程度。
9. 导热系数:物质导热的能力,即单位时间内两个相邻处的温度差距单位长度。
10. 融化热和汽化热:物质熔化和汽化时吸收的能量。
高中化学常见物质物理性质总结

高中化学常见物质物理性质总结1、有色气体:F2(淡黄绿色)、Cl2(黄绿色)、Br2(g)(红棕色)、I2(g)(紫红色)、NO2(红棕色)、O3(淡蓝色),其余均为无色气体。
其它物质的颜色见会考手册的颜色表。
2、有刺激性气味的气体:HF、HCl、HBr、HI、NH3、SO2、NO2、F2、Cl2、Br2(g);有臭鸡蛋气味的气体:H2S。
3、熔沸点、状态:①同族金属从上到下熔沸点减小,同族非金属从上到下熔沸点增大。
②同族非金属元素的氢化物熔沸点从上到下增大,含氢键的NH3、H2O、HF反常。
③常温下呈气态的有机物:碳原子数小于等于4的烃、一氯甲烷、甲醛。
④熔沸点比较规律:原子晶体>离子晶体>分子晶体,金属晶体不一定。
⑤原子晶体熔化只破坏共价键,离子晶体熔化只破坏离子键,分子晶体熔化只破坏分子间作用力。
⑥常温下呈液态的单质有Br2、Hg;呈气态的单质有H2、O2、O3、N2、F2、Cl2;常温呈液态的无机化合物主要有H2O、H2O2、硫酸、硝酸。
⑦同类有机物一般碳原子数越大,熔沸点越高,支链越多,熔沸点越低。
同分异构体之间:正>异>新,邻>间>对。
⑧比较熔沸点注意常温下状态,固态>液态>气态。
如:白磷>二硫化碳>干冰。
⑨易升华的物质:碘的单质、干冰,还有红磷也能升华(隔绝空气情况下),但冷却后变成白磷,氯化铝也可;三氯化铁在100度左右即可升华。
⑩易液化的气体:NH3、Cl2 ,NH3可用作致冷剂。
4、溶解性①常见气体溶解性由大到小:NH3、HCl、SO2、H2S、Cl2、CO2。
极易溶于水在空气中易形成白雾的气体,能做喷泉实验的气体:NH3、HF、HCl、HBr、HI;能溶于水的气体:CO2、SO2、Cl2、Br2(g)、H2S、NO2。
极易溶于水的气体尾气吸收时要用防倒吸装置。
②溶于水的有机物:低级醇、醛、酸、葡萄糖、果糖、蔗糖、淀粉、氨基酸。
初中常见化学物质物理性质

初中常见化学物质物理性质单质金属:具有金属光泽,大多数为银白色固体。
所有金属均有导电性,导热性。
另类:金Au-金色铜Cu-紫红色汞Hg-液体气体:氢H:无色无味气体氧O:无色无味气体氮N:无色无味气体氯Cl:黄绿色有刺激性气味气体稀有气体:无色无味,通电发出不同颜色的光固体:红磷:红色固体白磷:白色固体炭:黑色固体,吸附性硫:黄色固体氧化物金属氧化物:氧化镁:白色固体氧化钙(生石灰):白色固体,溶于水放热三氧化二铁/氧化铁(铁锈):红色固体四氧化三铁:黑色固体二氧化锰:黑色固体,不溶于水氧化铜:黑色固体非金属氧化物:一氧化二氢(水):无色无味液体过氧化氢(双氧水):无色液体一氧化碳:无色无味气体二氧化碳:无色无味气体,易溶于水二氧化硫:无色刺激性气味气体,易溶于水一氧化氮:无色气体二氧化氮:红棕色刺激性气味气体五氧化二磷:白色固体酸无机酸:碳酸:无色无气味液体,易分解硫酸:无色无气味油状粘稠液体,具有吸水性,溶于水放热氢氯酸/氯化氢溶液(盐酸):无色刺激性气味液体,易挥发硝酸:无色刺激性气味液体,易挥发有机酸:乙酸(醋酸/冰醋酸):无色刺激性气味液体,易挥发碱氢氧化钠(火碱/烧碱/苛性钠):白色固体,溶于水放热氢氧化钙(熟石灰):白色固体氢氧化铜:蓝色固体氢氧化铵(氨水/一水合氨):无色刺激性恶臭气体,易挥发盐硫酸盐:五水合硫酸铜(蓝矾/胆矾):蓝色固体无水硫酸铜:白色固体硫酸钠:白色固体硫酸钙(石膏):白色固体硫酸钡:白色固体硫酸铁:红褐色固体三水合硫酸亚铁(绿矾):浅绿色固体无水硫酸亚铁:白色固体盐酸盐:氯化钠(食盐):白色无气味咸味固体氯化钙:白色固体氯化铜:绿色固体(注:氯化铜浓溶液为绿色,稀溶液为蓝色)氯化铁:红褐色固体氯化亚铁:浅绿色固体氯化钡:白色固体氯化银:白色固体碳酸盐:碳酸钠(苏打/纯碱):白色固体碳酸钙(大理石/石灰石):白色固体碳酸镁(防滑运动镁粉主要成分):白色固体碱式碳酸铜(铜锈):蓝绿色固体硝酸盐:硝酸钾:白色固体硝酸铵:无色晶体,溶解吸热硝酸银:白色固体其他氨气:无色刺激性恶臭气体,极易溶于水氯化氢:无色刺激性气体,易溶于水高锰酸钾:暗紫色固体氯酸钾:白色固体碳酸氢钠(小苏打):白色固体十二水合硫酸铝钾(明矾):白色固体九水合硫代硫酸钠(大苏打):无色晶体酚酞溶液:无色无味品红溶液:红色无味液体石蕊溶液:紫色无味液体甲烷:无色无味气体乙醇(酒精):无色芳香气体。
物质的特性知识点归纳总结

物质的特性知识点归纳总结物质是构成宇宙万物的基本单位,其特性对我们了解和应用自然现象和科学原理至关重要。
本文将对物质的特性进行知识点的归纳总结,涵盖了物质的物理性质、化学性质以及其他相关特性。
一、物质的物理性质物质的物理性质是指在不改变物质本质的情况下所能观察到的特性。
1. 密度:物质的密度是指单位体积内的质量。
常见物质有不同的密度,如黄铜的密度(8.4g/cm³)、铝的密度(2.7g/cm³)等。
2. 硬度:物质的硬度是指物质抵抗变形和破坏的能力。
例如,钻石是地球上最硬的物质,可以用于切割和抛光。
3. 融点和沸点:物质的融点是指物质由固态转变为液态的温度,沸点则是指物质由液态转变为气态的温度。
4. 热导率和电导率:物质的热导率是指物质导热的能力,电导率是指物质导电的能力。
不同物质对热和电的导性能有所差异。
二、物质的化学性质物质的化学性质是指物质与其他物质发生化学反应时所表现出的特性。
1. 反应性:物质的反应性反映了物质与其他物质发生反应的能力。
例如,氧气与铁发生化学反应会导致铁的生锈。
2. 酸碱性:物质可以被分类为酸性、中性或碱性。
酸性物质具有酸的性质(如柠檬汁),碱性物质具有碱的性质(如氢氧化钠)。
3. 氧化还原性:物质的氧化还原性是指物质在反应过程中能够氧化或还原其他物质的能力。
例如,金属可以被氧化为金属离子。
4. 可燃性:物质的可燃性表示其在氧气存在下燃烧的能力。
可燃物质可以是固体、液体或气体。
5. 毒性:物质的毒性是指物质对生物体的有害能力。
某些物质具有毒性,对人类和其他生物造成危害。
三、其他相关特性除了物质的物理性质和化学性质,还有其他一些与物质相关的特性。
1. 可溶性:物质的可溶性是指物质在某种溶剂中可以溶解的程度。
某些物质更容易溶解于水,而对其他溶剂则不易溶解。
2. 光学性质:物质的光学性质包括折射、反射和透射等。
例如,光在水中的折射现象是由于光在不同介质间传播速度的变化所致。
13个物理性质

13个物理性质1.性:弹性是物体偏离其原始形状后,可以恢复其原始形状的能力。
在物理学中,这一概念是指物体抗变形能力,它不仅仅是指物体抗弯曲和压缩,而且包括抗拉伸。
2.度:强度是指物体在受力时所能承受的负荷,或者说,它是物体抵抗力的大小。
在物理学中,常见的强度类型有弯曲强度、压缩强度、拉伸强度、疲劳强度等。
3.度:硬度是指物体对外界体积力的弹性反应,它是物体抵抗被压缩和剥落的能力。
在物理学中,硬度分为硬度、抗剥落硬度和磨蚀硬度等几种不同类型。
4.度:密度是指物体的固有重量与它的体积之比,它是定义物质的重要参数之一。
物质的密度决定了其在物理和化学实验中所拥有的性质,对物体的弹性、导热系数、热容量、比热容等有重要意义。
5.性:磁性是指一种物质所具有的磁场属性,即它具有能与其他磁体相互交互作用,并能产生磁场的能力。
磁性是一种绝对性质,由于任何物质中都含有电子,因此只要它们能够受到外场的影响,就可以有磁性。
6.导率:热导率是指物体受热时,每秒钟可以传递的热量的量。
它的大小取决于物质的组织结构,而不受外界因素的影响。
由于热导率可以反映物质内部热流,因此在工程热力学中也是一个重要指标。
7.容量:热容量是指物体受热时,所吸收的热量的量,反映了物体对热能的容纳能力,也就是说,它是指物体在温度不变的情况下,所承受的热量的量。
8.热系数:导热系数是指物质中热传递所需要的时间和能量的比值,它可以用来衡量在一定时间内物质能够传递的最大热量。
它可以用来测量物质在热能传输过程中的效率,也可以用于计算物质在热传输过程中的温度分布。
9.电率:导电率是指物质在特定状态下传导电流的能力,它反映了物质中电子的流动性。
在物理学中,通常使用电阻率来衡量物质的导电性,而电阻率和导电率是正比的,即越大的导电率意味着越小的电阻率。
10.寸稳定性:尺寸稳定性是指物质在外界作用下保持其尺寸和形状的能力。
这是一个重要的物理性质,物体的尺寸稳定性决定了它的结构特性,也影响着它的性能特性。
物理属性特性归纳总结

物理属性特性归纳总结物理属性特性是指物体在物理性质方面的表现和特征。
物理属性特性直接反映了物体的性质和行为,对于我们理解和研究物质世界起着重要的作用。
本文将从不同角度对常见的物理属性特性进行归纳总结。
1. 基本物理属性特性1. 质量(mass)质量是物体所具有的物质量度,用于衡量物体所含物质的多少。
质量是一个标量量,单位是千克(kg)。
2. 体积(volume)体积是物体所占空间的大小,用于衡量物体的大小。
体积也是一个标量量,单位是立方米(m³)。
3. 密度(density)密度是物质的质量与体积的比值,表示单位体积内的质量。
密度是一个标量量,单位是千克每立方米(kg/m³)。
4. 温度(temperature)温度是物体内部粒子热运动的程度或者物体与周围环境的热交换程度的度量。
温度是一个标量量,单位是摄氏度(°C)或开尔文(K)。
2. 光学属性特性1. 透明度(transparency)透明度是物体光线透过程中的阻碍程度的度量。
透明度可以分为完全透明、半透明和不透明三种类型。
2. 折射率(refractive index)折射率是介质中光传播速度与真空中光传播速度之比的度量。
不同介质的折射率决定了光线的折射方向和倾斜程度。
3. 反射(reflection)反射是光线遇到介质界面时部分或全部光线发生反向传播的现象。
反射程度取决于介质的光学属性和入射光线的角度。
4. 色散(dispersion)色散是指介质对不同波长的光的折射率不同,导致光的分离和成谱的现象。
色散常见于折射率与波长相关的介质,如玻璃和水。
3. 力学属性特性1. 弹性(elasticity)弹性是物体回复原状的性质,即物体受力后能够恢复原来形状和大小的程度。
弹性分为完全弹性和部分弹性两种类型。
2. 强度(strength)强度是物体抵抗受力破坏的能力,表示物体所能承受的最大应力。
强度常用于描述材料的耐力和抗拉性能。
物质的物理性质

物质的物理性质物质是构成宇宙万物的基本要素,而物质的性质则决定了不同物质的特点和行为。
在物理学中,我们通常将物质的性质分为物理性质和化学性质两大类。
本文将重点介绍物质的物理性质。
一、物质的物理性质概述物理性质是描述物质在不发生化学变化的情况下所表现出的性质。
它们是可以通过观察和实验来测量和研究的,不会改变物质的组成和结构。
物质的物理性质包括但不限于以下几个方面:1. 密度:物体的密度是指单位体积内所含质量的大小。
我们可以通过密度来判断物体的浓度、轻重等特性。
2. 弹性:物质的弹性是指其在受力作用下恢复原状的能力。
根据物体的弹性特性,我们可以将物质分为弹性体和非弹性体。
3. 热性质:热性质包括物质的热传导、热膨胀、热导率等方面的性质。
通过研究物质的热性质,我们可以深入了解物体的热传导机制和热变形规律。
4. 光学性质:物质的光学性质涉及光的传播、折射、反射等方面的性质。
通过研究物体的光学性质,我们可以了解物质对光的吸收和反射情况。
5. 电性质:物质的电性质包括导电性、电阻率、磁性等方面。
通过研究物质的电性质,我们可以更好地理解电流的传导和电磁场的作用。
6. 力学性质:物质的力学性质包括硬度、脆性、韧性等方面。
通过研究物质的力学性质,我们可以判断物体的耐磨性和耐力等特性。
二、不同不同物质具有不同的物理性质,这使得我们能够通过观察和测量物质的性质来进行分类。
下面以几种常见物质为例,具体介绍它们的物理性质:1. 金属:金属是一类具有良好的导电性和导热性的物质。
它们通常具有高密度、高强度和良好的延展性和可塑性。
金属还具有一定的光泽和电磁性质。
2. 非金属:非金属是一类电导率较差的物质。
它们通常具有较低的密度和较高的电阻率。
非金属的硬度和脆性较大,常常用于绝缘和包覆材料。
3. 液体:液体是一种没有固定形状和体积的物质。
液体具有较高的流动性和较大的可压缩性。
常见的液体如水、酒精等具有不同的密度、黏度和表面张力特性。
常见物质性质归纳
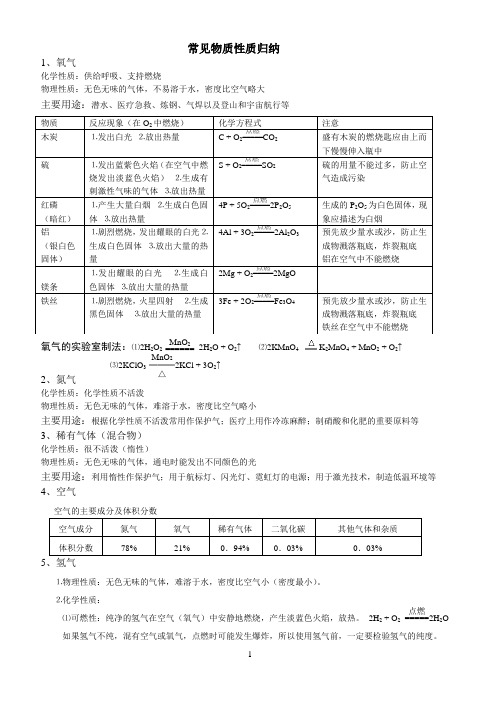
常见物质性质归纳1、氧气化学性质:供给呼吸、支持燃烧物理性质:无色无味的气体,不易溶于水,密度比空气略大主要用途:潜水、医疗急救、炼钢、气焊以及登山和宇宙航行等氧气的实验室制法:⑴2H 2O 2 MnO 2====== 2H 2O + O 2↑ ⑵2KMnO 4K 2MnO 4 + MnO 2 + O 2↑⑶2KClO 3 MnO 2═══△2KCl + 3O 2↑2、氮气化学性质:化学性质不活泼物理性质:无色无味的气体,难溶于水,密度比空气略小主要用途:根据化学性质不活泼常用作保护气;医疗上用作冷冻麻醉;制硝酸和化肥的重要原料等 3、稀有气体(混合物)化学性质:很不活泼(惰性)物理性质:无色无味的气体,通电时能发出不同颜色的光主要用途:利用惰性作保护气;用于航标灯、闪光灯、霓虹灯的电源;用于激光技术,制造低温环境等 4、空气空气的主要成分及体积分数5⒈物理性质:无色无味的气体,难溶于水,密度比空气小(密度最小)。
⒉化学性质:⑴可燃性:纯净的氢气在空气(氧气)中安静地燃烧,产生淡蓝色火焰,放热。
2H 2 + O 2 点燃=====2H 2O 如果氢气不纯,混有空气或氧气,点燃时可能发生爆炸,所以使用氢气前,一定要检验氢气的纯度。
⑵还原性(氢气还原CuO)实验现象:黑色粉末变红色;试管口有水珠生成H2 + CuO Cu + H2O⒊氢气的用途:充灌探空气球;作高能燃料;冶炼金属。
6、碳的单质⒉木炭、活性炭⑴木炭:有吸附作用,用于吸附一些食品和工业产品里的色素,吸附有异味的物质。
⑵活性炭:有较强的吸附作用,用于防毒面具、冰箱的除臭剂。
7、碳⒈常温下,碳的化学性质不活泼(碳原子最外层有4 个电子)应用:解释古代字画为什么经历几千年而不变色?档案资料为什么要求用碳素墨水书写?⒉碳的可燃性(相同的反应物,因反应物的量不同,生成物不同)充分燃烧 C + O2点燃===== CO2放热不充分燃烧2C + O2点燃===== 2CO⒊碳的还原性⑴C + 2CuO 2Cu + CO2↑现象:黑色粉末变红色,澄清的石灰水变浑浊。
常见物质的物理性质1

常见物质的物理性质一.沉淀的颜色1.不溶于水也不溶于稀硝酸的白色沉淀:AgCl, BaSO42.不溶于水但能溶于稀硝酸或稀盐酸的白色沉淀:CaCO3, BaCO3,Mg(OH) 2, Al(OH)3等3.红褐色沉淀:Fe(OH)34.蓝色沉淀:Cu(OH)2二.常见的固体物质的颜色1.白色:CaO,MgO,P2O5,NaOH,CaCO3,Ca(OH)2,CuSO4,KClO3,KCl,NaCl,Na2CO3,NaHCO32.红色:红磷(P), Cu,Fe2O3,HgO3.黑色:炭粉(C) ,MnO2,Fe3O4,CuO4.绿色:Cu2(OH)2CO35.蓝色:CuSO4·5H2O6.暗紫色:KMnO47.黄色:硫黄(S)三.溶液的颜色1.蓝色:铜盐(Cu 2+)溶液,如CuSO4溶液,CuCl2溶液2.黄色:铁盐(Fe 3+)溶液,如Fe2(SO4)3溶液,FeCl3溶液3.浅绿色:亚铁盐(Fe2+)溶液,如FeSO4溶液,FeCl2溶液4.紫红色:KMnO4溶液5.紫色:石蕊溶液常见物质的俗名一.化合反应1.铝在氧气中燃烧:4Al+3O2=2Al2O3(点燃)2.铁在氧气中燃烧:3Fe+2O2=Fe3O4(点燃)3.铜与氧气共热:2Cu+O2=2CuO(加热)4.镁在氧气中燃烧:2Mg+O2=2MgO(点燃)5.汞在空气中受热:2Hg+O2=2HgO(加热)6.硫在空气中燃烧:S+O2=SO2(点燃)7.碳在氧气中充分燃烧:C+O2=CO2(点燃)8.碳不充分燃烧:2C+O2=2CO(点燃)9.红磷或白磷燃烧/发令枪产生白烟:4P+5O2=2P2O5(点燃)10.氢气作燃料:2H2+O2=2H2O(点燃)11.一氧化碳(煤气的主要成分)燃烧(一氧化碳具有可燃性):2CO+O2=2CO2(点燃)12.二氧化碳通过炽热的碳:C+CO2=2CO(高温)13.二氧化碳与水反应/碳酸饮料中和反应:CO2+ H2O=H2CO314.酸雨的形成/二氧化碳与水反应生成亚硫酸:SO2+H2O=H2SO415.氧化钙与水反应/用生石灰作干燥剂/用生石灰制取熟石灰或石灰水:CaO+H2O=Ca(OH) 2二.分解反应1.实验室用过氧化氢和二氧化锰为原料制取氧气:2H2O2=2H2O+ O2↑(MnO2)2.实验室用氯酸钾与二氧化锰共热制取氧气:2KClO3=2KC+3O2↑(加热,MnO2)3.用高锰酸钾为原料制取氧气:2KMnO4=K2MnO4+ MnO2+ O2↑(加热)4.氧化汞受热分解:2HgO=2Hg+O2↑(加热)5.水电解:2H2O=2 H2↑+ O2↑(通电)6.碳酸不稳定分解: H2CO3=CO2↑+ H2O7.煅烧石灰石/工业上用石灰石制取生石灰:CaCO3=CaO+ CO2↑(高温)8.氢氧化铜受热分解: Cu(OH) 2=CuO+ H2O(加热)三.置换反应1. 木炭(碳)还原氧化铜(还原性):C+2CuO=2Cu+CO2↑(高温)2. 木炭(碳)还原氧化铁:3C+2Fe2O3=4Fe+3CO2↑(高温)3.氢气还原氧化铜(氢气的还原性):H2+CuO=Cu+H2O(加热)4.Fe与稀盐酸反应:Fe+2HCl=FeCl2+H2↑5.Fe与稀硫酸反应:Fe+H2SO4=FeSO4+H2↑6.Zn与稀盐酸反应:Zn+2HCl=ZnCl2+H2↑7.Zn与稀硫酸反应:Zn+H2SO4=ZnSO4+H4↑8.Al与稀盐酸反应:2Al+6HCl=2AlCl3+H2↑9.Al与稀硫酸反应:2Al+3H2SO4=Al2(SO4)3+3H2↑10.Mg与稀盐酸反应:Mg+2HCl=MgCl2+H2↑11.Mg与稀硫酸反应:Mg+H2SO4=MgSO4+H2↑12.铁与硫酸铜反应/湿法炼铜/用铁检验或除去工业废水中铜离子:Fe+CuSO4=Cu+FeSO413.锌与硫酸铜溶液反应:Zn+CuSO4=Cu+ZnSO414.铝与硫酸铜溶液反应:2Al+3CuSO4=3Cu+Al2(SO4)315.铜与硝酸汞溶液反应:Cu+Hg(NO3)=Hg+Cu(NO3)216.铜与硝酸银溶液反应:Cu+2AgNO3=2Ag+Cu(NO3)217.铝与硝酸银溶液反应:Al+3AgNO3=3Ag+Al(NO3)3四、复分解反应(一)有气体生成1.实验室制取二氧化碳/用大理石或石灰石与稀盐酸反应制取二氧化碳/用盐酸除水垢/用墨鱼骨粉除胃酸过多/用盐酸检验大理石、石灰石、或贝壳中含有碳酸钙:CaCO3+2HCl=CaCl2+H2O+CO2↑(泡沫灭火器原理)2.碳酸钠(纯碱、苏打)与盐酸反应/检验碳酸根离子/检验氢氧化钠是否变质:Na2 CO3+2HCl=2NaCl+H2O+CO2↑3.碳酸氢钠(小苏打)与盐酸反应(小苏打除胃酸):NaHCO3+HCl=NaCl+H2O+CO2↑4.碳酸钾溶液与硫酸反应:K2CO3+H2SO4=K2SO4+CO2↑+H2O5.碳酸钾溶液与盐酸反应:K2CO3+2HCl=2KCl+ H2O+CO2↑(二)有沉淀生成1.硫酸与硝酸钡溶液反应:H2SO4+Ba(NO3)22.碳酸钠与石灰水反应/用石灰水检验碳酸钠/用石灰水与碳酸钠为原料制取氢氧化钠:(纯碱制烧碱)Na2CO3+Ca(OH)2=CaCO3↓+2NaOH3.氢氧化钠溶液与硫酸铜溶液反应:2NaOH+CuSO4=Na2SO4+Cu(OH)2↓4.碳酸钠溶液与氯化钡溶液反应:。
高考化学常见物质物理性质

高考化学常见物质物理性质高考化学常见物质的物理性质一、常见有机物的物理性质有机物是由碳和氢组成的化合物,其物理性质主要包括颜色、气味、熔点、沸点、密度等。
以下是几种常见有机物的物理性质:1. 纯净、无色、无味、无毒的醇类物质举例来说,甲醇是一种无色、无味、有毒的液体,熔点为-97.6°C,沸点为64.6°C,密度为0.79 g/cm³。
乙醇是一种无色、有酒精味的液体,熔点为-114.1°C,沸点为78.4°C,密度为0.79 g/cm³。
它们在水中溶解度较大。
2. 纯净、无色、无臭、易燃的醛类物质例如,甲醛是一种无色、有刺激性的气味的液体,熔点为-92°C,沸点为-21°C,密度为0.815 g/cm³。
它在水中溶解度较小。
3. 纯净、无色、无味、不燃的酮类物质例如,丙酮是一种无色、有刺激性气味的液体,熔点为-95°C,沸点为56°C,密度为0.79 g/cm³。
它在水中溶解度较小。
4. 纯净、有颜色、有 odor、沸点和熔点较高的酚类物质例如,苯酚是一种无色、有特殊气味的晶体,熔点为42.4°C,沸点为182°C,密度为1.06 g/cm³。
它在水中溶解度较小。
二、常见无机物的物理性质无机物是由非金属和金属元素组成的化合物,其物理性质主要包括颜色、气味、熔点、沸点、密度等。
以下是几种常见无机物的物理性质:1. 纯净、白色、无味、无毒的氧化物例如,氧化钙是一种白色的粉末,熔点为2572°C,沸点为2850°C,密度为3.34 g/cm³。
氧化铝是一种白色的粉末,熔点为2050°C,沸点为2980°C,密度为3.95 g/cm³。
2. 黄色、有臭气、有毒的氯化物例如,氯化银是一种黄色的晶体,熔点为455°C,沸点为1560°C,密度为5.56 g/cm³。
物质的性质总结

物质的性质总结物质的性质是指物质所具有的各种特性和行为。
这些性质可以通过观察、测量和实验得出,并用于描述和区分不同的物质。
物质的性质可以分为物理性质和化学性质两大类。
物理性质是指物质在不改变其化学组成的情况下所表现出的性质。
以下是一些常见的物理性质:1. 密度:物质单位体积的质量。
密度可以用来描述物质的重量和轻重程度。
不同物质的密度是不同的,因此可以通过密度来区分和鉴别物质。
2. 沸点和熔点:物质在加热或冷却过程中从液体到气体或固体的转变温度。
不同物质的沸点和熔点也是不同的,因此可以通过这两个性质来进行物质的分离和纯化。
3. 热导率:物质传导热量的能力。
不同物质的热导率不同,有的物质可以很好地传导热量,而有的物质则相对较差。
4. 电导率:物质导电的能力。
金属等导电物质具有很高的电导率,而绝缘材料则具有较低的电导率。
5. 透明度:物质对光的透过程度。
透明度可以用来描述物质的透明、半透明或不透明程度。
化学性质是指物质在与其他物质发生化学反应时所表现出的性质。
以下是一些常见的化学性质:1. 腐蚀性:物质与其他物质接触产生腐蚀作用。
例如,某些酸类物质具有强腐蚀性,可腐蚀金属。
2. 氧化性:物质与氧气或其他氧化剂接触时发生氧化反应。
例如,铁与氧气接触会发生氧化反应,生成铁锈。
3. 还原性:物质在与还原剂接触时发生还原反应。
例如,氧气与还原剂反应会发生还原反应,氧气被还原为水。
4. 燃烧性:物质能够与氧气在适当条件下燃烧。
不同物质的燃烧性质不同,有的物质易燃,有的物质难燃。
5. 化学稳定性:物质在一定条件下的稳定性。
有些物质可以长时间保持稳定,而有些物质在特定条件下会发生分解或反应。
物质的性质可以进一步通过实验和测量得到更加详细和具体的结论。
例如,物质的酸碱性可以通过酸碱中和实验来测定,物质的溶解性可以通过加入特定溶剂后观察其溶解程度来确定。
总之,物质的性质是描述物质特征和行为的概括性概念。
这些性质可以通过物质的外观、观察和实验得到,对于了解和研究物质非常重要。
初三物理复习理解物质的性质

初三物理复习理解物质的性质初三物理复习:理解物质的性质物质是构成世界的基本单位,它的性质直接影响着我们日常生活和科学研究。
在初中物理学习中,我们需要深入理解物质的性质,这对于我们进一步探索自然科学世界具有重要意义。
本文将从不同角度介绍物质的性质及其实际应用,帮助我们在初三物理复习中获得更深入的理解。
一、物质的物理性质物质的物理性质是指物质在不改变其化学成分的情况下所表现出的特性。
物理性质主要包括质量、体积、密度、颜色、硬度、熔点、沸点等。
下面将分别介绍其中几个重要的物理性质。
1. 质量质量是物质所固有的属性,是一个物体所含质点的总和。
质量不随物体所在的地点、外界条件的改变而改变。
常用的质量单位有千克(kg)、克(g)等。
在物理学习中,我们经常会用到质量守恒定律,即封闭系统内物质的质量在物理和化学变化过程中不会发生改变。
2. 密度密度是物质的质量与体积之比,用来表示物质的致密程度。
密度的公式为:密度 = 质量 / 体积。
根据密度的不同,物质可以分为固体、液体和气体。
密度还可以用来判断物体之间的浮沉关系,常用的单位有千克/立方米(kg/m³)、克/立方厘米(g/cm³)等。
3. 熔点和沸点熔点是物质从固态变为液态的温度,沸点是物质从液态变为气态的温度。
熔点和沸点是物质固有的性质,不同物质具有不同的熔点和沸点。
例如,水的熔点是0℃,沸点是100℃。
通过控制温度,我们可以改变物质的状态,这在日常生活中具有广泛的应用,比如烹饪、制冷等。
二、物质的化学性质物质的化学性质是指物质参与化学变化时所表现出的性质。
化学性质决定了物质的化学反应和变化过程。
下面将介绍几个常见的化学性质。
1. 反应性物质的反应性是指物质与其他物质发生化学反应的倾向。
不同物质的反应性不同,有的物质容易与其他物质发生反应,而有的物质相对不活泼。
反应性还可以根据物质与酸碱、氧化剂等物质的反应性质来进行分类。
2. 氧化性和还原性氧化是物质与氧气发生化学反应或与氧化剂发生反应的现象,还原则与氧化相反,是物质与还原剂发生反应的过程。
化学物质的物理性质

化学物质的物理性质化学物质是构成物质世界的基本单位,其物理性质是研究和描述物质在不引起化学反应的情况下所表现出来的性质特征。
物理性质通常可以通过观察、测量和实验得到,为我们深入了解和研究化学物质提供了基础和理论依据。
一、密度和相对密度密度是物质的物理性质之一,指的是单位体积的物质的质量。
常用符号为ρ,单位一般为g/cm³或kg/m³。
相对密度是以水的密度作为参照标准,比较其他物质与水的密度之比。
相对密度没有单位,是一个纯数。
例如,铁的密度为7.87 g/cm³,相对密度为7.87。
这意味着铁的密度是水的7.87倍。
二、熔点和沸点熔点指的是物质从固态转变为液态的温度,沸点是物质从液态转变为气态的温度。
物质的熔点和沸点是其物质结构和分子间相互作用力的体现。
不同物质由于其分子结构的不同,熔点和沸点也会有所差异。
例如,氢氧化钠的熔点为318℃,氯化钠的熔点为801℃。
从熔点的差异可以看出,氯化钠的分子结构相对较稳定,因此需要更高的温度才能熔化。
三、溶解度和溶解度曲线溶解度是指在一定温度下,单位体积溶剂中能溶解的溶质的质量。
溶解度常用单位为g/100g水或mol/L。
不同化学物质的溶解度受温度和压力的影响。
一般来说,随着温度的升高,溶解度也会增大;而对于气体溶解度来说,压力的升高会使溶解度增大。
溶解度曲线是描述溶解度随温度变化的图形,在图形上可以看出溶解度随温度的变化趋势。
例如,氯化钠在20℃下的溶解度为36g/100g水,而在60℃下的溶解度则增加到47g/100g水。
通过观察溶解度的变化,可以推断出溶解过程的热效应和化学反应的活性。
四、导电性和磁性导电性是指物质能否传导电流的能力。
导电性与物质的离子性质和电子结构有关。
金属和一些离子化合物由于具有自由移动的电子或离子,在外加电场的作用下能够传导电流。
这种物质称为电解质。
磁性是指物质在外加磁场作用下所表现出来的性质。
常见的磁性包括铁磁性、顺磁性和抗磁性。
初中化学常见物质的物理性质与化学性质解析

初中化学常见物质的物理性质与化学性质解析化学作为一门自然科学,研究物质的物理性质与化学性质是其中的关键内容。
而在初中化学课程中,学生们通常会接触到一些常见物质,对这些物质的性质进行解析,对于深入理解化学的基本概念和原理非常重要。
本文将从物质的物理性质和化学性质两个方面进行解析。
一、物质的物理性质解析物理性质是指物质的固有属性,与物质的组成和结构无关。
通过观察和测量,我们可以获得物质的物理性质。
下面,我们来解析一些常见物质的物理性质。
1. 密度密度是物质的质量与体积之比,通常用符号ρ表示,单位为g/cm³或kg/m³。
不同物质的密度差异很大,这使得密度成为物质鉴别和分离的重要依据。
例如,金属的密度通常较大,而气体的密度较小。
2. 熔点和沸点熔点是指物质从固态转变为液态的温度,沸点则是指物质从液态转变为气态的温度。
熔点和沸点也是物质的特征性质,可用于物质的鉴定。
例如,水的熔点为0℃,沸点为100℃。
3. 溶解性溶解性是物质在特定温度和压力下与其他物质形成溶液的能力。
溶解性受到温度、溶剂性质等因素的影响。
例如,盐可以在水中溶解,形成盐水溶液;而油和水则不能相互溶解。
二、物质的化学性质解析物质的化学性质是指物质与其他物质发生化学反应时呈现出的性质。
下面,我们来解析一些常见物质的化学性质。
1. 酸碱性酸碱性是物质的一种重要的化学性质。
酸性物质具有酸性质,能与碱反应生成盐和水;碱性物质具有碱性质,能与酸反应生成盐和水。
反应中产生的盐可以是无机盐,也可以是有机盐。
例如,盐酸和氢氧化钠反应生成氯化钠和水。
2. 氧化性和还原性氧化性是指物质与其他物质接触时,能使其他物质失去电子,自己得到电子的性质;还原性则相反,是指物质能够接受其他物质失去的电子。
氧化还原反应是化学反应中非常重要的一类反应。
例如,氧气可以与铁发生氧化反应,形成铁的氧化物。
3. 反应活性反应活性是指物质发生化学反应的能力。
某些物质具有很高的反应活性,容易与其他物质发生反应,而某些物质反应活性较低。
化学物质的常见性质总结

化学物质的常见性质总结化学物质是构成物质世界的基本单位,不同的化学物质具有不同的性质。
本文将对常见的化学物质性质进行总结,包括物理性质、化学性质和特殊性质。
一、物理性质1.密度:指单位体积物质的质量,常用于确定物质的浮沉性质。
2.颜色:不同的物质吸收和反射不同波长的光线,从而呈现出不同的颜色。
3.熔点和沸点:不同物质在不同温度下会发生熔化和汽化,熔点是指物质由固态转变为液态的温度,沸点是指物质由液态转变为气态的温度。
4.溶解性:不同的物质在不同的溶剂中具有不同的溶解性,可溶性物质会在溶剂中形成溶液,而不溶性物质则会以悬浮物的形式存在。
二、化学性质1.反应性:化学物质会与其他物质发生各种化学反应,如氧化、还原、酸碱反应等。
2.氧化性:某些物质具有与氧气或氧化剂发生反应的能力,被氧化的物质叫做还原剂。
3.还原性:某些物质具有与还原剂发生反应的能力,被还原的物质叫做氧化剂。
4.酸碱性:物质可以根据其在溶液中生成的离子来判断其是酸性还是碱性。
5.氧化数:指在化合物中元素的氧化状态,用来描述元素在化学反应中的变化情况。
三、特殊性质1.电导性:某些物质在溶液中能够导电,这是因为其溶解后会生成可以移动的离子。
2.磁性:部分物质在外加磁场下会表现出吸引或排斥的性质,这是由于物质内部的微观结构产生的。
3.放射性:某些元素的原子核不稳定,会自发地放出α、β、γ粒子或电磁波,这种现象称为放射性。
通过对化学物质的常见性质总结,我们可以更加深入地了解物质的本质和性质,这对于化学工业生产、实验研究以及环境保护等领域具有重要意义。
本文所提到的性质只是化学物质性质的一小部分,具体的性质还包括凝固性质、光学性质、燃烧性质等。
进一步研究化学物质的性质可以帮助我们更好地认识和利用化学物质,为人类发展和进步做出更大的贡献。
物理属性特性归纳总结表

物理属性特性归纳总结表物理属性特性是指物质在物理方面所具备的性质和特点,这些特性对于我们了解和研究物质非常重要。
在本文中,我们将对一些常见的物理属性特性进行归纳总结,以便更好地理解和应用这些知识。
1. 密度(Density)密度是指物质单位体积的质量,常用单位是克/立方厘米(g/cm³)或千克/立方米(kg/m³)。
密度越大,表示单位体积内所含的质量越多。
例如,钢的密度较大,而气体的密度较小。
2. 弹性模量(Elastic Modulus)弹性模量是物质的刚度指标,描述了物质对外力变形的抵抗能力。
常见的弹性模量有静态弹性模量(杨氏模量)和剪切模量。
杨氏模量用于描述物质在轴向受力时的弹性性能,剪切模量用于描述物质在剪切受力时的弹性性能。
3. 热膨胀系数(Coefficient of Thermal Expansion)热膨胀系数是物质随温度变化而引起的尺寸变化的比率。
它描述了物质在温度变化下的热胀冷缩特性。
不同物质的热膨胀系数不同,因此在实际应用中需要考虑热膨胀对物体的影响。
4. 热导率(Thermal Conductivity)热导率是物质导热性能的指标,表示单位时间内传导单位温度差的热量。
热导率高的物质,热量传导能力强,适用于热传导要求较高的场合。
5. 电导率(Electrical Conductivity)电导率是物质导电性能的指标,表示单位长度内单位横截面积所能通过的电流。
电导率高的物质,具有良好的导电性能,常用于电子器件和电路中。
6. 磁导率(Magnetic Permeability)磁导率是物质对磁场的导磁性能指标,表示物质中磁感应强度与磁场强度之比。
根据物质对磁场的响应程度,磁导率可分为磁导率大于1的顺磁性物质和磁导率小于1的抗磁性物质。
7. 抗拉强度(Tensile Strength)抗拉强度是材料所能承受的拉力最大值,是衡量材料抗拉性能的重要指标。
抗拉强度越高,表示材料越能在受拉条件下保持形状和完整性。
化学物质性质

化学物质性质化学物质是指由不同的元素组成的物质,其性质决定了它们在化学反应中的行为和用途。
本文将探讨化学物质的性质及其在日常生活中的应用。
一、物质的物理性质物质的物理性质是指在没有发生化学变化下所表现出来的性质。
以下将介绍几个常见化学物质的物理性质:1. 密度:密度是指单位体积内所含质量的大小。
不同的物质由于不同的化学成分,其密度也各不相同。
例如,水的密度为1克/立方厘米,而氯化钠的密度为2.16克/立方厘米。
2. 熔点和沸点:熔点是指物质从固态转变为液态的温度,而沸点是指物质从液态转变为气态的温度。
不同的物质由于其分子间力的差异,其熔点和沸点也各不相同。
例如,铁的熔点为1538摄氏度,而水的沸点为100摄氏度。
3. 可溶性:可溶性是指物质在给定条件下在溶剂中的溶解程度。
不同的物质由于其分子结构和相互作用力的不同,它们在溶剂中的可溶性也不同。
例如,食盐在水中具有很高的溶解度,而石蜡在水中几乎不溶解。
二、物质的化学性质物质的化学性质是指物质在化学反应中的行为。
以下将介绍几个常见化学物质的化学性质:1. 反应活性:物质的反应活性指的是其参与化学反应的能力和速度。
不同的物质由于其分子结构和化学键的稳定性不同,其反应活性也各不相同。
例如,金属与氧气反应会产生金属氧化物,而铁的反应速度较慢,而钠的反应速度则非常快。
2. 氧化还原性:氧化还原性是指物质发生氧化还原反应的能力。
氧化反应是指物质失去电子,而还原反应是指物质获得电子。
例如,氧气在与金属反应时具有较强的氧化性,而金属则具有较强的还原性。
3. 化学稳定性:化学稳定性指物质在一定条件下是否容易发生化学变化。
一些物质具有较高的化学稳定性,不容易被环境因素所破坏,而一些物质具有较低的化学稳定性,容易分解或发生反应。
例如,金属铝在常温下具有较高的化学稳定性,而铁在潮湿空气中容易生锈。
三、化学物质在日常生活中的应用化学物质广泛应用于各个领域,如医药、农业、能源等。
常见物质的主要物理性质

常见物质的主要物理性质1、常见固体物质的颜色:⑴白色固体:CuSO4、MgO、P2O5、CaO、Ca(OH)2、CaCO3、KClO3、KCl、NaCl、Na2CO3、NaOH等。
⑵红色固体:Cu(亮红色)、Fe2O3(红棕色)、红磷(暗红色)。
⑶黑色固体:MnO2、CuO、Fe3O4、C(木炭)、铁粉。
⑷蓝色固体:CuSO4•5H2O。
⑸淡黄色固体:硫磺(单质S)。
⑹绿色固体:碱式碳酸铜(了解)Cu2 (OH) 2CO32、常见沉淀的颜色⑴不溶于水也不溶于稀硝酸的白色沉淀物是AgCl、BaSO4。
⑵不溶于水但能溶于酸,且能产生使澄清石灰水变浑浊的气体的白色沉淀物是CaCO3、BaCO3等。
⑶不溶于水,能溶于酸,但没有气泡生成的白色沉淀物是Mg(OH)2、Zn(OH)2、Al(OH)3。
⑷不溶于水的蓝色沉淀是Cu(OH)2。
⑸不溶于水的红褐色沉淀是Fe(OH)3。
3、常见溶液的颜色⑴常见的酸,如盐酸、硫酸、硝酸、碳酸、磷酸是无色的;其中浓盐酸、浓硝酸有刺激性气味。
⑵蓝色溶液:含Cu2+的溶液,如CuSO4溶液、CuCl2溶液。
⑶黄色溶液:含Fe3+的溶液,如Fe2(SO4)3溶液、FeCl3溶液。
⑷浅绿色溶液:含Fe2+的溶液,如FeSO4溶液、FeCl2溶液。
4、常见气体的颜色⑴红棕色气体:二氧化氮(NO2)。
⑵黄绿色气体:氯气(Cl2)。
⑶无色气体:氧气,氮气,氢气,二氧化碳,一氧化碳,二氧化硫,氯化氢气体等大多数气体。
5、溶液的酸碱性⑴显酸性的溶液:酸溶液和某些盐溶液。
如硫酸氢钠(NaHSO4)、硫酸氢钾(KHSO4)等⑵显碱性的溶液:碱溶液和某些盐溶液。
碳酸钠(Na2CO3)、碳酸氢钠(NaHCO3)等。
⑶显中性的溶液:水和大多数的盐溶液四、敞口置于空气中质量改变的(一)质量增加的八、分离和提纯的主要方法⒈如何检验NaOH是否变质:滴加稀盐酸,若产生气泡则变质。
⒉检验生石灰中是否含有石灰石:滴加稀盐酸,若产生气泡则含有石灰石。
化学初三常见化合物的物理性质总结

化学初三常见化合物的物理性质总结化学是一门研究物质性质和变化的科学,对于初三学习化学的学生来说,了解常见化合物的物理性质是非常重要的。
本文将对常见化合物的物理性质进行一定的总结和探讨。
一、酸类物质首先,我们来讨论一下酸类物质。
酸是指在水溶液中产生氢离子(H+)的物质。
常见的酸类物质有盐酸(HCl),硫酸(H2SO4),硝酸(HNO3)等。
酸类物质具有以下几个特点:1. 酸类物质的味道酸酸的,常常带有腐蚀性。
2. 酸类物质能与金属产生反应,生成氢气。
3. 酸类物质能与碱发生中和反应,生成盐和水。
二、碱类物质接下来,我们来了解一些碱类物质。
碱是指在水溶液中产生氢氧根离子(OH-)的物质。
常见的碱类物质有氢氧化钠(NaOH),氢氧化钾(KOH),氢氧化铵(NH4OH)等。
碱类物质具有以下几个特点:1. 碱类物质的味道苦苦的,有刺激性。
2. 碱类物质能与酸发生中和反应,生成盐和水。
3. 碱类物质能与酸类物质产生反应,产生盐和水。
三、氧化物氧化物是由金属和非金属元素结合而成的化合物,它们的物理性质与其组成元素有关。
常见的氧化物有氧化铁(Fe2O3),氧化钙(CaO),氧化铝(Al2O3)等。
氧化物具有以下几个特点:1. 氧化物的性质主要与金属元素有关,因此常常具有金属的性质,如导电性等。
2. 氧化物常常是固体,且具有一定的熔点和沸点。
3. 氧化物常常是不溶于水的,但可以与酸发生反应。
四、盐类盐类是由酸和碱反应生成的物质,也可以通过金属与非金属元素的化合反应得到。
常见的盐类有氯化钠(NaCl),硫酸铜(CuSO4),硝酸钾(KNO3)等。
盐类具有以下几个特点:1. 盐类物质的味道咸咸的,不具有酸和碱的刺激性。
2. 盐类常常是晶状固体,具有一定的熔点和沸点。
3. 盐类可以溶于水,形成电解质溶液。
五、水和气体除了上述的化合物,还有两种常见的物质,即水和气体。
水(H2O)是生命之源,是一种无色、无味、无臭的液体。
常见物质的物理性质归纳

常见物质的物理性质归纳1.颜色的规律(1)常见物质颜色①以红色为基色的物质红色:难溶于水的Cu,Cu2O,Fe2O3,HgO等。
碱液中的酚酞、酸液中甲基橙、石蕊及pH试纸遇到较强酸时及品红溶液。
橙红色:浓溴水、甲基橙溶液、氧化汞等。
棕红色:Fe(OH)3固体、Fe(OH)3水溶胶体等。
②以黄色为基色的物质黄色:难溶于水的金、碘化银、磷酸银、硫磺、黄铁矿、黄铜矿(CuFeS2)等。
溶于水的FeCl3、甲基橙在碱液中、钠离子焰色及TNT等。
浅黄色:溴化银、碳酦银、硫沉淀、硫在CS2中的溶液,还有黄磷、Na2O2、氟气。
棕黄色:铜在氯气中燃烧生成CuCl2的烟。
③以棕或褐色为基色的物质碘水浅棕色、碘酒棕褐色、铁在氯气中燃烧生成FeCl3的烟等④以蓝色为基色的物质蓝色:新制Cu(OH)2固体、胆矾、硝酸铜、溶液中淀粉与碘变蓝、石蕊试液碱变蓝、pH试纸与弱碱变蓝等。
浅蓝色:臭氧、液氧等蓝色火焰:硫、硫化氢、一氧化碳的火焰。
甲烷、氢气火焰(蓝色易受干扰)。
⑤以绿色为色的物质浅绿色:Cu2(OH)2CO3,FeCl2,FeSO4•7H2O。
绿色:浓CuCl2溶液、pH试纸在约pH=8时的颜色。
深黑绿色:K2MnO4。
黄绿色:Cl2及其CCl4的萃取液。
⑥以紫色为基色的物质KMnO4为深紫色、其溶液为红紫色、碘在CCl4萃取液、碘蒸气、中性pH试纸的颜色、K +离子的焰色等。
⑦以黑色为基色的物质黑色:碳粉、活性碳、木碳、烟怠、氧化铜、四氧化三铁、硫化亚铜(Cu2S)、硫化铅、硫化汞、硫化银、硫化亚铁、氧化银(Ag2O)。
浅黑色:铁粉。
棕黑色:二氧化锰。
⑧白色物质★无色晶体的粉末或烟尘;★与水强烈反应的P2O5;★难溶于水和稀酸的:AgCl,BaSO3,PbSO4;★难溶于水的但易溶于稀酸:BaSO3,Ba3(PO4)2,BaCO3,CaCO3,Ca3(PO4)2,CaHPO4,Al(OH)3,Al2O3,ZnO,Zn(OH)2,ZnS,Fe(OH)2,Ag2SO3,CaSO3 等;★微溶于水的:CaSO4,Ca(OH)2,PbCl2,MgCO3,Ag2SO4;★与水反应的氧化物:完全反应的:BaO,CaO,Na2O;不完全反应的:MgO。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
H2S(1:2.6) SO2(1:40)
③ 微溶于水的
O2,O3,C2H2等
④ 难溶于水的
H2,N2,CH4,C2H2,NO,CO等。
(2)液体的溶解性
① 易溶于水或与水互溶的
如:酒精、丙酮、醋酸、硝酸、硫酸。
② 微溶于水的
如:乙酸乙酯等用为香精的低级酯。
② 以黄色为基色的物质
黄色:难溶于水的金、碘化银、磷酸银、硫磺、黄铁矿、黄铜矿(CuFeS2)等。
溶于水的FeCl3、甲基橙在碱液中、钠离子焰色及TNT等。
浅黄色:溴化银、碳酦银、硫沉淀、硫在CS2中的溶液,还有黄磷、Na2O2、氟气。
棕黄色:铜氯气中燃烧生成CuCl2的烟。
③ 以棕或褐色为基色的物质
⑦ 以黑色为基色的物质
黑色:碳粉、活性碳、木碳、烟怠、氧化 铜、四氧化三铁、硫化亚铜(Cu2S)、硫化铅、硫化汞、硫化银、硫化亚铁、氧化银(Ag2O)。
浅黑色:铁粉。
棕黑色:二氧化锰。
⑧ 白色物质
★ 无色晶体的粉末或烟尘;
★ 与水强烈反应的P2O5;
★ 难溶于水和稀酸的:AgCl,BaSO3,PbSO4;
③ 难溶于水的
如:液态烃、醚和卤代烃。
(3)固体的水溶性(无机物略)
有机物中羟基和羧基具有亲水性,烃基具有憎水性,烃基越大,则水溶性越差,反而易I溶于有机溶剂中。如:甲酸、乙酸与水互溶,但硬脂酸、油酸分子中因—COOH比例过少反而不溶于水而溶于CCl4,汽油等有机溶剂。苯酚、三溴苯酚、苯甲酸均溶于苯。
沸点指液体饱和蒸气压与外界压强相同时的温度,外压力为标准压(1.01×105Pa)时,称正常沸点。外界压强越低,沸点也越低,因此减压可降低沸点。沸点时呈气、液平衡状态。
(1)由周期表看主族单质的熔、沸点
同一主族单质的熔点基本上是越向下金属熔点渐低;而非金属单质熔点、沸点渐高。但碳族元素特殊,即C,Si,Ge,Sn越向下,熔点越低,与金属族相似。还有ⅢA族的镓熔点比铟、铊低,ⅣA族的锡熔点比铅低。
(7)难溶于水和一般溶剂的物质
① 原子晶体(与溶剂不相似)。如:C,Si,SiO2,SiC等。其中,少量碳溶于熔化的铁。
② 有机高分子:纤维素仅溶于冷浓H2SO4、铜氨溶液和CS2跟NaOH作用后的溶液中,已热固化的酚醛树脂不溶于水或一般溶剂。
5.常见的有毒物质
(1)剧毒物质
白磷、偏磷酸、氰化氢(HCN)及氰化物(NaCN,KCN等)砒霜(As2O3)、硝基苯等。
金属的低熔点区有两处:IA、ⅡB族Zn,Cd,Hg及ⅢA族中Al,Ge,Th;ⅣA族的Sn,Pb;ⅤA族的Sb,Bi,呈三角形分布。最低熔点是Hg(-38.87℃),近常温呈液态的镓(29.78℃)铯(28.4℃),体温即能使其熔化。
(3)从晶体类型看熔、沸点规律
原子晶体的熔、沸点高于离子晶体,又高于分子晶体。金属单质和合金属于金属晶体,其中熔、沸点高的比例数很大(但也有低的)。
钦酒过多也有一定毒性。汞蒸气毒性严重。有些塑料如聚氯乙烯制品(含增塑剂)不宜盛放食品等。
② 有刺激性气味:HCl,HBr,HI,HF,SO2,NO2,NH3?HNO3(浓液)、乙醛(液)。
③ 具有强烈刺激性气味气体和挥发物:Cl2,Br2,甲醛,冰醋酸。
④ 稀有气味:C2H2。
⑤ 臭鸡蛋味:H2S。
⑥ 特殊气味:苯(液)、甲苯(液)、苯酚(液)、石油(液)、煤焦油(液)、白磷。
浅绿色:Cu2(OH)2CO3,FeCl2,FeSO4?7H2O。
绿色:浓CuCl2溶液、pH试纸在约pH=8时的颜色。
深黑绿色:K2MnO4。
黄绿色:Cl2及其CCl4的萃取液。
⑥ 以紫色为基色的物质
KMnO4为深紫色、其溶液为红紫色、碘在CCl4萃取液、碘蒸气、中性pH试纸的颜色、K+离子的焰色等。
上述情况的特殊性最主要的是相对分子质量小而沸点高的三种气态氢化物:NH3,H2O,HF比同族绝大多数气态氢化物的沸点高得多(主要因为有氢键)。
(4)某些物质熔沸点高、低的规律性
① 同周期主族(短周期)金属熔点。如
Li<Be,Na<Mg<Al
② 碱土金属氧化物的熔点均在2000℃以上,比其他族氧化物显著高,所以氧化镁、氧化铝是常用的耐火材料。
MnO4-:紫色
:血红色;
:苯酚与FeCl3的反应开成的紫色。
②主族元素在水溶液中的离子(包括含氧酸根)无色。
运用上述规律便于记忆溶液或结晶水合物的颜色。
(3)主族金属单质颜色的特殊性
ⅠA,ⅡA,ⅣA,ⅤA的金属大多数是银白色。
铯:带微黄色 钡:带微黄色
铅:带蓝白色 铋:带微红色
CO(与血红蛋白结合),Cl2,Br2(气),F2(气),HF,氢氟酸等。
(2)毒性物质
NO(与血红蛋白结合),NO2,CH3OH,H2S。
苯酚、甲醛、二氧化硫、重铬酸盐、汞盐、可溶性钡盐、可溶性铅盐、可溶性铜盐等。
这些物质的毒性,主要是使蛋白质变性,其中常见的无机盐如:HgCl2,BaCl2,Pb(CHCOO)2;铜盐也使蛋白质凝固变性,但毒性较小,此外铍化合物也有相当的毒性。
★ 难溶于水的但易溶于稀酸:BaSO3,Ba3(PO4)2,BaCO3,CaCO3,Ca3(PO4)2,CaHPO4,Al(OH)3,Al2O3,ZnO,Zn(OH)2,ZnS,Fe(OH)2,Ag2SO3,CaSO3等;
★ 微溶于水的:CaSO4,Ca(OH)2,PbCl2,MgCO3,Ag2SO4;
(4)从碘、溴、氯的水溶液中萃取卤素的有机溶剂
如:苯、汽油、乙醚、乙酸乙酯、CCl4、CS2等。
(5)白磷、硫易溶于CS2
(6)常见水溶性很大的无机物
如:KOH,NaOH,AgNO3溶解度在常温超过100g(AgNO3超过200g)。KNO3在20℃溶解度为31.6g,在100℃溶解度为246g。溶解度随温度变化甚少的物质常见的只有NaCl。
常见物质的物理性质归纳
1.颜色的规律
(1)常见物质颜色
① 以红色为基色的物质
红色:难溶于水的Cu,Cu2O,Fe2O3,HgO等。
碱液中的酚酞、酸液中甲基橙、石蕊及pH试纸遇到较强酸时及品红溶液。
橙红色:浓溴水、甲基橙溶液、氧化汞等。
棕红色:Fe(OH)3固体、Fe(OH)3水溶胶体等。
(4)其他金属单质的颜色
铜呈紫红色(或红),金为黄色,其他金属多为银白色,少数为灰白色(如锗)。
(5)非金属单质的颜色
卤素均有色;氧族除氧外,均有色;氮族除氮外,均有色;碳族除某些同素异形体(金钢石)外,均有色。
2.物质气味的规律(常见气体、挥发物气味)
① 没有气味的气体:H2,O2,N2,CO2,CO,稀有气体,甲烷,乙炔。
在原子晶体中成键元素之间共价键越短的键能越大,则熔点越高。判断时可由原子半径推导出键长、键能再比较。如熔点:
金刚石>碳化硅>晶体硅
分子晶体由分子间作用力而定,其判断思路是:
① 结构性质相似的物质,相对分子质量大,范德华力大,则熔、沸点也相应高。如烃的同系物、卤素单质、稀有气体等。
② 相对分子质量相同,化学式也相同的物质(同分异构体),一般烃中支链越多,熔沸点越低。烃的衍生物中醇的沸点高于醚;羧酸沸点高于酯;油脂中不饱和程度越大,则熔点越低。如:油酸甘油酯常温时为液体,而硬脂酸甘油酯呈固态。
⑦ 特殊气味:乙醇(液)、低级酯。
⑧ 芳香(果香)气味:低级酯(液)。
⑨ 特殊难闻气味:不纯的C2H2(混有H2S,PH3等)。
3.熔点、沸点的规律
晶体纯物质有固定熔点;不纯物质凝固点与成分有关(凝固点不固定)。
非晶体物质,如玻璃、水泥、石蜡、塑料等,受热变软,渐变流动性(软化过程)直至液体,没有熔点。
碘水浅棕色、碘酒棕褐色、铁在氯气中燃烧生成FeCl3的烟等
④ 以蓝色为基色的物质
蓝色:新制Cu(OH)2固体、胆矾、硝酸铜、溶液中淀粉与碘变蓝、石蕊试液碱变蓝、pH试纸与弱碱变蓝等。
浅蓝色:臭氧、液氧等
蓝色火焰:硫、硫化氢、一氧化碳的火焰。甲烷、氢气火焰(蓝色易受干扰)。
⑤ 以绿色为色的物质
★ 与水反应的氧化物:完全反应的:BaO,CaO,Na2O;
不完全反应的:MgO。
⑨ 灰色物质
石墨灰色鳞片状、砷、硒(有时灰红色)、锗等。
(2)离子在水溶液或水合晶体的颜色
① 水合离子带色的:
Fe2+:浅绿色;
Cu2+:蓝色;
Fe3+:浅紫色 呈黄色因有[FeCl4(H2O)2] 2-;
③ 卤化钠(离子型卤化物)熔点随卤素的非金属性渐弱而降低。如:NaF>NaCl>NaBr>NaI。
4.物质溶解性规律
(1)气体的溶解性
① 常温极易溶解的
NH3[1(水):700(气)] HCl(1:500)
还有HF,HBr,HI,甲醛(40%水溶液—福尔马林)。
② 常温溶于水的
(2)同周期中的几个区域的熔点规律
① 高熔点单质
C,Si,B三角形小区域,因其为原子晶体,熔点高。金刚石和石墨的熔点最高大于3550℃,金属元素的高熔点区在过渡元素的中部和中下部,其最高熔点为钨(3410℃)。
② 低熔点单质
非金属低熔点单质集中于周期表的右和右上方,另有IA的氢气。其中稀有气体熔、沸点均为同周期的最低者,而氦是熔点(-272.2℃,26×105Pa)、沸点(268.9℃)最低。
