高中化学常见离子检验汇总
高中化学离子检验(全)

高中化学离子检验(全)高中化学离子检验H+的检验使用试剂:石蕊试液,Na2CO3溶液或pH试纸。
操作步骤和反应现象:将含有H+的溶液取出放入试管中,滴加Na2CO3溶液,会产生气泡。
将溶液用玻璃棒蘸取少量滴到蓝色石蕊试纸或pH试纸上,会呈现红色。
离子方程式:2H++CO32- CO2↑+H2O。
Na+、K+的检验使用试剂:XXX、HCl。
操作步骤和反应现象:取含钠离子的溶液,用烧过的铂丝蘸溶液或固体少许在酒精灯焰上灼烧,观察会出现黄色火焰。
用蘸HCl溶液烧铂丝进行清洗,直到看不出黄色为止,再取K+盐或其溶液在酒精灯焰上灼烧,透过钴玻璃片观察会出现紫色火焰。
NH4+的检验使用试剂:浓HCl、NaOH溶液、红色石蕊试纸。
操作步骤和反应现象:取含NH4+的盐或溶液加入浓NaOH溶液后加热,会产生气体,接触湿润红色石蕊试纸会变蓝。
或者用玻璃棒蘸上浓HCl挨近上述气体时冒大量白烟。
离子方程式或化学方程式:NH4++OH- NH3↑+H2O,NH3+H2O NH3•H2O,NH3+HCl NH4Cl。
Mg2+检验使用试剂:NaOH溶液。
操作步骤和反应现象:将含Mg2+的溶液中加入NaOH溶液,会生成白色不溶于过量NaOH的沉淀。
离子方程式:Mg2++2OH- Mg(OH)2↓。
Al3+的检验使用试剂:NaOH溶液,HCl溶液。
操作步骤和反应现象:在含有Al3+的溶液中滴加少量NaOH溶液,会产生白色絮状沉淀。
过量NaOH溶液沉淀会溶解,白色状沉淀也会溶于盐酸。
离子方程式:Al3++3OH-Al(OH)3↓,Al(OH)3+OH- AlO2-+2H2O,Al(OH)3+3H+Al3++3H2O。
Cu2+的检验使用试剂:NaOH溶液,NH3•H2O。
操作步骤和反应现象:取含Cu2+的蓝色溶液加入NaOH 溶液,会生成蓝色的沉淀。
再加NH3•H2O振荡,会呈现深蓝色溶液。
离子方程式:Cu2++2OH- Cu(OH)2↓,Cu(OH)2+4NH3 Cu(NH3)4(OH)2.Fe2+的检验使用试剂:NaOH溶液。
高中化学常见离子检验大全(精品范文).doc

【最新整理,下载后即可编辑】(一)常见阳离子的检验方法
2Fe2++ Cl
2Fe3++
2
2Cl-
Fe3++3SCN-=
Fe(SCN)
3
即显红色。
-+8H+
5Fe2+ + MnO
4
5Fe3+ +Mn2++4 H
O
2
(二)常见阴离子的检验方法
【最新整理,下载后即可编辑】 注意:
1.若SO 42-与Cl-同时检验,需注意检验顺序。
应先用Ba(NO 3)2溶液将SO 42-检出,并滤去BaSO 4,然后再用AgNO 3检验Cl-。
2.检验SO 32-的试剂中,只能用盐酸,不能用稀硝酸。
因为稀硝酸能把SO 32-氧化成SO 42-。
3.若Ag +和Ba 2+同时检验,也需注意检验顺序,应先用盐酸将Ag +检验出并滤去沉淀,然后再用稀硫酸检验Ba 2+。
4.若Ag +和Ba 2+同时检验,也需注意检验顺序,应先用盐酸将Ag +检验出
5.若CO 32-和HCO 3-同时检验,应先用足量的BaCl 2溶液将CO 32-检出,静置,取上层清夜用Ba(OH)2或Ca(OH)2检出HCO 3-。
高中化学中常见离子检验方法总结

高中化学中常见离子检验方法总结高中化学中常见离子检验方法总结一、常见阴离子的检验1.阴离子的初步检验①与稀H2SO4作用,试液中加入稀H2SO4并加热,有气泡产生,可能有CO32-、SO32-、S2-、NO2-或CN-存在,再根据气体的特性不同,再进行判断。
②与BaCl2的作用。
试液中加入BaCl2溶液,生成白色沉淀,可能有SO42-、SO32-、PO43-、S2O32-根据沉淀性质不同进行检验。
③与AgNO3HNO3作用。
试液中加入AgNO3再加入稀HNO3若为白色沉淀为Cl-黄色沉淀可能有I-、Br-和CN-存在,若有黄色沉淀很快变橙、褐色,最后变为黑色,表示有S2O32-存在,Ag2S 为黑色沉淀。
④氧化性阴离子的检验试液用H2SO4酸化后,加入KI溶液和淀粉指示剂,若溶液变蓝,说明有NO2-存在。
⑤还原性阴离子检验a、强还原性阴离子与I2的试验,试液用H2SO4酸化后,加含0.1%KI的I2-淀粉溶液,若其蓝色褪去,可能有SO32-、C2O42-、S2O32-、S2-和CN-等离子存在。
b、还原性阴离子与KMnO4的试验,试液用H2SO4酸化后,加入0.03%KMnO4溶液,若能褪色,可能有SO32-、S2O32-、S2-、C2O42-、Br-、I-、NO2-等离子。
2.个别鉴定反应⑴SO42-加入BaCl2溶液生成BaSO4白色沉淀,该沉淀不溶于稀HCl或稀HNO3Ba2SO42-===BaSO4↓⑵SO32-a、加入BaCl2溶液生成BaSO3白色沉淀,加入稀HCl,沉淀溶解并放出有刺激性气味的气体SO2Ba2SO32-===BaSO3↓BaSO32H===Ba2H2O SO2↑b、加入少量I2-淀粉溶液,蓝色褪去SO32-I2H2O===SO42-2I-2H⑶Cl-加入AgNO3生成AgCl白色沉淀,该沉淀不溶于稀HNO3或稀HCl,但溶于浓NH3·H2OAgCl2NH3·H2O===[Ag(NH3)2]Cl-2H2O⑷Br-a、加入AgNO3生成淡黄色AgBr沉淀,该沉淀不溶于HCl或HNO3中,微溶于浓NH3·H2O。
高中常见离子检验方法

高中常见离子检验方法高中常见离子检验方法主要包括酸碱中性离子检验、金属离子检验和非金属离子检验等。
下面将从这三个方面逐一介绍。
一、酸碱中性离子检验1. 酸碱中性离子的灼烧法:将待检物质灼烧,观察它的灼烧现象来判断其离子成分。
如钠离子的存在可以通过灼烧后火花变亮、扑灭的现象来判定。
2. 酸碱指示剂法:通过将待检物质与酸碱指示剂反应,观察颜色的变化来判断其离子成分。
如酚酞指示剂在酸性溶液中呈现红色,在碱性溶液中呈现无色。
3. 气体的放出法:通过加热待检物质,观察有无气体产生来判断其离子成分。
如将一些金属碳酸盐加热,可以释放出二氧化碳气体,从而判定其中含有碳酸根离子。
二、金属离子检验1. 阳离子的碳酸盐沉淀法:通过加入碳酸盐试剂,观察是否产生沉淀来判断钙、镁、锌等金属离子的存在。
如加入碳酸钠试剂,若产生白色沉淀,则说明存在钙离子。
2. K2CrO4沉淀法:通过加入铬酸钾试剂,观察是否产生沉淀来判断铁、铜、银等金属离子的存在。
如加入铬酸钾试剂,若产生红棕色沉淀,则说明存在铁离子。
3. Na2S沉淀法:通过加入硫化钠试剂,观察是否产生沉淀来判断铅、汞、铅等金属离子的存在。
如加入硫化钠试剂,若产生黑色沉淀,则说明存在铅离子。
三、非金属离子检验1. 阴离子的沉淀法:通过加入适当的反应剂,观察是否产生沉淀来判断氯离子、碳酸根离子等的存在。
如加入银离子试剂,在存在氯离子的溶液中产生白色沉淀。
2. 离子溶液的颜色法:一些离子溶液具有显色性,可以通过颜色变化来判断其离子成分。
如硫酸铜溶液是蓝色的、硫酸钴溶液是红色的,可以通过观察其颜色来判断其中是否含有铜离子和钴离子。
3. 离子溶液的电导率法:通过测量离子溶液的电导率来判断其离子成分。
一般来说,含有离子的溶液的电导率较高,可以通过测定电导率的大小来判断其离子是否存在。
以上是高中中化学常见的离子检验方法。
通过这些方法,可以对样品中的离子成分进行准确的判断和分析,帮助搞懂化学中的一些问题。
高中化学常见离子检验大全

(一)常见阳离子的检验方法离子检验试剂实验步骤实验现象离子方程式H+①酸度计②pH试纸③石蕊试液①将酸度计的探头浸泡在待测液中②用玻璃棒蘸取少量待测液滴到干燥的pH试纸上③取样,滴加石蕊试液①、②pH<7③石蕊变红K+焰色反应①铂丝用盐酸洗涤后在火焰上灼烧至原火焰色②蘸取溶液,放在火焰上灼烧,观察火焰颜色。
浅紫色(通过蓝色钴玻璃片观察钾离子焰色)Na+焰色反应火焰分别呈黄色NH4+NaOH溶液(浓)取少量待测溶液于试管中,加入NaOH浓溶液并加热,将湿润红色石蕊试纸置于试管口加热,生成有刺激性气味、使湿润红色石蕊试纸变蓝的气体Ag+ 稀HNO3、稀盐酸(或NaCl)取少量待测溶液于试管中,加入稀HNO3再加入稀盐酸(或NaCl)生成白色沉淀,不溶于稀HNO3Ag++Cl-=AgCl↓Ba2+稀H2SO4或可溶性硫酸盐溶液、稀HCl取少量待测溶液于试管中,加入稀H2SO4再加入稀HCl产生白色沉淀,且沉淀不溶于稀HClBa2++ SO42—=BaSO4↓Fe3+KSCN溶液取少量待测溶液于试管中,加入KSCN溶液变为血红色溶液Fe3++3SCN-=Fe(SCN)3加苯酚取少量待测溶液于试管中,加苯酚溶液显紫色6C6H5OH + Fe3+ ⇌[Fe(C6H5O)6]3—+ 6H+淀粉KI溶液滴加淀粉KI溶液溶液显蓝色2Fe3++2I-=2Fe2++ I2加NaOH溶液加NaOH溶产生红褐色沉淀Fe3++3OH-=Fe(OH)3↓离子检验试剂实验步骤实验现象离子方程式Fe2+ ①KSCN溶液,新制的氯水取少量待测溶液于试管中,加入KSCN溶液,新制的氯水加入KSCN溶液不显红色,加入少量新制的氯水后,立即显红色。
2Fe2+ + Cl22Fe3+ + 2Cl-Fe3++3SCN-=Fe(SCN)3②NaOH溶液取少量待测溶液于试管中,加入NaOH溶液并露置在空气中开始时生成白色沉淀,迅速变成灰绿色,最后变成红褐色沉淀。
高中化学常见离子检验汇总大全

⾼中化学常见离⼦检验汇总⼤全⿊龙江省林⼝林业局助考辅导中⼼⾼中化学离⼦检验汇总(⼀)常见阳离⼦的检验⽅法离⼦检验试剂实验步骤实验现象离⼦⽅程式?H+①pH试纸②⽯蕊试液①⽤玻璃棒蘸取少量待测液滴到⼲燥的pH试纸上②取样滴加⽯蕊试液①pH<7②⽯蕊变红K+焰⾊反应①铂丝⽤盐酸洗涤后在⽕焰上灼烧⾄原⽕焰⾊②蘸取溶液,放在⽕焰上灼烧,观察⽕焰颜⾊。
浅紫⾊(通过蓝⾊钴玻璃⽚观察钾离⼦焰⾊)Na+焰⾊反应⽕焰分别呈黄⾊NH4+NaOH溶液(浓) 取少量待测溶液于试管中,加⼊NaOH浓溶液并加热,将湿润红⾊⽯蕊试纸置于试管⼝加热,⽣成有刺激性⽓味、使湿润红⾊⽯蕊试纸变蓝的⽓体Ag+ 稀HNO3、稀盐酸(或NaCl)取少量待测溶液于试管中,加⼊稀HNO3再加⼊稀盐酸(或NaCl)⽣成不溶于稀硝酸的⽩⾊沉淀Ag++Cl-=AgCl↓Ba2+①稀H2SO4或可溶性硫酸盐溶液②稀HNO3取少量待测溶液于试管中,加⼊稀H2SO4再加⼊稀HNO3产⽣不溶于稀硝酸的⽩⾊沉淀Ba2++ SO42-=BaSO4↓Fe3+KSCN溶液加⼊KSCN溶液变为⾎红⾊溶液Fe3++3SCN-=Fe(SCN)3(络合物)加苯酚取少量待测溶液于试管中,加苯酚溶液显紫⾊淀粉KI溶液滴加淀粉KI溶液溶液显蓝⾊2Fe3++2I-=2Fe2++ I2NaOH溶液加NaOH溶液产⽣红褐⾊沉淀Fe3++3OH-=Fe(OH)3↓Fe2+ ①KSCN溶液,新制的氯⽔①取少量待测溶液于试管中,加⼊KSCN溶液,新制的氯⽔①加⼊KSCN溶液不显红⾊,加⼊少量新制的氯⽔后,⽴即显红⾊。
2Fe2+ + Cl22Fe3+ + 2Cl-Fe3++3SCN-=Fe(SCN)3(⼆)常见阴离⼦的检验⽅法注意:1.若SO42-与Cl-同时检验,需注意检验顺序。
应先⽤Ba(NO3)2溶液将SO42-检出,并滤去BaSO4,然后再⽤AgNO3检验Cl-。
2.检验SO32-的试剂中,只能⽤盐酸,不能⽤稀硝酸。
高中化学所有离子检验

高中化学所有离子的鉴别1.H+的检验采用试剂:石蕊试液,Na2CO3溶液或pH试纸操作步骤和反应现象:取含有H+溶液于试管中,滴加Na2CO3溶液有气泡;取溶液用玻璃棒蘸取溶液少量滴到蓝色石蕊试纸或pH试纸上呈红色.有关离子方程式;2H++CO32-CO2↑+H2O2.Na+、K+的检验采用试剂:铂丝、HCl操作步骤和反应现象:取含钠离子的溶液,用烧过的铂丝蘸溶液或固体少许在酒精灯焰上灼烧,观察有黄色火焰;用蘸HCl溶液烧铂丝进行清洗,直到看不出黄色为止,再取K+盐或其溶液在酒精灯焰上灼烧,透过钴玻璃片观察有紫色火焰.3.NH4+的检验采用试剂:浓HCl、NaOH溶液、红色石蕊试纸操作步骤和反应现象:取含NH4+的盐或溶液加入浓NaOH溶液后加热,使产生气体接触湿润红色石蕊试纸变蓝或用玻璃棒蘸上浓HCl挨近上述气体时冒大量白烟有关离子方程式或化学方程式:NH4++OH-NH3↑+H2ONH3+H2ONH3 H2ONH3+HClNH4Cl4.Mg2+检验采用试剂:NaOH溶液操作步骤和反应现象:含Mg2+的溶液中加入NaOH溶液时生成白色不溶于过量NaOH的沉淀有关离子方程式:Mg2++2OH-MgOH2↓5.Al3+的检验采用试剂:NaOH溶液,HCl溶液操作步聚和反应现象:在含有Al3+的溶液中滴加少量NaOH溶液产生白色絮状沉淀,过量NaOH溶液沉淀溶解;白色状沉淀也溶于盐酸有关离子方程式:Al3++3OH-AlOH3↓AlOH3+OH-AlO2-+2H2OAlOH3+3H+Al3++3H2O6.Cu2+的检验采用试剂:NaOH溶液NH3H2O操作步骤和反应现象:取含Cu2+的蓝色溶液加入NaOH溶液生成蓝色的沉淀,再加NH3H2O振荡呈深蓝色溶液有关离子方程式:Cu2++2OH-CuOH2↓CuOH2+4NH3CuNH34OH27.Fe2+的检验采用试剂:NaOH溶液操作步骤和反应现象:在含Fe2+溶液中加入NaOH溶液生成白色沉淀,在空气中逐渐变成红褐色沉淀.有关反应的离子方程式及化学方程式Fe2++2OH-=FeOH2↓白色4FeOH2+2H2O+O2=4FeOH3↓红褐色8.Fe3+的检验采用试剂:NaOH溶液,KSCN溶液操作步骤和反应现象:1在含Fe3+溶液中加入NaOH溶液生成褐红色的沉淀,2在含Fe3+溶液中滴加KSCN溶液生成血红色溶液有关离子方程式:Fe3++3OH-=FeOH3↓Fe3++CNS-=FeSCN2+9.Ba2+的检验采用试剂:稀H2SO4、稀HNO3操作步骤和反应现象在含有Ba2+的溶液中加入稀H2SO4生成白色沉淀,再加HNO3沉淀不溶有关离子方程式:Ba2++SO42-=BaSO4↓10.Zn2+的检验采用试剂:NaOH溶液,NH3、H2O、HCl溶液操作步骤和反应现象:在含Zn2+溶液中滴加NaOH 溶液,出现白色沉淀,NaOH过量时,沉淀溶解;在含Zn2+溶液中加NaOH溶液生成沉淀分成两试管,一试管加NH3 H2O,振荡白色沉淀溶解;另一试管中加入适量的HCl,白色沉淀也溶解.有关离子方程式:Zn2++2OH-=ZnOH2↓ZnOH2+4NH3=ZnNH34OH2ZnOH2+2OH-=ZnO22-+2H2OZnOH2+2H+=Zn2++2H2O11.OH-的检验采用试剂:石蕊、酚酞和甲基橙操作步骤和反应现象:含OH-的试液能使红色石蕊试纸变蓝,酚酞变红色;甲基橙变黄;pH试纸的变色范围中紫色加深12.Cl-的检验采用试剂:AgNO3溶液、HNO3溶液操作步骤和反应现象:滴加AgNO3溶液生成白色沉淀,再加稀HNO3沉淀不溶,有关的离子方程式:Ag++Cl-AgCl↓13.Br-的检验采用试剂:AgNO3、HNO3溶液,Cl2水操作步骤和反应现象:滴加AgNO3溶液生成浅黄色沉淀,沉淀不溶于稀HNO3;滴加Cl2水振荡后加几滴汽油,油层红棕色有关的离子方程式:Ag++Br-AgBr↓Cl2+2Br-2Cl-+Br214.I-的检验采用试剂:AgNO3、HNO3溶液,Cl2水操作步骤和反应现象:滴加AgNO3溶液生成黄色沉淀,沉淀不溶于稀HNO3;滴加Cl2水,振荡用CCl4萃取呈紫色有关的离子方程式:I-+Ag+AgI↓Cl2+2I-I2+2Cl-15.S2-的检验采用试剂:PbNO32或PbAc2操作步骤和反应现象:用玻璃棒蘸取被测液于PbNO32或PbAc2试纸上,试纸变为黑色有关的离子方程式:Pb2++S2-PbS↓16.SO42-的检验采用试剂:BaCl2、HNO3溶液操作步骤和反应现象:向被测溶液滴加BaCl2或BaNO32溶液,出现白色沉淀,再滴加稀HNO3沉淀不溶有关的离子方程式:Ba2++SO42-BaSO4↓17.SO32-的检验采用试剂:稀HNO3、BaCl2、HCl溶液操作步骤和反应现象:取含SO32-的溶液,滴加HCl溶液少量出现能使品红褪色的气体;如滴加BaCl2溶液生成白色沉淀;再加过量HCl能溶解,但用硝酸白色沉淀则不溶有关的离子方程式:SO32-+2H+SO2↑+H2OSO32-+Ba2+BaSO3↓BaSO3+2H+Ba2++H2O+SO2↑3B aSO3+2H++3NO3-=3BaSO4↓+2NO↑+H2O18.CO32-的检验采用试剂:HCl溶液、CaOH2溶液操作步骤和反应现象:取含CO32-溶液于试管中滴加HCl溶液,发生气泡,再将气泡通入CaOH2溶液中,溶液发浑浊有关的离子方程式:CO32-+2H+CO2↑+H2OCO2+Ca2++2 OH-CaCO3↓+H2O19.NO3-的检验采用试剂:Cu、浓H2SO4操作步骤和反应现象:在Cu屑和浓H2SO4混合物的试管中加入少许含NO3-物质的粉末或浓缩溶液,在加热条件下出现棕色气体有关的离子方程式:2NO3-+4H++CuCu2++2NO2↑+ 2H2O20.PO43-的检验采用试剂:AgNO3、稀HNO3操作步骤和反应现象:向含有PO43-溶液的试管中滴加AgNO3溶液,生成黄色沉淀,再加HNO3后沉淀溶解有关的离子方程式:PO43-+3Ag+Ag3PO4↓Ag3PO4+3H+3Ag++H3PO4。
高中化学15种离子鉴定

高中化学几种常见离子的鉴定1、铵根(NH4+)检验用浓NaOH 溶液,现象:有刺激性气味气体产生离子反应式:NH4(++OH(-=NH3 ↑+H2O2、钾离子(K+)试剂:使其盐溶液在无色火焰中灼烧,现象:透过蓝色的钴玻璃看见火焰是紫色,方程式:无(焰色反应是物理变化)3、钠离子(Na+)方法同上,火焰呈黄色4、亚铁离子(Fe2+试剂:氢氧化钠溶液,现象:产生白色沉淀,之后变为灰绿色,最后变成红褐色。
方程:Fe(2++2OH(-==Fe(OH2↓4Fe(OH2 + O2 +H2O==4Fe(OH3↓5、铁离子(Fe3+)试剂:氢氧化钠溶液,现象:红褐色沉淀生成,方程:Fe(3++3OH(-==Fe(OH3↓6、铝离子(Al3+)方法一:加氨水,现象产生白色沉淀,方程:Al(3++3NH3-H2O=Al(OH3↓+3NH4(+ 方法2:加氢氧化钠溶液,现象:产生白色沉淀,加入过量NaOH 溶液后沉淀溶解方程:Al(3++3OH(-=Al(OH3↓Al(OH3+NaOH==NaAlO2+2H2O7、铜离子(CU2+)方法一:加氨水,现象产生蓝色沉淀,方程:Cu(2++4NH3-H2O=[Cu(NH34](2++4H2O方法2:加氢氧化钠溶液,现象:产生BLUE 色沉淀,方程:CU(2++2OH(-=CU(OH2↓8、氯离子(Cl-)试剂:稀硝酸和硝酸银,现象:白色沉淀生辰,方程:Ag(++Cl(-=AgCl↓9、溴离子Br(-试剂同上,浅黄色沉淀生成,方程Br(++Cl(-=AgBr↓10、硫离子S(2-试剂硝酸铅,现象:黑色沉淀,方程:Pb(2++S(2-=PbS↓或者用稀盐酸,现象:臭鸡蛋气味气体放出,气体可以使乙酸铅、硝酸铅试纸变黑方程:2H(++S(2-=2H2S↑S(2-+Pb(2+=PbS↓11、硝酸根NO3(-试剂:浓硫酸和铜单质现象:产生红棕色气体,方程:Cu+2NO3(-+4H(+=CU(2++NO2↑+2H2O12、碳酸根CO3(2-试剂:稀盐酸,现象,声称使澄清石灰水变浑浊的气体方程:2H(++CO3(2-=H20+CO2↑C02+CA(0H2=CACO3↓+H2O13、硫酸根(SO42-试剂:稀盐酸和氯化钡,现象:白色沉淀生成,方程:Ba(2++SO4(2-=BaSO4↓此沉淀不溶于盐酸和稀硝酸14、磷酸根PO4(3-试剂:稀硝酸和硝酸银现象:黄色沉淀,方程:3Ag(++PO4(3-=Ag3PO4↓15、氟离子(F-)加入氯化钙溶液,产生白色的CaF2沉淀2F-+Ca(2+=CaF2↓。
离子的检验

一、常见阳离子的检验1、Mg2+:加入NaOH溶液,生成白色沉淀[Mg(OH)2],该沉淀不溶于过量的NaOH溶液.2、Al3+:加入NaOH溶液,生成白色絮状沉淀,该沉淀能溶于盐酸或过量的NaOH溶液,但不能溶于氨水.3、Ba2+:加入稀硫酸或可溶性硫酸盐溶液,生成白色沉淀(BaSO4),该沉淀不溶于稀硝酸.4、Ag+:①加入稀盐酸或可溶性盐酸盐,生成白色沉淀(AgCl),该沉淀不溶于稀硝酸.②加入氨水,生成白色沉淀,继续滴加氨水,沉淀溶解.5、 Fe2+:①加入少量NaOH溶液,生成白色沉淀[Fe(OH)2],迅速变成灰绿色,最终变成红褐色[Fe(OH)3].②加入KSCN溶液,无现象,然后加入适量新制的氯水,溶液变红.6、Fe3+:①加入KSCN溶液,溶液变为血红色.②加入NaOH溶液,生成红褐色沉淀.7、Cu2+:①加入NaOH溶液,生成蓝色沉淀[Cu(OH)2].②插入铁片或锌片,有红色的铜析出.8、NH4+:加入浓NaOH溶液,加热,产生刺激性气味气体(NH3),该气体能使湿润的红色石蕊试纸变蓝.9、H+:①加入锌或Na2CO3溶液,产生无色气体;②能使紫色石蕊试液、pH试纸变红.二、常见阴离子的检验1、OH-:能使无色酚酞、紫色石蕊等指示剂分别变为红色、蓝色;能使红色石蕊试纸、pH试纸变蓝.2、Cl-:加入AgNO3溶液,生成白色沉淀(AgCl).该沉淀不溶于稀硝酸,能溶于氨水.3、Br-:①加入AgNO3溶液,生成淡黄色沉淀(AgBr),该沉淀不溶于稀硝酸.②加入氯水后振荡,滴入少许四氯化碳,四氯化碳层呈橙红色.4、I-:①加入AgNO3溶液,生成黄色沉淀(AgI),该沉淀不溶于稀硝酸.②加入氯水和淀粉试液,溶液变蓝.5、 SO42-:加入BaCl2溶液,生成白色沉淀(BaSO4),该沉淀不溶于稀硝酸.6、SO32-:①加入盐酸或硫酸,产生无色、有刺激性气味的气体(SO2),该气体可使品红溶液褪色.②加入BaCl2溶液,生成白色沉淀(BaSO3),该沉淀可溶于盐酸,产生无色、有刺激性气味的气体(SO2).7、S2-:①加入盐酸,产生臭鸡蛋气味的气体,且该气体可以使湿润的Pb(NO3)2试纸变黑.②能与Pb(NO3)2溶液或CuSO4溶液生成黑色的沉淀(PbS或CuS).8、CO32-:①加入CaCl2或BaCl2溶液,生成白色沉淀(CaCO3或BaCO3),将沉淀溶于强酸,产生无色、无味的气体(CO2),该气体能使澄清的石灰水变混浊.②加入盐酸,产生无色、无味的气体,该气体能使澄清的石灰水变浑浊;向原溶液中加入CaCl2溶液,产生白色沉淀.9、HCO3-:加入盐酸,产生无色、无味的气体,该气体能使澄清的石灰水变浑浊;向原溶液中加入CaCl2溶液,无明显现象.10、NO3-:向浓溶液中加入铜片、浓硫酸加热,放出红棕色、有刺激性气味的气体(NO2).碘钟反应碘钟反应是一种化学振荡反应,其体现了化学动力学的原理。
高中化学常见离子检验

.(一)常见阳离子的检验方法NH4(浓)+浓溶液并加热,将色石蕊试纸变蓝湿润红色石蕊试纸的气体置于试管口取少量待测溶液于稀HNO、稀3生成白色沉淀,加入稀HNO不试管中,3+- Ag+↓Ag+Cl=AgCl盐酸(或再加入稀盐酸(或溶于稀HNO3)NaCl NaCl)SO①稀H42取少量待测溶液于产生白色沉淀,且可或溶性2+2+2-↓Ba+ SO淀不溶于Ba 稀=BaSO加酸硫盐溶试管中,入稀沉再加入稀HNO②液稀HNO3234 HNO3取少量待测溶液于3+- +3SCNFeKSCN=溶液KSCN Fe(SCN) 44 HSO变为血红色溶液试管中,加入3溶液取少量待测溶液于加苯酚溶液显紫色3+试管中,加苯酚Fe溶KI淀粉3+-2+滴加淀粉KI+ I溶液显蓝色 +2I2Fe=2Fe溶液2液溶加NaOH-3+产生红褐色沉淀 Fe+3OH 溶NaOH加=Fe(OH)↓3液...氯水量新制的氯水后,KSCN溶液,新制的3+-Fe+3SCN 2不显红色,于试管中加入少,加入=Fe(SCN) 3立即显红色。
氯水②开始时生成白②取少量待测溶液— 2+沉淀,色Fe(OH) +2OH =Fe(OH)↓Fe22于试管中,加入②加NaOH2+Fe迅速变成灰绿色,NaOH溶液并露置在溶液 O=4Fe(OH)4Fe(OH)十O+2H最后变成红褐色3222空气中沉淀。
Fe(OH)3③(无其它还原性物取少量待测溶液于加入酸性高锰酸2-试管中,加入酸性质如SO)3钾溶液紫色褪去高锰酸钾溶液酸性高锰酸钾3+- Al(OH)↓+3OHAl=3溶NaOH加入适量取少量待测溶液于液后生成白色沉-3+-O + 2H= AlO+OHAl(OH) 试管中,逐滴加入AlNaOH溶液223该沉淀溶于过淀,溶液至过量NaOH 溶液中量NaOHNaOH ↓=Cu+2OHCu(OH)22+NaOH溶液NaOH试管中,加入液后生成-+溶加入适量取少量待测溶液于蓝色沉 Cu 淀溶液...(二)常见阴离子的检验方法...注意:.若SO与Cl-同时检验,需注意检验顺序。
常见离子检验大全.docx
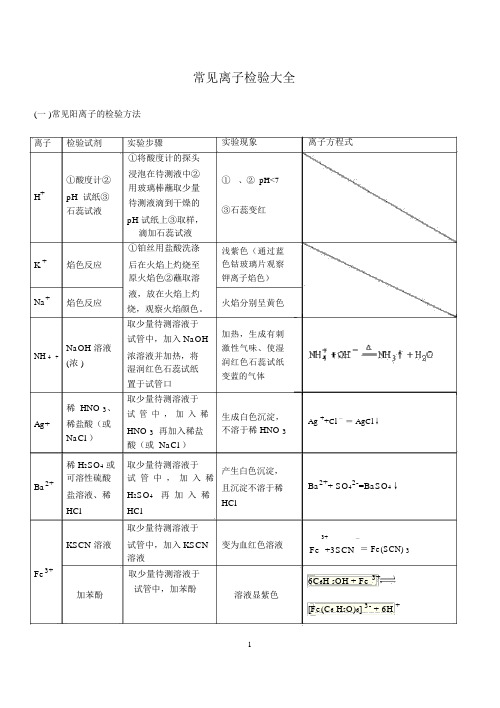
常见离子检验大全(一 )常见阳离子的检验方法离子检验试剂实验步骤①将酸度计的探头①酸度计②浸泡在待测液中②用玻璃棒蘸取少量H+pH 试纸③待测液滴到干燥的石蕊试液pH 试纸上③取样,滴加石蕊试液①铂丝用盐酸洗涤K +焰色反应后在火焰上灼烧至原火焰色②蘸取溶Na+焰色反应液,放在火焰上灼烧,观察火焰颜色。
取少量待测溶液于NaOH 溶液试管中,加入 NaOHNH 4+浓溶液并加热,将(浓 )湿润红色石蕊试纸置于试管口稀 HNO 3、取少量待测溶液于试管中,加入稀Ag+稀盐酸(或HNO 3再加入稀盐NaCl )酸(或 NaCl )实验现象①、② pH<7③石蕊变红浅紫色(通过蓝色钴玻璃片观察钾离子焰色)火焰分别呈黄色加热,生成有刺激性气味、使湿润红色石蕊试纸变蓝的气体生成白色沉淀,不溶于稀 HNO 3离子方程式Ag ++Cl -= AgCl↓稀 H2SO4或取少量待测溶液于产生白色沉淀,可溶性硫酸试管中,加入稀Ba2+且沉淀不溶于稀盐溶液、稀H2SO4再加入稀HClHCl HCl取少量待测溶液于KSCN 溶液试管中,加入 KSCN变为血红色溶液溶液Fe3+取少量待测溶液于加苯酚试管中,加苯酚溶液显紫色Ba2++ SO42-=BaSO4↓3+-Fe +3SCN= Fe(SCN) 36C6H 5OH + Fe 3+[Fe(C6 H5O)6] 3- + 6H +淀粉 KI溶滴加淀粉 KI 溶液溶液显蓝色2Fe3++2I-=2Fe2++ I 2液加 NaOH 溶加 NaOH 溶产生红褐色沉淀Fe3++3OH -= Fe(OH) 3↓液离子检验试剂实验步骤实验现象离子方程式Fe2+Al 3+2+ CuMg 2+①KSCN 溶取少量待测溶液于加入 KSCN 溶液不显红色,加入液,新制的试管中,加入 KSCN少量新制的氯水氯水溶液,新制的氯水后,立即显红色。
取少量待测溶液于开始时生成白色②NaOH 溶试管中,加入 NaOH 沉淀,迅速变成液溶液并露置在空气灰绿色,最后变中成红褐色沉淀。
高中常见离子检验方法

高中常见离子检验方法
1. 火焰试验:将待检离子溶液挂在锥形玻璃棒上,送入酒精灯火焰中,观察火焰的颜色和特点变化。
2. 沉淀法:将待检离子溶液与特定试剂混合,观察是否生成沉淀或颜色变化。
3. 电化学法:利用电化学方法,如电解或电沉积法来检验离子。
4. 复分析法:通过多种化学反应组合,将待检离子与已知离子进行比较,以确定待检离子的种类和含量。
5. 分光光度法:利用光谱仪测量溶液对特定波长的光的吸收或发射特性,来分析离子的含量和浓度。
6. 离子交换法:利用离子交换树脂对离子交换特性进行分析。
高中化学常见离子检验大全

Cu2+
NaOH溶液
取少量待测溶液于 试管中,加入
NaOH溶液
加入话量NaOH
溶液后生成蓝色 沉淀
Cu2++2OH J Cu(OH)2J
2+
NaOH溶液
取少量待测溶液于 试管中,加入
NaOH溶液
加入话量NaOH
溶液后生成白色 沉淀,该沉淀不
溶于过量NaOH
生成不溶于稀 盐酸的白色沉 淀
Ba2++ SO42-=BaSO4J
SO32-
①稀盐酸、 品红溶液
取少量待测溶液 于试管中,加入 稀盐酸后放出的 气体通入品红溶 液
加入稀盐酸后 放出的气体使 品红溶液褪色
SO32-+2H+=H2O+SO2?
②BaCl2溶
液、稀盐酸
取少量待测溶液 于试管中,加入BaCl2溶液再向沉 淀中加入稀盐 酸。
浅紫色(通过蓝 色钴玻璃片观察 钾离子焰色)
Na+
焰色反应
火焰分别呈黄色
NH4+
NaOH溶液
(浓)
取少量待测溶液于 试管中,加入NaOH浓溶液并加 热,将湿润红色石 蕊试纸置于试管口
加热,生成有刺 激性气味、使湿 润红色石蕊试纸 变蓝的气体
WH;+0H-十也0
Ag+
稀HNO3、
稀盐酸(或
NaCl)
取少量待测溶液于 试管中,加入稀HNO3再加入稀盐
溶液中
Mg2++2OH—=Mg(OH)2J
(仅用于鉴别Mg2+和Al3+)
(二)常见阴离子的检验方法
高中各离子或物质的检验方法

高中各离子或物质的检验方法一、常见阳离子的检验1、 Mg2+:加入NaOH溶液,生成白色沉淀[Mg(OH)2],该沉淀不溶于过量的NaOH溶液。
2、 Al3+:加入NaOH溶液,生成白色絮状沉淀,该沉淀能溶于盐酸或过量的NaOH溶液,但不能溶于氨水。
3、 Ba2+:加入稀硫酸或可溶性硫酸盐溶液,生成白色沉淀(BaSO4),该沉淀不溶于稀硝酸。
4、 Ag+:①加入稀盐酸或可溶性盐酸盐,生成白色沉淀(AgCl),该沉淀不溶于稀硝酸。
②加入氨水,生成白色沉淀,继续滴加氨水,沉淀溶解。
5、 Fe2+:①加入少量NaOH溶液,生成白色沉淀[Fe(OH)2],迅速变成灰绿色,最终变成红褐色[Fe(OH)3]。
②加入KSCN溶液,无现象,然后加入适量新制的氯水,溶液变红。
6、 Fe3+:①加入KSCN溶液,溶液变为血红色。
②加入NaOH溶液,生成红褐色沉淀。
7、 Cu2+:①加入NaOH溶液,生成蓝色沉淀[Cu(OH)2]。
②插入铁片或锌片,有红色的铜析出。
8、 NH4+:加入浓NaOH溶液,加热,产生刺激性气味气体(NH3)①使沾有浓HCL的玻璃棒冒白烟。
②使湿润的红色石蕊试纸变蓝。
9、 H+:①加入锌或Na2CO3溶液,产生无色气体;②能使紫色石蕊试液、pH试纸变红。
10、Ca2+:①焰色反应砖红色。
②加入Na2CO3后产生白色沉淀。
11、K+:焰色反应紫色12、Na+:焰色反应黄色二、常见阴离子的检验1、 OH-:能使无色酚酞、紫色石蕊等指示剂分别变为红色、蓝色;能使红色石蕊试纸、pH试纸变蓝。
2、 Cl-:加入稀HNO3酸化的AgNO3溶液,生成白色沉淀(AgCl)。
该沉淀不溶于稀硝酸,能溶于氨水。
3、 Br-:①加入AgNO3溶液,生成淡黄色沉淀(AgBr),该沉淀不溶于稀硝酸。
②加入氯水后振荡,滴入少许四氯化碳,四氯化碳层呈橙红色。
4、 I-:①加入AgNO3溶液,生成黄色沉淀(AgI),该沉淀不溶于稀硝酸。
高中化学常见离子检验篇

常见物质性质小结之离子检验篇下面这些,完全可以在化学推断题、实验设计题中直接使用;像亚铁离子这种有多种检验方法的,一般情况下选用第一种,有时候可用第二种,第三种等如实验条件限制,原溶液中所含离子颜色干扰等一、阳离子1.氢离子H+:取少量溶液,滴加紫色石蕊试液或甲基橙试液,溶液显红色,则可证明溶液中含有氢离子;2.钠离子Na+:焰色反应,火焰呈黄色;3.钾离子K+:焰色反应,透过蓝色钴玻璃观察,火焰呈蓝色;4.钡离子Ba2+:取少量溶液,加稀盐酸酸化,无明显现象排除Ag+,再滴加稀硫酸,析出不溶于稀硝酸的白色沉淀,则可证明溶液中含有钡离子;5.镁离子Mg2+:取少量溶液,滴加NaOH溶液,析出白色沉淀且沉淀溶于NH4Cl溶液,则可证明溶液中含有镁离子;6.铝离子Al3+:取少量溶液,逐滴滴加NaOH溶液,先析出白色絮状沉淀,然后沉淀消失,则可证明溶液中含有铝离子;7.银离子Ag+:取少量溶液,滴加稀盐酸,析出不溶于稀硝酸的白色沉淀,则可证明溶液中含有银离子;8.铵离子NH4+:取适量溶液,加入浓的NaOH溶液并加热,放出能使湿润的红色石蕊试纸变蓝的刺激性气味气体,则可证明溶液中含有铵离子;9.亚铁离子Fe2+:①取少量浅绿色溶液,滴加NaOH溶液,先生成白色沉淀,迅速变为灰绿色,最后沉淀变为红褐色,则可证明溶液中含有亚铁离子;请注意“先”“迅速”“最后”,不要更改②取少量浅绿色溶液,加入KSCN溶液,不显红色,滴加少量新制氯水,溶液立即显红色或血红色,则可证明溶液中含有亚铁离子;10.三价铁离子Fe3+:①取少量黄色溶液,滴加KSCN溶液,溶液变为血红色,则可证明溶液中含有三价铁离子;②取少量黄色溶液,滴加NaOH溶液,生成红褐色沉淀,则可证明溶液中含有三价铁离子;11.铜离子Cu2+:取少量蓝色溶液,加入NaOH溶液,生成蓝色沉淀,沉淀加热后变为黑色,则可证明溶液中含有铜离子;二、阴离子1.氢氧根OH-:①取少量溶液,滴加无色酚酞试液,溶液显红色,则可证明溶液中含有氢氧根;②取少量溶液,滴加紫色石蕊试液,溶液显蓝色,则可证明溶液中含有氢氧根;③取少量溶液,滴加橙色甲基橙试液,溶液显黄色,则可证明溶液中含有氢氧根;2.氯离子Cl-:取少量溶液,滴加AgNO3溶液,生成不溶于稀硝酸的白色沉淀,则可证明溶液中含有氯离子;3.溴离子Br-:取少量溶液,滴加AgNO3溶液,生成不溶于稀硝酸的淡黄色沉淀,则可证明溶液中含有溴离子;4.碘离子I-:①取少量溶液,通入氯气,再滴加淀粉溶液,溶液显蓝色,则可证明溶液中含有碘离子;②取少量溶液,滴加AgNO3溶液,生成不溶于稀硝酸的黄色沉淀,则可证明溶液中含有碘离子;5.硫酸根SO42-:取少量溶液,先加入稀盐酸,无明显现象排除Ag+,再加入氯化钡溶液,生成不溶于稀硝酸的白色沉淀,则可证明溶液中含有硫酸根;6.亚硫酸根SO32-:①取少量溶液,滴加氯化钡溶液,有白色沉淀生成,加入稀盐酸后会有可使品红溶液褪色的刺激性气味气体,则可证明溶液中含有亚硫酸根;②取少量溶液,加入浓硫酸不可用浓盐酸或浓硝酸,有刺激性气味气体逸出,且该气体能使品红溶液褪色,则可证明溶液中含有亚硫酸根;7.碳酸根CO32-:取少量溶液,加入稀盐酸有无色无味的气体生成,且该气体能使澄清石灰水变浑浊,则可证明溶液中含有碳酸根;。
高中化学常见离子检验大全
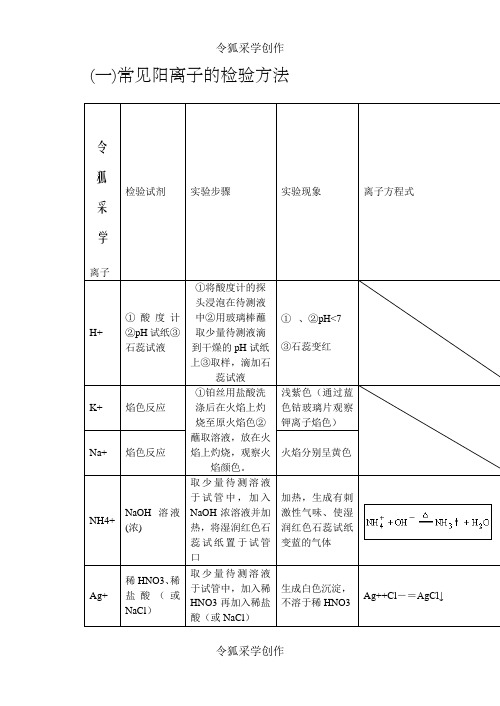
(一)常见阳离子的检验方法令狐采学离子检验试剂实验步骤实验现象离子方程式H+ ①酸度计②pH试纸③石蕊试液①将酸度计的探头浸泡在待测液中②用玻璃棒蘸取少量待测液滴到干燥的pH试纸上③取样,滴加石蕊试液①、②pH<7③石蕊变红K+ 焰色反应①铂丝用盐酸洗涤后在火焰上灼烧至原火焰色②蘸取溶液,放在火焰上灼烧,观察火焰颜色。
浅紫色(通过蓝色钴玻璃片观察钾离子焰色)Na+ 焰色反应火焰分别呈黄色NH4+ NaOH溶液(浓)取少量待测溶液于试管中,加入NaOH浓溶液并加热,将湿润红色石蕊试纸置于试管口加热,生成有刺激性气味、使湿润红色石蕊试纸变蓝的气体Ag+ 稀HNO3、稀盐酸(或NaCl)取少量待测溶液于试管中,加入稀HNO3再加入稀盐酸(或NaCl)生成白色沉淀,不溶于稀HNO3Ag++Cl-=AgCl↓Ba2+ 稀H2SO4或可溶性硫酸盐溶液、稀HCl取少量待测溶液于试管中,加入稀H2SO4再加入稀HCl产生白色沉淀,且沉淀不溶于稀HClBa2++ SO42-=BaSO4↓Fe3+ KSCN溶液取少量待测溶液于试管中,加入KSCN溶液变为血红色溶液Fe3++3SCN-=Fe(SCN)3 加苯酚取少量待测溶液于试管中,加苯酚溶液显紫色6C6H5OH+Fe3+⇌[Fe(C6H5O)6]3-+6H+ 淀粉KI溶液滴加淀粉KI溶液溶液显蓝色2Fe3++2I-=2Fe2++ I2加NaOH溶液加NaOH溶产生红褐色沉淀Fe3++3OH-=Fe(OH)3↓离子检验试剂实验步骤实验现象离子方程式Fe2+①KSCN溶液,新制的氯水取少量待测溶液于试管中,加入KSCN溶液,新制的氯水加入KSCN溶液不显红色,加入少量新制的氯水后,立即显红色。
2Fe2+ + Cl22Fe3+ + 2Cl-Fe3++3SCN-=Fe(SCN)3②NaOH溶液取少量待测溶液于试管中,加入NaOH溶液并露置在空气中开始时生成白色沉淀,迅速变成灰绿色,最后变成红褐色沉淀。
高中化学常见离子检验方法一览表

高中化学常见离子检验方法一览表(一)常见阳离子的检验方法
2(二)常见阴离子的检验方法
注意:
1.若SO
42-与Cl-同时检验,需注意检验顺序。
应先用Ba(NO
3
)
2
溶液将SO
4
2-检出,并滤去
BaSO
4,然后再用AgNO
3
检验Cl-。
2.检验SO
32-的试剂中,只能用盐酸,不能用稀硝酸。
因为稀硝酸能把SO
3
2-氧化成SO
4
2-。
3.若Ag+和Ba2+同时检验,也需注意检验顺序,应先用盐酸将Ag+检验出并滤去沉淀,然后再用稀硫酸检验Ba2+。
4.若Ag+和Ba2+同时检验,也需注意检验顺序,应先用盐酸将Ag+检验出
5.若CO
32-和HCO
3
-同时检验,应先用足量的BaCl
2
溶液将CO
3
2-检出,静置,取上层清夜用
Ba(OH)
2或Ca(OH)
2
检出HCO
3
-。
常见离子的检验方法(表格整理版)
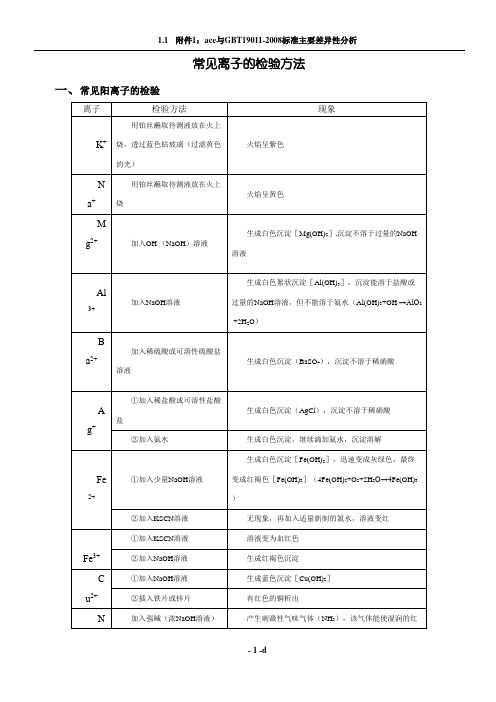
生成黑色的沉淀(PbS或CuS)
CO32-
①加入CaCl2或BaCl2溶液
生成白色沉淀(CaCO3或BaCO3),将沉淀溶于强酸,产生无色、无味的气体(CO2),该气体能使澄清的石灰水变混浊
②加入盐酸
产生无色、无味的气体,该气体能使澄清的石灰水变浑浊;向原溶液中加入CaCl2溶液,产生白色沉淀
常见离子的检验方法
一、常见阳离子的检验
离子
检验方法
现象
K+
用铂丝蘸取待测液放在火上烧,透过蓝色钴玻璃(过滤黄色的光)
火焰呈紫色
Na+
用铂丝蘸取待测液放在火上烧
火焰呈黄色
Mg2+
加入OH-(NaOH)溶液
生成白色沉淀[Mg(OH)2],沉淀不溶于过量的NaOH溶液
Al3+
加入NaOH溶液
生成白色絮状沉淀[Al(OH)3],沉淀能溶于盐酸或过量的NaOH溶液,但不能溶于氨水(Al(OH)3+OH-→AlO2-+2H2O)
生成淡黄色沉淀(AgBr),该沉淀不溶于稀硝酸
②加入氯水后振荡,滴入少许四氯化碳
四氯化碳层(下层)呈橙红色
I-
①加入AgNO3溶液
生成黄色沉淀(AgI),该沉淀不溶于稀硝酸
②加入氯水后振荡,滴入少许四氯化碳
四氯化碳层(下层)呈紫红色
③加入氯水和淀粉试液
溶液变蓝
SO42-
先加入HCl再加入BaCl2溶液(加H+防CO32-干扰;加HCl防Ag+干扰;不用HNO3防 SO32-干扰)
H+
①加入锌或Na2CO3溶液
产生无色气体
②能使紫色石蕊试液、pH试纸、甲基橙
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学常见离子检验汇总
(一)常见阳离子的检验方法 离子 检验试剂 实验步骤 实验现象 离子方程式
H+
①将酸度计的探 头浸泡在待测液 ①酸度计 中②用玻璃棒蘸 、②pH<7 ②pH 试纸 取少量待测液滴 ③石蕊试 到干燥的 pH 试纸 ③石蕊变红 液 上③取样,滴加 石蕊试液 ①铂丝用盐酸洗 浅紫色(通过蓝 焰色反应 涤后在火焰上灼 色钴玻璃片观 烧至原火焰色② 察钾离子焰色) 蘸取溶液,放在 火焰上灼烧,观 火焰分别呈黄 焰色反应 察火焰颜色。
色
K+
Na+
取少量待测溶液 于试管中,加入 加热,生成有刺 NaOH 溶液 NaOH 浓溶液并加 激性气味、使湿 NH4+ (浓) 热,将湿润红色 润红色石蕊试 石蕊试纸置于试 纸变蓝的气体 管口 取少量待测溶液 稀 HNO3、 稀 于试管中,加入 生成白色沉淀, Ag+ 盐酸(或 稀 HNO3 再加入稀 不溶于稀 HNO3 NaCl) 盐酸(或 NaCl) ①稀 H2SO4 取少量待测溶液 或可溶性 产生白色沉淀, 于试管中,加入 Ba2+ 硫酸盐溶 且沉淀不溶于 稀 H2SO4 再加入 液②稀 稀 HNO3 稀 HNO3 HNO3 取少量待测溶液 变为血红色溶 Fe3+ KSCN 溶液 于试管中,加入 液 KSCN 溶液
Ag++Cl-=AgCl↓
Ba2++ SO42-=BaSO4↓
Fe3++3SCN-=Fe(SCN)3
加苯酚
取少量待测溶液 于试管中,加苯 酚
溶液显紫色
淀粉 KI 溶 滴加淀粉 KI 溶液 溶液显蓝色 液 加 NaOH 溶 液 离子 检验试剂 加 NaOH 溶 实验步骤 产生红褐色沉 淀 实验现象
2Fe3++2I-=2Fe2++ I2
Fe3++3OH-=Fe(OH)3↓ 离子方程式
①加入 KSCN 溶 ①取少量待测溶 ①KSCN 溶 液不显红色,加 液于试管中,加 2Fe2+ + Cl22Fe3+ + 2Cl液,新制的 入少量新制的 入 KSCN 溶液,新 Fe3++3SCN-=Fe(SCN)3 氯水 氯水后,立即显 制的氯水 红色。
②开始时生成 ②取少量待测溶 白色 Fe(OH)2 沉 Fe2++2OH — =Fe(OH)2↓ ②加 NaOH 液于试管中,加 淀,迅速变成灰 4Fe(OH)2 十 溶液 入 NaOH 溶液并露 绿色,最后变成 O2+2H2O=4Fe(OH)3 Fe2+ 置在空气中 红褐色 Fe(OH)3 沉淀。
③(无其它 还原性物 取少量待测溶液 加入酸性高锰 质如 于试管中,加入 酸钾溶液紫色 SO32-)酸 酸性高锰酸钾溶 褪去 性高锰酸 液 钾 加入适量 NaOH 取少量待测溶液 溶液后生成白 于试管中,逐滴 Al3++3OH-=Al(OH)3↓ Al3+ NaOH 溶液 色沉淀,该沉淀 加入 NaOH 溶液至 Al(OH)3+OH-=AlO2-+ 2H2O 溶于过量 NaOH 过量 溶液中 取少量待测溶液 加入适量 NaOH Cu2+ NaOH 溶液 于试管中,加入 溶液后生成蓝 NaOH 溶液 色沉淀
Cu++2OH-=Cu(OH)2↓
(二)常见阴离子的检验方法
离子
检验试剂
实验步骤
实验现象
离子方程式
①将酸度计的探 头浸泡在待测液 ①酸度计② ②pH>7 中②用玻璃棒蘸 pH 试纸③酚 OH取少量待测液滴 ③酚酞变红或 酞或石蕊试 到干燥的 pH 试 石蕊变蓝 液 纸上③取样,滴 加石蕊试液 1.加入 BaCl2 取少量待测溶液 溶液后生成白 于试管中,加入 色沉淀,沉淀 ①BaCl2 溶 Ba2++ CO32-=BaCO3↓ BaCl2 溶液再向 液、稀盐酸 溶于稀盐酸, BaCO3+2H+=Ba2++CO2↑+H2O 沉淀中加入稀盐 并放出无色无 酸。
味气体 CO322.加入稀盐酸 取少量待测溶液 后放出无色无 ②稀盐酸、 于试管中,加入 CO32-+2H+=H2O+CO2↑ 味气体,通入 Ca(OH)2 溶 稀盐酸后放出的 Ca2++2OH-+CO2=CaCO3↓ 澄清的 液 气体通入使澄清 +H2O Ca(OH)2 溶液 的 Ca(OH)2 溶液 变浑浊 取少量待测溶液 BaCl2 溶液、于试管中,加入 生成不溶于稀 SO42- 稀硝酸或稀 BaCl2 溶液再向 硝酸或稀盐酸 盐酸 沉淀中加入稀盐 的白色沉淀 酸。
取少量待测溶液 于试管中,加入 加入稀盐酸后 ①稀盐酸、 品 稀盐酸后放出的 放出的气体使 红溶液 气体通入品红溶 品红溶液褪色 液 SO32加入 BaCl2 溶 取少量待测溶液 液后生成白色 于试管中,加入 沉淀,沉淀溶 ②BaCl2 溶 BaCl2 溶液再向 液、稀盐酸 于稀盐酸,并 沉淀中加入稀盐 放出刺激性气 酸。
味的气体
Ba2++ SO42-=BaSO4↓
SO32-+2H+=H2O+SO2↑
SO32-+2H+=H2O+SO2↑
离子
检验试剂
实验步骤
实验现象
离子方程式
AgNO3 溶液、 生成不溶于稀 Cl- 稀硝酸或稀 硝酸或稀盐酸 盐酸 的白色沉淀 取少量待测溶液 AgNO3 溶液、于试管中,加入 生成不溶于稀 Br- 稀硝酸或稀 AgNO3 溶液,再 硝酸或稀盐酸 盐酸 向沉淀中加入稀 的浅黄色沉淀 盐酸。
①生成不溶于 ①AgNO3 溶 稀硝酸的黄色 液、稀硝酸 沉淀 I- 取少量待测溶液 ②滴入新制 ②新制氯水, 于试管中,加入 Cl2,振荡后再 淀粉溶液 新制氯水,再加 滴入淀粉溶 入淀粉溶液 液,变蓝 取少量待测溶液 于试管中,加入 淀粉-KI 溶液 HCl、 淀粉-KI HCl 溶液,然后 变蓝 加入淀粉-KI 溶 液 取少量待测溶液 于试管中,加入 石蕊先变红后 HCl、石蕊 HCl 溶液,然后 褪色 加入石蕊试液 注意:
Ag++Cl-=AgCl↓
Ag++Br-=AgBr↓
Ag++I-=AgI↓
Ag++I-=AgI↓ 2I-+Cl2=I2+2ClI2 遇淀粉变蓝
ClO-
1. 若 SO42-与 Cl-同时检验, 需注意检验顺序。
应先用 Ba(NO3)2 溶液将 SO42检出,并滤去 BaSO4,然后再用 AgNO3 检验 Cl-。
2. 检验 SO32-的试剂中, 只能用盐酸, 不能用稀硝酸。
因为稀硝酸能把 SO32氧化成 SO42-。
3.若 Ag+和 Ba2+同时检验,也需注意检验顺序,应先用盐酸将 Ag+检验出 并滤去沉淀,然后再用稀硫酸检验 Ba2+。
4.若 Ag+和 Ba2+同时检验,也需注意检验顺序,应先用盐酸将 Ag+检验出 5.若 CO32-和 HCO3-同时检验,应先用足量的 BaCl2 溶液将 CO32-检出,静 置,取上层清夜用 Ba(OH)2 或 Ca(OH)2 检出 HCO3-
。
