物理化学第六章-化学平衡原理ppt分析解析
物理化学 第六章 相 平 衡 课件

第六章相平衡§6-1 相律1.基本概念(1)相和相数相:系统中物理性质和化学性质完全相同的均匀部分称为相,系统中相数目为相数。
相数用“P”表示。
相的确定:气体:无论有多少种物质都为一相液体:根据相互的溶解性可为一相、二相、三相固体:由固体的种类及晶型决定(固熔体除外)(2)自由度和自由度数自由度:能够维系系统原有相数,而可以独立改变的变量叫自由度,这种变量的数目叫做自由度数,用“F”表示。
说明:a)在一定范围内,任意改变F不会使相数改变。
b)自由度数和系统内的物种数和相数有关。
2.相律物种数:系统中所含独立物质的数目,用“S”表示。
依据:自由度数=总变量数-非独立变量数=总变量数-方程式数相律表达式:F = C – P + 2式中C = S –R- R’称组分数R 独立反应的方程式数R’独立限制条件3.几点说明(1) 每一相中均含有S种物质的假设,不论是否符合实际,都不影响相律的形式。
(2) 相律中的2表示整体温度、压强都相同。
(3) F = C – P + 2是通常的形式。
(4) 凝聚相系统的相律是F = C – P + 1§6.2单组分系统相图相图:表示相平衡系统的组成与温度、压力之间的图形。
单组分系统一相:P=1 则F=1-1+2=2(T,P)双变量系统二相:P=2 则F=1-2+2=1(T或P)单变量系统三相:P=3 则F=1-3+2=0 无变量系统1.水的相平衡实验数据由数据可得:(1)水与水蒸气平衡,蒸气压随温度的升高而增大;(2)冰与水蒸气平衡,蒸气压随温度的升高而增大;(3)冰与水平衡,压力增大,冰的熔点降低;(4)在0.01℃和610Pa下,冰、水和水蒸气共存,三相平衡。
2. 水的相图单相区:液态水,水蒸气,冰双相线:OA —液固共存线,冰的熔点曲线OB —气固共存线,冰的饱和蒸气压曲线OC —气液共存线,水的饱和蒸气压曲线三相点:冰、水和水蒸气共存相图的说明(1) 冰在熔化过程中体积缩小,故水的相图中熔点曲线的斜率为负,但大多数物质熔点曲线的斜率为正。
物理化学天津大学第五版第六章讲解

一、完全互溶双液系相平衡及相图——定温的 p - x 图
3)、相图分析——杠杆规则
l
恒压线
D p*B
R:系统点, pR-XR; L:液相
点
pR-xL ; G:气相点, pR-yG
气相量为nG,液相量为nL;
pR
p*A C
LR
G
nL
nG
g
(nG nL ) X R nG yG nL xL A
p
A
x
A
pB xB
p
A
(
pB
p
A
)xB
xB
101.325
p
A
p
B
p
A
,
yB
pB p
p
B
x
B
101.325
A xL XR y
B
G
l
pR
L
p*A C
Dp *
B
R G
g
(T,xB,yB)
A
XL
y
B
x (y G)
2)相图分析
(1)点: F=0, C=1,P=2
⑴ 30℃下,与水蒸气平衡共存的含水盐最多可能有 几种?
⑵ -10℃及常压下,与碳酸钠水溶液及冰平衡共存 的含水盐最多可能有几种?
解:⑴ 设S=2,则R=0、R’=0,C=S-R-R’=2 或设S=5,则R=3、R’=0,C=S-R-R’=2 F =C - P + 1= 3 - P ,∵Fmin=0,∴ Pmax=3,含水盐
确定平衡系统的状态所必须的独立强度变量的 数目称为自由度。
物理化学课件第六章节相平衡

热力学性质测定
利用热力学仪器测量物质的热容、 熵、焓等热力学性质,推算相平衡 常数。
相分离实验
观察不同条件下物质是否发生相分 离,确定相平衡状态。
计算方法
热力学模型法
利用热力学模型计算相平衡常数, 如van der Waals方程、 Redlich-Kister方程等。
表达式
ΔU = Q + W
应用
计算封闭系统中能量的变化,以及热量和功之间的转换关系。
热力学第二定律
热力学第二定律定义
自然发生的反应总是向着熵增加的方向进行,即系统总是向着更 加混乱无序的状态发展。
表达式
ΔS ≥ 0
应用
判断反应自发进行的方向,以及热量传递和转换的方向。
热力学第三定律
热力学第三定律定义
液液相平衡的应用
液液相平衡是指两种不同物质液体之 间达到平衡状态的过程。
液液相平衡在工业上有广泛应用,如 石油工业中的油水分离、化学工业中 的萃取过程等。
液液相平衡的原理
当两种液体混合达到平衡时,各组分 的浓度不再发生变化,系统达到动态 平衡状态。
05 相平衡的实验测定与计算 方法
实验测定方法
蒸气压测定
分子模拟法
利用计算机模拟分子运动,计算 分子间的相互作用力和相平衡常
数。
统计力学法
利用统计力学原理计算相平衡常 数,如Maxwell
分子动力学模拟
模拟分子在相平衡状态下的运动轨迹,分析分子 间的相互作用和排列方式。
Monte Carlo模拟
通过随机抽样方法模拟分子在相平衡状态下的分 布和排列,计算相平衡常数。
界面张力
相界面上的物质传递是相平衡的重要特征之一,界面张力的大小对于物 质在相界面上的吸附、溶解和传递等过程具有重要影响。研究界面张力 有助于深入理解相平衡的机制和规律。
物理化学化学平衡PPT课件
( pB B )equi.
( p ) B K p
( p ) B
Kp
p
B
B
B
B
B
K p
K
p
B PB
2020/12/29
当 B 0 时, K p 无单位。
Kp:与T有关 16
对于理想气体
K p
K
p
B PB
对于真实气体
K p K
K
f
B PB
ln
pB p
B
B
pB p
B
9
令 r Gm =
B
B
化学反应标准摩尔Gibbs 自由能
∴
r Gm = r Gm +
RT ln
B
pB p
B
令: Qp
B
pB p
B
压力商
rGm rGm RT ln Qp …理想气体反应的等温方程
2020/12/29
10
二、理想气体反应的标准平衡常数
B
对理想气体,pB cRT
B
Kc K p (RT ) B
5.液相反应用活度表示的平衡常数 Ka
Ka
(aB B )equi.
B
2020/12/29
19
总结 说明:
Kp
B
Kx ( p) B
K
n
p n总,equi.
B B
Kc
(RT
) B B
单位:
K p (: 压强)x
Kn (: mol)x Kc (: mol m3)x
了化学反应亲和势的概念。他定义化学亲和势A为:
def
G
A
( )T , p
物理化学PPT化学平衡

p
B (T , p, xB ) x,B (T ) RT ln ax,B
如果溶质浓度用质量摩尔浓度表示,得: mB □ B (T , p, mB ) B (T , p) RT ln m □ B (T , p, mB ) B (T , p ) RT ln am,B
(2)在理想稀溶液中,溶质服从Henry定律:
* B (T , p, xB ) B (T , p) RT ln xB
若对Henry定律发生偏差,得
* B (T , p, xB ) B (T , p) RT ln ax,B
(T , p) (T , p ) VBdp (T , p )
显然,
B (T , p, xB ) B (T , p, mB ) B (T , p, cB )
但是
x,B (T ) m,B (T ) c,B (T )
§6.3 平衡常数的表示式
一、气体反应的经验平衡常数
对于理想气体
h H e E
K f Kp
仅是温度的函数。
对于任意反应
dD eE gG hH
g h
( fG / p ) ( fH / p ) r Gm r Gm (T ) RT ln d e ( fD / p ) ( fE / p )
r Gm (T ) RT ln Q f
化学反应等温方程式
Q f 称为“逸度商”。
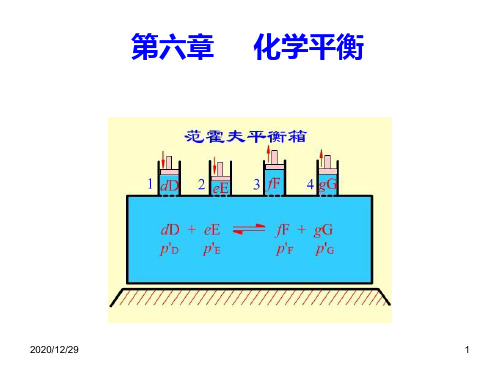
若要使反应进行到底,需在van’t Hoff 平衡箱中 进行,防止反应物之间或反应物与产物之间的任何 形式的混合,才可以使反应从R点直接到达S点。
三、化学反应的亲和势
1922年,比利时热力学专家De donder首先引进了化 学反应亲和势的概念。定义化学亲和势A为:
物理化学化学平衡

5. 实验结束后,整理 数据并进行分析。
4. 开始反应,并定时 记录反应物和生成物 的浓度变化。
数据处理与分析
数据整理
将实验过程中记录的浓度数据整理成表格,包括反应 条件、初始浓度、平衡浓度等。
数据分析
根据实验数据计算转化率和平衡常数,分析不同条件 对平衡的影响。
结果表达
将数据分析结果以图表形式表示,便于直观比较不同 条件下的变化趋势。
热力学第二定律
熵增加原理,即在一个封闭系统中,自发反应总是向着熵 增加的方向进行,也就是说,自发反应总是向着混乱度增 加的方向进行。
热力学第三定律
绝对熵的概念,即绝对熵等于0的物质不存在,也就是说 ,绝对零度也不可能达到。
动力学基础
反应速率的概念
反应速率是指化学反应在单位时间内所进行的程度,通常用反应 物浓度的变化量来表示。
平衡常数的计算方法
通过实验测定反应物和生成物的浓度,代入平衡常数表达式进行计 算。
平衡常数的意义
平衡常数是化学反应的重要参数,可以用于判断反应进行的方向和 程度,以及预测反应在不同条件下的行为。
02
化学平衡的移动
浓度对化学平衡的影响
总结词
当反应物或生成物的浓度发生变化时,化学平衡会发生移 动。
详细描述
实验原理
基于化学平衡的基本原理,通过改变反应条件(如温度、压 力、浓度等),观察反应物和生成物的浓度变化,从而确定 平衡常数。
实验设计与操作
实验步骤 1. 准备实验器材和试剂,包括反应容器、温度计、压力计、浓度计等。
2. 按照实验要求配制反应物溶液,并放入反应容器中。
实验设计与操作
3. 设定实验条件(如 温度、压力),并记 录初始浓度。
物理化学-第六章__相平衡

第六章相平衡一.基本要求1.掌握相平衡的一些基本概念,会熟练运用相律来判断系统的组分数、相数和自由度数。
2.能看懂单组分系统的相图,理解相图中的点、线和面的含义及自由度,知道相图中两相平衡线的斜率是如何用Clapeyron方程和Clausius-Clapeyron方程确定的,了解三相点与凝固点的区别。
3.能看懂二组分液态混合物的相图,会在两相区使用杠杆规则,了解蒸馏与精馏的原理,知道最低和最高恒沸混合物产生的原因。
4.了解部分互溶双液系和完全不互溶双液系相图的特点,掌握水蒸汽蒸馏的原理。
5.掌握如何用热分析法绘制相图,会分析低共熔相图上的相区、平衡线和特殊点所包含的相数、相的状态和自由度,会从相图上的任意点绘制冷却时的步冷曲线。
了解二组分低共熔相图和水盐相图在湿法冶金、分离和提纯等方面的应用。
6.了解生成稳定化合物、不稳定化合物和形成固溶体相图的特点,知道如何利用相图来提纯物质。
二.把握学习要点的建议相律是本章的重要内容之一,不一定要详细了解相律的推导,而必须理解相律中各个物理量的意义以及如何求算组分数,并能熟练地运用相律。
水的相图是最简单也是最基本的相图,要把图中的点、线、面的含义搞清楚,知道确定两相平衡线的斜率,学会进行自由度的分析,了解三相点与凝固点的区别,为以后看懂相图和分析相图打好基础。
超临界流体目前是分离和反应领域中的一个研究热点,了解一些二氧化碳超临界流体在萃取方面的应用例子,可以扩展自己的知识面,提高学习兴趣。
二组分理想液态混合物的相图是二组分系统中最基本的相图,要根据纵坐标是压力还是温度来确定气相区和液相区的位置,理解气相和液相组成为什么会随着压力或温度的改变而改变,了解各区的条件自由度(在二组分相图上都是条件自由度),为以后看懂复杂的二组分相图打下基础。
最高(或最低)恒沸混合物不是化合物,是混合物,这混合物与化合物的最根本的区别在于,恒沸混合物含有两种化合物的分子,恒沸点的温度会随着外压的改变而改变,而且两种分子在气相和液相中的比例也会随之而改变,即恒沸混合物的组成也会随着外压的改变而改变,这与化合物有本质的区别。
天津大学版物理化学课件六章相平衡

又如:任意组成的二组分盐水溶液与水蒸气的两相平衡系统, 又如:任意组成的二组分盐水溶液与水蒸气的两相平衡系统, 可以改变的变量有三个:温度、压力和盐水溶液的组成。 可以改变的变量有三个:温度、压力和盐水溶液的组成。但 因水蒸气压是温度和溶液的组成的函数,或者说沸腾温度是 因水蒸气压是温度和溶液的组成的函数, 压力和溶液的组成的函数。显然,要保持两相平衡, 压力和溶液的组成的函数。显然,要保持两相平衡,这三个 变量之中只有两个可以独立改变,故这个系统的自由度数为2 变量之中只有两个可以独立改变,故这个系统的自由度数为2 F=2)。 (F=2)。
要表示每一相的组成需要(S-1)个浓度变量,系统共有P个 相,共需有P(S-1)浓度变量。根据相平衡条件:所有各相 的温度相等,压力相等,于是确定系统状态的总变量数=[P (S-1)+2]。
• 设一相平衡系统: Ⅰ:1,2,3,…,S Ⅱ:1,2,3,…,S …………… 共有P(S-1)浓度变量 P: 1,2,3,…,S 各相温度压力相等,则有 总变量数=[P(S-1)+2]
3.自由度数 自由度数F 自由度数 • 相平衡系统发生变化时,系统的温度、压力及 每个相的组成均可发生变化。我们把能够维持 把能够维持 原有相数而可独立改变的变量(可以是温度、 原有相数而可独立改变的变量(可以是温度、 压力和某一相组成的某些物质的相对含量) 压力和某一相组成的某些物质的相对含量)叫 做自由度,这种变量的数目叫自由度数, 做自由度,这种变量的数目叫自由度数,用F表 示。 • 例如:纯水的气液两相平衡时,温度、压力可 以改变,但是其中只有一个变量(如T)可以独 立改变,另一个变量(p)是不能独立改变的, 它是前一个变量的函数,这个函数关系就是克 拉佩龙方程。由此可见,要维持纯水的气液两 相平衡,系统只有一个独立可变的变量,我们 说这一系统的自由度数F = 1。
《化学平衡教学》课件

在制药、石油化工、冶金等领域,化学平衡的计 03 算和分析对于工艺流程的优化和改进具有重要意
义。
环境保护中的应用
01 化学平衡在环境保护中发挥着重要作用,如大气 中温室气体的平衡、水体中污染物的平衡等。
02 通过研究污染物在环境中的化学反应和迁移转化 规律,可以预测和控制环境污染,制定有效的治 理措施。
THANKS
感谢观看
化学平衡的计算方法
平衡图解法
通过作图和观察图像,利用平衡 常数和温度的关系,求出平衡常
数和温度的关系。
代数法
通过建立化学平衡的代数方程组 ,求解未知数。
微分法
利用化学反应速率和浓度的关系 ,建立微分方程,求解未知数。
04
化学平衡的应用
工业生产中的应用
化学平衡在工业生产中有着广泛的应用,如化学 01 反应器的设计和优化、催化剂的选择和制备等。
的结构和功能研究等。
05
化学平衡的实验研究
实验目的与原理
实验目的
通过实验探究化学平衡的原理,加深对化学平衡概念的 理解。
实验原理
化学平衡是指在一定条件下,可逆反应的正逆反应速率 相等,反应物和生成物浓度不再发生变化的状态。实验 将通过具体反应来展示化学平衡的形成和特点。
实验步骤与操作
实验步骤 1. 准备实验器材和试剂,包括反应容器、温度计、搅拌器、可逆反应的试剂等。
《化学平衡教学》 ppt课件
目录
• 化学平衡的基本概念 • 化学平衡的原理 • 化学平衡的计算 • 化学平衡的应用 • 化学平衡的实验研究
01
化学平衡的基本概念
平衡的定义
《化学平衡状态》课件

总结词
详细描述
反应速率受温度、浓度、压力和催化剂等 因素影响。
温度越高,反应速率越快;浓度越高,反 应速率越快;压力越大,反应速率越快; 适当使用催化剂可以加快反应速率。
化学反应的方向
总结词
反应方向决定了化学平衡的移 动方向。
详细描述
根据勒夏特列原理,如果改变 影响平衡的条件,平衡就会向 着减弱这种改变的方向移动。
在制药工业中,化学平衡状态对于药物的合成和分离过程至关重要,通过调节平衡 条件可以获得高纯度的药物。
环境保护中的应用
化学平衡状态在环境保护中也有着重 要的应用,例如在大气污染控制中, 通过化学反应原理来降低大气中的污 染物浓度。
在土壤污染修复中,通过调节土壤中 的化学平衡来降低重金属等有害物质 的活性,从而减少对生态环境的危害 。
用率。
促进环境保护
通过研究化学平衡状态,可以减少 有害物质的排放,促进环境保护。
推动科学研究
化学平衡状态是化学反应动力学和 热力学研究的重要内容,有助于深 入了解化学反应的本质和规律。
02
化学平衡状态的建立
化学反应的速率
总结词
详细描述
反应速率是化学平衡状态建立的关键因素 。
化学反应速率决定了反应进行的快慢,对 于可逆反应,正逆反应速率相等是平衡状 态的特征之一。
《化学平衡状态》ppt课件
目录
• 化学平衡状态的定义 • 化学平衡状态的建立 • 化学平衡状态的移动 • 化学平衡状态的应用 • 化学平衡状态的实验验证
01
化学平衡状态的定义
什么是化学平衡状态
01
化学平衡状态是指在一定条件下 ,可逆反应进行到正、逆反应速 率相等且不再改变的状态。
02
物理化学06相平衡

克拉佩龙方程应用于液-气(或固-气)平衡
以液-气平衡为例 * * * vap H m vap H m p vap H m dp * * * dT T {Vm (g) Vm (l)} TVm (g) RT 2
dln p dT
* vap H m
RT 2
此式称为Clausius- Clapeyron方程, 简称克-克方程.
21
3. 水的相图 由水的相平衡数据绘成 p - T 相图如下:
平衡压力的影响.
克拉佩龙方程应用于凝聚相之间的平衡(固-液, 固-固)
* * 对于熔化过程, Vm 0 (少数物质除外), H m 0
* dT TVm dT 由 可知, 0, 即熔点随外压增大而升高. * dp H m dp
但由于Vm=Vm(l) Vm(s) 0, 故熔点受外压的影响是很小的. 15
sub H m
8.314 273.2 293.2 12.30 103 ln 293.2 273.2 3.27 103 44.12kJ mol 1 〃
J mol 1 〃
(3)
subHm = fusHm + vapHm fusHm = subHm- vapHm = (4412-3417)kJ· 1 mol = 995 kJ· 1 mol
• R 个 独立的限制条件 如某二种物质成恒定的比例关系. 故关联变量的方程式数为 S(P-1)+ R +R .
独立变量数目, 即自由度数为
F = {P(S-1)+2}-{S(P-1)+R+R }=(S-R-R )-P+2 令 C = S-R-R , 则 F = C-P+2 吉布斯相律:只受温度和压力影响的平衡系统的自由度数, 等于系统的独立组分数减去相数加 2.
物理化学 第六章 相平衡

S = 6, R =2, R′= 2 C = S – R - R’ = 6 –2 -2 = 2 若 NaCl 溶解完,则只存在一个化学平衡 H2O = H+ + OH S = 5, R =1, R′= 2
C =S –R -R’ = 5 –1 -2 = 2
一、理想液态混合物的气—液平衡相图
1)蒸气压-组成图 因是理想液态混合物,任一组分都服从拉乌尔定律,即
p = pA*xA + pB*xB p = pA* ( 1- xB ) + pB*xB =pA* + ( pB* - pA* ) xB
即系统总压与液相组成xB 成线性关系,在p - x图中是一直线, 这是理想双液系相图的一个特点。
解:
(1) C = S - R - R´= 3 - 1 - 1=1
F=C-P +2= 1-2+2=1 (2) C = S - R - R´= 3 - 1 - 0 =2
F =C-P+2= 2-2+2=2
例2 (1) 仅由CaCO3(s)部分分解,建立如下反应平衡: CaCO3 (s) = CaO(s) + CO2(g) (2) 由任意量的 CaCO3 (s), CaO (s), CO2 (g)建立如下反应平衡:
2 相律(Phase rule)的推导
①系统中的变量总数 设系统中有 S 个物种,分布在 P 个相中,在温度T、压力p下 达到平衡。 在α 相中的变量为:T,p,xα 1,xα 2,…, xα S-1 在β 相中的变量为:T,p,xβ 1,xβ 2,…, xβ S-1 ………… 在P 相中的变量为:T,p,xP1,xP2,…, xPS-1
考研《物理化学》考点精讲教程(第06讲 相平衡)

(3)对于大气压力下凝聚系统,压力影响很小,相律的
形式为:
F =C -P +1
《物理化学》考点精讲教程
例:CH4 与 H2O(g)反应,部分转化为CO 、CO2 和 H2 达成 平衡。
① 2CH4 + 3H2O = CO + CO2 + 7 H2 ② CH4 + 2H2O = CO2 + 4 H2
《物理化学》考点精讲教程
6.1 相律
一、基本概念:相和相数、物种数 S、自由度和 自由度数
二、相律
《物理化学》考点精讲教程
相律是关于系统相平衡的规律。 一、基本概念 1. 相和相数 相—系统中物理性质和化学性质完全相同的均匀部分。
相数—系统内相的数目,用P表示。相与相之间有明显
的相界面。 §多种气体混合,一个相; §两种液体可以形成一相或两相; §一种固体一个相,固溶体除外。二组分饱和溶液,2相;
面:F = 2 三个单相区 l、g、s
OA:冰的熔点曲线
斜率
dp dT
sl Hm T slVm
0
OB:冰的饱和蒸气压曲线
斜率
dp dT
g s
H
m
T sgVm
0
OC:水的饱和蒸气压曲线(蒸发)
斜率
dp dT
vap Hm T glVm
0
OC′:过冷水饱和蒸气压曲线
《物理化学》考点精讲教程
点: F = 0 O: 三相点
《物理化学》考点精讲教程
2. 物种数 S 系统中可以独立分离出来的化学物质的种数。
§ 一种物质可有多种相,如冰水混合系统:S = 1,P = 2
第六章 物理化学 相平衡

若再加上人为限制条件,N2 与 H2 物质的量的比为 1 : 3 , 则有,R =1,R´ =1,所以 C = 3 – 1 – 1 = 1。
10
4.说明:
1. S 种物质可以不存在于每一相中, 而不影响相律的形式。
解: S = 5,R = 2 p(NH3) = p(HCl) + 2p(H2); p(H2) = p(Cl2)
因为它们在同一相,浓度又成比例。 R´ =2 , C= S – R – R´ = 5 – 2 – 2 = 1, P = 2, F=C–P+2=1–2+2=1
14
§6.2 单组分系统相图
11
例1:今有密闭抽空容器中有过量固体 NH4Cl,有下列分解 反应: NH4Cl(s) = NH3(g) + HCl(g),
求:此系统的 R、R´ 、C、P、F 各为多少?
解:S=3,R=1,R´ =1 (因为从 NH4Cl 出发,生成的两种产物处于同一相,而且符 合比例 1:1) C = S – R – R´ = 3 – 1 – 1 = 1,
一、单组分系统的相律
F=C–P+2
C=1 F = 3–P
当 P =1
单相
F =2
(冰),(水),(水蒸气 )
P =2
两相平衡 F =1
冰水,冰水蒸气,水水蒸气
P =3
三相共存 F=0
冰,水,水蒸气三相平衡
双变量系统 T,p可变
单变量系统 T,p一个可变 无变量系统
T,p不可变
单组分系统的自由度最多为2,双变量系统的相图可用平面 图表示。
物理化学第六章相平衡

OB 是气-固两相平衡线,即 冰的升华曲线,理论上可延长 至0 K附近。
OC 是液-固两相平衡线,当C点延长至压力大于 2108 Pa时,相图变得复杂,有不同结构的冰生成。
6.2.1 水的相图
冰点温度比三相点温度低 0.01 K 是由两种因素造成的:
(1)因外压增加,使凝固点下降 0.00748K;
(2)因水中溶有空气,使凝固点下降 0.00241K。
6.2.1 水的相图
利用相图分析两相平衡线上的相变过程
两相平衡线上的相变过程
在两相平衡线上的任何 一点都可能有三种情况。如 OA线上的P点:
投料比:N2∶H2=1∶3 R’=1 f**=(3-1-1)- 1 + 0 =0
§ 6.2 单组分体系的相图
相点 表示某个相状态(如相态、组成、温度 等)的点称为相点。
物系点 相图中表示体系总状态的点称为物系点。 在T-x图上,物系点可以沿着与温度坐标平行的垂线 上、下移动;在水盐体系图上,随着含水量的变化, 物系点可沿着与组成坐标平行的直线左右移动。
第六章 相平衡
引言 6.1 Gibbs相律 6.2 单组分系统相图 6.3 双组分系统相图及应用
§ 6.1.1 基本概念
相(phase) 体系内部物理和化学性质完全均
匀的部分称为相。相与相之间在指定条件下有明 显的界面,在界面上宏观性质的改变是飞跃式的。 体系中相的总数称为相数,用 P表示。
气体,不论有多少种气体混合,只有一个气相。
在单相区,物系点与相点重合;在两相区中, 只有物系点,它对应的两个相的组成由对应的相点 表示。
物理化学第六章 相平衡

xM nL nG nG xG nL xL
整理可得:
nL-液相量
nL xM xL nG xG xM
即:
nL L2 M nG MG2
(3)
保持组成不变,得 T-p 图
不常用。
二组分系统相图:气—液平衡相图 液态完全互溶系统 p-x、t-x图 理想系统 真实系统
一般正偏差 最大正偏差 一般负偏差 最大负偏差
液态部分互溶系统 t-x图
气相组成介于两液相之间
气相组成位于两液相同侧
液态完全不互溶系统 t-x图
1. 理想液态混合物系统压力—组成图
第六章 相 平 衡
453
单相
TB
B
等压
等温
p
pB
T/K
373
A'
An
A"
T1
pA
两相
C 313 D 0.2 0.4 0.6 0 H2 O 质量分数
1.0 A 0.8 C6 H5 NH2
E
xB
B
相平衡是热力学在化学领域中的重要应用之一。 研究多相系统的平衡在化学、化工的科研和生产中有 重要的意义,例如:溶解、蒸馏、重结晶、萃取、提纯及 金相分析等方面都要用到相平衡的知识。 相平衡研究内容: 表达相平衡系统的状态如何随其组成、温度、压力 等而变化; 两种方法: 数学公式——如克拉佩龙方程、拉乌尔定律等等。 相图——直观。 本章主要介绍相律和一些基本的相图,以及如何由实验数 据绘制相图、如何应用相图等等。
例:
在一个密闭抽空的容器中有过量的NH4I(s),同时存
NH 4 I(s) NH3 (g) HI(g)
在下列平衡:
物理化学-第六章,相平衡-164

pC
A
临界点
647.30K
水
22.09MPa
ed c b a 冰
D O三相点 气
273.16K
B
610.62Pa
水的相图 T
OA、OB、OC三条线即两相平 衡线,可用克拉佩龙方程描述。
O:三相点 triple point(水在它 自身蒸气压力下的凝固点)。 通常所说的水的凝固点或冰点 (273.15 K)则是在101.325 kPa 下被空气所饱和的水的凝固点。
2020/9/7
相平衡
15
例4:某一纯理想气体的自由度为零,它必处于( )。 (A) 气液平衡共存; (B) 临界点; (C) 三相点; (D) 气相区
相律只能对系统作定性的描述,它只讨论“数目”而不 讨论“数值”:
根据相律可以确定有几个因素能对相平衡发生影响;在 一定条件下系统有几个相;等等。
但相律不能告诉我们这些数目具体代表哪些变量或哪些 相,也不知道各相的量之间的关系
2020/9/7
相平衡
29
第四节 理想的完全互溶双液系的相图
二组分系统: F = C – P + 2 = 4 – P
F最少为0,P最多为4; P最少为1,F最多为3——其相 图要用 p-T-x 三维立体图表示。
二组分系统相图的类型很多。
2020/9/7
相平衡
5
物种数 S:系统中所含化学物质的种数。 独立组分数 C:确定相平衡系统中所有各相组成所需的 最少物种数。
如:由 HI、H2、I2 三种气体组成的单相系统,S = 3。
① 如果各物质间没有任何化学反应,则组分数也是 3,即需要三 种物质才能确定气相的组成;
② 如果存在反应 2HI == H2 + I2,则组分数为 2,只需两种即可; ③ 如果还存在浓度限制如[H2]:[I2]=1:1,则组分数为1,只需一种
物理化学完整ppt课件

数称为(独立)组分数。 S:物种数
CSRR'
R:独立的化学平衡数 R′独立限制条件数
说明:★独立限制条件数只有在同一相中才能起作用
CaCO3(s)=CaO(s)+CO2(g) R′= 0 ★独立的化学平衡数:指物质间构成的化学平衡是相互独立的
C+H2O=CO+H2 C+CO2=2CO CO+H2O=CO2+H2 R=2 S=5 C=5-2=3
(1)因外压增加,使凝固点下降 0.00748K (2)因水中溶有空气,使凝固点下降 0.00241K
可编辑课件
16
例:如图为CO2的相图,试问: (1)将CO2在25℃液化,最小需加多大压力? (2)打开CO2灭火机阀门时,为什么会出现少量白色固体(俗称于冰)?
解:(1)根据相图,当温度为25℃ 液一气平衡时,压力应为67大气压, 在25℃时最小需要67大气压才能使 CO2液化。
2、水的相图
可编辑课件
13
◎组分数
S:物种数
CSRR'
R:独立的化学平衡数 R′独立限制条件数
总结1
说明:★独立限制条件数只有在同一相中才能起作用 ★独立的化学平衡数:指物质间构成的化学平衡是相互独立的
◎相律
◎单组分系统相图 F=C-P十2=3-P
单组分系统最多三相共存 单组分系统是双变量系统
可编辑课件
可编辑课件
7
杠杆规则还可以表示为:
(1)
m() 1 wB() wB 1
m( )
wB wB ()
m() m() wB() wB wB wB()
m( )
wB wB ()
m() wB wB() m wB() wB()
