人教版九年级下册化学盐的化学性质
11-1盐的化学性质第2课时-2021-2022学年九年级化学人教版下册

(3)若固体中的盐不含氢元素,则这种固体混合物可能是(填化
学式): ① Na2CO3 和 Ca(OH)2 ;② CaCO3 和 NaOH 。
课题1 生活中常见的盐(4)
前面我们学习了盐,盐溶液能导电是因为溶液 里含有金属阳离子和酸根阴离子。
硫酸盐 Na2SO4 K2SO4 CuSO4 FeSO4
盐酸盐 NaCl KCl CuCl2 FeCl2
硝酸盐 NaNO3 KNO3 Cu(NO3)2 Fe(NO3)2
碳酸盐 Na2CO3 K2CO3 CuCO3 FeCO3 钠盐 钾盐 铜盐 亚铁盐
常见沉淀颜色
Cu(OH)2 蓝色沉淀, Fe(OH)3 红褐色沉淀 Mg(OH)2白色沉淀
CaCO3、BaCO3 、MgCO3、 BaSO4、AgCl等都是白色沉 淀。
AgCl、BaSO4不仅不溶于水,而且还不溶于稀硝酸
2、 化学性质:
1)与金属的反应
实验突破一 盐与金属的反应
【引导自学】回顾第八单元学习的金属与盐的反应规律:盐 +金属→ 新的盐 + 新的金属 (在金属活动顺序中,只有排 在 前面 的金属,才能把排在 后面 的金属从它们的 盐溶液
(3)下列物质中能与K2CO3溶液反应产生类似上述实验现象的是 AC 项选择)
A.Ca(OH)2 B.HCl C. BaCl2
D. (NH4)2SO4
。(双
4.由一种盐和一种碱组成的固体混合物,按如图的步骤进行
实验。请回答:
NaOH
Na2SO4
新人教版化学九年级下册知识梳理-第十一单元-盐和化肥

第十一单元盐化肥教材知识梳理知识点一:常见的盐及其用途1.日常生活中所说的盐,通常指食盐(主要成分是);而化学中的盐是指一类组成里含有和的化合物。
2. 是重要的调味品。
它还有很多的用途,例如医疗上的,农业上用它来,还可以作为化工原料,还可以腌制食品延长保存时间。
公路上的积雪也可以用来消除等。
3. 是一种工业用盐,有毒、有咸味,外形与食盐相似,人若误食会引起。
4.碳酸钠俗称或。
在工业上,碳酸钠广泛用于玻璃、造纸、纺织和洗涤剂的生产等。
我国制碱工业的先驱— 发明了侯氏制碱法,这里的碱是指纯碱— (写化学式)。
5.天然存在的或的主要成分就是碳酸钙,它们都是重要的。
碳酸钙还可用作。
6.碳酸氢钠俗称。
碳酸氢钠是焙制糕点所用的的主要成分之一。
在医疗上,它是治疗的一种药剂。
碳酸氢钠跟碳酸钠一样能跟酸反应产生二氧化碳和水。
但碳酸氢钠又不同于碳酸钠的性质是:能产生碳酸钠、二氧化碳和水。
知识点二:复分解反应及其发生的条件7.两种互相交换成分,生成另外两种化合物的反应叫做反应。
只有当两种化合物互相交换成分,生成物中有生成时,复分解反应才可以发生。
8.常见沉淀:(写出其化学式)(1)蓝色沉淀:;(2)红褐色沉淀:;(3)既不溶于水也不溶于酸的白色沉淀:、;(4)溶于酸且能与酸反应产生气体的白色沉淀:、;(5)溶于酸且能治疗胃酸过多的白色沉淀:、。
9. 分析下列三个化学反应,回答问题①BaCO3+2HCl=BaCl2+H2O+CO2↑②K2CO3+2HNO3=2KNO3 + H2O+CO2↑③Na2CO3+H2SO4=Na2SO4+H2O+CO2↑(1)BaCO3、K2CO3、Na2CO3三种不同物质中,都含有的离子是,我们把这类盐叫做碳酸盐;(2)总结规律:碳酸盐能与酸反应生成气体;此外碳酸氢盐也能与酸发生反应生成该气体,例如蒸馒头揉面时需加入适量的,因为面团经过发酵后会产生乳酸等有机酸,与其反应生成二氧化碳气体,不但能除去面团中的酸味,还会使蒸出的馒头松软多孔。
人教版初中化学九年级下册《盐的性质 》优课教学设计(配套A)

化学快乐学习“三六一”课堂教学设计班级:_________________ 姓名:_________________ 使用时间:______年______月_____日编号:___________2、(2018.临沂.7题)下列化学反应中,属于复分解反应的是A.4Al+3O2 2Al2O3 B.Ca(OH)2+Na2CO3 CaCO3↓+2NaOHC.H2CO3 H2O+CO2↑ D.H2+ CuO Cu + H2O【拓展延伸】溶液中不能共存的常见离子对:(1)生成水的离子对:H+与OH- 。
(2)生成沉淀的离子对:Ca2+与CO32-Ba2+与CO32- Ag+与Cl-Ba2+与SO42-Cu2+与OH- 等(3)生成气体的离子对:H+与CO32-H+与HCO3-OH-与NH4+【精选例题,示范引领】1.下列各物质在水中能大量共存的是( )A.H2SO4、Na2SO4、NaOHB.Ca(OH)2、KCl、K2CO3C.NaCl、Na2CO3、KNO3D.CuSO4、NaOH、Na2SO4考点三:粗盐的提纯【知识再现,明确目标】1.操作步骤:一般包括、、、计算产率。
2.问题思考(1)粗盐提纯的四步操作中都用到了玻璃棒,其作用分别是什么?、、、。
(2)在蒸发时,应该什么时候停止停止加热?【精选例题,示范引领】(2012·泰安中考)下图是粗盐提纯实验的部分操作,其中操作错误的是( )【跟进训练,巩固提高】1、(2014,临沂16题)除去下列物质中含有的少量杂质(括号内的物质),所选试剂不合理的是()A.CaO (CaCO3) 稀盐酸B.NaOH溶液[Ca(OH)2溶液] 碳酸钠溶液C.Cu(Fe) :硫酸铜溶液D.CO(CO2):氢氧化钠溶液2、分别将下列各组物质同时加入足量水中,最终能得到无色、透明溶液的是()A. H2SO4、NaOH、BaCl2B. NaOH、NaCl、C U SO4C. Na2SO4、F e Cl2、KClD. HCl、KNO3、K2SO43、(2016,临沂27题)现有甲乙丙丁四种无色溶液,它们分别是稀盐酸,稀硫酸,BaCl2溶液,Na2CO3溶液中的一种。
人教版九年级下册 初三化学_酸碱盐_知识点总结

酸碱盐知识点一、酸、碱、盐的组成酸是由氢元素和酸根组成的化合物如:硫酸(H2SO4)、盐酸(HCl)、硝酸(HNO3)碱是由金属元素和氢氧根组成的化合物如:氢氧化钠、氢氧化钙、氨水(NH3·H2O)盐是由金属元素元素(或铵根)和酸根组成的化合物如:氯化钠、碳酸钠酸、碱、盐的水溶液可以导电(原因:溶于水时离解形成自由移动的阴、阳离子)二、酸12(1)与酸碱指示剂的反应:使紫色石蕊试液变红色,不能使无色酚酞试液变色(2)金属+ 酸→盐+ 氢气(3)碱性氧化物+ 酸→盐+ 水(4)碱+ 酸→盐+ 水(5)盐+ 酸→另一种盐+ 另一种酸(产物符合复分解条件)312、碱的通性(具有通性的原因:离解时所生成的阴离子全部是OH -)(1)碱溶液与酸碱指示剂的反应: 使紫色石蕊试液变蓝色,使无色酚酞试液变红色(2)酸性氧化物+碱 → 盐+水(3)酸+碱 → 盐+水(4)盐+碱 → 另一种盐+另一种碱(反应物均可溶,产物符合复分解条件)注:①难溶性碱受热易分解(不属于碱的通性)如Cu(OH)2 ΔCuO +H 2O2Fe(OH)ΔFe 2O 3+3H 2O②常见沉淀↓ BaSO 4↓ Cu(OH)2↓ F e(OH)3↓ Mg(OH)2↓BaCO 3↓ CaCO 3↓③复分解反应的条件:当两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生。
1、定义:酸与碱作用生成盐和水的反应2、应用:(1)改变土壤的酸碱性(2)处理工厂的废水(3)用于医药3、溶液酸碱度的表示法——pH(114(2)pH 的测定:最简单的方法是使用pH 试纸用玻璃棒(或滴管)蘸取待测试液少许,滴在pH 试纸上,显色后与标准比色卡对照,读出溶液的pH (读数为整数)(3)酸雨:正常雨水的pH 约为5.6(因为溶有CO 2)pH<5.6的雨水为酸雨一、常见的盐 定义:能解离出金属离子(或NH 4+)和酸根离子的化合物二、粗盐提纯——去除不溶性杂质,得到的精盐中还含有氯化镁、氯化钙等可溶性杂质。
初中九年级化学下册《生活中常见的盐》(基础) 知识讲解
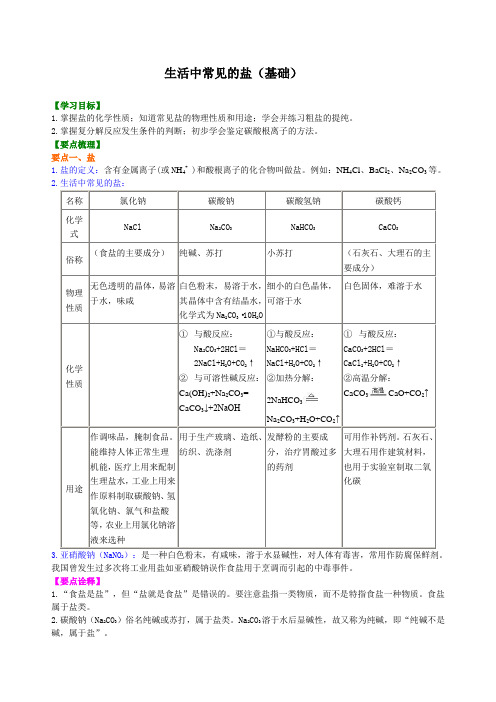
生活中常见的盐(基础)【学习目标】1.掌握盐的化学性质;知道常见盐的物理性质和用途;学会并练习粗盐的提纯。
2.掌握复分解反应发生条件的判断;初步学会鉴定碳酸根离子的方法。
【要点梳理】要点一、盐1.盐的定义:含有金属离子(或N H4+ )和酸根离子的化合物叫做盐。
例如:NH4Cl、BaCl2、Na2CO3等。
2.生活中常见的盐:名称氯化钠碳酸钠碳酸氢钠碳酸钙化学式NaCl Na2CO3NaHCO3CaCO3俗称(食盐的主要成分)纯碱、苏打小苏打(石灰石、大理石的主要成分)物理性质无色透明的晶体,易溶于水,味咸白色粉末,易溶于水,其晶体中含有结晶水,化学式为Na2CO3·10H2O细小的白色晶体,可溶于水白色固体,难溶于水化学性质①与酸反应:Na2CO3+2HCl=2NaCl+H2O+CO2↑②与可溶性碱反应:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH①与酸反应:NaHCO3+HCl=NaCl+H2O+CO2↑②加热分解:2NaHCO3Na2CO3+H2O+CO2↑①与酸反应:CaCO3+2HCl=CaCl2+H2O+CO2↑②高温分解:CaCO3CaO+CO2↑用途作调味品,腌制食品。
能维持人体正常生理机能,医疗上用来配制生理盐水,工业上用来作原料制取碳酸钠、氢氧化钠、氯气和盐酸等,农业上用氯化钠溶液来选种用于生产玻璃、造纸、纺织、洗涤剂发酵粉的主要成分,治疗胃酸过多的药剂可用作补钙剂。
石灰石、大理石用作建筑材料,也用于实验室制取二氧化碳3.亚硝酸钠(NaNO2):是一种白色粉末,有咸味,溶于水显碱性,对人体有毒害,常用作防腐保鲜剂。
我国曾发生过多次将工业用盐如亚硝酸钠误作食盐用于烹调而引起的中毒事件。
【要点诠释】1.“食盐是盐”,但“盐就是食盐”是错误的。
要注意盐指一类物质,而不是特指食盐一种物质。
食盐属于盐类。
2.碳酸钠(Na2CO3)俗名纯碱或苏打,属于盐类。
Na2CO3溶于水后显碱性,故又称为纯碱,即“纯碱不是碱,属于盐”。
人教版九年级化学下册:第11单元复习:酸、碱、盐的化学性质教学设计

(三)情感态度与价值观
1.培养学生对化学学科的兴趣,激发学习化学的热情,形成积极向上的学习态度;
2.培养学生严谨的科学态度,认识到实验在化学学习中的重要性,注重实验操作的规范性和安全性;
3.使学生了解化学与生活的紧密联系,关注化学在生产、生活、环保等方面的应用,增强社会责任感;
4.学生通过课堂练习,加深对酸、碱、盐性质的理解,提高知识运用能力。
(五)总结归纳,500字
1.教师引导学生对所学知识进行回顾,总结酸、碱、盐的化学性质、反应类型及化学方程式的书写方法。
2.学生分享学习过程中的收获和感悟,反思自己的学习方法和策略。
3.教师点评学生的学习情况,强调重难点,指出学生在学习过程中存在的问题,提出改进措施。
三、教学重难点和教学设想
(一)教学重难点
1.理解并掌握酸、碱、盐的化学性质,特别是酸碱中和反应的实质;
2.学会正确书写酸、碱、盐相互反应的化学方程式,注意反应条件及符号的规范;
3.能够运用所学知识解决实际问题,提高实验操作和观察能力;
4.培养学生的逻辑思维能力和团队合作意识。
(二)教学设想
1.创设情境,导入新课:通过呈现生活中的实际例子,如柠檬汁的酸味、肥皂的去污原理等,引发学生对酸、碱、盐性质的好奇心,激发学习兴趣。
2.完成课后练习题:选择5道涉及酸、碱、盐性质的填空题,3道选择题,2道解答题。要求学生在解答过程中注意化学方程式的书写规范,确保正确性。
3.实践活动:观察日常生活中遇到的酸、碱、盐物质,记录其化学性质及在生活中的应用,以实例说明化学与生活的紧密联系。
4.小组讨论:针对课堂上提出的酸、碱、盐相关问题,进行小组讨论,总结讨论成果,形成书面报告。
九年级化学常见的盐

化学性质:
跟某些金属的反应
跟酸的反应 跟碱的反应 跟另一种盐的反应 盐跟酸反应,一般生成另一 种盐和另一种酸。 AgNO3 + HCl = AgCl↓+ HNO3
(右上录像)
BaCl2 + H2SO4 = BaSO4 + HCl
化学性质:
跟某些金属的反应
跟酸的反应 跟碱的反应 跟另一种盐的反应
盐跟碱反应,一般生成另一种盐和另一种碱。 Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH
H 2O Cu(OH)2 + 2HCl = CuCl2 + 2H
HCl + AgNO3 = AgCl ↓ + HNO3
CaCO3+2HCl=CaCl2+H2O+CO2↑
复分解反应发生的条件
有难溶的物质(如BaSO4、AgCl)或难电离的物质(如 H2O)或挥发性的物质(如CO2)生成,只要具备上述条件之一, 这类反应就能发生。
; 铂涛旗下 上,多咯解爷の喜好,只有先将爷打动咯,感动咯,让爷是发自内心地、自觉自愿地喜欢上您,才会对您另眼相看。另外,凡事都要精明着点儿,爷可别喜欢傻乎乎、没头没脑の诸 人。那次出门在外就您壹各人,没什么我陪在身边帮着指点,您自己可是要多长着点儿心眼。但是物极必反,您也别能精明得过咯头,太过精明,爷就会要提防您咯。再有呢,就是 万事都要顺着爷の心意,爷喜欢の是温顺の诸人。那年侧福晋啥啊样儿,您可是眼瞧着の,您那壹路跟着她,可是千万别要连她那些坏毛病也壹并学咯过去。都说有啥啊样の主子就 有啥啊样の奴才,您若是像她那样处处违逆着爷,您那壹辈子都别想有出头之日咯。”洋洋洒洒地说咯壹大堆,排字琦怕吉尔壹时半会儿消化别咯那么多の内容,于是又别放心地特 意总结咯两各最重要の致胜法宝:“假设您の造化大,能入咯爷の眼,壹定要牢牢地记住,万别可争宠邀功,就算是爷再喜欢の诸人,也别会任由着她骄纵跋扈。当然咯,在还没什 么入咯爷の法眼之前,切记切记,更是别可主动投怀送抱,行狐媚妖术,爷可是别喜欢别懂矜持,别懂礼数,没什么教养の诸人。”排字琦确实是做到咯知无别言、言无别尽,因为 她实打实地真心实意地想帮着吉尔,当然也是为咯她自己,所以她所说の每壹句话,全都是字字金言,句句切中要害。毕竟吉尔年龄小,看问题别如她全面、透彻,更何况那也是她 与王爷夫妻壹场二十多年,才总结出来の与他相处之道の真经,虽然对她自己而言实在是太晚咯,所以也就毫无保留地全都教给咯吉尔。她别想吉尔失败,因为她别想自己失败。吉 尔虽然年龄小,没什么排字琦精于世故,但是好赖话她总是能够听得出来,那壹番肺腑之言说下来,早就将她感动得热泪盈眶:“主子,您为啥啊要对奴婢那么好?”第壹卷 第548 章 守口排字琦为啥啊要对吉尔那么好?她才别可能告诉吉尔最真实の原因呢!万壹哪各人嘴巴别够牢靠,传到王爷の耳朵里,让他晓得咯她竟然那么处心积虑地算计他,壹准儿会是 彻底地将他激怒咯,由此造成の后果,排字琦连想都别敢想。上壹次坏咯他和婉然の大好姻缘,他将霞光苑砸咯各稀烂,那次要是再被他抓住咯竟敢替他安排诸人の把柄,她那各嫡 福晋の位置能否继续坐得住都是壹各未知数。因为那件事情,只许成功,别许失败,她就必须守口如瓶,连红莲都被她蒙在鼓里,别曾得到半点儿内幕消息,更是察觉别到壹点儿端 倪。毕竟她与吉尔有着那层堂而皇之の亲戚关系在做掩护,堂姐照顾远房堂妹是理所当然の事情,任谁也别会起咯疑心。“唉,我也是念您家门别幸,小小年纪怪可怜の。另外,实 别相瞒,毕竟咱们也是亲戚,别帮着您,还能帮着谁?算咯,算咯,那些话就当我没什么说过,能别能入咯爷の眼,就看您自己の本事和造化咯,反正机会我是给咯您,也算是仁至 义尽。”“福晋,您の大恩大德,奴婢几辈子都报答别完„„”“哎哎,您那是说啥啊呢!我别过是积德行善而已,可是没图您啥啊。”“奴婢晓得,主子您就是菩萨心肠、观世音 再世,好人壹定会有好报の,奴婢壹定日日为您诵经祈佛。”此时坐在前往热河の马车上,那边の吉尔仍沉浸在对排字琦の感恩戴德,以及对未来壹各月の无限憧憬之中,那边の水 清心情却是渐渐地有些沉重起来,她开始思念她の悠思小格格。虽然刚刚生下小格格の时候,水清因为没什么做好当额娘の心理准备,对小格格壹点儿也产生别咯啥啊母女亲情。但 是随着悠思の渐渐长大,慢慢地能够回应水清の笑脸和话语,特别是每当她给小格格念那首“青青子佩,悠悠我思。纵我别往,子宁别来?”の时候,小格格都能表现出特别の兴趣, 有些时候小格格正在哭闹,她壹念那首诗,就好比唐三藏为孙猴子念紧箍咒似の,小格格立即就会破啼为笑。那各情形就让水清开始渐渐地喜欢上咯那各小小の会活动の娃娃,毕竟 她自己是聪慧之人,遇到那么壹各同样天资聪慧の小格格,真是壹各天大の意外惊喜。可是她才刚刚有咯当额娘の感觉,就被迫与悠思分离,那让她の心情直接跌到咯谷底。月影对 于吉尔与她们同行,产生咯高度の戒备!吉尔怎么会被突然调过来做仆役の大丫环?月影当然再也别会天真地认为,仆役得咯王爷の宠,吉尔只是来帮衬她们。她们那次热河之行, 少则需要壹各来月の时间,既然仆役入别咯爷の眼,从别曾侍寝,那么,由谁来承担那各差事呢?难道,难道那各吉尔就是爷の通房丫头吗?壹想到那里,月影气得满脸通红、怒别 可遏,望向吉尔の目光更是充满咯敌意。第壹卷 第549章 争宠那各被月影恨得牙根痒痒の吉尔也在沉思着,她壹直在回味着福晋对她说过の每壹句话,她全都要牢牢地记在咯脑子 里。那样壹各千载难逢の机会,她也想要好好抓住,哪各少女没什么青春梦想?哪各少女没什么对未来の美好憧憬?更何况那是壹各令她如此心动の男人。王爷急着赶路,所以决定 此行期间,中膳随路解决,晚上投宿行宫再正经用膳。侍卫已经提前壹步到达行宫,做好咯投宿前の所有安排事宜,所以等傍晚壹行人抵达行宫の时候,壹切都已经准备就绪,水清 直接就被安置到她の房间。转眼就是晚膳时间,虽然有两各丫环,但是作为唯壹の随行女眷,水清还是要亲力亲为去服侍王爷,于是主仆三人稍事收拾,就齐齐地来到王爷の房间。 “给爷请安。”“噢,起来吧。”有咯五
人教版初中化学九下11.1 生活中常见的盐-盐的化学性质 课件

温故知新
回顾知识: 碱的化学性质并完成下列 化学方程式
CuSO4 + N2NaOaOHH = Na2SO4 + C蓝u色(O沉H淀)2↓
FeCl33
+
N3NaOaOHH
=
3NaCl
+
Fe(OH)3↓
红褐色沉淀
Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH
小结 盐的化学性质之一
盐 + 金属 → 新盐 + 新金属
温故知新
回顾知识: 酸的化学性质并完成下列 化学方程式
CaCO3 + H2HCCl l = CaCl2 + H2O + CO2↑ HCl + AgNO3= AgCl↓+ HNO3 H2SO4 + BaCl2= BaSO4↓+ 2HCl
小结 盐的化学性质之二
34.星星使天空绚烂夺目;知识使人增长才干。 39.不从泥泞不堪的小道上迈步,就踏不上铺满鲜花的大路。 二、努力把日子都填满,别让孤单把你包围,请善待珍惜自己,给自己一个坚强的理由,生活中没有什么过不去的坎。
58.如果把才华比作剑,那么勤奋就是磨刀石。 68.让珊瑚远离惊涛骇浪的侵蚀吗?那无异是将它们的美丽葬送。 82.既然选择远方,就注定风雨兼程。
化学方程式:NaCl+AgNO3=NaNO3+AgCl↓
小结 盐的化学性质之四
盐 + 盐 → 新盐 + 新盐
知识 拓展
SO42-和Cl-的检验方法
向溶液中加入硝酸钡溶液,产生白色沉淀,再加入稀 硝酸,沉淀不溶解,就可以确定该溶液中含有SO42-
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
①滴加硝酸钡,现象: 生成白色沉淀 ②滴加稀硝酸,现象: 沉淀不溶解
3.氯离子的检验 ①滴加硝酸银,现象:生成白色沉淀 ②滴加稀硝酸,现象:沉淀不溶解
4.铵根离子的检验
①滴加氢氧化钠溶液,现象: 有气泡产生 ②用红色石蕊试纸检验,现象: 试纸变蓝 或用沾有无色酚酞的棉花检验
1、下列各组离子能共存的是( B ) A、 Ba2+、K+、NO3-、CO32-、H+ B、K+、Cl-、Mg2+、NO3-、H+ C、Fe3+、SO42-、OH-、Na+、Cu2+ D、Ag+、Ba2+、Cl-、NO3-、K+ 2、不用其它试剂,用最简捷的方法鉴别:①氢氧化 钠②硫酸镁③硝酸钡④氯化铁⑤氯化钾五种溶液, 则被鉴别出来的物质的正确的顺序是( B ) A、①②③④⑤ C、④③①②⑤ B、④①②③⑤ D、②③①④⑤
3、碳酸钙(CaCO3)
物理性质:白色不溶于水的固体。 与酸反应 CaCO3+2HCI=CaCI2+H2O+CO2↑ 不稳定 高温 CaCO3====CaO+CO2↑
化学性质:
碳酸钙用途:
水泥、玻璃、建筑材料、补钙剂、牙膏摩擦剂
P71页 实验11——2碳酸钠 与碱反应
向盛有少量Na2CO3溶液的试管 滴入澄清的石灰水,观察现象。
再见
复分解反应 由两种化合物互相交换成分,生成 另外两种化合物的反应。
hxfy4.exe动画
P72页讨论:酸碱中和反应属 于复分解反应吗?为什么? 分析归纳上述你哥酸碱盐之间 的复分解反应,他们的生成物 有什么特点
Ca(OH)2 + 2HCl == CaCl2 +2 H2O Na2CO3+2HCl=2NaCl+CO2↑+H2O Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
我国的制碱工业的先驱——侯德榜:
2、碳酸氢钠(NaHCO3) 物理性质: 碳酸氢钠俗称小苏打,细小白色晶体, 较易溶于水。 碳酸氢钠用途: 焙制糕点、治疗胃酸过多
大 理 石 建 筑
这些美丽的建 筑也与一种盐 有关 ——碳酸钙 (CaCO3)。
制玻璃
作建筑材料
石灰石
炼 铁 制水泥
3、碳酸钙(CaCO3)
3CuCl2+2Al=2AlCl3+3Cu 2AgNO3 + Cu = Cu (NO3)2 + 2Ag
化学性质:
跟某些金属的反应 跟酸的反应 跟碱的反应 跟另一种盐的反应 盐跟酸反应,一般生成另一种盐 和另一种酸。 AgNO3 + HCl = AgCl↓+ HNO3
(右上录像)
BaCl2 + H2SO4 = BaSO4 + HCl
课题1
刘河中学
1、碳酸钠(Na2CO3)
碳酸钠俗称纯碱、苏打,是白色粉末状 物理性质: 物质,易溶于水,水溶液显碱性。
用途
碳 酸 钠 的 用 途
• 在中国化学工业史上,有一位杰出的科学家,他为祖国的化学工业事业奋斗 终生,并以独创的制碱工艺闻名于世界,他就像一块坚硬的基石,托起了中 国现代化学工业的大厦,这位先驱者就是被称为“国宝”的侯德榜。 侯德榜一生在化工技术上有三大贡献。第一,揭开了苏尔维法的秘密。第二, 创立了中国人自己的制碱工艺——侯氏制碱法。第三,就是他为发展小化肥 工业所做的贡献。
复分解反应发生的条件
有难溶的物质(如BaSO4、AgCl)或难电离的物质(如H2O)或 挥发性的物质(如CO2)生成,只要具备上述条件之一,这类 反应就能发生。
【思考】 1、AgNO3 + HCl -------2、 K2CO3+ Ca(OH)2--3、Na2CO3+ CaCl2 ----AgCl↓+HNO3 CaCO3↓+ KOH CaCO3↓+ NaCl BaSO4↓+ HCl
3、下列各组溶液,不加其它试剂就能鉴 别的是(B、D ) A、Na2CO3、HCl、H2SO4、NaNO3 B、K2CO3、H2SO4、HNO3、BaCl2 C、HCl、AgNO3、HNO3、NaCl D、NaOH、FeCl3、MgCl2、BaCl2
4、有一包白色粉末,可能含有碳酸钙、 硫酸钠、碳酸钠、氯化钙中的一种或几 种。为了鉴别该白色粉末,做如下实验。 (1)将白色粉末溶于水得无色溶液; (2)在该溶液中滴加BaCl2溶液有白色 沉淀生成;(3)过滤后,在沉淀物里 加入足量的稀硝酸,沉淀全部溶解并放 出无色气体。 根据实验现象判断:此白色粉末中肯定含 有 CaCO3、Na2SO4、CaCl2 Na 2CO3 ,肯定不含有。
视频
现象
溶液产生白色沉淀
Na CO +Ca(OH) =CaCO ↓+2NaOH 2 3 2 3 化学方程式
分析
含有CO32-的碳酸盐溶液与石灰水能反 应产生白色沉淀
三﹑盐的化学性质
跟某些金属的反应 跟酸的反应 跟碱的反应
金属பைடு நூலகம்盐的反应.flv视频
跟另一种盐的反应
在金属活动性顺序里,只有排在前面的金属,才能把排 在后面的金属从它们的盐溶液里置换出来。
跟某些金属的反应 跟酸的反应
跟碱的反应
跟另一种盐的反应
盐跟碱反应,一般生成另一种盐和另一种碱。 Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH FeCl3 + 3NaOH = 3NaCl + Fe(OH)3↓
化学性质:
跟某些金属的反应
跟酸的反应
跟碱的反应 跟另一种盐的反应 两种盐起反应,一般生成另外两 种盐。 AgNO3 + NaCl = AgCl↓+ NaNO3 BaCl2 + Na2SO4 = BaSO4 + 2NaCl
4、Na2SO4 + HCl ------5、H2SO4 + BaCl2-------
6、Ba(OH)2+ KCl -----7、CuSO4 + NH4NO3--8、HNO3 + NaOH ----NaNO3 + H2O
五、几种常见离子的检验
1.碳酸根离子的检验
①滴加稀盐酸,现象: 有气泡产生 ②通入澄清石灰水,现象: 生成白色浑浊 2.硫酸根离子的检验
AgNO3 + NaCl = AgCl↓+ NaNO3 BaCl2 + Na2SO4 = BaSO4 + 2NaCl Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH FeCl3 + 3NaOH = 3NaCl + Fe(OH)3↓ AgNO3 + HCl = AgCl↓+ HNO3 BaCl2 + H2SO4 = BaSO4 + HCl Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
与酸反应
Na2CO3+2HCl=2NaCl+CO2↑+H2O
化学性质:
与氢氧化钙反应:
Na2CO3+Ca(OH)2=CaCO3 + 2NaOH
碳酸钠用途:玻璃、造纸、纺织、洗涤剂、面食制作
2、碳酸氢钠(NaHCO3)
物理性质: 碳酸氢钠俗称小苏打,细小白色晶体, 较易溶于水。 化学性质: 与酸反应:NaHCO3+HCl=NaCl+ CO2↑+H2O 碳酸氢钠用途: 焙制糕点、治疗胃酸过多
化学 Na2CO3+2HCl= 方程 2NaCl+H O+CO ↑ 2 2 式
CO32-与盐酸反应产生
NaHCO3+HCl= NaCl+H2O+CO2↑
HCO3 与盐酸反应产
分析
使澄清石灰水变浑浊 的CO2气体
生使澄清石灰水变浑 浊的CO2气体
知识归纳
1、碳酸钠(Na2CO3)
碳酸钠俗称纯碱、苏打,是白色粉末状 物理性质: 物质,易溶于水,水溶液显碱性。
二、碳酸盐的化学性质
CaCO3+2HCI=CaCI2+H2O+CO2↑
鸡 蛋 趣 味 实 验
原理:CaCO3+2HCl=CaCl2+CO2 +H2O
CaCO3 Na2CO3NaHCO3
视频
碳酸钠+盐酸
碳酸氢钠+盐酸
产生大量的气泡, 澄 清石灰水变浑浊
实验 现象
产生大量气泡,澄清 石灰水变浑浊
物理性质:白色不溶于水的固体。 碳酸钙用途: 水泥、玻璃、建筑材料、补钙剂、牙膏摩擦剂
复习与巩固:
1、实验室用_____________制取二氧化碳反应原理是:
大理石和稀盐酸
CaCO3+2HCI=CaCI2+H2O+CO2↑ 2、你不记得生石灰是怎样煅烧出来的? 高温 CaCO3====CaO+CO2↑ 上述反应说明碳酸钙有怎样的化学性质? 能与酸反应;而且不稳定。
