电化学作业1
高考化学一轮复习 电化学1 锂电池练习试题

回夺市安然阳光实验学校专题01 锂电池1.锂海水电池常用在海上浮标等助航设备中,其示意图如图所示。
电池反应为2Li+2H2O===2LiOH+H2↑。
电池工作时,下列说法错误的是( )A. 金属锂作负极B. 电子从锂电极经导线流向镍电极C. 海水作为电解质溶液D. 可将电能转化为化学能【答案】D2.某科研小组公司开发了Li-SO2Cl2用电池,其示意图如下图所示,已知电池总反应为:2Li+ SO2Cl2= 2LiCl+SO2↑。
下列叙述中错误的是A. 电池工作时负极材料是Li,发生氧化反应B. 电池工作时电子流向:锂电极→导线→负载→碳棒C. 电池工作时,外电路流过0.2 mol电子,状况下生成4.48 L气体D. 电池工作过程中,石墨电极反应式为SO2Cl2+2e-=2Cl-+SO2↑【答案】C【解析】根据电池的总反应:2Li+ SO2Cl2= 2LiCl+SO2↑。
得到单质锂在反应中失电子化合价升高,所以单质锂是该电池的负极,发生失电子的氧化反应,选项A正确。
锂电极为负极,所以电子从锂电极流出,经导线、负载,到达石墨电极,选项B正确。
总反应的电子转移数为2e-,所以转移电子是生成的SO2气体的2倍,外电路流过0.2 mol电子,状况下生成2.24 L(0.1mol)气体,选项C错误。
石墨电极是反应的正极,正极上是SO2Cl2得电子,转化为SO2和Cl-,方程式为:SO2Cl2+2e-=2Cl-+SO2↑,选项D正确。
3.下图是采用新能源储能器件将CO2 转化为固体产物,实现CO2 的固定和储能灵活应用的装置。
储能器件使用的Li-CO2电池组成为钌电极/CO2-饱和LiClO4-DMSO电解液/锂片。
下列说法正确的是A. Li -CO2 电池电解液由LiClO4和DMSO溶于水得到B. CO2 的固定中,每转移8 mole-,生成3mol气体C. 过程Ⅱ中电能转化为化学能D. 过程Ⅰ的钌电极的电极反应式为2Li2CO3 +C-4e-=4Li++3CO2↑【答案】D4.中国科学家用蘸墨汁书写后的纸张作为空气电极,设计并组装了轻型、柔性、能折叠的可充电锂空气电池如下图1,电池的工作原理如下图2。
电化学原理考题1

阴极(+)→负移 阳极(-)→正移
E>V
阳极→正移 阴极→负移
E<V
速度控制步骤
速度控制步骤 (rate-determining step):串连的
各反应步骤中反应速度最慢的步骤。
浓差极化(concentration polarization):液相传质
步骤为控制步骤时引起的电极极化。
电化学极化(electrochemical polarization):由于
Fe-H2O系的电位-pH图的分析
第三章 电极/溶液界面的结构与性质
一、电毛细曲线及 其测定
两相间均存在界面张力, 电极体系界面张力不仅与 界面层的物质有关,而且 与电极电位有关,此界面 张力随电极电位变化的现 象叫做电毛细现象。
双电层结构
一、电极/溶液界面的基本结构
静电作用使相反电荷靠近,倾向于紧贴电极表面 排列,图3.11。而热运动使带电粒子倾向于均匀 分布,使剩余电荷不能紧贴电极表面分布,有一 定扩散性,形成扩散层。二者相互作用使不同条 件下电极体系中,双电层由紧密层和分散层两部 分组成。
零电荷电位
表面剩余电荷为零或电极/溶液界面不存在离子双电层 时的电极电位,其数值大小相对于某一参比电极获得。 剩余电荷是相电位存在重要而非唯一原因,各种极化等 因素都可形成一定的相间电位,零电荷电位仅表示电极 表面剩余电荷为零时的电位。而非电极/溶液相间电位 或绝对电极电位零点。 零电荷电位用经典毛细管法测量,对固态金属,可采用 间接测量方法,如硬度,润湿性等。
j nFv
由于nF是一常数,所以j完全取决于v, 即j可以表示 电极反应的速度.在电化学中电流密度就是电化学 反应速度的同义语.
应用电化学练习1

应用电化学练习(一)
1.若电极Zn︱ZnSO4 (a=1)的双电层电容与电极电位无关,其数值为
36µF·cm-2,已知该电极的E0=-0.763V,E z=-0.63V,试求:(1)平衡电位时的表面剩余电荷密度;(2)通电使电极电位变化到E=0.32V时的表面剩余电荷密度。
2.何谓电毛细曲线?何谓零电荷电势?由lippman公式可进一步得到界面双
电层的微分电容Cd,请给出Cd的数学表达式。
3.何谓电化学极化?产生极化的主要原因是什么?试分析极化在电解工业
(如氯碱工业)﹑电镀行业和电池工业的利弊。
4.参比电极需选用理想极化电极还是不极化电极?目前参比电极有那些类
型?选择参比电极需考虑什么?
5.零电荷的电势可用哪些方法测定?零电荷电势说明什么现象?能利用零
电荷电势计算绝对电极电位吗?
6.为什么卤素离子在汞电极上吸附依F﹤Cl﹤I的顺序而增强,特性吸附在
电毛细曲线和微分电容曲线上有何表现?。
1电化学基础部分课堂测试卷参考答案

电化学基础部分课堂测试卷参考解题姓名:学号:1. 下列电池中,哪个电池的电动势与Cl- 离子的活度无关(C )(A) Zn│ZnCl2 (aq)│Cl2 (g)│Pt (B) Zn│ZnCl2 (aq)‖KCl (aq)│AgCl(s)│Ag (C) Ag│AgCl (s)│KCl (aq)│Cl2 (g)│Pt (D) Hg│Hg2Cl2 (s)│KCl (aq)‖AgNO3 (aq)│Ag [思路]:负极(左)氧化,正极(右)还原;写出电池反应看出有没有氯离子,没有则无关!解:A. Zn + Cl2 = Zn2+ + 2Cl- B. Zn + 2AgCl = Zn2+ + 2Ag + 2Cl-C. Ag + Cl2 = AgClD. 2Hg + 2Cl- + Ag+ = Hg2Cl2 + Ag2. 下列对原电池的描述哪个是不准确的: ( C )(A) 在阳极上发生氧化反应(B) 电池内部由离子输送电荷(C) 在电池外线路上电子从阴极流向阳极(D) 当电动势为正值时电池反应是自发的[思路]:概念题,概念清晰,很容易选出。
看清题目要求是选择不正确的!解:A. 定义发生氧化反应的电极为阳极B. 电池内部是电解质溶液,电解质溶液靠离子的自由移动导电,即输送电荷C.原电池电流从正极流向负极;电子流动方向相反,从负(阳)极到正(阴)极D. 电动势是电池反应方向判据,正说明正向可自发,反之,反向可自发。
3. 已知:E θ(Cl2/Cl-)= 1.36 V,Eθ(O2|OH -)= 0.401 V,Eθ(Cu2+/Cu) = 0.337 V,用铜电极电解CuCl2的水溶液,在阳极上会发生( D ) (A) 析出氧气(B) 析出氯气(C) 析出铜(D) 铜电极溶解[思路]:阳极上发生的放电反应,记住“阴大阳小”,就是比较数值的大小。
在阳极上发生的是阴离子或者分子(原子)的氧化反应。
根据题目条件有Cl-, OH-和Cu,题中只给出了标准还原电极电势,则可直接用标准还原电极电势的数值大小比较;如果给出了相关的活度或者浓度,或者超电势的数值,则要考虑离子活度或者浓度以及超电势的影响。
第五章电化学(1)

第五章 电 化 学四 习题解答5.1 将两个银电极插入AgNO 3溶液,通以0.2A 电流共30 min ,试求阴极上析出银的质量。
解: 通过电解池的电量 Q = It =(0.2×30×60)C=360 C根据法拉第定律 Q =nF则电极上起反应的物质的量:-1360C(Ag)0.003731mol 96485C moln ==⋅ 阴极上析出Ag 的质量 (Ag)(Ag)0.003731107.9g 0.4026g m n M =⨯=⨯=5.2 用银电极电解KCl 水溶液,电解前每100 g 溶液中含KCl 0.7422 g 。
阳极溶解下来的银与溶液中的Cl -反应生成AgCl(s),其反应可表示为 Ag =Ag + + e ﹣, Ag + + Cl ﹣=AgCl(s),总反应为Ag +Cl ﹣=AgCl(s)+e ﹣。
通电一段时间后,测得银电量计中沉积了0.6136 g Ag ,并测知阳极区溶液重117.51 g ,其中含KCl 0.6659 g 。
试计算KCl 溶液中的K +和Cl -的迁移数。
解:通电前后水的量不变。
以水的质量为2H O m =(117.51-0.6659)g =116.83g 作为计算基准。
对于阳极区K +的物质的量进行衡算(K +不参与电极反应)有:n n n =-迁后前 ,KCl 3KCl 0.7422116.83mol 11.7210mol (1000.7422)74.551m n M -⨯===⨯-⨯前前,KCl 3KCl0.6659mol 8.9310mol 74.551m n M -===⨯后后 33(11.728.93)10mol 2.7910mol n n n --=-=-⨯=⨯迁后前由银电量计的测试数据可知发生电极反应的物质的量 Ag 3Ag0.6136mol 5.6910mol 107.868m n M -===⨯电K +的迁移数t ( K +):332.7910mol(K )0.495.6910moln t n -+-⨯===⨯迁电Cl -的迁移数: (Cl )1(K )10.490.51t t -+=-=-= 5.3 见例题5.1 5.4 见例题5.25.5 291K 时,纯水的电导率为κ(H 2O )=3.8×10-6 S·m -1。
电化学习题课-1

答案:C
课堂练习:
电池 Pt H 2 p $
H 2 SO 4 0.01m O 2 p $
Pt
在298K时,该电池的电动势为1.228V,H2O(l)的生 成焓为-286.06kJ.mol-1 (A)写出该电池的电极反应和电池反应 (B)求298K时该电池电动势的温度系数 (C)求298K时该电池可逆放电时的热效应 (D)求标准电池电动势
注意等式中物质的量的一致性,都用电子的物质的量或者 Pb2+的物质的量。
n终=n前+n电-n迁
课后习题的关键点:
20.画出下列电导滴定的示意图: (1)用NaOH滴定C6H5OH; (2)用NaOH滴定HCl; (3)用AgNO3滴定K2CrO4; (4)用BaCl2滴定TI2SO4。 知识点: 1)相同浓度下,强电解质的电导率远大于弱电解质; 2)相同条件下,H+的电迁移速率最大,其次OH-。 其次还要知道化合物的溶解性,Ag2CrO4, BaSO4, TICl均难溶或微溶于水。
TI+|
Pt 的电极电势
2
1
= 1.250 V
TI 的电极电势
= -0.336 V,则TI 3+| TI 的电
极电势 3 为( )。
(a) 0.305 V (b) 0.721 V (c) 0.914 V (d) 1.586 V
答案:b
下周习题课: 电极电势及电池电动势的计算及其应用 (1)求热力学函数的变化值 (2)判断反应趋势 (3) 求一价离子的迁移数t+,t(4)求化学反应的平衡常数 (5)求微溶盐活度积 (6)求离子平均活度系数 (7)pH值的测定 (8)E(Ox|Red)- pH图
电化学原理习题课

问题:①不要漏掉空穴,②部分同学认为载流子在 各自导体间导电过程涉及化学变化。这是不对的 ,只有在两类导体界面上传递时才会出现化学反 应。
2、什么是电化学体系?你能举出两﹑三个实例 加以说明吗?
答:电化学体系是指由两类不同导体组成的,是 一种在电荷转移时不可避免地伴随有物质变化的 体系。
电层,其电位差为,' 此时分散层电位1 '。其双电层
结构和电位分布如下图。
Ψ1=φ’
②当电极电位为 1 时,由于1 0 ,该电极表面带正电
荷。
a当电极上不发生超载吸附时,其双电层结构和电位分
布如下图。其表面电位为:
1
A
2RT F
ln a
RT F
ln c( A为常数 )
-
-
-
-
a
-
a 1
-
1
第二章电化学热力学
习题2、计算25℃时下列电池的电动势。
(2)Pt | SnCl2(0.001mol/ kg),SnCl4(0.01mol/ kg) || FeCl3(0.01mol/ kg),FeCl2(0.001
mol/ kg) | Pt
解:电极反应:(–) Sn2 2e Sn4
(+) 2Fe3 2e 2Fe2 电池反应: Sn2 2Fe3 Sn4 2Fe2 此题可视为无限稀释的溶液,用浓度代替活度计算。 因为 0 (Pt | Fe3,Fe2 ) 0.771V
q C C(平 0 ) 36 (0.763 0.63) 4.79C / cm2
(2) 当在电解质溶液中加入1mol/L的NaCl 后,会发生 Cl-的特性吸附,导致紧密层的厚度减小,从而使双电 层的电容增加。题目已知,吸附使双电层电容改变时 电极电位不发生变化,而电极表面剩余电荷密度是与 电极电位相关的,电极电位不变,电极表面剩余电荷 密度不变,只是原来被水分子吸附的位置改由氯离子 吸附了。
电化学原理第一章习题解答(配合北航教材)

《电化学原理》习题第一章 绪论1.测得25℃时,0.001mol/L 氯化钾溶液中KCl 的当量电导为141.3Scm 2/eq,若作为溶剂的水的电导率为1.0×10-6S/cm ,试计算该溶液的电导率。
解: k=1000*c λ=1000001.03.141⨯=141.3×10-6S/cmk(溶液)=k(KCl)+k(H 2O)=141.3×10-6S/cm+1.0×10-6S/cm=142.3×10-6S/cm2.在18℃的某稀溶液中,H +,K +,Cl -等离子的摩尔电导分别为278Scm 2/mol, 48Scm 2/mol 和49Scm 2/mol,。
室温18℃时在场强为10V/cm 的电场中,美中离子以多大的平均速度移动?解:FU =λ即F=λE v得 v=FE λ 代入数据得 V H +=0.028cm/s V K +=0.0051cm/s V Cl -=0.0051cm/s3.在25℃时,将水中的一切杂质除去,水的电导率是多少?25℃时水的离子积1410008.1--+⨯==OH H W c c K 。
下列各电解质的极限当量电导分别为:()mol Scm KOH /4.2470=λ()mol Scm HCl /04.4260=λ()mol Scm KCl /82.1490=λ 解:=O H 20λ+KOH 0λ-HCl 0λKCl λ=274.4+426.04-149.83 =550.624.已知25℃时,KCl 溶液的极限摩尔电导为()mol Scm KCl /82.1490=λ,其中Cl -离子的迁移数是0.5095;NaCl溶液的极限摩尔电导为()mol Scm NaCl /45.1260=λ,其中Cl -离子的迁移数是0.6053。
根据这些数据:(1)计算各种离子的极限摩尔电导;(2)由上述计算结果证明离子独立移动定律的正确性;(3)计算各种离子在25℃的无限稀释溶液中的离子淌度。
电化学实验——精选推荐

实验一碳钢在碳酸铵溶液中的极化曲线【目的要求】1. 掌握准稳态恒电位法测定金属极化曲线的基本原理和测试方法。
2. 了解极化曲线的意义和应用。
3. 掌握电化学分析仪的使用方法。
【实验原理】1. 极化现象与极化曲线为了探索电极过程机理及影响电极过程的各种因素,必须对电极过程进行研究,其中极化曲线的测定是重要方法之一。
我们知道在研究可逆电池的电动势和电池反应时,电极上几乎没有电流通过,每个电极反应都是在接近于平衡状态下进行的,因此电极反应是可逆的。
但当有电流明显地通过电池时,电极的平衡状态被破坏,电极电势偏离平衡值,电极反应处于不可逆状态,而且随着电极上电流密度的增加,电极反应的不可逆程度也随之增大。
由于电流通过电极而导致电极电势偏离平衡值的现象称为电极的极化,描述电流密度与电极电势之间关系的曲线称作极化曲线,如图2-19-1所示。
图2-19-1 极化曲线AB:活性溶解区;B:临界钝化点;B-C:过渡钝化区;C-D:稳定钝化区;D-E:超(过)钝化区(1)AB段为活性溶解区,此时金属进行正常的阳极溶解,阳极电流随着电势的正移而不断增大。
(2)BC段为过渡钝化区(负坡度区)。
随着电极电势变正达到B点之后,此时金属开始发生钝化,随着电势的正移,金属溶解速率不断降低,并过渡到钝化状态。
对应于B点的电极电势称为临界钝化电势ψ钝化,对应的电流密度叫临界钝化电流密度i钝化。
(3)CD段为稳定钝化区,在此区域内金属的溶解速率降低到最小值,并且基本上不随电势的变化而改变,此时的电流密度称为钝态金属的稳定溶解电流密度。
(4)DE段为超钝化区。
此时阳极电流又重新随电势的正移而增大,电流增大的原因可能是高价金属离子的产生,也可能是O2的析出,还可能是两者同时出现。
金属的阳极过程是指金属作为阳极时在一定的外电势下发生的阳极溶解过程,如下式所示:M→M n++n e此过程只有在电极电势正于其热力学平衡电势时才能发生。
阳极的溶解速度随电位变正而逐渐增大,这是正常的阳极溶出,但当阳极电势正到某一数值时,其溶解速度达到最大值,此后阳极溶解速度随电势变正反而大幅度降低,这种现象称为金属的钝化现象。
电化学原理试题(1)

电化学原理试题(1)第六章电化学极化1. 简述三种极化的概念,哪⼀种极化严格来讲不能称为极化。
电化学极化:当电极过程为电化学步骤控制时,由于电极反应本⾝的“迟缓性”⽽引起的极化。
浓度极化:当电极过程由液相传质步骤控制时,电极所产⽣的极化。
电阻极化:由电极的欧姆电阻引起的电位差。
电阻极化严格来讲不能称为极化2. 简述电化学极化最基本的三个动⼒学参数的物理意义。
1) 对称系数:电位偏离形式电位时,还原反应过渡态活化能改变值占F 的分数。
物理意义:反应改变电极电位对还原反应活化能的影响程度;(1—)反应改变电极电位对氧化反应活化能的影响程度。
对称系数是能垒的对称性的变量,是由两条吉布斯⾃由能曲线的斜率决定的,⽽且曲线的形状和斜率是取决于物质的化学键特性。
在CTP动⼒学中,可以⽤来推测过渡态的构型,研究电极反应的放电机理。
2)电极反应标准速率常数K:当电极电位等于形式电位时,正逆反应速率常数相等,称为标准速率常数。
物理意义:在形式电位下,反应物与产物浓度都为1时,K在数值上等于电极反应的绝对反应速度。
a.度量氧化还原电对的动⼒学难易程度;b体现电极反应的反应能⼒与反应活性;c.反应电极反应的可逆性。
3)交换电流密度J。
:在平衡电位下,氧化反应和还原反应的绝对电流密度相等,称为交换电流密度。
物理意义:a.度量氧化还原电对的动⼒学难易程度;b体现电极反应的反应能⼒与反应活性;c.反应电极反应的可逆性;d.表⽰平衡电位下正逆反应的交换速度。
3.为什么电极电位的改变会影响电极反应的速度和⽅向?4.写出Butler-Volmer公式在不同过电位范围下的近似公式。
5.简述J0对电极性质的影响。
6. J0描述平衡状态下的特征,为何它却能说明电化学动⼒学中的⼀些问题?7. 如何⽤稳态法测量三个动⼒学参数。
8. 在谈到⼀个CTP的不可逆性时,我们有时说它是过电位较⼤,⽽有时⼜说它是电流密度较⼩,这两种说法有何区别和联系?9.电解H2SO4⽔溶液,Ni阴极的过电位为0.35 V。
电化学实验一析氢行为

姓名:学号:日期:一.实验目的(1)掌握线性扫描技术(2)掌握三电极体系(3)掌握Tafel关系二.实验原理析氢反应方程:H++e→1/2H2线性扫描技术:控制电极电势按指定规律变化,同时测量电极电流随电势的变化。
Tafel关系:强极化(但无浓差)发生时,超电势η与通过电极的电流密度j呈线性关系。
(课本53页)三.实验步骤及结果实验步骤:(1)用18.4mol/L浓硫酸配置50mL0.5mol硫酸溶液(a=1)取适量水于烧杯中,量取6.8mL浓硫酸,缓慢加入烧杯中并用玻璃棒搅拌,将稀释后的溶液加入250mL容量瓶定容。
(2)用刚玉粉末作为抛光粉处理电极活性表面,以避免副反应干扰实验。
(3)使用电化学工作站CHI660E进行线性扫描,为获取准确电势值,采用三电极体系。
工作电极:Φ2mm圆盘电极Au,Ni,GC,Φ0.5mmPt对电极:钛电极参比电极:Ag-Agcl,φAgcl/Ag=0.222V,并使用鲁金毛细管以减小溶液电阻工作电极—绿色夹子,对电极—红色夹子,参比电极—白色电极参数设置要考虑不同金属的起始终止电势,选定合适sensitivity以避免数据溢出,实验开始前要除去电极表面的气泡。
(4)数据处理:i=ic +id基线代表ic变化,超电势η=-0.222-E,电流密度j=id/A使用origin处理i,E数据并绘制η-lnj曲线,找到ab。
实验数据:(1)Au电极表面析氢行为(2)GC 电极表面析氢行为C u r r e n t (A )Potential (V)η (V )lnj (A*m -2)C u r r e n t (A )Potetial (V)(3)Ni 电极表面析氢行为η (V )lnj (A*m -2)C u r r e n t (A )Potential (V)η (V )lnj (A*m -2)(4)Pt 电极表面析氢行为(5)四种电极综合图C u r r e n t (A )Potential (V)η (V )lnj (A*m -2)由图可知: 当lnj<4.81时,超电势受电极金属种类影响,η(GC )>η(Ni )>η(Au )>η(Pt ),当lnj>4.81时,Ni 电极的拟合直线与Au 电极的拟合直线交叉,主要原因是Ni 位置选取不够恰当,所以拟合的误差比较大;Pt 的超电势非常小,很适合做析氢反应的电极; 氢超电势主要受a 值影响,b 的影响较小; 当j →0时电极更接近可逆电极电势; 对GC,Ni,Au 电极,a 都要比b 大很多。
物理化学第7章-电化学参考答案

第7章 电化学 习题解答1. 将两个银电极插入AgNO 3溶液,通以0.2 A 电流共30 min ,试求阴极上析出Ag 的质量。
解:根据BItM m zF=得 Ag Ag 0.23060107.87g 0.4025 g 196500ItM m zF⨯⨯⨯===⨯2. 以1930 C 的电量通过CuSO 4溶液,在阴极有0.009 mol 的Cu 沉积出来,问阴极产生的H 2的物质的量为多少? 解:电极反应方程式为: 阴极 2Cu2e Cu(s)+-+→阳极 222H O(l)H (g)2OH 2e --→++在阴极析出0.009 mol 的Cu ,通过的电荷量为:Cu Q (0.009296500) C 1737 C nzF ==⨯⨯=根据法拉第定律,析出H 2的物质的量为2H Cu 19301737mol 0.001 mol 296500Q Q Q n zFzF --====⨯ 3. 电解食盐水溶液制取NaOH ,通电一段时间后,得到含NaOH 1 mol/dm 3的溶液0.6 dm 3,同时在与之串联的铜库仑计上析出30.4 g 铜,试问制备NaOH 的电流效率是多少? 解:根据铜库仑计中析出Cu(s)的质量可以计算通过的电荷量。
Cu Cu 30.4mol 0.957 mol 1163.52m n M ===⨯电 理论上NaOH 的产量也应该是0.957 mol 。
而实际所得NaOH 的产量为(1.0×0.6) mol = 0.6 mol所以电流效率为实际产量与理论产量之比,即0.6100%62.7%0.957η=⨯=4. 如果在10×10 cm 2的薄铜片两面镀上0.005 cm 厚的Ni 层[镀液用Ni(NO 3)2],假定镀层能均匀分布,用 2.0 A 的电流强度得到上述厚度的镍层时需通电多长时间?设电流效率为96.0%。
已知金属的密度为8.9 g/cm 3,Ni(s)的摩尔质量为58.69 g/mol 。
物理化学—电化学练习题及参考答案(1)-推荐下载

电化学A一、选择题1. 某燃料电池的反应为:H 2(g)+O 2(g)─→H 2O(g)12在 400 K 时的 ∆r H m 和 ∆r S m 分别为 -251.6 kJ ·mol -1和 –50 J ·K -1·mol -1,则该电池的电动势为:()(A) 1.2 V (B) 2.4 V(C) 1.4 V (D) 2.8 V2. 已知下列两个电极反应的标准电极电位为:Cu 2++ 2e -─→ Cu(s)φ= 0.337 V1$Cu ++ e -─→ Cu(s) φ= 0.521 V2$由此可算得 Cu 2++ e -─→ Cu +的 φ 值为: ()(A) 0.184 V (B) 0.352 V(C) -0.184 V (D) 0.153 V 3. 有下面一组电池:(1) H 2(p )│HCl(a =1)‖NaOH(a =1)│O 2(p )(2) H 2(p )│NaOH(a =1)│O 2(p )(3) H 2(p )│HCl(a =1)│O 2(p )(4) H 2(p )│KOH(a =1)│O 2(p )(5) H 2(p )│H 2SO 4(a =1)│O 2(p )电动势值:()(A) 除 1 外都相同(B) 只有 2,4 相同(C) 只有3,5 相同(D) 都不同4. 对应电池Ag(s)|AgCl(s)|KCl(aq)|Hg2Cl2(s)|Hg(l)的化学反应是:()(A) 2Ag(s)+Hg22+(aq) = 2Hg(l) +2Ag+(B) 2Hg+2Ag+ = 2Ag +Hg22+(C) 2AgCl+2Hg = 2Ag +Hg2Cl2(D) 2Ag+Hg2Cl2 = 2AgCl +2Hg5. 电动势测定应用中,下列电池不能用于测定H2O(l)的离子积的是:()(A) Pt,H2(p )|KOH(aq)||H+(aq)|H2(p ),Pt(B) Pt,H2(p )|KOH(aq)||参比电极(C) Pt,H2(p )|KOH(aq)|HgO(s)|Hg(l)(D) Pt,H2(p )|HCl(aq)|Cl2(p ),Pt6. 在电极与溶液的界面处形成双电层,其中扩散层厚度与溶液中离子浓度大小的关系是()(A) 两者无关(B) 两者成正比关系(C) 两者无确定关系(D) 两者成反比关系7. 某电池反应为Zn(s)+Mg2+(a=0.1)=Zn2+(a=1)+Mg(s) 用实验测得该电池的电动势E=0.2312 V, 则电池的E 为:( )(A) 0.2903 V(B) -0.2312 V(C) 0.0231 V(D) -0.202 V 8.电极 Tl 3+,Tl +/Pt 的电势为φ=1.250 V,电极 Tl +/Tl 的电势1$φ=-0.336 V ,则电极 Tl 3+/Tl 的电势 φ为: ()2$3$(A) 0.305 V (B) 0.721 V(C) 0.914 V (D) 1.568 V 9. 298 K 时,在下列电池的右边溶液中加入 0.01 mol ·kg -1的 Na 2S溶液, 则电池的电动势将: ()Pt │H 2(p )│H +(a =1)‖CuSO 4(0.01 mol ·kg -1)│Cu(s)(A) 升高(B) 下降(C) 不变 (D) 无法判断 10.298 K 时,反应为 Zn(s)+Fe 2+(aq)=Zn 2+(aq)+Fe(s) 的电池的E 为 0.323 V,则其平衡常数 K 为: ()(A) 2.89×105 (B) 8.46×1010(C) 5.53×104 (D) 2.35×102 二、填空题11.将反应H 2(g)+I 2(s)→2HI(aq)设计成电池的表示式为:__________________________________。
大学物理化学习题课(上课)-电化学(1)

∵ KCl溶液中t+ = t- ∴ m(K+)=m(Cl-) ∴m(KCl)=m(K+)+m(Cl-)= 2 m(K+)
=m(NaCl)+ m(KNO3) m(NaNO3) = 1.510-2Sm2mol-1
m(K+)=m(Cl-)=0.7510-2Sm2mol-1 m(Na+)=m(NaCl)m(Cl-)=0.5110-2Sm2mol-1 m(NO3-)=m(KNO3)m(K+)=0.7010-2Sm2mol-1
1.360
②BHCl+大量B
0.001
1.045
③HCl(aq)
0.001
4.210
BHCl为强电解质,在溶液中全部电离为BH+和Cl-。
B为非电解质。试计算BH+ =B+H+的离解平衡常数。
解:BHCl BH++Cl- (全部电离)
BH+ c(1-)
cc B + H+
c c
K
c 2 (1 )c
度下ZnSO4的=?
解:负极:Zn(s) 2e Zn2+
正极:PbSO4 (s)+2e Pb(s)+SO42-(m-)
电池反应:PbSO4 (s)+ Zn(s)= Pb(s)+ZnSO4(m)
(1)E
E
RT 2F
ln
a(ZnSO4 )
0.5477
E
RT F
ln(
m
/
m
)
E =0.5477+0.0591lg(0.380.01)=0.4046V
化学电化学练习题

化学电化学练习题化学电化学是研究化学反应与电流之间的关系的一个重要分支。
通过电化学反应,我们能够了解物质的氧化还原性质以及相关的能量变化。
下面是一些化学电化学的练习题,帮助您巩固和深入理解这一知识领域。
题目一:电池原理根据下图所示的电池图示,回答问题。
________________ ________________| Zn | Zn 2+ || Cl- | Cl2 || Pt | Pt ||_________|__________||_________|____________||____________|___ ______|a) 电池内发生了什么化学反应?b) 写出该电池中发生的半反应方程式。
c) 确定该电池的电势。
d) 该电池是属于什么类型的电池?题目二:电解反应下面是一个关于电解反应的问题。
请回答问题。
a) 将一定量的银离子电解,需要多少电子才能完全还原为银金属?b) 如果在电解槽中需要36.0分钟才能完全电解1.25克的铜离子,确定电解过程中流过电解槽的平均电流。
c)根据实验条件,写出该电解反应的半反应方程式。
题目三:电池组合下面是关于电池组合的问题,请回答问题。
a) 考虑以下两个半反应:i) Pb2+ + 2e- → Pb (反应1)ii) Zn2+ + 2e- → Zn (反应2)列出所有可能的电池组合。
b) 如何选择合适的反应组合来构建一种可行的电池?题目四:电化学应用下面是一个关于电化学应用的问题,请回答问题。
a) 解释电镀的原理,并列举两个电镀的应用。
b) 解释蓄电池的结构和工作原理,列举两个蓄电池的应用。
题目五:电解质溶液下面是一个关于电解质溶液的问题,请回答问题。
a) 解释强电解质和弱电解质的区别,并列举一个例子。
b) 什么是离子强度和离子亲和力?这两个参数如何影响电解质的电导率?希望通过这些练习题,您能更全面地了解和掌握化学电化学的相关知识。
如果您有任何问题或疑惑,欢迎随时向我们提问。
电化学实验一HER

四.分析与结论
实验中出现的问题和解决方案:
(1)实验中鲁金毛细管内液面降到参比电极之下,使实验图呈“散点”,后停止
实验并用滴管移取少量电解液加入鲁金毛细管。
(2)测Au曲线时发现起始电流约为2V:配制的硫酸溶液中有溶解氧,反应为
O2+2H2O+4e→4OH-
(3)随超电势η增大,电极电势偏离可逆电势的程度增加,获得相同电流所需的外加电压也要增加,应根据实际需要选择适合的金属做电极
(4)Pt的超电势非常小,很适合做析氢反应的电极
(5)工作电极的表面积小于对电极表面积,所以工作电极极化程度远大于对电极极化程度,只需要加很小的电压,就可以让工作电极出现极化现象,因为通过电流极小,可近似认为参比电极的电势在一定温度下为常数。
当lnj<4.81时,超电势受电极金属种类影响,η(GC)>η(Ni)>η(Au)>η(Pt),当lnj>4.81时,Ni电极的拟合直线与Au电极的拟合直线交叉,主要原因是Ni位置选取不够恰当,所以拟合的误差比较大;
Pt的超电势非常小,很适合做析氢反应的电极;
氢超电势主要受a值影响,b的影响较小;
当j→0时电极更接近可逆电极电势;
(3)扫描中发现曲线电流不再随时间变化,说明数据溢出,需要停止实验,增
大范围,重新测量。
(4)测量中发现曲线很早就不再满足线性关系,停止实验,发现工作电极上有气泡,驱走气泡重新测量,几次测量曲线更相近。
实验结论:
(1)根据Tafel方程η=a+b*lnj 超电势值受a影响较大,受b影响较小
(2)随电流密度j增加,超电势增大
(6)Tafel关系中a,b受实验室温度影响,所以b不等于0.050V
电化学练习题

电化学练习题1. 在电解质溶液中,为什么正极会生成氧气,而负极会生成氢气?在电解质溶液中,正极是氧化反应的地方,而负极是还原反应的地方。
在电解质溶液中,水分解为氢气和氧气的反应(2H2O -> 2H2 +O2)。
正极上发生氧化反应,水被氧化成氧气(4OH- -> 2H2O + O2 + 4e-),负极上发生还原反应,水被还原成氢气(2H2O + 2e- -> H2 + 2OH-)。
2. 什么是电化学电池?简要描述一下原电池和可逆电池。
电化学电池是一种将化学能转化为电能的装置。
它包括正极、负极和电解质溶液。
原电池是一种非可逆电池。
它的正极和负极之间存在电势差,通过化学反应发生电子转移,将化学能转化为电能。
在原电池中,化学反应发生后无法逆转,即电池反应不可逆。
可逆电池是一种理论上完全逆转的电池。
在可逆电池中,正极和负极之间的电势差可以通过反向电流逆转,使电子从负极流向正极,化学反应也可以逆转。
可逆电池的反应是在无限慇懃的条件下进行的。
3. 什么是标准电极电势?如何利用标准电极电势判断化学反应的方向?标准电极电势是指在标准条件下,将电极与标准氢电极相比较时的电势差。
在标准条件下,标准氢电极的电极电势被定义为0V。
其他电极相对于标准氢电极的电势差被称为标准电极电势。
根据标准电极电势的大小,可以判断化学反应的方向。
如果化学反应中一个物质的标准电极电势大于另一个物质,则这个物质在反应中将发生氧化反应,作为正极。
另一个物质将发生还原反应,作为负极。
反之,如果一个物质的标准电极电势小于另一个物质,则这个物质将发生还原反应,作为正极,另一个物质将发生氧化反应,作为负极。
4. 请解释电解质溶液中所发生的电解过程。
电解质溶液中的电解过程是指在施加外电压的情况下,正极和负极发生的化学反应。
正极上发生氧化反应,负极上发生还原反应。
在正极上,电解质溶液中的阴离子被氧化成氧气或其他氧化产物,同时放出电子。
在负极上,电解质溶液中的阳离子被还原成氢气或其他还原产物,并吸收电子。
电化学应用 (一)

腐蚀电池极化曲线示意图
Exercise
(1) 什么是金属的腐蚀? 金属防护的方法有那些? 什么是金属的腐蚀 金属防护的方法有那些 (2) 试比较原电池、电解池和腐蚀电池之间的同异? 试比较原电池、电解池和腐蚀电池之间的同异? (3) 金属电化学腐蚀的类型有那些 金属电化学腐蚀的类型有那些?
(4)
钢铁零件在盐酸中易发生腐蚀溶解, 钢铁零件在盐酸中易发生腐蚀溶解,而铜零件却不 易腐蚀。为什么? 易腐蚀。为什么?
(5) 将一根铁棒浸入水中一半,什么地方腐蚀溶解最严 将一根铁棒浸入水中一半, 为什么? 重?为什么
2、 、 分析右图,按要求写出有关反应方程式: 分析右图,按要求写出有关反应方程式: )、铁棒上的电极反应式为 (1)、铁棒上的电极反应式为: )、铁棒上的电极反应式为: )、碳棒上的电极反应式为 (2)、碳棒上的电极反应式为: )、碳棒上的电极反应式为: )、溶液中发生反应的化学方程式 (3)、溶液中发生反应的化学方程式: )、溶液中发生反应的化学方程式:
3.有M、N两种金属,分别与盐酸反应,产生 有 、 两种金属,分别与盐酸反应, 两种金属 H2速率相近,试设计一个实验比较 、N两 速率相近,试设计一个实验比较M、 两 种金属的活泼性。 种金属的活泼性。
腐蚀电流与腐蚀速率
金属的电化学腐蚀是自发的不可逆过程, 金属的电化学腐蚀是自发的不可逆过程,过程进行的主要 规律受电化学反应动力学支配。当微电池中有电流通过时, 规律受电化学反应动力学支配。当微电池中有电流通过时, 阴极和阳极分别发生极化作用,如下图(Evans图)所示。由 所示。 阴极和阳极分别发生极化作用,如下图 图 所示 于腐蚀电池的外电阻为零(两电极金属直接接触 两电极金属直接接触), 于腐蚀电池的外电阻为零 两电极金属直接接触 ,溶液内阻 很小,因而腐蚀金属的表面是等电势的, 很小,因而腐蚀金属的表面是等电势的,流经电池的电流 等于S点处的电流 腐蚀 称为腐蚀电流, 等于 点处的电流I(腐蚀 ,称为腐蚀电流,相应的电极电势 点处的电流 腐蚀), ZF∆f(腐蚀 叫做腐蚀电势。腐蚀电流反映腐蚀速率大小, 腐蚀)叫做腐蚀电势 腐蚀 叫做腐蚀电势。腐蚀电流反映腐蚀速率大小, 增加极化程度可减小I(腐蚀 从而降低腐蚀速率, 腐蚀), 增加极化程度可减小 腐蚀 ,从而降低腐蚀速率,减少金 属腐蚀。 属腐蚀。
电化学习题(1)
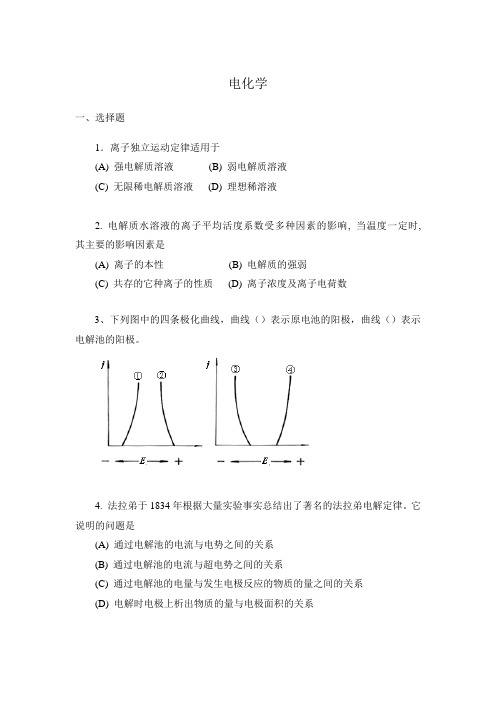
电化学一、选择题1.离子独立运动定律适用于(A) 强电解质溶液(B) 弱电解质溶液(C) 无限稀电解质溶液(D) 理想稀溶液2. 电解质水溶液的离子平均活度系数受多种因素的影响, 当温度一定时, 其主要的影响因素是(A) 离子的本性(B) 电解质的强弱(C) 共存的它种离子的性质(D) 离子浓度及离子电荷数3、下列图中的四条极化曲线,曲线()表示原电池的阳极,曲线()表示电解池的阳极。
4. 法拉弟于1834年根据大量实验事实总结出了著名的法拉弟电解定律。
它说明的问题是(A) 通过电解池的电流与电势之间的关系(B) 通过电解池的电流与超电势之间的关系(C) 通过电解池的电量与发生电极反应的物质的量之间的关系(D) 电解时电极上析出物质的量与电极面积的关系5. 将两个铂电极插入0.1升浓度为3mol的氯化钾水溶液中,在两极之间放置隔膜, 并于两电极附近分别滴入几滴酚酞溶液, 通以直流电。
片刻,观察到溶液中的显色情况是(A) 在阴极区显红色(B) 在阳极区显红色(C) 阴极区和阳极区只有气泡冒出, 均不显色(D) 阴极区和阳极区同时显红色7. 为了测量双液电池的电动势, 在两电极之间需要用盐桥来联接, 在下列各种溶液中可作盐桥溶液的是(A) 可溶性惰性强电解质溶液(B) 正负离子的扩散速度几乎相同的稀溶液(C) 正负离子的扩散速度几乎相同的浓溶液(D) 正负离子的扩散速度接近, 浓度较大的惰性盐溶液8. 为了测定电极的电极电势, 需将待测电极与标准氢电极组成电池, 这个电池的电动势就是待测电极电势的数值。
按照目前惯用的电池符号书写方式和IUPAC对电极电势符号的规定, 待测电池符号应是(A) (+)标准氢电极‖待测电极(-)(B) (-)待测电极‖标准氢电极(+)(C) (-)标准氢电极‖待测电极(+)(D) (+)待测电极‖标准氢电极(-)9. 用铂作电极电解一些可溶性碱的水溶液, 在阴、阳两电极上可分别获得氢气和氧气。
物理化学下策电化学试卷1

物理化学电化学试卷1一、选择题( 共20题40分)1. 2 分(4889)4889下列示意图描述了原电池和电解池中电极的极化规律, 其中表示原电池阳极的是:(A) 曲线1 (B) 曲线2(C) 曲线3 (D) 曲线42. 2 分(4373)4373有三种电极表示式: (1) Pt,H2(p∃)│H+(a=1), (2)Cu│Pt,H2(p∃)│H+(a=1),(3) Cu│Hg(l)│Pt,H2(p∃)│H+(a=1),则氢电极的电极电势彼此关系为:(A) 逐渐变大(B) 逐渐变小(C) 不能确定(D) 彼此相等3. 2 分(4863)4863j代表电池的电流密度,j0代表电极的交换电流密度,以下关系式中哪个反映了常用参比电极的工作特性?(A) │j│>> j0(B) │j│<< j0(C) │j│= j0≠0(D) │j│= j0= 04. 2 分(4111)4111铅蓄电池工作时发生的电池反应为:(A) Pb(s)+SO42-→PbSO4(s)+2e -(B) 2PbSO4(s)+2H2O(l) →Pb(s)+PbO2(s)+2H2SO4(aq)(C) Pb(s)+PbO2(s)+2H2SO4(aq) = 2PbSO4(s)+2H2O(l)(D) PbO2(s)+SO42-(aq)+4H++2e -→PbSO4(s)+2H2O(l)5. 2 分(5166) 5166铅蓄电池负极反应的交换电流密度,比正极反应的交换电流密度约小两个数量级,这表明:(A) 负极反应的恢复平衡的速率大, 容易出现极化(B) 正极反应的恢复平衡的速率大, 容易出现极化(C) 负极反应的恢复平衡的速率小, 容易出现极化(D) 正极反应的恢复平衡的速率小, 容易出现极化6. 2 分(4366)4366常见的燃料电池为: Pt,H2(p1)|NaOH(aq)|O2(p2),Pt,设其电动势为E1,如有另一电池可以表示为:Cu(s)|Pt|H2(p)|NaOH(aq)|O2(p)|Pt|Cu(s),其电动势为E2,若保持各物质的活度相同,则E1与E2的关系为:(A) E1>E2(B) E1<E2(B) (C) E1=E2(D) 无法判断7. 2 分(4946)4946电解时, 在阳极上首先发生氧化作用而放电的是:(A) 标准还原电势最大者(B) 标准还原电势最小者(C) 考虑极化后,实际上的不可逆还原电势最大者(D) 考虑极化后,实际上的不可逆还原电势最小者8. 2 分(4227)4227某一反应,当反应物和产物的活度都等于1 时,要使该反应能在电池内自发进行,则:(A) E为负(B) E∃为负(C) E为零(D) 上述都不是9. 2 分(5105)5105在还原性酸性溶液中, Zn的腐蚀速度较Fe为小, 其原因是:(A) φ(Zn2+/ Zn)(平) < φ(Fe2+/ Fe)(平)(B) φ(Zn2+/ Zn) < φ(Fe2+/ Fe)(C) φ(H+/ H2)(平, Zn) < φ(H+/ H2)(平, Fe)(D) φ(H+/ H2)(Zn) < φ(H+/ H2)(Fe)10. 2 分(4523)4523下列可逆电极中, 对OH-不可逆的是:(A) Pt,H2(g)│OH-(aq) (B) Pt,O2(g)│OH-(aq)(C) Hg(l)│HgO(s)│OH-(aq) (D) Ba(s)│BaSO4(s)│OH-(aq)11. 2 分(4861)4861极谱分析仪所用的测量阴极属于下列哪一种?(A) 浓差极化电极(B) 电化学极化电极(C) 难极化电极(D) 理想可逆电极12. 下述电池的电动势应该为(设活度系数均为1):Pt,H2(p∃)|HI(0.01 mol·kg-1)|AgI(s)|Ag—Ag|AgI(s)|HI(0.001 mol·kg-1)|H2(p∃),Pt(A) - 0.059 V (B) 0.059 V(C) 0.059 V/2 (D) -0.118 V13. 一贮水铁箱上被腐蚀了一个洞,今用一金属片焊接在洞外面以堵漏,为了延长铁箱的寿命,选用哪种金属片为好?(A) 铜片(B) 铁片(C) 镀锡铁片(D) 锌片14. 2 分(4513)4513在298 K时有如下电池:Pt│H2(p∃)│H+(a=1)‖CuSO4(0.01 mol·kg-1)│Cu(s)若在右边溶液中加入0.1 mol·kg-1的CuSO4溶液, 则电池的电动势将:(A) 增加(B) 下降(C) 不变(D) 无法判断15. 2 分(4194)4194)已知Tl++e -=Tl(s),E1∃(Tl+|Tl)= - 0.34 VTl3++3e -=Tl(s),E2∃(Tl3+|Tl)= 0.72 V则Tl3++2e -=Tl+的E3∃值为:(A) 1.06 V (B) 0.38 V(C) 1.25 V (D) 0.83 V16. 关于浓差电池,下述说法正确的是:(A) 反应物直接由一相迁入到另一相(B) 标准电动势为零(C) 电动势不能由能斯特方程计算(D) 标准电动势不一定为零17. 有两个电池,电动势分别为E1和E2:H2(p∃)│KOH(0.1 mol·kg-1)│O2(p∃) E1H2(p∃)│H2SO4(0.0l mol·kg-1)│O2(p∃) E2比较其电动势大小:(A) E1< E2(B) E1> E2(C) E1= E2(D) 不能确定18. 写出醌氢醌电极在酸性溶液中作为阴极时的电极反应式。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.谈谈你对科学哲学与现代科学基本研究方法的认识?
现代科学基本研究方法直接或间接地离不开科学哲学,哲学能够从广泛的认识论视野和深邃的形而上层次对科学的结果做出解释、证明和辩护,从而洞悉科学结果的深刻含义和在知识本体中的应有地位。
瓦托夫斯基说得好:“不管古典形式和现代形式的形而上学思想的推动力,都是企图把各种事物综合成一个整体,提供出一种统一的图景或框架,在其中我们经验中的各种各样的事物能够在某些普遍原理的基础上得到解释,或可以被解释为某种普遍本质或过程的各种表现。
”这种解释不仅能够坚定发现者或发明者的自信,也便于引起科学共同体的广泛关注或坦然接受,继续进行验证和深究。
要知道,凡是重大的科学发现或革命性的科学发明,都有悖于传统,有违于经典,往往会遭到抵制和反对,哲学的阐释和辩护在这里显得尤为必要。
哲学对科学的基本概念或基本原理具有分析功能,从而可以鉴别它们的长短优劣,以决定如何处置或取舍,或促使科学体系日益完善,或发现推进科学的重大突破口。
对此,爱因斯坦具有深沉的体验:“分析那些流行已久的概念,从而指明它们的正确性和适用性所依据的条件,指明它们是怎样从经验所给予的东西中一一产生出来的,这绝不是什么穷极无聊的游戏。
这样,它们的过大权威性就会被戳穿。
如果它们不能被证明为充分合法,它们就将被抛弃;如果它们同所给定的东西之间的对应过于松懈,它们就将被修改;如果能建立一个新的、由于无论那种理由都被认为是优越的体系,那么这些概念就会被别的概念所代替。
”德布罗意则从正反两个方面阐明:“对于一位科学家,特别是一位理论家,如果他无视哲学家,特别是忽视他们的评论著作,确有一些危险性。
实际上,经常有这种情况,他们使用的方法和概念并没有经过充分的分析,他们没有经过审慎的研究,不自觉地就接受了某种哲学体系,从而教条主义地拒绝对他们先入之见的评论。
这样,许多现代科学家不知不觉成为天真的实在论的牺牲者。
他们接受了某种物质论和机械论性质的形而上学,并把它看成是科学真理的唯一表示。
物理学的最近发展对现代思想的伟大贡献之一,就是它打破简单化的形而上学,并且以此为契机引起某些传统的哲学命题在全新的形势下的再考虑。
因此这就为科学和哲学的协调做好了准备;为了科学能继续发展,我们必须着手研究,或者说我们无论如何都要碰到哲学含义问题,并且要考虑它的新的更根本的解决。
另一方面,哲学家不得不考虑一些新的、由物理学家提供给哲学家思考的问题。
哲学本来就具有摧枯拉朽、激浊扬清的批判功能,运用在科学上,无疑能够为科学的发展扫清思想障碍,为新思想的涌现创造自由的气氛。
爱因斯坦道出了之所以需要发挥哲学批判功能的缘由:习用已久的有用概念很容易在我们那里造成一种权威性,使我们忘记了它们的世俗来源,而把它们当作某种一成不变的既定的东西。
这时,它们就会并被打上‘思维的必然性’、‘先验的给予’等等烙印。
科学前进的道路在很长一段时期内被这种错误弄得崎岖难行”,况且,“整个科学不过是日常思维的一种提炼。
正因为如此,物理学家的批判性的思考就不可能只限于检查他自己特殊领域里的概念。
如果他不去批判地考察一个更加困难得多的问题,即分析日常思维的本性问题,他就不能前进一步”。
从哲学对科学的解释功能、分析功能、批判功能不难看出,哲学直接或间接地作用于科学,因此科学家无论如何是无法离开哲学的,就像他在地面上无法摆脱地球的引力一样。
马赫言之凿凿:“哲学充分地包含在专门知识与知识巨大本体的关系的任何正确观点之中——这必然要求每一个专门研究者要有哲学。
在富有想象力的问题的形成中,在每一个包含是可以解决的还是不可解决的荒谬绝伦的东西的阐明中,都承认需要哲学。
2.几千年世界先进大国——中国为何没产生出现代科学?
(1)重技轻科,在长达一千多年的时间里,我们的技术一直遥遥领先于其他国家,但是我们的技术却十分落后。
大马士革学者阿尔珈兹在公元830年所说:“奇怪的是,希腊人对理论颇感兴趣但又不为实践所累,而中国人对实践兴味盎然但对理论则多有忽视。
”但是一味的强调经验并不能使我们长久地保持科技的领先。
众所周知,基础科学是一切科技持久发展的源泉,罗素就认为“没有希腊人创立的几何学,近代科学是不可能产生的”。
纵观我们国家古代的重大科技贡献,无不是来源于感官的经验的总结,极其缺乏科学上的逻辑推理等。
因此过于实用化的重技轻科使我们最终落后了。
(2)制度原因,李约瑟认为中国的官僚制度也阻碍了中国科技的发展。
为了巩固自己的统治,中国的官僚们创造性的举办科举,以此来拉拢杰出的人才来为统治阶级服务,也在客观上消除了他们反抗的隐患。
从科举制度本身上讲,它是一种合理的制度,以至于今天我们参加的种种考试也属于科举的演化,但是关键在于科举考试的内容只是限于四书五经之类,无半点科学与技术。
在此大环境下英杰们纷纷狂读圣人经典,而像西方那样去科研。
更可悲的是明清之后,八股横行,大众的思想也因此受到严重的束缚。
林毅夫就认为,中国古代没有一个像样的科学奖励机制导致了中国的落后。
于此相反,现代科技的起源地英国却是世界上最早建立有效产权制度的国家率先建立了鼓励创新和技术发明的专利保护制度。
1624 年英国颁布的《安娜法》,就是全世界第一部专利保护法。
随着《安娜法》的颁布,科技发明开始大量涌现,英国经济出现持续增长,那些发明家也因此从自己的发明成果中得到巨大的物质利益。
产权制度在社会进步过程中之所以有如此大的威力,是因为产权制度的演变具有既改变收入分配,又改变资源使用效率的潜在可能性,从而能影响人类选择行为的功能。
与之对比,在中国古代,从事与技术研究的都是工匠,他们不具备科学研究的条件社会地位很低,经常被那些具备科学研究条件的文人们所鄙视。
而这也更加剧了中国社会上的重技轻科,因为工匠们没有足够的收入来保证他们从事科学研究。
因此,现代的科学与技术很难在中国古代得到良好的发展。
(3)文化影响,长久以来,在中国占主导地位的是一直是儒家文化,虽然期间佛道两家也对中国文化都产生了深远的影响,但是不足以撼动儒家的正统地位。
而儒家文化强调学以致用、知行合一,而不务虚玄、无用的学问。
这种脚踏实地、注重实效的治学理念固然有其明智的一面,一定程度上促进了中华文明的发展,但也不乏急功近利、目光短浅的局限。
在中国古代官本位的思想下,最有用的就是可用来考取功名的四书五经,因此没有人会去研究科学;而知行合一往往会限制科学的发展,使人们更加偏向于实用化的技术。
儒家讲究等级观念,它一方面限制了中国民主的发展,而民主的环境才能最大程度上激发出人们的创造性;另一方面,等级观念也造就了中国的官场文化,形成了著名的官本位,于是乎中国的杰出人才大都热衷于考取功名,好光耀门楣,而那些一直在从事技术活动的工匠们则处于朝不保夕的地步。
儒家的中庸之道对于中国人探索自然也是大大不利。
杨振宁指出:“中国哲学里的中庸之道我认为对科学是不利的。
欧几里得的精神之一是打破砂锅问到底,中庸之道与这种精神是相背的。
”最根本的是,儒家思想强调“自省”,主张人应该反省自身,而不是去探索外物,它使中国人在根本上丧失了探索外界科学与技术的欲望。
正如冯友兰所说那样,中国人从自身来说不需要科学。
(4)地理位置,马克思主义学说认为经济基础决定上层建筑。
在古代的中国,最能决定经济基础的元素就应该是地理环境了。
在我们古代,中国的地理环境相对来说还是比较优良的。
在此孕育下的华夏文明形成了自己的农耕生活。
古代的小农经济是自己自足的,大家对商品交换的需求较少,因此导致中国形成了重农轻商思想。
历史已经表明,商业的发展会推动科技的发展。
更根本的是,在这种中国特色的小农经济下,我们形成了灿烂的中国文化,其中包括我们所熟知的儒家,道家,墨家等。
只是可惜在深受中国地理条件影响的发展下,我们选择了天人合一,顺从自然,而不像西方人那样去逐步地尝试改变自然。
另外,中国作为一个传统的内陆国,农业用的是灌溉体系,也需要一套官僚制度来加以保障,且思想容易僵化,也不利于科学的发展。
