《酸碱中和滴定》课件ppt
合集下载
高中化学酸碱中和滴定讲解17页PPT

61、奢侈是舒适的,否则就不是奢侈 。——CocoCha nel 62、少而好学,如日出之阳;壮而好学 ,如日 中之光 ;志而 好学, 如炳烛 之光。 ——刘 向 63、三军可夺帅也,匹夫不可夺志也。 ——孔 丘 64、人生就是学校。在那里,与其说好 的教师 是幸福 ,不如 说好的 教师是 不幸。 ——海 贝尔 65、接受挑战,就可以享受胜利的喜悦 。——杰纳勒 尔·乔治·S·巴顿
谢谢!Biblioteka 高中化学酸碱中和滴定讲解26、机遇对于有准备的头脑有特别的 亲和力 。 27、自信是人格的核心。
28、目标的坚定是性格中最必要的力 量泉源 之一, 也是成 功的利 器之一 。没有 它,天 才也会 在矛盾 无定的 迷径中 ,徒劳 无功。- -查士 德斐尔 爵士。 29、困难就是机遇。--温斯顿.丘吉 尔。 30、我奋斗,所以我快乐。--格林斯 潘。
《酸碱中和滴定》PPT课件

重视测定结果的复核。即重复实验测定2 次以上,取实验平均值。根据计算公式,求出 计算值。
课后作业:
1、完成课本p72页 四、五 两题在作业本上!
2、《优化设计》P84页 基础类
1、酸碱中和滴所用的仪器: 酸式滴定管、 碱式滴定管、 滴定管夹、 铁架台、 锥形瓶、 烧杯。
2、酸碱中和滴定所用的试剂 标准液(已知准确浓度的溶液)、 适当的指示剂(怎么选择?)
3、酸碱中和滴定的操作步骤
1、检查。
2、洗涤、润洗(2~3次)。 滴定前
3、加液、调节起始刻度。
的准备
4、加入指示剂。(并在瓶底衬一张白纸)
在反应时,酸和碱起反应的物质的量之比等于 它们的化学计量数之比。例如:
HCl + NaOH = NaCl + H2O
n(HCl) v (HCl) 1
=
=
n(NaOH) v(NaOH) 1
H2SO4 + 2NaOH = Na2 SO4 + 2H2O
n(H2SO4) = v (H2SO4) = 1
D
酸
碱
酚酞
(乙)
4.(2001天津12)在一支25 mL的酸式滴定管 中盛入0.lmol·L-1 HCl溶液,其液面恰好在5 mL的刻度处,若把滴定管中的溶液全部放入 烧杯中,然后以0.lmol·L-1 NaOH 溶液进行 中和.则所需 NaOH 溶液的体积
( A)
A.大于20 mL B.小于20 mL
c(NaOH )=
V[NaOH(aq)]
= 0.1032 mol/L× 0.0278 L
0.02500 L
= 0.1149mol/L
答:测得NaOH的物质的量浓度为0.1149mol/L。
课后作业:
1、完成课本p72页 四、五 两题在作业本上!
2、《优化设计》P84页 基础类
1、酸碱中和滴所用的仪器: 酸式滴定管、 碱式滴定管、 滴定管夹、 铁架台、 锥形瓶、 烧杯。
2、酸碱中和滴定所用的试剂 标准液(已知准确浓度的溶液)、 适当的指示剂(怎么选择?)
3、酸碱中和滴定的操作步骤
1、检查。
2、洗涤、润洗(2~3次)。 滴定前
3、加液、调节起始刻度。
的准备
4、加入指示剂。(并在瓶底衬一张白纸)
在反应时,酸和碱起反应的物质的量之比等于 它们的化学计量数之比。例如:
HCl + NaOH = NaCl + H2O
n(HCl) v (HCl) 1
=
=
n(NaOH) v(NaOH) 1
H2SO4 + 2NaOH = Na2 SO4 + 2H2O
n(H2SO4) = v (H2SO4) = 1
D
酸
碱
酚酞
(乙)
4.(2001天津12)在一支25 mL的酸式滴定管 中盛入0.lmol·L-1 HCl溶液,其液面恰好在5 mL的刻度处,若把滴定管中的溶液全部放入 烧杯中,然后以0.lmol·L-1 NaOH 溶液进行 中和.则所需 NaOH 溶液的体积
( A)
A.大于20 mL B.小于20 mL
c(NaOH )=
V[NaOH(aq)]
= 0.1032 mol/L× 0.0278 L
0.02500 L
= 0.1149mol/L
答:测得NaOH的物质的量浓度为0.1149mol/L。
酸碱中和滴定法3.ppt

NH4Cl弱酸性如果黄色变成橙色,可视为中 和滴定完全,此时HCl并不过量
酸滴定碱选酚酞,变色时PH=8.2为碱性,此时可能碱未 被完全中和。
③强碱滴定弱酸时用酚酞 NaOH + CH3COOH == CH3COONa + H2O
CH3COONa溶液为弱碱性,当酚酞由无色变 成粉红时,达到终点,碱不过量
解:V(HCl)=(30.51+30.50+30.49)/3=30.50ml
C(HCl)·V(HCl)=C(NaOH)·V(NaOH)
C(NaOH)=
C(HCl)·V(HCl) V(NaOH)
=
0.120×30.5 25
=0.146mol/L
三、酸碱中和滴定的主要仪器:
酸式滴定管 碱式滴定管 锥形瓶 容量瓶 滴定管夹 铁架台
3.不引起偏差的操作:
1)锥形瓶只用蒸馏水洗涤后,仍留有少量蒸 馏水;
2)量入待测液在锥形瓶内加入少量水稀释 待测液
(二) 杂质引起的误差
研究对象一般是在配制碱液时,所取固体碱中 混入了杂质。杂质不同所耗酸的体积不同.(等 质量的杂质与等质量的碱比较中和酸的能力)
1.用已知物质的量浓度的标准酸滴定未知物质的 量浓度的碱溶液(甲基橙作指示剂)
碱性:弱酸与强碱中和
例如:H3PO4+3NaOH==Na3PO4+3H2O 1 :3 即完全中和,,但溶液的PH>7 故酸碱完全中和指的是酸碱刚好完全反 应,n(H)=n(OH),而不是PH=7
二、酸碱中和滴定的定义及意义:
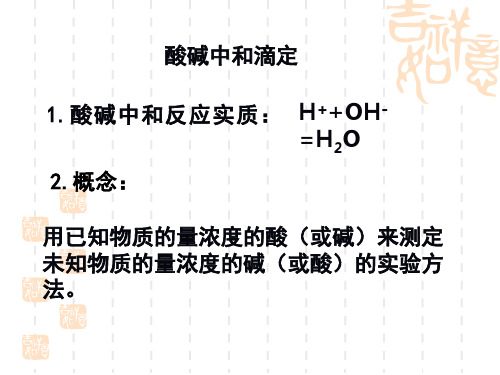
1、中和滴定的定义 用已知物质的量浓度的酸(或碱)来测定未 知物质的量浓度的碱(或酸)的方法叫酸碱 中和滴定
用Na2CO3溶液测定盐酸的量浓度时,如果杂质中含 NaHCO3,K2CO3,NaCl等杂质,所耗碱液体积偏多, 测出酸浓度偏高
第四节酸碱中和滴定PPT课件

❖强酸与弱碱相互滴定时,应选用甲基橙。 ❖强碱与弱酸相互滴定时,应选用酚酞。
中和滴定——主要实验仪器
量取液体常用仪器:量筒、移液管、滴定管
❖量筒:粗量仪,10mL量筒最小分刻度为 0.1mL ,读数精确到0.1mL,无“O”刻度 ❖移液管:精量仪,读数精确到0.01mL 准确量取一定量的试液(中和滴定量取待测液) ❖滴定管:精量仪 ▪标有温度、容积、“0”刻度在最高点 ▪常用规格:25mL、50mL ▪最小分刻度:0.1mL,读数精确到0.01mL (精量仪可估读一位,粗量仪不能估读)
中和滴定实验步骤
四、滴定
• 滴定管夹在夹子上,保持垂直 • 右手持锥形瓶颈部,向同一方向作圆周运动,
而不是前后振动 • 左手控制活塞(或玻璃球),注意不要把活塞
顶出 • 滴加速度先快后慢,直至指示剂颜色突变 • 滴定过程右手摇动锥形瓶,眼睛注视锥形瓶内
溶液颜色变化 • 滴定终点达到后,半分钟颜色不变,再读数
1、两体积如何准确测定 2、判断中和反应恰好完成,即达到终点
1、需要能准确表示所加溶液体积的仪器 ——滴定管
2、需要能指示酸碱反应完全的物质 ——酸碱指示剂
酸碱指示剂的选择
原则:为减少误差,变色点与等当点尽可能接近
讨论:强酸和强碱完全中和时,溶液pH应为7,但
甲基橙与酚酞的变色点不等于7,对实验有无误差? 为什么可将滴定终点当成完全中和的点?
▪种类: 酸式滴定管——下端玻璃活塞 碱式滴定管——下端连接一橡皮管(内有玻 璃小球控制流速)下端尖嘴玻璃管
、Na2SiO3) 碱式滴定管——可盛放碱性物质或无氧化性的物质
思考:为什么碱不能盛放在酸式滴定管, KMnO4不能用碱式滴定管盛放?
结论:常用甲基橙与酚酞
中和滴定——主要实验仪器
量取液体常用仪器:量筒、移液管、滴定管
❖量筒:粗量仪,10mL量筒最小分刻度为 0.1mL ,读数精确到0.1mL,无“O”刻度 ❖移液管:精量仪,读数精确到0.01mL 准确量取一定量的试液(中和滴定量取待测液) ❖滴定管:精量仪 ▪标有温度、容积、“0”刻度在最高点 ▪常用规格:25mL、50mL ▪最小分刻度:0.1mL,读数精确到0.01mL (精量仪可估读一位,粗量仪不能估读)
中和滴定实验步骤
四、滴定
• 滴定管夹在夹子上,保持垂直 • 右手持锥形瓶颈部,向同一方向作圆周运动,
而不是前后振动 • 左手控制活塞(或玻璃球),注意不要把活塞
顶出 • 滴加速度先快后慢,直至指示剂颜色突变 • 滴定过程右手摇动锥形瓶,眼睛注视锥形瓶内
溶液颜色变化 • 滴定终点达到后,半分钟颜色不变,再读数
1、两体积如何准确测定 2、判断中和反应恰好完成,即达到终点
1、需要能准确表示所加溶液体积的仪器 ——滴定管
2、需要能指示酸碱反应完全的物质 ——酸碱指示剂
酸碱指示剂的选择
原则:为减少误差,变色点与等当点尽可能接近
讨论:强酸和强碱完全中和时,溶液pH应为7,但
甲基橙与酚酞的变色点不等于7,对实验有无误差? 为什么可将滴定终点当成完全中和的点?
▪种类: 酸式滴定管——下端玻璃活塞 碱式滴定管——下端连接一橡皮管(内有玻 璃小球控制流速)下端尖嘴玻璃管
、Na2SiO3) 碱式滴定管——可盛放碱性物质或无氧化性的物质
思考:为什么碱不能盛放在酸式滴定管, KMnO4不能用碱式滴定管盛放?
结论:常用甲基橙与酚酞
酸碱中和滴定课件ppt课件

.
.
三、指示剂的选择:
通常指示剂的变色范围尽量与滴定终点的溶液酸碱性一致,在 强酸强碱的滴定时可以用__酚__酞____或__甲__基__橙____;强碱滴定弱酸, 最终生成的是强碱弱酸盐,滴定终点时溶液呈___碱__性___,选择 _酚__酞_____做指示剂;而强酸滴定弱碱时,则选_甲__基__橙___做指示剂。
⑷普通滴定管的精密度. 为—0—.—0—1— mL
⑸滴定管使用前,应检查滴定管下端是 否漏液和存在气泡
滴定管下端有气泡,必须排除; 排除方法为:
⑹滴定管读数必须—平—视——
刻度线
.
4、操作:
(1)滴前准备:
①检查
漏不漏 活塞是否灵活
橡皮,玻璃球
②洗涤仪器
滴定管: 自来水,蒸馏水,盛装液(润洗) 锥形瓶: 自来水,蒸馏水 (不用盛装液洗)
⑵碱式滴定管: 不能盛放酸性溶液和强氧化性溶液
.
⑶但并滴定未管在的—最—“上——0方—”刻,度滴线定在管上—上—方的——刻— 度由上到下,读数———由——小—到—,大 最大刻度线在滴定管———下—方。 想一想:量筒的构造与滴定管 有何不同?
量筒—没—有—“0”刻度线,其刻度由下到 上读数—由——小—到——大—,最大刻度线在 其—上——方—。
读出
实
值
际
值
滴定后
.
三、操作出现问题
⒈盛标准液的滴定管漏液;偏大 ⒉盛待测液的滴定管滴前尖嘴部分有气泡,终了无气泡 偏小
(或前无后有); 偏大 ⒊振荡锥形瓶时,不小心有待测液溅出; 偏小
⒋滴定过程中,将标准液滴到锥形瓶外; 偏大 ⒌快速滴定后立即读数; 偏大
四、含杂质
1、在配制待测氢氧化钠溶液过程中,称取一定质量的氢氧化钠
.
三、指示剂的选择:
通常指示剂的变色范围尽量与滴定终点的溶液酸碱性一致,在 强酸强碱的滴定时可以用__酚__酞____或__甲__基__橙____;强碱滴定弱酸, 最终生成的是强碱弱酸盐,滴定终点时溶液呈___碱__性___,选择 _酚__酞_____做指示剂;而强酸滴定弱碱时,则选_甲__基__橙___做指示剂。
⑷普通滴定管的精密度. 为—0—.—0—1— mL
⑸滴定管使用前,应检查滴定管下端是 否漏液和存在气泡
滴定管下端有气泡,必须排除; 排除方法为:
⑹滴定管读数必须—平—视——
刻度线
.
4、操作:
(1)滴前准备:
①检查
漏不漏 活塞是否灵活
橡皮,玻璃球
②洗涤仪器
滴定管: 自来水,蒸馏水,盛装液(润洗) 锥形瓶: 自来水,蒸馏水 (不用盛装液洗)
⑵碱式滴定管: 不能盛放酸性溶液和强氧化性溶液
.
⑶但并滴定未管在的—最—“上——0方—”刻,度滴线定在管上—上—方的——刻— 度由上到下,读数———由——小—到—,大 最大刻度线在滴定管———下—方。 想一想:量筒的构造与滴定管 有何不同?
量筒—没—有—“0”刻度线,其刻度由下到 上读数—由——小—到——大—,最大刻度线在 其—上——方—。
读出
实
值
际
值
滴定后
.
三、操作出现问题
⒈盛标准液的滴定管漏液;偏大 ⒉盛待测液的滴定管滴前尖嘴部分有气泡,终了无气泡 偏小
(或前无后有); 偏大 ⒊振荡锥形瓶时,不小心有待测液溅出; 偏小
⒋滴定过程中,将标准液滴到锥形瓶外; 偏大 ⒌快速滴定后立即读数; 偏大
四、含杂质
1、在配制待测氢氧化钠溶液过程中,称取一定质量的氢氧化钠
酸碱中和滴定ppt课件

作指示剂 B.溶液呈中性,只能选用石蕊作指示剂 C.溶液呈碱性,可选用 甲基橙或酚酞作指示剂 D.溶液呈碱性,只能选用酚酞作指示剂
四、实验步骤
1.滴定前准备
2.滴定操作 用左手控制滴定管活塞,逐滴放出溶液,右手摇动锥形瓶, 两眼注视锥形瓶内溶液颜色变化。
控制活塞
摇动锥形瓶
锥形瓶 内溶液颜色变化
3.终点判断 当滴入最后半滴×××标准溶液后,溶液由××色变成××色,
【课堂练习】
1.用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,从下表中选出正确 选项( C )
序号
① ② ③ ④
锥形瓶中 滴定管中 选用指示 选用滴定
溶液
溶液
剂
管
碱
酸
石蕊
甲
酸
碱
酚酞
甲
碱
酸
甲基橙
甲
酸
碱
酚酞
乙
A.①② B.②③ C.③④ D.②④
2.用0.10mol/LNaOH溶液滴定未知浓度的CH3COOH溶液,恰好完全反应 时,下列叙述中正确的是( D ) A.溶液呈中性,可选用甲基橙或酚酞
带玻璃球 的橡胶管
注意: 酸式滴定管:酸性、强氧化性试剂 碱式滴定管:碱性试剂
【课堂练习】
1.下列所述仪器“0”刻度位置正确的是( B )
A.在量筒的上端
B.在滴定管上端
C.容量瓶上端
D.在托盘天平刻度尺的右边2.50ml的滴定管盛有
溶液,液面恰好在20.0处,若把滴定管中溶液全部
C 排出,则体积( )
液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;D.取标准KOH
溶液注入碱式滴定管至“0”刻度以上2~3 mL;E.调节液面至“0”或“0”以
四、实验步骤
1.滴定前准备
2.滴定操作 用左手控制滴定管活塞,逐滴放出溶液,右手摇动锥形瓶, 两眼注视锥形瓶内溶液颜色变化。
控制活塞
摇动锥形瓶
锥形瓶 内溶液颜色变化
3.终点判断 当滴入最后半滴×××标准溶液后,溶液由××色变成××色,
【课堂练习】
1.用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,从下表中选出正确 选项( C )
序号
① ② ③ ④
锥形瓶中 滴定管中 选用指示 选用滴定
溶液
溶液
剂
管
碱
酸
石蕊
甲
酸
碱
酚酞
甲
碱
酸
甲基橙
甲
酸
碱
酚酞
乙
A.①② B.②③ C.③④ D.②④
2.用0.10mol/LNaOH溶液滴定未知浓度的CH3COOH溶液,恰好完全反应 时,下列叙述中正确的是( D ) A.溶液呈中性,可选用甲基橙或酚酞
带玻璃球 的橡胶管
注意: 酸式滴定管:酸性、强氧化性试剂 碱式滴定管:碱性试剂
【课堂练习】
1.下列所述仪器“0”刻度位置正确的是( B )
A.在量筒的上端
B.在滴定管上端
C.容量瓶上端
D.在托盘天平刻度尺的右边2.50ml的滴定管盛有
溶液,液面恰好在20.0处,若把滴定管中溶液全部
C 排出,则体积( )
液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;D.取标准KOH
溶液注入碱式滴定管至“0”刻度以上2~3 mL;E.调节液面至“0”或“0”以
酸碱中和滴定PPT精品课件

(2)滴入2滴酚酞试液,将锥形瓶置于酸式滴定管下方 ,并在瓶底衬一张白纸。
7、滴定:左手___控__制__酸__式__滴__定__管__活__塞__________,右手 __拿__住__锥__形__瓶__瓶__颈__,__边__滴__入__盐___酸__,__边__不__断__顺__时__针__方__向__摇_动, 眼睛__要__始__终__注__视__锥__形__瓶__溶__液__的__颜__色__变__化__。_______
五大湖剖面示意图
(点击图片观看录像)
• 五大湖各水面高低不同,由西向南逐级 降低,伊利湖与安大略湖之间的有将近
100米的落差,并有一个断层陡岸,从 而形成了世界著名的尼亚加拉瀑布。
北美的气候
芝加哥气温曲 线降水柱状图
• 温带大陆性 为主的气候
地形对气候的影响
(点击图片观看录像)
中央电教馆资源中心制作
2004.3
苏必利尔湖
• 苏必利是世界上最大的淡水湖,它 比我国的鄱阳湖要大22倍。
休伦湖
伊利湖
安大略湖
密歇根湖
圣劳伦斯河
尼亚加拉瀑布风光
• 尼亚加拉瀑布分为南北两段,北端呈半环状,名马蹄瀑布, 属加拿大;南端称亚美利加瀑布,属美国。美、加两国均 在瀑布之上修建了大型水电站。
尼亚加拉瀑布风光 2
(2)溶液使指示剂改变颜色,发生的化学变 化。指示剂滴加太多比将消耗一部分酸碱溶液 (一般为1~2滴)。
3、pH试纸(定量测定)
(1)成分:含有多种指示剂
(2)本身颜色:淡黄色
(3)操作:用镊子取一小块pH试纸放在洁 净的表面皿或玻璃片上,然后用玻璃棒沾取 少量待测液点在试纸中央,试纸显色后再与 标准比色卡比较,即知溶液的pH值。
7、滴定:左手___控__制__酸__式__滴__定__管__活__塞__________,右手 __拿__住__锥__形__瓶__瓶__颈__,__边__滴__入__盐___酸__,__边__不__断__顺__时__针__方__向__摇_动, 眼睛__要__始__终__注__视__锥__形__瓶__溶__液__的__颜__色__变__化__。_______
五大湖剖面示意图
(点击图片观看录像)
• 五大湖各水面高低不同,由西向南逐级 降低,伊利湖与安大略湖之间的有将近
100米的落差,并有一个断层陡岸,从 而形成了世界著名的尼亚加拉瀑布。
北美的气候
芝加哥气温曲 线降水柱状图
• 温带大陆性 为主的气候
地形对气候的影响
(点击图片观看录像)
中央电教馆资源中心制作
2004.3
苏必利尔湖
• 苏必利是世界上最大的淡水湖,它 比我国的鄱阳湖要大22倍。
休伦湖
伊利湖
安大略湖
密歇根湖
圣劳伦斯河
尼亚加拉瀑布风光
• 尼亚加拉瀑布分为南北两段,北端呈半环状,名马蹄瀑布, 属加拿大;南端称亚美利加瀑布,属美国。美、加两国均 在瀑布之上修建了大型水电站。
尼亚加拉瀑布风光 2
(2)溶液使指示剂改变颜色,发生的化学变 化。指示剂滴加太多比将消耗一部分酸碱溶液 (一般为1~2滴)。
3、pH试纸(定量测定)
(1)成分:含有多种指示剂
(2)本身颜色:淡黄色
(3)操作:用镊子取一小块pH试纸放在洁 净的表面皿或玻璃片上,然后用玻璃棒沾取 少量待测液点在试纸中央,试纸显色后再与 标准比色卡比较,即知溶液的pH值。
酸碱中和滴定ppt课件.ppt

不同点有哪些认识?使用它们注意哪些事项?
问题导学
课前预习导学
课堂合作探究
KEQIAN YUXI DAOXUE
KETANG HEZUO TANJIU
当堂检测
答案:酸式滴定管:取酸液或强氧化性溶液,特征:玻璃活塞。碱式滴
定管:取碱液,特征:内有玻璃球的橡皮管。注意点:a.检查是否漏水,玻璃
活塞用左手指内扣转动。b.滴定前要洗涤:洗涤剂洗—自来水洗—蒸馏
课堂合作探究
KEQIAN YUXI DAOXUE
KETANG HEZUO TANJIU
预习引导
(4)取:从碱式滴定管中放出 25.00 mL 氢氧化钠溶液于锥形瓶中,
滴入 2 滴酚酞溶液,将锥形瓶置于酸式滴定管下方,并在瓶底衬一张白
纸。
(5)滴定:左手控制活塞,右手振荡锥形瓶,边滴入盐酸,边不断摇动锥
内含少量的氢氧化钾,用标准盐酸溶液进行滴定(偏低)
(2)同上情况,若氢氧化钠中含有少量的碳酸钠,结果如何(偏低)
问题导学
课前预习导学
课堂合作探究
KEQIAN YUXI DAOXUE
KETANG HEZUO TANJIU
当堂检测
迁移与应用
例 3 用标准盐酸滴定未知浓度的 NaOH 溶液时,若测得的结
目标导航
课前预习导学
课堂合作探究
KEQIAN YUXI DAOXUE
KETANG HEZUO TANJIU
预习引导
答案:①不能用量筒代替滴定管,因为计量的精确度不同。在量取液
体的体积时,量筒只能读至 0.1 mL,而滴定管可读至 0.01 mL。用滴定管
测量时有测定值的精确度较高,读数方便,操作简单等优点。
(4)滴定操作时,有少量盐酸滴于锥形瓶外(偏高)
问题导学
课前预习导学
课堂合作探究
KEQIAN YUXI DAOXUE
KETANG HEZUO TANJIU
当堂检测
答案:酸式滴定管:取酸液或强氧化性溶液,特征:玻璃活塞。碱式滴
定管:取碱液,特征:内有玻璃球的橡皮管。注意点:a.检查是否漏水,玻璃
活塞用左手指内扣转动。b.滴定前要洗涤:洗涤剂洗—自来水洗—蒸馏
课堂合作探究
KEQIAN YUXI DAOXUE
KETANG HEZUO TANJIU
预习引导
(4)取:从碱式滴定管中放出 25.00 mL 氢氧化钠溶液于锥形瓶中,
滴入 2 滴酚酞溶液,将锥形瓶置于酸式滴定管下方,并在瓶底衬一张白
纸。
(5)滴定:左手控制活塞,右手振荡锥形瓶,边滴入盐酸,边不断摇动锥
内含少量的氢氧化钾,用标准盐酸溶液进行滴定(偏低)
(2)同上情况,若氢氧化钠中含有少量的碳酸钠,结果如何(偏低)
问题导学
课前预习导学
课堂合作探究
KEQIAN YUXI DAOXUE
KETANG HEZUO TANJIU
当堂检测
迁移与应用
例 3 用标准盐酸滴定未知浓度的 NaOH 溶液时,若测得的结
目标导航
课前预习导学
课堂合作探究
KEQIAN YUXI DAOXUE
KETANG HEZUO TANJIU
预习引导
答案:①不能用量筒代替滴定管,因为计量的精确度不同。在量取液
体的体积时,量筒只能读至 0.1 mL,而滴定管可读至 0.01 mL。用滴定管
测量时有测定值的精确度较高,读数方便,操作简单等优点。
(4)滴定操作时,有少量盐酸滴于锥形瓶外(偏高)
酸碱中和滴定实验ppt课件.ppt
C(酸)×V(酸) =化学计量数之比 C(碱)×V(碱)
讨论:运用这种方法的关键问题是什么?
4.关键: ①准确测出参加反应的两种溶液的体积。
②准确判断中和反应是否恰好进行完全。
思考:测定溶液体积的仪器有哪些? 量筒 滴定管:酸式滴定管和碱式滴定管
想一想:
1、如何判断酸式滴定管和碱式滴定管?
2、量筒和滴定管的“0”刻度位置是否一致?
思考:如果是强碱和弱酸中和滴定又该选择 什么指示剂?
结论:根据达到终点后溶液的酸碱性来选 变色范围尽可能与所生成盐的酸碱性范围一致 浅变深更好
练一练
1、酸碱恰好完全中和时,它们的( D)一定相等。
A、质量
B、物质的量
C、物质的量浓度
D、H+和OH-的物质的量
2、物质的量浓度相同、体积也相同的一元酸和一元
碱相互中时,溶液显什么性( D )
A、显酸性B、显碱性C Nhomakorabea显中性D、酸碱性无法判断
练一练
3.用已知物质的量浓度的NaOH溶液滴定未 知物质的量浓度的HCl溶液,一般选用(酚酞 ) 作指示剂,用已知物质的量溶液的HCl溶液滴 定未知物质的量浓度的NaOH溶液,一般选用 (甲基)橙作指示剂。
5、实验仪器
解: HCl 1mol
+
NaOH = NaCl+ H2O
1mol
c(HCl)•V[HCl(aq)] c(NaOH)•V[NaOH(aq)]
c(NaOH)= c(HCl ) •V[HCl (aq)] 1mol
V[NaOH (aq)] 1mol
= 0.1100mol / L 0.02900L
0.02300L
V[NaOH (aq)] 1mol
讨论:运用这种方法的关键问题是什么?
4.关键: ①准确测出参加反应的两种溶液的体积。
②准确判断中和反应是否恰好进行完全。
思考:测定溶液体积的仪器有哪些? 量筒 滴定管:酸式滴定管和碱式滴定管
想一想:
1、如何判断酸式滴定管和碱式滴定管?
2、量筒和滴定管的“0”刻度位置是否一致?
思考:如果是强碱和弱酸中和滴定又该选择 什么指示剂?
结论:根据达到终点后溶液的酸碱性来选 变色范围尽可能与所生成盐的酸碱性范围一致 浅变深更好
练一练
1、酸碱恰好完全中和时,它们的( D)一定相等。
A、质量
B、物质的量
C、物质的量浓度
D、H+和OH-的物质的量
2、物质的量浓度相同、体积也相同的一元酸和一元
碱相互中时,溶液显什么性( D )
A、显酸性B、显碱性C Nhomakorabea显中性D、酸碱性无法判断
练一练
3.用已知物质的量浓度的NaOH溶液滴定未 知物质的量浓度的HCl溶液,一般选用(酚酞 ) 作指示剂,用已知物质的量溶液的HCl溶液滴 定未知物质的量浓度的NaOH溶液,一般选用 (甲基)橙作指示剂。
5、实验仪器
解: HCl 1mol
+
NaOH = NaCl+ H2O
1mol
c(HCl)•V[HCl(aq)] c(NaOH)•V[NaOH(aq)]
c(NaOH)= c(HCl ) •V[HCl (aq)] 1mol
V[NaOH (aq)] 1mol
= 0.1100mol / L 0.02900L
0.02300L
V[NaOH (aq)] 1mol
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
的三 构、 造滴 特定 点管
应读到小数 点后几位?
两位
滴定管使用注意事项:
1、酸式滴定管可以盛装酸溶液或氧化性溶液(如 酸性高锰酸钾溶液) 2、碱式滴定管只能盛碱液,不能盛酸溶液或氧化 性溶液
仪器的使用
仪器的使用
答案: 25.60mL
3、酸碱中和滴定的操作步骤
1、检查。 2、洗涤、润洗(2~3次)。 滴定前 的准备 3、加液、调节起始刻度。 4、加入指示剂。(并在瓶底衬一张白纸) 5、滴定过程 6、数据处理
突跃范围
19.98mL
4.3 3.3 2.28
25
30
35
40
45
加入NaOH溶液的体积V(mL)
“突跃”的存在为准确判断终点提供了方便
红
橙
黄
红
紫
蓝
无色
粉红
红
指示剂的选择原则:
选择终点时指示剂的颜色变化明显灵敏、易观察。 强碱滴定强酸,强酸滴定强碱,酚酞、甲基橙 均可 强酸滴定弱碱:甲基橙 强碱滴定弱酸:酚酞
1mol
OH- = H2O
例题 : 用 0.1 0 3 2 mol/L 的 HCl 溶 液 滴 定
25.00mL 未知浓度的 NaOH 溶液, 滴定 完成时,用去HCl溶液27.84mL。通过中 和滴定测得 NaOH 溶液的物质的量浓度 是多少?
【思维探究】:要想测定的浓度结果更准确,你 认为实验的关键是什么?
2.在一支25 mL的酸式滴定管中盛入0.lmol/L的HCl 溶液,其液面恰好在5 mL的刻度处,若把滴定管中的 溶液全部放入烧杯中,然后以0.lmol/L NaOH 溶液 进行中和,则所需 NaOH 溶液的体积( A ) A.大于20 mL B.小于20 mL C.等于20 mL D.等于5 mL
因为石蕊试剂变化不灵敏,所以一般不用石蕊作中 和滴定的指示剂。
二、酸碱中和滴定
1、酸碱中和滴所用的仪器: 酸式滴定管、 碱式滴定管、 滴定管夹、 铁架台、 锥形瓶、 烧杯。 2、酸碱中和滴定所用的试剂 ⑴标准液(已知准确 浓度的溶液)、待测2.刻度 3.操作 4.读数
4、计算滴定结果(A强酸B强碱)。
操作2~3次取平均值代入公式计算:
次 待测液体积 (L) 数 1 2 标准液体积(L) 滴定前 滴定后 实际 平均值
cB =
cAVA VB
cA=
c BVB VA
四、酸碱中和滴定中的误差分析 产生误差的途径:操作不当,滴定终点判 断不准等。
根据原理:待测量的计算式。
4、下列实验操作中错误的( C ) A.分液时,分液漏斗中下层液体从下口放出,上 层液体从上口倒出 B.蒸馏时,应使温度计水银球靠近蒸烧瓶支管口 C.滴定时,左手控制滴定管活塞,右手握持锥形 瓶,边滴边振荡,眼睛注视滴定管中的液面 D.称量时,称量物放在称量纸上,置于托盘天平 的大盘,砝码放在托盘天平的右盘中
c标· V标 c待= V待
c(标) 误差分析:c(待)= V(待) V(标)
在分析过程中将误差归结到V(标)上 一.洗涤①未用标准液润洗滴定管( 偏高 ) ②未用待测液润洗滴定管( 偏低 ) ③用待测液润洗锥形瓶( 偏高 ) 二.漏溅液体 ①漏液 漏滴 ( 偏高 ) ②锥形瓶中待测液溅出( 偏低 )
三.气泡处理不当: ①装标准液的滴定管尖嘴处有气泡( 偏高 ) ②装待测液的滴定管尖嘴处有气泡( 偏低 )
四.观察时视线有误:
滴定前 俯视 仰视 滴定后 仰视 俯视 结果 偏高
偏低
五.终点判断有误: 偏低 ①滴定不足( ) ②滴定过量(偏高 )
【当堂检测】
1、下列叙述仪器“0”刻度位置正确的是( B) A.在量筒的上端 B.在滴定管上端 C 在托盘天平刻度尺的正中 D 在托盘天平刻度尺的右边
3、下列是一段关于中和滴定的实验叙述: ⑴ 取一锥形瓶,用待测NaOH溶液润洗两次; ⑵ 在锥形瓶中放入25.00 ml待测液NaOH溶液; ⑶ 加入几滴石蕊试剂作指示剂; ⑷ 取一支酸式滴定管,洗涤干净后; ⑸ 直接往其中注入标准酸溶液,进行滴定; ⑹ 左手旋转滴定管的玻璃活塞,右手不停摇动锥形瓶 ⑺ 两眼注视着滴定管内盐酸溶液液面下降,直至滴定 终点; 其中错误的是( ) A.⑷⑹⑺ B.⑴⑸⑹⑺ D C.⑶⑸⑺ D.⑴⑶⑸⑺
5、 用已知浓度的NaOH溶液测定某 H2SO4溶液的浓度,参考右图,从下表中 选出正确选项( cD )
锥形瓶中 的溶液 A B C D 碱 酸 碱 酸 滴定管 中的溶 液 酸 碱 酸 碱 选用指 示剂 石蕊 酚酞 甲基橙 酚酞 选用滴 定管 (乙) (甲) (甲) (乙)
3、酸碱中和滴定的关键
(1)准确测量参加反应的两种溶液的体积
需要能在滴加溶液时准确表示所加溶 液体积的仪器——滴定管
(2)准确判断中和反应是否恰好完全反应 需要能指示酸碱反应完全的物质 ——酸碱指示剂
14 12 10 12.5 11.7 10.7 9.7
20.02mL
8
溶 液 的 pH
7 6 4 2 1 0 0 5 10 15 20
学习目标
了解实验原理及指示剂的选择
掌握实验操作及仪器 能进行误差分析
一、酸碱中和滴定原理。 1、 定义:用已知物质的量浓度的酸或 碱(标准溶液)来测定未知物质的量浓度 的碱或酸(待测溶液或未知溶液)的方法 叫做酸碱中和滴定。 2、 原理:以酸碱中和反应为基础,
1mol
H+
+
在滴定达到终点(即酸碱恰好反应)时: 有 n(H+) = n(OH-)
