2018年学习氨基酸课件PPT
合集下载
氨基酸(本)ppt课件

脱氨 NH3 脱羧 胺
碳链降解
其它有害物质
(1)脱羧生成胺
His 组胺 Phe 苯乙胺 Trp 色胺 Tyr 酪胺
腐胺 尸胺
胺类 门静脉吸收 入肝(单胺氧化酶或 二胺氧化酶)
-羟化
胺类
假神经递质
相应的醛
(苯乙醇胺、
-羟酪胺)
相应的酸
假神经递质,替代多巴释放, 解毒
大脑发生抑制。
(2)脱氨生成氨 • RCH(NH2)COOH RCH2COOH+NH3
-谷氨 酸环化 转移酶
氨基酸 COOH
H 2N C H R
COOH
O
R
H 2N CH
半胱氨酰甘氨酸
R 氨基酸
γ-谷 氨酰 基转
(Cys-Gly)
肽酶
5-氧脯氨酸
5-氧脯
ATP
移酶
谷胱甘肽 甘氨酸 GSH
半胱氨酸 -谷氨酰
氨酸酶 谷氨酸
ADP+Pi
ADP+Pi
谷胱甘肽 合成酶
半胱氨酸 合成酶
ATP
ATP
食物蛋白质消 化吸收 组织蛋白质分解
合成非必需氨 基酸
氨基酸 代谢库
合成蛋白质和 多肽
脱氨基作用
脱羧基作用
转变为其他含 氮物
氨基酸的分解代谢概况
特殊分解代谢→ 特殊侧链的分 解代谢
脱羧基作用→ 一般分解代谢
脱氨基作用→
CO2 胺 NH3 -酮酸
氨基酸的脱羧基作用
氨基酸的 脱氨基作用
O
脱氨基作用概述
意义:协助诊断疾病
转氨基作用特点:
反应可逆 转氨酶:种类多、分布广、活性强 辅酶:B6-P
转氨基作用的机制
18氨基酸和肽共38页PPT资料

H2N C CH2CHCOO O NH3
HO
CH2 CHCOO NH 3
天冬氨酸(Aspartic acid) -氨基丁二酸
天 Asp D
HOOCC2HCHCOO NH3
谷氨酸(-氨基戊二酸)
谷
Glu E
HOOC2CH2CHCOO
Glutamic acid
NH3
12.04.2020
20种编码氨基酸的名称和结构式(*为必需氨基酸)
17.1 氨基酸的结构、分类和命名
17.1.1 氨基酸的结构
氨基酸(Amino Acid)是一类取代羧酸,可视为羧 酸分子中烃基上的氢原子被氨基取代的一类产物。 根据氨基和羧基在分子中相对位置的不同,氨基酸
可分为-,-,-,…,-氨基酸。
水解
蛋白质
多肽
H+ 或OH - 或酶
完全水解 α-氨基酸
12.04.2020
天然氨基酸更常用的是俗名,即根据其 来源和特性命名。
12.04.2020
记忆以下氨基酸:
名称 甘氨酸
中文 英文 缩写 缩写
甘 Gly,G
丙氨酸 丙 Ala,A
半胱氨酸 半胱 Cys,C
谷氨酸 谷 Glu,E
赖氨酸
12.04.2020
赖 Lys,K
结构式
_
CH2 COO
+NH3
_
H3C CHCOO
+NH 3
自然界发现的氨基酸有数百种,但由天然
蛋白质完全水解生成的氨基酸中只有20种与核
酸中的遗传密码相对应,用于在核糖体上进行
多肽合成,这20种氨基酸称为编码氨基酸
(coding amino acid)。它们在化学结构上具有
3.1 氨基酸ppt课件

(3)酶水解 一种或多种酶水解 优点:不引起消旋作用;不破坏氨基酸; 缺点:水解不完全;耗时
LOGO
第二节 理化性质与分类
1 光谱性质 (1)紫外吸收
原因:含共轭双键 最大吸收峰:色氨酸、 酪氨酸在 280 nm 附近 应用:分析蛋白质含量 (2)核磁共振波谱
LOGO
2 氨基酸的酸碱化学
R CH COOH NH2
H C
在 弱 碱 中
COOH
R NO 2
DNFB
O2N
HH
-
N C COOH+F
R NO 2
DNP-氨基酸(黄色)
4 Edman反应:与苯异硫氰酸酯形成苯氨基硫甲酰衍生物,后者在硝基甲烷中 与酸反应;脱水形成苯乙内酰硫脲,可测定N端氨基酸
H NCS+H 2NCCO在 O 弱 碱 中 H
PITC
R
H HO
COOH(弱酸型) 阴离子交换树脂:活性基团是碱性的,如季胺基- N+(CH3)3OH-
二 电泳 电泳:带电颗粒/分子在电场中向带相反电荷的电极移动的现象。
LOGO
LOGO
LOGO
LOGO
1 P155 第5题; 2 P156 第15题
检查问题
LOGO
三 α-氨基与α-羧基参加的反应
1 茚三酮反应 氨基酸与茚三酮水合物共热,可形成蓝紫色化合物,最大吸收峰在 570nm,吸收峰值与氨基酸含量成正比。 用于定量分析氨基酸
例外:Pro黄色;Asn棕色
→ 紫色复合物
2 成肽反应
O +
NH2-CH-C H OH
甘氨酸
O NH-CH-C
H H OH
甘氨酸
RCH CO HO
LOGO
第二节 理化性质与分类
1 光谱性质 (1)紫外吸收
原因:含共轭双键 最大吸收峰:色氨酸、 酪氨酸在 280 nm 附近 应用:分析蛋白质含量 (2)核磁共振波谱
LOGO
2 氨基酸的酸碱化学
R CH COOH NH2
H C
在 弱 碱 中
COOH
R NO 2
DNFB
O2N
HH
-
N C COOH+F
R NO 2
DNP-氨基酸(黄色)
4 Edman反应:与苯异硫氰酸酯形成苯氨基硫甲酰衍生物,后者在硝基甲烷中 与酸反应;脱水形成苯乙内酰硫脲,可测定N端氨基酸
H NCS+H 2NCCO在 O 弱 碱 中 H
PITC
R
H HO
COOH(弱酸型) 阴离子交换树脂:活性基团是碱性的,如季胺基- N+(CH3)3OH-
二 电泳 电泳:带电颗粒/分子在电场中向带相反电荷的电极移动的现象。
LOGO
LOGO
LOGO
LOGO
1 P155 第5题; 2 P156 第15题
检查问题
LOGO
三 α-氨基与α-羧基参加的反应
1 茚三酮反应 氨基酸与茚三酮水合物共热,可形成蓝紫色化合物,最大吸收峰在 570nm,吸收峰值与氨基酸含量成正比。 用于定量分析氨基酸
例外:Pro黄色;Asn棕色
→ 紫色复合物
2 成肽反应
O +
NH2-CH-C H OH
甘氨酸
O NH-CH-C
H H OH
甘氨酸
RCH CO HO
高中化学《氨基酸》公开课PPT课件

氨基酸
你知道氨基酸与蛋白质的关系?
蛋白质在一定条件下水解生成氨基酸; 氨基酸通过肽键相互连接成蛋白质。
迄今人类在自然界已发现数百种氨基酸,但是从
蛋白质水解得到的氨常基见酸,的最氨常基见酸的大约有20种
(1) 甘氨酸
(2) 丙氨酸
CH2—COOH
CH3—CH—COOH
NH2 (3) 谷氨酸 HOOC—(CH2)2—CH—COOH
NH2
CH2—COO- + H2O NH2
●碱性 CH2—COOH + H+
NH2
CH2—COOH NH3+
通常 氨基酸分子中的氨基和羧基相互作用,
使氨基酸成为带有正电荷和负电荷的两性离 子(称为内盐)形式存在
R–CH–COO - NH3 +
R–CH–COO- H+ R–CH–COOH H+ R–CH–COOH
结构分析:
官能团分析: 氨基典型反应
羧基典型反应
R–CH–COOH NH2 相互影响的特性
二、氨基酸的性质
1、物理性质: 无色晶体,熔点较高(200℃以上),不易挥发, 能溶于强酸或强碱溶液中,一般能溶于水,难溶于 有机溶剂如乙醇、乙醚。
? 2—COOH + OH-
NH2
NH2
CH3 O H
O
NH2—CH—C—N—CH2—C—OH + H2O
两个氨基酸分子脱去一个水分子而形成二肽, 多个氨基酸分子脱去水分子而形成多肽.
n个氨基酸分子间通过缩聚(一个氨基酸分子 中氨基上的氢原子与相邻氨基酸分子羧基中的羟 基结合成水分子)后可得n肽,过程中形成了(n-1) 个肽键和 (n-1)个水。
(2)成肽反应(脱水缩合)
你知道氨基酸与蛋白质的关系?
蛋白质在一定条件下水解生成氨基酸; 氨基酸通过肽键相互连接成蛋白质。
迄今人类在自然界已发现数百种氨基酸,但是从
蛋白质水解得到的氨常基见酸,的最氨常基见酸的大约有20种
(1) 甘氨酸
(2) 丙氨酸
CH2—COOH
CH3—CH—COOH
NH2 (3) 谷氨酸 HOOC—(CH2)2—CH—COOH
NH2
CH2—COO- + H2O NH2
●碱性 CH2—COOH + H+
NH2
CH2—COOH NH3+
通常 氨基酸分子中的氨基和羧基相互作用,
使氨基酸成为带有正电荷和负电荷的两性离 子(称为内盐)形式存在
R–CH–COO - NH3 +
R–CH–COO- H+ R–CH–COOH H+ R–CH–COOH
结构分析:
官能团分析: 氨基典型反应
羧基典型反应
R–CH–COOH NH2 相互影响的特性
二、氨基酸的性质
1、物理性质: 无色晶体,熔点较高(200℃以上),不易挥发, 能溶于强酸或强碱溶液中,一般能溶于水,难溶于 有机溶剂如乙醇、乙醚。
? 2—COOH + OH-
NH2
NH2
CH3 O H
O
NH2—CH—C—N—CH2—C—OH + H2O
两个氨基酸分子脱去一个水分子而形成二肽, 多个氨基酸分子脱去水分子而形成多肽.
n个氨基酸分子间通过缩聚(一个氨基酸分子 中氨基上的氢原子与相邻氨基酸分子羧基中的羟 基结合成水分子)后可得n肽,过程中形成了(n-1) 个肽键和 (n-1)个水。
(2)成肽反应(脱水缩合)
18种氨基酸17页PPT

• 一.甘氨酸 (GLY) • 1、降低血液中的胆固醇浓度,防治高血压 • 2、降低血液中的血糖值,防治糖尿病 • 3、能防治血凝、血栓 • 4、提高肌肉活力,防止胃酸过多 • 5、甜味为砂糖的0.8倍,对人体有补益等营养作用 • 二.亮氨酸(LEU) • 1、降低血液中的血糖值,对治疗头晕有作用 • 2、促进皮肤、伤口及骨头有愈合作用 • 3、如果缺乏时,会停止生长,体重减轻 • 三.蛋氨酸 (MET) • 1、参与胆碱的合成,具有去脂的功能,防止动脉硬化高
糖尿病、肥胖病人食用较好
• 十.胱氨酸 (CYS) • 1、有治疗脂肪肝和解毒效果 • 2、治疗皮肤的损伤,对病后、产后脱发有疗效
• 十一.赖氨酸(LYB) • 1、参与结缔组织、微血管上皮细胞间质的形成,并
保持正常的渗 透性
• 2、可增加食欲,促进胃蛋白酶的分泌,增强免疫能 力,改善发育 迟缓,防止蛀牙,促进儿童生长
功能,有保肝护肝作用
• 2、甜味为砂糖的1.2倍 • 八.异亮氨酸 (ILE) • 1、能维持机体平衡,治疗精神障碍 • 2、有促进食欲的增加和抗贫血的作用 • 3、如果缺乏时,会出现体力衰竭,昏迷等症状 • 九.色氨酸(TRY) • 1、促进血红蛋白的合成 • 2、防治癞皮病 • 3、促进生长,增加食欲 • 4、甜味为砂糖的35倍,配制生产的低塘食物等对
• 在机体内转变为酪氨酸,促进甲状腺素和肾和肾上 腺素的合成
• 十五.脯氨酸 (PRO) • 对高血压有疗效作用 • 十六.丝氨酸 (SER) • 1、降低血液中的胆固醇浓度,防治高血压 • 2、是脑等组织中的丝氨酸磷脂的组成部分 • 十七.谷氨酸 (GLU) • 1、降低血氨,有解氨毒的作用 • 2、参与脑的蛋白和塘代谢,促进氧化,改善中枢神
糖尿病、肥胖病人食用较好
• 十.胱氨酸 (CYS) • 1、有治疗脂肪肝和解毒效果 • 2、治疗皮肤的损伤,对病后、产后脱发有疗效
• 十一.赖氨酸(LYB) • 1、参与结缔组织、微血管上皮细胞间质的形成,并
保持正常的渗 透性
• 2、可增加食欲,促进胃蛋白酶的分泌,增强免疫能 力,改善发育 迟缓,防止蛀牙,促进儿童生长
功能,有保肝护肝作用
• 2、甜味为砂糖的1.2倍 • 八.异亮氨酸 (ILE) • 1、能维持机体平衡,治疗精神障碍 • 2、有促进食欲的增加和抗贫血的作用 • 3、如果缺乏时,会出现体力衰竭,昏迷等症状 • 九.色氨酸(TRY) • 1、促进血红蛋白的合成 • 2、防治癞皮病 • 3、促进生长,增加食欲 • 4、甜味为砂糖的35倍,配制生产的低塘食物等对
• 在机体内转变为酪氨酸,促进甲状腺素和肾和肾上 腺素的合成
• 十五.脯氨酸 (PRO) • 对高血压有疗效作用 • 十六.丝氨酸 (SER) • 1、降低血液中的胆固醇浓度,防治高血压 • 2、是脑等组织中的丝氨酸磷脂的组成部分 • 十七.谷氨酸 (GLU) • 1、降低血氨,有解氨毒的作用 • 2、参与脑的蛋白和塘代谢,促进氧化,改善中枢神
氨基酸PPT幻灯片课件
20
等电点(pI)
对于任何一种氨基酸来说,总存在一定的pH值,使其净 电荷为零,这时的pH值被称为等电点。pI是一个氨基酸的 特征常数。在等电点pH时,氨基酸在电场中,不向两极移 动,并且绝大多数处于兼性离子状态,少数可能解离成阳 离子和阴离子,但解离成阴、阳离子的趋势和数目相等。
21
氨基酸的主要反应性质
17
18
特殊的酸碱性质与等电点
由于氨基酸既含有碱性的氨基又含有酸性的羧 基,因此氨基酸具有特殊的解离性质,但氨基 算的碱性和酸性分别弱于单纯的胺和羧酸。一 个氨基酸分子内部的酸碱反应使氨基酸能同时 带有正负两种电荷,以这种形式存在的离子被 称为兼性离子(zwitterions)或两性离子。
19
氨基酸的两性解离
质氨基酸:含硒半胱氨酸(第21种)和吡咯赖氨酸 (第22种)
非蛋白质氨基酸——不能直接参入到蛋白质分子 之中,或者是蛋白质氨基酸翻译后修饰产物
例如:瓜氨酸、鸟氨酸和羟脯氨酸
4
氨基酸的分类
① 脂肪族 ② 芳香族 ③ 含硫族
① 极性/不带电荷 ② 碱性/酸性
疏水:非极性R基团
亲水:极性的R基团 (电中性、带负电荷、 带正电荷)
2
氨基酸的结构通式
不同的侧链基团 不同的理化性质
3
蛋白质氨基酸和非蛋白质氨基酸
蛋白质氨基酸,即标准氨基酸——在蛋白质生物 合成中,由专门的tRNA携带,直接参入到蛋白 质分子之中
共22种:20种常见+2种不常见 ① 相同的结构通式 ② 差别在侧链基团(R基团) ③ 所有的生物体都含有常见的20种;2种不常见的蛋白
5
亲水氨基酸VS疏水氨基酸
亲水氨基酸,即极性氨基酸,其R基团呈极性,一般能 和水分子形成氢键,故对水分子具有一定的亲和性。它 们包括:Ser、Thr、Tyr、Cys、Sec、Asn、Gln、Asp、 Glu、Pyl、Arg、Lys、His;
等电点(pI)
对于任何一种氨基酸来说,总存在一定的pH值,使其净 电荷为零,这时的pH值被称为等电点。pI是一个氨基酸的 特征常数。在等电点pH时,氨基酸在电场中,不向两极移 动,并且绝大多数处于兼性离子状态,少数可能解离成阳 离子和阴离子,但解离成阴、阳离子的趋势和数目相等。
21
氨基酸的主要反应性质
17
18
特殊的酸碱性质与等电点
由于氨基酸既含有碱性的氨基又含有酸性的羧 基,因此氨基酸具有特殊的解离性质,但氨基 算的碱性和酸性分别弱于单纯的胺和羧酸。一 个氨基酸分子内部的酸碱反应使氨基酸能同时 带有正负两种电荷,以这种形式存在的离子被 称为兼性离子(zwitterions)或两性离子。
19
氨基酸的两性解离
质氨基酸:含硒半胱氨酸(第21种)和吡咯赖氨酸 (第22种)
非蛋白质氨基酸——不能直接参入到蛋白质分子 之中,或者是蛋白质氨基酸翻译后修饰产物
例如:瓜氨酸、鸟氨酸和羟脯氨酸
4
氨基酸的分类
① 脂肪族 ② 芳香族 ③ 含硫族
① 极性/不带电荷 ② 碱性/酸性
疏水:非极性R基团
亲水:极性的R基团 (电中性、带负电荷、 带正电荷)
2
氨基酸的结构通式
不同的侧链基团 不同的理化性质
3
蛋白质氨基酸和非蛋白质氨基酸
蛋白质氨基酸,即标准氨基酸——在蛋白质生物 合成中,由专门的tRNA携带,直接参入到蛋白 质分子之中
共22种:20种常见+2种不常见 ① 相同的结构通式 ② 差别在侧链基团(R基团) ③ 所有的生物体都含有常见的20种;2种不常见的蛋白
5
亲水氨基酸VS疏水氨基酸
亲水氨基酸,即极性氨基酸,其R基团呈极性,一般能 和水分子形成氢键,故对水分子具有一定的亲和性。它 们包括:Ser、Thr、Tyr、Cys、Sec、Asn、Gln、Asp、 Glu、Pyl、Arg、Lys、His;
氨基酸优秀PPT课件

调节蛋白、胺类、神经递质、嘌呤、嘧啶等
三.能源: • 17 .19 kJ/克蛋白质 • 次要作用
氮平衡(nitrogen balance): 机体摄入氮 ~ 机体排出氮
总氮平衡: 机体摄入氮 = 机体排出氮 正氮平衡: 机体摄入氮 > 机体排出氮 负氮平衡: 机体摄入氮 < 机体排出氮
总氮平衡的要求: 蛋白质最低需要量:30~50克/日 营养学会推荐量: 80克/日
假神经递质,替代多巴释放
Trp 5-羟色胺(抑制性)
大脑抑制
2 蛋白质的消化、吸收与腐败
(2)脱氨生成氨 • RCH(NH2)COOH RCH2COOH+NH3 NH3 • C=O 2NH3+CO2 NH3
• NH3 重吸收入肝
• NH3
NH4+
氨有毒性,NH3 比 NH4+易吸收,降低肠 道 pH,可减少 NH3 的吸收。
pepsin 自身激活autocatalysis
trypsin
chymotrypsinogen
chymotrypsin
2 蛋白质的消化、吸收与腐败
消化部位:胃、肠(为主)
1. 胃:胃蛋白酶(pepsin)
胃蛋白酶原 H+ 胃蛋白酶 + 6肽 (1) 最适 pH 1.5 ~ 2.5 (2)水解芳香族氨基酸及亮氨酸的羧基端 (3)凝乳作用
R4=任何氨基酸 R4=任何氨基酸 R4=任何氨基酸 R4=任何氨基酸 R2=除脯氨酸外 R6=除精、赖、脯氨酸外 R6=精、赖
O
O
O
H2N-CH-C-NH-CH---NH-CH-C-NH-CH---NH-CH-C-NH-CH-COOH
R1
R2
R3
三.能源: • 17 .19 kJ/克蛋白质 • 次要作用
氮平衡(nitrogen balance): 机体摄入氮 ~ 机体排出氮
总氮平衡: 机体摄入氮 = 机体排出氮 正氮平衡: 机体摄入氮 > 机体排出氮 负氮平衡: 机体摄入氮 < 机体排出氮
总氮平衡的要求: 蛋白质最低需要量:30~50克/日 营养学会推荐量: 80克/日
假神经递质,替代多巴释放
Trp 5-羟色胺(抑制性)
大脑抑制
2 蛋白质的消化、吸收与腐败
(2)脱氨生成氨 • RCH(NH2)COOH RCH2COOH+NH3 NH3 • C=O 2NH3+CO2 NH3
• NH3 重吸收入肝
• NH3
NH4+
氨有毒性,NH3 比 NH4+易吸收,降低肠 道 pH,可减少 NH3 的吸收。
pepsin 自身激活autocatalysis
trypsin
chymotrypsinogen
chymotrypsin
2 蛋白质的消化、吸收与腐败
消化部位:胃、肠(为主)
1. 胃:胃蛋白酶(pepsin)
胃蛋白酶原 H+ 胃蛋白酶 + 6肽 (1) 最适 pH 1.5 ~ 2.5 (2)水解芳香族氨基酸及亮氨酸的羧基端 (3)凝乳作用
R4=任何氨基酸 R4=任何氨基酸 R4=任何氨基酸 R4=任何氨基酸 R2=除脯氨酸外 R6=除精、赖、脯氨酸外 R6=精、赖
O
O
O
H2N-CH-C-NH-CH---NH-CH-C-NH-CH---NH-CH-C-NH-CH-COOH
R1
R2
R3
2018年学习蛋白质和氨基酸教材课件PPT

2.性质 (1) 盐 析 : 在 蛋 白 质 溶 液 里 加无机盐溶液 入某些浓的 [ 如 (NH4)2SO4 溶液、 Na2SO4 溶液 ] ,可使蛋白 质的溶解度降低而 ,这一过程称为盐析, 可逆 析出 是 ( 填“可逆”或“不可逆”)过程, 物理 属于 变化。 紫外线 热 强酸 强碱 重金属盐 (2) 变 性 : 福尔马林 在 、 、 、 、 不可逆 、 化学 等作用下,蛋白质的性质发生改变 并发生凝聚,失去生理功能,这一过程称为蛋 氨基酸 白质的变性,是 (填“可逆”或“不 可逆”)过程,属于 变化。
解析
考查蛋白质和糖类的性质以及对社会热点的关注程
度。葡萄糖等糖类物质不属于高分子化合物,A项错误; 三聚氰胺有毒,能增加牛奶中的含氮量,但不能增加蛋白 质的含量,B项错误;蛋白质主要由C、H、O、N四种元 素组成,有些蛋白质中还有S、P等元素,C项正确;蛋白
质的水解产物是氨基酸,淀粉水解最终产物是葡萄糖,D
考查蛋白质的性质,使学生能熟练掌握蛋白质的 盐析和变性两个性质,并应用到实际生活中去。
【体验 2】 蛋 白质溶液分别做如下处理后,仍不 失去生理活性的是 ( )。 A.高温加热 B.紫外线 照射 C.加食盐水 D . NaOH 溶液 解析 蛋白质一旦变性即失去生理活性, A 、 B、D三项均能使蛋白质变性而失去生理活性。 答案 C
2.化学性质 (1) 氨基酸之间能发生反应,合成更复杂的化 合物 (多肽),构成 。 蛋白质 (2)与盐酸反应:
(3)与烧碱溶液反应:
3.几种常见的氨基酸
H2N—CH2—COOH
甘氨酸(氨基乙酸)
;
丙氨酸(α-氨基丙酸)
;
谷
氨
酸
(α-
氨
基
氨基酸的结构和功能(共23张PPT)

含共轭双键的氨基酸具 有紫外吸收性质
色氨酸、酪氨酸的最大 吸收峰在 280 nm 附近。
大多数蛋白质含有这两种氨 基酸残基,所以测定蛋白质溶液
280nm的光吸收值是分析溶液 中蛋白质含量的快速简便的方 法。
芳香族氨基酸的紫外吸收
氨基酸与茚三酮试剂发生呈色反响〔氨基酸定量分析〕 氨基酸与2,4-二硝基氟苯反响生成二硝基苯基氨基酸〔鉴定
蛋白质N-末端氨基酸〕
氨基酸与亚硝酸反响生成氮气〔氨基酸定量和蛋白质水解程度〕
含共轭双键的氨基酸具有紫外吸收性质〔蛋白质含量分析〕
薄层层析是鉴定氨基酸及其修饰的经典方法
〔570nm光吸收峰〕
第一章
氨基酸的结构与功能
The Structure and Function of Amino Acids
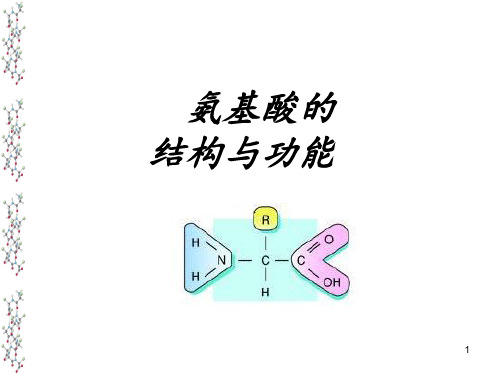
一、构成人体蛋白质氨基酸均为L--氨基酸
虽然存在于自然界中的氨基酸有300余种, 但组成人体蛋白质的氨基酸仅有20种,且均属 L- -氨基酸〔除甘氨酸外〕。
COO-
甘氨酸、丝氨酸、半胱氨酸、苏氨酸、天冬酰胺和谷氨酰胺。 蛋白质中的L- -氨基酸依据极性的分类 非蛋白质组成氨基酸及其衍生物功能举例 (2)侧链含羟基或含巯基是极性中性氨基酸 此类氨基酸有赖氨酸、精氨酸和组氨酸,其侧链分别含有氨基、胍基和咪唑基,均可发生质子化,使之带正电荷。 此类氨基酸在水溶液中溶解度小。 组成蛋白质的氨基酸的其他功能及重要衍生物举例
在某一pH的溶液中,氨基酸解离成阳离子和阴离子的
趋势及程度相等,成为兼性离子,呈电中性。此时溶液的pH
值称为该氨基酸的等电点。
R CH COOH +OH-
NH3+
+H+
+OH+H+
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
【问题解决】 第二题: 4种
教材 P103
O
O CH 2 C OH
H2 N CH2 C NH
O
O C OH
H2 N CH C NH CH CH3 CH3
O
O
H2 N CH2 C NH O CH3
CH C OH
CH3 O
H2 N CH C NH CH2 C OH
讨论: 教材 P111 第3题
27种
第 2组
第 3组
7、从结构特点分析氨基酸具有哪些化学性质? 8、分别写出甘氨酸(氨基乙酸)与氢氧化钠溶液、盐 酸反应的离子方程式。
9、什么叫成肽反应?写出两分子甘氨酸形成二肽的方 程式。说明成肽反应有何意义。 第 4组 10、如何检验氨基酸?
【问题探究】1 (1)你知道组成蛋白质的主要元素有哪些吗? 蛋白质由C、 H、 O 、N、 S 、P等元素 组成。相对分子质量很大,一万到几千 万,是天然的高分子。 (2)你是如何理解氨基酸与蛋白质关系的? 蛋白质在一定条件下水解生成氨基酸; 氨基酸通过肽键相互连接成蛋白质。 (3)什么是氨基酸?
【实验探究】
(四)氨基酸的检验
教材 P102
现象:茚三酮溶液中加入氨基酸溶液,显紫色。
注意: 1、利用该反应可以对氨基酸进行检
测。但有的氨基酸呈其他颜色,如: 脯氨酸、羟脯氨酸显黄色。 2、蛋白质也能发生茚三酮反应,蛋白 质与稀的茚三酮溶液共热,显蓝紫色。
【对点专练】1
已知有机物A分子中有3个碳原子, 有关它的某些信息注 明在下面的示意图中:
H H H N CH2C OH H N CH2C OH
O
氨基酸的成肽反应 O O
水解
H2O
O H H H N CH2C OH H N CH2C OH
H2O
H2O
H N CH2C
O
O H N CH2C
H N CH2C
O
H N CH2C
O
两个氨基酸可以结合 多肽 成为一个二肽分子。 结合中失去一个H2O 水解 分子,得到一个肽键。 蛋白质 这样由于可以结合无 数的氨基酸分子,所 以蛋白质分子很大。
●人体内不能合成的氨基酸(必需氨基酸)有 哪几种?8种 合成能力较差的氨基酸(半必需 氨基酸)有几种? 2种
●亚氨基酸与氨基酸的区别?
【问题探究】2 (4)氨基酸分子的结构有什么特点?
●结 构:
(1)含有-NH2 及-COOH
(2)除甘氨酸外,其余都是
手心分子,且都是L型。
L -丙氨酸 D-丙氨酸
NH—CH2 H2C-CO-OH + H-HN C=O +2H2O NH-H + HO-OC-CH2 浓硫酸O=C CH2—NH
NH2—CH2 —CH2 —CH2 —CH2—COOH的分 子内脱水:
CH2 —CH2—CO— OH CH2—CH2—NH—H
CH2—CH2 浓硫酸H2C CH —NH C=O +H2O 2
α-氨基酸
-CH2-CH-COOH
NH2
迄今人类在自然界已发现数百 种氨基酸,但是从蛋白质水解得到 的氨基酸,最常见的大约有20种。
【拓展视野】
采用系统命名比较繁琐,常采
用俗名,通常采用缩写省去氨
酸,如甘氨酸,中文缩写甘, ●20种常见氨基酸在结构上的相似之处? 不同之处? 英文glycine缩写为Gly。 都是α -氨基酸, R-基不相同 ●氨基酸如何命名?
问题与讨论:
第 1组
1、组成蛋白质的主要元素有哪些吗? 2、你是如何理解氨基酸与蛋白质关系的? 3、氨基酸的结构有何特点?什么叫α-氨基酸?试写 出常见氨基酸的结构简式。 4、迄今人类的发现的氨基酸有多少种? 5、天然蛋白质水解得到的氨基酸有多少种?人体不能 合成有几种? 合成能力较弱的有几种?它们的结构有 何相似性?又有何不同点? 6、氨基酸的物理性质有哪些?
常见的氨基酸
(1) 甘氨酸(α-氨基乙酸) CH2—COOH
NH2 (2) 丙氨酸(α-氨基丙酸)
羧酸分子里烃基上 的氢原子被氨基取 代后的生成物叫氨 基酸。
CH3—CH—COOH
NH2
பைடு நூலகம்
分子中氨基 连接在离羧 NH2 基最近的碳 (4) 苯丙氨酸 (α-氨基-β-苯基丙酸) 原子上。
(3) 谷氨酸 (α-氨基戊二酸) HOOC—(CH2)2—CH—COOH
H2N-CH2-COOCH3
相互影响的特性
(三)化学性质 (1)两性 CH2-COO- + H2O ●酸性 CH2-COOH + OH●碱性
NH2 CH2-COOH + H+ NH2 R–CH–COO
-
NH2 CH2-COOH NH3+
为什么-NH2能结 合H+
NH2 负离子
(强碱中)
H+ R–CH–COOH H+ R–CH–COOH - - OH OH + NH NH 3
O
O
肽键
H2N
CH2 C NH CH2 C OH+ H2O
● 氨基酸在酸或碱的存在下加热,通过一分子的 氨基与另一分子的羧基间脱去一分子水,缩合形 成含有肽键的化合物,叫做成肽反应。
● 成肽反应是分子间脱水反应,属于 取代 反应。
●成肽的两个氨基酸分子(可以相同,
也可以不同)
● 两个氨基酸分子脱去一个水分子而形成二肽, 多个氨基酸分子脱去水分子而形成多肽.
(5)氨基酸有哪些重要的性质? ●性 质: (1)具有两性:碱性和酸性
(2)成肽(缩合)反应
(一)物理性质:
无色晶体,有特殊香甜味,熔点较高 (200℃),能溶于强酸或强碱溶液中, 一般能溶于水,(难溶于乙醇、乙醚)。
(二)结构分析
官能团分析: 氨基典型反应 R–CH–COOH NH2 羧基典型反应
2
正离子
(强酸中) R–CH–COO - NH3 + 两性离子(内盐中)
当溶液中的氨基酸主要以两性 R–CH–COO - 离子的形式存在时,氨基酸在水中 NH3 + 的溶解度最小,可以形成晶体析出。 不同的氨基酸出现这种情况的pH值各不相同。 利用这一差异,可以通过控制溶液PH值的 分离氨基酸及多肽或蛋白质。 (2)成肽(缩合)反应 2NH2CH2COOH→
若题目改成:“在一定条件下生成的同时 含有三种氨基酸的链状三肽共有多少种?” 答案为多少? 6种
【拓展视野】 (1) 二个氨基酸缩合生成二肽,三个氨基酸缩合 生成三肽,多个氨基酸缩合生成多肽,n个氨基酸 缩合生成蛋白质。 (2) 氨基酸的缩合反应也可能成环,试写出下列 反应的产物: NH2—CH2—COOH的分子间脱水:
