最优考马斯亮蓝染色Protocol
考马斯亮蓝染色液

考马斯亮蓝染色液(常规法)的详细信息考马斯亮蓝染色液(常规法)规格:250ml500ml公司提取试剂盒不同样本提取DNA一次时间:15-30min, 并且可以适用于配备仪器大批量提取使用。
同系列产品:大鼠可溶性CD30配体(sCD30L)ELISA试剂盒大鼠可溶性CD40配体(sCD40L)ELISA试剂盒大鼠干细胞因子受体(SCFR)ELISA试剂盒大鼠基质细胞衍生因子1β(SDF-1β/CXCL12)ELISA试剂盒考马斯亮蓝染色液(常规法)大鼠血管生成素受体Tie1(ANG-R-Tie1)ELISA试剂盒大鼠含免疫球蛋白样环和上皮生长因子样域酪氨酸激酶2(Tie-2)ELISA试剂盒大鼠基质金属蛋白酶抑制因子2(TIMP-2)ELISA试剂盒许多因素都能够影响质粒的产量,包括细菌培养液的体积,质粒的拷贝数,培养基的种类及所使用的菌株。
纯化的质粒不需后续处理即可用于DNA的各种分子生物学操作,但若用于体外转录实验,还需配合核糖考马斯亮蓝染色液(常规法)核酸酶抑制剂的使用。
溶液II-NaOH-SDS液:NaOH:核酸在pH大于5,小于9的溶液中,是稳定的。
但当pH>12或pH<3时,就会引起双链之间氢键的解离而变性。
在溶液II中的NaOH浓度为0.2mo1/L,加抽提液时,该系统的pH 就高达12.6,因而促使染色体DNA 与质粒DNA 的变性。
SDS:SDS是离子型表面活性剂。
它主要功能有:(1)溶解细胞膜上的脂质与蛋白,因而溶解膜蛋白而破坏细胞膜。
(2)解聚细胞中的核蛋白。
(3)SDS能与蛋白质结合成为R-O-SO3-…R+-蛋白质的复合物,使蛋白质变性而沉淀下来。
但是SDS能抑制核糖核酸酶的作用,所以在以后的提取过程中,必须把它去除干净,防止在下一步操作中(用RNase去除RNA 时)受到干扰。
DNA 溶液是DNA 以水合状态稳定存在,当加入乙醇时,乙醇会夺去DNA 周围的水分子,使DNA 失水而易于聚合。
考马斯亮蓝快速染色液使用说明

色,可以重复2-3次。 注:染色时如果把凝胶和染色液一起放置在微波炉中适当加热,可以大大加快染色速度。但加热时宜尽量避免沸腾,以 免出现因暴沸而导致的凝胶碎裂。 4. 染色至看到清晰的目标蛋白条带后即可停止染色。弃染色液,加入适量的蒸馏水,停止染色反应。然后即可拍照记录。 注:通常使用本染色液染色后背景非常低,如果希望获得更加清晰的蛋白条带,可以加入适量的室温蒸馏水进行洗涤。 通过蒸馏水洗涤可以进一步降低背景。在4℃蒸馏水中浸泡过夜可以获得背景更低,条带更清晰的条带。在次日对4℃蒸 馏水浸泡过夜的已经进行了染色的凝胶再同前一天一样进行染色和洗涤可以进一步改善染色效果,获得更好的考染蛋白 条带。
包装清单:
产品编号 P0017 —
产品名称 考马斯亮蓝快速染色液
说明书
包装 250ml
1份
保存条件:
4℃保存,一年有效。
注意事项:
本染色液呈酸性,有轻微腐蚀性,使用时请作必要防护。 如果使用微波炉加热,请特别注意避免沸腾。以免因暴沸而导致凝胶碎裂。 为了您的安全和健康,请穿实验服并戴一次性手套操作。
常见问题:
1. 无染色条带:可能上样量太少,建议电泳时加适当量的BSA等作为阳性对照。 2. 背景太高:可能杂质没有除尽,建议延长最初的蒸馏水洗涤时间或增加洗涤次数。也可以在完成染色后,把凝胶放置在
蒸馏水中在室温或4℃进行洗涤。在4℃蒸馏水中浸泡过夜,通常可以取得较好的脱色效果。 3. 染色条带的灵敏度不够理想:可以使用考马斯亮蓝快速染色液进行重复染色,重复染色可以改善染色效果。在加热情况
使用说明:
1. 电泳结束后,取胶放入约50-100ml蒸馏水中,在摇床上摇动5分钟,倒弃液体,再重复两次,共洗涤三次。 注:本步骤的目的是为了洗去凝胶中的SDS等干扰物质。如果不能充分去除SDS会导致背景较高,如果胶非常厚,每次的 洗涤时间需适当延长并且洗涤次数也需适当增加。蒸馏水洗涤去除凝胶中的杂质时,如果使用经过加热至接近沸腾的蒸 馏水,每次洗涤1-2分钟即可。
蛋白质含量的测定考马斯亮蓝染色法

1 2
洗涤
用洗涤液洗涤染色后的蛋白质样品,去除多余的 染料。
测量
使用分光光度计测量蛋白质样品的吸光度值。
3
结果计算
根据标准曲线和吸光度值计算蛋白质含量。
04
结果分析
数据记录与整理
数据记录
在实验过程中,应详细记录每个实验 组的吸光度值,包括空白对照组。
数据整理
将实验数据整理成表格,包括实验组 别、吸光度值以及相应的波长等。
VS
药物研发
在药物研发过程中,考马斯亮蓝染色法可 用于评估药物对蛋白质表达的影响,为新 药研发提供实验依据。
未来发展方向与挑战
技术优化
随着科学技术的不断发展,考马斯亮蓝染色法需要不断优化和完善, 以提高检测的灵敏度和特异性。
应用领域拓展
随着蛋白质组学研究的深入,考马斯亮蓝染色法的应用领域将进一 步拓展,为生命科学和医学研究提供更多支持。
蓝色与黄色
考马斯亮蓝染色后呈蓝色,与未结合蛋白质的黄色形成鲜明对比,便于观察和 检测。
颜色深浅与浓度正相关
随着蛋白质浓度的增加,染色后样品的颜色逐渐加深,通过比色法可测定出不 同浓度下的光密度值,进而计算出蛋白质浓度。
03
实验步骤
样品准备
样品收集
蛋白质提取
选择具有代表性的样品,确保样品新 鲜、无污染。
05
应用与展望
在生物学领域的应用
蛋白质表达分析
考马斯亮蓝染色法常用于检测细胞或组织中蛋白质的表达水平,有助于研究生物体的生 理和病理过程。
蛋白质分离与鉴定
通过考马斯亮蓝染色法对蛋白质进行染色,可以方便地对蛋白质进行分离和鉴定,为蛋 白质组学研究提供技术支持。
在医学领域的应用
考马斯亮蓝法——完整版

一、基本原理
酸性溶液两者结合,使染料溶液 的最大吸收峰的位置,由465nm变 为595nm,溶液的颜色也由棕黑色 变为兰色。
二、试剂与器材
1. 试剂:
(1)考马斯亮蓝试剂: 考马斯亮蓝G—250 100mg溶于50ml 95%乙醇,加入100ml
(1)由于各种蛋白质中的精氨酸和芳香族氨基酸的含量 不同,因此Bradford法用于不同蛋白质测定时有较大的偏 差,在制作标准曲线时最好选用 γ—球蛋白为标准蛋白质, 以减少这方面的偏差。
(2)仍有一些物质干扰此法的测定,主要的干扰物质有: 去污剂、 Triton X-100、十二烷基硫酸钠(SDS)和0.1M 的NaOH
三、操作方法
1、标准曲线的制作
试管编号
0123456
100ug/ml标准蛋白(ml) 0.0 0.1 0.2 0.3 0.4 0.5 0.6
0.15mol/L NaCl (ml) 1 0.9 0.8 0.7 0.6 0.5 0.4
考马斯亮蓝试剂 (ml) 5 5 5 5 5 5 5
摇匀,1h内以0号管为空白对照,在595nm处比色
最好的方法; 干扰物质少; 颜色稳定; 颜色深浅随不同
双缩脲反应;磷 钼酸-磷钨酸试 剂 被 Tyr 和 Phe 还 原
非蛋白氮(可 用三氯乙酸沉 淀蛋白质而分 离)
硫酸铵; Tris缓冲液; 某些氨基酸
各种嘌吟和嘧 啶; 各种核苷酸
硫酸铵; Tris缓冲液; 甘氨酸; 各种硫醇
用于标准蛋白质 含量的准确测定; 干扰少;费时太 长
用于快速测定, 但不太灵敏;不 同蛋白质显色相 似
用于层析柱流出 液的检测;核酸 的吸收可以校正
考马斯亮蓝染色原理

考马斯亮蓝染色原理
考马斯亮蓝染色原理是一种非常重要的染色技术,它可以有效解决染色过程中的颜色发生改变的问题。
19世纪末,考马斯亮蓝染料在染色领域内开始流行,它成为一种有效的染色方法,能够有效地提供出美观、耐用的染色效果。
考马斯亮蓝染色原理是一种常用的染色技术,它依据矿物质中的亮蓝矿物为原料,以及活性盐的辅助,通过精密的混合和周转,以及微观的改变来发挥其有效的染色效果。
在染色过程中,染色料与活性盐形成一个“涂料-原料”的交互,以及“铸锭处理-熔融”的依赖,从而有效地提供出良好的染色效果。
此外,考马斯亮蓝染色原理还可以提供出一种精确、良好的染色效果。
根据不同的环境条件,可以精确地控制所需要的颜色深浅,并有效地保证染色材料的纯净性,从而获得出精确、良好的染色效果。
此外,考马斯亮蓝染色还可以较好地防止抗菌性漂浮微粒的影响,且比常规染料具有更高的抗氧化性,从而使染色物料的使用寿命大大延长。
另外,考马斯亮蓝染色原理还有效地降低了生产工艺的复杂度。
比起其他染色方法,减少了很多涉及熔融,干燥等复杂工序,有效提高了染色材料的优质性,降低了生产成本。
综上所述,考马斯亮蓝染色原理是一种有效的染色方法,可以有效实现出良好的染色效果,又有效降低了生产工艺的复杂度,从而受到广泛的应用。
它不仅可以用于纺织品的染色,还可以用于化工、油
漆等行业的染色,以及塑料、树脂的加工业的染色,从而发挥其重要的作用。
最优考马斯亮蓝染色Protocol

考马斯亮蓝染色推荐选用前三种染色方法,另有传统考马斯亮蓝染色法和网上经验,染色效果不好,不推荐使用,仅供参考;见后页比对照片操作步骤:1、取出SDS-PAGE凝胶,经超纯水漂洗;以下每步操作皆在摇床上进行;2、固定:将凝胶放入相应的固定液中,固定1小时;3、染色:取出凝胶,放入相应的染色液中,过夜染色;也可依实际情况缩短时间4、脱色胶体法&改良法:凝胶放入纯水中洗脱,换液数次;脱色Neuhoff法:取出凝胶,用M Tris-H3PO4缓冲液漂洗2分钟;再用25%乙醇淋洗<1 min;然后再用10%乙酸中在室温脱色2小时即可;试剂的配制:1、胶体考马斯亮蓝染色法colloidal Coomassie brilliant blue,cCBB:固定液:40%甲醇、10%乙酸染色液:%磷酸、8%硫酸铵、% CBB-G250、20%乙醇脱色液:H2O2、改良考马斯亮蓝染色法modified Coomassie brilliant blue,mCBB:固定液:40%甲醇、10%乙酸染色液:10%磷酸、10%硫酸铵、% CBBG250、20%乙醇着色1小时即可;脱色液:H2O3、Neuhoff染色法:固定液:12%三氯醋酸染色液:2%磷酸、10%硫酸铵、% CBB-G250、使用前振摇;染色时,取一定体积的染色液,加入1/4体积的甲醇;脱色所需:M Tris-磷酸缓冲液、25%乙醇、10%醋酸4、传统考马斯亮蓝染色法:固定液:%甲醇、%乙酸染色液:%甲醇、%乙酸、% CBB-G250脱色液:5%甲醇、%乙酸5、网上方法:固定液:40%甲醇、10%乙酸染色液:30%甲醇、10%乙酸、% CBB-G250脱色液:30%甲醇,10%乙酸比对照片:每块胶左道是Marker质量原因,未跑开ˇˇ 上样量5μl,右道是BSA分子量68kDa,上样量为3μg.-Neuhoff法传统法胶体法改良法网上法。
考马斯亮蓝蛋白快速染色液

贮存:
室温密封保存
使用说明 1.洗涤 电泳结束后,将凝胶剥离玻璃板, 放入烧杯或塑料盒中,加入 100ml 的蒸馏水。 煮沸或微波炉中加热至沸腾,维持 1 分钟, 弃水。 2.染色 倒入适量染色液,煮沸或微波炉中 加热至沸腾,维持 2 分钟;如果胶非常厚, 染色的时间需适当延长。
注:在微波炉中适当加热,可以大大加快染色速度。 加热时,敞开容器口,容器尽量大些 ,以免出现因
考马斯亮蓝蛋白胶快速染色液
考马斯亮蓝蛋白胶快速染色液 Commassie Blue Fast Staining Solution
包装:
Cat.No
产品名称
规格
WB021 考马斯亮蓝蛋白胶快 100ml
WB022
速染色液
50ቤተ መጻሕፍቲ ባይዱml
产品简介: ※考马斯亮蓝快速染色液(Commassie Blue Fast Staining Solution)是以考马斯亮蓝R-250 为染料配 制而成的染色液,可用于SDS-PAGE或非变性PAGE 蛋白电泳胶的快速染色,或Western转膜后PAGE胶 上残余蛋白的检测。 ※考马斯亮蓝快速染色液采取新配方,超薄胶只需 染色 10 分钟,就可以显示出清晰的蛋白电泳条带; 检测到低达 10ng的蛋白电泳条带。 ※无需对蛋白和凝胶进行固定,操作更加简单。 ※本考马斯亮蓝快速染色液是一种无毒,无刺激性 气味的高度环保型染色液。普通的常规方法需使用 剧毒的甲醇及强刺激性的乙酸,而本公司生产的考 马斯亮蓝快速染色液则采取全新配方,实现了无毒 和无刺激性气味。 ※本染色液和质谱分析兼容,即经过本染色液染色 的蛋白条带或蛋白点可以用于后续的质谱分析。
考马斯亮蓝染色总结

考马斯亮蓝染色总结考马斯亮蓝染色是一种广泛应用于生物学实验中的染色技术,它可以用于检测许多不同的分子和细胞类型。
这种染色方法是法国生物学家Louis-Charles Malassez于1867年发明的,后由德国生物学家Richard Kuhn于1933年进行改良,使其成为现代生物学实验的标准技术之一。
本文将对考马斯亮蓝染色的方法、应用以及优缺点进行总结。
一、方法考马斯亮蓝染色的原理是,亮蓝染料可以与DNA的碱基对结合而形成复合物。
这种染色技术需要一些基本试剂,包括亮蓝染料、甲醛、醋酸以及石蜡等。
具体操作步骤如下:1. 取需要染色的细胞或组织样本,用生理盐水进行清洗;2. 将样本固定在载玻片上,用甲醛和醋酸进行固定处理;3. 将载玻片在70%乙醇和95%乙醇中依次浸泡,以去除固定剂;4. 在50%和75%醇溶液中浸泡数分钟,使样本逐渐变暗;5. 用亮蓝染料染色,通常需要在100倍和400倍低倍镜下观察。
二、应用考马斯亮蓝染色可以用于检测DNA、RNA、核蛋白和细胞质等细胞成分。
在分子生物学实验中,考马斯亮蓝染色被广泛应用于检测DNA条带的大小、纯度和含量。
此外,它还可以用于细胞形态和结构的观察,如观察细胞核、染色质和核仁等。
在医学领域中,考马斯亮蓝染色可以用于检测肿瘤、癌细胞、炎症细胞和血液样本等。
从组织样本中提取DNA或RNA 时,也会使用该染色技术。
三、优缺点优点:1.对许多不同类型的细胞和分子具有高度灵敏度和特异性。
2.操作简便,仅需要一些基本试剂和设备。
3.观察结果清晰,可以展示细胞组织的形态和结构。
4.染色技术稳定性好,结果可复制性高。
缺点:1.过程中可能会使样本遭到破坏或溶解。
2.亮蓝染料可能与背景杂质结合,导致结果不准确。
3.需要专业人员进行染色和观察,较为复杂。
4.染色后,样品无法再进行分子生物学的使用,比如PCR 反应等。
结语:考马斯亮蓝染色是一种简便、灵敏并且重要的分子生物学实验技术。
考马斯亮蓝染色及丽春红染色操作规程

考马斯亮蓝染色及丽春红染色操作规程附录7:考马斯亮蓝染色及丽春红染色操作规程
1. 考马斯亮蓝染色
1.1 染色液配制
醋酸脱色液。
5%(V/V)甲醇,7%(V/V)醋酸,88%HO。
2
固定液。
50%(V/V)甲醇,10%(V/V)冰醋酸,40%HO。
2
考马斯亮蓝染液。
50%(V/V)甲醇,0.05%(V/V)考马斯亮蓝,10%(V/V)冰醋酸,40%HO。
2
1.2.实验步骤
将胶条置于固定液中,摇床固定1 h;? 倒掉固定液,加考马斯亮蓝染液染色2 h;?去离子水漂洗1-2次,脱色液漂洗1次;? 脱色液中脱色1 h,最后置于去离子水中。
2. 丽春红染色
2.1. 染色液配制
10×丽春红染液
丽春红S 2g
三氯乙酸 30g
磺基水杨酸 30g
加蒸馏水至 100ml。
使用时将其稀释10倍,即为应用液。
2.2. 实验步骤转膜完成后,取出膜在甲醇里泡1分钟;?将膜于双蒸水中漂洗数次后,浸入丽春红染液着色;? 室温下,于摇床上轻摇5-30 min;? 将染好的膜置于双蒸水中漂洗数次,不要洗的太久,只需把表面的丽春红洗掉即可,此时可看到红色的蛋白条带。
考马斯亮蓝快速染色液使用说明

考马斯亮蓝快速染色液产品编号产品名称包装P0017 考马斯亮蓝快速染色液 250ml产品简介:考马斯亮蓝快速染色液(Commassie Blue Fast Staining Solution)是以考马斯亮蓝G250为染料,可用于SDS-PAGE或非变性PAGE等蛋白电泳胶的快速、高灵敏染色,或Western转膜后PAGE胶上残余蛋白的检测。
本考马斯亮蓝快速染色液是一种无毒,无刺激性气味的高度环保型染色液。
普通的常规方法需使用剧毒的甲醇及强刺激性的乙酸,而碧云天生产的考马斯亮蓝快速染色液则采取全新配方,实现了无毒和无刺激性气味。
本考马斯亮蓝快速染色液只需一小时或更短时间就可以检测到低达100ng的蛋白电泳条带,而常规方法需3小时以上。
本试剂盒可以进行高灵敏染色,最低可以清楚检测到10ng的蛋白电泳条带,参考图1。
蛋白上样量: 10μg 5μg 2μg 1μg 500ng 200ng 100ng 50ng 20ng 10ng 5ng 2ng 1ng图1. 使用碧云天的考马斯亮蓝快速染色液对不同上样量的BSA蛋白样品用10% SDS-PAGE胶电泳后的两次染色结果。
无需对蛋白和凝胶进行固定,可以不进行脱色,操作更加简单。
本染色液和质谱分析兼容,即经过本染色液染色的蛋白条带或蛋白点可以用于后续的质谱分析。
包装清单:产品编号产品名称包装P0017 考马斯亮蓝快速染色液250ml—说明书1份保存条件:4℃保存,一年有效。
注意事项:本染色液呈酸性,有轻微腐蚀性,使用时请作必要防护。
如果使用微波炉加热,请特别注意避免沸腾。
以免因暴沸而导致凝胶碎裂。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
使用说明:1. 电泳结束后,取胶放入约50-100ml蒸馏水中,在摇床上摇动5分钟,倒弃液体,再重复两次,共洗涤三次。
注:本步骤的目的是为了洗去凝胶中的SDS等干扰物质。
如果不能充分去除SDS会导致背景较高,如果胶非常厚,每次的洗涤时间需适当延长并且洗涤次数也需适当增加。
考马斯亮蓝染色总结

考马斯亮蓝染色总结考马斯亮蓝染色法是一种广泛应用于生物学及医学领域的染色技术,其主要作用是使细胞和组织的结构、形态和组成成分可见,从而帮助科学家们更好地进行观察、研究和分析。
在本文中,我们将对考马斯亮蓝染色法进行详细的介绍和总结。
1. 染色原理考马斯亮蓝染色法是以亮蓝G和甲基绿为主要染色剂,通过它们与细胞结构中的核酸和蛋白质发生亲和作用从而染色的。
亮蓝G主要染色细胞核及细胞质内的核糖体、蛋白质及其它细胞结构,而甲基绿则主要染色细胞质囊泡、线粒体等细胞质结构。
2. 染色方法考马斯亮蓝染色法的染色方法一般分为几个步骤:处理标本、脱水、清洗、染色、除色和封片。
下面我们将详细介绍每个步骤。
(1)处理标本:首先需要将待染标本进行处理,可以选择切片或制片方法制备,一般采用的是石蜡切片,用甲醛或卡尼液(一种带有防腐功能的溶液)固定标本,然后用甲醇或乙醇进行脱水。
(2)脱水:脱水是将固定的标本从水溶液中转移到乙醇(酒精)中,这个过程需要逐渐进行,不可以用高浓度酒精来快速脱水。
脱水的目的是防止固定的标本因含水过多而膨胀变形。
(3)清洗:将标本从酒精中取出后,需要清洗干净,以防止其中残留的酒精对染色的影响。
(4)染色:将标本浸入考马斯亮蓝染液中进行染色。
染色时间一般在几分钟至半小时之间,具体时间根据标本的大小和厚薄来决定。
(5)除色:染色过程结束后,需要将标本进行除色,以清除过多的染液,防止染色过重。
除色是用95%至100%的酒精进行。
(6)封片:染色和除色结束后,需要将标本封装在玻璃片上。
封装通常使用覆盖片和封片胶,将标本与玻璃片粘合在一起。
3. 染色结果经过考马斯亮蓝染色后,标本中的不同细胞结构会被染上不同颜色。
细胞核染成深蓝色,细胞质染成浅蓝色或颜色较浅,细胞质囊泡、线粒体等细胞质结构则呈现深绿色。
通过染色结果,我们可以清楚地观察到样本中不同结构之间的分布情况。
4. 应用领域考马斯亮蓝染色法广泛应用于生物学、医学及其它相关领域。
PH0357 考马斯亮蓝快速染色液实验手册

PH0357|考马斯亮蓝快速染色液(Commassie Blue Fast Staining Solution)Catalog No:PH0357Size:☐500mL Store at4℃◆简介考马斯亮蓝蛋白胶快速染色液是一种即用型快速灵敏而且安全的染液,以考马斯亮蓝G-250为染料,可用于SDS-PAGE 或者非变性电泳蛋白凝胶的快速染色,染色时间短,半小时内即可检测到蛋白电泳条带。
◆保存4℃保存,有效期12个月◆使用参考工作液的配制,取100ml溶液B,加入2ml溶液A,混匀,此为工作液。
此工作液配好后请在一周内使用完,过期效果会有一定的影响。
1.将电泳后的PAGE胶(以8cm×10cm大小为例)取下放入容器中,加入50ml双蒸水或去离子水,加热至沸腾后停止,(可选:继续在脱色摇床上摇动5分钟),弃去水溶液。
2.加入25ml快速染色工作液,加热至沸腾后保持沸腾状态30-60秒,停止加热后继续在脱色摇床上摇动5-10分钟,弃去染色液(此时蛋白条带应已可见)。
3.加入约50ml水,加热至沸腾后保持沸腾状态30-60秒,停止加热后继续在脱色摇床上摇动5-10分钟,换水即可完成脱色,观察结果。
◆注意事项1.染色前的清洗步骤(第一步)中,水的质量非常重要,质量越好灵敏度越高,研究证明若用自来水加热清洗,染色效果与灵敏度仅与常规甲醇考马斯亮蓝染色(分子克隆第二版)相同。
2.脱色时可用自来水清洗。
3.若要得到无背景的染色胶,可重复脱色步骤或将胶放在水中过夜。
4.经本染色液染色的PAGE胶,胶的缩涨度小于5%,染色后的胶可在水中放置数月而无明显脱色。
5.每次加热后,继续在脱色摇床上摇动5分钟,可增强染色效果。
6.本染色液有轻微腐蚀性,请带手套操作。
考马斯亮蓝染色法测定蛋白质浓度含(_Bradford_法)

反应化合物在595nm处有最大光吸收,化合物颜色 的深浅在一定范围内与蛋白质浓度成正比,,因
此可通过测定595nm处的光吸收值来计算蛋白的含
量。
考马斯亮蓝染色法的优点:
(1)灵敏度高(比Lowry法灵敏4倍),测 其最低蛋白质测量可达1mg。 (2)测定快速,简洁。只需加入一种试剂, 完成一个样品的测定,只需5min左右。 (3)此方法干扰物少 如干扰Lowry法的K+、 Na+、Mg+例子,Tris缓冲液、蔗糖、甘油、
思考题
1.考马斯亮蓝法测定蛋白质含量的原理 是什么? 2.为什么不能用试管刷来清洗比色皿? 3.能否将卫生纸塞入比色皿中吸干余液? 4.为什么最后要用95%的乙醇来润洗比 色皿?
尽管相对于其他方法来说尽管相对于其他方法来说??尽管相对于其他方法来说此法的干扰物较少尽管相对于其他方法来说此法的干扰物较少此法的干扰物较少此法的干扰物较少但但由于每种蛋白质与该染料的结合能力不同由于每种蛋白质与该染料的结合能力不同故故标准品的选择非常重要选择标准品的选择非常重要选择尽可能与待测蛋白尽可能与待测蛋白一致的样品一致的样品做标准能最大限度的提高该方法的做标准能最大限度的提高该方法的准确性
七.补充
蛋白质含量测定方法比较
蛋白质含量测定法,是生物化学研究中最
常用、最基本的分析方法之一。目前常用 的有四种古老的经典方法,即定氮法,双 缩尿法(Biuret法)、Folin-酚试剂法 (Lowry法)和紫外吸收法。另外还有一种 近十年才普遍使用起来的新的测定法,即 考马斯亮蓝法(Bradford法)。其中 Bradford法和Lowry法灵敏度最高,比紫外 吸收法灵敏10~20倍,比Biuret法灵敏100 倍以上。定氮法虽然比较复杂,但较准确, 往往以定氮法测定的蛋白质作为其他方法 的标准蛋白质。
考马斯亮蓝快速染色液使用说明

色,可以重复2-3次。 注:染色时如果把凝胶和染色液一起放置在微波炉中适当加热,可以大大加快染色速度。但加热时宜尽量避免沸腾,以 免出现因暴沸而导致的凝胶碎裂。 4. 染色至看到清晰的目标蛋白条带后即可停止染色。弃染色液,加入适量的蒸馏水,停止染色反应。然后即可拍照记录。 注:通常使用本染色液染色后背景非常低,如果希望获得更加清晰的蛋白条带,可以加入适量的室温蒸馏水进行洗涤。 通过蒸馏水洗涤可以进一步降低背景。在4℃蒸馏水中浸泡过夜可以获得背景更低,条带更清晰的条带。在次日对4℃蒸 馏水浸泡过夜的已经进行了染色的凝胶再同前一天一样进行染色和洗涤可以进一步改善染色效果,获得更好的考染蛋白 条带。
蛋白上样量: 10μg 5μg 2μg 1μg 500ng 200ng 100ng 50ng 20ng 10ng 5ng 2ng 1ng
图1. 使用碧云天的考马斯亮蓝快速染色液对不同上样量的BSA蛋白样品用10% SDS-PAGE胶电泳后的两次染色结果。
无需对蛋白和凝胶进行固定,可以不进行脱色,操作更加简单。 本染色液和质谱分析兼容,即经过本染色液染色的蛋白条带或蛋白点可以用于后续的质谱分析。
常见问题:
1. 无染色条带:可能上样量太少,建议电泳时加适当量的BSA等作为阳性对照。 2. 背景太高:可能杂质没有除尽,建议延长最初的蒸馏水洗涤时间或增加洗涤次数。也可以在完成染色后,把凝胶放置在
蒸馏水中在室温或4℃进行洗涤。在4℃蒸馏水中浸泡过夜,通常可以取得较好的脱色效果。 3. 染色条带的灵敏度不够理想:可以使用考马斯亮蓝快速染色液进行重复染色,重复染色可以改善染色效果。在加热情况
本考马斯亮蓝快速染色液是一种无毒,无刺激性气味的高度环保型染色液。普通的常规方法需使用剧毒的甲醇及强刺激 性的乙酸,而碧云天生产的考马斯亮蓝快速染色液则采取全新配方,实现了无毒和无刺激性气味。
EMSAprotocol
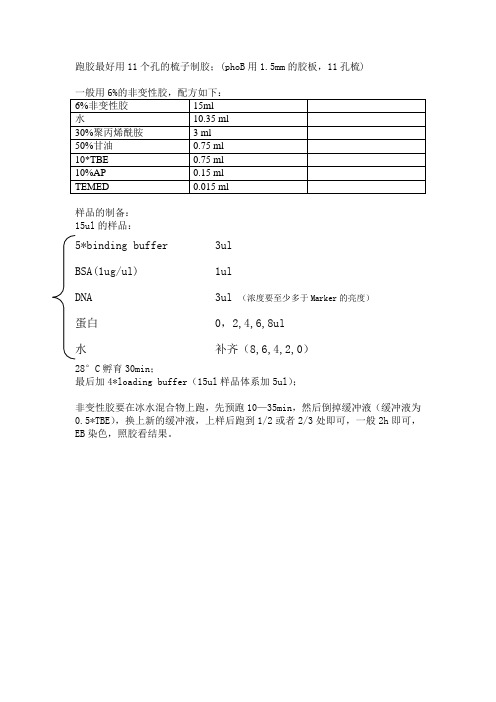
跑胶最好用11个孔的梳子制胶;(phoB用1.5mm的胶板,11孔梳)样品的制备:15ul的样品:5*binding buffer 3ulBSA(1ug/ul) 1ulDNA 3ul (浓度要至少多于Marker的亮度)蛋白 0,2,4,6,8ul水补齐(8,6,4,2,0)28°C孵育30min;最后加4*loading buffer(15ul样品体系加5ul);非变性胶要在冰水混合物上跑,先预跑10—35min,然后倒掉缓冲液(缓冲液为0.5*TBE),换上新的缓冲液,上样后跑到1/2或者2/3处即可,一般2h即可,EB染色,照胶看结果。
EMSA所用试剂配方:5×Binding buffer:Hepes 100 mM,pH 7.6,EDTA 5 mM(NH4)2 S04 50 mM,DTT 5 mM,Tween 20 1 % (w/v),KCl 150 mM4× Loading buffer:0.25 x TBE buffer 60%;Glycerol 40%bromphenol blue 0.2% (w/v)10xTBE( pH 8.0):Tris 890 mMboric acid (硼酸) 890 mM,EDTA 20 mMSDS-PAGE各种试剂配方:30%丙烯酰胺:Acrylamide(丙烯酰胺)29gBIS(甲叉双丙烯酰胺)1g去离子水80ml充分搅拌至溶解,定容至100ml,滤膜过滤。
1M Tirs-HCl,PH8.0:Tirs 12.1g去离子水 80ml浓盐酸调PH,越约加6ml左右,最后定容至100ml1M Tirs-HCl,PH6.8:Tirs 12.1g去离子水 80ml浓盐酸调PH,越约加3ml左右,最后定容至100ml5×Tirs-Glycine Buffer:Tirs 15.1gGlycine 94.0gSDS 5.0g去离子水 800ml最后定容至1L考马斯亮蓝染色液:考马斯亮蓝R250 2.5g溶解到1L的甲醇:水:冰乙酸(4.5:4.5:1)中。
掌握用考马斯亮蓝(Coomassie
[apparatus, material and reagent]
光学显微镜;烧杯、吸管、镊子、玻片染
色缸、载玻片、盖玻片;
新鲜洋葱鳞茎;
试剂 1.细胞骨架稳定液(CSB ,pH 6.1):10 mM MES; 138 mM KCl; 3 mM MgCl; 2 mM EGTA; 0.4M 甘 露醇 2. PBS:含0.1% 的TritonX-100 3.封闭液:PBS; 0.1% Ttiton X-100; 2% BSA 4.微丝荧光染料:0.4 µ g/ml罗丹明标记的鬼笔环肽 (Rhodamine-Phalloidin) (用封闭液配制;贮存 液为0.2mg/ml,临用前稀释) 5.封片液: PBS; 0.1% p-phenylenediamine(抗淬灭 剂); 90% 甘油
Experiment protocol
1. 撕取洋葱内表皮,用5ml含有0.25%戊二醛和0.25% Triton X-100的CSB处理1-2分钟(烧杯1); 2. .0 3. 用5ml含有1%戊二醛的CSB固定20分钟(烧杯2) ; 4. 用5ml含有0.1%NaBH4 和0.1% Ttiton X-100的PBS 清 洗10分钟(临用前配置)(烧杯3) ; 4.用5ml含有0.1% Ttiton X-100的PBS清洗两遍,每次5 分钟(烧杯4) ; 5.用5ml封闭液处理10分钟(烧杯4) ; 6.用0.3ml 的0.4 µ g/ml荧光染料避光染色20分钟(EP管); 7.用5ml含有0.1% Triton X-100的PBS清洗两遍,每次5 分钟(烧杯4) ; 8.在载玻片上滴加1-2滴封片液,将洋葱表皮平铺其上,盖
1、撕取洋葱鳞茎内表皮(约1平方厘米)置于2~3ml pH6.8 磷酸缓冲液中待其下沉(烧杯1) ; 2、用2~3ml 1%Triton X-100处理20 min(烧杯1) ; 3、吸去Triton X-100,用M缓冲液2~3ml洗2次,每 次5 min (烧杯1) ; 4、 2~3ml 3%戊二醛固定40 min(烧杯2) ; 5、pH6.8磷酸缓冲液2~3ml洗2次,每次5 min,滤 纸吸去残液(烧杯1) ; 6、 2~3ml 0.2%考马斯亮蓝R250染色15分钟,然后 用蒸馏水小心冲洗1~2次(烧杯1) ; 7、将表皮铺放在载玻片上,加盖玻片,在高倍显 微镜或者油镜下进行观察。
考马斯亮蓝染色

考马斯亮蓝染色一产品简介:本考马斯亮蓝染色试剂盒(Commassie Blue Staining Kit)采用了最经典的考马斯亮蓝染色和脱色方法,以考马斯亮蓝R250为染料,可用于SDS-PAGE或非变性PAGE等蛋白电泳凝胶的常规染色和脱色,或Western转膜后PAGE胶上残余蛋白的检测。
使用本试剂盒,采用常规染色脱色方法累计时间达到2-3小时后可以观察到蛋白条带;采用快速染色脱色方法20分钟左右即可观察到蛋白条带。
观察到最清晰的蛋白条带则需染色脱色更长时间。
本试剂盒中的染色液和脱色液经过改良,不含有毒的甲醇,但含有刺激性气味的乙酸。
二保存条件:室温保存,至少一年有效。
注意事项:可以使用枪头盒或适当大小的培养皿作为染色和脱色的容器。
本染色液呈酸性,有轻微腐蚀性,使用时请作必要防护。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
三使用说明:1. 常规染色脱色方法:a. 电泳结束后,取凝胶放入适量考马斯亮蓝染色液中,确保染色液可以充分覆盖凝胶。
b. 置于水平摇床或侧摆摇床上缓慢摇动,室温染色1小时或更长时间。
注:具体的染色时间取决于凝胶的厚度和染色时的温度。
凝胶较厚,温度较低,则染色时间宜适当延长。
凝胶较薄,温度较高,则染色时间可以适当缩短。
通常染色至凝胶的颜色和染色液的颜色非常接近,在染色液中几乎看不清凝胶时,可以认为已染色充分。
染色2-4个小时或更长时间不会对最终的染色效果产生负面影响。
c. 倒出染色液。
染色液可以回收重复使用至少2-3次。
d. 加入适量考马斯亮蓝染色脱色液,确保脱色液可以充分覆盖凝胶。
e. 置于水平摇床或侧摆摇床上缓慢摇动,室温脱色4-24小时。
期间更换脱色液2-4次,直至蓝色背景基本上全部被脱去,并且蛋白条带染色效果达到预期。
通常蛋白条带在脱色1-2小时后即可出现。
注:脱色期间可以在脱色液中加入一片吸水纸,可以使部分染料吸附在吸水纸上,加快脱色。
脱色时间过长也会导致蛋白条带的颜色变浅。
考马斯亮蓝染色法

蛋白质浓度的测定──考马斯亮蓝染色法目的要求学习考马斯亮蓝(Coomassie Brilliant Blue)法测定蛋白质浓度的原理和方法。
实验原理考马斯亮蓝法测定蛋白质浓度,是利用蛋白质―染料结合的原理,定量的测定微量蛋白浓度的快速、灵敏的方法。
考马斯亮蓝G―250存在着两种不同的颜色形式,红色和蓝色。
它和蛋白质通过范德华力结合,在一定蛋白质浓度范围内,蛋白质和染料结合符合比尔定律(Beer’s law)。
此染料与蛋白质结合后颜色有红色形式和蓝色形式,最大光吸收由465nm变成595nm,通过测定595nm处光吸收的增加量可知与其结合蛋白质的量。
蛋白质和染料结合是一个很快的过程,约2min即可反应完全,呈现最大光吸收,并可稳定1h,之后,蛋白质―染料复合物发生聚合并沉淀出来。
蛋白质―染料复合物具有很高的消光系数,使得在测定蛋白质浓度时灵敏度很高,在测定溶液中含蛋白质5µL/ml时就有0.275光吸收值的变化,比Lowry法灵敏4倍,测定范围为10-100µg蛋白质,微量测定法测定范围是1-10µg蛋白质。
此反应重复性好,精确度高,线性关系好。
标准曲线在蛋白质浓度较大时稍有弯曲,这是由于染料本身的两种颜色形式光谱有重叠,试剂背景值随更多染料与蛋白质结合而不断降低,但直线弯曲程度很轻,不影响测定。
此方法干扰物少,研究表明:NaCl,KCl,MgCl2,乙醇,(NH4)2SO4无干扰。
强碱缓冲液在测定中有一些颜色干扰,这可以用适当的缓冲液对照扣除其影响。
Tris,乙酸,2―巯基乙醇,蔗糖,甘油,EDTA及微量的去污剂如Triton X―100,SDS,玻璃去污剂有少量颜色干扰,用适当的缓冲液对照很容易除掉。
但是,大量去污剂的存在对颜色影响太大而不易消除。
试剂与器材一、试剂考马斯亮蓝试剂:考马斯亮蓝G―250 100mg溶于50ml95%乙醇中,加入100ml85%磷酸,用蒸馏水稀释至1000ml,滤纸过滤。
掌握用考马斯亮蓝(Coomassie

[apparatus, material and reagent]
光学显微镜;烧杯、吸管、镊子、玻片染
色缸、载玻片、盖玻片;
新鲜洋葱鳞茎;
试剂 1.细胞骨架稳定液(CSB ,pH 6.1):10 mM MES; 138 mM KCl; 3 mM MgCl; 2 mM EGTA; 0.4M 甘 露醇 2. PBS:含0.1% 的TritonX-100 3.封闭液:PBS; 0.1% Ttiton X-100; 2% BSA 4.微丝荧光染料:0.4 µ g/ml罗丹明标记的鬼笔环肽 (Rhodamine-Phalloidin) (用封闭液配制;贮存 液为0.2mg/ml,临用前稀释) 5.封片液: PBS; 0.1% p-phenylenediamine(抗淬灭 剂); 90% 甘油
学而不思则罔思而不学则殆专业分享敬请收藏experimentprotocol1撕取洋葱鳞茎内表皮约1平方厘米置于23mlph68磷酸缓冲液中待其下沉烧杯12用23ml1tritonx100处理20min烧杯13吸去tritonx100用m缓冲液23ml洗2次每min烧杯1423ml3戊二醛固定40min烧杯25ph68磷酸缓冲液23ml洗2次每次5min滤纸吸去残液烧杯1623ml02考马斯亮蓝r250染色15分钟然后用蒸馏水小心冲洗12次烧杯17将表皮铺放在载玻片上加盖玻片在高倍显微镜或者油镜下进行观察
[Apparatus, material and reagent]
光学显微镜;烧杯、吸管、镊子、玻片染
色缸、载玻片、盖玻片;
新鲜洋葱鳞茎;
6mM磷酸盐缓冲液
(pH6.8)、M缓冲液、 1%Triton X-100、 0.2%考马斯亮蓝R250、 3%戊二醛。
考马斯亮蓝染色法定量阳离子脂质体

考马斯亮蓝染色法定量阳离子脂质体A Simple Quantification of Cationic Liposomes Using Commassie Blue Dye周冬梅 庄燕 谢晓芳 马轶凡摘 要 本文研究发现阳离子脂质体(例如DOTAP)与考马斯亮蓝染料相结合后,考马斯亮蓝染料的最大吸收峰从465 nm处飘移至622 nm处,并且在阳离子脂质体浓度为0-45 mg/ml范围内其622nm处的吸光光度值呈现线性关系。
终浓度为45mg/ml阳离子脂质体DOTAP与考马斯亮蓝染料结合后,622nm处吸光光度值为0.6,表明了此方法的灵敏度较高。
此外,阳离子脂质体颗粒表面的电荷,粒径大小,脂质成分等因素影响阳离子脂质体与考马斯亮蓝染料的结合反应。
考马斯亮蓝染色法是一种简单,灵敏的定量阳离子脂质体的新方法。
关键词 DOTAP ;考马斯亮蓝 ; 藻红BABSTRACT We reported a novel quantitative analysis of cationic liposomes using Coomassie blue dye. Binding of Coomassie blue dye to cationic liposomes (e.g. DOTAP) resulted in a shift of the absorption maximum of the dye from 465 nm to 622 nm, which allows the quantification of these vesicles. Color development peaked within 10 minutes after incubation at room temperature. The standard curve of DOTAP in Coomassie Brilliant blue dye was linear over 0-45 µg/ml and the absorption maximum at 6 nm was over 0.6, indicating a better sensitivity of the assay as compared with Erythrosine dyeing assay. The sensitivity of the assay is related with the surface charge, size and other lipid components in cationic liposomes. Overall, Coomassie blue dyeing assay is a reliable and simple assay for the quantification of cationic liposomes.KEYWORDS DOTAP;Coomassie Blue Dye ;Erythrosine B1 IntroductionCationic liposomes, the nano-particles consisting of either a single cationic lipid or a combination of cationic and neutral lipids, have been widely applied for gene and drug delivery [1]. Previous studies have shown that different doses of cationic liposomes exert different biological activities both in vivo and in vitro [2, 3]. Hence, it is highly desirable to accurately quantitate cationic liposome for the purpose of quality control of liposome-formulated drugs and vaccines.Currently, several quantitative methods, such as Reversed-phase High performance Liquid Chromatography (RP-HPLC) [4] and High performance Liquid Chromatography (HPLC) [5], gas chromatograph (GC), thin-layer chromatography (TCL) [6], are applied for measuring cationic liposomes. However, these methods are relatively expensive and labor intensive. Recently, Dass et al. [7] reported a simple quantitative method using erythrosine dye , however the sensitivity of this method was low. In the present study, we reported a Coomassie blue dyeing assay as a simple and sensitive method for the quantitation of cationic liposomes.2 Materials and Methods2.1 Preparation and characterization ofliposomeLiposomes were prepared by thin-film hydration method [1]with a minor modification. Briefly, a chloroform/methanol (2:1, v/v) solution containing 1mg 1,2-dioleoyl-3trimethyl- ammonium-propane (DOTAP) or DOTAP and 1,2-dioleoyl-sn-glycero-3-phosphocholine (DOPC) (the weight to weight ratio at 1:1) was placed in a round bottom vial and dried under a steady stream of dry nitrogen gas to form a lipid film. The lipid films were kept under vacuum with desiccators overnight to remove traces of organic solvent and then hydrated with PBS for 12h. The suspensions were sonicated in a bath-type sonicator for 10 min followed by extrusion through 0.22 µm polycarbonate membranes twice, and stored at 4°C before use. In some experiments, liposomes were sonicated for 5 -30 min to acquire varied particles size. The particle size and the zeta (]ćB(m v )CD86) potential of different liposomes were measured using a Delsa Nano C partical analyzer.2.2 Spectrophotometric scans of cationic6with 4 parts demonized water according to manufacture’s instruction. Erythrosine (10 µg/ml, Sigma-Aldrich) solution was prepared in 0.1M Tris, pH4.25 as described previously [7]. 8 µl of DOTAP liposome (500 µg/ml) was added into different dyes to reach the final concentration at 40 µg/ml in a 100 µl reaction volume. After 10-min incubation at room temperature, the samples were spectrophotometrically scanned from 300 to 700 nm by a Bio-Tek Universal Microplate Spectrophotometer using water as blank.2.3 standard curves of DOTAP liposomein different dyesDOTAP liposome (500 µg/ml) was serially diluted with either Coomassie Brilliant blue dye or Erythrosine solution to reach the final concentration at 10-50 µg/ml in a 100 µl reaction volume. After 10-min incubation, the absorbance of DOTAP in Coomassie blue dye or Erythrosine was measured at 622 nm and 540 nm, respectively. The OD values shown in figures were adjusted by deducting the OD value of blank from the OD value of each sample. In some experiments, the absorbance of DOTAP liposome in Coomassie blue dye was measured at 622 nm at time intervals of 0, 10, 20, 30, 40, 50, 60, 90 and 120min in order to determine the optimal reaction time.2.4 Assay interferenceTo examine if the size, surface charge or other lipid components of cationic liposome could affect the absorbance of cationic liposomes in Coomassie Brilliant bluedye, different cationic liposomes, including Lipofectamine2000 (Invitrogen,USA), DOTAP, and DOTA : DOPC (1:1, w/w) liposomes were serially diluted with Coomassie Brilliant blue dye solution to reach the final concentration at 1-50 µg/ml in a 100 µl reaction volume. The absorbance of each sample was measured at 622nm by a Bio-Tek Universal Microplate Spectrophotometer using water as blank. The OD values shown in figures were adjusted by deducting the OD value of blank from the OD value of each sample.3 Results and Discussion3.1 Standard curves and Spectro-photometric scans of liposomedye complexesThe wavelength of maximum absorbance ((max O )maxO maxO maxOD maxOD ) forfree Coomassie Brilliant Blue dye solution was 465 nm. Upon binding with DOTAP liposomes, (max O )max O max O max OD shifted from465 nm to 622 nm, and the OD value at 622 nm was 0.7, which was significantly higher that the OD value of freedye (Fig. 1A). Although DOTAP liposomes binding with Erythrosine dye also caused a shift of (max O )max O max O maxOD maxOD µfrom 528 nm to 540 nm, the maximal absorbance was only about 0.2, which was much lower than its OD value in CoomassieBrilliant Blue dye solution (Fig. 1B). Hence, Coomassie Brilliant Blue dyeing assay is more sensitive than Erythrosine for the quantification of cationic liposome. To compare the sensitivity of two assays using different dyes, max )maxmax max OD max OD µof DOTAP with different concentrations was measured in Coomassie Brilliant Blue andErythrosine, respectively. The standard curve of DOTAPin Coomassie Brilliant Blue was linear over the rangeof 0 – 45 µg/ml, and adjusted max )maxmax max OD maxOD µat 622nm was 0.6 (Fig. 2A). However, the standard curve of DOTAP in theerythrosine solution had a narrow linear range (0 – 8 µg/ml), and the max )max max max OD maxODµ at 540 nm was only about 0.1 (Fig. 2B). These data further confirmed the Coomassie blue dyeing assay as a sensitive assay for cationic liposomequantification.3.2 The stability of liposome-Coomassie blue dye complex To further optimize the reaction condition of Coomassie blue dying assay, we measured OD622 of DOTAP at different incubation time. The result showed that OD622 of DOTAP peaked within 10 minutes after incubation, and then slightly declined afterwards (Fig. 3). After a 2h incubation, the OD622 of DOTAP (10 µg/ml) reduced about 20-30%.3.3 Assay interferencesSince the quantification of cationic liposome with Coomassie blue dying assay relies on the binding of the dye to liposomes, we therefore investigated the effect of potential interferences, such as particle size, surface charge, and lipid components on the sensitivity of the assay. The result showed that OD622 of DOTAP slightly decreased with the particle size decreased, which suggests that larger liposomes bind Coomassie blue dye more potently than smaller liposomes (Fig. 4).Moreover, we observed that the liposomes containing neutral lipid components, such as DOTAP:DOPC (1:1, w/w) and Lipofectamine 2000, a commercial cationic liposome had a lower OD value at 622 nm as compared with DOTAP liposome(Fig. 5). The reduced OD value can be due to the decreased surface charge of cationic liposomes. However, the potential effect of other lipid or non-lipid component on assay sensitivity can not excluded and will be further investigated. Nonetheless, the standard curves of DOTAP:DOPC (1:1) and Lipofectamine 2000 remained to be linear over 0-20 µg/ml, indicating Coomassie blue dyeing assay is capable of600650700750622nmh (nm)ne B55557058560040nmh (nm)Coomassie Brilliant Blue(A)Erythrosine B 036912151821240.00.10.20.3DOTAP (P g/ml)(B)O D 540Coomassie Brilliant Blue3504004505005506006507007500.20.40.60.80P g/ml 40P g/ml465nm622nm(A)Wavelength (nm)A b s o r b a n c eErythrosine B4804955105255405555705856000.10.20.30.40.5528nm540nm(B)Wavelength (nm)A b s o r b a n c eCoomassie Brilliant Blue(A)O D 622O D 540Incubation time (min)O D 6221502002503003504000.250.300.350.40size(nm)O D 622quantitate different cationic liposomes despite other lipidcomponents.4 ConclusionCoomassie blue dyeing assay is a simple and sensitivemethod for the quantification of cationic liposomes.Fig. 1. The absorption spectra of Coomassie Brilliant blueand erythrosine dyes with or without DOTAP (40 ug/ml)Fig. 2. The standard curves of DOTAP in CoomassieBrilliant blue dye and erythrosine solutionFig. . Standard curves of different cationic liposomes inCoomassie Brilliant blue dye solution.AcknowledgmentThis project was supported by Shenzhen Basic Research Program (LC200903160383A), and the National Basic Research Program of China (973 grant: 2010CB732600).References[1]W. L . Yan and L Huang, “Recent Advances in Liposome-BasedNanoparticles for Antigen Delivery”, Polymer Review, vol. 47, pp. 329-344, 2007.[2]W.L. Yan and L. Huang, “The effects of salt on the physicochemical properties and immunogenicity of protein based vaccine formulated in cationic liposome”, International Journal of Pharmaceutics, vol. 368, pp. 7, 2008.[3]Aviva Joseph, N. I. Cooper, S. Samira, O. Flasterstein, H.4804955105255405555705856000.10.2528nm540nmA30.00.101530456075901051201351500.00.10.20.3Incubation time (min)O D 622lipid (P g/ml)480495510525540555570585600A b O0.10.3O D 6220.10.2528nm540nmA b 030.00.1O 01530456075901051201351500.00.2O D 622lipid (P g/ml)58Elivahu, D. Simberg , I. Goldwaser and Y . Barenholz , “A new intranasal influenza vaccine based on a novel polycationic lipid—lipid—ceramide carbamoyl-spermine (CCS) Immunogenicity and efficacy studies in mice”, Vaccine, vol.24, pp. 3990-4006, 2006.[4]O. Meyer, O. Roch, D. Elmlinger and H . V. J. Kolbe,“Direct lipid quantitation of cationic liposomes by reversed-phase HPLC in lipoplex preparation process”, European Journal of Pharmaceutics and Biopharmaceutics, vol. 50, pp. 353-356, 2000.[5]H. J. Felgner,“separation and Quantitation ofCationic liposome Components by High Performance liquid Chromatography with Evaporative light-Scanttering Detection”, Pharmaceutical Research, vol. 14, pp.1269-1271, 1997.[6]S. Rodríguez, M. V. Cesio, H. Heinzen and P. Moyna,“Determination of the phospholipid/ lipophilic compounds ratio in liposomes by thin-layer chromatography scanning densitometry”, Lipid, vol. 35, pp. 1033-1036, 2000.[7]C. R. Dass,“Formulation and quality control of cationic liposomes”, S. Pac. J. Nat. Sci, vol. 19, pp. 18-23, 2001.作者简介周冬梅 在读硕士,中国科学院先进技术研究院客座学生。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
考马斯亮蓝染色
推荐选用前三种染色方法,另有传统考马斯亮蓝染色法和网上经验,染色效果不好,不推荐使用,仅供参考。
(见后页比对照片)
操作步骤:
1、取出SDS-PAGE凝胶,经超纯水漂洗;(以下每步操作皆在摇床上进行。
)
2、固定:将凝胶放入相应的固定液中,固定1小时;
3、染色:取出凝胶,放入相应的染色液中,过夜染色;(也可依实际情况缩短时间)
4、脱色(胶体法&改良法):凝胶放入纯水中洗脱,换液数次;
脱色(Neuhoff法):取出凝胶,用0.1 M Tris-H3PO4缓冲液(pH6.5)漂洗2分钟。
再用25%乙醇淋洗<1 min。
然后再用10%乙酸中在室温脱色2小时即可。
试剂的配制:
1、胶体考马斯亮蓝染色法(colloidal Coomassie brilliant blue,cCBB):
固定液:40%甲醇、10%乙酸
染色液:1.6%磷酸、8%硫酸铵、0.02% CBB-G250、20%乙醇
脱色液:H2O
2、改良考马斯亮蓝染色法(modified Coomassie brilliant blue,mCBB):
固定液:40%甲醇、10%乙酸
染色液:10%磷酸、10%硫酸铵、0.12% CBBG250、20%乙醇(着色1小时即可)。
脱色液:H2O
3、Neuhoff染色法:
固定液:12%三氯醋酸
染色液:2%磷酸、10%硫酸铵、0.02% CBB-G250、使用前振摇。
染色时,取一定体积的染色液,加入1/4体积的甲醇。
脱色所需:0.1 M Tris-磷酸缓冲液(pH6.5)、25%乙醇、10%醋酸
4、传统考马斯亮蓝染色法:
固定液:45.4%甲醇、4.6%乙酸
染色液:45.4%甲醇、4.6%乙酸、0.1% CBB-G250
脱色液:5%甲醇、7.5%乙酸
5、网上方法:
固定液:40%甲醇、10%乙酸
染色液:30%甲醇、10%乙酸、0.125% CBB-G250
脱色液:30%甲醇,10%乙酸
比对照片:每块胶左道是Marker(质量原因,未跑开( ˇˍˇ ))上样量5μl,右道是BSA(分子量68kDa),上样量为3μg.
Neuhoff法
传统法胶体法改良法网上法。
