环境化学第三章水环境化学第二节水中无机污染物的迁移转化(20200825195345)
环境化学第3章水环境化学-2-无机污染物的迁移转化

随pH值的变化而改变。铝可发生聚合反应,最终生成
[Al(OH)3]∞的无定形沉淀物。 ②铁:铁是丰量元素,水解反应和形态与铝类似。 ③锰:锰与铁类似,其丰度不如铁,但溶解度比铁高。 ④硅:硅酸能生成聚合物,并可生成胶体以至沉淀物。
2Si(OH)4 H6SiO7 + H2O
(SinO2n-m(OH)2m )
属污染物在水环境中迁移转化的基本原理。
思考题
1. 叙述天然水体中存在哪几类颗粒物?
2. 什么是表面吸附作用、离子交换吸附作用和专属吸附
作用?
3. 根据腐殖质在溶液中的溶解度不同划分为哪几类?
4. 叙述水中颗粒物以哪些方式进行聚集?
2.1颗粒物与水之间的迁移
★2.1.1水中颗粒物的类别 矿物微粒和黏土矿物 金属水合氧化物
吸 引
吸 引
(1)水中离子浓度高
天然水环境和水处理过程中所遇到的颗粒聚集方式: (1)压缩双电层凝聚:
由于水中电解质浓度增大而离子强度升高,压缩扩散
层,使颗粒相互吸引结合凝聚。 实质:电解质加入--与反离子同电荷离子↑--压缩双 电层--ξ电位↓--凝聚
对于水中的负电荷胶体,投入的电解质——混凝剂应是正 电荷或聚合离子,如Na+、Ca2+、Al3+等,其作用是压缩 胶体双电层。
2.2水中颗粒物的聚集
凝聚(Coagulation):由电介质促成的聚集; 絮凝(Flocculation):由聚合物促成的聚集
电位离子 反离子
滑动面
胶团边界
胶核
吸附层 扩散层
胶粒
ξ电位
Ψ电位
胶体的双电层结构
– 胶体的结构:
按照以上的描述胶体粒子的结构式可写为:
【环境化学】第3.2章 水环境化学——第二节 水中无机污染物的迁移转化

22
吸附等温线和等温式
吸附等温线: 在固定的温度下,当吸附达到平衡时, 颗粒物表面上的吸附量(G)与溶液中溶质平衡浓度 (C)之间的关系,可用吸附等温线来表示。
吸附等温线类型:
Henry型(H型) Freundlich型(F型) Langmuir型(L型)
腐植质分子与金属络合的机理★
Hum
COO OH
-
+[Fe(OH)(H2O)x-1]2+
低pH
Hum
COO O
Fe
OH (O) x-1
+ H+
在低pH时,从腐植质的酸性基团中置换出一个质子
Hum COOHO-+ [Fe(OH)(H2O)x-1]2+
高pH
[ Hum
COO O
Fe
OOHH(H2O)x-2]-+2H+
23
H型等温式为: G = kc
k: 分配系数;等温线为直线型
F型等温式为:G = kc(1/n)
1)k 是c=1的吸附量,大致表示 吸附能力的强弱; 2)1/n为斜率,表示吸附量随 浓度增长的强度; 3)该等温线不能给出饱和吸附 量。
L型等温式: G = G0c/(A+c)
G0—单位面积上达到饱和时的 最大吸附量; A—常数。
胶体表面的化学反应(见下页胶片)
25
胶体表面的化学反应
是氢氧化物和氧化物的典型行为 与pH值有关
在酸性介质中 M(OH)n (s) + H+ → M(OH)n-1(H2O)+(s) 粒子带净正电荷
在碱性介质中 M(OH)n (s) → MO(OH)n-1-(s) + H+ 粒子带净负电荷
第三章 水环境化学水中无机污染物的迁移转化汇总

20
1. 胶体颗粒凝聚的基本原理和方式
1) 带电胶粒稳定性的经典理论--DLVO理论 带电胶粒的两种相互作用力
双电层重叠时的静电排斥力 粒子间的长程范德华吸引力
DLVO理论认为,当吸引力占优势时,溶胶发生聚 沉; 当排斥力占优势,并大到足以阻碍胶粒由于 布朗运动而发生聚沉时,则胶体处于稳定状态。 颗粒在相互接近时两种力相互作用的总位能随相 隔距离的变化而变化: 总位能 VT=VR+VA 式中:VA——由范德华力所产生的位能; VR——由静电排斥力所产生的位能。
4
一 、 颗粒物与水之间的迁移
2、水环境中颗粒物的吸附作用
专属吸附是指吸附过程中,除了化学键的作
用外,尚有加强的憎水键和范德华力或氢键在 起作用。
专属吸附作用不但可使表面电荷改变符号, 而且可使离子化合物吸附在同号电荷的表面上。
5
表3-8水合氧化物对金属离子的专属吸附 与非专属吸附的区别
项目 非专属吸附 专属吸附 发生吸附的表面净电荷的符号 - -、0、+ 金属离子所起的作用 反离子 配位离子 吸附时发生的反应 阳离子交换 配位体交换 发生吸附时体系的PH值 >零电位点 任意值 吸附发生的位置 扩散层 内层 对表面电荷的影响 无 负电荷减少, 正电荷增多 注:本表摘自陈静生主编,1987。
(4)水体悬浮沉积物
悬浮沉积物是以矿物微粒,特别是粘土矿物 为核心骨架,有机物和金属水合氧化物结合在矿 物微粒表面上,成为各微粒间的粘附架桥物质, 把若干微粒组合成絮状聚集体(聚集体在水体中 的悬浮颗粒粒度一般在数十微米以下),经絮凝 成为较粗颗粒而沉积到水体底部。
(5)其他
3
一、 颗粒物与水之间的迁移
环境化学教案 第三节水中无机污染物的迁移转化(氧化还原2)
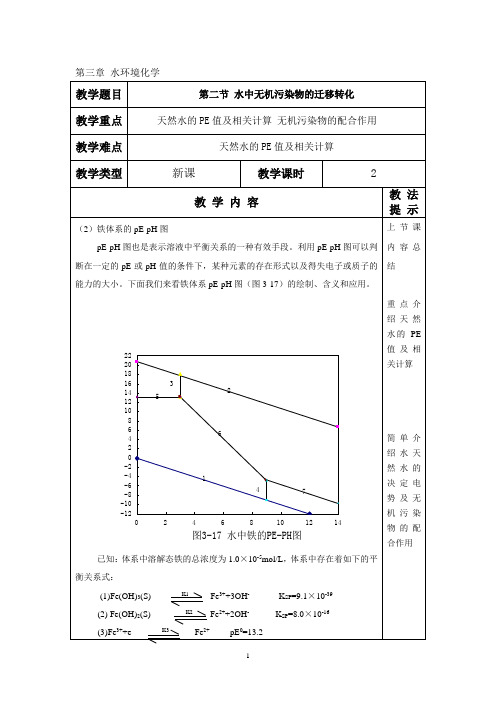
由此反应可知,当有机物进入天然水后,水体中溶解氧的含量会迅速降低。如果有机物的数量非常多的话,可以使水体中溶解氧全部被消耗掉,甚至可以使水体转换成为沼泽。在水中,NH4+只有被氧化成NO3-后,氮才能被藻类利用。
例2求被大气氧所饱合的中性天然水的pE值。
解:该体系溶解氧起决定电势作用,溶解氧的氧化还原反应为:
pE=pE0+ [H+]
已知:pE0=20.75
pH=7 [H+]=10-7
将已知条件代入pE的表达式,得:pE=13.58。该体系pE值较高,是一个氧化性体系。
例3求微生物作用产生甲烷的中性厌氧水的pE值及溶解氧的分压
天然水是一个非常复杂的混合体系,其中存在着众多的氧化剂和还原剂。其中常见的氧化剂包括溶解氧、Mn(IV)、Fe(III)、和S(VI),常见的还原剂包括有机物、Mn(II)、Fe(II)、S(-II)。当我们要求得某种天然水的pE值时,首先需要确定哪种物质起决定电势作用,然后根据起决定电势作用物质的氧化还原反应,求得体系的pE值。一般的天然水体中起决定电势作用的物质是溶解氧,当有机物含量非常高时,则有机物起决定电势作用。铁和锰起决定电势作用的情况则比较少见。下面我们来看两种极端情况下体系的pE值。
pE=-4.13
将已知条件代入pE的表达式,得: =3.0×10-72atm。
由此可见该体系中溶解氧的分压非常低,一般水体中的溶解氧的分压均超过此值。由于天然水的pE值随水中溶解氧的减少而降低,因此表层水pE值较高,底层水pE值较低。
例3:从湖水中取出深层水,其PH=7.0,含溶解氧浓度0.32mg/L,请计算PE和Eh。(KH=1.26*10-8[mol/(L·Pa)]
水环境化学(3)-4-22

迁移过程中,大部分重金属在水体 中的可溶态都是配合形态,随环境条件 改变而运动和变化。
至于毒性,自由铜离子的毒性大于 配合态铜;甲基汞的毒性大于无机汞。
1、天然水体中配合作用的特点
(Character of Complexation in Natrual Water Bodies)
(1)大多数配合物稳定地存在于水中;
(2)羟基、卤素配体的竞争配位作用, 影响金属难溶盐的溶解度; (3)重金属离子与不同配体的配位作用, 改变其化学形态和毒性。
2、分类 (Classification)
天然水体中常见的配位体可分为 无机和有机两类。 其中重要的无机配体有:OH-、Cl-、 CO32- 、 HCO3- 、 F- 、 S2- ,其中最重要的 无机配体是OH-、Cl-。
3、腐殖质形成的螯合物
腐殖质对环境中几乎所有金属离子都有螯合作用,尤其是对过渡金 属 螯 合 性 更 强 。 对 金 属 螯 合 能 力 强 弱 一 般 符 合 欧 文 - 威 廉 ( Irving-
Willian)次序,即
Mg<Ca<Cd<Mn<Co<Zn≈Ni<Cu<Hg
从海洋沉积物中分离出的腐殖质,其对金属的总螯合容量约97-150mg/g; 对于不同金属其螯合能力不同,Cu、Zn、Ni、Co、Mn,螯合容量分别为
无机螯合剂较少,如聚合磷酸盐,由相 邻的PO43-基团中的氧原子同金属离子形成环 状配位结构。
聚合磷酸盐最基本结构形式为:
(二) 配合物在溶液中的稳定性
稳定常数是衡量配合物稳定性大小的尺度,例如Zn(NH3)2+ 总反应 Zn2+ + 4NH3 = Zn(NH3)42+
第二节 水中无机污染物的迁移转化

第二节水中无机污染物的迁移转化水中无机污染物特别是重金属污染物进入水体,不能被生物降解,主要是通过沉淀-溶解、氧化-还原、配合作用、胶体形成、吸附-解吸等作用进行迁移转化。
一、颗粒物与水之间的迁移1、矿物颗粒物和黏土颗粒物常见矿物颗粒物为石英、长石、云母及黏土矿物等硅酸盐矿物,主要由物理作用形成。
2、金属水合氧化物:铝、铁、锰、硅等金属以无机高分子及溶胶等形态存在。
例:铝在岩土中是丰量元素,在水中浓度低,<0.1mg/L。
水解,主要形态是:Al3+Al(OH)2+Al2(OH)24+Al(OH)22+Al(OH)3+等铁水合氧化物:Fe3+Fe(OH)2+Fe(OH)2+ Fe2(OH)24+Fe(OH)3等硅酸聚合物:Si n O2n-m(OH)2m3、腐殖质是一种代负电的高分子弱电解质。
4、水体悬浮沉积物是以矿物微粒为核心骨架,有机物和金属水合氧化物结合在矿物微粒表面上,经絮凝成为较粗颗粒而沉积在底部。
5、其它藻类、细菌、病毒、表面活性剂、油滴等。
二、水环境中颗粒物的吸附作用1、表面吸附:胶体具有巨大的表面积和表面能;属物理吸附,胶体表面积越大,吸附越强。
2、离子吸附:由于胶体表面的电荷引力。
3、专属吸附:除了化学键以外,尚有加强的憎水键及范德华力或氢键起作用。
水锰矿对Co、Cu、Ni、K和Na离子的吸附及其随pH的变化图:对于碱金属离子,在低浓度时,体系pH在水锰矿ZPC以上时发生吸附。
表明其为离子吸附。
而Co 、Cu 、Ni 等在体系pH 在ZPC 处或小于时都能进行吸附,这表明不带电荷或带正电均能吸附过渡金属。
4、吸附理论――有效层流脱理论5、吸附方向和推动力6、吸附等温线和等温式(1) 等温吸附经验式――弗罗因德利希式Freundlich 型等温式为: G =kC 1/n两边取对数: log G =log k +1/nlog C,nkP P k n Γ=Γ--吸附量-吸附压力常数(2) 单分子层吸附理论――兰格缪尔吸附等温式单分子层吸附吸附剂表面是均匀被吸附的分子与其它同气体分子无作用力吸附是一个动态平衡φ被吸附质分子覆盖的吸附表面积覆盖率()=吸附剂的总表面积 Langmuir 型吸附等温线:G =G 0C /(A +C ) 1/G =1/G 0+(A /G 0)(1/C )G0------单位表面上达到饱和时间的最大吸附量; A-------常数(3)Henry 型吸附等温线为直线,等温式为: G =kCk------分配系数影响吸附作用的因素:(a) pH 值的影响:一般情况下,吸附量随pH 升高而增大。
03-2环境化学第三章__水环境化学

1 的强弱。 n
为斜率,它表示吸附量随浓度增长的强
度。
该等温线不能给出饱和吸附量。
③Langmuir型吸附等温线 G=G0c/(A+c) 1/G=1/G0+(A/G0)(1/c) G0---单位表面上达到饱和 时间的最大吸附量;
G0
G0/2 L型
A
1/G
c
L型
A---常数
1/c
1 1 以 G 对 作图,同样得到一直线。 c
该等温线在一定程度上反映了吸附剂与吸附物的 特性,其形式在许多情况下与实验所用溶质浓度区
段有关。当溶质浓度甚低时,可能在初始区段中呈
现H型,当浓度较高时,曲线可能表现为F型,但统
一起来仍属于L型的不同区段。
④影响吸附作用的因素:
Fe(OH)2+、Fe(OH)2+、Fe2(OH)24+和Fe(OH)3。 3)锰 与铁类似,其丰度虽然不如铁,溶解度比铁高, 也是常见的水合金属氧化物。 4)硅酸的单体H4SiO4,若写成Si(OH)4,则类似于多价金 属,是一种弱酸,过量的硅酸将会生成聚合物,并可生 成胶体以至沉淀物。
重要的水合氧化物主要有:
4、吸附等温线
1)吸附等温线和等温式:水体中颗粒物对溶质的
吸附是一个动态平衡过程,在固定的温度条件下,
当吸附达到平衡时,颗粒物表面上的吸附量 (G)与
溶液中溶质平衡浓度 (c) 之间的关系,可用吸附等 温线来表达。 水体 中常见 的吸附 等温线 有三类 : Henry 型 、 Freundlich型、 Langmuir型,简称为 H、 F、 L型。
① Henry 型吸附等温线为直线,等温式为: G=kc
第二节 水无机污染物的迁移转化

第二节水中无机污染物的迁移转化水中无机污染物特别是重金属污染物进入水体,不能被生物降解,主要是通过沉淀-溶解、氧化-还原、配合作用、胶体形成、吸附-解吸等作用进行迁移转化。
一、颗粒物与水之间的迁移1、矿物颗粒物和黏土颗粒物常见矿物颗粒物为石英、长石、云母及黏土矿物等硅酸盐矿物,主要由物理作用形成。
2、金属水合氧化物:铝、铁、锰、硅等金属以无机高分子及溶胶等形态存在。
例:铝在岩土中是丰量元素,在水中浓度低,<0.1mg/L。
水解,主要形态是:Al3+Al(OH)2+Al2(OH)24+Al(OH)22+Al(OH)3+等铁水合氧化物:Fe3+Fe(OH)2+Fe(OH)2+ Fe2(OH)24+Fe(OH)3等硅酸聚合物:Si n O2n-m(OH)2m3、腐殖质是一种代负电的高分子弱电解质。
4、水体悬浮沉积物是以矿物微粒为核心骨架,有机物和金属水合氧化物结合在矿物微粒表面上,经絮凝成为较粗颗粒而沉积在底部。
5、其它藻类、细菌、病毒、表面活性剂、油滴等。
二、水环境中颗粒物的吸附作用1、表面吸附:胶体具有巨大的表面积和表面能;属物理吸附,胶体表面积越大,吸附越强。
2、离子吸附:由于胶体表面的电荷引力。
3、专属吸附:除了化学键以外,尚有加强的憎水键及范德华力或氢键起作用。
水锰矿对Co、Cu、Ni、K和Na离子的吸附及其随pH的变化图:对于碱金属离子,在低浓度时,体系pH在水锰矿ZPC以上时发生吸附。
表明其为离子吸附。
而Co 、Cu 、Ni 等在体系pH 在ZPC 处或小于时都能进行吸附,这表明不带电荷或带正电均能吸附过渡金属。
4、吸附理论――有效层流脱理论5、吸附方向和推动力6、吸附等温线和等温式(1) 等温吸附经验式――弗罗因德利希式Freundlich 型等温式为: G =kC 1/n两边取对数: log G =log k +1/nlog C,nkP P k n Γ=Γ--吸附量-吸附压力常数(2) 单分子层吸附理论――兰格缪尔吸附等温式单分子层吸附吸附剂表面是均匀被吸附的分子与其它同气体分子无作用力吸附是一个动态平衡φ被吸附质分子覆盖的吸附表面积覆盖率()=吸附剂的总表面积 Langmuir 型吸附等温线:G =G 0C /(A +C ) 1/G =1/G 0+(A /G 0)(1/C )G0------单位表面上达到饱和时间的最大吸附量; A-------常数(3)Henry 型吸附等温线为直线,等温式为: G =kCk------分配系数影响吸附作用的因素:(a) pH 值的影响:一般情况下,吸附量随pH 升高而增大。
第三章水环境化学水中无机污染物的迁移

3.2 硫化物
H2S = H+ + HS— HS— = H+ + S2— 即: H2S = 2H+ + S2— 则:K1,2 = [H+][S2—]/[H2S] =K1 K2 = 1.16×10-22 如溶液中存在二价金属离子Me2+,则有: [Me2+][S2-] = Ksp
5、配合作用
5.1 配合物在溶液中的稳定性 5.2 羟基对重金属离子的配合作用 5.3 氯离子对重金属的配合作用 5.4 腐殖质的配合作用 5.5 有机配体对重金属迁移的影响
5.4 腐殖质的配合作用
天然水中对水质影响最大的有机物是腐殖质。 它有生物体物质在土壤、水和沉积物中转化而 来。可分为: 腐殖酸(Humic acid):可溶于稀碱液,但不 溶于酸的部分 富里酸(Fulvic acid) :可溶于碱液,又可溶于 酸的部分 腐黑物(Humin):不能被酸和碱提取的部分 研究表明:重金属在天然水中主要以腐殖酸的 配合物存在。
4.4 无机氮氧化物的氧化还原转化
水中氮主要以NH4+或NO3—形态存在, 在某种情况下也可能有中间产物NO2—。
4.5 无机铁的氧化还原转化
Fe3+ + e → Fe2+ pE0=13.05 当pE<<pE0时, [Fe3+]<<[Fe3+] 当pE>>pE0时, [Fe3+]>>[Fe3+]
第二节 水中无机污染物的迁移转化
1、颗粒物与水之间的迁移 2、水中颗粒物的聚集 3、溶解和沉淀 4、氧化-还原
环境化学第三章__水环境化学(PPT)

第十二页,共九十页。
代入亨利定律即可求出氧在水中的摩尔(mó ěr)浓度为:
[O2(aq)]= KH·PO2=1.26×10-8×0.2056×105 =2.6×10-4 mol/L
氧的分子量为32,因此其溶解度为8.32 mg/L。
第三章 水环境 化学 (huánjìng)
第一节 天然水的根本特征及污染物的存在形态(xíngtài)
第二节 水中无机污染物的迁移转化 第三节 水中有机污染物的迁移转化
第一页,共九十页。
内容提要: 本章主要介绍天然水的根本特征,水中重要污染物存在形态及分布, 污染物在水环境中的迁移转化(zhuǎnhuà)的根本原理。
第二十三页,共九十页。
❖❖[图CO中3的2p-]H可=以8.3忽可略以不作计为,一水个分中界只点有,[CpOH2<〔8.a3q,〕很]、小[,H22CO3]、
❖[HCO3-],可以只考虑一级电离平衡(pínghéng),即此时:
❖
❖❖❖当溶所液以的ppHH>=8p[.3KH时1-],lg[[KHH122[CC[HHOO23C3C**]OO3]+3可*]l]g以[H忽C略O不3-计]。,水中只存在
P↑↓R
C 1 0 6H 2 6 3 O 1 1 0N 1 6P 1 3 8 O 2
第十七页,共九十页。
〔二〕天然水的性质(xìngzhì)
1、碳酸平衡〔重点〕
对于CO2-H2O系统,水体中存在着CO2〔aq〕、H2CO3、HCO3-和CO32-等 四种化合态,常把CO2(aq)和H2CO3合并为H2CO3*,实际上H2CO3含量 (hánliàng)极低,主要是溶解性气体CO2(aq)。
第三章 水环境化学(3)

3.沉积物中重金属的释放 . -盐浓度升高:碱金属和碱土金属离子可将吸附在固体颗粒上 重金属从悬浮物或沉积物中重新释放属二次 污染问题,对水生系统及饮用水的供给都是 的金属离子交换出来。 -氧化还原条件的变化:在湖泊、河口及近岸沉积物中一般均 氧化还原条件的变化 有较多的耗氧物质,使一定深度以下沉积物中的氧化还原电位 急剧降低(实际上就是说具有还原性),使金属氧化物部分或 全部溶解,从而导致被其吸附的或与之共沉淀的重金属也同时 释放出来。 降低pH值 pH H -降低pH值:pH值降低,导致碳酸盐和氢氧化物的溶解,H+ 的竞争作用增加了金属离子的解吸量。 -增加水中配合剂的含量:天然或合成的配合剂使用增加,能 增加水中配合剂的含量 和重金属形成可溶性配合物,有时这种配合物稳定度较大,可 以溶解态形式存在,使重金属从固体颗粒上解吸出来。 -生物化学迁移:一些生物化学迁移过程也能引起金属的重新 生物化学迁移 释放,从而引起重金属从沉积物中迁移到动、植物体内,可能 沿食物链进一步富集或直接或间接进入水体。
颗粒聚集方式
——压缩双电层凝聚 压缩双电层凝聚 ——专属吸附凝聚:胶体颗粒专属吸附异电离子,产生电中和,使颗粒脱稳而凝聚。 专属吸附凝聚: 专属吸附凝聚 这种凝聚可以出现超荷状况,使胶体颗粒改变电荷符号后,又趋于稳定分散。 ——胶体相互凝聚:两种电荷符号相反的胶体相互中和而凝聚。 胶体相互凝聚: 胶体相互凝聚 ——边对面絮凝:粘土矿物颗粒形状呈板状,其板面带负电,边缘带正电。 边对面絮凝: 边对面絮凝 ——第二极小值絮凝 第二极小值絮凝:在一般情况下,位能综合曲线上的第二极小值较弱,不足以 第二极小值絮凝 发生颗粒间的结合,但若颗粒较粗或在某一维方向上较长,就有要可能产生较深的 第二极小值,使颗粒相互聚集。这种聚集属于较远距离的接触,颗粒本身并未完全 脱稳,因而比较松散,具有可逆性。这种絮凝在实际体系中有时是存在的。 ——聚合物粘结架桥絮凝 聚合物粘结架桥絮凝:聚合物具有链状分子,它可以同时吸附若干个胶体粒子, 聚合物粘结架桥絮凝 在微粒间架桥粘结,使它们聚集成团,这时胶体颗粒可能并未完全脱稳。若聚合物 同时可发挥电中和及粘结架桥作用,就表现出较强的絮凝能力。
第二节水中无机污染物的迁移转化

2. pH对水解速率的影响 水解速率: RH = Kh [C]= {KA[H+] + KN + KB[OH-]} [C]
式中: KA、KN 、KB ——分别为酸性、碱性和中性催化过 程的二级反应水解速率常数
Kh = KA[H+] + KN + KBKw/[H+]
c溶解相中有机毒物的浓度kv挥发速率常数kv单位时间混合水体的挥发速率常数z水体的混合深度p在所研究的水体上面有机毒物在大气中的分压kh亨利定律常数?第三节水中有机污染物的迁移转化二挥发作用kvcpkhzkvcpkhtc??kvctc??有机物可溶解相分数w
第三章
第三节
水环境化学
有机污染物的迁移转化
第三节 水中有机污染物的迁移转化 水解速率常数:Kh = KA[H+] + KN + KBKw/[H+]
第三节 水中有机污染物的迁移转化 对于IAN点应满足于: lgKh = lg KA – pH = lg KN 三条切线得到三个交点, IAN IAB 和K INB / K ) pH= lg KN –lg KA = -、 lg ( N A 对于IAB点应满足于: lgKh = lg KA – pH = lgKBKw + pH pH = -1/2 lg(KBKw/KA) 对于INB点应满足于: lgKh = lgKBKw + pH = lg KN pH = - lg(KBKw/ KN)
水体中,若悬浮物中85%为细颗粒,有机碳含量为
5%,其余粗颗粒有机碳含量为1%,已知该有机物 在水中溶解度为0.05mg/L,那么,其分配系数(Kp)
就可根据公式计算出:
解: lgKow = 5.00-0.670lg(0.05×103/192)=5.39 则 Kow =2.46×105 Koc=0.63 Kow=1.55×105 Kp = 1.55×105[0.2(1-0.85)(0.01) + 0.85×0.05] = 6.63×103
《环境化学》第三章 水环境化学

d) 水体悬浮沉积物:水体中胶体物质聚集体。矿物微粒为 骨架,有机物和水合物结合在表面
e) 藻类、细菌、病毒、油迹、表面活性物质
一、颗粒物与水之间的迁移
二、水中颗粒物的聚集
异体凝聚理论
适用于处理物质本性不同、粒径不等、电荷符号不同、电位 高低不等之类的分散体系
电性相异的胶粒相接近,吸引力占优势 电性相同的胶粒相接近,位能最大值取决于荷电较弱而
电位较低的一方。 只要有一种的稳定性甚低而电位达到临界状态,就必然
发生快速凝集
二、水中颗粒物的聚集
口沉积物氧化还原电位降低 ③ 降低pH值, 导致碳酸盐和
氢氧化物溶解 ④ 增加水中配合剂的含量, 稳
定的配合物的形成导致重金 属元素的形态变化
二、水中颗粒物的聚集
凝集:由电解质促成的胶体颗粒聚集 絮凝:由聚合物促成的胶体颗粒聚集
DLVO理论——解释胶体聚集的理论
DLVO理论假设: a) 胶粒为粒度相等的球体 b) 引力:多分子范德华力(VA) c) 斥力:扩散双电层排斥力(VR)(静电+水化膜) d) 胶粒间的综合位能: VT = VR + VA
(1)
Fe3+ + 2H2O = 2H+ + Fe(OH)2+
(2)
H++OH-=H2O
(3)
Fe(OH)3(s) = Fe(OH)2+ + OH-
(4)
lgK4=lgK1+lgK2+2lgK3=(-38)+(-6.74)+214=-16.74
优选环境化学第三章水中无机污染物的迁移转化

2020/9/4
21
水处理中新型絮凝剂
无机高分子絮凝剂 以三氯化铁、硫酸铝和碱式氯化铝等 为基体制备 如:聚合硫酸铁(poly ferric sulfate, PFS)、含硼聚硅硫酸铁、聚合硅铝酸铁 等Al2(SO4)3- CPAM(阳离子聚丙烯胺)
2020/9/4
22
水处理中新型絮凝剂
有机高分子絮凝剂
2020/9/4
18
天然水环境和水处理条件下主要的颗 粒物聚集方式
1.压缩双电层的聚集
水中电解质浓度增大而离子强度增大, 压缩扩散层,颗粒物吸引而聚集
2. 专属吸附凝聚
胶体颗粒专属吸附异电的离子化合态, 降低表面电位,产生电中和现象,使颗粒 物聚集
2020/9/4
19
天然水环境和水处理条件下主要的颗 粒物聚集方式
2020/9/4
7
一、颗粒物与水之间的迁移
悬浮沉积物
各种环境胶体物质的聚集物,组成不固定
其他
湖泊中的藻类、污水中的细菌、病毒、废 水中的表面活性剂或油滴。
2020/9/4
8
2.水环境中颗粒物的吸附作用
表面吸附—物理吸附,与胶体的比表面 积有关。
离子交换吸附—物理化学吸附,水环境中 一部分胶体带负电荷,吸附一部份阳离子, 同时释放等量其它阴离子。
属可逆反应,不受温度影响,交换吸附能力 与溶质的性质、浓度、吸附剂性质有关
2020/9/4
9
2.水环境中颗粒物的吸附作用
专属吸附—受化学键作用外,还受加强 的憎水键、 范德华力、氢键等的作用。 在水环境中:配合离子、无机高分子、有 机离子、 有机高分子专属吸附强烈,水 合氧化物胶体对金属离子有较强的专属吸 附。 氧化物表面配位吸附模式(p124)
环境化学水环境化学第二节

(α1 ≈1, α2=K2[HCO3-]/[H+]),HCO3-为主
lg[Ca2+] = 0.5lgKSP–0.5lgk2–0.5lgpH 当pH < pK1时, α2 ≈ K1K2 / [H+]2,H2CO3为主, lg[Ca2+] = 0.5lgKSP – 0.5lgK1k2 – lgpH
四、氧化还原
2、异体凝聚理论
(1)适用条件:适用于物质本性不同、粒径不等、电荷符
号不同、电位高低不等的分散体系。
(2)主要论点:
A、电荷符号相异的胶体微粒接近时,吸引力总是占优势; B、电荷符号相同但电性强弱不等,则位能曲线上的能峰高 度总是决定于荷电较弱而电位较低的一方。 因此异体凝聚时,只要有一种胶体的稳定性甚低而电位 达到临界状态,就可以发生快速凝聚。
(2)理论描述
总的综合作用位能:VT = VR + VA
VA——由范德华力产生的位能 VR——由静电排斥力所产生的位能
V VR VT
Vmax
d
VA
两个离子靠得很 近时,要考虑水 化膜阻力
①不同离子强度有不同VR曲线,呈指数下降; ②VA与粒子强度无关,只随颗粒间的距离变化; ③不同离子强度有不同的VT曲线;离子强度较小时,综合位能曲 线上出现较大位能峰,排斥力占优势,体系保持分散稳定状态; 离子强度较大时,双电层被压缩,Vmax 降低,一部分颗粒可能超 越该能峰。
(4)增加水中配合剂的含量:天然或合成的配合剂使用量增加,能和重金属
形成可溶性配合物,有时这种配合物稳定度较大,可以溶解态形态存在, 使重金属从固体颗粒上解吸下来。
二、水中颗粒物的聚集(自学)
1、物理凝聚理论 凝聚 coagulation 电介质促成的聚集 絮凝 flocculation 聚合物促成的聚集 (1)前提:①颗粒粒度均等、球体 ②范德化引力和静电排斥力是仅有的作用因素 ③没有化学专属吸附作用 颗粒在水溶液中进行热运动,其平均动能为3/2 KT
【环境化学】第3.2章 水环境化学——水中无机污染物的溶解和沉淀

水体中常见无机化合物的溶解性
氢氧化物
氨、碱金属、Ba(OH)2可溶; Ca(OH)2 、 Sr(OH)2微溶;其余难溶
(注: Ca 、 Sr 、 Ba是碱土金属)
硫化物
(NH4)2S 、碱金属、碱土金属可溶;其余难溶
碳酸盐
(NH4)2CO3 、碱金属(Li除外)可溶;其余难溶
4
第三章/第二节/2.3 溶解和沉淀
lg*Ks0=12.7 [Pb2+]=*Ks0× [H+]2 lg*Ks1=5.0 [Pb(OH)+]=*Ks1×[H+] lg*Ks2=-4.4 [Pb(OH)2]=*Ks2 lg*Ks3=-15.4 [Pb(OH)3]=*Ks3×[H+]-1
PbO的溶解度 [Pb(Ⅱ)T]=*Ks0[H+]2+*Ks1[H+]+*Ks2+*Ks3[H+]-1
HCO3- ⇌ CO32- + H+
K2 = [CO32-][H+]/[HCO3- ]
α2 = [CO32-]/cT = {1 + [H+]/K2 + [H+]2/(K1K2)}-1
[Me2+] = (Ksp/CT){1 + [H+]/K2 + [H+]2/(K1K2)}
17
第三章/第二节/2.3 溶解和沉淀
2.3.4 碳酸盐
二、碳酸盐在碳酸(盐)封闭体系的溶解度(二价金属)
pH>pK2
CT ≈ [CO32-]; [CO32-] ≈ CT; [Me2+] ≈ (Ksp/CT);lg[CO32-]-pH和lg[Me2+]-pH斜率为0
水环境化学

(4)水生生物: ①水生生物是生态系统、食物链中的一个重要环 节。 ②水生生物根据其利用的能源不同分为自养生物和 异养生物;藻类是水体中典型的自养生物,通常 CO2、NO3-、PO43-多为自养生物的C、N、P源; ③水中营养物通常决定水的生产率。
2.天然水的性质(重点) (1) 碳酸平衡:CO2在水中形成酸,可同岩石中 的碱性物质发生反应,并可通过沉淀反应变 为沉积物而从水中除去.在水和生物之间的 生物化学交换中,CO2占有独特地位.
天然水中常见的主要离子总量可以粗略地作为 水的总含盐量(TDS): TDS=[ K++Na++Ca2++Mg2+]+[HCO3-+Cl-+SO42-]
表3-2 水中的主要离子组成图(汤鸿霄,1979) 硬度 Ca2+ Mg2+ 酸 H+ 碱金属 K+ Na+ NO3- Cl- SO42酸根 阳离子
该平衡服从亨利定律,即一种气体在液体中的 溶解度与液体所接触的该种气体的分压成正比。
亨利定律
溶解气体 CO2、O2、H2S、CH4等污染性气体。 亨利定律计算公式: [ X(aq)]=kH •pg 式中: kH—气体在一定温度下的亨利常数。
pg ——气体分压。 (1)计算气体溶解度时,需要对水蒸气的分压加 以校正; (2)该定律与反应无关; (3)气体的溶解度随温度升高而降低; (4)亨利定律常数的使用。
碳酸盐系统的形态分布图
图3-1 碳酸形态分布图
碳酸盐系统的形态分布函数
若用cT表示各种碳酸化合态的总量,即
CT = [H2CO3 *] + [HCO3-] + [CO32-]
