前体mRNA剪接蛋白Tra2α特异抗体的制备和鉴定①
前体mrna剪辑蛋白tra2基因在神经组织中的表达特征、发育调控及功能

that shares high similarity with the previously reported Tra2u(Tra2ctl).In addition,
Tra2(Transformer2)属前体mRNA剪辑蛋白。在果蝇和哺乳动物中均有表达, 在果蝇中是性发育的关键调控蛋白,在哺乳动物中,性别决定的机制与果蝇中完 全不同,Tra2可能具有其它的功能。有限的研究提示Tra2蛋白在哺乳动物中可 能与发育有关。但该基因在哺乳动物中的表达特征、发育调控及其生理功能和作 用机制如何,目前尚不清楚。本论文的目的便是针对上述问题,研究Tra2在神 经发育过程中的表达特征及其功能。
基因表达谱分析是研究基因功能及其调节的重要一环。Tra2已知有多种亚型 (Tra2131,2,3,4,5和Tra2cz)。如果Tra2参与发育调节,那么作为功能调节的一个 方面,它的各个亚型的表达谱是否会随着发育阶段和组织类型的不同而受到调 节?对此,我们首先分析Tra2各个亚型在不同发育阶段和不同组织的基因表达 谱。其中包括考察在发育过程中是否会有新的Tra2的亚型产生。我们利用RT-PCR 扩增的方法,对人胚胎组织中的Tra2进行扩增,在Tra2B扩增时,没有发现新的 亚型,但在扩增Tra2a时,发现了一种新的Tra2亚型,它与Tra2 0c具有相当高的 同源性(暂命名为Tra2et2,原有的亚型命名为Tra2c£1)。另一方面,为了分析 Tra2各个皿型的表达量在不同组织和不同发育阶段之间是否存在差异,我们利用 半定量RT-PCR的方法,对不同发育阶段的人胚胎组织中的Tra2a和Tra21j的各 mRNA亚型进行了检测。结果显示,在Tra2[B各亚型中,Tra2Bl和Tra2p5在各 种组织中均有表达,其表达量随发育阶段的不同而有变化,但不同组织之间表达 量差异较小。而Tra2133的表达则有明显的组织和发育阶段调控特征。在11周时, 所有组织中均未检测到其表达,而在16周时,所有组织中均检测出了Tra2133条 带,但各组织之间表达量变化幅度很大。Tra2.134的表达特征与Tra2133类似,在 ll周时,它仅在包括小脑在内的几种组织中表达,在16周也表现出在各组织中 普遍表达的特征。在Tra2a的2种亚型中,Tra2al和Tra2ct2在1l周和16周均 为普遍表达,从11周到16周,绝大多数组织中该两种Tra2亚型的表达都有增 加。上述结果从基因表达层次提示:在人类发育(包括神经发育)过程中,对 Tra2蛋白的选择性剪辑的调节功能的需求也随不同的组织和发育阶段而变化。
mRNA剪切机制简介mRNA专题

mRNA剪切机制简介mRNA专题细胞核内前体mRNA的剪接的执行者是剪接小体,它能够在成熟mRNA出核和翻译之前识别剪接信号,移除不编码内含子,并将能够编码蛋白的外显子拼接在一起。
细胞核内前体mRNA的剪接需要经历2次转酯化反应化步骤去掉内含子才能将相邻的外显子拼接成成熟的mRNA。
在前体mRNA上有三个反应区域分别在5'剪接位点(5'SS),3'剪接位点(3'SS)以及分枝位点(图1)。
除了这三个反应区域外,在多细胞生物体的内含子上还拥有保守性的多聚嘧啶束,它位于3'剪接位点以及分枝位点之间。
图1选择性剪接发生过程示意图选择性剪接由内含子5'剪接位G和U2个核苷酸点以及3'剪接位点A和G 2个核苷酸介导。
分支点A核苷酸非常保守的,一般位于3'剪接位点上游20-50个核苷酸。
剪接反应的过程发生2次转酶化反应,这个过程中需要5个snRNPs复合物(Ul,U2,U4,U5,andU6)。
这些复合物能够聚集在前体mRNA上形成大分子的聚合物。
剪接小体,核内最大的RNP复合物,能够识别这些反应位点并催化前体mRNA发生剪接。
剪接小体中主要的模块是snRNPs复合物。
剪接小体一般包含5种snRNPs:U1、U2、U4,U5和U6 snRNP。
每一个snRNP包含了单个snRNA和至少7种蛋白亚基。
这些snRNP和另外的非snRNP相关蛋白(例如SF1、U2AF和Prp19复合物)一步步有序的聚集在前体mRNA上依次形成前剪接小体E,A,B以及C复合物(图1)。
在这有序的过程中,这些snRNP以及非snRNP相关蛋白和反应位点之间发生复杂的结合与去结合过程,这些复杂的过程为核小体提供了多次检查的机会以保证它们结合的准确性从而提高位点选择的精确性。
在核小体组装之前,U1 snRNP占据5'剪接位点,而SF1结合在分枝位点,这2个过程是ATP依赖的并最终形成前剪接小体E复合物(图1)。
真核生物mrna前体的一般加工过程

真核生物mrna前体的一般加工过程
真核生物mRNA前体的一般加工过程包括以下步骤:
1.在5’-末端加“帽子”结构。
由加帽酶和甲基转移酶催化,可以
使mRNA免遭核酸酶的攻击,并参与蛋白质生物合成的起始过程。
2.在3’-末端加poly(A)尾。
由多聚腺苷酸聚合酶催化,以ATP为底
物,在mRNA的3’端加上大约100~200个腺苷酸残基的尾部。
poly(A)尾的有无与长短是维持mRNA作为翻译模板的活性以及增加mRNA本身稳定性的因素。
3.剪接和剪切。
真核生物的基因是不连续的即断裂基因,由外显子
和内含子相互间隔但又连续镶嵌而成。
剪接是去除内含子后将相邻外显子连接起来。
mrna前体加工过程

mrna前体加工过程
MRNA前体加工过程(mRNA processing)是指在转录过程中,原始mRNA合成后需要经过修饰和剪接等一系列复杂的加工过程,才能成为能够指导蛋白质合成的成熟mRNA。
mRNA前体加工过程可以分为三个阶段:5'端顶磷酸盐修饰、RNA剪接和UCU二聚体修饰。
具体地说,mRNA前体首先需要被加上5'端顶磷酸盐帽结构,这使得mRNA能够被转译终止因子扫描到并与肝细胞蛋白结合,从而翻译为成熟蛋白质。
而RNA剪接则是指在mRNA 的转录过程中,剪掉其中一些区域,从而得到成熟mRNA的过程。
这一过程能够增加基因表达的多样性,从而实现更加复杂和精确的生命过程。
最后,mRNA前体还需要进行UCU二聚体修饰,这能够促进成熟mRNA的穿透性和稳定性,从而使其能够在细胞质中稳定存在。
总体上,mRNA前体加工过程是一个非常复杂和精细的过程,需要多种酶类和调节因子的参与。
目前,科学家们已经成功研究出了许多这一过程中的分子机制和调节因子,从而促进了对基因表达和蛋白质合成等生命过程的深入了解。
总之,mRNA前体加工过程是一项必不可少的生物学过程,它能够调
节基因表达和蛋白质合成的精准度和多样性,并为我们深入了解和治疗多种疾病提供了强大的科学基础。
mrna疫苗制作流程

mrna疫苗制作流程mRNA疫苗制作流程mRNA疫苗是一种新型的疫苗,它利用Messenger RNA (mRNA)技术来激活免疫系统对特定病原体产生免疫反应。
以下是mRNA疫苗的制作流程:1. 选择靶点病原体:首先,科学家们需要确定他们要开发疫苗的目标。
这可能是一种病毒、细菌或其他病原体。
2. 获取目标病原体的基因信息:一旦确定目标,科学家们需要获取目标病原体的基因信息。
这可以通过分离病原体、提取其RNA 或使用DNA测序技术来完成。
3. 设计mRNA序列:基于目标病原体的基因信息,科学家们可以设计合成相应的mRNA序列。
这个序列将编码目标病原体的特定蛋白质。
4. 合成mRNA:设计好的mRNA序列被合成成为mRNA 分子。
这通常是通过体外转录过程,即使用特定的酶来合成RNA。
5. 包装mRNA:合成的mRNA需要被包装成纳米颗粒,以保护其在体内的稳定性,并提高疫苗的效果。
这些纳米颗粒通常由脂质或脂质类似物制成。
6. 疫苗制剂制备:制作mRNA疫苗的最后一步是将包装好的mRNA和其他辅助物质(如辅助基质或佐剂)组合在一起制成疫苗。
这些辅助物质可以增强免疫反应并提供疫苗的稳定性。
7. 质量控制:在生产过程中,严格的质量控制措施将被采用,以确保生产的疫苗是安全、纯度高且有效的。
8. 临床试验:一旦制备好的mRNA疫苗通过质量控制,它将进入临床试验阶段。
这些试验旨在评估疫苗的安全性和有效性,确保它可以诱导免疫反应。
9. 批准和分发:如果临床试验的结果证明mRNA疫苗是安全和有效的,监管机构将批准其上市。
然后,疫苗将分发给物流渠道,以供接种使用。
制作mRNA疫苗的过程涵盖了选择目标病原体、获取基因信息、设计和合成mRNA序列、包装mRNA、制备疫苗、实施质量控制、进行临床试验以及最终的批准和分发。
这一新颖的技术为我们应对疾病带来了希望,并在短时间内开发出了多种可用于应对不同病原体的疫苗。
转换蛋白2及其调节和生理病理作用

转换蛋白2及其调节和生理病理作用宁毅;郑晓旭;孙睿【摘要】转换蛋白(TRA)2为前体mRNA剪接蛋白,是一族富含丝氨酸-精氨酸重复剪接因子(SR)家族的相关蛋白,包括TRA2α和TRA2β两个亚族。
它们在结构上与SR蛋白有着一定的相似性,在功能上与SR蛋白有着明显的差异,即TRA2蛋白不为组成性剪接所必需,但在选择性前体mRNA剪接中决定剪接位点方面却起着重要的作用。
在哺乳动物中,TRA2蛋白家族在生理和病理过程中发挥着诸多关键性作用,且在疾病的发生发展过程中错误地调控剪接过程产生异常的RNA可引起分子病或者导致原来的疾病更加严重。
迄今为止,人们还不清楚TRA2蛋白与疾病间的关系,所以对其引起疾病的治疗研究还处在初级阶段。
%The transformer(TRA)2 protein belongs to the serine/arginine-rich(SR) protein family. The protein possesses two homologs, namely, TRA2α and TRA2β. These homologs exhibit structures similar to those of the SR proteins but significantly differ in function. TRA2 is not necessarily implicated in composition splicing but plays an important role in selecting the splicing sites of precursor mRNA. Further studies found that in mammals, the TRA2 family protein plays a key role in many physiological and pathological, as well as disease occurrence and development, processes. Moreover, the abnormal splicing process of RNA molecules can cause disease or aggravate existing pathological problems. However, the relationship between TRA2 proteins and diseases remains to be completely understood. Additional energy and effort are required to achieve success in investigating disease causes and in developing treatments【期刊名称】《国际口腔医学杂志》【年(卷),期】2016(043)003【总页数】4页(P357-360)【关键词】转换蛋白;前体mRNA剪接蛋白;生理病理作用;疾病防治【作者】宁毅;郑晓旭;孙睿【作者单位】山西医科大学口腔医学系太原 030001;马里兰大学医学院附属医院肾内科巴尔的摩 21201;山西省人民医院口腔颌面外科太原 030012【正文语种】中文【中图分类】Q51前体mRNA剪接转换蛋白(transformer,TRA)2是一族富含丝氨酸-精氨酸重复剪接因子(splicing factor containing serine-arginine repeat,SR)家族相关蛋白,它包括TRA2α和TRA2β亚族。
信使RNA(mRNA)解析mRNA在蛋白质表达中的重要作用

信使RNA(mRNA)解析mRNA在蛋白质表达中的重要作用信使RNA(mRNA)是一种与蛋白质合成密切相关的核酸分子。
它在基因表达中充当着重要的角色,携带着来自DNA的遗传信息,并将其传递到细胞质中的核糖体,从而参与蛋白质的合成过程。
本文将对mRNA的结构和功能进行解析,并探讨其在蛋白质表达中的重要作用。
一、mRNA的结构和合成过程mRNA是一种单链RNA分子,由核酸碱基(腺嘌呤、胸腺嘧啶、鸟嘌呤和尿嘧啶)组成,以及磷酸、核糖和核苷酸等组分构成。
mRNA的合成是通过转录过程进行的。
在转录过程中,DNA的模板链上的碱基序列被转录酶复制成为mRNA的碱基序列,形成了一串可移动的遗传信息。
这个过程包括启动、延伸和终止三个阶段。
启动阶段是通过转录酶的结合来识别和定位转录起始位点,从而开始合成新生mRNA链。
延伸阶段是转录酶沿DNA模板链向下进行移动,合成与DNA模板链互补的mRNA链。
终止阶段是在到达终止序列后,转录酶脱离DNA模板链,完成mRNA链的合成。
二、mRNA的功能和重要作用mRNA通过其特殊的结构和功能,在蛋白质合成过程中发挥着重要的作用。
1. 遗传信息的传递:mRNA是将DNA中的遗传信息转移到蛋白质合成机器-核糖体上的媒介分子。
在转录过程中,mRNA被合成出来,其碱基序列与DNA的一部分序列相对应,使得mRNA携带着来自DNA的遗传信息。
核糖体通过读取mRNA上的密码子,将其转化为特定的氨基酸,从而合成出特定的蛋白质。
2. 蛋白质合成的调节:mRNA还可以通过一系列调控机制对蛋白质合成过程进行调控。
在转录后修饰过程中,mRNA可以通过剪接、拼接和修饰等方式对其结构进行改变,从而影响其在蛋白质合成中的效率和准确性。
此外,转录因子和RNA结合蛋白等分子还可以结合mRNA上的调控区域,促进或抑制mRNA的翻译,从而对蛋白质合成进行精细的调节。
3. 表达基因的调控:mRNA不仅携带着蛋白质合成所需的信息,还能通过RNA干扰等机制对基因表达进行调控。
前体mRNA的剪接过程
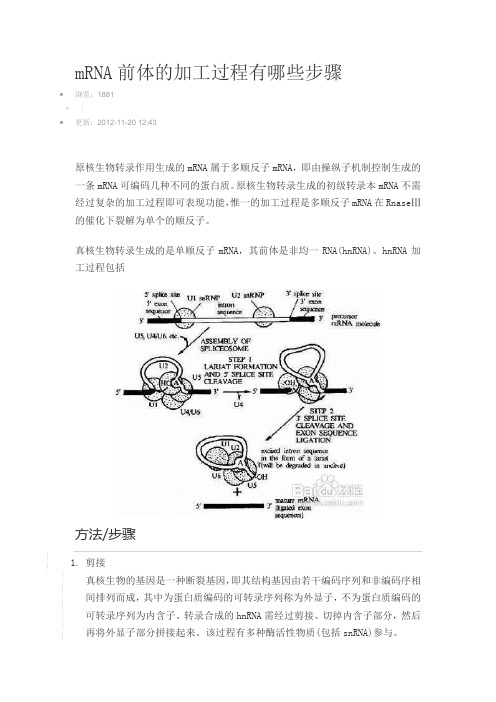
mRNA前体的加工过程有哪些步骤•浏览:1881•|•更新:2012-11-20 12:43原核生物转录作用生成的mRNA属于多顺反子mRNA,即由操纵子机制控制生成的一条mRNA可编码几种不同的蛋白质。
原核生物转录生成的初级转录本mRNA不需经过复杂的加工过程即可表现功能,惟一的加工过程是多顺反子mRNA在RnaseⅢ的催化下裂解为单个的顺反子。
真核生物转录生成的是单顺反子mRNA,其前体是非均一RNA(hnRNA)。
hnRNA加工过程包括方法/步骤1.剪接真核生物的基因是一种断裂基因,即其结构基因由若干编码序列和非编码序相间排列而成,其中为蛋白质编码的可转录序列称为外显子,不为蛋白质编码的可转录序列为内含子。
转录合成的hnRNA需经过剪接、切掉内含子部分,然后再将外显子部分拼接起来。
该过程有多种酶活性物质(包括snRNA)参与。
2.5′末端加“帽”真核细胞成熟mRNA的5′末端均有一个特殊的结构,即m7Gpp-pmnNp,称为“帽”。
帽的生成是在细胞核内进行的,但胞浆中也有酶体系,动物病毒mRNA 加帽过程就是在宿主细胞的胞浆内进行的。
3.3′末端加“尾”mRNA前体分子的3′末端有一段保守序列,由特异的核酸内切酶切去多余的核苷酸,然后在多聚A聚合酶的催化下,由ATP聚合生成多聚A尾。
该反应在核内发生,在胞浆中也可继续进行。
4.碱基修饰mRNA分子中有少量稀有碱基(如甲基化碱基)是在转录后经化学修饰(如甲基化)而形成的。
5.选择性加工某些MRNA前体含有多个3‘剪切位点和多聚腺苷酸化位点,因此利用这些选择性位点可产生具有不同3'端非编码区或者具有不同编码能力的RNA产物。
通过可变剪接途径可以挑先最保留在MRNA中的外显子,结果单个基因可以合成多种不同的蛋白质。
6.RNA编辑在合成并经RNA编辑加工之后,MRNA分子的序列可以发生改变。
个别核苷酸可以被置换,添加或者删除。
编辑过的MRNA翻译产生了较短脱脂基蛋白B48,由于基缺少一个结合受体的蛋白结构域,因此功能受限。
前体mRNA的剪接过程

mRNA前体的加工过程有哪些步骤•浏览:1881•|•更新:2012-11-20 12:43原核生物转录作用生成的mRNA属于多顺反子mRNA,即由操纵子机制控制生成的一条mRNA可编码几种不同的蛋白质。
原核生物转录生成的初级转录本mRNA不需经过复杂的加工过程即可表现功能,惟一的加工过程是多顺反子mRNA在RnaseⅢ的催化下裂解为单个的顺反子。
真核生物转录生成的是单顺反子mRNA,其前体是非均一RNA(hnRNA)。
hnRNA加工过程包括方法/步骤1.剪接真核生物的基因是一种断裂基因,即其结构基因由若干编码序列和非编码序相间排列而成,其中为蛋白质编码的可转录序列称为外显子,不为蛋白质编码的可转录序列为内含子。
转录合成的hnRNA需经过剪接、切掉内含子部分,然后再将外显子部分拼接起来。
该过程有多种酶活性物质(包括snRNA)参与。
2.5′末端加“帽”真核细胞成熟mRNA的5′末端均有一个特殊的结构,即m7Gpp-pmnNp,称为“帽”。
帽的生成是在细胞核内进行的,但胞浆中也有酶体系,动物病毒mRNA 加帽过程就是在宿主细胞的胞浆内进行的。
3.3′末端加“尾”mRNA前体分子的3′末端有一段保守序列,由特异的核酸内切酶切去多余的核苷酸,然后在多聚A聚合酶的催化下,由ATP聚合生成多聚A尾。
该反应在核内发生,在胞浆中也可继续进行。
4.碱基修饰mRNA分子中有少量稀有碱基(如甲基化碱基)是在转录后经化学修饰(如甲基化)而形成的。
5.选择性加工某些MRNA前体含有多个3‘剪切位点和多聚腺苷酸化位点,因此利用这些选择性位点可产生具有不同3'端非编码区或者具有不同编码能力的RNA产物。
通过可变剪接途径可以挑先最保留在MRNA中的外显子,结果单个基因可以合成多种不同的蛋白质。
6.RNA编辑在合成并经RNA编辑加工之后,MRNA分子的序列可以发生改变。
个别核苷酸可以被置换,添加或者删除。
编辑过的MRNA翻译产生了较短脱脂基蛋白B48,由于基缺少一个结合受体的蛋白结构域,因此功能受限。
mrna疫苗制备流程

mrna疫苗制备流程深入解析:从源头到接种——mRNA疫苗制备的详细流程在过去的两年中,mRNA疫苗技术因其在对抗COVID-19疫情中的卓越表现而备受瞩目。
这种新型疫苗的制备过程独特且高效,它的核心是利用人体自身的细胞机制来产生免疫反应。
本文将详细阐述mRNA疫苗从研发到接种的全过程。
一、基础原理mRNA疫苗的基本理念是将病毒的遗传信息(即mRNA)直接注入人体细胞,让它们“阅读”这些信息并制造出病毒蛋白。
人体的免疫系统随后会识别这些蛋白质,并将其视为外来入侵,从而引发免疫反应,形成对病毒的防御。
与传统的灭活或减毒疫苗不同,mRNA疫苗无需在体内繁殖,因此减少了潜在的安全风险。
二、设计与合成首先,科学家们通过基因序列分析确定目标病毒的关键蛋白序列,然后将这部分DNA转录成相应的mRNA。
这个过程需要精确的生物信息学工具,确保mRNA 的编码部分与病毒蛋白完全一致,以便激活正确的免疫反应。
合成后的mRNA通常会被包裹在脂质纳米颗粒(LNP)中,这有助于保护mRNA免受体内的降解酶破坏,并促进其在细胞内释放。
三、生产与纯化在实验室条件下,mRNA疫苗经过大规模生产,包括细胞培养、提取、纯化和质量控制等步骤。
科学家们使用酵母或哺乳动物细胞作为生产平台,因为它们能高效地表达外源mRNA。
生产过程中,要严格监控mRNA的质量,包括稳定性、纯度和活性,以确保最终产品符合安全和有效性标准。
四、临床试验完成生产后,mRNA疫苗需经历严格的临床试验阶段,包括I、II和III期试验。
这些试验旨在评估疫苗的安全性、耐受性和免疫效果,涉及数千甚至数万志愿者,数据经过多层审核后才能用于批准疫苗上市。
五、储存和运输mRNA疫苗通常需要在-70℃或更低的温度下储存和运输,以保持其稳定性和活性。
这是由于mRNA在常温下容易降解。
然而,先进的储存和运输设施,如干冰,使得mRNA疫苗在全球范围内的分发成为可能。
六、接种与监测接种时,医生或护士会使用特殊注射器将疫苗注射到肌肉或皮肤下。
mrna疫苗制备制剂过程原理

mrna疫苗制备制剂过程原理宝子们!今天咱们来唠唠mRNA疫苗制备制剂那点事儿。
这mRNA疫苗啊,可是现代医学里超级酷炫的存在呢。
咱先说说mRNA是啥吧。
mRNA就像是一个小信使,在我们身体这个超级大工厂里跑来跑去传达指令的。
在细胞里啊,DNA是那种超级神秘又重要的大老板,它掌握着各种制造蛋白质的秘密配方。
但是呢,DNA可不能自己跑出去指挥身体各个地方制造蛋白质呀,这时候mRNA就闪亮登场啦。
它就像个小秘书,从DNA那里把制造某种蛋白质的指令抄下来,然后就离开细胞核这个小办公室,跑到细胞的细胞质里去传达指令啦。
那mRNA疫苗呢,就是利用这个聪明的小信使来发挥大作用的。
科学家们啊,先得找到病毒身上特别关键的部分,就像是找到敌人最致命的弱点一样。
比如说新冠病毒,它表面有个刺突蛋白,这个刺突蛋白就像是病毒用来打开我们身体细胞大门的钥匙。
那科学家就把制造这个刺突蛋白的指令,也就是对应的mRNA找出来。
然后呢,就开始准备制造mRNA疫苗啦。
这可不容易呢,就像做一道超级精致的菜肴。
要在实验室里精心合成这个mRNA。
这个mRNA可不能随随便便就那样,它得经过各种修饰,就像是给小信使穿上一层保护衣一样。
为啥要穿保护衣呢?因为我们的身体可挑剔啦,如果mRNA赤裸裸地进去,身体里的各种酶就可能把它当成外来的坏东西,一下子就给分解掉了,那还怎么发挥作用呀。
所以这层保护衣很重要,能让mRNA 安全地到达细胞里。
再之后呢,就是把这个做好的mRNA放到一个合适的载体里。
这个载体就像是一个小快递车,负责把mRNA这个小包裹送到细胞里。
常见的载体就像脂质纳米颗粒,它就像一个超级小的泡泡,把mRNA包裹在里面。
这个小泡泡可厉害了,它能很容易地就和我们身体细胞的细胞膜融合在一起。
就像两个好朋友见面,一下子就拥抱在一起啦。
当这个带着mRNA的小泡泡和细胞融合后,mRNA就顺利地进入细胞啦。
一进入细胞,mRNA就开始大展身手喽。
它按照之前抄来的指令,指挥细胞里的那些小工厂(核糖体)开始制造刺突蛋白。
E_cadherin前体蛋白抗体的制备与鉴定

第50卷 第1期厦门大学学报(自然科学版)V ol.50 N o.1 2011年1月Journal of Xiam en U niversity (Natural Science)Jan.2011E cadherin 前体蛋白抗体的制备与鉴定王继峰,叶志云,林舒勇*(厦门大学生命科学学院,细胞生物学与肿瘤细胞工程教育部重点实验室,福建厦门361005)收稿日期:2010 04 27基金项目:福建省自然科学基金资助项目(2008J0109)*通信作者:lin sy@摘要:E cadher in 是一种重要的肿瘤转移抑制因子,它的功能异常能够导致肿瘤细胞的转移.细胞内成熟的E cadher in由其前体蛋白剪切而成,目前还没有针对该前体蛋白的特异性抗体.为了得到能用于检测内源性E cadher in 前体蛋白(E cadherin pre)的抗体,对E cadher in 基因用限制性内切酶Pst I 和Pvu II 进行双酶切,获取E cadher in 基因的N 端片段,将其重组入原核表达载体pG EX 4T 2中,在大肠杆菌BL 21(DE3)菌株中表达重组蛋白,经谷胱甘肽 琼脂糖珠子纯化后,得到较高纯度的E cadher in 前体抗原.用该抗原免疫新西兰兔,获得抗血清,进一步纯化血清得到抗E cadher in pr e 的多克隆抗体.用Western blot 检测了外源性和内源性E cadher in pre,发现该抗体效价高且特异性强;免疫荧光实验表明该抗体可以用于细胞染色,为深入研究E cadherin pre 在细胞内的功能奠定了基础.关键词:E cadher in pr e;抗体;pG ST E cadherin pre中图分类号:R 392.11 文献标志码:A 文章编号:0438 0479(2011)01 0097 04 E cadherin 是一个120ku 的钙依赖性跨膜糖蛋白,它主要在上皮细胞中表达,与catenin 蛋白家族相结合,介导上皮细胞间的粘附连接[1].E cadherin 对维持正常上皮细胞形态和结构完整性起着重要作用,E cadherin 表达下调或缺失可导致癌细胞间黏附性减弱,易发生脱落和转移[2].成熟的E cadherin 是在正确的蛋白酶作用下将其前体N 端的一段区域水解之后才能发挥正常的生物学功能[3].与成熟的E cadherin 相似,未加工过的E cadherin 仍然能够定位在细胞膜上,具有可以结合catenin 蛋白家族以及具有钙依赖性等.但是,细胞内的E cadherin 如果不能正常加工,则细胞失去E cadherin 依赖的细胞连接[1,3].所以,对E cadherin 前体蛋白(E cadherin pre)的研究有助于更深入地了解E cadherin 的功能.随着对E cadherin 蛋白研究的深入进行,我们需要获得大量特异性高的针对E cadher in pre 的抗体,但目前尚未发现商业化的针对E cadher in pre 的抗体.因此,本实验选取E cadherin N 端亲水性高且抗原表位较多的133个氨基酸区域作为抗原,将相应的基因序列克隆到pGST parallel 载体中,并在工程菌中大量表达E cadherin pre 抗原蛋白,用该抗原免疫兔子,制备了E cadher in pre 抗体.该抗体造价低廉,特异性高,可以满足不同实验需求.1 材料和方法1.1 材 料1)细胞、菌株、质粒和载体:MDCK 细胞、大肠杆菌DH 5 、大肠杆菌BL21(DE3)、pCMV5 my c E cad herin 及表达载体pGEX 4T 2由本实验室保存.2)主要试剂:Pst I 、P vu II 、Sma I 、EcoR I 、X ho I 等主要工具酶和DNA M ar ker,protein M arker 购自Invitrog en 公司.鼠单克隆抗体my c pro be 和RIT C 标记羊抗兔、H RP 标记羊抗兔、H RP 标记羊抗鼠抗体购自美国Santa Cruz 公司,谷胱甘肽 琼脂糖珠、还原型谷胱甘肽(G4251)、完全弗氏佐剂(com plete Freund s adjuv ant)、不完全弗氏佐剂(inco mplete Freund s ad juvant)和H ochest 购自美国Sig ma 公司.DNA 序列测定由Invitrog en 公司完成.3)实验动物:新西兰兔,购自中国科学院上海实验动物中心.1.2 方 法1)原核表达质粒的构建:质粒pCM V5 myc E cadherin 用Pst I 、P vu II 酶切后平端化获得目的片段,表达载体pGEX 4T 2用Sma I 酶切,对相应片段进行回收并连接,构建成重组E cadherin pre 表达质粒pGEX 4T 2E cadherin pr e (aa31 164),命名为pGST E cadherin pre.用其转化大肠杆菌DH 5 感受态细胞,小量制备质粒DNA,用E coR I 、X ho I 进行双酶切检验并测序验证重组质粒.2)GST融合蛋白的诱导表达及纯化:将所得重组质粒pGST E cadher in pre转化到大肠杆菌BL21 (DE3)感受态细胞中,挑选单克隆到含氨苄青霉素的选择性培养基中,37 ,以220r/min的转速摇菌过夜;第2天将获得的母液稀释到新鲜培养基中,使菌液的OD600 0.1,并于37 继续摇菌;直至OD600为0.4~0.6时,加入诱导物异丙基硫代半乳糖苷(IPT G),使其终浓度为1m mo l/L,22 再培养8h;在4 条件下,以5000g的速度离心5min,获得菌体,每升菌液约以50mL PBS重悬,加入体积分数为1%的Triton X 100和 巯基乙醇,PMSF(终浓度1 mmo l/L);超声破碎菌体至重悬液澄清(在冰上操作);4 ,15000g,20min离心取上清;在上清中加入适量用PBS浸泡过夜的谷胱甘肽 琼脂糖珠,置于4 轻摇1h使其吸附蛋白,然后2000g离心5m in,弃上清,琼脂糖珠用10mL PBS洗涤,洗涤3次后加入1.5mL洗脱液(5mmo l/L还原型谷肽甘肽(G4251) in50mmo l/L T ris,pH8.0),2000g离心5min,收集上清,重复洗脱3次,得到纯化的GST E cad pre蛋白.将蛋白置于-20 保存待用.3)蛋白纯度及浓度鉴定:通过进行SDS PAGE 胶电泳来确定蛋白的纯度[4],取20 L纯化后的抗原蛋白加入等体积的2 SDS Sam ple Buffer,100 加热10min,在质量分数为12%的SDS PA GE胶上电泳,考马斯亮蓝R250染色检测,并通过Bradford标准蛋白曲线测定法测定蛋白浓度.4)抗体制备:测定抗原浓度后,免疫新西兰兔[5 6].第1次免疫,以0.5mg纯化的pGST E cad herin pre蛋白加等体积的完全弗氏佐剂乳化后,注射于新西兰兔的四肢皮下.3周后,进行第2次免疫,抗原量改为0.3m g,用等体积的不完全弗氏佐剂乳化后,注射于新西兰兔的四肢皮下,注射部位同第1次.间隔2周后,进行第3次免疫,抗原量、佐剂及注射部位均同第2次.再间隔2周后,进行第4次免疫,除抗原量改为0.25m g外,其他条件均同第2,3次.10d 后采集新西兰兔血液,离心后收集血清.5)抗体纯化:剪一细长条的0.45 m硝酸纤维膜于1mL pGST E cadherin pr e抗原(1mg/mL)中于浸渍5min;再将长条放在Whatman滤纸上晾干;置于1.5mL微量离心管用1mL的缓冲液A(BSA5% (质量分数),T ris10m mol/L,NaCl0.15mol/L,NP 400.2%(体积分数),pH7.4)轻摇30min,再用缓冲液A洗1次;将其置于0.8mL第4次免疫10d后采血的抗血清中轻摇1.5h;取出硝酸纤维膜并用PBS 洗涤4次,每次5m in;用10mmo l/L甘氨酸洗脱液(pH2.5)洗脱3次,所加的量分别为200,200,400 L,在此过程中用手不时的轻摇.迅速将洗脱下的抗体转移至含100 L1mo l/L T ris(pH8.0)的微量离心管中,即得到纯化的抗E cad pr e的抗体.6)E cadherin pre亚细胞定位的免疫荧光染色检测:将M DCK细胞固定后加FIT C 羊抗兔IgG进行免疫荧光染色(一抗为自制的兔抗E cadherin pre抗体),在共聚焦显微镜下观察结果并拍照.2 结 果2.1 pGEX 4T 2E cadherin pre原核表达载体的构建、鉴定及序列分析由于限制性内切酶在质粒pCM V5 myc E cad herin上有多个酶切位点,经酶切后只对目的条带(400 bp)进行回收(图1),然后连接到经Sma I单酶切的pGEX 4T 2载体上.带有E cadher in N 端的重组质粒pGEX 4T 2E cadherin pre经EcoR I、X ho I双酶切鉴定(图2),取阳性克隆进行DNA测序.由于载体和片段为平末端连接,只选取结果表明pGEX 4T 2E cadherin pr e中插入的基因片段序列及读码框架正确的质粒,以备后用.2.2 E cadherin pre的诱导表达将测序正确的pGEX 4T 2E cadherin pre重组表达质粒转化原核表达用大肠杆菌BL21(DE3),分别在26,28,30 条件下,经1.0mmo l/L IPTG条件下诱导8h,超声破碎后离心,分别将上清、沉淀(可能含有涵体)以及pGST beads纯化后样品进行SDSM.DN A分子质量标准(D NA L adder,H igh r ang e+100bp DN A Ladder);1.pCM V5c my c E cadher in经Pst I+P vu II双酶切.图1 双酶切鉴定回收重组质粒pCM V5 c my cE cadherin抗原片段Fig.1 Restrict ive enzy me digestio n o f recombinantpCM V5c myc E cadherin98厦门大学学报(自然科学版) 2011年M 1.DN A 分子质量标准(100bp D NA L adder);M 2:DN A 分子质量标准(D NA L adder,High r ang e);1~10.pG EX4T 2E cadherin pr e 经EcoR I+X ho I 双酶切.图2 双酶切鉴定重组质粒pG EX 4T 2E cadher in pr e Fig.2 Restrict ive enzy me digestio n o f recombinantpG EX 4T 2E cadher in pr ePAGE 分离(图3),可以看到在分子质量约40ku 处有1条高表达的蛋白带,而且基本上以可溶性蛋白形式存在.最后确定最佳诱导条件为30 ,1.0m mol/L IPT G 诱导8h,在此条件下从上清中即可获得大量可溶性蛋白.2.3 E cadherin pre 抗体效价与特异性的检测1)Western blo t 检测外源性E cadherin 蛋白:分别用稀释比例为1 1000(体积比)的anti m yc 的Santa Cruz 公司商业化抗体和稀释比例为1 1000(体积比)以及1 2000(体积比)自制的抗E cadherin pre 的抗体来检测在293T 细胞中过量表达的c myc E cadherin 蛋白.pCMV5 c m yc E cadherin 质粒载体在293T 细胞内可以瞬时表达,由于在基因的C 端加上myc 标签,所以表达后带有未切割前体的c m yc E cadherin(大小约为135ku)以及切割成熟的c m yc E cadherin 蛋白(大小约为120ku)均可用商业化anti myc 抗体测出.实验结果显示(图4),用anti myc 抗体(图4A)和自制的E cadherin pre 抗体(图4B)均可在135ku 处检测到一条蛋白条带,与预测的未经加工的c myc E cadherind 大小相一致,其中图4A 在120ku 处检测到的蛋白条带为切割成熟的c myc E cadher in.结果表明我们所制备的E cadherin pre 抗体在效价上能与商业化的my c 抗体相当,具有很高的特异性,而且可以特异性地识别E cadherin pre.2)Western blot 检测内源性E cadherin pre:收集MDCK 细胞的裂解液,用稀释比例为1 1000(体积比)的自制抗E cadher in pre 的抗体来检测MDCK 细胞中E cadherin pre,结果如图5所示.结果表明我们所制备的E cadherin pre 抗体具有很高的特异性,可以特异性地识别内源性的E cadherin pre.3)免疫荧光检测:MDCK 细胞的免疫荧光染色结果显示(图6),未经加工过的E cadherin(即E cad herin pre),除了分布于细胞质内,也可以定位在细胞膜上.证实我们的E cadher in pre 抗体能够很好地应用于内源性E cadherin pre 的定位及功能研究.3 讨 论对E cadherin pre 的研究将有助于我们对E cad herin 切割活化以及其功能的全面了解,而目前国内外对其研究报道都相对较少.我们通过分析E cadherin 的一级结构,以及在N CBI 网站上对其序列进行二级结构的预测发现,其第31~164个氨基酸位置亲水性高,对表达可溶性的蛋白片段有利,且抗原表位较多,99 第1期 王继峰等:E cadher in 前体蛋白抗体的制备与鉴定易于形成特异性抗体,因此选择这段序列作为E cad herin pre 抗原表达的片段.商业化E cadherin 抗体是通过合成的短肽免疫兔子获得的,价格相对昂贵,而且目前商业化所选取的片段过短,可能造成抗原表位不足,其抗体所能识别的E cadherin 蛋白区域有限,最重要的是,商业化抗体无法识别E cadherin pre 片段以及某些缺失突变体,这样就为后续研究E cadherin pre 的功能带来诸多不便.而我们在选取抗原片段时充分考虑了这一点,针对E cadherin pre 设计抗原而且尽量选取较长的片段,但又不影响抗体的特异性,为研究带来方便,弥补了商业化抗体的缺陷.实验证明用其作为抗原免疫新西兰兔,产生的抗体较商业化抗体具有相同的特异性,而其效价与商业化的myc 抗体接近,为进一步展开E cadher in pre 的研究提供了有力的工具.参考文献:[1] Shore E M ,N elson W J.Biosynthesis of t he cell adhesionmolecule uv omo rulin(E cadher in)in M adin Dar by canine kidney epithelial cells [J].J Bio l Chem,1991,266(29):19672 19680.[2] Zhang A ,Chen G ,M eng L ,et al.Antisense snail tr ansfer inhibits tumor metastasis by inducing E cadherin expres sion[J].A nt icancer R es,2008,28(2A ):621 628.[3] O zawa M ,Kemler R.Co rr ect pr oteo lyt ic cleavag e is requir ed fo r the cell adhesive functio n of uvo morulin[J].J Cell Bio l,1990,111(4):1645 1650.[4] 哈洛E,莱恩D.抗体技术实验指南[M ].沈关心,龚非力,等译.北京:科学出版社,2002:49 50.[5] 萨姆布鲁克J ,费里奇E F,曼尼阿蒂斯T.分子克隆实验指南[M ].2版.金冬雁,黎孟枫,等译.北京:科学出版社,1992:846 848,854.[6] 奥斯伯F,布伦特R,金斯顿R E,等.精编分子生物学实验指南[M ].北京:科学出版社,1999:432 435,649 652.Preparation and Identification of the Antibody Againstthe Precursor Protein of E cadherinWA NG Ji feng,YE Zhi yun,LIN Shu yong *(K ey L aborat ory of the M inistr y o f Educat ion for Cell Bio lo gy and T umor Cell Engineer ing ,Scho ol o f L ife Sciences,X iamen U niv ersity ,X iamen 361005,China)Abstract:Ecadher in,an impor tant tumo r suppr essor which w as defected hig hly corr elates w ith tumor metastasis w as der ived fro m its precur sor pro tein.A s fo r the commer cial unav ailability ,the pr ecur so r for m o f E cadher in can not be detected at endo genous levels.In o rder to get qualified ant ibody ag ianst E cadher in pr e,Ps t I Pv u II fr agment (am ino acids 31to 164)N terminal in the precursor reg ion of E cadher in was ligated to pGST par allel v ecto r,ex pr essed in the E.coli .str ain BL 21.T he fusion pr otein w as purified by GST beads,and rabbits wer e immunized.9w eeks later ,the sera of the r abbits w ere har vested and an anti P re E cadherin po ly clonal antibo dy was purified.T he precursor o f E cadher in w as successfully detected w ith g reat sensit ivit y and specificit y by w estern blo tting using t his anti Pre E cadher in antibo dy in the lysate of 293T cells tr ansfected w ith pCM V 5 c m yc E cadher in.F ur thermo re,the anti body lays a g ood foundation for fur ther research on the functio n o f E cadherin pre,especially on its r ole in signal transductio n path w ays.Key words:Ecadher in pre;antibody;pGST E cadher in pr e100 厦门大学学报(自然科学版) 2011年。
一种新的多肽——人前体 mRNA 剪切SR蛋白12.54和编码这种多肽的多核

专利名称:一种新的多肽——人前体 mRNA 剪切SR蛋白
12.54和编码这种多肽的多核苷酸
专利类型:发明专利
发明人:毛裕民,谢毅
申请号:CN00127561.5
申请日:20001124
公开号:CN1355216A
公开日:
20020626
专利内容由知识产权出版社提供
摘要:本发明公开了一种新的多肽——人前体mRNA剪切SR蛋白12.54,编码此多肽的多核苷酸和经DNA重组技术产生这种多肽的方法。
本发明还公开了此多肽用于诊治多种疾病的方法,如糖尿病、甲亢、心律失常、肿瘤、各种感染等。
本发明还公开了抗此多肽的拮抗剂及其诊治作用。
本发明还公开了编码这种新的人前体mRNA剪切SR蛋白12.54的多核苷酸的用途。
申请人:复旦大学,上海博道基因技术有限公司
地址:200433 上海市邯郸路220号
国籍:CN
代理机构:上海正旦专利代理有限公司
更多信息请下载全文后查看。
双特异性抗体的制备流程

双特异性抗体的制备流程《双特异性抗体的制备流程,就像一场奇妙冒险!》嘿,各位小伙伴们!今天咱来聊聊双特异性抗体的制备流程,那可真是一场充满挑战和惊喜的奇妙冒险啊!咱就先从“原材料”开始说起吧。
这就好比是做饭,得先有好材料,才能做出美味佳肴。
为了制备这厉害的双特异性抗体,咱得精心挑选各种细胞、抗体片段啥的,这可不能马虎,要像挑食材一样精挑细选!万一挑到个“歪瓜裂枣”,那可就麻烦啦。
选好材料后,那就是“加工环节”啦!这就好像雕刻艺术品,得小心翼翼、精雕细琢。
要把那些细胞啊、片段啊,一点点地拼接起来,组合成我们想要的样子。
这个过程可不简单,得有一双稳定的手和一颗专注的心。
要是手抖一下,说不定就前功尽弃喽,这可不能像我平时做饭撒盐那样随手一抖呀!接下来就是“调试”啦!这就跟调整音响的音质似的,得让双特异性抗体发挥出最佳效果。
得看看它结合各种靶点的能力够不够强,效果好不好。
要是不行,还得回去重新调整那些“小零件”,这可真是个考验耐心的活儿。
等一切都弄好了,那就是见证奇迹的时刻啦!就好像动画片里英雄出场一样,闪闪发光。
看着自己亲手制备的双特异性抗体,那感觉,可别提多有成就感啦!不过呢,这制备流程可不是一帆风顺的哦!有时候会碰上各种各样的问题,就像是游戏里的关卡一样,得一个个去攻克。
可能会发现某个环节没做好,得重新开始;也可能会遇到一些意想不到的难题,得绞尽脑汁地想办法解决。
但是,别怕呀!这就是科研的魅力嘛,充满了未知和挑战。
就像打游戏升级一样,虽然过程中困难重重,但每攻克一个难题,就感觉自己又厉害了一点。
总之呢,双特异性抗体的制备流程,那真是一场既精彩又刺激的冒险。
虽然有麻烦,但也有无尽的乐趣和成就感。
大家一起加油,去探索这个神奇的领域吧!愿我们都能在这场冒险中取得圆满成功,做出超级厉害的双特异性抗体来造福人类哟!哈哈!。
rna剪接过程

rna剪接过程一、内含子识别。
1. 剪接体组装起始。
- 在细胞核内,首先由U1小核核糖核蛋白(snRNP)识别并结合到前体mRNA (pre - mRNA)的5'剪接位点。
U1 snRNP通过其RNA组分与5'剪接位点的互补序列进行碱基配对结合。
2. 内含子界定。
- 接着,U2辅助因子(U2AF)结合到内含子的3'端附近的多聚嘧啶区(Py - tract)和3'剪接位点。
U2AF由一个大的亚基U2AF65和一个小的亚基U2AF35组成,U2AF65结合多聚嘧啶区,U2AF35识别3'剪接位点的AG序列。
- 同时,U2 snRNP识别并结合到内含子中的分支点序列(BPS)。
分支点序列通常位于内含子内部,距离3'剪接位点较近,U2 snRNP与分支点序列的结合使得内含子的结构被进一步确定。
二、剪接体组装完成与催化反应准备。
1. 剪接体组装的后续步骤。
- 在U1 snRNP、U2 snRNP和U2AF结合之后,其他的snRNP(U4/U6.U5 tri - snRNP)被招募到这个复合物上,从而形成完整的剪接体。
这个过程涉及到多个snRNP 之间的相互作用以及它们与pre - mRNA的进一步调整结合。
2. 催化活性中心形成。
- 在剪接体组装过程中,U4和U6 snRNA之间存在着相互作用。
随着剪接体的成熟,U4 snRNA与U6 snRNA解离,U6 snRNA与U2 snRNA通过碱基配对形成催化活性中心。
这个活性中心对于后续的剪接反应至关重要。
三、剪接反应。
1. 第一步反应:转酯反应(分支点形成)- 在剪接体的催化活性中心,pre - mRNA发生第一次转酯反应。
内含子中的5'剪接位点的鸟嘌呤(G)与分支点序列中的腺苷酸(A)发生反应,腺苷酸的2' - OH攻击5'剪接位点的磷酸二酯键,形成一个具有2',5' - 磷酸二酯键的套索(lariat)结构。
mrna异常剪接体外验证实验技术的流程

在讨论 mRNA 异常剪接的外部验证实验技术的流程之前,我们首先需要了解 mRNA 异常剪接的含义和意义。
在此之后,我们将介绍这一验证实验技术的流程,以及其在研究中的重要性和应用价值。
我们会共享一些个人观点和理解。
让我们深入探讨。
1. mRNA 异常剪接的含义和意义mRNA 异常剪接指的是在转录后的 mRNA 水平上发生的剪接异常,而不是在 DNA 水平上。
这种异常剪接可能导致编码蛋白质的错误,进而影响基因的功能。
这种异常在许多疾病中都起着关键作用,包括癌症、遗传性疾病和自身免疫性疾病。
研究 mRNA 异常剪接及其验证实验技术对于理解疾病的发生和发展至关重要。
2. mRNA 异常剪接的外部验证实验技术流程外部验证实验技术是通过实验手段对某一假设或猜想进行验证的过程。
在研究 mRNA 异常剪接的外部验证实验技术中,一般包括以下步骤:(1) 样本准备:选择合适的细胞系或组织样本,以及相应的对照样本,进行实验前的样本准备工作。
(2) RNA 提取:从样本中提取RNA,以获得研究所需的mRNA 样本。
(3) RT-PCR:利用逆转录-聚合酶链反应技术,将 mRNA 转录为cDNA,然后进行PCR 扩增,以检测mRNA 异常剪接的存在与比较。
(4) 凝胶电泳:将扩增后的产物进行凝胶电泳分析,以观察不同样本间mRNA 异常剪接产物的差异。
(5) Sanger 测序:对凝胶电泳检测到的异常剪接产物进行 Sanger 测序,以确定具体的剪接位点和剪接类型。
(6) 数据分析:对实验结果进行分析,判断是否存在mRNA 异常剪接,并对其进行定量和定性描述。
3. mRNA 异常剪接的外部验证实验技术在研究中的重要性和应用价值外部验证实验技术是验证和验证科研成果的关键手段之一。
在研究mRNA 异常剪接的外部验证实验技术中,其重要性和应用价值主要体现在以下几个方面:- 确认研究发现:通过外部验证实验技术,可以对初步研究结果进行验证,从而保证研究的可靠性和科学性。
mrna 的制备

mrna的制备
mRNA(Messenger RNA)是一种携带遗传信息的分子,它将DNA上的基因信息传递到核糖体,指导蛋白质的合成。
制备mRNA的过程通常包括以下几个步骤:
1.设计和合成目标基因序列:首先,需要设计和合成目标基因的DNA序列。
这个序列可以是一个完整的基因,也可以是一个特定的片段。
2.将DNA模板转录为mRNA:使用一种称为聚合酶链式反应(PCR)的技术,将目标DNA序列放大并制备成模板。
然后,使用一种称为RNA聚合酶的酶将DNA 模板转录为mRNA。
3.修饰和处理mRNA:为了提高mRNA的稳定性和表达效率,通常需要对其进行修饰和处理。
这可能包括添加帽子结构、poly(A)尾巴和其他修饰。
4.纯化和浓缩mRNA:通过柱层析或其他方法,对制
备好的mRNA进行纯化和浓缩,以去除杂质和其他不需要的分子。
5.质量控制和验证:对制备好的mRNA进行质量控制和验证,以确保其具有正确的序列、纯度和活性。
制备好的mRNA可以用于各种应用,如基因治疗、疫苗开发、细胞治疗和蛋白质合成等领域。
mrna疫苗制备流程

mrna疫苗制备流程深入解析:mrna疫苗的制备流程与科学奥秘在当前全球抗击新冠病毒的战役中,mrna疫苗技术扮演了关键角色。
mrna (信使核糖核酸)疫苗以其独特且高效的制备方式,打破了传统疫苗研发的传统观念,引领了一场医学科技革命。
本文将详细探讨mrna疫苗的制备流程,揭示其背后的科学原理和创新之处。
一、mrna疫苗的基本原理mrna疫苗的核心理念是利用人体自身的免疫系统来对抗病原体。
传统的疫苗通常包含灭活或减毒的病原体,或者其部分蛋白质,而mrna疫苗则是将病原体的遗传信息——mrna,直接引入人体。
当mrna进入细胞后,它会被细胞内的分子机器翻译成病原体的蛋白质,这些蛋白质会引发免疫反应,使人体记住并能够对抗真正的病原体。
二、制备流程详解1. 基因序列设计:首先,科学家需要确定目标病毒的基因序列,然后选取与感染相关的基因片段,作为mrna疫苗的主要成分。
这个过程类似于“剪辑”病毒的基因蓝图。
2. mrna合成:使用化学方法,将选取的基因序列编码到mrna分子上。
这个mrna分子与天然病毒mrna非常相似,但没有自我复制的能力,降低了潜在的安全风险。
3. mrna纯化与优化:经过合成的mrna需要经过严格的纯化处理,去除可能的杂质,并通过化学修饰使其更稳定,能够在体内维持较长时间。
4. 载体包裹:为了提高mrna在人体细胞中的稳定性并增强其递送效率,科研人员通常会将其与脂质纳米颗粒等载体结合。
这些载体可以保护mrna免受体内的降解酶影响,同时帮助mrna穿过细胞膜。
5. 临床试验:经过实验室验证后的mrna疫苗候选品,需要进行一系列的临床试验,从动物实验到人体I/II/III期试验,确保其安全性和有效性。
6. 大规模生产:如果疫苗在临床试验阶段表现出良好的效果,制药公司会开始大规模生产,包括mrna的制备、质量控制以及最终的疫苗包装。
三、mrna疫苗的优势与挑战mrna疫苗的优势在于其快速研发速度、无需培养活病毒、安全性高,且可针对多种病原体进行定制。
真核生物核基因mrna前体的剪接机制

真核生物核基因mrna前体的剪接机制下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!本店铺为大家提供各种类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you! In addition, this shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts, other materials and so on, want to know different data formats and writing methods, please pay attention!标题:真核生物核基因mRNA前体的剪接机制导言在真核生物中,基因的表达是一个复杂而精密的过程。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
・免疫学技术与方法・前体mRNA剪接蛋白T ra2α特异抗体的制备和鉴定①陈献华 林万敏 孙凯华 黄 嘉 汪 凌 徐 平②(复旦大学生命科学院基因生理学研究室,脑研究中心,立人实验室,上海200433) 中国图书分类号 R392111 文献标识码 A 文章编号 10002484X(2002)1020682205摘 要 目的:制备用于检测人胚胎组织T ra2α蛋白的特异抗体。
方法:选择T ra2α中特有的一段编码序列(第52~165位核苷酸),通过克隆至p GEX23x表达载体形成G ST融合基因,并以诱导表达和纯化的该融合蛋白为抗原免疫新西兰兔,获得了抗T ra2α的血清。
结果:免疫印迹(Western blot)检测结果显示,该血清能特异地与人胎脑组织中的T ra2α蛋白结合。
免疫组织化学结果显示,该血清能用于人胎脑组织中T ra2α蛋白分布的检测。
结论:所制备的抗血清具有很好的特异性,可用于人胚胎组织中T ra2α蛋白的检测。
关键词 T ra2α 前体mRNA剪接蛋白 特异性抗原片段 抗体Preparation and determination of polyclonal antibody to pre2mRNA splicing protein Tra2αCHEN Xian2Hua,LIN Wan2Min,SUN Kai2Hua et boratory o f G enomic Physiology,School o f Life Sciences,Brain Research Center,Liren Laboratory,Fudan Univer sity,Shanghai200433Abstract Objective:T o prepare specific antibody against the pre2mRNA splicing protein T ra2αin human fetal tissues.Methods:A spe2 cific antigen fragment of human T ra2αwas cloned into the p GEX23x expression vector to express a recombinant G ST2T ra2αfusion protein.The fusion protein was expressed,purified and used as an antigen to immunize the New Z ealand rabbit,and the polyclonal antibody to T ra2αwas ob2 tained.R esults:The antibody was success fully used to detect T ra2αprotein in human fetal cerebrum with Western blot and immunohistoche2 mistry analysis.Conclusion:This prepard antibody has g ood specificity and can be used to detect the T ra2αprotein in the human fetal tissues.K ey w ords T ra2α Pre2mRNA splicing protein S pecific antigen fragment Antibody Tra2α(trans former2α)蛋白最初发现于果蝇,它通过和Tra蛋白共同调控果蝇的dsx基因前体mRNA 的剪接而控制果蝇的性别分化124,因而Tra2α基因被认为是果蝇的性别决定相关基因。
就哺乳动物而言,Tra2α基因在大鼠、小鼠和人类中也已被发现。
现在已知,哺乳动物中,Tra2α是Tra2家族中的一个亚族,已发现它包括Tra2α的全长型(Tra2α)和截短型(truncated)两种亚型(后者与前者相比,缺少了C端和N端的两个RS区域),而Tra2家族的另一个亚族则是与Tra2α高度同源的Tra2β,它包括至少5个由同一前体经不同剪接形成的亚型5,6。
迄今为止,人们对哺乳动物Tra2家族中的Tra2β亚族的研究相对较多,而对Tra2α亚族的研究则很①国家自然科学基金资助项目(批准号30070242)②本文通讯作者作者简介:陈献华,女,35岁,讲师,生理及生物物理学硕士。
少。
因此,尽管体外的生化研究7,8已证实Tra2α蛋白在选择性前体mRNA剪接中有序列特异的激活作用,且研究也表明,人类的Tra2α在果蝇中也同样具有控制其性别分化的作用9,10。
但总体上对Tra2α的许多方面,尤其是在体内功能方面尚不清楚。
有鉴于此,我们实验室近年来围绕Tra2α开展了一系列的研究,并取得了初步的进展(结果待发表)。
我们在研究中需要用到抗Tra2α的特异抗体,以进行Tra2α蛋白表达的检测,但目前尚无商品化的抗Tra2α抗体供应,文献中提及的几种Tra2蛋白的抗体6,7,11大多是抗Tra2β的,即便是抗Tra2α的,也同时抗Tra2β。
因此,制备抗Tra2α的特异抗体就成了我们重要的工作内容,这也是本文的目的。
我们研制的是抗Tra2α全长型蛋白的抗体。
鉴于Tra2α与其另一截短的亚型之间以及与Tra2β之间的高度序列同源性7,在设计特异抗原片段时,我们选择了其编码序列中与其它亚型以及G enebank 中其它的EST无同源的一段作为特异抗原编码序列,将其克隆到表达载体p GEX23X中,在大肠杆菌中高效表达,并制备了相应的多克隆抗体,从而为进一步的研究打下了基础。
1 材料与方法111 试剂和材料 限制性内切酶、T4连接酶购自R oche公司;T aq DNA聚合酶、Factor Xa购自Promega 公司;p GEX23X表达质粒、G lutathion2sepharose4B和还原型谷胱甘肽洗脱液购自Pharmacia公司;Trizol 试剂盒购自G ibco2BR L公司;羊抗兔IgG2Biotin、Streptavidin2HRP购自Sigma公司;大肠杆菌DH5α、BL21(DE3)为本实验室保存;PCR引物由上海生物工程技术有限公司合成:引物1:5’2T ACGGG ATC2 CAG TC AAAATCTCC AACG23’,对应于Tra2α1cDNA的第52~66位核苷酸序列。
引物2:5’2T AGG AAT2 TCTC ATTTTG ATCTTG ATCG AG A23’(其中引入了一个终止密码子),对应于Tra2α1cDNA的第148~165位核苷酸序列。
在上述的两个引物中,分别导入了BamHI和EcoRI酶切位点(见下划线部分)。
112 方法11211 Tra2α特异抗原片段的选择 利用G CG软件先将Tra2αcDNA中的编码序列与截短的Tra2α亚型及Tra2β各亚型的序列进行比较,获得与这些亚型序列不同源的Tra2α核苷酸序列片段,再利用Blast 工具将该片段与G enebank中的其它EST进行比较确认其特异性,获得的序列在检查其插入载体后的阅读框与Tra2αcDNA编码序列的读框一致后,即作为Tra2α的特异抗原的编码序列。
利用此方法,我们选定了一个含114核苷酸的序列(相对于Tra2α1蛋白编码序列的第52~165位核苷酸),编码一个含38个氨基酸残基的多肽链。
11212 Tra2α特异抗原片段编码序列的克隆 由于本实验室先前已有克隆了人类Tra2α的全长编码序列的表达质粒(PCR2112Tra2α),所以,我们以该质粒为模板,利用前述的引物1和引物2进行PCR扩增,以获得带有BamHI和EcoRI酶切接头的片段。
PCR 反应条件为:94℃预变性5min后,进行30个循环的扩增,每个循环包括:94℃变性15s,58℃退火15s, 72℃延伸30s,最后一个循环为72℃延伸7min。
PCR产物经纯化、酶切、片段回收后,克隆到p GEX2 3X表达质粒中,获得重组表达质粒并测序验证。
11213 融合蛋白的诱导表达及纯化 将含p GEX2 Tra2α质粒的单克隆BL21菌落在2×Y T培养基(含100mgΠL的氨苄青霉素)中37℃培养至A600为016~018,加入终浓度为012mm olΠL的IPTG诱导表达3h,收集菌体,参照文献12用超声波破菌法处理和收集表达产物,根据S DS2PAGE电泳结果确定最佳表达条件。
表达产物上清经谷胱甘肽转硫酶(G ST)亲和柱纯化,获得纯度为95%以上的G ST融合蛋白。
11214 蛋白质免疫实验以获得Tra2α蛋白特异的抗血清 在利用纯化的G ST融合蛋白免疫新西兰大白兔时,考虑到以下两方面的原因:一方面,由于融合蛋白中G ST部分的长度(27kD)远远大于我们克隆的目的片段(约4kD),所以,在自然状态下的该融合蛋白中,Tra2α片段的抗原性可能被G ST蛋白部分所掩盖;而另一方面,变性蛋白虽然能使抗原决定簇充分暴露,但作为抗原所获得的抗体又可能会有较低的效价,甚至不与抗原结合。
为稳妥起见,我们采用了一半非变性蛋白加一半变性蛋白(100℃,5 min)的混合物对新西兰兔进行免疫注射,具体程序是:首次免疫一个月后,进行一次加强免疫,1w后再进行第二次加强免疫。
三次免疫均用400mg非变性蛋白和400mg变性蛋白的混合物加上等体积弗氏不完全佐剂或完全佐剂乳化后进行肌肉注射。
免疫后的兔血清经小量采血用E LIS A反应检测效价合格(效价超过4096)后,利用颈总动脉插管法取血并收集血清。
获得的血清用于下一步的结合特异性检测。
11215 Western印迹杂交法检测血清与Tra2α蛋白结合的特异性反应 由于注入的抗原为G ST融合蛋白,抗血清中可能兼有抗G ST和抗Tra2α的抗体。
因此有必要通过实验确认抗血清中的这两种抗体成分。
为此,我们设计了如下实验:用本文制备的抗血清与另一种同样方法制备的兔抗G ST2Nestin融合蛋白的血清(相关论文即将发表)对11周的人胚胎大脑组织样品进行Western blot检测,那么,只能用前者检测到的条带便是Tra2α。
实验基本按文献12进行,即:将011g人胎脑组织在预冷的012ml裂解液(100mm olΠL NaCl,10mm olΠL TrisΠHCl,pH7.6;1 mm olΠL E DT A,pH8.0;1μgΠml Aprotinin,100μgΠml PMSF)中制成匀浆,然后加入等体积的2×S DS2 PAGE上样液(100mm olΠL T irsΠHCl,pH6.8;200mm olΠL DTT,4gΠL S DS,2gΠL溴酚蓝,20%甘油),再在100℃水浴煮沸5min,冰上冷却后待用。
