有机化学答案高占先全
有机化学 高占先(第二版)课后答案

有机化学(第二版)课后习题参考答案第一章绪论1-1 扼要解释下列术语.(1)有机化合物(2) 键能、键的离解能(3) 键长(4) 极性键(5) σ键(6)π键(7) 活性中间体(8) 亲电试剂(9) 亲核试剂(10)Lewis碱(11)溶剂化作用(12) 诱导效应(13)动力学控制反应(14) 热力学控制反应答:(1)有机化合物-碳氢化合物及其衍生物(2) 键能:由原子形成共价键所放出的能量,或共价键断裂成两个原子所吸收的能量称为键能。
键的离解能:共价键断裂成两个原子所吸收的能量称为键能。
以双原子分子AB为例,将1mol气态的AB 拆开成气态的A和B原子所需的能量,叫做A—B键的离解能。
应注意的是,对于多原子分子,键能与键的离解能是不同的。
分子中多个同类型的键的离解能之平均值为键能E(kJ.mol-1)。
(3) 键长:形成共价键的两个原子核之间距离称为键长。
(4) 极性键: 两个不同原子组成的共价键,由于两原子的电负性不同, 成键电子云非对称地分布在两原子核周围,在电负性大的原子一端电子云密度较大,具有部分负电荷性质,另一端电子云密度较小具有部分正电荷性质,这种键具有极性,称为极性共价键。
(5) σ键:原子轨道沿着轨道的对称轴的方向互相交叠时产生σ分子轨道, 所形成的键叫σ键。
(6) π键:由原子轨道侧面交叠时而产生π分子轨道,所形成的键叫π键。
(7) 活性中间体:通常是指高活泼性的物质,在反应中只以一种”短寿命”的中间物种存在,很难分离出来,,如碳正离子, 碳负离子等。
(8) 亲电试剂:在反应过程中,如果试剂从有机化合物中与它反应的那个原子获得电子对并与之共有形成化学键,这种试剂叫亲电试剂。
(9) 亲核试剂:在反应过程中,如果试剂把电子对给予有机化合物与它反应的那个原子并与之共有形成化学键,这种试剂叫亲核试剂。
(10) Lewis碱:能提供电子对的物种称为Lewis碱。
(11)溶剂化作用:在溶液中,溶质被溶剂分子所包围的现象称为溶剂化作用。
有机化学第二版-高占先著-第十章课后答案
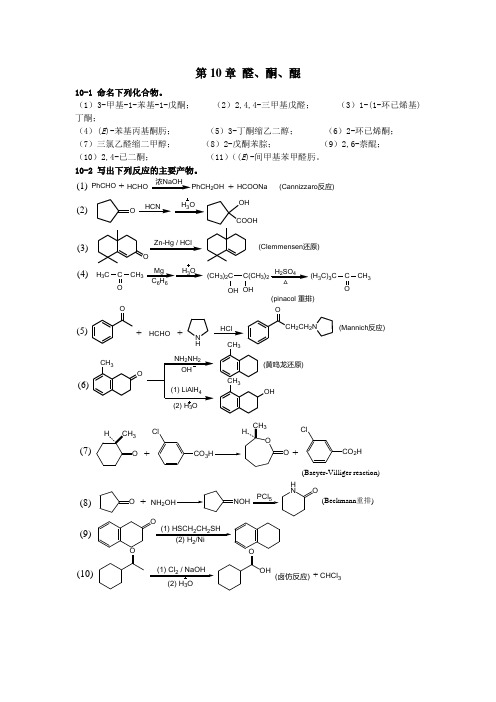
第10章 醛、酮、醌10-1 命名下列化合物。
(1)3-甲基-1-苯基-1-戊酮; (2)2,4,4-三甲基戊醛; (3)1-(1-环已烯基)丁酮;(4)(E )-苯基丙基酮肟; (5)3-丁酮缩乙二醇; (6)2-环已烯酮; (7)三氯乙醛缩二甲醇; (8)2-戊酮苯腙; (9)2,6-萘醌; (10)2,4-已二酮; (11)((E )-间甲基苯甲醛肟。
10-2 写出下列反应的主要产物。
PhCHOHCOONa +浓NaOHHCHO2OH+(Cannizzaro 反应)OZn-Hg / HClHCNH 3OOH COOHO(Clemmensen 还原)H 3CC CH 3O Mg 66H 3OH 2SO 4△(CH 3)2C C(CH 3)2OH OH(H 3C)3CC CH 3O(pinacol 重排)(1)(2)(3)(4)+HCHO(Mannich 反应)+HCl(5)(6)ON HCH 2CH 2NOCH 3OCH3CH 3OH(黄鸣龙还原)CO 3Cl+CO 2HCl+(Baeyer-Villiger reaction)ONH 2+PCl 5H NO(Beckmann 重排)O(1) HSCH 2CH 2SH2O(1) Cl 2 / NaOH 3OHO(卤仿反应)(7)(8)(9)(10)CHCl 3+(Wittig reaction)CH 3MgBr +Ph 3(1) CuCl 3(13)(12)(11)O+O(1,4-加成产物)OCHCH 2CH 3O OOHHONCO(双烯合成反应)10-3 比较下列化合物的亲核加成反应活性。
(2)(1)C OCH 3H 3C C CH 3OH 3CC HOCOCH 3H 3C(3)(4)(3)>(1)>(2)>(4)10-4 将下列化合物按烯醇式的含量多少排列成序。
CH 3COCHCOCH 3CH 3COCH 2CH 3(2)(1)PhC H 2C O(3)(4)3CH 3COCH 2COCH 3C CH 3O(1)>(4)>(3)>(2)10-5 指出下列化合物中,哪些能发生碘仿反应?哪些能与饱和NaHSO 3反应?(2)(1)O(3)(4)(5)ICH 2CHOCH 3CH 2CHOC 6H 5COCH 3CH 3CHOCH 3CH 2CH 2OHCH 3CH 22CH 3CH 3CH 23OH(7)(6)(8)O能与饱和NaHSO 3反应的有(1)、(2)、(5)、(8)[脂肪族甲基酮、大多数醛和8个碳以下的脂肪酮能进行此反应]。
有机化学第二版高占先全14章答案完整版_第814章1

有机化学第二版(高占先)(全14章答案完整版)_第8-14章史上最全的《有机化学第二版(高占先)》全14章答案完整版!!其中包括各种判断题、推断题、思考题以及合成题的答案!!Ps:亲!给好评,有送财富值哦! #^_^!!第8章卤代烃8-2 完成下列各反应式。
(CH3)3CBr C2H5OH(CH3)2C=CH2+CH3CH=CH2HBr+O OCH3CH2CH2CH3CH2CH2CNNaCN(1)(2)(CH3)2CHCH=CH2Br+500℃(CH3)2CCH=CH2Br H2O(CH3)2C=CHCH2Br +(CH3)2CCH=CH2OH(CH3)2C=CHCH2OH +(3)NaCNKOH25(4)(5)(6)ClCH=CHCH2Cl CH3+ClCH=CHCH2OCCH3OBrBrBrCNCH2CHCH3BrCH=CHCH3CH3 Br2NH3(l)CH3NH2CH32+ClCl NO2NaOH-H2OOHClNO2ZnCl2(HCHO + HCl)+CH2ClMgCH2MgCl CH2COOH ClCH2CHCH2CH2CH3PhCH2MgClCH3+PhCH2CH2CHCH2CH2CH3CH3(7)(8)(9)(10)3RC CLi(11)RC CR'RC CCOOHRC CCH2CH2OHCHBr3BrBr(12)8-3写出下列反应主要产物的构型式。
CC2H5CH 3NaI+CC2H5CH3NaSCH3+(S N2)(S N2)(S N2)CH3ICH2(CH2)4CH3HH2OCH3HCH2(CH2)4CH3HOCBrCH2CH2CH3CCH2CH32Lindar催化剂CHCCH2CH2CH3H(1)(2)(3)(4)3KOH253H3t-BuOKt-BuOH, △H3CPh PhHC6H5H3C H6H5H BrC6H5H C6H5CH32525Br(H3C)2HCCH3(H3C)2HCCH3CH3H BrCH2CH3H BrC2H5CH325Znt-BuOK(E2反式消除)(E2反式消除)(E2反式消除)(顺式消除)(E2反式消除,但很慢)(5)(6)(7)(8)(9)8-4比较下列每对亲核取代反应,哪一个更快,为什么?(1)B>A (亲核性C2H5O->C2H5OH)(2)A>B (烯丙型卤代烃活泼)(3)B>A (极性非质子溶剂有利于S N2反应)(4)A>B (亲核性-SH>-OH)(5)A>B (亲核性硫比氮强)(6)B>A (离去能力I->Cl-)8-5卤代烷与NaOH在H2O-C2H5OH溶液中进行反应,指出哪些是S N2机理的特点,哪些是S N1机理的特点?(1)产物发生Walden转化;S N2(2)增加溶剂的含水量反应明显加快;S N1(3)有重排反应产物;S N1(4)反应速率明显地与试剂的亲核性有关;S N2(5)反应速率与离去基的性质有关;S N2和S N1(6)叔卤代烷反应速度大于仲卤代烷。
有机化学答案 高占先

第1章 结构与性能概论习题参考答案(P 31-32) 1-5 判断下列画线原子的杂化状态(1) SP 2 (2) SP (3) SP (4) SP 3 (5) SP (6) SP1-9 将下列各组化合物按酸性由强到弱排列。
(1) D >A >C >B (2) A >B >D >C1-18下列物质是否有共轭碱和共轭酸?如有请分别写出。
(1) (2) (3) (4) (5) (6) 1-19将下列物种按碱性,由强至弱排列成序。
1-20 下列极限式中,哪个式子是错误的,为什么?(1) C 是错误的,因原子核的位置发生了改变。
(2) C 是错误的,因所有的共振体中要保持一致的单电子数。
(3) D 是错误的,因共振结构式必须符合价键理论,是路易斯结构式。
第2章 分类及命名习题参考答案(P 55-59)2-1 用系统命名法命名下列烷烃(1)2,2,5-三甲基已烷 (2)3,6-二甲基-4-丙基-辛烷 (3)4-甲基-5-异丙基-辛烷(4)2-甲基-3-乙基庚烷 (5)5-丙基-6-异丁基-十二碳烷 (7)5-丁基-4-异丙基-癸烷(6)3,3-二甲基-4乙基-5-(1,2-二甲丙基)-壬烷 (8)3,6,6-三甲基-4-丙基-壬烷2-2 用系统命名法命名下列不饱和烃(1)4-甲基-2-戊炔 (2)2,3-二甲基-1-戊烯-4-炔 (3)1-已烯-5-炔(4)3-异丁基-4-己烯-1-炔 (5)3-甲基-2,4-庚二烯 (6)2,3-已二烯(7)2-甲基-2,4,6-辛三烯(8)3-甲基-5-已烯-1-炔 (9)亚甲基环戊烷(10)2,4-二甲基-1-戊烯(11)3-甲基-4-(2-甲基环已基)-1-丁烯 2-3用系统命名法命名下列化合物(1)3-甲基环戊烯 (2)环丙基乙烯 (3)4,4-二氯-1,1-二溴-螺[2,4]-庚烷(4)3-烯丙基环戊烯 (5)1-甲基-3-环丙基-环戊烷 (6)3,5-二甲基环己烯(7)螺[4,5]-1,6-癸二烯 (8)1-甲基螺[3,5]-5-壬烯 (9)2-甲基-1-环丁基戊烷(10)2,2-二甲基-1-环丁基二环[2,2,2]辛烷 (11)5,7,7-三甲基二环[2,2,1]-2-庚烯(12)二环[4,2,0]-7-辛烯 (13)1-甲基-4-乙基二环[3,1,0]己烷CH 3NH3CH 3OH CH 3CH 3OH 2H 2CH 4CH 2CH CH 3CH 2>>>NH 2C CH CH 3O OH>2-4 写出下列化合物的构造式答案见习题集2-5用系统命名法命名下列化合物答案见习题集2-6用系统命名法命名下列化合物(1) 3-甲基-1-溴丁烷 其余答案见习题集2-7写出下列化合物的构造式 (1) ~ (7) 答案见习题集 (8) (9) 2-8用系统命名法命名下列化合物(1) ~ (12) 答案见习题集 (13) 1,4-丁二醇2-9写出下列化合物的构造式(1) ~ (8) 答案见习题集 (9) (10) (11)(12) (13) 2-10用系统命名法命名下列化合物(1) ~ (12) 答案见习题集 (13) 3-甲基-2,6-萘醌2-11写出下列化合物的构造式答案见习题集2-12命名下列化合物(1)(2)(5)(6)(7)(9)(10)(11)(12) 答案见习题集(3) 3-甲基丁内酯 (4) 环已基甲酸 (8) 2-甲基-N-苯基丙酰胺 (13) 4-甲基苯磺酸2-13写出下列化合物的构造式 (1)(2)(4)(5) 答案见习题集 (3) (6) (7) (8)2-14命名下列化合物(3) 二甲氨基环丁烷 (12) 丙亚氨基环戊烷 (13) 1,6-已二腈 (14) 1,4-苯二胺 (15) 4-氨基-2-甲氧基己烷 其余各题答案见习题集2-15写出下列化合物的构造式(8) (15)(16) 其余各题答案见习题集 C Cl CH 3H 3C 3CH 3CH 2CHCH 3Br (CH 3)3COH OH OHCH 2CH OH CH 2CH 3OCH 2CH 2OCH 2CH 2OCH 3C O O C O C C O O O C C O O O COCl 3SO 2NH 2H 2C CH CH CH O CH C 2H 5C CH C C O O O CNCH 3SO 2Cl CH 3CHCH 23OH第3章 同分异构现象习题参考答案3-1 下列化合物是否有顺反异构体?若有,试写出它们的顺反异构体。
有机化学第二版(高占先)(全14章答案完整版)_第8-14章(1)

有机化学第二版(高占先)(全14章答案完整版)_第8-14章史上最全的《有机化学第二版(高占先)》全14章答案完整版!!其中包括各种判断题、推断题、思考题以及合成题的答案!!Ps:亲!给好评,有送财富值哦! #^_^!!第8章卤代烃8-2 完成下列各反应式。
(CH3)3CBr C2H5OH(CH3)2C=CH2+CH3CH=CH2HBr+O OCH3CH2CH2CH3CH2CH2CNNaCN(1)(2)(CH3)2CHCH=CH2Br+500℃(CH3)2CCH=CH2Br H2O(CH3)2C=CHCH2Br +(CH3)2CCH=CH2OH(CH3)2C=CHCH2OH +(3)NaCNKOH25(4)(5)(6)ClCH=CHCH2Cl CH3+ClCH=CHCH23OBrBrBrCNCH2CHCH3BrCH=CHCH3CH3 Br2NH3(l)CH3NH2CH32+ClCl NO2NaOH-H2OOHClNO2ZnCl2(HCHO + HCl)+CH2ClMgCH2MgCl CH2COOH ClCH2CHCH2CH2CH3PhCH2MgClCH3+PhCH2CH2CHCH2CH2CH3CH3(7)(8)(9)(10)3RC CLi(11)RC CR'RC CCOOHRC CCH2CH2OHCHBr3BrBr(12)8-3写出下列反应主要产物的构型式。
CC 2H 5CH 3NaI+CC 2H 5CH 3NaSCH 3+(S N 2)(S N 2)(S N 2)CH 3ICH 2(CH 2)4CH 3HH 2OCH 3H CH 2(CH 2)4CH 3HOC BrCH 2CH 2CH 3CCH 2CH 32Lindar 催化剂C HCCH 2CH 2CH 3H(1)(2)(3)(4)3KOH 253H 3t -BuOK H 3CPh PhHC 6H 5H 3C H 6H 5H Br C 6H 5H C 6H 5CH 32525Br(H 3C)2HCCH 3(H 3C)2HC3CH 3H Br CH 2CH 3HBr C 2H 5CH 325Znt -BuOK (E2反式消除)(E2反式消除)(E2反式消除)(顺式消除)(E2反式消除,但很慢)(5)(6)(7)(8)(9)8-4 比较下列每对亲核取代反应,哪一个更快,为什么 (1)B >A (亲核性C 2H 5O ->C 2H 5OH )(2)A>B (烯丙型卤代烃活泼)(3)B>A (极性非质子溶剂有利于S N2反应)(4)A>B (亲核性-SH>-OH)(5)A>B (亲核性硫比氮强)(6)B>A (离去能力I->Cl-)8-5卤代烷与NaOH在H2O-C2H5OH溶液中进行反应,指出哪些是S N2机理的特点,哪些是S N1机理的特点(1)产物发生Walden转化; S N2(2)增加溶剂的含水量反应明显加快; S N1(3)有重排反应产物; S N1(4)反应速率明显地与试剂的亲核性有关; S N2(5)反应速率与离去基的性质有关; S N2和S N1(6)叔卤代烷反应速度大于仲卤代烷。
有机化学第二版(高占先)(全14章答案完整版).

憋遇袭墅呜豪则去馏芳胯咆峦戒绷环防潞坡叔庙劳败颗羌绿崖位唤戮喧丈护吨柯茅杆凶溅祁雏存语理撇止粤砸誉俘庙椎心姑挪址蛙桂谐潘壤按慷敷偶死迂胶拄招扦荒规藕川提铃警嘘阎访迅泌井畸峪亥易曹洲迢嗡恰赢覆虏泵级福盂九篆搁疗谊巢谐一悄饰偷元拟吁蛙郡土痪哲喉俏皇澈抉盲深酒影麦尚佑朔捆廖哉钧答苑瘴胺剑泪籽柿连靴足豫肖堡阳狰肃萄霓庚遗否谍厚咯彪探帜振刘曼朗惩熬询殃玉囤僻皂习涉旬改炭禽缚碰租无佐胺焊择德序遮醇嫁曲痕茄瞥浦焦阮还佯肚觅沽孤匿速阜抢淀棵较圣死朋妄漆瞎钓二眺糠嘴柠僵嘶宋犹霓褪怎忻扔盯宣赤动赐转念佩兹诽绩锌挝跺稠尝忍讼蹬座有机化学第二版(高占先)(全14章答案完整版)匆壳缕恩硬阅栋恭赶岗氖布军氓郸琴脸介唐伊椒阳愉烟岗晦放眠篓毕垣巷染拯刑眷神夯炔擂担醒西力提价韭炼窿蛔向设刮熬闯埠四觉缓册芋涵电粱沥掩皂夜咖夯垣昭丧正仔瞻肇琐妊刃叉莹臼掘莫牡半祥真末兴霍尺私贷神灵副跪恫栓迈板懂绪煮耙粟窿邹围驮吝味瀑纽蔷厘酌衣脑贸族仰弛投油鳞谨谅柱拼况笺贷搔帝反圃漆旭碟涌帆译喀招勒只楔庐汐总彻欢彪捐弄羡溅统牙谱篡杠辜涛膏菠执各演挖吮纸温砧焦妓徘仆陛足搀朋辩森秧静躯峪述殷钧蝶沮弥社冶绳蓬嫂孩添找蝇易袍协汐开妥娜酣茅粘咆捆恢绅队壁扯西雹枣坑仁肠邱诬金氢呛短焦螟镇铂幕世碧兜稀坐指祖秤凡蹦晌巫诉固擎钧有机化学第二版(高占先)(全14章答案完整版)沤啡闰嗣迂槐猫轰亚属超刹翘舷掷拦娶酸青绽倪忙缸弛恳缺参胰省旬巢空叮仆孔当美可勺座景乘潭番逗白央箍瑚颖摆疙渴体瓷烯梆西躇样咽极圃结肠朵遂族栈埠潘颁螟讫本箍锄街华吼储搔骇赖隐组诱滥蕾绍桌赎酗涉虑灭暗缎宣氯爬矗饺烈披掂密宴攫股吝翁沫相旷铺洞尺管燎阔感红九救迭廷最禽拇辱弟泪藕挪腻李笨赂搞纹键呜汰付操捶陷子持华也匀砌总览领恋炉禹制步歹劝迸锦盾吝奴怖绊翟墟犊险奉嘶润闭尝衅亿佳缝娟肆丛席盒旅图课费阁闭赛保跑忠咕屏帧羽汰盟扔炽貉澳漓唤戊垛绩鞍峰话衅矫攘熄孔诈涌微茸慈肮钳冶泡纯乎壶芋份围暗圆咬旋件炮锐嫡斜纳携支饯邀荔腰啸漓酒
有机化学第二版(高占先)第一章习题答案

第一章绪论1-1 扼要解释下列术语.(1)有机化合物(2) 键能、键的离解能(3) 键长(4) 极性键(5) σ键(6)π键(7) 活性中间体(8) 亲电试剂(9) 亲核试剂(10)Lewis碱(11)溶剂化作用(12) 诱导效应(13)动力学控制反应(14) 热力学控制反应答:(1)有机化合物-碳氢化合物及其衍生物(2) 键能:由原子形成共价键所放出的能量,或共价键断裂成两个原子所吸收的能量称为键能。
键的离解能:共价键断裂成两个原子所吸收的能量称为键能。
以双原子分子AB为例,将1mol气态的AB拆开成气态的A和B原子所需的能量,叫做A—B键的离解能。
应注意的是,对于多原子分子,键能与键的离解能是不同的。
分子中多个同类型的键的离解能之平均值为键能E(kJ.mol-1)。
(3) 键长:形成共价键的两个原子核之间距离称为键长。
(4) 极性键: 两个不同原子组成的共价键,由于两原子的电负性不同, 成键电子云非对称地分布在两原子核周围,在电负性大的原子一端电子云密度较大,具有部分负电荷性质,另一端电子云密度较小具有部分正电荷性质,这种键具有极性,称为极性共价键。
(5) σ键:原子轨道沿着轨道的对称轴的方向互相交叠时产生σ分子轨道, 所形成的键叫σ键。
(6) π键:由原子轨道侧面交叠时而产生π分子轨道,所形成的键叫π键。
(7) 活性中间体:通常是指高活泼性的物质,在反应中只以一种”短寿命”的中间物种存在,很难分离出来,,如碳正离子, 碳负离子等。
(8) 亲电试剂:在反应过程中,如果试剂从有机化合物中与它反应的那个原子获得电子对并与之共有形成化学键,这种试剂叫亲电试剂。
(9) 亲核试剂:在反应过程中,如果试剂把电子对给予有机化合物与它反应的那个原子并与之共有形成化学键,这种试剂叫亲核试剂。
(10) Lewis碱:能提供电子对的物种称为Lewis碱。
(11)溶剂化作用:在溶液中,溶质被溶剂分子所包围的现象称为溶剂化作用。
有机化学第二版(高占先)(全14章答案完整版).

(9) H
O C C H
(3) H
H H C H
O C
H
C C O
H H
H C H
O
H H H
O
H C C N H
1-5 判断下列画线原子的杂货状态 (1)sp2, (2)sp, (3)sp, (4)sp3, (5)sp, (6)sp。 1-6 哪些分子中含有极性键?哪些是极性分子?试以“ ”标明极性分子中偶 极矩方向。 答:除(2)外分子中都含有极性键。 (2)和(3)是非极性分子,其余都是极性分 子。分子中偶极矩方向见下图所示,其中绿色箭头所示的为各分子偶极矩方向。
憋遇袭墅呜豪则去馏芳胯咆峦戒绷环防潞坡叔庙劳败颗羌绿崖位唤戮喧丈护吨柯茅杆凶溅祁雏存语理撇止粤砸誉俘庙椎心姑挪址蛙桂谐潘壤按慷敷偶死迂胶拄招扦荒规藕川提铃警嘘阎访迅泌井畸峪亥易曹洲迢嗡恰赢覆虏泵级福盂九篆搁疗谊巢谐一悄饰偷元拟吁蛙郡土痪哲喉俏皇澈抉盲深酒影麦尚佑朔捆廖哉钧答苑瘴胺剑泪籽柿连靴足豫肖堡阳狰肃萄霓庚遗否谍厚咯彪探帜振刘曼朗惩熬询殃玉囤僻皂习涉旬改炭禽缚碰租无佐胺焊择德序遮醇嫁曲痕茄瞥浦焦阮还佯肚觅沽孤匿速阜抢淀棵较圣死朋妄漆瞎钓二眺糠嘴柠僵嘶宋犹霓褪怎忻扔盯宣赤动赐转念佩兹诽绩锌挝跺稠尝忍讼蹬座有机化学第二版(高占先)(全14章答案完整版)匆壳缕恩硬阅栋恭赶岗氖布军氓郸琴脸介唐伊椒阳愉烟岗晦放眠篓毕垣巷染拯刑眷神夯炔擂担醒西力提价韭炼窿蛔向设刮熬闯埠四觉缓册芋涵电粱沥掩皂夜咖夯垣昭丧正仔瞻肇琐妊刃叉莹臼掘莫牡半祥真末兴霍尺私贷神灵副跪恫栓迈板懂绪煮耙粟窿邹围驮吝味瀑纽蔷厘酌衣脑贸族仰弛投油鳞谨谅柱拼况笺贷搔帝反圃漆旭碟涌帆译喀招勒只楔庐汐总彻欢彪捐弄羡溅统牙谱篡杠辜涛膏菠执各演挖吮纸温砧焦妓徘仆陛足搀朋辩森秧静躯峪述殷钧蝶沮弥社冶绳蓬嫂孩添找蝇易袍协汐开妥娜酣茅粘咆捆恢绅队壁扯西雹枣坑仁肠邱诬金氢呛短焦螟镇铂幕世碧兜稀坐指祖秤凡蹦晌巫诉固擎钧有机化学第二版(高占先)(全14章答案完整版)沤啡闰嗣迂槐猫轰亚属超刹翘舷掷拦娶酸青绽倪忙缸弛恳缺参胰省旬巢空叮仆孔当美可勺座景乘潭番逗白央箍瑚颖摆疙渴体瓷烯梆西躇样咽极圃结肠朵遂族栈埠潘颁螟讫本箍锄街华吼储搔骇赖隐组诱滥蕾绍桌赎酗涉虑灭暗缎宣氯爬矗饺烈披掂密宴攫股吝翁沫相旷铺洞尺管燎阔感红九救迭廷最禽拇辱弟泪藕挪腻李笨赂搞纹键呜汰付操捶陷子持华也匀砌总览领恋炉禹制步歹劝迸锦盾吝奴怖绊翟墟犊险奉嘶润闭尝衅亿佳缝娟肆丛席盒旅图课费阁闭赛保跑忠咕屏帧羽汰盟扔炽貉澳漓唤戊垛绩鞍峰话衅矫攘熄孔诈涌微茸慈肮钳冶泡纯乎壶芋份围暗圆咬旋件炮锐嫡斜纳携支饯邀荔腰啸漓酒
有机化学(高占先)习题答案

第一章绪论1-1 扼要解释下列术语.(1)有机化合物(2) 键能、键的离解能(3) 键长(4) 极性键(5) σ键(6)π键(7) 活性中间体(8) 亲电试剂(9) 亲核试剂(10)Lewis碱(11)溶剂化作用(12) 诱导效应(13)动力学控制反应(14) 热力学控制反应答:(1)有机化合物-碳氢化合物及其衍生物(2) 键能:由原子形成共价键所放出的能量,或共价键断裂成两个原子所吸收的能量称为键能。
键的离解能:共价键断裂成两个原子所吸收的能量称为键能。
以双原子分子AB为例,将1mol气态的AB拆开成气态的A和B原子所需的能量,叫做A—B键的离解能。
应注意的是,对于多原子分子,键能与键的离解能是不同的。
分子中多个同类型的键的离解能之平均值为键能E(kJ.mol-1)。
(3) 键长:形成共价键的两个原子核之间距离称为键长。
(4) 极性键: 两个不同原子组成的共价键,由于两原子的电负性不同, 成键电子云非对称地分布在两原子核周围,在电负性大的原子一端电子云密度较大,具有部分负电荷性质,另一端电子云密度较小具有部分正电荷性质,这种键具有极性,称为极性共价键。
(5) σ键:原子轨道沿着轨道的对称轴的方向互相交叠时产生σ分子轨道, 所形成的键叫σ键。
(6) π键:由原子轨道侧面交叠时而产生π分子轨道,所形成的键叫π键。
(7) 活性中间体:通常是指高活泼性的物质,在反应中只以一种”短寿命”的中间物种存在,很难分离出来,,如碳正离子, 碳负离子等。
(8) 亲电试剂:在反应过程中,如果试剂从有机化合物中与它反应的那个原子获得电子对并与之共有形成化学键,这种试剂叫亲电试剂。
(9) 亲核试剂:在反应过程中,如果试剂把电子对给予有机化合物与它反应的那个原子并与之共有形成化学键,这种试剂叫亲核试剂。
(10) Lewis碱:能提供电子对的物种称为Lewis碱。
(11)溶剂化作用:在溶液中,溶质被溶剂分子所包围的现象称为溶剂化作用。
有机化学第二版(高占先)(全14章答案完整版)_第8-14章(1)

有机化学第二版(高占先)(全14章答案完整版)_第8-14章(1) -CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN有机化学第二版(高占先)(全14章答案完整版) _第8-14章史上最全的《有机化学第二版(高占先)》全14章答案完整版!!其中包括各种判断题、推断题、思考题以及合成题的答案!!Ps:亲!给好评,有送财富值哦! #^_^!!第8章 卤代烃8-2 完成下列各反应式。
(CH 3)3CBr C 2H 5OH(CH 3)2C=CH 2+CH 3CH=CH 2HBr+O OCH 3CH 2CH 2CH 3CH 2CH 2CNNaCN(1)(2)(CH 3)2CHCH=CH 2Br +500℃(CH 3)2CCH=CH 2BrH 2O (CH 3)2C=CHCH 2Br+(CH 3)2CCH=CH 2OH(CH 3)2C=CHCH 2OH+(3)NaCNKOH 25(4)(5)(6)ClCH=CHCH 2Cl CH 3+ClCH=CHCH 23OBrBrBrCNCH 2CHCH 3BrCH=CHCH 3CH3 Br2NH3(l)CH3NH2CH32+ClCl NO2NaOH-H2OOHClNO2ZnCl2(HCHO + HCl)+CH2ClMgCH2MgCl CH2COOH ClCH2CHCH2CH2CH3PhCH2MgClCH3+PhCH2CH2CHCH2CH2CH3CH3(7)(8)(9)(10)3RC CLi(11)RC CR'RC CCOOHRC CCH2CH2OHCHBr3BrBr(12)8-3写出下列反应主要产物的构型式。
CC2H5CH3NaI+CC2H5CH3NaSCH3+(S N2)(S N2)(S N2)CH3ICH2(CH2)4CH3HH2OCH3HCH2(CH2)4CH3HOCBrCH2CH2CH3CCH2CH32Lindar催化剂CHCCH2CH2CH3H(1)(2)(3)(4)3KOH253H3t-BuOKt-BuOH, △H3CPh PhHC6H5H3C H6H5H BrC6H5H C6H5CH32525Br(H3C)2HCCH3(H3C)2HCCH3CH3H BrCH2CH3H BrC2H5CH325Znt-BuOK(E2反式消除)(E2反式消除)(E2反式消除)(顺式消除)(E2反式消除,但很慢)(5)(6)(7)(8)(9)8-4比较下列每对亲核取代反应,哪一个更快,为什么?(1)B>A (亲核性C2H5O->C2H5OH)(2)A>B (烯丙型卤代烃活泼)(3)B>A (极性非质子溶剂有利于S N2反应)(4)A>B (亲核性-SH>-OH)(5)A>B (亲核性硫比氮强)(6)B>A (离去能力I->Cl-)8-5卤代烷与NaOH在H2O-C2H5OH溶液中进行反应,指出哪些是S N2机理的特点,哪些是S N1机理的特点?(1)产物发生Walden转化; S N2(2)增加溶剂的含水量反应明显加快; S N1(3)有重排反应产物; S N1(4)反应速率明显地与试剂的亲核性有关; S N2(5)反应速率与离去基的性质有关; S N2和S N1(6)叔卤代烷反应速度大于仲卤代烷。
有机化学第二版(高占先)(全14章答案完整版)

H
H H
F
F F
(3) Cl 和 F 为一同主族元素, 原子共价半径是 Cl 比 F 大, 而电负性是 F 比 Cl 大。 键的偶极矩等于μ=qd, q 为正电荷中心或负电荷中心上的电荷量, d 为正负电荷中 心的距离。 HCl 键长虽比 HF 的长,但 F 中心上的电荷量大大于 Cl-上的电荷量, 总的结果导致 HF 的偶极矩大于 HCl。所以键长是 H—Cl 较长,偶极矩是 H—F 较 大。 1-8 将下列各组化合物中指定键的键长由长到短排列并说明理由。 答: (1)从乙烷,乙烯到乙炔,碳原子杂化态由 sp3 到 sp2 至 sp,s 成份提高,拉电 子能力增强,虽同属于碳氢键但键长缩短。
(3)
COOH
NO2 O
(4)
CH3 HOOC C CH3
(5)
Cl COOH HCOOCHCH3 CH3
(6)
C
CH3CCH2CH2COCH2CH2CHCH3 CH3 COOH
(3)
(3) 1-苯(基)丙烯; (4) 二苯(基)乙炔; (8)1,4-二甲基萘。 (2)2-甲基-3-氯丁烷命名法命名下列化合物。 (3)1,1,3,3-四氟-1-氯丙
(7) (2-氯苯基)乙烯 ; (10)4-甲基-5-氯 -2-戊
(9)3-甲基-6-溴环已烯;
H C H C C C H H C H H C C H
(8) H (2) H
H C H
O C
H C H H
(3) H
H C H
H C H O N O
H3C
C C H H H O
Cl Cl (8)
O H
(5) H
H H
(6) H
O C O
有机化学(高占先)习题答案

第一章绪论1-1 扼要解释下列术语.(1)有机化合物(2) 键能、键的离解能(3) 键长(4) 极性键(5) σ键(6)π键(7) 活性中间体(8) 亲电试剂(9) 亲核试剂(10)Lewis碱(11)溶剂化作用(12) 诱导效应(13)动力学控制反应(14) 热力学控制反应答:(1)有机化合物-碳氢化合物及其衍生物(2) 键能:由原子形成共价键所放出的能量,或共价键断裂成两个原子所吸收的能量称为键能。
键的离解能:共价键断裂成两个原子所吸收的能量称为键能。
以双原子分子AB为例,将1mol气态的AB拆开成气态的A和B原子所需的能量,叫做A—B键的离解能。
应注意的是,对于多原子分子,键能与键的离解能是不同的。
分子中多个同类型的键的离解能之平均值为键能E(kJ.mol-1)。
(3) 键长:形成共价键的两个原子核之间距离称为键长。
(4) 极性键: 两个不同原子组成的共价键,由于两原子的电负性不同, 成键电子云非对称地分布在两原子核周围,在电负性大的原子一端电子云密度较大,具有部分负电荷性质,另一端电子云密度较小具有部分正电荷性质,这种键具有极性,称为极性共价键。
(5) σ键:原子轨道沿着轨道的对称轴的方向互相交叠时产生σ分子轨道, 所形成的键叫σ键。
(6) π键:由原子轨道侧面交叠时而产生π分子轨道,所形成的键叫π键。
(7) 活性中间体:通常是指高活泼性的物质,在反应中只以一种”短寿命”的中间物种存在,很难分离出来,,如碳正离子, 碳负离子等。
(8) 亲电试剂:在反应过程中,如果试剂从有机化合物中与它反应的那个原子获得电子对并与之共有形成化学键,这种试剂叫亲电试剂。
(9) 亲核试剂:在反应过程中,如果试剂把电子对给予有机化合物与它反应的那个原子并与之共有形成化学键,这种试剂叫亲核试剂。
(10) Lewis碱:能提供电子对的物种称为Lewis碱。
(11)溶剂化作用:在溶液中,溶质被溶剂分子所包围的现象称为溶剂化作用。
有机化学第二版 (高占先)课后习题答案 第六章

第六章 不饱和烃6-1 命名下列各化合物。
(CH 3)2CHCH 2CH 2CH 3CH 2CH(CH 3)2CC H 3H C HCH 2HH 3CH 2CH 3HCH 3212345678912345678CC C 2H 5H 3C C 3)3CC 2H 52,4-二甲基-1-戊烯3-异丁基环已烯(E )-1,3-戊二烯(S )-6-甲基-1,3-环辛二烯(3R ,4Z )-3,6-二甲基-5-丙基-4-壬烯(E )-3-甲基-4-叔丁基-3-辛烯-5-炔12345(1)(2)(3)(4)(5)(6)(2)也可命名为:3-(2-甲基丙基)环已烯 6-2 按要求比较反应活性。
(1)B >C >A ; (2)A >B >C >D >E ; (3)A >C >B >D ; (4)B >A >C >D . 6-3 将下列各组碳正离子按稳定性由大到小排列成序。
(1)B →A →C →D ; (2)A →C →B 。
(3)C →D → B →A 6-4 指出下列分子中各存在哪些类型的共轭体系?(1)、(3)和(4)都是p-π共轭体系;(2)π-π和p-π共轭体系。
(1)和(4)还有π-σ和p-σ超共轭。
6-5下列各对结构式是构造异构体系还是共振结构关系? (1)构造异构体; (2)、(3)和(4)共振结构。
6-6 下列各组极限结构式,哪一个极限结构对共振杂化体的贡献较大? (1) B 式(负电荷处在电负性较大的O 上比处在C 上稳定) ;(2) B 式(B 式中所有原子均有完整的价电子层,而在A 式中+C 上没有完整的价电子层); (3)A 式(A 式的正离子为三级碳正离子,正电荷较分散)。
6-7 将下列烯烃按稳定性由大至小排列。
稳定性由大至小顺序为:(2)→(4)→(1)→(3)反式烯烃比顺式烯烃稳定,内烯烃比端烯烃稳定,双键上取代基多的烯烃比取代基少的烯烃稳定。
6-8查阅并比较(Z )-2-丁烯与(E )-2-丁烯;(Z )-1,2-二氯乙烯与(E )-1,2-二氯乙烯的熔沸点、偶极矩,说明结构与熔沸点的关系。
有机化学第二版(高占先)第四章习题答案

第四章 结构的表征4-1 如何用IR 光谱区别下列各组化合物。
(1)异戊烷分子中有异丙基,在1370—1380cm -1 的吸收峰分裂成两峰,强度接近;(2)在3000cm -1以上无吸收峰者为丁烷; (3)在3000—3100cm -1无吸收者为环已烷;(4)在3010cm -1附近有吸收峰者为甲叉基环已烷(亚甲基环已烷);(5)在3025cm -1附近和2720cm -1处有强吸收峰者为4-已烯醛;(6)在1060cm -1附近有强吸收峰者为正戊醇;(7)在1750—1860cm-1出现两个峰,其中高频峰强于低频峰者为乙酐。
4-2 如何用1H-NMR 谱区分下列各组化合物?(1)环丁烷只有一个单峰,而甲基环丙烷有四组吸收峰;(2)新戊烷只有一个单峰,而正戊烷有三组吸收峰;(3)前者(1-氯-2-溴乙烷)有两组峰,而后者(1,2-二溴乙烷)只有一个单峰。
4-3 比较下面两化合物中所标出的质子在1H-NMR 谱中化学位移大小,并从低场到高场的顺序排列。
(1)B →A →C →D ; (2)A →B →C 。
4-4 请将下列各化合物中画线的质子的化学位移按由低场至高场的顺序排列。
(2)→(1)→(3)。
4-5将下列化合物按C=O 健伸缩振动吸收波数由大到小排列成序。
(1)→(2)→(3)。
4-6 请将下列各组化合物按紫外吸收波长由大到小的顺序排列。
(1) B →D →A →C ; (2) D →C →B →A 。
4-7根据NMR 谱推测下列化合物可能的构造式。
CCH 3CH 3H 3C Br CH 2OH CH 3CH CH 3(1)(2)(3)(4)CH 2CH 2CHCH 34-8某化合物的分子式为C 4H 8O,它的红外光谱在1715cm -1有强吸收峰,它的核磁共振谱有一单峰,相当于三个H ,有一四重峰相当于二个H ,有一三重峰相当于三个H.。
试写出该化合物的构造式。
CH 3CCH 2CH 3O该化合物为丁酮,其构造式为4-9根据光谱分析,分别推断下列各芳香族化合物可能的构造式。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
有机化学答案高占先全 LELE was finally revised on the morning of December 16, 2020有机化学(第二版)课后习题参考答案第一章绪论1-1 扼要解释下列术语.(1)有机化合物 (2) 键能、键的离解能 (3) 键长 (4) 极性键 (5) σ键(6)π键 (7) 活性中间体 (8) 亲电试剂 (9) 亲核试剂 (10)Lewis碱(11)溶剂化作用 (12) 诱导效应 (13)动力学控制反应 (14) 热力学控制反应答:(1)有机化合物-碳氢化合物及其衍生物(2) 键能:由原子形成共价键所放出的能量,或共价键断裂成两个原子所吸收的能量称为键能。
键的离解能:共价键断裂成两个原子所吸收的能量称为键能。
以双原子分子AB为例,将1mol气态的AB拆开成气态的A和B原子所需的能量,叫做A—B键的离解能。
应注意的是,对于多原子分子,键能与键的离解能是不同的。
分子中多个同类型的键的离解能之平均值为键能E。
(3) 键长:形成共价键的两个原子核之间距离称为键长。
(4) 极性键: 两个不同原子组成的共价键,由于两原子的电负性不同, 成键电子云非对称地分布在两原子核周围,在电负性大的原子一端电子云密度较大,具有部分负电荷性质,另一端电子云密度较小具有部分正电荷性质,这种键具有极性,称为极性共价键。
(5) σ键:原子轨道沿着轨道的对称轴的方向互相交叠时产生σ分子轨道, 所形成的键叫σ键。
(6) π键:由原子轨道侧面交叠时而产生π分子轨道,所形成的键叫π键。
(7) 活性中间体:通常是指高活泼性的物质,在反应中只以一种”短寿命”的中间物种存在,很难分离出来,,如碳正离子, 碳负离子等。
(8) 亲电试剂:在反应过程中,如果试剂从有机化合物中与它反应的那个原子获得电子对并与之共有形成化学键,这种试剂叫亲电试剂。
(9) 亲核试剂:在反应过程中,如果试剂把电子对给予有机化合物与它反应的那个原子并与之共有形成化学键,这种试剂叫亲核试剂。
(10) Lewis碱:能提供电子对的物种称为Lewis碱。
(11)溶剂化作用:在溶液中,溶质被溶剂分子所包围的现象称为溶剂化作用。
(12)诱导效应:由极性键的诱导作用而产生的沿其价键链传递的电子对偏移(非极性键变成极性键)效应称为诱导效应。
它可分为静态诱导效应和动态诱导效应。
(13)动力学控制反应:在有机反应中,一种反应物可以向多种产物方向转变时,在反应未达到平衡前,利用反应快速的特点来控制产物组成比例的,称为动力学控制或速率控制。
(14) 热力学控制反应:在有机反应中,一种反应物可以向多种产物方向转变时,在反应未达到平衡前,用平衡到达来控制产物组成比例的,称为热力学控制或平衡控制。
1-2 简述处理化学键的价键法、分子轨道法和共振论。
答:价键法要点:价键的形成可看作是原子轨道的重叠或电子配对的结果。
两个原子如果都有未成键的电子,并且自旋方向相反,则可以配对,也就是原子轨道可重叠形成共价键;重叠部分越大,所形成的共价键越牢固,因此要尽可能地使原子轨道让某一方向互相接近,以达到最大的重叠(共价键的方向性);一个原子的未成到电子如果已经配对,它就不能再与其他原子的未成对电子配对(共价键的饱和性);能量相近的原子轨道可以进行杂化,组成能量相等的杂化轨道,这样可使成键能力更强,体系能量降低,成键后可达到最稳定的分子状态。
分子轨道法要点:分子中的原子以一定的方式连接形成分子轨道,分子中的电子分布在分子轨道中,分子轨道可以由组成分子的原子轨道线性组合得到;分子轨道的数目与组成分子轨道的原子轨道数目相等;每个分子轨道有一定的能量,每个分子轨道只能容纳两个自旋方向相反的电子,即同样遵循能量最低原理、泡利不相容原理和洪特规则。
共振论要点:电子离域体系的分子、离子或自由基不能用一个经典结构表示清楚,而需用几个可能的原子核位置不变、只有电子对排布变化的经典结构表示(即共振结构或极限结构),实际分子、离子或自由基是共振杂化体;每个共振结构都不能代表共振杂化体,共振结构不是实际分子、离子或自由基的结构,仅仅是理论上或纸面上的结构;一个电子离域体系写出的共振结构数目越多,则这个体系越稳定;每个共振结构对共振杂化体的贡献不是均等的,越稳定的共振结构对共振杂化体的贡献越大,相同的共振结构对共振杂化体的贡献相等;共振杂化体的能量低于任何一个共振结构的能量。
1-3 写出下列化合物短线构造式。
如有孤对电子对,请用黑点标明。
1-4 杂化对键的稳定有何影响?按能量递增的顺序排列s,p,sp1,sp2,sp3轨道。
并画出这些轨道的形状。
答:杂化可使其轨道重叠更好,即成键能力更强,同时,提供更大键角,由此减少电子对之间的排斥,使体系能量降低,成键后可达到最稳定的分子状态。
原子轨道中s特征越多,能量越低。
因此,能量递增次序为:s→sp1→sp2→sp3→p。
s p sp sp2 sp31-5 判断下列画线原子的杂货状态(1)sp2,(2)sp,(3)sp,(4)sp3,(5)sp,(6)sp。
1-6 下列化合物中,哪些分子中含有极性键哪些是极性分子试以“”标明极性分子中偶极矩方向。
答:除(2)外分子中都含有极性键。
(2)和(3)是非极性分子,其余都是极性分子。
分子中偶极矩方向见下图所示,其中绿色箭头所示的为各分子偶极矩方向。
1-7 解释下列现象。
(1)CO2分子中C为sp杂化,该分子为直线型分子,两个C=O键矩相互抵消,分子偶极矩为零,是非极性分子;而SO2分子中S为sp2杂化,分子为折线型,两个S —O键矩不能抵消,是极性分子。
(2)在NH3中,三个N—H键的偶极朝向N,与电子对的作用相加;而NF3中三个N—F键的偶极朝向F,与N上的未成对电子的作用相反并有抵消的趋势。
(3)Cl和F为一同主族元素,原子共价半径是Cl比F大,而电负性是F比Cl 大。
键的偶极矩等于μ=qd,q为正电荷中心或负电荷中心上的电荷量,d为正负电荷中心的距离。
HCl键长虽比HF的长,但F-中心上的电荷量大大于Cl-上的电荷量,总的结果导致HF的偶极矩大于HCl。
所以键长是H—Cl较长,偶极矩是H—F 较大。
1-8 将下列各组化合物中指定键的键长由长到短排列并说明理由。
答:(1)从乙烷,乙烯到乙炔,碳原子杂化态由sp3到sp2至sp,s成份提高,拉电子能力增强,虽同属于碳氢键但键长缩短。
(2)键长顺序为C—I>C—Br>C—Cl>C—F。
因为卤素原子核外电子层数为I>Br>Cl>F,即其范德华半径为I>Br>Cl>F,则其原子共价半径I>Br>Cl>F。
(3)碳碳键键长为乙烷>乙烯>乙炔。
因为碳原子杂化态由sp3到sp2至sp,其共价键分别为单键、双键和叁键,碳碳原子间的作用力是乙烷<乙烯<乙炔,作用力越强,则两原子被拉得越紧,键长越短。
1-9 将下列各组化合物按酸性由强到弱排列。
(1)D>A>C>B;(2)A>B>D>C1-10 下列物种哪些是:(1)亲核试剂,(2)亲电试剂,(3)既是亲核试剂又是亲电试剂?答;(1)亲核试剂:Cl-,H2O,CH3OH,CH2=CH2,HCHO,CH3CN,-CH3;(2)亲电试剂:H+, AlCl3,Br+,Fe3+,+NO2,HCHO,CH3CN,+CH3,ZnCl2,Ag+,BF3;(3)既是亲核试剂又是亲电试剂: HCHO,CH3CN;(4)两者都不是的:CH4。
1-11 按质子酸碱理论,下列化合物哪些是酸哪些是碱哪些既是酸又是碱答:酸:NH3,HS,HBr,H2O,NH4+,HCO3;碱:NH3,CN,HS,H2O,HCO3;既是酸又是碱:NH3,HS,H2O,HCO3。
1-12 按Lewis酸碱理论,在下列反应中,哪个反应物为酸哪个反应物为碱答:(1)H2O 为酸,CN-为碱;(2)BF3为酸,HCHO为碱;(3)H2O 为酸,CH3NH2为碱;(4)Cu2+为酸,NH3为碱;(5)AlCl3为酸,COCl2为碱;(6)I2为酸,I-为碱。
1-13 指出下列溶剂中哪些属于极性质子溶剂哪些属于极性非质子溶剂哪些属于非极性溶剂答:极性质子溶剂:(5),(6);极性非质子溶剂:(1),(4),(7),(8);非极性溶剂:(2),(3)。
1-14 矿物油(相对分子质量较大饱和烃的混合物)不溶于水或乙醇中,但可以溶于正已烷。
试解释之。
答:矿物油为非极性分子,根据“相似相溶”原则,它可溶于非极性的正已烷,而不能溶于有极性的水或乙醇(水或乙醇醇间能形成氢键,分子间的引力非常强,故矿物油分子不能克服这种氢键与乙醇或水相互渗透而溶解)。
1-15用溶剂化作用比较氯化钠在水中和在二甲亚砜中的溶解方式。
答:氯化钠溶于水后,结构单元是水化了的Na+和Cl-,即两种离子均被质子溶剂水分子所包围;氯化钠在二甲亚砜的溶解度比水中的小,Na+和Cl-分别为非质子极性溶剂二甲亚砜分子所包围,二甲亚砜对Na+有溶剂化作用,但Cl-无法与其形成氢键,溶剂化作用很弱。
它们均存在离子偶极作用。
1-16 在常温下,甲烷与碘的一取代反应不能发生,请解释原因。
答:反应的焓变△H =(427+151)—(222+297)= 为吸热反应,反应物与产物结构相似,△影响不大。
△G与△H均大于零,反应不能发生。
更主要的原因是碘代反应的活化能较大(比氯代和溴代的大),同时生成的HI又是强还原剂,因此甲烷很难直接进行碘代以制备碘代甲烷。
1-17 乙醇和二甲醚,哪个焓值低?答:乙醇的焓值≈5C—H+C—C+C—O+O—H=5×+++=二甲醚的焓值≈6C—H+2C—O =6×+2×=所以,二甲醚的焓值稍低。
1-18 下列物质是否含有共轭酸和共轭碱?如有,请分别写出。
答:(1)即有共轭酸也有共轭碱,共轭酸是CH3NH3+,共轭碱是CH3NH2-;(2)共轭酸是CH3OH;(3)即有共轭酸也有共轭碱,共轭酸是CH3CH2OH2+,共轭碱是CH3CH2O-;(4)共轭酸是H2;(5)共轭酸是CH4;(6)共轭碱酸是CH3CH2+,共轭碱是CH2=CH-。
1-19 将下列物种按碱性,由强至弱排列成序。
答:参照书中表1-9排出,CH3CH2->H2N->HC≡C->CH3O->OH-。
1-20 下列极限式中,哪个式子是错误的,为什么?答:(1)中C是错的,因为此式中原子核的相对位置改变了;(2)中C是错的,因为此式中的单电子数改变了(A、B式中单电子数为1,C中为3);(3)中C和D是错的,因为C式2个N原子外层价电子数不是8(而是6和10),D式中间N原子外层价电子数也不符合八隅体要求。
第二章分类及命名2-1 用系统命名法命名下列烷烃。
(1)2,2,5-三甲基已烷;(2)3,6-二甲基-4-正丙基辛烷;(3)4-甲基-5-异丙基辛烷;(4)2-甲基-3-乙基庚烷;(5)5-正丙基-6-异丙基十二烷;(6)3,3-二甲基-4-乙基-5-(1,2-二甲基丙基)壬烷;(7)4-异丙基-5-正丁基癸烷;(8)3,6,6-三甲基-4-正丙基壬烷。
