非小细胞肺癌常见的驱动基因突变类型
a549细胞系中突变基因的具体氨基酸位点

a549细胞系中突变基因的具体氨基酸位点a549细胞系是一种人类非小细胞肺癌细胞系,通常被用于肺癌相关研究。
在肺癌的发展过程中,突变基因起着重要作用。
本文将针对a549细胞系中突变基因的具体氨基酸位点进行详细的介绍。
1、TP53基因:TP53基因是最为常见的肿瘤抑制基因之一,该基因在肺癌发生和发展中起着关键作用。
在a549细胞系中,TP53基因的突变非常普遍,其中最为常见的位点为第175位的氨基酸。
该位点的突变常使TP53基因的功能受损,导致细胞无法有效抵抗恶性转化。
2、KRAS基因:KRAS基因属于RAS基因家族,其突变在多种肿瘤中都非常常见,特别是肺癌。
在a549细胞系中,KRAS基因的突变频率也较高,其中最为常见的位点为第12和第61位的氨基酸。
这些突变导致了KRAS蛋白的功能改变,进而促进了肿瘤的增殖和侵袭能力。
3、EGFR基因:EGFR是上皮生长因子受体的缩写,EGFR基因突变与肺癌患者中EGFR-TKI治疗的敏感性关联密切。
在a549细胞系中,EGFR基因突变的位点涉及到第858位(L858R)和第exon21缺失(del19)等。
这些突变会导致EGFR信号通路的过度激活,进而促进肿瘤细胞的增殖和生存。
4、BRAF基因:BRAF基因是RAS-RAF-MEK-ERK信号通路中的一个重要组成部分,该信号通路在肿瘤的发生和发展中起着关键作用。
在a549细胞系中,BRAF基因的突变频率较低,主要位点为第600位(V600E),这一突变导致了BRAF蛋白的高度激活,进而促进细胞增殖和转移的能力。
5、MET基因:MET基因编码了一种受体酪氨酸激酶,其与肺癌的发生和预后密切相关。
在a549细胞系中,MET基因的突变频率较低,主要位点为第1604位的氨基酸。
这些突变导致MET蛋白功能的改变,使肿瘤细胞具有较强的生存和转移能力。
除了上述基因外,还有一些其他基因在a549细胞系的突变中也与肺癌的发生和发展有关,如PTEN、STK11等。
最新:晚期驱动基因阳性非小细胞肺癌免疫治疗专家共识(全文)

最新:晚期驱动基因阳性非小细胞肺癌免疫治疗专家共识(全文)一、EGFR突变EGFR基因突变是非鳞状NSC1C最常见的突变类型之一,EGFR突变阳性率在高加索人群中约为10%,在东亚人群中约为50%o对于伴有EGFR敏感突变的晚期NSC1C患者,一线标准治疗方案为EGFRTKIs,包括第一代EGFRTKIs(吉非替尼、厄洛替尼和埃克替尼\第二代EGFRTKIs(阿法替尼和达可替尼)和第三代EGFRTKIs(奥希替尼、阿美替尼和伏美替尼入研究证实,与传统化疗相比,EGFRTKIs显著改善了ORR和PFS o但随着治疗的推进,不可避免的面临耐药问题。
免疫治疗可以通过激活免疫系统发挥肿瘤杀伤作用,并可获得持续的疾病控制。
共识意见1不推荐ICIs用于晚期初治EGFR敏感突变NSC1C患者(推荐程度:一致不推荐IEGFR突变与肿瘤免疫原性低及非炎症性微环境有关,且早期临床研究表明,IQs单药或ICIs联合化疗治疗初治EGFR敏感突变患者疗效远不及标准EGFRTKIs靶向治疗,然而,在EGFRTKIs基础上联合ICIs的疗效提升有限,且存在较大安全性风险。
共识意见2推荐耐药的EGFR突变患者再次活检,同时检测肿瘤耐药基因和免疫微环境相关的生物标志物(推荐程度:一致推荐工基于EGFRTKIs治疗会影响肿瘤特征和及肿瘤微环境(TME),建议条件允许的情况下应再次活检,为后续精准治疗提供依据。
检测标本优选肿瘤组织,组织标本无法获得时可以采用其他类型标本替代;检测范围优选高通量检测以获得全面的耐药信息,包括肿瘤相关和免疫微环境相关的生物标志物。
共识意见3对于EGFRTKIs耐药后发生广泛进展的患者,且在缺乏有效靶向治疗的情况下,推荐使用ICIs(推荐程度:一致推荐\对于ICIS的方案选择,应结合患者的体能状态和疾病进展情况进行综合判断,其中IC1s+化疗+抗血管治疗方案的临床证据较为丰富(推荐程度:强推荐);IQs+含粕化疗方案在多项早期研究中均显示良好的治疗活性,且耐受性方面ICIs+含粕化疗方案较ICIs+含粕化疗+抗血管联合方案具有一定优势(推荐程度:强推荐);ICIs联合抗血管治疗(推荐程度:弱推荐)的证据主要针对多线耐药的患者或体力状况较差不耐受高强度治疗的患者,疗效获益有限。
非小细胞肺癌间质上皮细胞转化因子14外显子跳跃突变的研究进展

非小细胞肺癌间质上皮细胞转化因子14外显子跳跃突变的研
究进展
刘艳萍;罗敏
【期刊名称】《临床医药实践》
【年(卷),期】2024(33)1
【摘要】近年来,随着肿瘤分子生物学研究的不断深入,以表皮生长因子受体为首的分子靶向治疗开启了晚期非小细胞肺癌(NSCLC)治疗的新篇章,患者总生存期(OS)得到显著延长。
间质上皮细胞转化因子(MET)14外显子跳跃突变作为非小细胞肺癌的潜在驱动基因引起人们的关注,MET 14外显子跳跃突变是NSCLC患者治疗的新靶点之一^([1])。
目前已有多种MET-络氨酸激酶抑制剂(TKIs)正在进行临床研究,包括克唑替尼、卡马替尼、替泊替尼、赛沃替尼和谷美替尼等。
本文讨论非小细胞肺癌的MET 14外显子跳跃突变的分子生物学、治疗方法及其发展中遇到的各种挑战。
【总页数】5页(P61-65)
【作者】刘艳萍;罗敏
【作者单位】南宁市第二人民医院
【正文语种】中文
【中图分类】R73
【相关文献】
1.MET14外显子跳跃突变在非小细胞肺癌中的研究进展
2.间质上皮细胞转化因子扩增非小细胞肺癌患者的临床病理特征与预后分析
3.表皮生长因子受体20外显子插入突变的非小细胞肺癌靶向治疗研究进展
4.真实世界中MET14外显子跳跃突变晚期非小细胞肺癌的疗效分析
5.晚期非小细胞肺癌MET 14外显子跳跃突变的治疗新进展
因版权原因,仅展示原文概要,查看原文内容请购买。
非小细胞肺癌中KRAS基因突变与PD-1

㊃综 述㊃非小细胞肺癌中K R A S 基因突变与P D -1/P D -L 1信号通路相关性的研究进展柴荣1 范银星1 赵家义1 周慈航2 韩一平11海军军医大学附属长海医院呼吸与危重症医学科,上海274300;2海军军医大学附属长海医院全科教研室,上海274300通信作者:韩一平,E m a i l y ph a n 2006@163 c o m ʌ摘要ɔ 鼠类肉瘤病毒癌基因(K R A S )是非小细胞肺癌(N S C L C )中最常见的基因突变之一,且针对K R A S 突变N S C L C 的治疗手段有限,提示酪氨酸激酶抑制剂靶向药物初始耐药㊂P D -1及其配体信号通路可诱导肿瘤细胞免疫逃逸,在肿瘤的发生㊁发展过程中发挥着重要作用㊂新近发现抗P D -1/P D -L 1抑制剂可能为K R A S 突变N S C L C 的治疗提供新的选择和应用前景,本文将对其两者间的关系关系及调控机制进行综述㊂ʌ关键词ɔ 癌,非小细胞肺;免疫疗法;R A S 基因突变;程序性死亡受体1;程序性死亡受体1配体D O I 10 3760 c m a ji s s n 1673-436X 2019 23 013A d v a n c e s o f t h e r e l a t i o n s h i p b e t w e e nP D -1 P D -L 1p a t h w a y a n dK R A S g e n em u t a t i o n i nn o n -s m a l l c e l l l u n g ca n c e r C h a iR o n g 1 F a nY i n x i n g 1 Z h a oJ i a y i 1 Z h o uC i h a n g 2 H a nY i p i n g 11D e p a r t m e n t o f R e s p i r a t o r y M e d i c i n e S h a n g h a iC h a n g h a i H o s p i t a l S e c o n d M i l i t a r y Me d i c a l U n i v e r s i t y S h a n g h a i 274300 C h i n a 2D e p a r t m e n t of G e n e r a l P r a c t i c e S h a ngh ai C h a n gh a i H o s p i t a l S e c o n d M i l i t a r y M e d i c a lU n i v e r s i t y S h a n g h a i 274300 C h i n a C o r r e s p o n d i n g a u t h o r H a nY i p i n g E m a i l y ph a n 2006@163 c o m ʌA b s t r a c t ɔ K i r s t e nr a ts a r c o m av i r a lo n c o ge n e K R A S i so n eof t h e m o s tc o mm o ng e n e m u t a t i o n s i nn o n -s m a l l c e l l l u n g ca n c e r N S C L C a n dt h e t r e a t m e n to fK R A S m u t a n tN S C L Ci s l i m i t e da n do r i g i n a l r e s i s t a n c eo f t y r o s i n ek i n a s e i n h ib i t o r s P r o g r a mm e dd e a t h1 P D -1 a n di t s l i g a n d s s i g n a l i n gp a t h w a yc a n i nd u ce t h e i mm u n e e s c a p eof t u m o r c e l l s a n d p l a y a nc r i t i c a l r o l e i n t u m o r ig e n e s i s a n d p r o g r e s s i o n R e c e n t l y i th a sb e e n r e p o r t e d t h a t a n ti -P D -1o r a n t i -P D -1i n h i b i t o r s m a yp r o v i d en e w o p t i o n sa n da p p l i c a t i o n p r o s p e c t sf o rt h et r e a t m e n to fK R A S -m u t a t e d N S C L C p a t i e n t s T h i s a r t i c l e s u p p o s e d t o r e v i e wt h e c u r r e n t r e s e a r c ho n t h e r e l a t i o n s h i p b e t w e e nP D -1 P D -L 1p a t h w a y a n dK R A S g e n em u t a t i o na n d t h e i r r e g u l a t o r y m e c h a n i s m s ʌK e y wo r d s ɔ C a r c i n o m a n o n -s m a l l -c e l l l u n g I mm u n o t h e r a p y R A S g e n e m u t a t i o n P r o g r a mm e dd e a t h1 P r o g r a mm e dd e a t h l i ga n d1D O I 10 3760 c m a j i s s n 1673-436X 2019 23 013鼠类肉瘤病毒癌基因(K i r s t e n r a t s a r c o m av i r a l o n c o g e n e ,K R A S )是原癌基因R A S 家族的成员之一,为肺癌R A S /R A F /M E K /MA P K 信号通路中最常见的突变,是表皮生长因子受体(e p i d e r m a l g r o w t h f a c t o r r e c e pt o rm u t a t i o n ,E G F R )信号通路下游的重要调节位点,参与细胞生长增殖与分化的调节,其主要突变位点位于12㊁13和61外显子[1]㊂K R A S 突变在西方国家肺腺癌中发生率大约为20%~25%,在亚洲人群中约为10%~15%,是最常见的非小细胞肺癌(n o n -s m a l lc e l ll u n gc a n c e r ,N S C L C )驱动基因突变之一㊂研究业已表明K R A S 突变提示患者预后差,化疗效果不理想[2-3]㊂S h e ph e r d 等[4]发现K R A S 突变与其他突变如E G F R 和间变性淋巴瘤激酶突变相互排斥,应用E G F R 和间变性淋巴瘤激酶酪氨酸激酶抑制剂治疗效果不理想和原发耐药[5]㊂K R A S 突变N S C L C 迫切需要新的更高效持久的治疗方法出现㊂㊃2281㊃国际呼吸杂志2019年12月第39卷第23期 I n t JR e s pi r ,D e c e m b e r 2019,V o l .39,N o .23Copyright ©博看网. All Rights Reserved.程序性死亡受体-1(p r o g r a mm e dd e a t h1,P D-1)是免疫球蛋白超家族的Ⅰ型跨膜蛋白,由胞外N-末端I g V样结构域,跨膜结构域和参与抑制信号传递的细胞质尾组成[5]㊂P D-1的配体包括程序性死亡配体1(p r o g r a mm e dd e a t h l i g a n d,P D-L1)和P D-L2,二者均属于B7家族[6]㊂肿瘤细胞内P D-L1/P D-L2的激活能够下调肿瘤微环境中效应T 细胞表面P D-1的表达水平[7],从而抑制T细胞对肿瘤的免疫应答和诱导免疫逃逸㊂阻滞P D-1/P D-L1免疫检查点的单克隆抗体抑制剂可以恢复效应T细胞的功能,促进T 细胞介导的肿瘤细胞杀伤效应[8],为晚期/转移性N S C L C 的治疗提供了新的选择㊂但是,在接受免疫治疗的N S C L C 患者中仅观察到10%~20%的客观缓解率[9],需要更特异预测性生物标志物指导接受P D-1/P D-L1免疫检查点抑制剂治疗最大获益人群的选择㊂研究表明K R A S基因突变与N S C L C内P D-1/P D-L1的表达水平以及抗P D-1/P D-L1免疫治疗的效果具有相关性,这提示阻断P D-1/P D-L1信号通路可能是治疗K R A S 突变N S C L C的新选择[10]㊂1K R A S与P D-1及其配体的生物学特性11 K R A S的生物学特性 K R A S基因与H R A S㊁N R A S 病毒致癌基因均属R A S基因家族,主要编码鸟苷三磷酸(g u a n o s i n e t r i p h o s p h a t e,G T P)结合蛋白,与G T P结合激活R A S信号通路,与鸟苷二磷酸(g u a n o s i n ed i p h o s p h a t e, G D P)结合后失活,在调节正常细胞增殖和细胞信号传导方面发挥着重要作用[11-12]㊂这一过程主要由G T P-G D P转换因子及G T P激活蛋白调控㊂G T P-G D P转换因子促进R A S释放G D P,与G T P结合激活R A S蛋白及其下游信号通路㊂G T P激活蛋白提高G T P酶的活性,R A S迅速转变为G D P结合的失活状态,正常细胞中G D P与G T P的比值维持着R A S信号通路的功能[13-14]㊂R A S突变可削弱G T P 酶的活性,引起细胞内R A S癌蛋白的持续级联激活,导致细胞的失控性增殖与非正常细胞的存活,超过20%的肿瘤中存在R A S驱动基因突变[15]㊂与其他肺癌驱动基因不同,K R A S突变在吸烟患者尤其是重度吸烟患者中的发生概率较高,且在吸烟与非吸烟患者中K R A S突变状态不同㊂非吸烟患者中多发生颠换突变(G>A),在既往吸烟或正在吸烟患者中转换突变(G> C或G>T)更常见[16-17]㊂另外,与非吸烟患者相比,吸烟患者中K R A S突变状态也更为复杂,更易出现驱动基因共突变,更高水平的肿瘤突变负荷,瘤内更大量淋巴细胞浸润,这使得应用抗P D-1或P D-L1抑制剂治疗K R A S突变N S C L C成为可能[17]㊂12 P D-1及其配体的生物学特性 P D-1表达于活化的T 细胞㊁B细胞㊁自然杀伤细胞等多种细胞中,参与抗病毒感染的免疫细胞表达其配体P D-L1和P D-L2㊂P D-L1和P D-L2的编码基因均位于9号染色体(9p241),但二者具有不同的转录调节方式和表达模式㊂P D-L1主要由T h1细胞释放的细胞因子γ-干扰素诱导产生,而P D-L2的转录受到I L4/I L13/S T A T6信号通路和T h2释放的细胞因子的调节,并且P D-L2在T h2介导的免疫应答反应中发挥重要的调节作用,可诱导肿瘤细胞免疫逃逸[18-19]㊂P D-L1是P D-1的主要配体,主要表达于造血干细胞来源的T细胞,B细胞,树突状细胞,巨噬细胞,肥大细胞和非造血干细胞来源的内皮㊁表皮细胞[20]㊂P D-1与P D-L1相互作用抑制T 细胞转录因子G A T A-3和T-b e t的表达,以及C D8+细胞毒性T淋巴细胞的生长㊁增殖,从而诱导肿瘤浸润T细胞的凋亡[21-22]㊂J i a n g等[23]发现P D-L1阳性肿瘤细胞和P D-L1/C D8双阳性淋巴细胞共同定位于肿瘤团块中央时,采用P D-1/P D-L1抑制剂治疗可达最大肿瘤杀伤效应㊂2K R A S基因突变与P D-1及其配体的关系21 K R A S突变与P D-1及其配体相关性的研究 C a l l e s 等[8]通过免疫组织化学对114例K R A S突变N S C L C患者(84例吸烟,30例非吸烟)肿瘤细胞P D-L1/P D-L2和肿瘤浸润淋巴细胞P D-1的表达水平进行检测,发现K R A S突变N S C L C患者体内P D-1/P D-L1/P D-L2的表达水平具有异质性㊂与肺腺癌P D-L1表达阳性率达50%相比,K R A S 突变肺腺癌患者的P D-L1阳性表达率较低为24%,尚未确定P D-L1/2的表达水平与K R A S突变具有相关性㊂有学者发现P D-1阳性率与K R A S突变具有显著相关性[24]㊂在一项对43例肺肉瘤样癌手术切除标本的研究中显示肿瘤突变负荷与P D-L1的表达水平明显相关,73%的P D-L1阳性肺肉瘤样癌标本存在K R A S突变,K R A S突变是影响瘤内P D-L1表达水平的主要因素之一[25]㊂C h e n 等[10]的一项研究提示肺腺癌K R A S过表达可以上调P D-L1水平,与肺腺癌细胞系和组织中的K R A S突变呈正相关㊂一项m e t a分析显示K R A S突变型肿瘤比K R A S野生型肿瘤P D-L1表达的阳性率更高(51%比36%)[26]㊂F u k u d a 等[27]发现K R A S和T P53共突变肺腺癌中P D-L1的表达水平更高,这与D o n g等[28]的研究结果一致㊂而J i等[9]认为K R A S突变与肺腺癌肿瘤细胞内P D-L1的表达水平呈负相关㊂迄今,关于K R A S突变状态与P D-1及其配体相关性的研究结论各异㊂这可能与P D-L1的检测试剂㊁P D-1及其配体阳性表达界值标准㊁标本数量及部位㊁患者临床病理学特征不同以及人口统计学基线不均衡有关㊂其二者关系仍需统一的标准和大样本的数据进一步明确㊂22 K R A S突变与P D-1/P L-1相关性机制的研究221 K R A S上调P D-L1及肿瘤浸润淋巴细胞水平C o e l h o等[29]利用E R-R A S G12V融合共建细胞系证实了癌基因R A S的信号传导可上调内源性P D-L1表达水平㊂通过分析R A S激活后的抗原加工和抗原呈递过程发现K R A S G12V突变信号的传导可显著降低T A P1㊁T A P B P㊁H L A-A㊁H L A-B㊁H L A-C和B2M的表达水平,说明抗原加工和呈递过程的破坏以及P D-L1水平的升高共同增强了R A S突变肿瘤细胞的免疫耐受状态㊂与此同时,B u s c h 等[30]观察到K R A S G12D突变肺癌小鼠模型中C D8+T细胞明显扩增,在人N S C L C瘤内K R A S突变与更高水平的C D8+T细胞浸润相关㊂且R A S突变在肿瘤发生早期就可㊃3281㊃国际呼吸杂志2019年12月第39卷第23期I n t JR e s p i r,D e c e m b e r2019,V o l.39,N o.23Copyright©博看网. All Rights Reserved.存在,K R A S突变可形成肿瘤新抗原,诱导激发细胞毒性T淋巴细胞的杀伤肿瘤作用[31]㊂多项研究显示P D-L1的表达水平与吸烟史㊁高水平的T I L s呈正相关[8,32],这可能与吸烟诱导的大量非同义突变使T I L s增多,释放γ-干扰素上调肿瘤细胞表面P D-L1表达水平有关[33]㊂晚近,一项关于K R A S突变肺腺癌的临床病理学特征分析显示突变组患者瘤内P D-L1㊁T细胞免疫球蛋白粘蛋白家族成员3㊁吲哚胺2,3-二氧合酶-1等炎症相关因子在炎症细胞中的表达水平均高于野生型组[34]㊂综上,K R A S突变N S C L C患者应用抗P D-1/P D-L1抑制剂可能出现更高的反应率㊂222 K R A S共突变状态影响肿瘤免疫特征 S k o u l i d i s 等[35]将K R A S突变肺腺癌分为3个主要共突变亚组, S T K11/L K B1(K L亚组)㊁T P53(K P亚组)㊁C D K N2A/B (K C亚组),具有不同的生物学特性与治疗反应㊂S T K11/ L K B1是应用P D-1/P D-L1抑制剂治疗效果的负性预测㊂因子在小鼠K R A S突变N S C L C模型中发现S T K11缺失后招募中性粒细胞释放肿瘤促进促炎细胞因子的产生,导致T 细胞排斥[36];上调H I F1-α与核转录因子的表达水平调节代谢与抗氧化反应,形成葡萄糖耗竭肿瘤微环境,抑制T 细胞活性[35-37]㊂而且,高代谢状态可促进D N A高甲基化使干扰素依赖基因表达沉默,形成免疫惰性肿瘤微环境,是K R A S突变N S C L C患者免疫治疗原发耐药的重要机制[38]㊂研究发现K P亚组具有更高水平的体细胞突变负荷,炎症标志物和免疫检查点效应分子的表达,是采用P D-1/ P D-L1抑制剂治疗的正性预测因子[35]㊂M i u r a和S w n a g a[39]阐述了T P53基因突变对K R A S突变N S C L C肿瘤免疫微环境的影响主要体现在以下3个方面:(1)T P53/ K R A S共突变时可提高肿瘤突变负荷水平,其P D-L1的表达水平最高,瘤内共表达P D-L1与浸润C D8+T细胞的比例也最高,相应的淋巴细胞活化3等非P D-L1免疫检查点效应分子的表达水平减低;(2)K R A S突变可导致多种D N A修复缺陷,其中包括错配修复基因突变㊂有学者利用生物信息技术分析,发现错配修复突变与P D-1/P D-L1抑制剂治疗效果呈正相关性[40]㊂(3)T P53突变增加了与D N A校对外切酶活性破坏相关基因P O L E的突变频率,导致更高的肿瘤突变负荷水平㊂T P53/K R A S共突变N S C L C 患者在应用免疫检查点抑制剂(i mm u n e c h e c k p o i n t b l o c k e r,I C B)治疗中获益更显著[28]㊂223 R A S调节P D-L1表达的信号通路 R A S通过抑制锌指蛋白36结合A U富集元件,减少P D-L1m R N A的降解,从而增强P D-L1m R N A的稳定性,上调肿瘤细胞内P D-L1的表达水平㊂锌指蛋白36通过A U元件结合位于P D-L1m R N A上的3'U T R,使得P D-L1m R N A降解,负向调节P D-L1的表达㊂该研究还揭示了R A S基因突变可能通过R A S/M E K/R O S/p38/MK2(MA P K A P K2)这一信号通路抑制T T P活性,诱导P D-L1表达㊂应用M E K抑制剂可降低P D-L1m R N A的稳定性,同时提高T T P的表达水平和减少其磷酸化,逆转R A S持续激活所致的P D-L1表达增加㊂C h e n等[10]利用K R A S突变细胞系H358 (G12C)发现,K R A S基因过表达通过p-E R K而非p-A K T 信号通路上调肿瘤细胞内P D-L1表达水平,诱导C D3+T 细胞凋亡,导致肺腺癌肿瘤细胞的免疫逃逸㊂应用P e m b r o l i z u m a b或E R K抑制剂可恢复T细胞的抗肿瘤免疫能力,降低K R A S突变N S C L C细胞的存活率㊂研究发现K R A S突变N S C L C瘤内P D-L1/P D-L2的表达水平也具有异质性[27]㊂与T P53基因突变的肿瘤具有较高的炎症标记物和免疫检查点效应分子水平不同,存在S T K11/L K B1改变的K R A S突变肿瘤内表达较低水平的免疫标记物包括P D-L1㊂研究显示无L K B1突变时,P D-L1/ P D-L2的表达频率更高,P D-1配体的表达可能需要完整的L K B1/AM P K信号传导通路[8]㊂但编码P D-L1的C D274 m R N A表达水平在K R A S突变的N S C L C细胞系中差异较大,意味着还存在其他机制调控着不同K R A S突变状态N S C L C中P D-L1的表达㊂3K R A S基因突变与抗P D-1/P D-L1抗体治疗效果的关系一项Ⅰ期临床试验中发现,21例K R A S突变患者中1例A v e l u m a b治疗有效,E G F R和间变性淋巴瘤激酶突变患者中未发现有反应者[41]㊂N i v o l u m a b与多西他赛的Ⅲ期临床试验中也提示K R A S突变肺腺癌患者可能从I C B治疗中受益[42]㊂D a v a r等[43]报道了一例全身多处转移晚期K R A S突变肺腺癌患者应用N i v o l u m a b单药获得完全缓解的案例㊂一项荟萃分析研究纳入了C h e c k m a t e057㊁O A K㊁P O P L A R三项临床试验中519例明确K R A S突变状态的患者表明,与二线接受多西他赛治疗相比,K R A S突变N S C L C患者应用I C B治疗可延长患者总生存期,而在K R A S野生型患者中未表现出此种生存优势㊂但该研究中不同K R A S突变状态患者应用免疫检查点抑制剂的治疗效果无统计学差异,尚不足以推荐K R A S突变作为I C B治疗效果的预测标志物[44]㊂新近,P a s s i g l i a等[45]进行了一项K R A S突变N S C L C患者多线应用N i v o l u m a b治疗的真实世界研究㊂这是目前针对K R A S突变在晚期非鳞状N S C L C 患者接受N i v o l u m a b治疗评估其预测作用的一项最大研究,共纳入206例K R A S突变型患者及324例K R A S野生型患者,2组患者的疾病客观缓解率㊁疾病控制率㊁中位无进展生存期㊁中位总生存期均未显示出明显差异,且K R A S 突变可能与免疫治疗不良反应的发生率呈正相关㊂由此推测K R A S突变状态并不是N i v o l u m b治疗效果的可靠的预测指标㊂目前,针对K R A S突变N S C L C这一特定亚群接受抗P D-1/P D-L1治疗的研究相对较少,存在患者的基线临床特征不平衡㊁不同的I C B治疗方案等问题,K R A S突变对I C B治疗效果的预测作用仍需在临床研究中进一步探索㊂4展望越来越多的证据表明,单一的生物标志物可能无法完全预测免疫治疗的临床反应情况㊂分析不同基因突变类型与肿瘤免疫微环境的相互作用机理在提高靶向治疗联合免疫治疗的临床效果以及免疫治疗最大获益人群的选择方面㊃4281㊃国际呼吸杂志2019年12月第39卷第23期I n t JR e s p i r,D e c e m b e r2019,V o l.39,N o.23Copyright©博看网. All Rights Reserved.具有重要意义和广阔前景㊂K R A S突变N S C L C具有生物学异质性,新型治疗策略的开发存在许多挑战,免疫治疗可能是K R A S突变型N S C L C最有前景的新疗法之一㊂未来仍需进一步阐述K R A S突变在P D-1/P D-L1信号通路的作用,以及更大样本的临床数据探索免疫治疗在K R A S突变N S C L C患者中的应用前景㊂利益冲突所有作者均声明不存在利益冲突参考文献1 Y u C C Q i u W J u a n g C S e t a l M u t a n t a l l e l e s p e c i f i ci m b a l a n c e i n o n c o g e n e s w i t h c o p y n u m b e r a l t e r a t i o n sO c c u r r e n c e m e c h a n i s m s a n d p o t e n t i a lc l i n i c a li m p l i c a t i o n sJ C a n c e rL e t t201738486-93D O I101016j c a n l e t2016100132 M a r t i nP L e i g h lN B T s a o M S e ta l K R A S m u t a t i o n sa sp r o g n o s t i ca n d p r e d i c t i v e m a r k e r si n n o n-s m a l lc e l ll u n gc a n c e r J J T h o r a c O n c o l201385530-542D O I101097J T O 0b013e318283d9583刘苗苗南岩东房延凤等基于二代测序的肺癌患者外周血c t D N A突变与临床病理特征的相关性研究J国际呼吸杂志201939141041-1046D O I103760c m a j i s s n1673-436X 2019140014S h e p h e r dF A D o m e r g C H a i n a u tP e t a l P o o l e da n a l y s i so f t h e p r o g n o s t i c a n d p r e d i c t i v e e f f e c t s o fK R A Sm u t a t i o n s t a t u sa n d K R A S m u t a t i o n s ub t y p ei n e a r l y-s t a g er e s ec t ed n o n-s m a l l-c e l l l u n g c a n c e r i n f o u r t r i a l s o f a d j u v a n t c h e m o t h e r a p yJ JC l i n O n c o l201331172173-2181D O I101200J C O 20124813905赵家义张蓉韩一平等P D-1P D-L1抗体在非小细胞肺癌治疗中的研究现状J国际呼吸杂志2016368616-619D O I103760c m a j i s s n1673-436X 2016080146J iM L i uY L iQ e t a l P D-1P D-L1p a t h w a y i nn o n-s m a l l-c e l l l u n g c a n c e ra n di t sr e l a t i o n w i t hE G F R m u t a t i o n J JT r a n s lM e d2015135D O I101186s12967-014-0373-07 C h a m o t oK A l-H a b s iM H o n j oT R o l e o f P D-1i n i mm u n i t ya n dd i s e a s e s J C u r rT o p M i c r ob i o l I mm u n o l201741075-97D O I10100782_2017_678 C a l l e sA L i a oX S h o l lL M e t a l E x p r e s s i o no fP D-1a n d i t sl i g a n d s P D-L1a n d P D-L2i ns m o k e r sa n d n e v e rs m o k e r sw i t hK R A S-m u t a n t l u n g c a n c e r J JT h o r a cO n c o l201510121726-1735D O I101097J T O 0000000000000687 9J iM L i uY L i Q e t a l P D-1P D-L1e x p r e s s i o n i nn o n-s m a l l-c e l l l u n g c a n c e r a nd i t s c o r re l a t i o n w i t h E G F R K R A Sm u t a t i o n s J C a n c e rB i o lT h e r2016174407-413D O I101080153840472016115625610 C h e n N F a n g W L i n Z e t a l K R A S m u t a t i o n-i n d u c e du p r e g u l a t i o n o fP D-L1m e d i a t e si mm u n ee s c a p ei n h u m a n l u n g a d e n o c a r c i n o m a J C a n c e r I mm u n o lI mm u n o t h e r20176691175-1187D O I101007s00262-017-2005-z11 Z h o uB D e rC J C o xA D T h e r o l e o fw i l d t y p eR A S i s o f o r m si n c a n c e r J S e m i nC e l lD e vB i o l20165860-69D O I101016j s e m c d b20160701212 A t h u l u r i-D i v a k a r S K V a s q u e z-D e l C a r p i oR D u t t aK e t a l As m a l lm o l e c u l eR A S-m i m e t i cd i s r u p t sR A Sa s s o c i a t i o n w i t he f f e c t o r p r o t e i n s t ob l o c ks i g n a l i n g J C e l l20161653643-655D O I101016j c e l l20160304513 C o xA D D e rC J R a sh i s t o r y T h es a g ac o n t i n u e s J S m a l lG T P a s e s2010112-27D O I104161s g t p1112178 14J a n g H M u r a t c i o g l uS G u r s o y A e t a l M e m b r a n e-a s s o c i a t e d R a sd i m e r sa r ei s o f o r m-s p e c i f i c K-R a sd i m e r sd i f f e rf r o mH-R a s d i m e r s J B i o c h e m J2016473121719-1732D O I101042B C J2016003115金琳芳刘彦魁陆莲等非小细胞肺癌中E M L4-A L K融合基因的检测及其与E G F R㊁K-r a s基因的相关性J国际呼吸杂志201737281-84D O I103760c m a j i s s n1673-436X 20170200116 D o g a nS S h e n R A n g D C e ta l M o l e c u l a re p i d e m i o l o g y o fE GF Ra n dK R A Sm u t a t i o n s i n3026l u n g a d e n o c a r c i n o m a sh i g h e rs u s c e p t i b i l i t y o f w o m e nt os m o k i n g-r e l a t e d K R A S-m u t a n t c a n c e r s J C l i n C a n c e r R e s201218226169-6177D O I1011581078-0432C C R-11-326517 F e r r e r I Z u g a z a g o i t i a J H e r b e r t z S e t a l K R A S-M u t a n t n o n-s m a l l c e l l l u n g c a n c e r F r o m b i o l o g y t ot h e r a p y J L u n gC a n c e r201812453-64D O I101016j l u n g c a n20180701318 R o z a l i E N H a t oS V R o b i n s o nB W e t a l P r o g r a mm e dd e a t hl i g a n d2i nc a n c e r-i n d u c e d i mm u n es u p p r e s s i o n J C l i nD e vI mm u n o l20122012656340D O I1011552012656340 19S u g i t a S U s u i Y H o r i e S e t a l T-c e l ls u p p r e s s i o n b y p r o g r a mm e d c e l l d e a t h1l i g a n d1o n r e t i n a l p i g m e n te p i t h e l i u m d u r i n g i nf l a mm a t o r y c o n d i t i o n s J I n v e s tO p h t h a l m o lV i sS c i20095062862-7280D O I101167i o v s08-284620J iM L i uY L iQ e t a l P D-1P D-L1p a t h w a y i nn o n-s m a l l-c e l l l u n g c a n c e ra n di t sr e l a t i o n w i t hE G F R m u t a t i o n J JT r a n s lM e d2015135D O I101186s12967-014-0373-0 21 A k i n l e y eA R a s o o lZ I mm u n ec h e c k p o i n t i n h i b i t o r so fP D-L1a s c a n c e r t h e r a p e u t i c s J JH e m a t o lO n c o l201912192D O I101186s13045-019-0779-522S z a b o P A L e v i t i n HM M i r o n M e t a l S i n g l e-c e l l t r a n s c r i p t o m i c s o f h u m a nTc e l l s r e v e a l s t i s s u e a n d a c t i v a t i o n s i g n a t u r e s i nh e a l t ha n dd i s e a s e J N a tC o mm u n20191014706D O I101038s41467-019-12464-323J i a n g L S u X Z h a n g T e ta l P D-L1e x p r e s s i o n a n di t s r e l a t i o n s h i p w i t h o n c o g e n i c d r i v e r si n n o n-s m a l lc e l ll u n gc a n c e r J O n c o t a r g e t201781626845-26857D O I1018632o n c o t a r g e t1583924 D'I n c e c c oA A n d r e o z z iM L u d o v i n iV e t a l P D-1a n dP D-L1e x p r e s s i o n i n m o l e c u l a r l y s e l e c t e dn o n-s m a l l-c e l l l u n g c a n c e rp a t i e n t s J B rJ C a n c e r2015112195-102D O I101038b j c201455525 L o c o c o F T o r r i c e l l i F R o s s i G e t a l I n t e r-r e l a t i o n s h i pb e t w e e n P D-L1e x p r e s s i o n a n dc l i n i c-p a t h o l o g i c a lf e a t u r e sa n d d r i v e r g e n e m u t a t i o n s i n p u l m o n a r y s a r c o m a t o i dc a r c i n o m a s J L u n g C a n c e r201711393-101D O I101016j l u n g c a n201709009㊃5281㊃国际呼吸杂志2019年12月第39卷第23期I n t JR e s p i r,D e c e m b e r2019,V o l.39,N o.23Copyright©博看网. All Rights Reserved.26 L iD Z h u X W a n g H e ta l A s s o c i a t i o n b e t w e e n P D-L1e x p r e s s i o na n d d r i v e n g e n e s t a t u s i nN S C L C A m e t a-a n a l y s i sJ E u rJS u r g O n c o l20174371372-1379D O I101016j e j s o20170200827S k o u l i d i sF B y e r sL A D i a o L e ta l C o-o c c u r r i n gg e n o m i ca l t e r a t i o n s d e f i n e m a j o r s ub s e t s o f K R A S-m u t a n t l u n ga d e n o c a r c i n o m a w i t hd i s t i n c tb i o l o g y i mm u n e p r o f i l e s a n dt h e r a p e u t i cv u l n e r a b i l i t i e s J C a n c e r D i s c o v201558860-877D O I1011582159-8290C D-14-123628 D o n g Z Y Z h o n g W Z Z h a n g X C e ta l P o t e n t i a l p r e d i c t i v ev a l u e o f T P53a n dK R A Sm u t a t i o n s t a t u s f o r r e s p o n s e t oP D-1b l o c k a d e i mm u n o t h e r a p y i nl u n g a d e n o c a r c i n o m a J C l i nC a n c e rR e s201723123012-3024D O I1011581078-0432C C R-16-255429 C o e l h o MA d eC a r néT réc e s s o nS R a n aS e ta l O n c o g e n i cR A S s i g n a l i n g p r o m o t e s t u m o r i mm u n o r e s i s t a n c e b y s t a b i l i z i n g P D-L1m R N A J I mm u n i t y20174761083-1099e6D O I101016j i mm u n i20171101630 B u s c hS E H a n k e M L K a r g lJ e ta l L u n g c a n c e rs u b t y p e sg e n e r a t e u n i q u e i mm u n e r e s p o n s e s J J I mm u n o l2016197114493-4503D O I104049j i mm u n o l160057631 C u l l i s J D a sS B a r-S a g iD K r a s a n d t u m o r i mm u n i t y f r i e n do r f o e J C o l d S p r i n g H a r bP e r s p e c tM e d201889D O I101101c s h p e r s p e c t a03184932 H u y n h T G M o r a l e s-O y a r v i d e V C a m p o M J e t a lP r o g r a mm e dc e l ld e a t hl i g a n d1e x p r e s s i o ni nr e s e c t e dl u n ga d e n o c a r c i n o m a s A s s o c i a t i o n w i t h i mm u n em i c r o e n v i r o n m e n t J JT h o r a cO n c o l201611111869-1878D O I101016j j t h o20160813433 R i b a s A A d a p t i v e i mm u n er e s i s t a n c e H o w c a n c e r p r o t e c t sf r o mi mm u n e a t t a c k J C a n c e rD i s c o v201559915-919D O I1011582159-8290C D-15-056334 W a n g H M a oL Z h a n g T e t a l A l t e r e de x p r e s s i o no fT I M-3L A G-3I D O P D-L1a n d C T L A-4d u r i n g n i m o t u z u m a b t h e r a p y c o r r e l a t e s w i t h r e s p o n s e s a n d p r o g n o s i s o f o r a l s q u a m o u sc e l lc a r c i n o m a p a t i e n t s J J O r a lP a t h o l M e d2019488669-676D O I101111j o p1288335S k o u l i d i sF B y e r sL A D i a o L e ta l C o-o c c u r r i n gg e n o m i ca l t e r a t i o n s d e f i n e m a j o r s ub s e t s o f K R A S-m u t a n t l u n ga d e n o c a r c i n o m a w i t hd i s t i n c tb i o l o g y i mm u n e p r o f i l e s a n dt h e r a p e u t i cv u l n e r a b i l i t i e s J C a n c e r D i s c o v201558860-877D O I1011582159-8290C D-14-123636 K o y a m aS A k b a y E A L iY Y e t a l S T K11L K B1d e f i c i e n c yp r o m o t e s n e u t r o p h i l r e c r u i t m e n t a n d p r o i n f l a mm a t o r yc y t o k i n e p r od u c t i o nt os u p p re s s T-c e l la c t i v i t y i nt h el u n gt u m o rm i c r o e n v i r o n m e n t J C a n c e rR e s2016765999-1008D O I1011580008-5472C A N-15-143937 K e r r E M M a r t i n s C P M e t a b o l i cr e w i r i n g i n m u t a n t K r a sl u n g c a n c e r J F E B SJ2018285128-41D O I101111f e b s1412538 K o t t a k i sF N i c o l a y B N R o u m a n e A e ta l L K B1l o s s l i n k ss e r i n e m e t a b o l i s m t o D N A m e t h y l a t i o n a n dt u m o r i g e n e s i sJ N a t u r e20165397629390-395D O I101038n a t u r e2013239 M i u r aY S u n a g a N R o l eo f I mm u n o t h e r a p y f o r O n c o g e n e-D r i v e n N o n-S m a l lC e l lL u n g C a n c e r J C a n c e r s B a s e l2018108D O I103390c a n c e r s1*******40 M e n g X H u a n g Z T e n g F e t a l P r e d i c t i v e b i o m a r k e r s i nP D-1P D-L1c h e c k p o i n t b l o c k a d ei mm u n o t h e r a p y J C a n c e r T r e a tR e v20154110868-876D O I101016j c t r v20151100141 G u l l e y J L R a j a n A S p i g e lD R e ta l A v e l u m a bf o r p a t i e n t sw i t h p r e v i o u s l y t r e a t e dm e t a s t a t i c o r r e c u r r e n t n o n-s m a l l-c e l l l u n g c a n c e r J A V E L I NS o l i dT u m o r d o s e-e x p a n s i o nc o h o r t o f am u l t i c e n t r e o p e n-l a b e l p h a s e1b t r i a l J L a n c e tO n c o l2017185599-610D O I101016S1470-20451730240-142 B r a h m e rJ R e c k a m p K L B a a s P e ta l N i v o l u m a b v e r s u sd o ce t a x e li n a d v a n c e d s q u a m o u s-c e l l n o n-s m a l l-c e l l l u n gc a n c e r J N E n g l J M e d20153732123-135D O I101056N E J M o a150462743 D a v a rD S o c i n s k iMA D a c i cS e t a l N e a r c o m p l e t e r e s p o n s ea f t e rs i n g l e d o s e o f n i v o l u m ab i n p a t i e n t w i t h a d v a nc e dh e a v i l yp r e-t r e a t e dK R A Sm u t a n t p u l m o n a r y a d e n o c a r c i n o m aJ E x p H e m a t o lO n c o l2015434D O I101186s40164-015-0029-744 L e e C K M a n J L o r d S e t a l C l i n i c a l a n d m o l e c u l a rc h a r a c t e r i s t i c s a s s o c i a t ed w i t h s u r v i v a l a m o n g p a t ie n t st r e a t e dw i t h c h e c k p o i n t i n h i b i t o r s f o r a d v a n c e dn o n-s m a l l c e l l l u n g c a r c i n o m a As y s t e m a t i cr e v i e wa n d m e t a-a n a l y s i s JJ AMA O n c o l201842210-216D O I101001j a m a o n c o l2017442745 P a s s i g l i a F C a p p u z z o F A l a b i s o O e t a l E f f i c a c y o fn i v o l u m a bi n p r e-t r e a t e dn o n-s m a l l-c e l l l u n g c a n c e r p a t i e n t sh a r b o u r i n g K R A Sm u t a t i o n s J B r JC a n c e r2019120157-62D O I101038s41416-018-0234-3收稿日期2019-05-21㊃6281㊃国际呼吸杂志2019年12月第39卷第23期I n t JR e s p i r,D e c e m b e r2019,V o l.39,N o.23Copyright©博看网. All Rights Reserved.。
基因驱动阳性晚期NSCLC一线免疫治疗

基因驱动阳性晚期NSCLC一线免疫治疗
简介
本文档旨在探讨基因驱动阳性晚期非小细胞肺癌(NSCLC)一线免疫治疗的相关信息。
NSCLC是一种常见的肺癌类型,基因驱动阳性NSCLC是一种具有特定基因突变的亚型。
基因驱动阳性NSCLC概述
基因驱动阳性NSCLC是指肺癌细胞中存在特定基因的突变,这些突变可能导致肿瘤细胞的生长和扩散。
常见的基因突变包括EGFR、ALK、ROS1等。
一线免疫治疗
一线免疫治疗是指在NSCLC患者初始治疗阶段,使用免疫治疗药物作为首选治疗方法。
免疫治疗药物通过激活患者自身的免疫系统来攻击肿瘤细胞。
基因驱动阳性NSCLC一线免疫治疗的意义
基因驱动阳性NSCLC患者在接受免疫治疗时可能有更好的治
疗效果。
根据不同的基因突变,可以选择相应的靶向免疫治疗药物,提高治疗的针对性和效果。
具体治疗方案
针对不同的基因突变,基因驱动阳性NSCLC患者可以选择合
适的免疫治疗方案。
例如,EGFR突变的患者可以使用特定的
EGFR靶向免疫治疗药物。
治疗方案的选择应根据医生的建议和患
者的具体情况来确定。
结论
基因驱动阳性晚期NSCLC一线免疫治疗是一种具有潜力的治
疗方法。
通过基因检测和采用相应的免疫治疗药物,可以提高患者
的治疗效果和生存率。
然而,具体的治疗方案需要根据患者的基因
情况和医生的指导进行个性化选择。
以上是对基因驱动阳性晚期NSCLC一线免疫治疗的简要介绍。
如需更详细的信息,请咨询专业医生或查阅相关研究文献。
ALK基因突变和对应的靶向药物
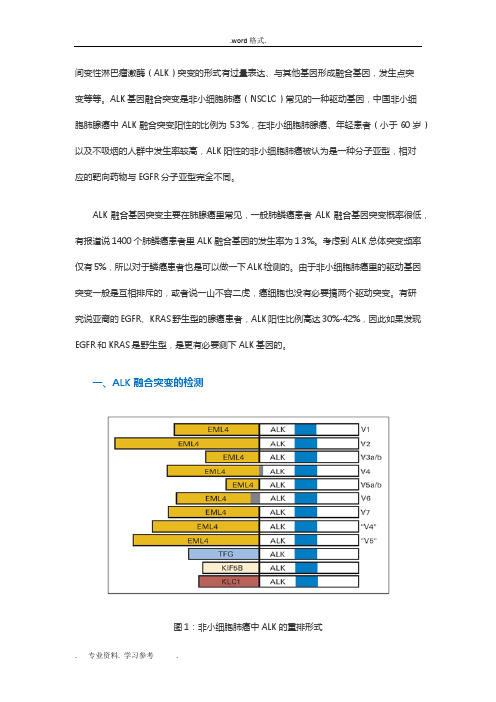
间变性淋巴瘤激酶(ALK)突变的形式有过量表达、与其他基因形成融合基因,发生点突变等等。
ALK基因融合突变是非小细胞肺癌(NSCLC)常见的一种驱动基因,中国非小细胞肺腺癌中ALK融合突变阳性的比例为5.3%,在非小细胞肺腺癌、年轻患者(小于60岁)以及不吸烟的人群中发生率较高,ALK阳性的非小细胞肺癌被认为是一种分子亚型,相对应的靶向药物与EGFR分子亚型完全不同。
ALK融合基因突变主要在肺腺癌里常见,一般肺鳞癌患者ALK融合基因突变概率很低,有报道说1400个肺鳞癌患者里ALK融合基因的发生率为1.3%。
考虑到ALK总体突变频率仅有5%,所以对于鳞癌患者也是可以做一下ALK检测的。
由于非小细胞肺癌里的驱动基因突变一般是互相排斥的,或者说一山不容二虎,癌细胞也没有必要搞两个驱动突变。
有研究说亚裔的EGFR、KRAS野生型的腺癌患者,ALK阳性比例高达30%-42%,因此如果发现EGFR和KRAS是野生型,是更有必要测下ALK基因的。
一、ALK融合突变的检测图1:非小细胞肺癌中ALK的重排形式据报道,目前已发现21种EML4-ALK的融合形式,另外ALK还可能与TFG、KIF5B、KLC1、PTPN3、STRN等基因发生融合,因此ALK融合突变的诊断是存在一定难度的。
下表是关于ALK融合突变的诊断方法,及其相应的特点。
表1:ALK基因检测的方法需要注意,临床常用的三种方法是FISH、Ventana IHC及RT-PCR,三种方法FISH的灵敏度最低。
因此,如果是胸腔积液、细针穿刺取到的细胞学样本做成的蜡块,不建议使用FISH,避免假阴性。
另外通过抽血检测循环肿瘤DNA(ctDNA),循环肿瘤细胞(CTC)也正在发展起来。
总之在面对ALK检测结果模棱两可的时候,一定要换一个检测方法去验证,也没有哪一种方法灵敏度和特异性都是100%。
二、ALK的靶向药物ALK融合突变阳性的患者使用克唑替尼可以获益,克唑替尼具有ALK、c-MET、ROS1三个靶点。
肺癌常见突变基因EGFR与ALK的认知

肺癌常见突变基因EGFR与ALK的认知肺癌是我国发病率最高,也是我国死亡率最高的癌症,而幸运的是在我国大约有40-50%的肺癌具有敏感基因突变,最常见的是EGFR突变及ALK融合突变(欧美10%),可以应用靶向药物治疗,EGFR/ALK靶点的突变应用靶向药物有效率高达70%,明显提高患者生存质量,提高生存期。
有效率虽然很高但总有一个跨不过去的坎那就是耐药。
一、EGFR(表皮生长因子受体)突变EGFR大家已经非常熟悉了,是非小细胞肺癌最常见的致癌基因,是目前肺癌靶向药物对应的主要驱动基因,常见的突变位点发生在18、19、20和21号外显子上。
最常见的有两种,一种是19号外显子的缺失(45%),另外一种是21号外显子L858R(40-45%)的突变。
针对EGFR突变的肺癌患者,比如19外显子缺失和L858突变,常用的药物一代EGFR抑制剂厄洛替尼、吉非替尼、埃克替尼和二代EGFR抑制剂阿法替尼,三代奥西替尼(9291),这些药物对EGFR 突变的非小细胞肺癌患者不错的药物。
但多数病人在使用第一代靶向药物1-2年时间内,就会出现耐药,肿瘤进展。
其中原因有四:1,60%的患者是由于出现继发耐药突变——T790M突变,一旦T790M突变,可以使用三代靶向药物奧希替尼(9291);2,20%的患者耐药是因为旁路激活,比如c-MET扩增,也就是说肿瘤细胞的增殖绕开了EGFR,走了另外一条路。
如果基因检测显示MET扩增或突变,可以应用克唑替尼;3,表型改变也是一代靶向药物产生耐药的一种情况,比如腺癌会向小细胞肺癌转化;4,EGFR驱动基因的下游信号通路激活,也会导致的原发耐药或者获得性耐药。
这种情况就要考虑化疗。
奧希替尼作为一代靶向药耐药后的选择,仍然会产生耐药。
比如继发C797S的共生突变,其他旁路激活等。
在EGFR突变的患者中,除了常见的19/21基因突变外,还有3种罕见突变:G719X(18外显子)、S768I(20外显子)和L861Q (21外显子)。
ALK基因突变和对应靶向药物

间变性淋巴瘤激酶(ALK)突变的形式有过量表达、与其他基因形成融合基因,发生点突变等等。
ALK基因融合突变是非小细胞肺癌(NSCLC)常见的一种驱动基因,中国非小细胞肺腺癌中ALK融合突变阳性的比例为5.3%,在非小细胞肺腺癌、年轻患者(小于60岁)以及不吸烟的人群中发生率较高,ALK阳性的非小细胞肺癌被认为是一种分子亚型,相对应的靶向药物与EGFR分子亚型完全不同。
ALK融合基因突变主要在肺腺癌里常见,一般肺鳞癌患者ALK融合基因突变概率很低,有报道说1400个肺鳞癌患者里ALK融合基因的发生率为1.3%。
考虑到ALK总体突变频率仅有5%,所以对于鳞癌患者也是可以做一下ALK检测的。
由于非小细胞肺癌里的驱动基因突变一般是互相排斥的,或者说一山不容二虎,癌细胞也没有必要搞两个驱动突变。
有研究说亚裔的EGFR、KRAS野生型的腺癌患者,ALK阳性比例高达30%-42%,因此如果发现EGFR 和KRAS是野生型,是更有必要测下ALK基因的。
一、ALK融合突变的检测图1:非小细胞肺癌中ALK的重排形式据报道,目前已发现21种EML4-ALK的融合形式,另外ALK还可能与TFG、KIF5B、KLC1、PTPN3、STRN等基因发生融合,因此ALK融合突变的诊断是存在一定难度的。
下表是关于ALK融合突变的诊断方法,及其相应的特点。
表1:ALK基因检测的方法需要注意,临床常用的三种方法是FISH、Ventana IHC及RT-PCR,三种方法FISH的灵敏度最低。
因此,如果是胸腔积液、细针穿刺取到的细胞学样本做成的蜡块,不建议使用FISH,避免假阴性。
另外通过抽血检测循环肿瘤DNA(ctDNA),循环肿瘤细胞(CTC)也正在发展起来。
总之在面对ALK检测结果模棱两可的时候,一定要换一个检测方法去验证,也没有哪一种方法灵敏度和特异性都是100%。
二、ALK的靶向药物ALK融合突变阳性的患者使用克唑替尼可以获益,克唑替尼具有ALK、c-MET、ROS1三个靶点。
非小细胞肺癌突变基因类型

非小细胞肺癌突变基因类型非小细胞肺癌 (Non-small cell lung cancer, NSCLC) 是一种常见的肺癌类型,其发生和发展与多个基因的突变和异常有关。
以下是 NSCLC 中常见的突变基因类型:1. EGFR (Epidermal Growth Factor Receptor) 基因突变:EGFR 基因突变是NSCLC 中最常见的突变类型之一,约有10%-35% 的 NSCLC 患者存在 EGFR 基因突变。
这种突变可以导致肿瘤细胞增殖和转移,也是一些靶向治疗药物的靶点。
2. ALK (Anaplastic Lymphoma Kinase) 基因重排:ALK 基因重排是NSCLC 中另一个常见的基因异常,大约有3%-5% 的NSCLC 患者存在 ALK 基因重排。
这种重排可以导致蛋白质异常表达,促进肿瘤细胞增殖和转移。
3. ROS1 (ROS Proto-Oncogene 1, Receptor Tyrosine Kinase) 基因重排:ROS1 基因重排是NSCLC 中较为罕见的突变类型,约有 1%-2% 的 NSCLC 患者存在 ROS1 基因重排。
这种重排也可以促进肿瘤细胞增殖和转移。
4. KRAS (Kirsten Rat Sarcoma Viral Oncogene Homolog) 基因突变:KRAS 基因突变是 NSCLC 中比较常见的突变类型之一,约有 20%-30% 的 NSCLC 患者存在 KRAS 基因突变。
这种突变可以导致肿瘤细胞增殖和转移,但一些针对 KRAS 突变的靶向治疗药物目前仍处于研发阶段。
除了以上几种基因突变和重排,还有其他一些基因异常可能与NSCLC 的发生和发展有关,如 TP53、BRAF、RET 等。
具体的突变基因类型会因个体差异和地区差异而有所不同。
非小细胞肺癌中九基因联合检测突变分析

网络出版时间:2020-6-2813:41 网络出版地址:https://kns.cnki.net/kcms/detail/34.1073.R.20200628.0848.008.html非小细胞肺癌中九基因联合检测突变分析邓 庆,罗 韬,葛 佳,刘 锋,李 磊,汪黎鸿,王 姣,阎晓初摘要:目的 通过ARMS PCR法联合检测非小细胞肺癌(non smallcelllungcancers,NSCLC)中9个驱动基因(ALK、ROS1、RET、EGFR、KRAS、HER 2、PIK3CA、NRAS和BRAF)的突变情况,分析其突变状态及临床意义。
方法 采用ARMS PCR技术检测2018年2月~2019年2月陆军军医大学第一附属医院病理科存档的522例NSCLC肿瘤组织中的9个驱动基因的突变情况。
结果 522例NSCLC中ALK、ROS1和RET的融合突变率分别为5 17%、1 34%、1 34%,EGFR、KRAS、HER 2、PIK3CA、NRAS和BRAF的突变率分别为47 32%、7 28%、1 72%、1 72%、0 95%和0 57%。
女性患者中EGFR突变和ALK融合突变率明显高于男性患者(P<0 001),而KRAS突变率低于男性患者(P<0 001)。
EFGR和KRAS突变在肺腺癌中显著高于肺鳞癌(P<0 001)。
无吸烟史患者中EGFR突变和ALK融合发生率均高于吸烟患者(P<0 001),KRAS突变在吸烟患者的发生率显著高于无吸烟史患者。
利用ARMS法联合检测9个基因在单点检测EGFR基础上增加了10 15%的患者可使用靶向药物(P<0 01)。
结论 在9个驱动基因突变中,EGFR突变、ALK融合、KRAS突变与患者性别、吸烟以及组织学类型密切相关,其它较为罕见驱动基因突变并未发现与组织学类型、患者性别及吸烟与否相关。
九基因联合检测可作为NSCLC更简便适用的药物靶向检测方法。
Kras突变非小细胞肺癌介绍

Kras突变非小细胞肺癌介绍Kras基因是什么基因的概念最早出现于19世纪60年代,遗传学家孟德尔提出了生物的性状是由遗传因子控制的观点。
20世纪初期,遗传学家摩尔根通过果蝇的遗传实验,认识到基因存在于染色体上,得出了染色体是基因载体的结论,此后人们对基因的研究从来没有间断过。
在细胞的讯息传递路径上,RAS主要为活化控制基因转录的激酶,从而调节细胞的增生与分化,其与肿瘤细胞的生存,增值,迁移,扩散,血管生成均有关系。
研究表明约30%的人类恶性肿瘤与RAS基因突变有关。
RAS基因的发现以及结构和功能的明确经过了几代人的努力。
1981年Nature杂志上发表了一篇关于新基因序列的研究成果。
科学家们在Harvery鼠肉瘤病毒( Ha-MSV) 和Kirsten 鼠肉瘤病毒(Ki-MSV)的子代基因中发现含有来源于宿主细胞的基因组的新基因序列,此后人们将这种宿主细胞基因称为RAS基因。
1982 年Weinberg 和Barbacid首先从人膀胱癌细胞系中分离出一种转化基因,可使NIH3T3 细胞发生恶性转化,而从正常人组织中提取的DNA 则无此种作用。
随后,Santos 与Parada发现上述转化基因并非新型基因,而是Harvery鼠肉瘤病毒RAS基因的人类同源基因,命名为HRAS。
同年,Krontiris在人肺癌细胞中发现Kirsten 鼠肉瘤病毒基因的同系物,称为KRAS。
另一种相似的基因是在人神经母细胞瘤DNA 感染NIH3T3 细胞时发现的与RAS类似的基因,称为NRAS。
RAS基因家族的三个成员相继被发现后,针对其结构和功能的研究也随之进行。
KRAS基因与非小细胞肺癌KRAS是肺癌中一种最常见的突变基因,发生在大约25%的肺腺癌中。
肺癌KRAS突变主要定位在第12和13号密码子。
肺癌中的KRAS突变似乎与EGFR和ALK易位互不相容,而患者通常都有吸烟史。
由于在病情分期、治疗方案以及生物标记物状态方面都存在分歧,对于非小细胞肺癌患者KRAS基因突变的预后与预测价值存在一定争议。
浅述ALK融合突变及其检测方法(上)

浅述ALK融合突变及其检测方法(上)作者:闵ALK融合突变是非小细胞肺癌常见驱动基因突变之一,因其靶向药使用时间长,平均生存期长,也被病友们戏称为“钻石突变”。
由于ALK融合突变发生概率仅5%-7%左右,不少病友都很羡慕ALK阳性的幸运儿,也希望同样的运气降落在自己身上,于是如何认识ALK 融合突变、如何检测ALK突变以及如何看懂结果就成了需要回答的问题。
有很多病友会奇怪自己的基因检测报告上有ALK突变却被告知不能吃靶向药,或者为什么自己的病理报告上写着ALK(+)还要做基因检测?想回答这些问题,我们需要去了解什么是ALK融合突变,究竟是怎么检测的。
什么是ALK融合突变?让我们先了解一下主角ALK融合突变到底是怎么回事。
ALK基因全称为间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK),总共有29个外显子。
为了方便理解,各位可以将它想象成一辆名为ALK的高铁列车,而29个外显子就是列车的29节车厢,那么“融合突变”就是指ALK 的某节车厢断裂并且与其他班次的列车车厢相接变成一个新的列车,最常见的是从ALK号列车的20号车厢处断裂,并与另一辆名为“EML4”的基因重新拼接,如下所示。
已发现的所有ALK基因融合突变都是在ALK基因外显子20处发生断裂,而EML4断裂点有外显子2/6/13/14/15/17/18/20,即上图中与断裂后的ALK基因20号外显子重新连接的不但可以是EML4基因13号外显子,也可以是其他外显子。
上面例子可简称为“E13:A20”,即代表EML4外显子13与ALK 外显子20融合,有些基因检测报告的结果也采用这种缩写。
不同的融合类型使用靶向药的效果也不同,这是后话在此不过多赘述。
随着研究进步,更多的ALK基因融合伴侣被发现,ALK基因20外显子断裂后不仅可能与EML4基因融合,还可能有与KIF5B基因、KLC1基因、TFG基因、HIP1基因等等融合,此类也成为罕见ALK融合突变。
KRAS突变非小细胞肺癌的预后和疗效

KRAS突变⾮⼩细胞肺癌的预后和疗效RAS癌基因参予细胞⽣长和分化的调控,参与多种肿瘤的形成与发展。
与⼈类肿瘤相关的RAS基因有三种,即HRAS、KRAS和NRAS,它们分别定位于11、12、1号染⾊体,见图1。
KRAS突变已被明确为NSCLC发⽣的驱动基因,在肺鳞癌中⽐例极少,在东亚国家肺腺癌中约占8-10%,在欧美国家肺腺癌中约占20-30%。
中国肺腺癌中KRAS突变⽐例为8.3%,优势⼈群为男性、吸烟史、浸润性黏液型腺癌和实体型腺癌,G12C最常见(33.6%),G12D(23.9%)和G12V(22.1%)其次,见图2。
疾病预后KRAS突变⾮⼩细胞肺癌患者与EGFR/ALK/ROS1突变患者相⽐,有较短的⽣存期。
⽽且KRAS突变患者有显著的临床异质性,与KRAS突变亚型⽆关,与其共存基因突变有关。
美国纪念斯隆-凯特琳癌症中⼼应⽤⼆代测序⽅法筛选出330例KRAS突变的晚期⾮⼩细胞肺癌患者,评估共存的最常见的基因组改变。
见图2,TP53、STK11(LKB1)和KEAP1/NFE2L2是最常见的共存基因突变。
STK11(LKB1)或KEAP1/NFE2L2共存突变患者总⽣存期明显缩短,⽽TP53共存突变对总⽣存期没有影响,见图3。
多变量分析显⽰,KEAP1/NFE2L2突变是独⽴的不良预后预测因⼦,⽽TP53或STK11(LKB1)突变与预后⽆关*。
*STK11(LKB1)突变患者中63%同时也有KEAP1/NFE2L2突变。
临床前研究显⽰,KEAP1/NFE2L2突变对铂类耐药,导致含铂化疗⽅案疗效较差。
KEAP1/NFE2L2共存突变的KRAS⾮⼩细胞肺癌患者对PD1/PD-L1免疫治疗响应也较差。
化疗疗效荷兰的⼀个回顾性研究显⽰,晚期KRAS突变NSCLC⼀线化疗采⽤紫杉醇⽅案的疗效最佳,总有效率50%,联合贝伐单抗时更⾼达62%,培美曲赛⽅案的总有效率为21%,吉西他滨⽅案的总有效率为25%,具体数据见表1。
非小细胞肺癌(NSCLC) 患者 EGFR 突变类型

NSCLC患者EGFR 突变类型为使患者尽可能地从最有效的治疗中受益,只要条件许可,所有非小细胞肺癌患者和含腺癌成分的其他类型肺癌患者都应当尝试进行EGFR基因突变检测。
EGFR基因位于第7号染色体p12-q22区上,包括28个外显子区域。
与NSCLC相关的EGFR基因突变主要集中在酪氨酸激酶(tyrosinekinase,TK)区域的18~21号外显子上,包括30余种突变。
NSCLC患者EGFR 突变类型18外显子基因突变G719X 基因突变亚洲NSCLC 患者中,G719X 突变约占EGFR 突变总数的2%~3%,是18外显子最常见的突变类型。
对于G719X 突变的患者,临床上使用二代TKIs 作为首选靶向药物预后或许更好。
E709X 点突变E709X 是发生于18外显子的少见敏感突变之一,约占EGFR 突变总数的1.5%。
近年来发表的临床研究或个案报道中,E709X 突变的患者对一代TKIs 的疗效反应不一,或病情得到控制或出现疾病进展。
二代TKIs 治疗E709X 突变的NSCLC 患者是否比一代TKIs 更具生存优势仍待更大样本的临床研究进一步证实。
DelE709_T710insX 点突变DelE709_T710insX 是发生在第709位外显子上的缺失/插入突变,约占EGFR 突变总数的0.16%。
目前尚缺乏关于DelE709_T710insX 对一代TKIs 敏感程度的系统性研究。
在临床应用方面,二代TKIs 对DelE709_T710insX 突变的NSCLC 患者临床疗效是否更好仍缺乏临床证据。
19外显子基因突变缺失突变外显子19缺失突变超过20种,包括大的缺失突变、缺失合并点突变、缺失并插入突变等。
其中最常见的就是小的外显子747-750LREA 模体框内缺失,约占EGFR 总突变类型的40%~50%。
多项大型一线Ⅲ期临床研究已证实,与传统化疗相比,一代TKIs 如吉非替尼、厄洛替尼可以明显提高Del19和L858R 患者的客观有效率(超过70%)、延长无进展生存期(达9~12个月)和总生存期(达20~24个月)。
非小细胞肺癌驱动基因谱

非小细胞肺癌驱动基因谱《非小细胞肺癌驱动基因谱》非小细胞肺癌(Non-small cell lung cancer,NSCLC)是一种常见的肺癌类型,占据了肺癌患者的大部分比例。
尽管在治疗方法和技术上有了显著进步,但NSCLC仍然是一个具有挑战性的疾病。
为了更好地理解NSCLC的发病机制和开发更有效的治疗策略,科学家们开始关注NSCLC的驱动基因谱。
驱动基因谱是指与肿瘤发展、进展和预后相关的一组突变基因。
在NSCLC中,研究人员已经鉴定出许多驱动基因,这些基因的突变直接参与了肿瘤形成和发展的过程。
下面,我们将介绍一些目前已知的NSCLC驱动基因。
第一个被发现的驱动基因是EGFR基因突变。
EGFR基因突变在NSCLC患者中非常常见,特别是在亚洲人群中。
EGFR突变导致了受体激活通路的过度激活,进而促进了细胞生长和增殖。
由于EGFR突变的存在,EGFR酪氨酸激酶抑制剂成为了NSCLC治疗的重要药物。
另一个重要的驱动基因是ALK基因突变。
ALK基因突变在NSCLC患者中也比较常见。
ALK融合蛋白的过度表达与肿瘤细胞增殖和生存的异常相关。
针对ALK突变的靶向治疗剂已经在临床试验中显示出显著的疗效。
此外,研究人员还发现了ROS1、RET、KRAS、HER2等一系列驱动基因。
这些基因的突变与肺癌的发生和发展密切相关。
研究人员通过对这些驱动基因的研究,为NSCLC的治疗带来了新的机会。
了解NSCLC的驱动基因谱对于治疗选择至关重要。
通过对患者进行基因检测,可以确定突变的存在与否,从而为个体化治疗提供指导。
有了对驱动基因的更好理解,科学家们正在努力开发更多的靶向药物,以提高NSCLC患者的生存率和生活质量。
总之,《非小细胞肺癌驱动基因谱》的研究揭示了NSCLC发病机制中重要的驱动基因,为肺癌的治疗策略提供了新的思路。
未来,随着对这些驱动基因的进一步研究,我们有望开发出更多的靶向药物,提供更加个体化的NSCLC治疗方案。
egfr20突变类型

egfr20突变类型(实用版)目录1.EGFR20 突变类型概述2.EGFR20 突变的具体类型3.EGFR20 突变的影响与应用正文【EGFR20 突变类型概述】EGFR20 突变类型是指发生在表皮生长因子受体 20 号外显子(Exon 20)的突变。
这种突变主要与肺癌的发生、发展及治疗有关,尤其在非小细胞肺癌(NSCLC)患者中较为常见。
通过对 EGFR20 突变类型的研究,有助于我们更好地了解肺癌的生物学特性,从而指导临床诊断、治疗和预后评估。
【EGFR20 突变的具体类型】EGFR20 突变类型主要分为以下几种:1.点突变:指在 EGFR 基因的编码序列中发生的单个碱基改变。
常见的点突变有 L858R、G719X 等。
2.插入突变:指在 EGFR 基因的编码序列中插入了一个或多个额外的碱基。
常见的插入突变有 E746-A750del 等。
3.缺失突变:指在 EGFR 基因的编码序列中丢失了一个或多个碱基。
常见的缺失突变有 L861Q 等。
4.倒位突变:指在 EGFR 基因的编码序列中发生的局部碱基顺序颠倒。
常见的倒位突变有 T790M 等。
5.复合突变:指在 EGFR 基因的编码序列中发生的两种或多种突变。
常见的复合突变有 L858R/T790M 等。
【EGFR20 突变的影响与应用】EGFR20 突变类型对肺癌的诊断、治疗和预后评估具有重要意义。
根据 EGFR20 突变类型,可以为患者提供个体化的治疗方案。
例如,针对L858R 突变的患者,第一代 EGFR-TKI(如吉非替尼)治疗有效;而针对T790M 突变的患者,第三代 EGFR-TKI(如奥西替尼)治疗效果更佳。
此外,通过检测患者的 EGFR20 突变类型,还可以预测患者对不同 EGFR-TKI 的敏感性和耐药性,为临床治疗提供依据。
总之,EGFR20 突变类型在肺癌的诊断、治疗和预后评估中具有重要作用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
非小细胞肺癌常见的驱动基因突变类型
非小细胞肺癌(Non-Small Cell Lung Cancer,NSCLC)是目前肺癌的主要类型,约占所有肺癌的85%。
驱动基因突变是NSCLC发生和发展的重要原因之一。
本文将介绍非小细胞肺癌中常见的几种驱动基因突变类型。
1. EGFR突变
表皮生长因子受体(Epidermal Growth Factor Receptor,EGFR)是一种经常发生突变的驱动基因。
EGFR突变包括点突变和插入/缺失突变,常见的突变位点有Exon 19和Exon 21。
EGFR突变可以导致受体激活异常,进而促进细胞增殖和进化,是NSCLC中最为常见的驱动基因突变。
EGFR突变与亚型NSCLC的发生有关,对EGFR酪氨酸激酶抑制剂(EGFR-TKI)有较好的治疗反应。
2. ALK融合基因
ALK基因重排是NSCLC中另一种常见的驱动基因突变。
ALK基因重排导致ALK蛋白与其他蛋白(如EML4)融合,形成具有激酶活性的融合蛋白。
这种融合蛋白能够激活多个信号通路,促进肿瘤细胞的增殖和生存。
ALK融合基因在NSCLC中的检出率约为5%,主要见于非吸烟者和年轻患者。
对于ALK阳性的NSCLC患者,ALK 抑制剂是一种有效的治疗选择。
3. ROS1融合基因
ROS1基因融合是NSCLC中另一种重要的驱动基因突变。
ROS1融合基因的患者通常是非吸烟者和年轻人。
ROS1融合基因可以激活多个信号通路,促进肿瘤细胞的增殖和生存。
ROS1融合基因在NSCLC中的检出率约为1-2%。
针对ROS1阳性的NSCLC患者,ROS1抑制剂是一种有效的治疗选择。
4. BRAF突变
BRAF基因突变是NSCLC中较为罕见但具有重要意义的驱动基因突变。
BRAF突变通常见于不吸烟的患者,尤其是女性。
BRAF突变可以导致信号通路的异常激活,进而促进肿瘤细胞的增殖和生存。
BRAF突变在NSCLC中的检出率约为1-4%。
对于BRAF阳性的NSCLC患者,BRAF抑制剂是一种有效的治疗选择。
5. HER2突变
HER2突变是NSCLC中较为罕见的驱动基因突变。
HER2突变导致HER2受体激活异常,进而促进肿瘤细胞的增殖和生存。
HER2突变在NSCLC中的检出率约为2-4%。
针对HER2阳性的NSCLC患者,HER2抑制剂是一种有效的治疗选择。
以上是非小细胞肺癌常见的几种驱动基因突变类型。
这些突变可以导致细胞信号通路的异常激活,促进肿瘤细胞的增殖和生存。
因此,准确检测和识别驱动基因突变对于NSCLC患者的治疗选择和预后评估非常重要。
随着分子生物学和基因测序技术的不断进步,越来
越多的驱动基因突变被发现,为NSCLC的个体化治疗提供了更多的选择和希望。
