香菊片半成品(内包工序)内控质量标准
中成药半成品成品取样标准操作规程

半成品成品取样标准操作规程1目的:建立半成品(中间体)、成品取样标准操作程序。
2范围:中间体、成品。
3职责:Q A对本SOP的实施负责。
4程序:4.1 取样前的准备工作4.1.1 接到中间站管理员或工艺员发来的检验申请单后,做好取样准备。
4.1.2 依据检验申请单的品名、规格、数量等计算取样量。
4.1.3 准备洁净或已灭菌的取样容器、盛样容器和取样工具。
4.1.4 到中间站或外包间(按外包实际工作天数平均)取样:核对状态标记,应为黄色待验区。
核对检验申请单内容与实物标记相符,内容为品名、规格、生产批号、数量。
按取样原则随机抽取规定的样本件数,进入洁净区中间站,取样员应按SOP“人员进入洁净区标准操作程序”进入中间站。
4.2 取样:对于有洁净度要求的取样,打开包装后,戴上洁净的手套,用不锈钢勺等工具按上中下随机抽样,将样品放入洁净的玻璃瓶内,贴上取样标签;中药提取浓缩液或浸膏,用取样管取样,无洁净度要求的则无需戴洁净手套。
成品则直接取样放入取样盛器内。
4.3 取样结束4.3.1封好已打开的样品包件并贴上取样证。
4.3.2 填写取样记录和取样台帐。
4.4. 取样工具及容器清洗程序:4.4.1用饮用水冲洗三遍。
4.4.2用适宜的刷子沾洗涤剂反复刷洗。
4.4.3用饮用水冲净泡沫,使之清亮。
4.4.4用蒸馏水冲洗三遍。
4.4.5洁净后的器皿应不挂水珠,经检查未洗干净的器皿按如下方法洗涤:不锈钢器皿:将其放在热的(40-70℃)洗涤液中浸泡30分钟。
玻璃器皿:将其用重铬酸钾洗液浸泡过夜,倾去洗液后。
4.4.6洗涤后的器皿一般应倒置于专用仪器柜中自然干燥,急用时可将容器中的水尽量倒净,放在105-110℃干燥箱中干燥或者用少量无水乙醇荡洗后,用电吹风吹干。
4.5干燥后的器皿包好放于专用柜中保存,做好清洁标记。
再使用时如超过规定贮存期,应重新洗涤干燥。
质量控制规范(菊花)

质量控制规范(菊花)一、组织结构1.1总经理负责主持公司质量管控的全面工作,对本公司的产品质量管理全面负责;组织质量体系文件的编制、修订与管理;按照绿色食品生产质量体系文件的要求,制定并组织实施公司质量标准,完善各生产环节的质量管控体系。
1.2生产部负责生产基地基础设施的管理,推进标准化基地建设;负责产品种植过程的质量安全控制和生态环境的管理;根据公司生产加工作业计划组织采收、加工,保质、保量、按期完成任务;参与不合格品的评审和处理。
1.3仓储部负责仓储和运输过程中环境的管理;负责对原辅料的采购、贮存、交付防护资金费;防止运输过程中产品的灰尘、雨水的污染;负责办理出入库手续,确保账、物一致。
1.4质检部负责公司质量管理、产品质量检查、计量检定及工序质量监督工作,搞好本部门职能分配及全面管理工作。
参与本公司质量方针、质量目标的制定,并认真组织好本部门的贯彻和实施。
1.5销售部负责市场调研、分析与预测,做好产品信息收集工作;负责收集客户的反馈信息及顾客满意度的调查分析,向公司反馈产品质量和客户意见;对不合格品的处理,包括产品召回、改用,并负责纠正措施的制定与实施。
1.6财务部总 经 理生 产 部仓储 部办公 室财务 部质检 部销售 部负责公司日常财务核算,参与公司的经营管理。
根据公司资金运作情况,合理调配资金,确保公司资金正常运转。
严格财务管理,加强财务监督,督促财务人员严格执行各项财务制度和财经纪律。
1.7办公室负责公司全部档案的记录、规整、存档,做好各部门间的协调工作,完善公司的各项规章制度,负责全体员工的考勤工作。
负责公司的财务管理、资金管理,成本控制、财务报表的提报、税收工作的对接。
二、内部质量检查体系1、原辅材料验收管理制度1.1原辅材料要符合《中华人民共和国产品质量法》和《中华人民共和国食品安全法》及国家标准的要求,保管员负责原辅材料的验收、发放和保管工作。
1.2原辅材料入库必须保证入库原辅材料数量准确,质量符合要求,包装完整无损,手续完备清楚,入库迅速。
中药饮片生产过程的质量控制指标及控制方法

中药饮片生产过程质量控制指标通则一、净选过程的质量指标:1、根、根茎、藤木、叶、花、皮类,泥砂和非药用部位等杂质不得超过2%。
2、果实、种子类,泥砂和非药用部位等杂质不得超过3%。
3、全草类,不允许有非药用部位,泥砂等杂质不得超过3%。
4、动物类,附着物、腐肉和非药用部位等杂质不得超过2%,5、矿物类,夹石、非药用部位等杂质不得超过2%,6、菌藻类,杂质不得超过3%。
7、树脂类,杂质不得超过3%。
8、需去毛、刺的药材,其未去净茸毛和硬刺的药材不得超过1%。
净选过程检查方法:取定量样品,过二号或三号筛筛净灰屑,拣出非药用部位等杂质,合并称重计算。
杂质%= 非药用部位的重量/样品重量×100%二、中药材软化质量指标:1、喷淋:经清水喷洒或喷淋的药材应略润或润透。
未润透后水分过大的不得超过5%。
2、淘洗:经清水淘洗、冲洗或抢水洗的药材,不得伤水。
水分过大和未透者不得超过5%。
3、浸泡:经清水或液体辅料浸泡的药材,应软硬适度,未泡透的不得超过5%,伤水的不得超过3%。
4、漂洗:经漂洗需去除腥味、咸味、毒性或需浸洗透心的药材,漂洗后应无或微有腥味、咸味,内无白心,有毒药材略有麻辣味,不得有霉变、腐烂、酸败。
5、润渍:经清水润过的药材,应软硬适度,不伤水、不酸败,润透程度一致。
未润透的不得超过5%。
中药材软化检查方法:1、取定量样品,用下列方法拣出未润透和水分过大的药材,合并称重计算。
(1)刀劈:质地坚硬药材用刀劈开,内心应有潮湿痕迹。
(2)指掐:团块状药材用指甲应能掐入药材表体(白术,天花粉)。
(3)穿刺法(针刺法):用钢针穿刺药材中心应无坚硬感(大黄、虎杖)。
(4)弯曲:长条形药材用手弯曲应曲而不折断(白芍、山药)。
(5)口尝:口尝断面应无异味。
(6)鼻闻:应有该药材特有气味,无异味。
2、表面泥土较重的药材,取定量样品置清水中淘(冲)洗,洗水不得有明显的沉积物。
三、中药材切制质量控制指标1、片形质地疏松或坚实的根及根茎类、菌类药材厚片2~4mm(切制斜片:厚度数2~4mm、直顺片:厚度2~4mm)皮类(根皮及茎皮)药材切制成细丝:皮类宽丝2-3mm质地坚硬的根及根茎类、藤木类和部份动物角类药材切制成极薄片0.5mm以下质地较紧实,不易切碎的药材成薄片 1~2mm质地疏松或坚实的根及根茎类、菌类药材厚片2~4mm部份菌类药材切制成块:8~12mm 方块叶类宽丝5~10mm。
企业药材内控质量标准

企业药材内控质量标准浙江鸿禾瑞堂医药有限公司引用标准及制定依据:中华人民共和国药典2005版一部适用范围:中药制剂及医疗配方责任部门:采购部、质管部、仓库一、质量内控标准1、药材名称中文名称:麦冬汉语拼音:Maidong拉丁文:RADLX OPHIOPGONIS2、药材来源本品为百合科植物麦冬Ophiogon japonicus (Thunb.)Ker—Gawl.的干燥块根。
夏季采挖,洗净,反复暴晒、堆置,至七八成干,除去须根,干燥。
3、性状本品呈纺锤形,两端略尖,长1.5~3cm,直每径,0.3~0.6cm。
表面黄白色或淡黄色,有细纵纹。
质柔韧,断面黄白色,半透明,中柱细小,气微香、味甘、微苦。
4、鉴别(1)本品横切面:表皮细胞1列,根被为3-5列木化细胞。
皮层宽广,散有含草酸钙针晶束的黏液细胞,有的针晶直径至10cm;内皮层细胞壁均匀增厚,木化,有通道细胞,外侧为1列石细胞,其内壁及侧壁增厚,纹孔细密。
中柱较小,韧皮部束16~22个,木质部由导管、管胞、木纤维以及内侧的木化细胞连结成环层,髓小,薄壁细胞圆状。
(2)取本品2g剪碎,加三氯甲烷—甲醇(7:3)混合溶液20ml,浸泡3小时,超声处理30分钟,放冷,滤过,滤液蒸干,残渣加三氯甲烷0.5ml 使溶解,作为供试品溶液。
另取麦冬对照药材2g,同法制成对照药材溶液,照薄层色谱法(附录V1B)试验,吸取上述两种溶液各10ul,分别点于同一硅胶CF254薄层板上,以甲苯—甲醇—冰醋酸(80:5:1)为展开剂,展开,取出,晾干,置紫外光灯(254mm)下检视。
供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的斑点。
5、检查水分照水分测定法(2005版药典附录IVH第一法)测定,不得过18.0%。
总灰分不得过5.0%。
酸不溶性灰分,不得过0.80%。
浸出物:照水溶性浸出物测定法项下冷浸法(附录X A)测定,不得少于60.0%。
6、炮制:除去杂质,洗净,润透,轧扁,干燥。
半成品(中间体)质量标准.

江西山香药业有限公司技术标准中间体质量标准、检验操作规程(片剂、颗粒剂)制订:2001年7月30日执行:2001年9月15日目录山香圆片中间体质量标准SX—JS—ZB—03—001 (1)清火片中间体质量标准SX—JS—ZB—03—002 (2)增效黄连素片中间体质量标准SX—JS—ZB—03—003 (3)感冒清片中间体质量标准SX—JS—ZB—03—004 (4)感冒通片中间体质量标准SX—JS—ZB—03—005 (5)土霉素片中间体质量标准SX—JS—ZB—03—006 (6)磷酸苯丙哌林片中间体质量标准SX—JS—ZB—03—007 (7)山香圆颗粒中间体质量标准SX—JS—ZB—03—008 (8)板蓝根颗粒中间体质量标准SX—JS—ZB—03—009 (9)药材粉末检验操作规程SX—JS—ZB—04—001 (10)干燥颗粒检验操作规程SX—JS—ZB—04—002 (11)素片检验操作规程SX—JS—ZB—04—003 (13)山香圆流浸膏检验操作规程SX—JS—ZB—04—004 (15)大青叶流浸膏检验操作规程SX—JS—ZB—04—005 (16)板蓝根流浸膏检验操作规程SX—JS—ZB—04—006 (17)目的:建立药材粉末的检验规程。
范围:药材粉末。
责任人:检验员。
内容:1.仪器与用具80目、100目的药筛2.方法取粉碎药材适量,放入药筛内,振动药筛,粉末应能全部通过80目药筛,并含能通过100目药筛的粉末不少于95%。
3.注意事项3.1过筛时先振动。
3.2过筛时粉末应干燥3.3放入筛内的药物不宜太多、太厚。
目的:建立颗粒检验规程。
范围:颗粒。
责任人:检验员。
内容:1.主药含量:凡有可靠含量测定方法者,均应进行含量测定。
2.方法取本品颗粒三份,按主药测定方法测定均应符合公司各品种颗粒项指标。
3.干燥颗粒的水分测定取本品适量,精密称定。
用水分快速测定仪测定干燥颗粒的含水量。
原辅料、包装材料、半成品、成品取样方法和操作规程

原辅料、包装材料、半成品、成品取样方法和操作规程水、沉降菌、浮游菌、悬浮粒子检测法规、指南取样指令:1、当原辅料或包装材料到货时,评价室应收到发自物料部的一份化验申请单、一份厂商的化验证书。
成品生产实现后,评价室应收到生产部的化验申请单。
评价人员检查过这些资料后根据化验申请单在批化验记录相应地位上填写代号、批号、名称,并将化验申请单和批化验记录发至取样员。
对于增补取样,由评价室填写化验申请单,在备注栏内注明“增补取样”。
2、取样员根据化验申请单所记载的来料包装数目预备留检标签、留样标签和清洁干燥的取样容器(对无菌罐装产品用原辅料,取样器具灭菌后应保留在密闭的无菌容器内,超过两周应从新灭菌)。
粘好留检标签后,即可着手取样。
取样方法:1、对原辅料、半成品(中间产品)、成品、副产品及包装材料、工艺用水都应分辨制定取样办法。
2、对取样环境的洁净要求、取样人员、取样容器、取样部位温柔序、取样方法、取样量、样品混合方法、取样容器的清洗、保存、必要的留样时间以及对无菌及麻毒、精力药品在取样时的特别要求等应又明白的规定。
3、原辅料、内包装材料,可在仓储区原辅料取样间或支架式层流罩内取样。
4、取样环境的空气洁净度级别应与生产要求一致。
5、中间品、成品取样可以在生产结束时进行,也能够在生产过程的前、中、后期取样。
(1)原则:根据取样规划单进行取样,取样时,应留神样品的代表性。
如非均一的物料(如悬浮物)在取样前应使其均一;如不可能这样做或不懂得物料是否均一,则应注意从物料不同部位取样;如取样不能达到物料的所有部位时,应随机地在可到达的部位取样;物料表面和物料主题可能会存在差别,抽样时,不应只从表面抽取样品。
对于混合样品,如某批号有2个混合样品,则每一个留样样品应由等量的混合样品混合组成。
(2)取样个别由专职取样员进行。
也可由车间工人或者中控人员根据相应的BPR或SOP取样,然后由取样员进行收集,但抽样人员必需经由恰当的培训和考察,以避免差错,保障抽样的代表性。
硫氰酸红霉素可溶性粉(半成品)内控内控质量标准
制药GMP管理文件
一.目的:制定硫氰酸红霉素素可溶性粉半成品的内控质量标准,对生产的产品实施中间控制。
二.适用范围:适用于硫氰酸红霉素可溶性粉的生产和质量控制。
三.责任者:生产人员、质量监督员、质量检验员。
四.正文:
【物料名称】硫氰酸红霉素可溶性粉
【质量指标】本品为硫氰酸红霉素与适宜的辅料配制而成,含红霉素应为标示量的93.0%-106.0%.
性状本品为白色或类白色粉末。
鉴别 1取本品约0.1g,加硫酸10ml,缓缓摇匀,即显红棕色。
2取本品0.1g,加丙酮2ml,溶解后加盐酸2ml,即显棕黄色,渐变为紫红色,再加三氯甲烷2ml,充分振摇,三氯甲烷层显紫蓝色。
3取本品0.1g,加水10ml,滴加三氯化铁试液2ml,摇匀,溶液显朱红色。
【检查】
干燥失重取本品,以五氧化二磷微干燥剂,在60℃减压干燥4小
时,减失重量不得过8.0%。
其他应符合可容性粉剂项下的有关各项规定。
【规格】 100g: 5g。
【贮藏】密闭,在干燥处保存。
化妆品半成品内控标准模版
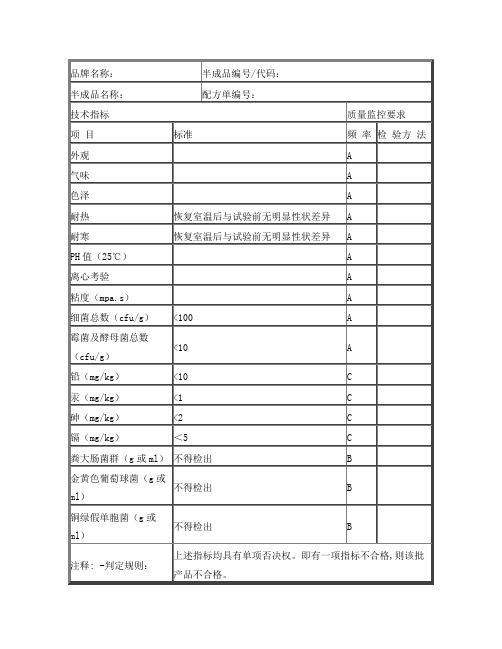
A
铅(mg/kg)
<10
C
汞(mg/kg)
<1
C
砷(mg/kg)
<2
C
镉(mg/kg)
<5
C
粪大肠菌群(g或ml)
不得检出
B
金黄色葡萄球菌(g或ml)
不得检出
B
铜绿假单胞菌(g或ml)
不得检出
B
注释: -判定规则:
上述指标均具有单项否决权。即有一项指标不合格,则该批产品不合格。
-测试频率规则:
品牌名称:
半成品编号/代码:
半成品名称:
配方单编号:
技术指标
质量监控要求
项 目
标准
频 率
检 验方 法
外观
A
气味
A
色泽
A
耐热
恢复室温后与试验前无明显性状差异
A
耐寒
恢复室温后与试验前无明显性状差异
A
PH值(25℃)
A
离心考验
A
粘度(mpa.s)
A
细菌总数(cfu/g)
<100
A
霉菌及酵母菌总数(cfu/g)
A-每批必检。
B-前5批次进行连续测试,合格后可进行每月抽检一次。
C-每12个月至少提供一份第三方检验报告或我司自检或送第三方检验一次。
其 它 信 息
文件变更记录:
更改原因及内容:
取代文件编号:
储存方法:
常温密封
保 质 期:
18个月
菊花成品质量标准

菊花成品质量标准目的∶建立菊花的成品内控质量标准,包括来源、主要产地、炮制、性状、检查等内容,提供检验依据,确保中药饮片产品质量。
责任人:文件制订人及所有相关人员。
标准来源∶《中华人民共和国药典》2010年版一部、《河南省中药饮片炮制规范》、《江苏省中药饮片炮制规范》等。
内容∶【产品代码】【产品包装规格】统0.5kg*10袋、【包装形式】纸箱、丝袋【取样方法】参照ZLSOP000500取样标准操作规程【检验操作规程】参照ZLSOP501300菊花成品检验标准操作规程【来源】本品为菊科植物菊Chrysanthemum morifolium Ramat.的干燥头状花序。
9~11月份花盛开时分批采收,阴干或焙干,或熏、蒸后晒干。
药材按产地和加工方法不同,分为“亳菊”、“滁菊”、“贡菊”、“杭菊”。
【主要产地】河南武陟、温县、沁阳、博爱、孟州;浙江、安徽、四川、山东等地。
【炮制】菊花除去残留的花梗、叶片等杂质,筛去灰屑。
【性状】菊花亳菊呈倒圆锥形或圆筒形,有时稍压扁呈扇形,直径1.5~3cm,离散。
总苞碟状;总苞片3~4层,卵形或椭圆形,草质,黄绿色或褐绿色,外面被柔毛,边缘膜质。
花托半球形,无托片或托毛。
舌状花数层,雌性,位于外围,类白色,劲直,上举,纵向折缩,散生金黄色腺点;管状花多数,两性,位于中央,为舌状花所隐藏,黄色,顶端5齿裂。
瘦果不发育,无冠毛。
体轻,质柔润,干时松脆。
气清香,味甘、微苦。
滁菊呈不规则球形或扁球形,直径1.5~2.5cm。
舌状花类白色,不规则扭曲,内卷,边缘皱缩,有时可见淡褐色腺点;管状花大多隐藏。
贡菊呈扁球形或不规则球形,直径1.5~2.5cm。
舌状花白色或类白色,斜升,上部反折,边缘稍内卷而皱缩,通常无腺点;管状花少,外露。
杭菊呈碟形或扁球形,直径2.5~4cm,常数个相连成片。
舌状花类白色或黄色,平展或微折叠,彼此粘连,通常无腺点;管状花多数,外露。
【鉴别】取本品1g,剪碎,加石油醚(30~60℃)20ml,超声处理10分钟,弃去石油醚,药渣挥干,加稀盐酸1ml与乙酸乙酯50ml,超声处理30分钟,滤过,滤液蒸干,残渣加甲醇2ml使溶解,作为供试品溶液。
催情散(半成品)内控质量标准

制药G,,MP管理文件
一.目的:制定催情散(半成品)的内控标准,规范公司催情散的生产。
二.适用范围:适用于催情散的生产和质检。
三.责任者:生产部经理、质管部经理、检验员、各岗位操作人员。
四.正文:
【名称】催情散
【规格】 500g,,/袋
【质量指标】
处方:淫羊藿6g,,阳起石(酒淬)6g,,当归4g,,香附5g,,益母草6g,,菟丝子5g,,
性状:本品为淡灰色的粉末;气香,味微苦、微辛。
鉴别:取本品,置显微镜下观察:非腺毛3-10细胞,长
200-1000um,顶端细胞长,有的含棕色或黄棕色物。
薄壁细胞纺锤形,壁略厚,有极微细的斜向交错纹理,分泌细胞类圆形,含淡黄棕色至红棕色分泌物,其周围细胞作反射状排列,非腺毛
1-3细胞,稍弯曲,壁有疣状突起。
种皮栅状细胞2列,内列较
外列长,有光辉带。
检查:应符合散剂项下的有关各项规定。
3087续断半成品质量标准
题目:续断半成品质量标准
编号:TS-34-3087
制定人:
制定日期2013年月日
版本:3
页数:1/1
审核人:
审核日期2013年月日
颁发部门:质量部
批准人:
批准日期2013年月日
生效日期2013年月日பைடு நூலகம்
分发部门
质量部、化验室、生产部
标准依据
《内控标准》
质量标准内容
本品为川续断科植物川续断的干燥根经切制而成。
3、水分:本品水分应为≤10.0%。
4、片厚:2-4mm。无连刀片、异形片不得过5.0%。
【取样方法】按成品、半成品取样操作规程(SOP-09-102)进行取样。
附:变更记载
版本号
生效日期
变更原因、依据及变更内容
03
执行新版GMP标准
【性状】本品呈类圆形或椭圆形的厚片。外表皮灰褐色至黄褐色,有纵皱。切面皮部墨绿色或棕褐色,木部灰黄色或黄褐色,可见放射状排列的导管束纹,形成层部位多有深色环。气微,味苦、微甜而涩。
【检查】
1、净度:含药屑、杂质不得过2.0%。
2、色泽:外表皮灰褐色至黄褐色。切面皮部墨绿色或棕褐色,木部灰黄色或黄褐色。
中药饮片生产过程的质量控制指标及控制方法

中药饮片生产过程质量控制指标通则一、净选过程的质量指标:1、根、根茎、藤木、叶、花、皮类,泥砂和非药用部位等杂质不得超过2%。
2、果实、种子类,泥砂和非药用部位等杂质不得超过3%。
3、全草类,不允许有非药用部位,泥砂等杂质不得超过3%。
4、动物类,附着物、腐肉和非药用部位等杂质不得超过2%,5、矿物类,夹石、非药用部位等杂质不得超过2%,6、菌藻类,杂质不得超过3%。
7、树脂类,杂质不得超过3%。
8、需去毛、刺的药材,其未去净茸毛和硬刺的药材不得超过1%。
净选过程检查方法:取定量样品,过二号或三号筛筛净灰屑,拣出非药用部位等杂质,合并称重计算。
杂质%=非药用部位的重量/样品重量X100%二、中药材软化质量指标:1、喷淋:经清水喷洒或喷淋的药材应略润或润透。
未润透后水分过大的不得超过5%。
2、淘洗:经清水淘洗、冲洗或抢水洗的药材,不得伤水。
水分过大和未透者不得超过5%。
3、浸泡:经清水或液体辅料浸泡的药材,应软硬适度,未泡透的不得超过5%,伤水的不得超过3%。
4、漂洗:经漂洗需去除腥味、咸味、毒性或需浸洗透心的药材,漂洗后应无或微有腥味、咸味,内无白心,有毒药材略有麻辣味,不得有霉变、腐烂、酸败。
5、润渍:经清水润过的药材,应软硬适度,不伤水、不酸败,润透程度一致。
未润透的不得超过5%。
中药材软化检查方法:1、取定量样品,用下列方法拣出未润透和水分过大的药材,合并称重计算。
(1)刀劈:质地坚硬药材用刀劈开,内心应有潮湿痕迹。
(2)指掐:团块状药材用指甲应能掐入药材表体(白术,天花粉)。
(3)穿刺法(针刺法):用钢针穿刺药材中心应无坚硬感(大黄、虎杖)。
(4)弯曲:长条形药材用手弯曲应曲而不折断(白芍、山药)。
(5)口尝:口尝断面应无异味。
(6)鼻闻:应有该药材特有气味,无异味。
2、表面泥土较重的药材,取定量样品置清水中淘(冲)洗,洗水不得有明显的沉积物。
三、中药材切制质量控制指标1、片形质地疏松或坚实的根及根茎类、菌类药材厚片2〜4mm (切制斜片:厚度数2〜4mm、直顺片:厚度2〜4mm)皮类(根皮及茎皮)药材切制成细丝:皮类宽丝2-3mm质地坚硬的根及根茎类、藤木类和部份动物角类药材切制成极薄片0.5mm以下质地较紧实,不易切碎的药材成薄片1〜2mm质地疏松或坚实的根及根茎类、菌类药材厚片2〜4mm部份菌类药材切制成块:8〜12mm方块叶类宽丝5〜10mm。
菊花质量标准及检验操作规程

XXXXXXX有限公司原料质量标准及检验操作规程1 品名:1.1 中文名:菊花1.2 汉语拼音:Juhua2 代码:3 取样文件编号:4 检验方法文件编号:5 依据:《中国药典》(2020年版一部)。
6 质量标准:7 检验操作规程:7.1 试药与试剂:石油醚(30~60℃)、盐酸、乙酸乙酯、甲醇、菊花对照药材、绿原酸对照品、乙醇、甲苯、甲酸、冰醋酸、乙腈、磷酸、木犀草苷对照品、3,5-O-双咖啡酰基奎宁酸对照品。
7.2 仪器与用具:电子天平、烘箱、聚酰胺薄膜、三用紫外分析仪、水浴锅、展开缸、超声波清洗器、高效液相色谱仪、二氧化硫测定仪。
7.3 性状:取本品适量,自然光下目测色泽,嗅闻气味。
7.4 鉴别:7.4.1取本品制片置10×10显微镜下做显微观察。
7.4.2取本品lg,剪碎,加石油醚(30~60℃)20ml,超声处理10分钟,弃去石油醚,药渣挥干,加稀盐酸lml与乙酸乙酯50ml,超声处理30分钟,滤过,滤液蒸干,残渣加甲醇2ml使溶解,作为供试品溶液。
另取菊花对照药材lg,同法制成对照药材溶液。
再取绿原酸对照品,加乙醇制成每lml含0.5mg的溶液,作为对照品溶液。
照薄层色谱法(附录7)试验,吸取上述三种溶液各0.5~1μl,分别点于同一聚酰胺薄膜上,以甲苯-乙酸乙酯-甲酸-冰醋酸-水(1:15:1:1:2)的上层溶液为展开剂,展开,取出,晾干,置紫外光灯(365nm)下检视。
供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的荧光斑点。
7.5 检查:7.5.1水分不得过15.0% (附录15 第二法)。
7.5.2二氧化硫残留量照二氧化硫残留量测定法(附录58)测定,不得过150mg/kg。
8.6 含量测定:高效液相色谱法(附录8)测定。
色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以乙腈为流动相A,以0.1%磷酸溶液为流动相B,按下表中的规定进行梯度洗脱;检测波长为348nm。
七清败毒颗粒(半成品)内控质量标准

GMP管理文件一.目的:制定七清败毒颗粒(半成品)的内控标准,规范公司七清败毒颗粒的生产。
二.适用范围:适用于七清败毒颗粒的生产和质检。
三.责任者:生产部经理、质管部经理、检验员、各岗位操作人员。
四.正文:【名称】七清败毒颗粒【处方】黄芩100g 虎杖100 g 白头翁80 g 苦参80 g板蓝根100 g 绵马贯众100 g 大青叶40 g【制法】以上7味,加水提取2次,合并滤液,浓缩至相对密度为1.30~1.35(20℃),得清膏、糖、糊精按1:2.5:1的比例成颗粒,干燥,即得.【性状】本品为棕褐色颗粒;味苦。
【鉴别】(1)取本品研细的粉末15 g,加甲醇50ml,超声处理20分钟,滤过,滤液蒸干,残残渣加甲醇2 ml使溶解,滤过,滤液作为供试品溶液。
另取黄芩苷对照品,加甲醇制成每1 ml含1mg的溶液,作为对照品溶液。
照薄层色谱法试验,吸取上述两种溶液各5ul,分别点于同一以含4%醋酸钠的羧甲基纤维素钠溶液为黏合剂的硅胶G薄层板上,以乙酸乙酯-丁酮-甲酸-水(5:3:1:1)为展开剂,置展开缸内预饱和30分钟,展开,取出,晾干,喷以1%三氯化铁乙醇溶液。
供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点。
(2)取本品研细的粉末8g加三氯甲烷25ml,超声处理20分钟,滤过,滤液蒸干,残渣加甲醇0.5 ml使溶解,作为供试品溶液.另取虎杖对照药材0.1g,同法制成对照药材溶液.再取大黄素对照品,加甲醇制成每1ml含1mg的溶液,作为对照品溶液。
照薄层色谱法试验,吸取上述三种溶液各5ul,分别点于同一以羧甲基纤维素钠为黏合剂的硅胶G薄层板上,以甲苯-乙酸乙酯-甲酸(15:2:1)为展开剂,展开,取出,晾干,置紫外光灯(365nm)下检视。
供试品色谱中,在与对照品及对照药材色谱相应的位置上,显相同的橙黄色荧光斑点;置氨气中熏后,日光下检视,斑点变为红色。
(3)取本品研细的粉末15 g,加三氯甲烷30ml,加三氯甲烷制成每1ml各含1mg的混合溶液,作为对照品液。
香菊片半成品(片芯)内控质量标准
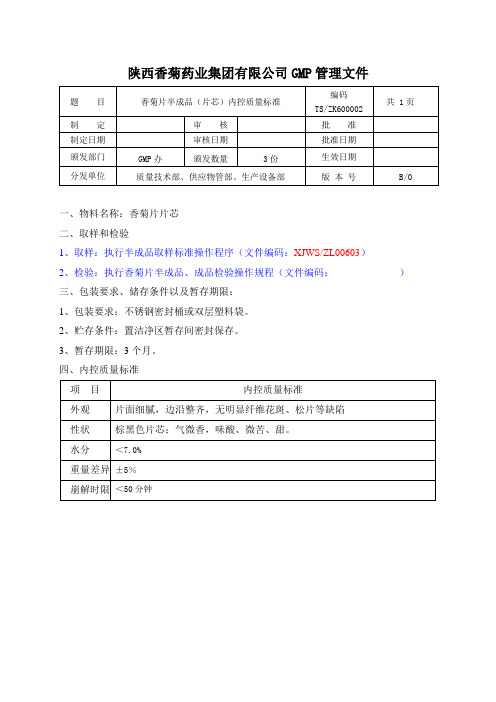
三、包装要求、储存条件以及暂存期限:
1、包装要求:不锈钢密封桶或双层塑料袋。
2、贮存条件:置洁净区暂存间密封保存。
3、暂存期限:3个月。
四、内控质量标准
项目
内控质量标准
外观
片面细腻,边沿整齐,无明显纤维花斑、松片等缺陷
性状
棕黑色片芯;气微香,味酸、微苦、甜。
陕西香菊药业集团有限公司GMP管理文件
题目
香菊片半成品(片芯)内控质量标准
编码
TS/ZK600002
共1页
制定
审核
批准
制定日期
审核日期
批准日期
颁发部门
GMP办
颁发数量
3份
生效日期
分发单位
质量技术部、供应物管部、生产设备部
版本号
B/0
一、物料名称:香菊样标准操作程序(文件编码:XJWS/ZL00603)
水分
<7.0%
重量差异
±5%
崩解时限
<50分钟
2.化妆品包材、半成品、成品检验标准

化妆品包材、半成品、成品检验标准1.0本公司制定的操作标准是为了达到体系标准所规定的要求,保证所生产的产品符合公司规定,满足客户品质要求,指导质管部、技术部如何开发、检测、改善、处理的作业指导文件。
它也是一个强制性的文件。
2.0版序控制2.1 文件编号:SOP-QC-001-002.2 文件版序:002.3 编制人/时间:体系小组/2015年11月10日2.4 审核人/时间: XXX2.5 批准人/时间: XXX2.6 文件发布日期: 2015年11月10日2.7 文件实施日期: 2015年11月10日2.8 文件管理部门:行政部3.0监控记录3.1 《产品检测报告》3.2 《原料检验报告》3.3 《原始记录表》3.4 《QA检验报告》、《IQC检验报告》、《QC巡查表》3.5 《水质检验报告》3.6 《环境卫生检测报告》3.7 《包材检验报告记录表》内控标准文件目录一.化验室内控标准(半成品、成品)1.0取样原则:半成品:按批次,每锅取一个样品。
成品:按批次取一个样品。
原料:每个批次去一个样品。
空气:室内取样纯水:纯水室内出水点取样2.0取样方法:抽样时,必须带口罩,带手套,以免污染样品。
取样瓶,不锈钢匙须用75%的酒精消毒。
送检样品,应严格保持原有的包装状态,容器不应有破裂,在检验前不得开启,以防再污染.若一个样品,须同时做多种分析,宜先取出部分样品做细菌检验,再将剩余样品作其它分析.3.0产品检验产品(半成品和成品)的检验包括理化指标检验和微生物检验。
3.1产品(半成品和成品)理化指标的标准洗发水沐浴露润肤乳液(修复液)脱毛膏3.2所有的新品都必须做耐寒/耐热试验。
3.3新产品首批(成品和半成品)都必须进行离心试验。
化验室还必须对成品的外包装进行检查。
根据QB/T1685-93《化妆品产品包装外观要求》进行检查。
4.0原料理化指标的标准参照了《原料检验标准 Q/NT-YL01-2009》。
半成品工艺控制标准

半成品工艺控制标准
1、目的和适用范围
通过检验,对半成品实行过程控制,确保质量达到规定要求。
适用于毛毯生产过程中半成品的工艺质量控制。
2、职责
质检人员负责对半成品检验抽验,并根据本标准对试验结果做出相应处置。
相关部门负责按规定要求进行停车或不合格品的处置。
3、控制内容:
3.1织造车间质量控制
3.1.1、目数:±0.5目;
3.1.2、毛长:±0.1mm;
3.1.3、坯布重量范围:±20g/m;
3.1.4坯布匹长按照工艺标准±3米。
3.2、上浆定型质量控制
3.2.1、目数:±0.5目;
3.2.2、幅宽:±3cm;
3.2.3、浆比:严格按照工艺要求执行;
3.2.4坯布重量范围:±20g/m。
3.3、拉幅烘干质量标准
3.3.1、幅宽:±3cm;
3.3.2、花长:±3cm。
3.4、整理包边质量控制
3.4.1、幅宽:±3cm;
3.4.2、花长:±5cm;
备注:1、半成品外观质量标准执行«毛毯产品质量标准»
毛毯事业部。
中药饮片中间产品待包装产品成品质量检查管理规程

文件制修订记录1.0目的:建立中间产品、待包装产品、成品质量检查管理规程,规范对上述产成品质量检查和判断。
2.0范围:适用于所有中药饮片中间产品、待包装产品及成品包装操作的质量检查。
3.0责任:3.1各工序及岗位班组长为中间产品、待包装产品、成品质量的第一责任人,按规定的工艺规程和操作规程组织生产外,按本文件规定对本工序及岗位的中间产品、待包装产品、成品质量进行检查。
3.2生产主管负责本文件在车间的培训与执行监督。
3.3 QA现场监控员按本文件规定对中间产品、待包装产品、成品质量进行检查,填写“中间产品放行审核记录”,负责其放行工作等。
3.4 上述制成品质量异常和生产偏差由生产管理部和质量管理部进行调查与处理。
4.0内容与程序:4.1 制成品外观要求4.2.1片形:切制后的饮片应均匀、整齐,无整体,无长梗,无连刀片、掉刀片、边缘卷曲等不合规格的饮片异型片。
片形的大小和厚薄应以国家中药饮片炮制规范的要求为准。
4.2.2 异型片分类极薄片(厚度0.5mm以下):异型片为超过该品种标准厚度0.5mm的饮片;薄片(厚度1-2mm)、厚片(厚度2-4mm)、细丝(宽度2-3mm):异型片为超过该标准1mm的饮片;短段(长度5-10mm)、长段(长度10-15mm)、块(边长8-12mm立方块或长方块)、宽丝(宽度5-10mm):异型片为超过该标准2mm的饮片;饮片粉末应粉粒均匀,无杂质,粉末的分等应符合药典要求;一些不宜切制的饮片,经挑选整理或水处理后,用手工或机器粉碎成碎块颗粒,便于煎煮或调剂。
碎块的大小应按照具体品种炮制规范要求。
4.2.3 异型片、药屑和杂质限度净制、切制饮片的异型片、药屑和杂质限度应符合下表要求样后拣出其中杂质,再过指定目数筛,合计杂质和药屑称重计算。
4.3 饮片色泽要求炮制饮片为净制、切制后经炮制的饮片,其片型、药屑杂质应符合4.2.3的规定,同时饮片色泽还应符合下表色泽要求。
的饮片,称重计算。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
三、包装要求、储存条件以及暂存期限:
1、包装要求:塑筐或纸箱。
2、贮存条件:置一般区暂存间,密封、防潮、防尘。
3、暂存期限:3个月。
四、内控质量标准
项目
内控质量标准
微生物限度
需氧菌总数:≤g
霉菌、酵母菌总数:≤102cfu/g
大肠埃希菌:不得检出
陕西香菊药业集团有限公司GMP管理文件
题目
香菊片半成品(内包工序)内控质量标准
编码
TS/ZK600105
共1页
制定
审核
批准
制定日期
审核日期
批准日期
颁发部门
GMP办
颁发数量
3份
生效日期
分发单位
质量技术部、供应物管部、生产设备部
版本号
B/0
一、物料名称:香菊片内包半成品(内包工序)
二、取样和检验
1、取样:执行半成品取样标准操作程序(文件编码:XJWS/ZL00603)
