水溶液电解和熔盐电解资料PPT课件
合集下载
电解原理电解食盐水(课件PPT)

工具
第一章 化学反应与能量转化
(3)阴离子放电顺序:阳极上,阴离子失去电子,阴离子失 电子的能力越强,越先放电。常见阴离子的放电顺序为:
工具
第一章 化学反应与能量转化
2.电极反应式的书写 (1)确定电极:与电源正极相连的为阳极,与电源负极相连 的为阴极。 (2)剖析溶液:确定电解质溶液中存在的所有阴、阳离子。 (3)确定放电离子:依据阴、阳离子的放电顺序,确定阴、 阳极上放电离子。 (4)写出电极反应式,并调整得、失电子数相等。
工具
第一章 化学反应与能量转化
用Pt电极电解足量AgNO3溶液 (1)写出电极反应式: 阴极________________;阳极______________。 (2) 电 解 离 子 方 程 式 ________________________________ ________________________________________。
工具
第一章 化学反应与能量转化
3.以石墨为电极,电解熔融氯化钠时: (1)与电源负极相连的电极为电解池的________极,与电源 正极相连的电极为电解池的________极。 (2)写出两电极反应式: 阴极:________________________________, 阳极:________________________________。 (3)写出电解反应方程式:________________________。 (4)电解时,Na+、Cl-如何发生定向移动? _____________________________________________。
工具
第一章 化学反应与能量转化
②电极反应
在电极上进行的 电子的转移 。
半反应 ,它可以表示电极上物质变化和
现代无机合成化学-电解合成

熔盐在无机合成中的应用
• 合成新材料; • 非金属元素的制取; • 氟化物的合成; • 非常规价态化合物的合成;
熔盐在冶金中的应用
• 在电解过程中作为电解质; • 在热还原过程中作为助溶剂; • 各种熔盐制备与处理工艺。
熔盐在能源领域及太阳能领域中 的应用
• 用于金属铀、钍、钚及其它锕系元素的制备;
(可能)由于表面吸附抑制晶核长大而促进新晶核生成;
• 金属离子的配位作用 —— 添加配合物有助于改善产物
沉积状态。
电解装置
1. 阳极
电解提纯:阳极为目标产物的粗制品; 电解提取:使用不溶性阳极。
2. 阴极:
1. 能够高效回收所析出的金属; 2. 面积大于阳极(10 ~ 20 %);
3. 隔膜:用于分隔阳极与阴极。
阳极反应获得目标产物。
具有极强氧化性的物质 —— O3,OF2,等等;
• 应用 普通方法难于合成的高价态化合物 —— 三价Ag,Cu,等等;
特殊高价元素的化合物 —— 过二硫酸,过二硫酸盐,H2O2, 等等。
• 注:所得产物均具有强氧化性,反应活性高且不稳定,应
注意选择电解设备、材质和反应条件。
电还原合成
E槽=E可逆 + ∆E不可逆 + IR1 + IR2
6.1 水溶液中的电解
• 金属电沉积:是指在电场作
用下,金属从电解质中以晶
体形式析出的过程,又称电 结晶。
电解精炼
电镀
电沉积 电提取
要求沉积金属与基体结合牢 固,结构致密,厚度均匀
反应目的
• 获得不易购买的特殊金属; • 比市售品纯度更高的金属; • 粉状或其它特殊形状和性能的金属; • 由废料中回收金属。
水溶液(18张PPT)-精品课件

• 3、Patience is bitter, but its fruit is sweet. (Jean Jacques Rousseau , French thinker)忍耐是痛苦的,但它的果实是甜蜜的。10:516.17.202110:516.17.202110:5110:51:196.17.202110:516.17.2021
交流探究 2
H2O
H++OH- △H>0
对常温下的纯水进行下列操作:
条件
水的电离平 水的电 溶液 衡移动方向 离程度 中[H+]
溶液中 [OH-]
Kw [H+]、[OH-]浓
度大小关系
加热
正向
增大 增大 增大 增大 [H+]=[OH-]
加HCl 逆向 减小 增大 减小 不变 [H+]>[OH-]
加NaOH 逆向 减小 减小 增大 不变 [H+]<[OH-]
•
15、一年之计,莫如树谷;十年之计 ,莫如 树木; 终身之 计,莫 如树人 。2021年8月2021/8/112021/8/112021/8/118/11/2021
•
16、提出一个问题往往比解决一个更 重要。 因为解 决问题 也许仅 是一个 数学上 或实验 上的技 能而已 ,而提 出新的 问题, 却需要 有创造 性的想 像力, 而且标 志着科 学的真 正进步 。2021/8/112021/8/11August 11, 2021
[H+] = 1×10-13mol·L-。1
二、电解质在水溶液中的存在形态
观察实验并思考
1、 以上电解质溶液的导电能力有所 不同的原因是什么? 2 、氯化氢、醋酸等电解质在溶于水的 过程中发生了哪些变化? 3、它们最终以何种形态存在?
水溶液电解和熔盐电解资料课件

电解池的设计要点
选择适当的电解液
根据所需的电解反应,选择适合的电解液。
确定电极材料
电极材料的性质会影响电解效率,因此需要 选择合适的电极材料。
优化电流密度
电流密度过高或过低都会影响电解效率,因 此需要优化电流密度。
考虑温度和压力条件
温度和压力的变化可能会影响电解反应的进 行,因此需要考虑这些因素。
01
02
避免接触熔盐和其他危 险物质,防止烫伤和中 毒。
03
04
操作时必须穿戴防护用 品,如防护服、手套、 口罩等。
注意通风排气,防止气液电解与熔盐电解的比较
工艺特点的比较
水溶液电解
1
2
以水溶液为电解质,通过电解作用将水溶液中的 金属离子还原成金属态。
3
应用领域的比较
水溶液电解
01
02
广泛应用于金属冶炼、电池制造等领域。
例如,电解铜、电解铝等。
03
04
熔盐电解
主要应用于高温熔盐体系下的金属冶炼过 程。
05
06
例如,用于生产钠、钾、锂等轻金属。
优缺点的比较
水溶液电解
优点:工艺成熟,操作简便 ,适用于多种金属的冶炼和
电池制造。
缺点:能量密度较低,电解 过程中需要大量冷却水。
阳极和阴极
02
阳极是连接电源正极的电极,而阴极是连接电源负极的电极。
导线和电解液
03
导线连接电源和电极,而电解液则作为反应的媒介。
电解池的工作原理
电化学反应
在电解池中,电流通过电解液,在阳极和阴极上发生氧化还原反 应。
离子传输
在电流的作用下,电解液中的离子会向阳极和阴极迁移。
产物生成
熔盐电解

4、表面张力 • 熔融电解质在电极表面的润湿性,对熔盐电解时的两大特殊现
象,即金属的溶解和阳极效应都有很大影响。气-液-固三相界 面上的润湿角(又称接触角)θ ,是由杨氏方程决定的,即
cos g / s
e/s
e/g
式中,
— 气相与固相的表面张力 g/s
— 熔融电解质与固相的表面张力 e/s
• 如发生阳极效应,要及时添加氧化铝,还可以将 铝液泼在阳极上,使阳极和阴极短路。
熔盐电解
1 概述 2 熔盐电解电化学基础 3 铝电解 4 熔盐电解制取高熔点金属、
合金和半导体
1 概述
• 熔盐电解一电化学方法可以制取电极电位 最负的金属(锂)和电极电位最正的非金 属(氟)。
• 熔盐电解生产铝,产量仅次于钢铁、居世 界金属产量第二位。
• 此外,还可以进行电解制取稀土、高熔点 金属、合金和半导体。
随Al2O3的含量增大而减小。
六、生产控制 1、电解液的组成、浓度
• 常见的添加剂有以下几种: • CaF2,可降低电解质的初晶点,增大电解质的铝
液界面的表面张力。
• MgF2,也可降低电解质的初晶点,并减少电解质 对碳电极的润湿性,有利于碳渣和电解质的分离, 减少电解质向碳电极内部的渗透。
• NaCl,可降低电解质的初晶点,提高电导率,但 腐蚀性强。
(1)熔点
有冰晶石和氧化铝 组成的二元系是简 单的共晶系,从图 中可以确定其共晶 点在氧化铝含量为 10~11.5%(质量 比)或 18.6~21.1%(摩 尔比)
• 铝电解的电解质往往在上述二元合金中还
加入AlF3,因而形成三元系,不仅使熔点降 低,还可以改善电解质的物理化学性质。
• (2)表面张力 • Na3AlF6-Al2O3熔盐在碳电极上的润湿角θ
熔盐电解PPT)

实验结果与讨论
SiO2还原电压:-1.25V 氧还原电压:-0.5V
(a)
SiO2:0.1M
(b)
实验结果与讨论
SiO2还原电压:-1.25V 氧还原电压:-0.45V
SiO2:0.15M
实验结果与讨论
SiO2还原电压:-0.75V 氧还原电压:-0.5V
SiO2:0.2M
实验结果与讨论
SiO2还原电压:-0.9V 氧还原电压:-0.3V
氙气光源
光响应电流 密度曲线
实验结果与讨论
❖ 光电性能检测
用-2.5V恒电位制得的硅膜试样与商业p-type多晶硅片 进行比较。
蓝色-制得的p型硅膜
红色-商业p型硅膜
实验结果与讨论
❖ SEM检测
-2.5V条件下制得的硅膜厚 度平均在10μm左右,相对 致密
-2.4V条件下制得的硅膜厚 度平均在22μm左右,相对 疏松
❖ 然而,银是比较昂贵的金属材料,寻找一种相对廉价的阴极 基体材料也势在必行。因此,本实验提出采用廉价的石墨片 为基体进行p-型硅膜的制备。
选题意义及研究内容
纳米SiO2加入到CaCl2熔盐中后, 高温条件下进行布朗运动。
碰撞到阴极,在电场的作用下失 去氧离子被还原。
硅原子形成吸附原子进入基体材 料晶格或形成新的晶核。
电位在-0.5V-0.5V有两 个还原电流峰出现,根据热 力学原理、实际的情况可以 判断在更负的电位处还原电 流为氧的还原所致。
氯化钙 800℃ 预电解(1.0V,0.5h)
实验结果与讨论
❖ 电化学测试实验
SiO2 浓度
0.1M 0.15M 0.2M 0.25M 0.3M 0.35M 0.4M 0.5M
3.4水溶液电解和熔盐电解

熔盐电解
电化次序
熔盐电解基本上可以运用水溶液电化学热力学的方法, 但也遇到一些问题: 1.难以建立一个通用的电位序,各种熔盐在不同的 溶剂中可能有不同的电位序;
2.由于熔盐的温度高,温度变化区间大,因此电极 电位的变化范围大,甚至导致相互位置的变化;
3.由于以上两个困难,熔盐中电极电位的测量也比 较困难,缺乏通用的参比电极,因而不易确定共同的电 极电位标度。
熔盐电解
溶剂 温度/℃ 电位序
单独的氟化物
NaF - KF Na3AlF6 单独的氯化物 LiCl - KCl NaCl - KCl 单独的溴化物 单独的碘化物
1000
1000 850 800 450 700 700 700
Ba,Sr,Ca,Na,K,Mg,Li,Al,Mn,Cr,Ca,Ni,Fe,Cu,Ag
0 Ar Kr Xe Rn
金属电沉积
法拉第定律
1、通电与电解质溶液后,在电极上发生化学反应 的物质的量与通入电量成正比; 2、若将几个相同的电解池串联,通入一定电量, 在各个电解池的同号电极上发生反应的物质的量等同, 电极上析出的物质的质量与其摩尔质量成正比。
金属电沉积
法拉第定律
通过电量为Q时,电沉积出该金属的物质的量为:
熔盐电解
电导率
熔盐的电导率关系到电解槽中的欧姆压降、槽压、 以及能耗的高低。通常力求增加其电导率,降低槽压及 能耗。 电解质的组成、结构、离子的特性(荷电及在电场 中运动速度)、熔盐的温度等都会影响熔盐的电导率。
熔盐电解
蒸汽压
熔盐蒸汽压的大小对于实际工业生产也有一定的意 义。蒸汽压高,熔盐愈易挥发,电解损失大,还造成车 间环境污染,不利于生产。 实践表明,各种盐的蒸气压各不相同,具有离子键 的盐,常具有较低的蒸气压,沸点很高;而具有共价键 盐的蒸气压通常比较高,沸点较低。
电解原理实用ppt人教版
电解原理实用ppt人教版(优秀课件)
电解原理实用ppt人教版(优秀课件)
5.某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、
无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用
铅笔在滤纸上写字会出现红色字迹。则下列叙述正确的是( D )
A.铅笔端作阳极,发生还原反应 B.铂片端作阴极,发生氧化反应 C.铅笔端有少量的氯气产生 D.a点是负极,b点是正极
(1)通入氢气的电极为__负__极____(填“正极”或“负极”),负极的电极 反应式为: H2-2e-+2OH-===2H2O 。 (2)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜 溶液浓度将___减__小___(填“增大”“减小”或“不变”)。
电解原理实用ppt人教版(优秀课件)
电解原理实用ppt人教版(优秀课件)
课堂巩固
4.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质, 可用电解法制备高纯度的镍,下列叙述正确的是( D )
(已知氧化性:Fe2+<Ni2+<Cu2+) A.阳极发生还原反应,其电极反应式: Ni2+ + 2e— = Ni B.电解过程中,阳极质量的减少与阴极质量的增加相等 C.电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+ D.电解后,电解槽底部的阳极泥中只有Cu和Pt
Ag、Au
电解原理实用ppt人教版(优秀课件)
电解原理实用ppt人教版(优秀课件)
3.电解精炼铜
电解原理实用ppt人教版(优秀课件)
镍铁精炼炉
铜精炼阳极炉车间
电解原理实用ppt人教版(优秀课件)
4.电冶金
(1)金属冶炼的本质: 使矿石中的金属离子获得电子,从它们 的化合物中还原出来,电解法用于冶炼 活泼金属冶炼钠、钙、镁、铝这些金属
电解原理的应用化学课件PPT

64.伟大的事业不是靠力气、速度和身体的敏捷完成的,而是靠性格、意志和知识的力量完成的。 39.生活的道路一旦选定,就要勇敢地走到底,决不回头。 93.选对事业可以成就一生,选对朋友可以智能一生,选对环境可以快乐一生,选对伴侣可以幸福一生,选对生活方式可以健康一生。
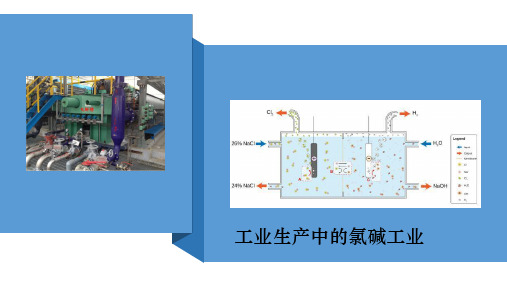
2H2O + 2NaCl = H2↑ + Cl2↑ + 2NaOH
上述装置的弱点:
1.H2和Cl2 混合不安全 2.Cl2会和NaOH反应,会使得到的 NaOH不纯
淡盐水
阳极 金属钛网
Cl2 +
Cl2
H2 -
H+ Na+
NaOH溶液
阴极 碳钢网
Cl—
OH—
阴
阳
极
极
室
室 精制饱和
离子交换膜
NaCl溶液
阴极:
无论是惰性电极还是活性电极都不参与电极反应,发生反应的 是溶液中的阳离子。阳离子在阴极上放电顺序是:
Ag+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+>
Al3+>Mg2+>Na+>Ca+>K+
放电
Hale Waihona Puke 放电由易到难顺序1、以石墨作电极分别电解下列溶液,在阴 极不能得到氢气的是( B) A. Na2SO4 B. AgNO3 C. NaCl D. NaOH
H2O(含少量NaOH)
1、生产设备名称:离子交换膜电解槽 阳极:金属钛网(涂钛钌氧化物) 阴极:碳钢网(有镍涂层) 阳离子交换膜:只允许阳离子通过,把电解
2H2O + 2NaCl = H2↑ + Cl2↑ + 2NaOH
上述装置的弱点:
1.H2和Cl2 混合不安全 2.Cl2会和NaOH反应,会使得到的 NaOH不纯
淡盐水
阳极 金属钛网
Cl2 +
Cl2
H2 -
H+ Na+
NaOH溶液
阴极 碳钢网
Cl—
OH—
阴
阳
极
极
室
室 精制饱和
离子交换膜
NaCl溶液
阴极:
无论是惰性电极还是活性电极都不参与电极反应,发生反应的 是溶液中的阳离子。阳离子在阴极上放电顺序是:
Ag+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+>
Al3+>Mg2+>Na+>Ca+>K+
放电
Hale Waihona Puke 放电由易到难顺序1、以石墨作电极分别电解下列溶液,在阴 极不能得到氢气的是( B) A. Na2SO4 B. AgNO3 C. NaCl D. NaOH
H2O(含少量NaOH)
1、生产设备名称:离子交换膜电解槽 阳极:金属钛网(涂钛钌氧化物) 阴极:碳钢网(有镍涂层) 阳离子交换膜:只允许阳离子通过,把电解
第五章 熔盐电解

3、电导率
• 4、粘度(1~10×10-3Pa.s) • 粘度与电导率如下近似关系 k 常数
k 1.8 ~ 2.8, 取决于电解质与温度。 • 5、表面张力
• 熔融电解质在电极表面的润湿性,对熔盐电解时 的两大特殊现象,即金属的溶解和阳极效应都有 很大影响。气-液-固三相界面上的润湿角(又称 接触角)θ ,是由杨氏方程决定的,即
4.3.2 室温电解铝
• 室温离子液体是由特定的阳离子和阴离子组成在室温或近 于室温下呈液态的离子化合物,又称室温熔盐。 • 在这种液体中只存在离子,没有中性分子。我们通常所知 的离子化合物在室温下一般都是固体,强大的离子键使阴、 阳离子在晶格上只能作振动,不能转动或平动,阴阳离子 之间的作用(即离子键)较强,一般具有较高的熔、沸点和 硬度如:NaCI,阴阳离子半径相似,在晶体中做最有效的紧 密堆积,每个离子只能在晶格点阵中做振动或有限的摆动, 熔点为1074.15K,由此看来离子液体通常应该在高温下存 在。
cos
g/s
e/s
e/ g
式中,
g/s
— 气相与固相的表面张力 — 熔融电解质与固相的表 面张力 — 熔融电解质与气相的表 面张力
e/s
e/g
当 g / s e / s 时,表示熔融电解质在 电极表面润湿良好; 当 g / s e / s 时,表示熔融电解质在 电极表面不润湿。
• 影响金属溶解的因素很多,应视金属和熔盐的性 质而定,一般来说,存在以下规律: • (1)温度上升时,金属溶解增加; • (2)同一金属在卤化物中的溶解度按氟化物、氯 化物、溴化物、碘化物的顺序增加; • (3)对于同一族金属,随着原子半径增加,溶解 度提高; • (4)当金属和熔盐的界面张力增加时,金属的溶 解度较小; • (5)在熔盐中加入电位更负的局外阳离子可减小 金属的溶解度。
相关主题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
6
金属电沉积
金属的电沉积步骤:
1.金属离子向电极表面的传质步骤; 2.金属离子在电极表面去水化、吸附等表面转化步骤; 3.金属离子在电极表面得到电子还原生成金属原子的电 化学反应步骤;
2020年9月28日
7
金属电沉积
金属的电沉积步骤:
4.金属原子结晶形成金属晶体的新相生产步骤; 5.金属原子向金属固体内部扩散的固相扩散步骤; 6.比较复杂的反应产物,在电极表面还可能进行分解、 复合、歧化、脱附等后续表面转化步骤。
2020年9月28日
5
金属电沉积
法拉第定律
通过电量为Q时,电沉积出该金属的物质的量为:
n = Q/zF 所沉积出该金属的质量为:
m = QM/zF
式中z是出现在电极反应式中的电子计量系数;F为法拉
第常数,表示1mol质子的电荷,F M为析出物的原子量。
=
NAe
=96500
C·mol-1;
2020年9月28日
电解用隔膜材料 石棉板 烧磁板 合成高分子材料 棉布 耐腐蚀条件 中性碱性 酸性中性 酸性中性碱性 中性
可将阴极制成直径10cm-20cm的圆筒状曲面,用削刮器 搜刮捕集金属粉末。
2020年9月28日
17
金属电沉积
金属电沉积装置
电解有时必须将阳极和阴极用隔膜隔开,选用隔膜的要 求:不被电解液所侵蚀,有适当的孔隙度、厚度、透过 系数、电阻以及ζ电位,有适当的机械强度等性能。
工业上常用的隔膜材料及使用条件
无光如法滑从黏。Ag附NO。3溶当液加电入解CNA-,g时用,A沉g(C积N)物2电由解大时晶,体沉组积成物,坚经固常
因此,电解Au、Cu、Zn、Cd等均用含氰电解液,其他金 属沉积物往往也加入配合物改进沉积物的状态。
2020年9月28日
12
金属电沉积
电流密度
电流密度低时,离子放电速度慢,晶核生长有充分的时 间,而不去形成新核。当电解液浓度大、温度高时,能 生成大的晶状沉淀物。 电流密度较高时,电解析出速度加快,晶体来不及排列 生长,促进核的生成,从而生成微晶,沉淀物是十分细 的晶粒或粉末状。 电流密度很高时,晶体多半趋于金属离子密集那边生长, 晶在体极呈板树上枝形状成或斑团点粒,状并。且同由时于p,H高值电局流部密增度高导而致沉H淀2析出出氢, 氧化物或碱式盐。
2020年9月28日
8
金属电沉积
电解液的组成及浓度 电金流属密电度沉积 的影响因素 温度
2020年9月28日
9
金属电沉积
电解液组成及浓度
➢含有一定浓度的欲得金属的离子且性质稳定 ➢电导性能好 ➢具有适于在阴极析出金属的pH值 ➢能出现金属收率好的电沉积状态 ➢尽可能少地产生有毒和有害气体
2020年9月28日
六 Cs Ba La Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn
水溶液中可能 氰化物溶液中可以电沉
电沉积出来
积出来
2020年9月28日
4
金属电沉积
法拉第定律
1、通电与电解质溶液后,在电极上发生化学反应的物 质的量与通入电量成正比;
2、若将几个相同的电解池串联,通入一定电量,在各 个电解池的同号电极上发生反应的物质的量等同,电极 上析出的物质的质量与其摩尔质量成正比。
板框压滤机式电解槽
2020年9月28日
15
金属电沉积
金属电沉积装置
电极材料的选用,首先要考虑电极不应被电解液及电解
产物所腐蚀,不污染产物。阳极为提纯金属的粗制品, 根据电解条件做成适当大小和形状。
不溶性阳极材料及其使用条件
阳极材料
使用环境
最大电流密度 /(A/cm2)
备注
铂
酸性、碱性
100
石墨
酸性、碱性 酸性、中性
2020年9月28日
2
金属电沉积
金属电沉积的目的:
➢获得在市场上难以得到的特殊金属 ➢获得比市售品更高纯度的金属 ➢制备粉状或其他具有特别形状和性能的金属 ➢由实验室和其他废物中回收金属 ➢对工业水法冶金进行基础研究
2离子在阴极电沉积可能性
金属离子在阴极电沉积的次序决定于金属离子的活度、 溶液pH值、金属离子在溶液中存在的形态、析出金属的 形态以及溶剂种类、溶液成分等多种因素。
10
金属电沉积
电解液组成及浓度
电解液中加入少量的有机质添加剂如糖、樟脑,明胶等 可使沉积物晶态由粗晶粒变细晶粒,同时使金属表面光 滑。
这可能是由于添加剂被晶体表面吸附并覆盖住晶体,抑 制晶核生长而促进新晶核的生成,导致细晶粒沉积。
2020年9月28日
11
金属电沉积
电解液组成及浓度
当简单的金属盐溶液电解时,往往得不到理想的沉积物。 加入络合剂可改善沉积物的状态。
金属离子还原可能性规律
ⅠA ⅡA ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB ⅢA ⅣA ⅤA ⅥA ⅦA 0
三 Na Mg
Al Si P S Cl Ar
四 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr
五 Rb Sr Y Zr Nb Mo Tc Ru Rh Pb Ag Cd In Sn Sb Te I Xe
水溶液电解和 熔盐电解
材料工程 杨浩田
160
2020年9月28日
1
金属电沉积
水溶液中金属的电沉积:通过水溶液电解法,金属离子 在电流的作用下在阴极还原并沉积为金属的过程。 金属电沉积的原料供给方法可分为两类: 1、用粗金属为原料作阳极进行电解,在阴极获得纯金 属的电解提纯法。 2、以金属化合物为原料,以不溶性阳极进行电解的电 解提纯法。
10 5
在F中受侵蚀 少量被侵蚀
铅银(%)合金 酸性、中性
8
镍
碱性
20
铜
碱性
10
较镍易受侵蚀
2020年9月28日
16
金属电沉积
金属电沉积装置
阴极一般要使用其面积比阳极面积大一圈的电极。
如果沉积金属状态致密且光滑,可用平板阴极,当其沉 积到一定厚度后,将其剥下。
如沉积物为粗糙、树枝状、针状、粉状或海绵状时,可 在电解过程中连续或间歇地刮下,或连续地加以敲击振 动,使沉积物落于下方。
2020年9月28日
13
金属电沉积
温度
温度的影响不尽相同,因为提升温度的同时可能产生对 立影响。
如提高温度有利于阴极的扩散并使电沉积均匀,但同时 也有利于加快成核速率使沉积粗糙。 此如带果来氢的的影超响电也压比降较低突,出使。得提高温度时易使H2溢出,由
2020年9月28日
14
金属电沉积
金属电沉积装置:由阳极、阴极和隔膜构成的电解槽。
