药物不良反应控制流程图
严重药品不良反应事件报告处置流程图

药学部临床药学室
市食品药品 监督管理局
医务处 市卫生局
组织临床、医技科室相关 专家,发现严重ADR科室 的相关人员及临床药师
调查分析评价
严重药品不良反应/事件、药害事件报告处置流程
发现药品严重可疑不良反应/ 事件或药害事件的医护人员
立即报告科室负 责人
通知药学部质控组长
临床科室保存相关药品和物品 留样,同时报医务处投诉中心积极组织临床救治,做 医疗记录通知药学部质控药师
填 写 《药品不良反应/时间报告表》 《省药品不良反应/事件现场核查记录》 《已使用药品情况调查表》
药物过敏反应和处理流程图ppt课件

二、若为一般过敏反应,情况好转者可继续观察并 做好记录。
三、患者在注射或输液时发生反应,如心悸、胸闷、 呼吸困难、寒战、面色苍白、皮疹、发热等,就 地抢救,必要时行心肺复苏。
四、出现休克者,行抗休克治疗 五、记录患者生命体征、一般情况和抢救过程。 六、及时报告药剂科、护理部。 七、患者家属有异议时,立即按有关程序对输液器
药物过敏反应和处理流程图
药物不良反应案例
左氧氟沙星注射剂的严重不良反应
药物相互作用(接上页)
静滴后患者出现乏力、静默、四肢抽搐,呈强直后阵挛,伴胸闷、呼 吸困难、气促,无意识障碍、呕吐,无二便失禁、唇周发绀。即到抢 救中心治疗,查血常规、肾功能、心肌酶、电解质等均未见异常,体 温36.7℃,脉搏125 次/分,呼吸20 次/分,血压158/68 mmHg,予吸氧 并静滴0.9%氯化钠注射液500 ml、维生素C注射液3 g;静推地西泮注射 液10 mg;肌注盐酸苯海拉明注射液20 mg。后胸闷缓解,四肢仍强直, 遂转入内科住院部接受进一步治疗。经治疗,患者痊愈。
上报护理部、医疗事务部
药物过敏反应和处理流程图
青霉素过敏性休克的临床表现
呼吸道阻塞症状: 胸闷、气促、哮喘及呼吸困 难,伴濒死感
循环衰竭症状: 面色苍白,出冷汗、发绀,脉 搏细弱,血压下降
中枢神经系统症状:面部及四肢麻木,意识丧失, 抽搐或大小便失禁
其他过敏反应表现:可有荨麻疹,恶心、呕吐、 腹痛与腹泻等
药物过敏反应和处理流程图
患者发生输液反应的处理流程
患者发生输液反应
立即停止输液、更换液体和输 液器, 以生理盐水维持静脉 通道,保留余液及输液用具
报告医生、护士长
药物过敏反应和处理流程图

其他过敏反应表现:可有荨麻疹,恶心、呕吐、 腹痛与腹泻等
其中以呼吸道阻塞症状和皮肤过敏症状最早出现
青霉素过敏性休克的抢救措施
〔1立即停药,患者就地平卧,进行急救. 〔2立即皮下注射0.1%盐酸肾上腺素1ml.小儿酌减,症
状如不缓解,可每隔30分钟皮下或静脉注射0.5ml直 至脱离危险期. 〔3改善缺氧症状,给予氧气吸入.呼吸受抑制时,应立即 进行口对口的人工呼吸,并肌肉注射尼克刹米或山梗 菜碱等呼吸兴奋剂.喉头水肿影响呼吸时应立即进行 气管插管或配合施行气管切开术. 〔4根据医嘱用药:地塞米松5--10mg静脉推注或氢化 可的松200mg加5--10%葡萄糖50ml静脉滴注.其他根 据病情给予血管活性药物,纠正酸中毒和抗组胺类药 物. 〔5心跳骤停处理.立即行胸外心脏按压,同时施行人工 呼吸
药物不良反应案例
左氧氟沙星注射剂的严重不良反应 过敏反应
病例 患者,女,25岁,因肺部感染接受静脉滴 注盐酸左氧氟沙星氯化钠注射液100 ml,25滴 /分,10分钟后患者自诉胃部不适,四肢麻木感, 恶心无呕吐,面色苍白,冷汗.立即停止输液,给 予吸氧,平卧位,测量血压60/30mmHg,脉搏48 次/分,呼吸24 次/分.给予盐酸异丙嗪25 mg
药物的不良反应
药物不良反应的定义
药物不良反应〔ADR> 指正常剂量的药物用于预防、诊断、
治疗疾病或调节生理机能时出现的 与用药目的无关的有害反应.
——WHO国际药 物监测合作中心
药物不良反应应急预案
一、应严格适应症,出现不良反应停药报告医生并遵 医嘱处理.
二、若为一般过敏反应,情况好转者可继续观察并做 好记录.
三、患者在注射或输液时发生反应,如心悸、胸闷、 呼吸困难、寒战、面色苍白、皮疹、发热等,就地 抢救,必要时行心肺复苏.
对比剂不良反应处理流程图
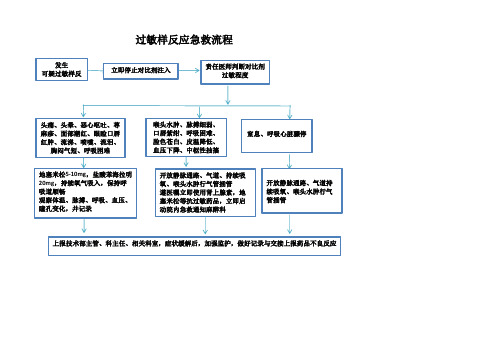
立即停止对比剂注入
责任医师判断对比剂 过敏程度
头痛、头晕、恶心呕吐、荨 麻疹、面部潮红、眼睑口唇 红肿、流涕、喷嚏、流泪、
胸闷气短、呼吸困难
地塞米松5-10mg,盐酸苯海拉明 20mg,持续氧气吸入,保持呼 吸道顺畅 观察体温、脉搏、呼吸、血压、 瞳孔变化,并记录
喉头水肿、脉搏细弱、 口唇紫绀、呼吸困难、 脸色苍白、皮温降低、 血压下降、中枢性抽搐
窒息、呼吸心脏骤停
开放静脉通路、气道、持续吸 氧、喉头水肿行气管插管 遵医嘱立即使用肾上腺素,地 塞米松等抗过敏药品,立即启 动院内急救通知麻醉科
开放静脉通路、气道持 续吸氧、喉头水肿行气 管插管
上报技术部主管、科主任、相关科室,症状缓解后,加强监护,做好记录与交接上报药品不良反应
药品不良反应监测报告制度含流程图

药品不良反应监测报告制度含流程图药品和医疗器械的安全监管至关重要,为确保人体用药安全有效,我们制定了药品及医疗器械不良反应监测报告制度和流程。
根据《中华人民共和国药品管理法》及《药品不良反应监测与报告管理办法》,各临床科室主任为药品和医疗器械不良反应监测工作的管理人员,医务科、药房负责全院药品不良反应的监测、收集、报告管理工作。
药品和医疗器械不良反应报告的范围为药品和医疗器械引起的所有可疑不良反应。
当发现可疑药品不良反应时,各岗位(医生、护士、药师)应立即向科主任汇报,并填写《药品不良反应/事件报告表》(见附表),逐级上报至医院药品和医疗器械不良反应监测员(医务科、药房)。
对于新的、严重的不良反应应积极救治患者,保存好相关药品、物品的留样,并分析查找问题,将损害降至最低。
当发现可疑药品和医疗器械不良反应群体病例时,应积极救治患者,迅速开展临床调查,分析事件发生的原因,必要时可采取暂停药品的使用等紧急措施,并立即向当地药品监督管理部门报告,同时填写《药品群体不良事件基本信息表》(见附表3)。
发现药品和医疗器械说明书中未载明的可疑严重不良反应病例应在15日内报告,其中死亡病例须立即报告。
其他药品不良反应应在30日内报告,有随访信息的应及时报告。
对于非本院所使用的药品引起的可疑药品不良反应,发现者可直接向当地药品监督管理部门报告。
经核实确认某批号药品发现不良反应或药品监督管理部门已确认有药品不良反应的药品,单位药品质量负责人应立即通知仓库管理员,停止该批号药品发出,就地封存,并及时追回已发出的药品等紧急控制措施。
未经当地药品监督管理部门允许的药品不良反应监测资料,任何单位和个人不得向国内外机构、组织、学术团体或个人提供。
对新发现的、严重的药品和医疗器械不良反应应进行重点监测,进一步了解药品的临床使用和不良反应发生情况,研究不良反应的发生特征、严重程度、发生率等,开展的药品安全性监测活动。
