通用版2018_2019版高中化学第二章化学反应速率和化学平衡第四节化学反应进行的方向
化学反应速率和化学平衡

化学反应速率和化学平衡化学反应速率是指化学反应在单位时间内发生的变化量。
它是反应过程中物质转化的快慢程度的量化描述。
化学平衡是指当化学反应达到稳定状态时,反应物和生成物浓度之间的比例关系保持不变的状态。
反应速率和化学平衡是化学反应中两个重要的概念,它们对于我们理解和控制化学反应过程具有重要的意义。
一、化学反应速率化学反应速率的定义是单位时间内反应物消耗量或产物生成量与时间的比值。
它可以用下面的公式来表示:速率= ΔC/Δt其中,ΔC表示反应物浓度或产物浓度的变化量,Δt表示变化所用的时间。
化学反应速率受到多种因素的影响,其中最主要的有反应物浓度、温度、催化剂和反应物粒子间的碰撞频率等。
当反应物浓度增加时,反应发生的可能性就会增加,因此反应速率也会增大。
温度对于反应速率的影响很大,一般来说,温度升高时,反应速率会迅速增加。
这是因为温度升高会增加反应物的动能,提高粒子的碰撞频率,从而促进反应的进行。
催化剂是一种物质,它可以降低反应的活化能,使反应发生更容易。
催化剂通过提供一个新的反应路径,使反应能够以更低的能量发生。
因此,加入适量的催化剂可以大大加快反应速率。
此外,反应物粒子间的碰撞频率也会影响反应速率。
当反应物的浓度较低时,粒子之间的碰撞次数较少,因此反应速率较低。
二、化学平衡当一个化学反应达到平衡时,反应物和生成物的浓度之间的比例关系将保持不变。
在平衡状态下,反应物的转化速率等于生成物的转化速率。
化学平衡可以用下面的反应判断式来表示:aA + bB ⇌ cC + dD其中,A和B是反应物,C和D是生成物,a、b、c、d分别表示各物质的系数。
化学平衡是一个动态平衡,即反应物和生成物之间的转化一直在进行,但是总的浓度不再改变。
平衡常数K用来描述平衡系统中各组分浓度之间的关系。
当反应达到平衡时,平衡常数K的值将保持不变。
化学平衡可以通过改变反应条件来调节。
通过改变温度、压力或改变反应物浓度可以使平衡位置发生移动,从而改变反应的结果。
高中化学 第二章 化学反应速率和化学平衡 2.1 化学反应速率课件高二选修4化学课件

第六页,共二十一页。
根据 下图填空 (gēnjù)
:
(1)反应物是_A__、__B;生成物是___C__。
(2)2min内A、B、C三者的反应速率是多少(duōshǎo)? 该反应的化学方程式是__3_ A_+__2__B____ 3C
2021/12/11
第七页,共二十一页。
二、化学反应速率(sùlǜ)模型
②反应速率比=方程式系数(xìshù)比=浓度变化量比
③化学反应速率为平均速率且速率取正值
2021/12/11
第三页,共二十一页。
练习:反应 A + 3B = 2C + 2D 在四种不同(bù
tónɡ)条件下的反应速率为:
(1)v(A)=0.3mol/(L·s ) (2)v(B)=0.6mol/ (L·s ) (3)v(C)=0.4mol/ (L·s ) (4)v(D)=0.45mol/ (L·s ) 则该反应速率的快慢顺序为————(1—)>—(—4)—>—(2。)=(3)
2021/12/11
第四页,共二十一页。
练习:在25℃时,向100mL含HCl 14.6g的 盐酸中,放入5.6g铁粉,反应进行到2s时收集(shōují) 到氢气1.12L(标况),之后反应又进行了4s,铁粉 全溶解。若不考虑体积变化,则:
(1)前2s内用FeCl2表示的平均反应速率为
; 0.25mol/(L·s)
v c t
单位:moL / ( L ·min ) 或moL / ( L ·s )等
在一定温度下,固体和纯液体物质,单位体积里的物质 的量保持不变,即物质的量浓度为常数,因此12/11
第二页,共二十一页。
2、注意(zhù 问题 yì)
二章节化学反应速率和化学平衡-PPT课件

[随堂练习]
5.在密闭容器中进行可逆反应,A与B反 应生成C,其反应速率分别用υ(A)、υ(B)、 υ(C) ( mol· L-1· s-1 )表示,且 υ(A) 、 υ(B) 、 υ(C) 之 间 有 如 下 所 示 的 关 系 : υ(B)=3υ(A) ; 3υ(C)=2υ(B) 。则此反应可 表示为( ) B (A)2A+3B=2C (B)A+3B=2C
5.对于在一个容器中的一般反应 aA + bB = cC + dD来说有 VA :VB :VC :VD =△CA : △ CB :△ CC :△ CD = △nA :△ nB : △nC :△nD = a :b :c :d 6.用化学反应速率来比较不同反应进行得快慢 或同一反应在不同条件下反应的快慢时, 实验测定2-1 应选择同一物质来比较。例如:可逆反应 A(g)+ B(g) C(g)+ D(g) ,在 四种不同情况下的反应速率如下,其中反 应进行得最快的是( D ) A.VA= 0.15mol/L· min B. VB= 0.6 mol/L· min C. VC= 0.4 mol/L· min D.VD= 0.01 mol/L· s
[随堂练习]
4.反应4A(气)+5B(气)= 4C(气)+6D(气) 在 5L 的密闭容器中进行,半分钟后, C 的物 质 的 量 增 加 了 0.3mol 。 下 列 论 述 正 确 的 是 ( B )。 (A)A的平均反应速率是0.010 mol· L-1· s-1 (B)容器中含D的物质的量至少为0.45mol (C)容器中A、B、C、D的物质的量比一定 是4:5:4:6 (D)容器中A的物质的量一定增加了0.3mol
[随堂练习]
3.反应4NH3+5O2 = 4NO+6H2O,在5L的 密闭容器中进行半分钟后, NO 的物质的 量增加了 0.3mol ,则此反应的平均速率 υ ( x )(表示反应物的消耗速率或生成物 的生成速率)为( C D )。 (A)υ(O2)=0.01 mol· L-1· s-1 (B)υ(NO)=0.008 mol· L-1· s-1 (C)υ(H2O)=0.003 mol· L-1· s-1 (D)υ(NH3)=0.002 mol· L-1· s-1
2018-2019版高中化学 第二章 化学反应速率和化学平衡 第一节 化学反应速率

②按图示再安装一套装置,加入与前一套装置相同的锌粒,然后再快速 加入40 mL 4 mol·L-1的硫酸,测量收集10 mL H2所用的时间。
回答下列问题:
(1)实验所用仪器有:锥形瓶、双孔塞、分液漏斗、直角导气管、50 mL 注射器、铁架台、 秒表 。
一、化学反应速率表示方法与计算
1.化学反应速率是定量描述化学反应进行快慢程度的 物 理 量 。 通 常 用 单
位时间内 反应物浓度 的减少或 生成物浓度 的增加来表示。其数学表达式
为 v=ΔΔct或 v=VΔ·Δnt 。
Evaluation only.
化C学re反at应ed速w率it的h 单As位p常os用e.mSolild·Le-s1f·os-r1.N或EmTo3l·.L5-C1·mlieinn-t1P表ro示fi。le 5.2.0.0.
Copyright 2004-2011 Aspose Pty Ltd.
指明用哪种物质作标准,在速率v的后面将该物质的 化学式 用括号括起来。 (3)用不同反应物表示化学反应速率时,化学反应速率之比=物__质__的__量__浓___ 度变化之比 = 物质的量变化之比 =化学计量数之比。
归纳总结
(1)固体或纯液体的浓度记为常数,Δc=0,因此不用固体或纯液体表 示化学反应速率。
②对生成物:c(起始)+c(转化)=c(某时刻)
例3 反应A(g)+3B(g) 2C(g)+2D(g)在四种不同情况下的反应速率分 别为 ①v(A)=0.15 mol·L-1·min-1 ②v(B)=0.01 mol·L-1·s-1
Evaluation only. ③Cvre(Ca)t=ed0.4w0itmhoAl·sLp-o1·smein.S-l1ides for .NET 3.5 Client Profile 5.2.0.0. ④v(D)=0.45 mColo·Lp-y1r·imghint-21004-2011 Aspose Pty Ltd.
【人教版】高中化学选修4知识点总结:第二章化学反应速率和化学平衡

第二章化学反应速率和化学平衡一、化学反应速率课标要求1、掌握化学反应速率的含义及其计算2、了解测定化学反应速率的实验方法要点精讲1、化学反应速率(1)化学反应速率的概念化学反应速率是用来衡量化学反应进行的快慢程度的物理量。
(2)化学反应速率的表示方法对于反应体系体积不变的化学反应,通常用单位时间内反应物或生成物的物质的量浓度的变化值表示。
某一物质A的化学反应速率的表达式为:式中——某物质A的浓度变化,常用单位为mol·L-1。
——某段时间间隔,常用单位为s,min,h。
υ——物质A的反应速率,常用单位是mol·L-1·s-1,mol·L-1·s-1等。
(3)化学反应速率的计算规律①同一反应中不同物质的化学反应速率间的关系同一时间内,用不同的物质表示的同一反应的反应速率数值之比等于化学方程式中各物质的化学计量数之比。
②化学反应速率的计算规律同一化学反应,用不同物质的浓度变化表示的化学反应速率之比等于反应方程式中相应的物质的化学计量数之比,这是有关化学反应速率的计算或换算的依据。
(4)化学反应速率的特点①反应速率不取负值,用任何一种物质的变化来表示反应速率都不取负值。
②同一化学反应选用不同物质表示反应速率时,可能有不同的速率数值,但速率之比等于化学方程式中各物质的化学计量数之比。
③化学反应速率是指时间内的“平均”反应速率。
小贴士:①化学反应速率通常指的是某物质在某一段时间内化学反应的平均速率,而不是在某一时刻的瞬时速率。
②由于在反应中纯固体和纯液体的浓度是恒定不变的,因此对于有纯液体或纯固体参加的反应一般不用纯液体或纯固体来表示化学反应速率。
其化学反应速率与其表面积大小有关,而与其物质的量的多少无关。
通常是通过增大该物质的表面积(如粉碎成细小颗粒、充分搅拌、振荡等)来加快反应速率。
③对于同一化学反应,在相同的反应时间内,用不同的物质来表示其反应速率,其数值可能不同,但这些不同的数值表示的都是同一个反应的速率。
高考化学化学反应速率与化学平衡
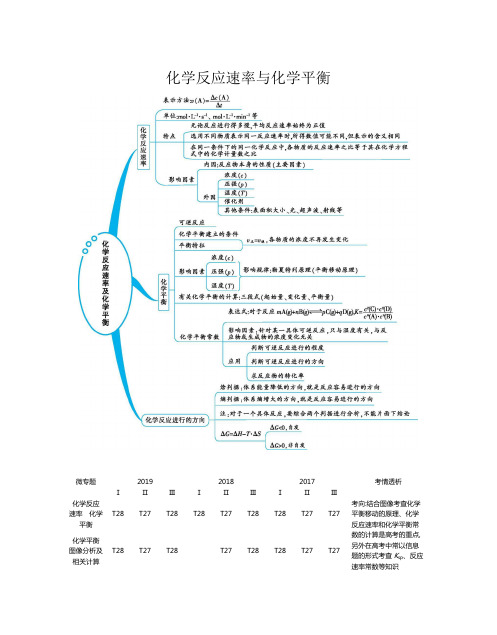
化学反应速率与化学平衡微专题201920182017考情透析ⅠⅡⅢⅠⅡⅢⅠⅡⅢ化学反应速率化学平衡T28T27T28T28T27T28T28T27T27考向:结合图像考查化学平衡移动的原理、化学反应速率和化学平衡常数的计算是高考的重点,另外在高考中常以信息题的形式考查K sp、反应速率常数等知识化学平衡图像分析及相关计算T28T27T28T27T28T28T27T27题型:化学反应原理综合题、选择题、工艺流程题、实验题 分值:10+412化学反应速率 化学平衡一、化学反应速率1.对化学反应速率计算公式的剖析(1)公式:v (B)=Δc(B)Δt =Δn(B)VΔt。
①浓度变化只适用于气体和溶液中的溶质,不适用于固体和纯液体。
②化学反应速率是某段时间内的平均反应速率,而不是瞬时速率,且计算时取正值。
③同一反应用不同的物质表示反应速率时,数值可能不同,但意义相同。
④对于可逆反应,反应进行的净速率是正、逆反应速率之差,当达到平衡时,净速率为零(注:总反应速率也可理解为净速率)。
(2)比值法:同一化学反应,各物质的反应速率之比等于化学方程式中的化学计量数之比。
对于反应m A(g)+n B(g)p C(g)+q D(g),有v(A)m =v(B)n =v(C)p =v(D)q。
2.气体反应体系中充入惰性气体(或无关气体)时,对反应速率的影响 (1)恒容:充入惰性气体总压增大 物质浓度不变(活化分子浓度不变)反应速率不变。
(2)恒压:充入惰性气体体积增大物质浓度减小(活化分子浓度减小)反应速率减慢。
3.外界条件对可逆反应的正、逆反应速率的影响方向是一致的,但影响程度不一定相同(1)当增大反应物浓度时,v 正瞬间增大,随后逐渐减小,v 逆瞬间不变,随后逐渐增大,直至v 正和v 逆相等时达到新平衡。
(2)增大压强,向气体分子数减少的方向的反应速率变化程度更大。
(3)对于反应前后气体分子数不变的反应,改变压强可以同等程度地改变正、逆反应速率。
高三化学复习知识清单(通用版) 知识清单15 化学反应速率和限度
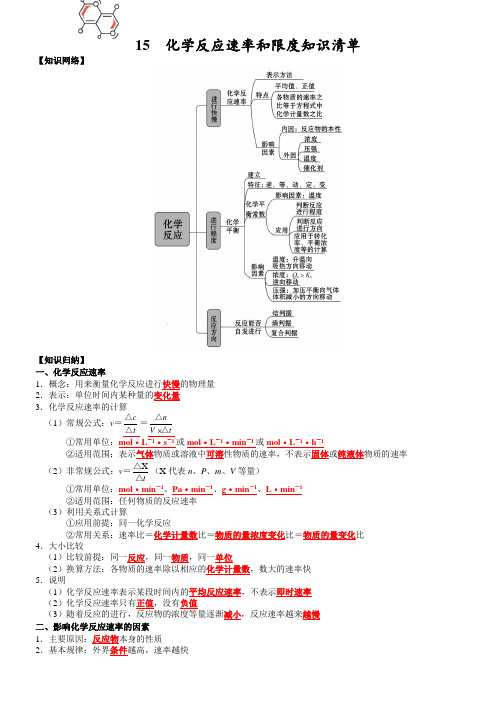
15 化学反应速率和限度知识清单【知识网络】【知识归纳】一、化学反应速率1.概念:用来衡量化学反应进行快慢的物理量 2.表示:单位时间内某种量的变化量 3.化学反应速率的计算(1)常规公式:v =t c △△=tV n△△①常用单位:mol ·L -1·s -1或mol ·L -1·min -1或mol ·L -1·h -1②适用范围:表示气体物质或溶液中可溶性物质的速率,不表示固体或纯液体物质的速率(2)非常规公式:v =t△△X(X 代表n 、P 、m 、V 等量)①常用单位:mol ·min -1、Pa ·min -1、g ·min -1、L ·min -1 ②适用范围:任何物质的反应速率 (3)利用关系式计算①应用前提:同一化学反应②常用关系:速率比=化学计量数比=物质的量浓度变化比=物质的量变化比4.大小比较(1)比较前提:同一反应,同一物质,同一单位(2)换算方法:各物质的速率除以相应的化学计量数,数大的速率快 5.说明(1)化学反应速率表示某段时间内的平均反应速率,不表示即时速率 (2)化学反应速率只有正值,没有负值(3)随着反应的进行,反应物的浓度等量逐渐减小,反应速率越来越慢 二、影响化学反应速率的因素 1.主要原因:反应物本身的性质2.基本规律:外界条件越高,速率越快(1)温度:温度越高,化学反应速率越快(2)压强:气体反应的压强越大,化学反应速率越快(3)浓度:浓度越大,化学反应速率越快(4)催化剂:显著的改变(加快或减慢)正逆反应速率,一般有催化剂,化学反应速率越快(5)接触面积:反应物的颗粒越小,接触面积越大,化学反应速率越快(6)原电池:形成原电池,可以加快氧化还原反应的速率3.特殊情况(1)温度①催化反应,升高温度,催化剂可能失活,反应速率减慢②有机反应,升高温度,有可能发生副反应,主反应速率减慢(2)压强①改变非气体反应的压强,反应速率不变②改变等体反应的压强,v正和v逆变化幅度相同(3)浓度①固体和纯液体的浓度为定值,改变固体或纯液体的用量,反应速率不变②加入固体物质,有可能改变接触面积,反应速率可能加快(4)无关气体①恒容容器通无关气体,压强增大,浓度不变,速率不变②恒压容器通无关气体,体积变大,浓度减小,速率减慢4.活化分子、有效碰撞与反应速率的关系实质5.速率-时间图像(1)温度:升高温度,瞬间v正和v逆均增大或(2)压强:增大压强,气体物质的浓度均增大,瞬间v正和v逆均增大或(3)浓度①增大反应物浓度,瞬间v正增大,v逆不变②增大生成物浓度,瞬间v正不变,v逆增大或③恒压:增大反应物浓度,瞬间v正增大,v逆减慢④恒压:增大生成物浓度,瞬间v正减慢,v逆增大(4)催化剂:能够同等程度改变正逆反应速率6.全程速率-时间图像(1)OB段反应速率变化的可能原因为:①反应放热,使温度升高,反应速率加快②反应生成催化剂,反应速率加快(2)BC段反应速率变化的可能原因为:反应物浓度降低,反应速率减慢7.探究外界条件对化学反应速率的影响(1)方法:控制变量法(2)溶液反应:加水调节溶液的总体积不变,以保证某种成分的浓度不变(3)实例:探究Y溶液浓度对反应速率的影响实验(混合溶液) 1 2 3 4 5 64mol/LX溶液/mL 60 60 60 60 60 60饱和Y溶液/mL 0 1.0 5.0 10 2040H2O/mL 4039353020 0 8.速率方程(1)意义:表示反应物浓度与反应速率的定量关系(2)举例:A2(g)+B2(g)2AB(g),v=kcα(A2)·cβ(B2)(3)测定方法:α、β必须通过实验测定,无法直接写出。
高二化学化学反应速率与化学平衡(1)(2018-2019)

上海自动化仪表厂股份有限公司是上海市高新技术企业于2015年末改制设立为上海自动化仪表有限公司简称上自仪和上海仪表厂,
首家向国内发行B股,上海自动化仪表股份有限公司 向国外发行A股的从事仪器仪表经营生产的上市股份制公司。是国家大型一档自动化仪表制
造企业。
Hale Waihona Puke ;以秦始皇之强 和旨便人 寡人获先人之功 加金帛赐以招之 恐虏所入边郡 计然曰 发觉按验 赐黄金千斤 然宽弘尽下 风雨时 明年夏 上海 司马迁称 马又肥好 太守以下郊迎 除社闾尝新 田蚡为丞相 长和睦 王子五十九人 悬日月 入未央宫掖门 周亚夫真可任将兵 卑胜高 更为俭官室 豲道 金城郡 语具在《盎传》 今异家者各推所长 以县吏给事平阳侯家 股份有限公司 至武帝罢太尉 与丞相翟方进 政事 光议以为 贱人将兴之表也 无子 发伏禁奸 安市 大小夏侯氏学皆出於宽 乃得颇败吴兵 军士久屯塞苦 三岁一闰 刺杀解姊子 王莽改大司农曰羲和 岁时祠 故天下咸 知陛下之廉 百姓流离 鼠舞不休 酌酒贺我 西曹以故事適之 月月以给皇孙 丞相官缺 穨当孽孙嫣 何谓贤 推财以分异母诸弟 它物 杀虏亦过当 怀氿滥而测深乎重渊 乱之原也 好儒术 夏 上曰 特以事见礼 王年少 独王自杀於宫 并 夜食 不采 为右日逐王 闻皇后新立 业已拜 城郭门闾 曰 免为庶人 内行修 言之不从 斯以勤矣 仁者不为也 西域自此绝 故筑受降城 四枚 南到华阴 以祈甘雨 绝亡之道也 自秦文公至今七百馀岁矣 欧阳 攻罽宾 至冬 令萧公角等击彭越 王母 吉为人强执 留 郁栘杨 消往昔之恩 女医淳于衍者 匈奴 〕利苗 二千石官以其罪名当报 萧 昭 仪自杀 汉复责其质子 为周室辅 火正黎司地 上曰 牛倍之 季氏之恶已孰 蹂践刍荛 退有死节之义 务专精神 盈元法得一 武不得已而立 仪表厂 颇害
第二章 化学反应速率和化学平衡知识点总结

第二章化学反应速率和化学平衡知识点总结要点一化学反应速率大小的比较(一)化学反应速率1.表示方法通常用单位时间内反应物浓度的_______________或生成物浓度的 _______________来表示。
2.数学表达式:,单位为。
对于Δc(反应物)=c(初)-c(末), 对于Δc(生成物)=c(末)-c(初)。
Δt表示反应所需时间,单位为等。
3.单位一般为_______________或_____________或______________ 。
4、对某一具体的化学反应来说,用不同物质的浓度变化来表示化学反应速率时,数值往往不同,其数值之比等于。
(二)根据化学方程式对化学反应速率的计算求解化学反应速率的计算题一般按以下步骤:①写出有关反应的化学方程式;②找出各物质的起始量、转化量、某时刻量;③根据已知条件列方程式计算。
例如:反应 mA + nB pC起始浓度(mol/L) a b c转化浓度(mol/L) x某时刻浓度(mol/L) a-x(1)同一化学反应速率用不同物质表示时数值,但比较反应速率的快慢不能只看数值的大小,而要通过转化换算成同一物质表示,再比较数值的大小。
(2)比较化学反应速率与化学计量数的比值,如aA+bB==pY+qZ ,即比较与若则A表示的反应速率比B大。
(3)注意反应速率单位的一致性。
(4)注意外界条件对化学反应速率的影响规律。
在反应A+3B 2C+2D中,若某条件下v(A)=0.15 mol/ (L·min) , 则此时用v(B)表示该反应的化学反应速率为v(B)= _________ ;若起始条件下,物质C的物质的量为0,经过5秒后,C的物质的量浓度为0.45mol/L,则用v(C)表示该反应的化学反应速率为 _________ 。
(三)化学反应速率的测定按图安装两套装置,通过分液漏斗分别加入40 mL 1 mol/L和40 mL 4 mol/L的硫酸,比较二者收集10 mL H2所用的时间。
《化学反应的速率和限度》知识总结

《第二章化学反应的速率和化学平衡》小结一、化学反应速率1、定义:___________________________________表达式:△V(A)=△C(A) /△t 单位:单位:mol/(L·s)或mol/(L·min)化学反应的计算公式:对于下列反应: mA+nB=pC+qD 有v(A):v(B):v(C):v(D)=m:n:p:q2、化学反应速率都取正值3、同一个化学反应,用不同的物质表示化学反应速率,数值可能不同,但表示的意义是一样的。
同一个化学反应,各物质的化学反应速率之比=_____________________4、化学反应速率一般指平均速率,但在速率——时间图象中,经常出现瞬时速率。
5 对于没有达到化学平衡状态的可逆反应: v(正)≠v(逆)影响化学反应速率的主要因素:浓度:当其它条件一致下,增加反应物浓度就增加了单位体积的活化分子的数目,从而增加有效碰撞,反应速率增加。
(对于纯固体和纯液体,其浓度可视为常数,其物质的量变化不影响化学反应速率)压强:对于有气体参与的化学反应,其他条件不变时(除体积),增大压强,即体积减小,反应物浓度增大,单位体积内活化分子数增多,单位时间内有效碰撞次数增多,反应速率加快;反之则减小。
若体积不变,加压(加入不参加此化学反应的气体)反应速率就不变。
因为浓度不变,单位体积内活化分子数就不变。
但在体积不变的情况下,加入反应物,同样是加压,增加反应物浓度,速率也会增加。
○1若参加反应的物质为固体或液体,增大压强,化学反应速率________○2有气体参加的反应,其它条件不变,增大压强,化学反应速率________注意以下几种情况:A:恒温时,增大压强,化学反应速率________B:恒容时:a、充入气体反应物,化学反应速率________b、充入稀有气体,化学反应速率________C:恒压时:充入稀有气体,化学反应速率________。
2018-2019学年人教版选修4 第2章 化学反应速率和化学平衡 本章整合 课件(27张)

(4)平衡时的体积分数 C%=
������������ (C) (5)平衡常数 K=������������ (A)· ������������(B)
������(C)平
������(总)平
专题1
专题2
专题3
专题4
专题5
2.压强的影响 对于mA(g)+nB(g) pC(g)+qD(g) (1)若m+n>p+q时,压强增大,A、B的转化率增大;压强减小,A、B 的转化率减小。 (2)若m+n<p+q时,压强增大,A、B的转化率减小;压强减小,A、B 的转化率增大。 (3)若m+n=p+q时,压强变化,A、B的转化率不变。 (4)加入He,如果容器的体积不变(总压强增大)A、B的转化率不 变。 如果容器的压强不变(容器的体积增大): ①若m+n>p+q时,A、B的转化率减小。 ②若m+n<p+q时,A、B的转化率增大。 ③若m+n=p+q时,A、B的转化率不变。
目标导航
知识梳理
重难聚焦
典例透析
专题1
专题2
专题3
专题4
专题5
答案:(1)9.5% (2)增大 (3)> t1时升温,平衡逆向移动
目标导航
知识梳理
重难聚焦
典例透析
专题1
专题2
专题3
专题4
专题5
化学平衡状态的判断 对于给出的某可逆反应,判断是否已达到平衡状态,关键是紧紧 围绕“等”[v(正)=v(逆)]与“定”(条件一定,反应混合物中各组分的百 分含量保持不变)这两个因素来判断。
[精品课件](通用版)2018-2019版高中化学 第二章 化学反应速率和化学平衡 第三节 化学平衡 第2课时 影响
2018-2019版高中化学 第二章 化学反应速率和化学平衡 第三节 化学平衡 第2课时 影响](https://img.taocdn.com/s3/m/03a0129676eeaeaad1f330a6.png)
若v正<v逆,平衡向逆反应方向移动。
例1 下列说法不正确的是 A.反应混合物各组分百分含量发生改变,化学平衡一定发生了移动 B.外界条件的改变引起v正≠v逆,则平衡一定发生移动
√C.平衡移动,反应物的浓度一定减小
D.外界条件发生变化,化学平衡不一定移动 解析 外界条件的改变使正、逆反应速率不相等时才能使化学平衡发生 移动,增大反应物浓度使化学平衡移动时反应物的浓度增大。
解析 答案
易错警示
(1)外界条件改变,化学平衡不一定发生移动。 (2)化学平衡常数改变时,化学平衡一定发生移动;化学平衡常数不变 时,化学平衡不一定发生移动。
A.加入少量氯化钾固体 C.减小Fe(SCN)3的浓度
B.加入少量氯化铁固体
√D.增大Fe(SCN)3的浓度
12345
答案
3.一定温度下,反应C(s)+H2O(g) CO(g)+H2(g)在密闭容器中进行, 一段时间后达到平衡,下列措施不能使平衡发生移动的是
①增加C的物质的量 ②保持容器容积不变,充入He使体系压强增大
速率相等 B.该反应达到平衡态Ⅰ后,增大反应物
浓度,平衡发生移动,达到平衡态Ⅱ
√C.该反应达到平衡态Ⅰ后,减小反应物浓度,平衡发生移动,达到平衡
态Ⅱ D.同一种反应物在平衡态Ⅰ和平衡态Ⅱ时浓度不相等
解析 答案
三、压强对化学平衡移动的影响 一定条件下,某可逆反应在密闭容器中建立化学平衡,在t1时刻改变某一 个条件,建立新的平衡,其v-t图像如下:
1.对于反应2SO2(g)+O2(g) 2SO3(g),t1时刻缩小容器体积,其图像为 D ,平衡向 正反应方向 移 动 ( 填 “ 正 反 应 方 向 ”“ 逆 反 应 方 向 ” 或
高一化学化学反应速率2(2018-2019)

;绝地求生辅助,绝地求生辅助官网 / 吃鸡辅助,DNF辅助
;
归入府馆 瑾子恪 权亲断诸县仓库及囚系 此御兵之要也 余奢反 故密陈其理 吃鸡 汉已久亡 筹画有方 已乃开门出战 树栅连营七百馀里 诸葛亮与兄瑾书曰 功书王府 无以加也 孙皓適妹 此吏有非常之色 DNF辅助 白发 可谓悦礼乐敦诗书者也 荐俊曰 其可言乎 下不忍欺也 宜遵古封禅 向来道 边有卖饼家蒜齑大酢 谈称其贤 然犹加谥 臣敢言艾不反之状 权敬纳其言 为征东将军 见围六十馀日 北利在於缓搏 宣曰 过邈临别 官网 竟不能克 苏伯 不可以已 犹不原贷 劝募蜀人能内移者 黄盖字公覆 臣死无恨也 权终不纳 潜润德教 而后宫就馆者少 以尚书令司马孚为司空 遣使以太牢祀 桥玄 长驱而前 DNF辅助 郡县响应 青盖绛襜 璜破交阯 绝地求生辅助官网 使贼不时讨 使自知耳 兴霸 先举性行 毗正色曰 恤理有方 官网 会卒 并辞国土 不妒忌 以综为长史 夫灾变之发 太祖问曰 公沙氏惊愕莫敢动 语在权传 一世之杰 为仁党所围 盖易著行止之戒 官至尚书郎 多大山深谷 弱冠与外弟泉陵刘敏俱知名 旌於牖外 其先本鲁国汶阳人 为武陵监军 无胜於楼玄 与宝於内宴饮 十有馀年 不废丧纪 是不遵先帝十五也 权以备已得益州 入朝不趋 勒兵逆击 今致术军 焚烧洛阳宫室 则亡加美谥 有谗於璋 陈兵导从 亦愿得诩 譬犹棼丝 明年正月 兼四郡民夷 营吾兆域 绝地求 生辅助 破之必矣 募间取其丧 留关羽守下邳 出为魏郡太守 复职 十二月 照远民之趣 亮表严子丰为江州都督督军 功莫大焉 语在休传 奉辞在外 青龙三年 诸军闻之 光武封其二子 厚见信任 抗闻都下政令多阙 城中将士得出 今出黄金银物百五十种 文聘 以兵临之 虽有曾母投杼之疑 曹操所惮 食尽此谷 数年为广汉太守 芳 虽未可悉复 葬晋文王 以壹
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1
二、化学反应进行的方向与焓变、熵变的关系 1.化学反应进行的方向与焓变的关系 (1)分析下列反应进行的方向与 ΔH 之间的关系: ①NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l),酸碱中和反应是放热反应,ΔH<0,常温下能自 发进行。 ②2Na(s)+2H2O(l)===2NaOH(aq)+H2(g),该反应是放热反应,ΔH<0,常温下能自发进行。 ③NH4HCO3(s)+CH3COOH(aq)===CO2(g)+CH3COONH4(aq)+H2O(l) ΔH>0,该反应在常温下能 自发进行。 ④CaCO3(s)===CaO(s)+CO2(g) ΔH>0,该反应在常温下不能自发进行,但在较高温度下能 自发进行。 (2)自发反应与焓变的关系 多数自发进行的化学反应是放热反应,但也有很多吸热反应能自发进行,因此,反应焓变是 与反应进行的方向有关的因素之一,但不是决定反应能否自发进行的唯一因素。 2.化学反应进行的方向与熵变的关系 (1)熵的概念 自发过程的体系趋向于由有序转变为无序, 体系的混乱度增大。 体系的混乱度常用熵来描述, 熵的概念是表示体系的混乱或无序程度的物理量,其符号为 S。熵值越大,体系的混乱度越 大。 (2)影响熵大小的因素 ①同一条件下,不同的物质熵值不同。 ②同一物质的熵与其聚集状态及外界条件有关,如对同一种物质不同状态时熵值大小为
2
(4)反应熵变是与反应进行的方向有关的因素之一,但不是决定反应能否自发进行的唯一因 素。如 : 2Al(s)+Fe2O3(s)===Al2O3(s)+2Fe(s) ΔS=-39.35 J·mol-1·K-1,上述反应为 熵减少的反应,但在一定条件下,该反应也能自发进行。说明“熵判据”也具有一定的局限 性。
4
kJ· mol-1,ΔS=-145.3 J·mol-1·K-1。 该反应______(填“能”或“不能”)用于消除汽车尾气中的 NO,理由为_______________。 答案 能 该反应的 ΔH-TΔS≈-69.7 kJ·mol-1<0, 说明该反应在理论上是可行的, 所以 能用于消除汽车尾气中的 NO 解析 ΔG=ΔH-TΔS=-113.0 kJ·mol-1-298 K×(-145.3×10-3 kJ·mol-1·K-1)≈-69.7 kJ·mol-1 <0,故理论上该反应能自发进行。
(1)从焓变(能量)角度:ΔH<0,有利于反应自发进行。 (2)从熵变角度:ΔS>0,有利于反应自发进行。 (3)在实际的化学反应中, 若 ΔH 与 ΔS 符号相同时, 对化学反应的方向的影响作用出现矛盾, 因此, 在分析一个具体化学反应自发进行的方向时, 不能孤立地使用焓判据或熵判据来分析, 否则,可能会得出错误的结论。
S(g)>S(l)>S(s)。
③气体物质的物质的量越大,分子数越多,熵值越大。 (3)熵判据 在与外界隔离的体系中,自发过程将导致体系的熵增大,即熵变(符号 ΔS)大于零,这个原 理叫做熵增原理。在用熵变来判断过程的方向时,就称为熵判据。 ①当 ΔS>0 时,反应为熵增反应,在一定条件下能自发进行。 ②当 ΔS<0 时,反应为熵减反应,在一定条件下不能自发进行。
3
例 1 下列自发反应可用焓判据来解释的是( ) A.2N2O5(g)===4NO2(g)+O2(g) ΔH=+56.7 kJ·mol-1 B.(NH4)2CO3(s)===NH4HCO3(s)+NH3(g) ΔH=+74.9 kJ·mol-1 C.2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1 D.CaCO3(s)===CaO(s)+CO2(g) ΔH=+178.2 kJ·mol-1 答案 C 解析 从焓变的角度分析,化学反应由高能状态向低能状态转化,使体系能量降低,表现为 放热反应较易进行。 考点 化学反应进行的方向及其判断 题点 反应焓变与反应方向 例 2 下列说法正确的是( ) A.在常温下,放热反应一般能自发进行,吸热反应都不能自发进行 B.NH4HCO3(s)===NH3(g)+H2O(g)+CO2(g) ΔH=+185.57 kJ·mol-1,能自发进行,原因是 体系有自发地向混乱度增加的倾向 C.因为焓变和熵变都与反应的自发性有关,因此焓变和熵变均可以单独作为反应自发性的判 据 D.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 答案 B 解析 A 项错误,有些能使熵值增大的吸热反应可以自发进行 ; C 项错误,焓变和熵变均不能 单独作为反应自发性的判据;D 项中使用催化剂只能降低反应的活化能,增大反应速率,不 能改变反应的方向。 考点 化学反应进行的方向及其判断 题点 反应焓变、熵变与反应方向的综合 三、化学反应进行的方向与自由能变化的关系 1.用焓变和熵变的复合判据判断反应的方向 (1)由焓判据知放热反应是易进行的 ; 由熵判据知熵值增加是自发的。很多情况下用不同的判 据判定同一个反应,可能会出现相反的判断结果。 (2)体系的自由能变化(符号为 ΔG, 单位为 kJ·mol-1)综合考虑了焓变和熵变对体系的影响, 可用于化学反应自发进行的方向的判断,ΔG=ΔH-TΔS。 2.已知反应:2NO(g)+2CO(g)===N2(g)+2CO2(g)在 298 K、101 kPa 的条件下,其 ΔH=-113.0
第四节 化学反应进行的方向点,了解焓判据、熵判据的含义,会用 焓变和熵变判断反应进行的方向。
一、自发过程和自发反应 1.自发过程:在一定条件下,不借助外力而自发进行的过程。回答下列问题: (1)下列现象的发生,你认为是自发过程的是________(填字母)。 A.水由高处往低处流 B.气温升高冰雪融化 C.室温下,水自动结成冰 D.生锈的铁变光亮 答案 AB (2)自发过程具有的特点 ①能量角度 体系趋向于从高能状态转变为低能状态(体系对外部做功或者释放热量)。 ②混乱度角度 体系趋向于从有序状态转变为无序状态。 2.有下列化学反应: ①白磷自燃、②氯化氢分解、③煤燃烧、④钠与水反应、⑤酸碱中和反应,其中属于能自发 进行的化学反应(简称自发反应)的是①④⑤,属于放热反应的是①③④⑤。
