胺-83464-尼日利亚人学汉语Chinese-English dictionary
第13章 胺

(CH3)3N bp: 2.87º C
C2H5NHCH3 36-37º C
CH3CH2CH2NH2 47.8º C
大多数芳胺具有毒性,苯胺可以导致再生障碍 性贫血,通过吸入,食入或透过皮肤吸收而致中 毒,食入0.25 mL就严重中毒。 β– 萘胺与联苯胺是能够引起恶性肿瘤的物质。
四、胺的化学性质 1. 胺的碱性与成盐
N R R R
N H H
学习胺的化学,要注意N上的孤对电子,胺的许多性 质都与它有关。
1. 胺的碱性与成盐
R—NH2 + H—OH R—NH3 + OH
[R+NH3][-OH] Kb = RNH2
pKb = - logKb
(1)产生碱性的原因: N上的孤对电子 (2)判别碱性的方法: pKb的值;或其共轭酸的
H R N H H O O H H H O H H H
R1 R N H R2 O H H
1° 胺 3° 胺 胺在水溶液中碱性的强弱,是其电子效应、空间效 应以及溶剂化效应的综合体现。
1. 胺的碱性与成盐
一些胺(氨)在水溶液中的pKb值
NH3 pKb 4.76
3.27
3.38 4.21
C6H5NH2
苯磺酰氯
对甲苯磺酰氯 (TsCl)
该反应用于伯、仲、叔胺的分离与鉴定。
磺酰化反应:
兴斯堡反应的反应式如下:
RNH2 + SO2Cl SO2NHR NaOH H+ SO2NR Na+
伯胺
R2NH + SO2Cl NaOH H2O SO2NR2
仲胺
R3N + SO2Cl NaOH H2O R3N +
+ NaOH H
胺基酸

pH = 常數 pKa?....當 [A-] = [AH], log 1 = 0
pH
pH 乙酸
pKa 5
★
[OH-]
[OH-]
圖 4 以乙酸為例說明緩衝分子如何在其 pKa 發揮作用
乙酸 根會 吸 收或 放出 一 個質 子, 可 以用 解離 常 數 Ka 描述 之;對 Ka 進行 數學 轉 換可得 Henderson-Hasselbalch 公式,此式描述當[A-]等於[AH]時,環境的 pH 恰等於乙酸的 pKa (= 5), 有最大的緩衝效果。
N
(1) 打有 * 者是人類的必需胺基酸,須由外界攝取。N, non-polar; P, polar 極性。
(2) 兩分子胱胺酸 (Cys) 以 雙硫鍵 連成二元体 (雙胱胺酸)。
(3) 這兩個胺基酸對蛋白質的立體構造有很大的影響。
◆ 圖 2 是特地設計用來說明各胺基酸的構造關係,不是代謝途徑,請特別注意。 圖 中把各種胺基酸依其 R 基團的性質不同分類,並安排在台北市地下鐵的模擬地圖 上,其中 Ala 是台北總站,因為其他的胺基酸都可由此分畫出來。中央線即為忠 孝東路線,由飽和碳氫鏈的胺基酸所組成,與忠孝東路的商業機能有類比關係。
◎ Ka 是平衡後兩邊的濃度比:
Ka = [A-] [H+] = 1
胺、硝基化合物和腈等有机化合物

11
12.2 胺的制 备
12.2.1 烃基化反应 12.2.2 含氮化合物的还原反应 12.2.3 亚胺的亲核加成反应
P.297
12
12.2.1 烃基化反 应
氨或胺的烃基化反应
P.297
NH3
RX SN2
RNH2
R
X
R2NH R X R3N
R X R4N+X-
不可控制的多步烷基化! 若要制备1o胺,如何避免过度烷基化?
13
邻苯二甲酰亚胺的烷基化反应
p.29
8
盖布瑞尔伯胺合成法——实验室中制备纯净伯胺
O
KOH
NH
EtOH
O pKa=8.3
O N- K+ RX
O
NaOH H2O
RNH 2 +
O NR
O CO2Na CO2Na
14
对甲苯磺酰胺的烷基化反应
CH3
SO2Cl RNH2 CH3
SO2NHR R'X / OH-
叔胺
R4N+OH-
季铵碱
季铵化合物:氮原子上连有四个烃基的衍生物
4
CH3
CH3 C NO2 CH3
CH3
CH3 C OH CH3
CH3 CH3 C Cl
CH3
叔5
CH3 CH3 C NH2
CH3
伯胺
胺的结构
P.296 亲核性、碱性
sp3
甲胺结构示意图
6
苯胺结构示意图:
不等性sp3杂化(具更多p轨道性质)
2
P.296
12.1 胺的结构和命 名
胺 —— NH3 的衍生物 氨基: –NH2 (Ar)R–NH2
胺

W N2 Cl W = Cl, NO2, SO3H
• 阴离子为 X , HSO4 , BF4 • 分子内重氮盐
Ar
N2 X
Ar
N2 SHO4
Ar
N2 BF4
O3S
N2
30-40oC时仍稳定
Organic Chemistry
University of South China
重氮盐的反应类型
Organic Chemistry
University of South China
注意反应条件
重氮盐与芳香叔胺偶联
pH =5~7 NR2 Ar N N NR2
Ar
N2 X
+ pH =5~7 R NR2 R NR2 N N Ar
活化的芳环
机理(苯环上的亲电取代)
H2O Ar N N NR2 Ar - H3O N N H NR2
CH3 NH2 N CH3
H3C
NH CH3 N
NH2
苯胺
N, N-二甲基 苯胺
N, 4-二甲基苯胺
氨基吡啶
NH2CH2CH2NH2
NH2CH2CH2CH2COOH
CH3NH CH(CH2)4CH3 CH3
乙二胺
-氨基丁酸
2-甲氨基庚烷
Organic Chemistry
University of South China
HOC2H5 法
Organic Chemistry
University of South China
合成上应用举例
Br H3C H3C OH
例 1:
磺酸碱熔法制备酚
NaOH ArSO3H 300 C
胺

RR'R''N
R4N+X四级铵盐
伯胺
叔醇
按胺基的数目:一元胺, 二元胺
第一节. 胺的结构和命名
一. 胺的结构: 1) 氨和胺中的N是不等性的 sp3 杂化,未共用电子对占据 一个sp3杂化轨道。 2) 随着N上连接基团的不同,键角大小会有改变。
+
鉴定和胺基的保护
O C6H5NH2 + (CH3CO)2O NHCCH3 + CH COOH 3 m.p. = 114
O NH CCH3 H N + O C CH3
HNO3 H2SO4 O NHCCH3 1) H3O+ 2) HO,
NH2
NO2
N2O
兴斯堡反应 (Hinsberg):
RNH2 + Ar-SO2Cl
NH2
NO2
NHCOCH3
H2O, OH-
NO2
NH2
第五节. 胺的制法
一. 氨或胺的直接烃化
氨或伯胺的烃化,得到混合物,在合成上用途不大。
如:
C6H5NH2 + C6H5CH2Cl NaHCO3, H2O 4h C6H5NHCH2C6H5
亲核性弱
需要剧烈条件才能继续烃化
二. 盖布瑞尔(Gabriel) 反应
两者综合作用结果
二. 芳香胺的碱性:
1. 与脂肪胺相比
既要考虑N上取代基的影响,又要考虑苯环上取代
基的影响
碱性:脂肪胺 >芳香胺 原因:PhNH2中存在有P-π共轭 2. 取代芳香胺的碱性
NH2 NH2 NH2 OCH3
伯胺 合成
CH3COONa
DMF 或 DMSO SN2 O
CH3COO
C6H13 H
CH3
OH
酯水解
C6H13
HO
H
CH3
TsCl
吡啶
(1)
NK
O SN2
(2) NH2NH2
C6H13
H
NH2
CH3
酰胺的 Hofmann 降解( Hofmann重排)(新内容)
O Br2 / NaOH
R C NH2
R NH2 + CO2
O NR O
NH2NH2(肼解) 或水解
R NH2
O
R OTs = R O S
CH3
O 对甲苯磺酸酯
例: Gabriel 伯 胺合成法应用 (教材p648)
C6H13 H OH
CH3
手性醇
➢ 合成分析
C6H13 H OH
CH3
C6H13 H OTs
CH3
构型翻转
构型翻转 构型保持 构型翻转
H2N
C6H13 H
Hofmann 降解
➢Hofmann 降解机理
比原料少一个碳
O R C NH
H OH
O R C NH
Br Br
O R C N Br
O R C N Br
H OH
未完,接下张ppt
接上张Hofmann 降解机理
缺电子中心
O - Br
R C N Br
R迁移 O
OH
消除和重排 同时进行
C NR 异氰酸酯
O H
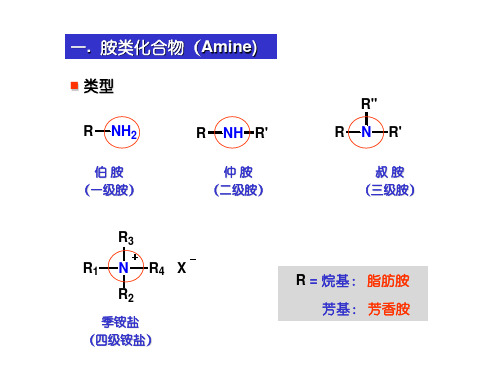
一. 胺类化合物(Amine)
类型
R NH2
伯胺 (一级胺)
R NH R'
二十种氨基酸结构式

20种罕见氨基酸的名称和结构式之邯郸勺丸创作名称中文缩写英文缩写结构式非极性氨基酸甘氨酸(α-氨基乙酸)Glycine甘Gly G丙氨酸(α-氨基丙酸)Alanine丙Ala A亮氨酸(γ-甲基-α-氨基戊酸)*Leucine亮Leu L异亮氨酸(β-甲基-α-氨基戊酸)*Isoleucine异亮Ile I缬氨酸(β-甲基-α-氨基丁酸)*Valine缬Val V脯氨酸(α-四氢吡咯甲酸)Proline脯Pro P苯丙氨酸(β-苯基-α-氨基丙酸)*Phenylalanine苯丙Phe F蛋(甲硫)氨酸(α-氨基-γ-甲硫基戊酸) *Methionine蛋Met M色氨酸[α-氨基-β-(3-吲哚基)丙酸]*色Trp W Tryptophan非电离的极性氨基酸丝氨酸(α-氨基-β-羟基丙酸)丝Ser S Serine谷氨酰胺(α-氨基戊酰胺酸)谷胺Gln Q Glutamine苏氨酸(α-氨基-β-羟基丁酸)*苏Thr T Threonine半胱氨酸(α-氨基-β-巯基丙酸)半胱Cys C Cysteine天冬酰胺(α-氨基丁酰胺酸)天胺Asn N Asparagine酪氨酸(α-氨基-β-对羟苯基丙酸)酪Tyr Y Tyrosine酸性氨基酸天冬氨酸(α-氨基丁二酸)天Asp D Aspartic acid谷氨酸(α-氨基戊二酸)谷Glu E Glutamic acid碱性氨基酸赖氨酸(α,ω-二氨基己酸)*赖Lys K Lysine精氨酸(α-氨基-δ-胍基戊酸)精Arg R Arginine组氨酸[α-氨基-β-(4-咪唑基)丙酸]组His H Histidine。
氨基酸、蛋白质和核酸

15 氨基酸、蛋白质和核酸
4、蛋白质的变性 蛋白质受物理和化学因素的影响,导致理化性质及生理 活性发生改变的过程,称蛋白质变性。
变性后的蛋白质称变性蛋白质。变性蛋白质首先是失去 生理活性,其次物理和化学性质也发生改变。如溶解度降 低,粘度增大,容易沉淀等。
蛋白质的不可逆沉淀一定 是蛋白质发生了变性。
2、核苷酸
核苷酸是核酸的基本结构单位。 核 糖 核 苷 酸 为 RNA 的 组 成 单 位 , 脱 氧 核 糖 核 苷 酸 是 DNA的组成单位。生物体内多数核苷酸是5′-核苷酸。
NH2 N H2PO3OCH 2 O N N N
HOCH 2 O N N N NH 2 N
HO
OH
OPO 3H2
5′-腺苷酸(5′-AMP)
1、多肽的分类和命名 2个α-氨基酸缩合而成的为二肽;3个和多个α-氨基 酸缩合而成的肽,分别叫三肽和多肽。
N端
O O O RCH C NH CH C NH CH C OH NH2 R R
某氨酰某氨酰某氨酸
C端
15 氨基酸、蛋白质和核酸
2、多肽结构的测定 多肽是不同的α-氨基酸按一定的顺序结合在一起的。 想了解一个多肽是由哪些氨基酸组成的,将多肽在酸性 溶液中彻底水解,经色层分离后逐个分析。 氨基酸在肽链中 是如何排列的,可 用端基分析法和部 分水解法结合起来 确定。
7、茚三酮反应
α-氨基酸与水合茚三酮在弱酸性溶液中共热,经氧 化、脱氨、脱羧及缩合等反应,生成蓝紫色的物质。 用于氨基酸的定性和定量分析。
O OH OH O + RCHCOOH NH2
O N O
O NH4+ O
蓝紫色
15 氨基酸、蛋白质和核酸
15.2 多肽
16-胺

16.1 16.2 16.3 16.4 16.5 16.6 16.7 16.8 胺的工业来源和用途 胺分子的四面体构型 胺的碱性及酸性 胺的反应 季铵盐和季铵碱 胺的制备 烯胺的生成及其应用 胺的光谱性质
分子中含氮的有机物称为含氮有机化合物。
包括:硝基化合物(R-NO2)、胺(RNH2)、腈(RCN)、重 氮盐(ArN2+X-)以及氨基酸(RCHNH2CO2H)和蛋白质等。 胺可看作氨的衍生物,根据在氮上的取代基的数目, 可分为: 一级胺 (伯胺) (R-NH2) CH3NH2 甲胺 二级胺 (仲胺) (R2NH) (CH3)2NH 二甲胺 三级胺 (叔胺)(R3N) (CH3)3N 三甲胺 四级(季) 铵盐 (R4N+Cl-) (CH3)4N+Cl- 氯化四甲铵
大多数胺具有特殊的生物活性,可作为药物使用。
HO OH HO CH3 HO HO NH2 HN NH
NH
多巴胺 (升压药,似肾上腺素)
O O O O H O H N CH3
肾上腺素 (治疗支气管性气喘)
哌嗪 (治疗蛔虫病)
Me O S O N H N O
H2N 磺胺甲噁唑, SMZ
Heroin (海洛因)
三正丙胺
3.35
10.65
哌啶
2.88
11.12
1. 烷基诱导效应对胺的碱性强弱的的影响
• 由于R-是给电子基,其结果是使氮原子上的电子云密 度增加,使其更易于接受质子,所以脂肪胺的碱性比氨 强,并据电子效应其碱性次序为: 叔胺 > 仲胺 > 伯胺 > 氨(气相或在氯苯中)
而在水溶液中,它们的碱性次序稍有变化:
NH2 NH2 NH2
N
胺和酰胺

R ' RN H 2 RN HR ' RNR ''
官 能
氨基
团
亚氨基
次氨基
(二)胺的分类
(1) 根据分子中与氮原子连接的烃基数来分
R ' RN H 2 RN HR ' RNR ''
伯胺(1°胺) 仲胺(2°胺) 叔胺(3°胺) 胺与醇的分级依据不同. 胺的分级着眼于氮
原子上烃基的数目;醇的分级立足于羟基所连的 碳原子的级别 .
② CH3—C—ONH—CH2CH3 N-乙基乙酰胺
==
③
C—NHCH3
N-甲基苯甲酰胺
O
④
C—N
CH2CH3 CH2CH3 N,N-二乙基苯甲酰胺
二.酰胺的性质
(一)酸碱性
酰胺分子中,虽然有氮原子,由于酰基的影响致使 其碱性减弱,酰胺一般为中性化合物。
(二)水解反应
酰胺在酸、碱或酶的作用下可以发生水解反应,得
OH CH CH CH3
NH CH3
麻 黄碱
N CH3
CH2 CH CH3 NH CH3
甲基 苯 丙胺 (去 氧 麻黄 碱即 冰 毒)
阿托 品
H O
O C CH
HO CH2
一、胺的结构和分类
(一)胺的结构
胺可以看作是氨(NH3)分子中的氢原子被烃基 取代的产物。根据取代烃基数目不同,胺有三种结 构通式:
NH2
NH2
练习 根据结构写命名或者是根据名称写结构
① H2C-CH2-CH2-CH2-CH2-CH2
NH2
NH2
1,6-己二胺
② 邻苯二胺
NH2
NH2
三、胺的性质
胺

三甲胺(trimethylamine TMA)是最简单的叔胺,常温下无色气体,有鱼腥恶臭,溶于水,乙醇,乙醚,易燃,有毒,相对密度(水=1)0.66(-5℃)、(空气=1)2.09。
分子式C3H9N,可用作分析试剂,在有机合成中也有用途。
三甲胺的球棍模型参数国标编号 21045 CAS号 75-50-3InChI=1S/C3H9N/c1-4(2)3/h1-3H3[1]分子式:C3H9N分子量 59.11闪点 -17.78 熔点 -117.1℃ 沸点24℃能与氧化剂、酸酐和汞发生剧烈反应。
可腐蚀铝、镁、锌、锡、铜和铜合金等金属。
[6]其蒸气与空气可形成爆炸性混合物[4],遇明火、高热即会剧烈燃烧、爆炸。
化学性质三甲胺的结构式三甲胺具有叔胺的典型性质,包括成盐、氧化,三甲胺的兴斯堡试验(Hisberg reaction)无反应。
[2]健康危害侵入途径:吸入、食入、经皮吸收。
健康危害:对人体的主要危害是对眼、鼻、咽喉和呼吸道的刺激作用。
浓三甲胺水溶液能引起皮肤剧烈的烧灼感和潮红,洗去溶液后皮肤上仍可残留点状出血。
长期接触感到眼、鼻、咽喉干燥不适。
环境行为危险特性:易燃,其蒸气与空气可形成爆炸性混合物。
遇明火、高热易引起燃烧爆炸。
受热分解产生有毒烟气。
与氧化剂接触会猛烈反应。
其蒸气比空气重,能在较低处扩散到相当远的地方,遇明火会引着回燃。
燃烧(分解)产物:一氧化碳、二氧化碳、氧化氮。
监测方法实验室监测方法气相色谱法(GB/T14676-93,空气)环境标准:前苏联车间空气中有害物质的最高容许浓度 5mg/m3中国(GB14554-93)恶臭污染物厂界标准(mg/m3)一级:0.05;二级:0.08~0.15;三级:0.45~0.80中国(GB14554-93)恶臭污染物排放标准 0.54~32kg/h前苏联(1975)水体中有害物质最高允许浓度 0.2mg/L前苏联(1975)污水中有害物质最高允许浓度 0.4mg/L泄漏应急处理迅速撤离泄漏污染区人员至上风处,并进行隔离,严格限制出入。
胺染料的妙用

CH2CH2NH2
CONH2 LiAlH4
CH2NH2
3.*醛和酮的还原氨化 将醛或酮与氨或胺作用后再进行催化氢化即得到胺。
R (R') H C =O + NH 3 R "N2 H
H2O
C =N H (R') H NR"
R
H2, N i
CH NH2 (R') H NHR"
R
注意:为防止生成的伯氨与醛或酮进一步缩合,需要 用过量的氨,以减少仲胺的生成。
H3O+
NH2 NO2
S O3H
NH2
H2SO4
NH3HSO 4
+
HNO3
NH3HSO 4 NO2
+
OH
NH2 NO2
3.磺化反应——内盐 在180~190℃下,加热苯胺和浓硫酸,即可得到对 氨基苯磺酸。
NH2 + H2S O4 NH3HS O4
+
碱
180~190℃
NH2
NH3
+
SO3H
S O3
酸
NH3
气态时,仅有烷基的供电子效应,烷基越多,供 电子效应越大,故碱性次序如上。
水溶液中,电子效应、空间效应和溶剂化效应共 同影响的结果。 电子效应: 3°胺>2°胺>1°胺 空间效应: 1°胺>2°胺>3°胺 溶剂化效应: 1°胺>2°胺>3°胺 碱性: 脂肪胺 > 氨 > 芳香胺 pKb < 4.70 4.75 >8.40
四、 胺的化学性质
(一)碱性
胺和氨相似,分子中氮原子上具有未共用电子对, 能接受一个质子形成铵离子,故胺具有碱性,能与大 多数强酸反应生成盐。
乙胺(氨基乙烷)化学品安全技术说明书MSDS
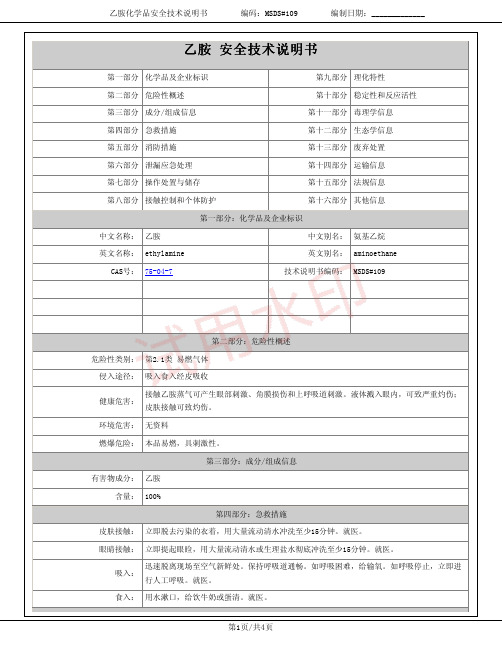
中文名称:乙胺中文别名:氨基乙烷英文名称:ethylamine英文别名:aminoethane CAS号:75-04-7技术说明书编码:MSDS#109第二部分:危险性概述危险性类别:第2.1类 易燃气体侵入途径:吸入食入经皮吸收健康危害:接触乙胺蒸气可产生眼部刺激、角膜损伤和上呼吸道刺激。
液体溅入眼内,可致严重灼伤;皮肤接触可致灼伤。
乙胺化学品安全技术说明书编码:MSDS#109编制日期:_____________体,用砂土、蛭石或其它惰性材料吸收。
若大量泄漏,构筑围堤或挖坑收容。
用泡沫覆盖,降低蒸气灾害。
用防爆泵转移至槽车或专用收集器内,回收或运至废物处理场所处置。
储罐区最好设稀酸喷洒设施。
第七部分:操作处置与储存操作注意事项:密闭操作,加强通风。
操作人员必须经过专门培训,严格遵守操作规程。
建议操作人员佩戴过滤式防毒面具(半面罩),戴化学安全防护眼镜,穿胶布防毒衣,戴橡胶手套。
远离火种、热源,工作场所严禁吸烟。
使用防爆型的通风系统和设备。
防止气体或蒸气泄漏到工作场所空气中。
避免与氧化剂、酸类接触。
在传送过程中,钢瓶和容器必须接地和跨接,防止产生静电。
搬运时轻装轻卸,防止钢瓶及附件破损。
配备相应品种和数量的消防器材及泄漏应急处理设备。
储存注意事项:储存于阴凉、通风的库房。
远离火种、热源。
库温不超过30℃,相对湿度不超过80%。
保持容器密封。
应与氧化剂、酸类分开存放,切忌混储。
采用防爆型照明、通风设施。
禁止使用易产生火花的机械设备和工具。
储区应备有泄漏应急处理设备。
相对蒸气密度(空气=1): 1.56分子量:45.08燃烧热(kJ/mol):1711.7临界压力(MPa): 5.62爆炸上限%(V/V):14.0爆炸下限%(V/V): 3.5外观与性状:无色、有强烈氨味的液体或气体。
主要用途:用于染料合成及作萃取剂、乳化剂、医药原料、试剂等。
其它理化性质:无资料第十部分:稳定性和反应活性稳定性:稳定禁配物:强氧化剂、强酸。
氨基(化)锂化学百科之中学阶段

氨基(化)锂化学百科之中学阶段
当今社会是一个高速发展的信息社会。
生活在信息社会,就要不断地接触或获取信息。
如何获取信息呢?阅读便是其中一个重要的途径。
据有人不完全统计,当今社会需要的各种信息约有80%以上直接或间接地来自于图书文献。
这就说明阅读在当今社会的重要性。
还在等什么,快来看看这篇氨基(化)锂化学百科之中学阶段吧~1.物质的理化常数:国标编号
43042CAS号7782-89-0中文名称氨基(化)锂英文名称Lithium amide别名氨基锂分子式LiNH2外观与性状白色结晶或粉
末,有氨的气味分子量22.96沸点430℃熔点380~400℃ 溶解性不溶于煤油密度相对密度(水=1)1.18稳定性稳定危险标记10(遇湿易燃物品)主要用途用于有机合成、药物制造2.对环境的影响:一、健康危害侵入途径:吸入、食入、经皮吸收。
健康危害:本品对粘膜、上呼吸道、眼睛及皮肤有强烈刺激性。
吸入后,可因喉和支气管的痉挛、炎症和水肿,化学性肺炎和肺水肿而致死。
中毒表现有烧灼感、咳嗽、喘息、喉炎、气短、头痛、恶心和呕吐。
二、毒理学资料及环境行为危险特性:遇明火、高热可燃。
接触酸或酸气以及氧化性物质,能发生强烈的化学反应而产生高热。
遇水或水蒸气反应放出有
毒的或易燃的气体。
燃烧(分解)产物:氨。
这篇氨基(化)锂化学百科之中学阶段,你推荐给朋友了么?。
