化学反应原理第三章水溶液3
【课标分析】水与水溶液

课标分析
课程标准要求:从电离、离子反应、化学平衡的角度认识电解质水溶液的组成、性质和反应。
解读:
深化课程改革的基本目标是培养学生的核心素养。
而化学观念是化学学科核心素养的构成要素,微粒观、平衡观和守恒观是三种基本的、重要的化学观念。
《化学反应原理》第三章第一节--水与水溶液这一节的内容就能很好的体现了如何利用学科知识,结合实际生活,以培养学生的化学核心素养。
学生认识的许多化学反应都是在水溶液环境中发生的,而物质在水溶液中的行为并不仅仅是简单的微粒扩散,而是水分子之间建立了相互依存,又相互制约的平衡关系。
教师在讲述这一部分知识应注重培养,巩固学生的微粒观(从宏观辨识到微观探析),平衡观(从化学平衡到电离平衡)和守恒观(从定性研究到定量研究)等三大认知观念,从这三个角度去探知各类物质在水溶液中的行为,并能运用科学精神思考和解决生活中的具体问题,培养学生的社会责任感,有效提高学生的化学核心素养,促进学生核心素养发展。
鲁教版高中化学选修四化学反应原理第三章物质在水溶液中的行为第三节《沉淀溶解平衡》
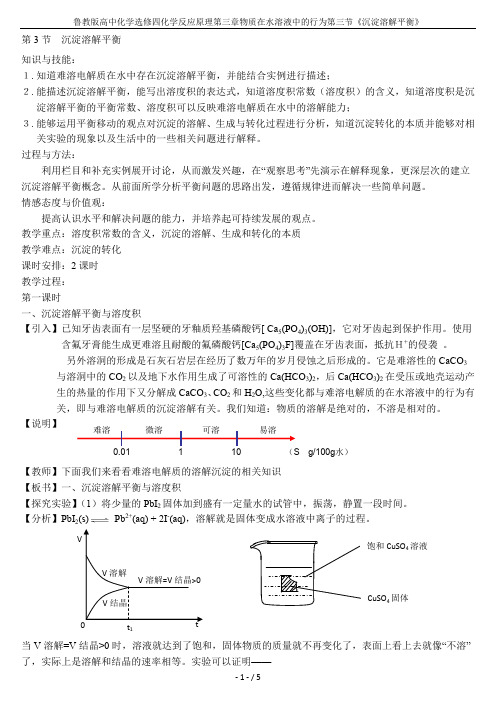
第3节 沉淀溶解平衡 知识与技能:1. 知道难溶电解质在水中存在沉淀溶解平衡,并能结合实例进行描述;2. 能描述沉淀溶解平衡,能写出溶度积的表达式,知道溶度积常数(溶度积)的含义,知道溶度积是沉淀溶解平衡的平衡常数、溶度积可以反映难溶电解质在水中的溶解能力;3. 能够运用平衡移动的观点对沉淀的溶解、生成与转化过程进行分析,知道沉淀转化的本质并能够对相关实验的现象以及生活中的一些相关问题进行解释。
过程与方法:利用栏目和补充实例展开讨论,从而激发兴趣,在“观察思考”先演示在解释现象,更深层次的建立沉淀溶解平衡概念。
从前面所学分析平衡问题的思路出发,遵循规律进而解决一些简单问题。
情感态度与价值观:提高认识水平和解决问题的能力,并培养起可持续发展的观点。
教学重点:溶度积常数的含义,沉淀的溶解、生成和转化的本质 教学难点:沉淀的转化 课时安排:2课时 教学过程: 第一课时一、沉淀溶解平衡与溶度积【引入】已知牙齿表面有一层坚硬的牙釉质羟基磷酸钙[ Ca 5(PO 4)3(OH)],它对牙齿起到保护作用。
使用含氟牙膏能生成更难溶且耐酸的氟磷酸钙[Ca 5(PO 4)3F]覆盖在牙齿表面,抵抗H+的侵袭 。
另外溶洞的形成是石灰石岩层在经历了数万年的岁月侵蚀之后形成的。
它是难溶性的CaCO 3与溶洞中的CO 2以及地下水作用生成了可溶性的Ca(HCO 3)2,后Ca(HCO 3)2在受压或地壳运动产生的热量的作用下又分解成CaCO 3、CO 2和H 2O,这些变化都与难溶电解质的在水溶液中的行为有关,即与难溶电解质的沉淀溶解有关。
我们知道:物质的溶解是绝对的,不溶是相对的。
【说明】【教师】下面我们来看看难溶电解质的溶解沉淀的相关知识 【板书】一、沉淀溶解平衡与溶度积【探究实验】(1)将少量的PbI 2固体加到盛有一定量水的试管中,振荡,静置一段时间。
【分析】PbI 2(s) Pb 2+(aq) + 2I -(aq),溶解就是固体变成水溶液中离子的过程。
第3章第3节第3课时-2024-2025学年高中化学选择性必修1教学PPT

化学·选择性必修1 化学反应原理
第三章 水溶液中的离子反应与平衡
第三节 盐类的水解
第3课时(能力课时) 水溶液中微粒浓度的关系 水溶液中的离子反应图像
返回目录 1
第三章 水溶液中的离子反应与平衡
文本
化学·选择性必修1 化学反应原理
目
录
CONTENTS
01 关 键 能 力 提 升 02 课 时 分 层 作 业
返回目录 20
第三章 水溶液中的离子反应与平衡
化学·选择性必修1 化学反应原理
A.由图可推测,H2X为弱酸 B.滴加过程中发生的反应有H2X+OH-═══HX-+H2O,HX-+OH-═══X2- +H2O C.水的电离程度:a点与b点大致相等 D . 若 常 温 下 Ka(HY) = 1.1×10 - 2 , HY 与 少 量 Na2X 发 生 的 反 应 是 2HY + X2 - ═══H2X+2Y-
返回目录 10
第三章 水溶液中的离子反应与平衡
化学·选择性必修1 化学反应原理
A.X 曲线代表草酸,Y 曲线代表醋酸,c1<c2 B.醋酸在滴定过程中始终有 n(CH3COOH)=0.02c1+n(OH-)+n(Na+)-n(H+) C.若 b 点时 c(H+)=Ka(CH3COOH),则 b 点溶液中 c(CH3COOH)=c(CH3COO-) >c(Na+) D.若 a 点 V[NaOH(aq)]=7.95 mL,则 a 点有 c(C2O24- )+2c(OH-)=c(HC2O- 4 ) +2c(H+)+c(H2C2O4)
点,判断是哪种溶质的等量 粒子浓度大小关系:c(A-)>c(Na+)>c(HA)>c(H+)
混合
>c(OH-)
高中化学说课比赛 《化学反应原理》说课稿

高中化学说课比赛《化学反应原理》说课稿各位读友大家好,此文档由网络收集而来,欢迎您下载,谢谢高中化学说课比赛《化学反应原理》第三章物质在水溶液中的行为说课第1节水溶液(第1课时)说课说课提纲:一、教材分析和学情分析二、教法学法三、教学过程设计四、教学设计说明说课内容:一、教材分析和学情分析1.教材地位和作用:本课是《化学反应原理》第3章第1节,《水溶液》是高中化学的重要内容,本节课既是对化学平衡原理的应用,也是为后续学习溶质在水溶液中的行为打下基础,尤其是为学习盐类的水解奠定基础。
本课时内容由两个大部分组成:水的电离和电解质在水溶液中的存在形态。
2.学情分析:经过前面的学习,学生已经储备了一定的相关知识:电解质及其电离,化学平衡及平衡常数,并基本养成了良好的思考、讨论、探究的习惯。
但在认知水平上,部分学生可能认为酸中无OHˉ,碱中无H+,由于知识点与已有经验的冲突和本节理论知识本身的抽象性,学生在学习中会有一定的困难。
3.教学目标:(1)知识与技能?理解水的电离以及水的离子积常数的含义,并能应用水的离子积常数进行相关计算?知道强弱电解质的区别,理解弱电解质电离平衡的含义,并掌握其表示方法(2)过程与方法?通过对水的离子积常数的推导,培养自己归纳、对比的能力(3)情感态度与价值观?通过水的离子积和强弱电解质等内容的学习,范文TOP100了解矛盾的对立统一,事物间的相互关系和相互制约等辩证唯物主义的观点4.教学重难点?重点:水的电离过程和KW的理解?难点:对KW的理解和应用二、教法学法理论支撑:“3M·HET”高效教学策略和建构主义理论各位读友大家好,此文档由网络收集而来,欢迎您下载,谢谢。
《化学反应原理》知识点归纳( 三)

《化学反应原理》知识点归纳(三)第三章水溶液中的离子平衡一、弱电解质的电离1、定义:电解质:在水溶液中或熔化状态下能的化合物,。
非电解质:在水溶液中或熔化状态下都不能的化合物。
强电解质:在水溶液里电离成离子的电解质。
弱电解质:在水溶液里只有分子电离成离子的电解质。
2、电解质与非电解质本质区别:电解质——离子化合物或共价化合物非电解质——共价化合物注意:①电解质、非电解质都是化合物②SO2、NH3、CO2等属于非电解质③强电解质不等于易溶于水的化合物(如BaSO4不溶于水,但溶于水的BaSO4全部电离,故BaSO4为强电解质)④电解质的强弱与导电性、溶解性无关。
3、电离平衡:。
4、影响电离平衡的因素:A、温度:电离一般,升温有利于电离。
B、浓度:浓度越大电离程度溶液稀释时,电离平衡向着的方向移动。
C、同离子效应:在弱电解质溶液里加入与弱电解质具有相同离子的电解质会电离。
D、其他外加试剂:加入能与弱电解质的电离产生的某种离子反应的物质时,有利于电离。
5、电离方程式的书写:强电解质的电离用符号;弱电解质的电离用符号;弱酸的电离要写(第一步为主),弱碱的电离则一步到位。
6、电离常数:在一定条件下,弱电解质在达到电离平衡时,溶液中电离所生成的各种离子浓度的乘积,跟溶液中未电离的分子浓度的比是一个常数,叫做电离平衡常数(一般用Ka 表示酸,Kb表示碱)。
表示方法:AB A++B-Ki=[ A+][ B-]/[AB]7、影响电离常数的因素:a、电离常数的大小主要由物质的本性决定。
b、电离常数受变化影响,不受变化影响,在室温下一般变化不大。
C、同一温度下,不同弱酸,电离常数越,其电离程度越,酸性越。
如:H2SO3>H3PO4>HF>CH3COOH>H2CO3>H2S>HClO二、水的电离和溶液的酸碱性1、水电离平衡::水的离子积:K W =25℃时,[H+]=[OH-] =mol/L ; K W=[H+]•[OH-] =注意:K W只与有关,温度,则K W值K W不仅适用于纯水,适用于任何溶液(酸、碱、盐)2、水电离特点:(1)(2)热(3)极3、影响水电离平衡的外界因素:①酸、碱:水的电离K W〈1*10-14②温度:水的电离(水的电离是热的)③易水解的盐:水的电离K W〉1*10-144、溶液的酸碱性和pH:(1)pH=(2)pH的测定方法A.酸碱指示剂法:、、。
鲁科版化学反应原理第三章《物质在水溶液中的行为》寒假复习学案及答案

《第三章物质在水溶液中的行为》寒假统考复习学案编辑人:高二化学组 2013.12.23一、水的电离:精确实验表明,水是一种极弱电解质,存在有电离平衡:在25℃时纯水中 ,[H+]=[OH-] = ,Kw = [H+][OH-] = mol-2·L-2[结论] 1、水的电离是个过程,故温度升高,水的Kw。
2、水的离子积是水电离平衡时的性质,它不仅适用于纯水,也适用于任何稀溶液。
即25℃时溶液中[H+][OH-] = 1.0× 10-14mol-2•L-23、在酸溶液中,[H+]近似看成是酸电离出来的H+浓度,[OH-]则来自于水的电离。
4、在碱溶液中,[OH-]近似看成是碱电离出来的OH-浓度,而[H+]则是来自于水的电离。
【练习】1.常温下,某溶液中由水电离出来的c(H+)=1.0×10-13mol·L-1,该溶液可能是( )①二氧化硫②氯化铵水溶液③硝酸钠水溶液④氢氧化钠水溶液A.①④B.①②C.②③D.③④2. 某溶液中水电离产生的C(H+)=10-3mol/L,,该溶液中溶质可能是()①Al2(SO4)3②NaOH ③NH4Cl ④NaHSO4 A、①②B、①③C、②③D、①④3. 25℃时,水的电离达到平衡:H 2O H++OH-;ΔH>0,下列叙述正确的是()A.将水加热,K W增大,溶液的pH增大B.向水中加入稀氨水,平衡正向移动,c(OH-)增加C.向水中加入少量固体硫酸氢钠,c(H+)降低,K W不变D.向水中加入少量固体CH3COONa,平衡正向移动,c(OH-)增加4. 能促进水的电离,并使溶液中C(H+)>C(OH—)的操作是()(1)将水加热煮沸(2)向水中投入一小块金属钠(3)向水中通CO2 (4)向水中通NH3(5)向水中加入明矾晶体(6)向水中加入NaHCO3固体(7)向水中加NaHSO4固体A、(1)(3)(6)(7)B、(1)(3)(6)C、(5)(7)D、(5)二、溶液的酸碱性和pH值1.溶液酸性、中性或碱性的判断依据是:看和的相对大小.在任意温度的溶液中:若c(H+)>c(OH-) c(H+)=c(OH-)c(OH-)>c(H+)溶液的pH值:氢离子浓度的负对数。
高中化学反应原理--3

碱溶液的pH=b,已知a+b=12,酸碱
溶液混合后pH=7。则V(酸)和V(碱)的
正确关系为( ) 恰好中和
C
A.V(酸)=102V(碱) B.V(酸)=2V(碱) C.V(碱)=102V(酸)
V酸 V碱
=10a+b-14
D.V(碱)=2V(酸)
⒌强酸、强碱溶液等V混合
例1:pH=2的盐酸与pH=6的盐酸等体积混合,
(1)温度:T↑,平衡 ,[H+]↑,[OH-]↑KW↑,中性 (2)加酸(H+):平衡 ,[H+]↑,[OH-]↓KW不变,酸. (3)加碱(OH-):. . ,[H+]↓,[OH-]↑KW不变,碱.
(思C4O)考2加; :活NH加泼3?金属平N衡a:析,:[HH2+O]↓,[ONHaH+ -]+↑OKHHW-2不变, 碱. 结论:KW仅与温度有关,↑T,促进电离, KW增大
第三章 物质在水溶液中的行为
第一节 水溶液
一、水的电离 思考1:纯水能导电吗?
1、 H2O 2H2O
H++ OHH3O++ OH-
实际:H+(H2O) 4 :H9O4+ 简写:H+
溶剂化 作用
H+(H2O)
:
H3O+
思考2:纯水导电能力如何?
25℃:纯水 [H+]=[OH-]=1*10-7mol.L-1 1L水:a(H2O)=?
KW [OH-]
课本:p77,图3-1-5
结论:PH越小,酸性越强;PH越大,碱性越强
25℃
100℃
中性:[H+]=[OH-]
7
6
化学选修四第三章 电解质水溶液中的(电荷、物料、质子)三大守恒

例:Na2CO3溶液中的电荷守恒
Na2CO3 2Na+ + CO32CO32-+ H2O HCO3- + OHHCO3-+ H2O H2CO3 + OHH 2O H+ + OHNa+ 、H+ 阳离子: 阴离子: CO32-、HCO3-、OH通常以浓度的形式表示: c(Na+)+c(H+) = 2c(CO32-) +c(HCO3-)+c(OH-)
选修四 化学反应原理 电解质溶液中三大守恒
同学们对如何把握好电解质溶液 中的三大守恒关系, 常常感到无从下 手或者混淆这些问题,导致做题时常 常出错。今天我们通过复习来突破该 难点。
1.电荷守恒
电解质溶液呈电中性。
阴离子所带负电荷总数=阳离子所带的正电荷总数
书写方法: ①准确找出电解质溶液中所有的阳离子与阴离子 (包括H+与OH-) ②弄清电荷浓度和离子浓度的关系
【你会了吗】 思考NaHCO3溶液的电荷守恒式 【答案】
c(Na+)+c(H+)= 2c(CO32-) +c(HCO3-)+c(OH-)
2.物料守恒(原子守恒)
即溶液中某一组分的原始浓度等于它在溶液中各 种存在形式的浓度之和。
例:Na2CO3溶液中的物料守恒式
Na2CO3 2Na+ + CO32CO32-+ H2O HCO3- + OHHCO3-+ H2O H2CO3 + OHH 2O H+ + OH故碳元素以CO32-,HCO3-,H2CO3三种形式存在,钠元素 以Na+形式存在
【你会了吗】 思考NaHCO3溶液的质子守恒式 【答案】
第三章物质在水溶液中的行为 化学反应原理 新课标 人教版

第三章物质在水溶液中的行为化学反应原理[课程标准与教材分析]本节内容分为两部分,一是引入沉淀溶解平衡、溶度积的概念以及溶度积的表达式;二是沉淀溶解平衡的移动,包括沉淀的溶解、转化和生成。
通过前两节的学习,学生已经能够从化学平衡的角度对水的电离、弱电解质的电离、盐类的水解等化学平衡问题进行分析,初步形成了从平衡角度看问题、分析问题的能力。
所以这节课可以自始至终依据涉及生活、生产以及人们广泛关注的环境问题等例子来解释抽象的概念,用对具体问题的分析讨论来带动理论问题的学习,引导学生利用平衡移动的一般规律一步步揭示沉淀溶解平衡的实质,可以使学生充分地动起来,极大地激发学生学习化学的兴趣,培养学生可持续发展的意识。
教材强调对沉淀溶解平衡的理解,注重学生的思维训练,所谓授人以鱼,不如授之以渔,在此可以得到充分的体现。
[教学设计]1.教学目标:知识与技能:⑴了解难溶电解质在水中存在沉淀溶解平衡,能描述沉淀溶解平衡。
⑵能写出溶度积的表达式,知道溶度积的含义。
⑶理解沉淀溶解平衡的移动。
过程与方法:⑴能够运用平衡移动的观点对沉淀的溶解、生成和转化过程进行分析。
⑵体会综合、分析、归纳、实验设计等方法在解决沉淀溶解平衡中的应用。
情感态度与价值观:通过对沉淀溶解平衡及其沉淀溶解平衡移动的研究,使学生体验化学科学的奥秘,提高学生的学习兴趣。
2.重点与难点:⑴重点是溶度积的含义,沉淀的溶解、生成和转化的本质。
⑵难点是沉淀的转化。
3.教学分析:⑴教学设想:通过复习水的电离、弱电解质的电离、盐类的水解等化学平衡问题,使学生回忆怎样从平衡移动的角度来分析问题、解决问题。
然后通过涉及生活、生产以及人们广泛关注的环境问题等生动有趣的例子来解释沉淀溶解平衡的概念,引导学生利用平衡移动的一般规律一步步揭示沉淀溶解平衡的实质,使学生很自然地、很高兴地完成本节课的学习,并且很想进一步探讨有关的问题。
⑵学情分析:通过前两节的学习,学生已经能够从化学平衡的角度对水的电离、弱电解质的电离、盐类的水解等化学平衡问题进行分析,初步形成了从平衡角度看问题、分析问题的能力。
2018-2019学年人教版 选修4 第3章 水溶液中的离子平衡教学安排教案

第三章水溶液中的离子平衡一、教学内容概述本章是选修4《化学反应原理》的第三章,它包含四节内容:第一节弱电解质的电离;第二节水的电离和溶液的酸碱性;第三节盐类的水解;第四节难溶电解质的溶解平衡。
本章内容应用前一章所学化学平衡理论,探讨水溶液中离子间的相互作用,内容比较丰富,理论与实际、知识与技能兼而有之,如电离平衡、水解平衡、沉淀溶解平衡的过程分析,体现了化学理论的指导作用。
pH的应用、盐类水解反应的应用、沉淀转化的应用等,展示了相关知识在生产、生活中的应用价值。
酸碱中和滴定介绍和测定酸碱反应曲线的实验则是学习实验操作技能。
在教学功能上,这一章起着巩固和深化前一章所学知识的作用。
全章4节内容可分为两条知识链:一是与弱电解质相关的电离平衡,包括1-3节,它们在知识的认识水平上是渐进的,前一节是后一节的基础和铺垫;二是沉淀溶解平衡,安排在第4节,它的知识基础是溶解度和化学平衡理论。
从整体上看,本章内容以深入认识水溶液中离子反应的本质为核心问题线索,分别研究了各类物质(弱电解质、水、盐类、难溶电解质)在水溶液中的离子平衡,使学生发现化学平衡、电离程度和溶解度之间的关系,并了解这些原理的应用。
教材内容框架如下:二、本章教学内容在选修模块内容体系中的地位和作用学习“水溶液中的离子平衡”主题的基础是义务教育阶段化学(或科学)、高中阶段必修课程化学1、化学2模块中相关的元素化合物知识,以及本模块中主题2中化学平衡方面的理论知识。
1.物质在水溶液中的行为与化学反应中的能量转化和化学反应限度的关系化学反应原理模块前两个专题分别从化学热力学、动力学的角度介绍了有关化学反应的规律和理论,本专题以前两个专题的理论为基础,选取了最常见、最典型的水溶液体系来引导学生运用所学理论(特别是化学平衡理论)分析物质的行为。
例如,本专题在化学平衡常数的基础上建立水的离子积常数、电离平衡常5.掌握从简单到复杂、从单一研究对象到多个研究对象的复杂体系的研究方法。
化学反应原理---第三章复习

第一节水溶液知识点1 水的电离平衡1、水是一种弱电解质,存在着电离平衡,可表示如下:H2O H++OH-或H2O+H2O H3O+ + OH-2、影响水电离平衡的因素温度、酸、碱、能水解的盐等都能影响水的电离平衡,使水的电离平衡发生移动。
(1)升温平衡右移;(2)加酸或碱平衡左移;(3)加入能水解的盐平衡右移。
3、水的离子积水的离子积K w =[H+][OH-]K w的大小只与温度有关。
所以在应用水的离子积时,必须指明温度。
如不指明,则认为25℃。
室温下,纯水中[H+]=[OH-]=10-7mol•L-1K w=1×10-14mol2•L-2知识点2 溶液的酸碱性和pH1、溶液酸碱性的判断(1)溶液呈酸性、碱性还是中性,应看[H+]和[OH-]的相对大小:[H+]=[OH-]溶液呈中性;[H+]>[OH-]溶液呈酸性;[H+]<[OH-]溶液呈碱性。
(2)利用pH:常温下,pH=7 中性;pH<7 酸性;pH>7 碱性。
(3)利用pH试纸(1—14的整数):pH试纸测定的为溶液中的[H+],使用时不能润湿。
正确的操作方法为:用干燥洁净玻璃棒蘸取试液滴在试纸上,迅速和标准比色卡对比。
(4)利用pH计(精确到0.01)知识点3 pH的计算关键先求出溶液的[H+],再通过pH = -lg[H+]求溶液的pH。
知识点4 强电解质与弱电解质1、电解质与非电解质2、强电解质与弱电解质知识点5 电解质溶液的导电1、电解质的导电电解质导电能力取决于溶液中离子的浓度以及离子所带电荷数,而与电解质的强弱没有必然联系。
离子浓度越大,离子所带电荷越多,则导电能力越强;离子浓度越小,离子所带电荷越少,导电能力越弱。
知识点6 电离方程式的书写1、强电解质完全电离,在写电离方程式时,用“=”2、弱电解质部分电离,在写电离方程式时用“”(1)一元弱酸、弱碱一步电离CH3COOH CH3COO- + H+NH3•H2O NH4+ + OH-(2)多元弱酸分步电离,必须分步写出,不可合并(其中以第一步电离为主)H2CO3H+ + HCO3-(主)HCO3-H+ + CO32-(次)(3)多元弱碱分步电离(较复杂),在中学阶段要求一步写出Fe(OH)3Fe3+ + 3OH-[习题训练]1、将纯水加热至较高温度,下列叙述正确的是()A、水的离子积变大,pH变小,呈酸性B、水的离子积不变,pH不变,呈中性C、水的离子积变小,pH变大,呈碱性D、水的离子积变大,pH变小,呈中性2、25 ℃时,水的电离达到平衡:H2O H++OH-ΔH>0,下列叙述正确的是()A、向水中加入稀氨水,平衡逆向移动,[OH-]降低B、向水中加入少量固体硫酸氢钠,[H+]增大,K W不变C、向水中加入少量固体钠,平衡逆向移动,[H+]降低D、将水加热,K W增大,[H+]不变3、下列物质中,属于强电解质的是()A 、CO B、KOH C、Fe(OH)3 D 、HF4、下列电离方程式中,不正确的是( )A 、 Ba(OH)2 Ba 2+ + 2OH -B 、 NH 3•H 2O NH 4+ + OH -C 、 CH 3COOH CH 3COO - + H +D 、 AgCl=Ag + + Cl -5、能证明某物质是弱电解质的是( )A 、难溶于水B 、溶液中存在已电离的离子和未电离的分子C 、水溶液的导电性差D 、熔融状态时不导电6、在25 ℃时,某溶液中由水电离出的[H +]=1×10-12 mol·L -1,则该溶液的pH 可能是(双选)( )A 、12B 、7C 、6D 、27、t ℃时,水的离子积为K w ,该温度下将a mol•L -1一元酸HA 与b mol•L -1一元碱BOH 等体积混合,要使混合液呈中性,必要的条件是( )A 、混合液的pH=7B 、混合液中c(H +)=C 、a=bD 、混合液中c(B +)=c(A -)+c(OH -)8、下列说法中,正确的是( )A 、导电能力强的电解质溶液一定是强电解质溶液B 、 强电解质溶液一定比弱电解质溶液的导电性强C 、强电解质的水溶液中不存在溶质分子D 、 0.1 mol·L -1NaOH 溶液比0.01mol·L -1NaOH 溶液导电性强,因此前者是强电解质,后者是弱电解质。
《水溶液》 说课稿

《水溶液》说课稿尊敬的各位评委老师:大家好!今天我说课的题目是《水溶液》。
下面我将从教材分析、学情分析、教学目标、教学重难点、教法与学法、教学过程以及教学反思这几个方面来展开我的说课。
一、教材分析《水溶液》是高中化学选修 4《化学反应原理》第三章的内容。
这一章节是在学生已经学习了化学平衡和弱电解质的电离平衡等知识的基础上,进一步深入探讨水溶液中的离子平衡问题。
通过对水溶液的学习,学生能够更全面、深入地理解化学平衡原理在溶液体系中的应用,为后续学习沉淀溶解平衡等知识奠定基础。
教材首先介绍了水的电离和水的离子积常数,让学生了解水的微弱电离以及溶液酸碱性的本质。
接着,教材重点讲解了溶液的酸碱性和pH 的计算,帮助学生掌握判断溶液酸碱性的方法和 pH 的相关计算。
此外,教材还介绍了酸碱中和滴定这一重要的定量分析实验,培养学生的实验操作能力和数据处理能力。
二、学情分析学生在之前的学习中已经掌握了化学平衡的基本概念和弱电解质的电离平衡等知识,具备了一定的分析和解决问题的能力。
但是,对于水溶液中的离子平衡问题,学生可能还存在理解上的困难,特别是对于一些抽象的概念和复杂的计算,需要教师进行引导和帮助。
此外,高二的学生已经具备了一定的实验操作能力和探究精神,在教学中可以通过实验和探究活动,激发学生的学习兴趣,培养学生的创新思维和实践能力。
三、教学目标1、知识与技能目标(1)了解水的电离、水的离子积常数。
(2)掌握溶液的酸碱性与 pH 的关系,能够进行 pH 的简单计算。
(3)理解酸碱中和滴定的原理,掌握酸碱中和滴定的操作方法和数据处理。
2、过程与方法目标(1)通过实验探究和数据分析,培养学生的观察能力、实验操作能力和数据处理能力。
(2)通过对水溶液中离子平衡问题的讨论和分析,培养学生的逻辑思维能力和问题解决能力。
3、情感态度与价值观目标(1)让学生体验科学探究的过程,培养学生的科学态度和创新精神。
(2)通过对水溶液中化学知识的学习,让学生认识到化学与生活的密切联系,增强学生学习化学的兴趣。
化学反应原理第三章第三节沉淀溶解平衡

化学反应原理第三章第三节沉淀溶解平衡化学反应原理第三章第三节沉淀溶解平衡教学案⽂登⼀中⾼⼆化学组新授教学案引、导学、测议、教查、练出⽰⽬标学习指导⾃主学习⾃我检测合作探究讲解提⾼⾃查反馈拓展训练〖教学流程〗〖学习过程〗【温故知新】1.根据溶解度的不同可将物质分为难溶、微溶、可溶、易溶。
2. CaCO3、FeS、Mg(OH)2等难溶电解质在⽔溶液中以何种形式存在?学习内容⼀:沉淀溶解平衡与溶度积【学习⽬标】1. 知道难溶电解质在⽔中存在沉淀溶解平衡,并能结合实例进⾏描述。
2. 了解沉淀溶解平衡的概念及其影响因素。
3. 了解溶度积的含义、表达式的书写及其计算。
4. 知道溶度积是沉淀溶解平衡的平衡常数,溶度积可以反映难溶电解质在⽔中的溶解能⼒。
【学习指导】沉淀溶解平衡建⽴的描述总结沉淀溶解平衡的概念;1.根据PbI3.通过阅读表3-3-1⼏种难溶电解质的Ksp,总结常见沉淀AgCl、AgBr、AgI 溶解能⼒的⼤⼩;【⾃主学习】阅读教材P页【观察·思考】90—91实验现象:在上层清液中滴加KI溶液后,有______________产⽣。
结论解释:说明上层清液中有_______当加⼊KI后,I-浓度增⼤,从⽽有___⾊的____⽣成。
⼀、沉淀溶解平衡1、定义:⼀定温度下,难溶电解质在⽔中_________的速率和_________的速率相等时,形成电解质的________ 溶液,达到平衡状态,我们把这种平衡称为沉淀溶解平衡。
2、沉淀溶解平衡的特征:(1)_________(2)________(3)_______(4)______ (5)____3、影响沉淀溶解平衡的因素:(1)内因:(2)外因:⼆、沉淀溶解平衡常数-----溶度积常数或溶度积Ksp1、定义:在⼀定条件下,难溶电解质在溶液中达到时,其称为溶度积常数简称为溶度积,⽤______表⽰,有单位。
例如: Mg(OH)2(s) ≒ Mg2 + (aq) +2OH- (aq)25℃ Ksp = [Mg2 + ][OH-]2= 5.6×10-12mol3·L-32、表达式:(见P96页)对于 AmBn (s)3、溶度积的影响因素:溶度积(Ksp )的⼤⼩与_____________和______________有关,与⽆关。
高中二年级上学期化学《水溶液中的离子反应与平衡总复习》教学设计

人教版(2019)普通高中教科书选修性必修1化学反应原理第三章水溶液中的离子反应与平衡总复习教学设计【课程标准】1.能描述弱电解质在水溶液中的电离平衡,了解酸碱电离理论。
2.知道水的离子积常数,能进行溶液pH的简单计算。
3.认识盐类水解的原理,归纳影响盐类水解程度的主要因素,能举例说明盐类水解在生产、生活中的应用。
4.能描述沉淀溶解平衡,知道沉淀转化的本质。
【教材分析】水溶液中的离子平衡与化学平衡密切相关。
本章内容实际上是应用前一章所学的化学平衡理论,探讨水溶液中离子间的相互作用。
电离平衡、水解平衡、沉淀溶解平衡的过程分析,体现了化学平衡理论的指导作用;pH的应用、盐类水解反应的应用、沉淀溶解平衡的应用等,体现了理论知识在生产、生活中的应用价值。
【学情分析】学生已经学了上一章中的化学平衡的理论知识,在必修中还学过电解质的知识。
在学习这章内容的时候,注意应用已学知识,从电离平衡到水解平衡到溶解平衡层层递进,难度较大。
【教学目标】1.认识电解质、盐类的水解的概念及方程式的书写。
2.理解电离平衡、水解平衡、溶解平衡的影响因素。
3.掌握溶液pH值、电离平衡常数、水解平衡常数、溶度积的计算公式。
4.掌握溶液中的离子浓度的大小比较。
【教学重难点】1.重点:电离平衡、水解平衡、溶解平衡。
2.难点:相关计算。
【教学方法】归纳总结、举一反三【教学过程】环节一【电解质和盐类水解】1、电解质(1)电解质:在水溶液或熔融状态下能够导电的化合物。
例如:酸、碱、盐、金属氧化物、H2O非电解质:在水溶液和熔融状态下都不能导电的化合物。
例如:非金属氧化物、大部分的有机物(蔗糖、酒精)、NH3(2)强电解质:能够全部电离的电解质。
例如:强酸、强碱、绝大多数的盐、活泼金属氧化物。
弱电解质:不能够全部电离的电解质。
例如:弱酸、弱碱、水。
注:判断电解质的强弱与溶解性无关,与溶液的导电性无关。
硫酸钡是强电解质,醋酸是弱电解质;浓醋酸可能比很稀的盐酸导电能力强。
【化学】鲁科版选修4《化学反应原理》教案:3.1《水溶液》(第3课时)

第三课时【题1】在25℃时,1mol•L-1的盐酸溶液中,水的Kw(单位:mol2•L-2)为(A)A.1×10-14B.0C.大于1×10-14D.小于1×10-14【解析】在一定温度下,水的离子积Kw为常数,不随水溶液中[OH-]和[H+]的改变而改变,只要在常温下,任何稀水溶液的Kw均为1×10-14mol2•L-2。
【题2】关于溶液酸碱性的说法中,正确的是(C)A.[H+]很小的溶液一定呈碱性B.pH=7的溶液一定呈中性C.[OH-]=[H+]的溶液一定呈中性D.不能使酚酞溶液变红的溶液一定呈酸性【解析】溶液的酸碱性最本质的判断标准是[OH-]和[H+]的相对大小。
如果[OH-]=[H+],溶液呈中性;如果[OH-]<[H+],溶液呈酸性;如果[OH-]>[H+],溶液呈碱性。
[H+]很小的溶液,[OH-]也可能很小;pH=7的溶液只有在常温下才是中性的;常温下,pH<8的溶液都不能使酚酞变红,可能为酸性、中性或弱碱性。
【题3】下列溶液中,肯定是酸性的是(D)A.含H+的溶液B.加酚酞显无色的溶液C.pH<7的溶液D. [OH-]<[H+]的溶液【解析】溶液的酸碱性判断方法虽然有多种,但用指示剂的判断是比较粗略的,它只能测出溶液的pH所在范围。
溶液的pH与温度有关,用pH判断也不够准确。
【题4】下列说法中,正确的是(D)A.向纯水中加入少量盐酸,Kw将增大B. 25℃时,水的离子积常数Kw为1×10-14mol2•L-2C.100℃时,纯水的[H+]=10-7mol•L-1D.100℃时,pH=7的溶液呈碱性【解析】25℃时,水的离子积常数Kw为1×10-14mol2•L-2,其值与溶液的浓度无关。
由于水的电离是吸热过程,温度升高,有利于水的电离,使得Kw增大,则在100℃时,[H+]的值在大于10-7mol•L-1呈中性,则100℃时,pH=7的溶液呈碱性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
水溶液3
1.将足量AgCl分别放入:①5mL水②10mL 0.2mol〃L-1MgCl2溶液③20mL 0.5 mol〃L-1NaCl溶液④40mL 0.1 mol〃L-1盐酸中溶解至溶液饱和,各溶液中Ag+浓度分别为a、b、c、d,它们由大到小顺序是。
2.某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。
下列说法正确的是()
A.加入Na2SO4固体可使a点变到b点
B.通过蒸发可使d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
3.已知t℃时AgCl的K sp=4×10-l0,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。
下列说法错误
的是()
A.在t℃时,Ag2CrO4的K sp为1×10-11
B.在Ag2CrO4饱和溶液中加入K2CrO4可使溶液由Y点到Z点
C.在t℃时,Ag 2CrO4(s)+2Cl-(aq)2AgCl(s)+CrO42-(aq)
平衡常数K=6.25×107
D.在t℃时,以0.001 mol〃L-1AgNO3溶液滴定20 mL0.001mol〃L-1KCl
和0.001 mol〃L-1的K2CrO4的混和溶液,CrO42-先沉淀
4.某温度下,Fe(OH)3(s)、 Cu(OH)2分别在溶液中达到沉淀溶解平
衡后,改变溶液pH,金属阳离子浓度的变化如图所示。
据图分析,
下列判断错误的是()
A. K sp[Fe(OH)3]<K sp[Cu(OH)2]
B.加适量NH4Cl固体可使溶液由a点变到b点
、两点代表的溶液中c(H+)与c(OH-)乘积相等
C.c d
D.、Fe(OH)3、 Cu(OH)2分别在b、c两点代表的溶液中达到饱和
5.某混合溶液中含有Fe3+和Al3+,向该溶液中滴入氨水,有Fe(OH)3与Al(OH)3共沉淀时,体系中
c(Fe3+)︰c(Al3+)= 。
[ 已知:Fe(OH)3的K sp=4.00×10-38,Al(OH)3的 K sp=1.33×10-33 ] 6.(1)粗制的CuCl2〃2H2O晶体中常含有Fe3+、Fe2+杂质。
在提纯时,常先加入合适的氧化剂,将
Fe2+氧化为Fe3+,下列可选用的氧化剂是___________。
A.KMnO4
B.H2O2
C.Cl2水
D.HNO3
(2)己知:常温下K sp[Fe(OH)3]=8.0×10-38,K sp[Cu(OH)2]=2.2×10-20,lg2=0.3。
通常认为残留在溶液中的离子浓度小于1×10-5mol〃L-1时就认为沉淀完全。
试计算
①将溶液的pH调至PH=__________时Fe3+转化为Fe(OH)3而沉淀完全。
②若CuSO4溶液的浓度为2.2mol〃L-1,则Cu(OH)2开始沉淀时溶液的pH为__________。
(3)调整溶液的pH可选用下列中的____________。
A.NaOH(aq)
B.NH3〃H2O
C.CuO粉末
D.Cu(OH)2悬浊液
E.Cu2(OH)2CO3(s)
1.a>d >b>c
2.C
3.D
4.B
5.3.0×10-5
6.(1) BC (2) ① 3.3 ②4 (3) CDE。
