物质的量浓度上课新
第2章 第6讲 物质的量浓度(学生版)2025年高考化学一轮复习讲义(新人教版)
第6讲 物质的量浓度[复习目标] 1.了解物质的量浓度及其相关物理量的含义和应用,体会定量研究对化学科学的重要作用。
2.了解溶液物质的量浓度的表示方法,理解溶解度、质量分数等概念,并能进行有关计算。
3.掌握一定物质的量浓度溶液的配制方法并能进行误差分析。
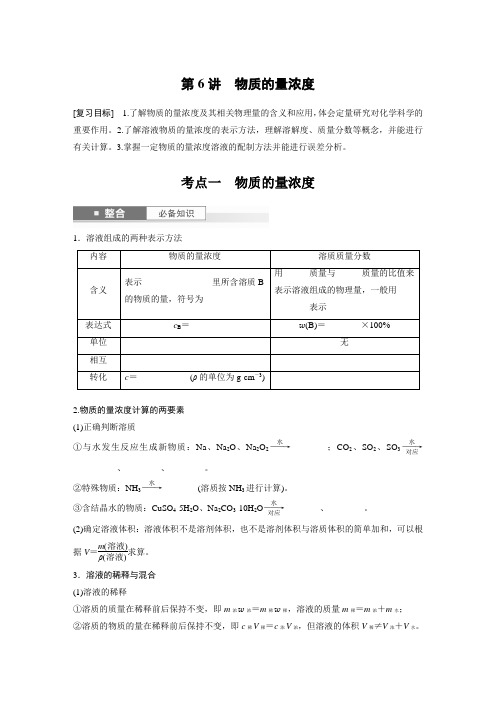
考点一 物质的量浓度1.溶液组成的两种表示方法内容物质的量浓度溶质质量分数含义表示________________里所含溶质B 的物质的量,符号为______用______质量与______质量的比值来表示溶液组成的物理量,一般用________表示表达式 c B =______w (B)=________×100%单位 无 相互转化 c =____________(ρ的单位为g·cm -3)2.物质的量浓度计算的两要素 (1)正确判断溶质①与水发生反应生成新物质:Na 、Na 2O 、Na 2O 2――→水________;CO 2、SO 2、SO 3――→水对应__________、________、________。
②特殊物质:NH 3――→水________(溶质按NH 3进行计算)。
③含结晶水的物质:CuSO 4·5H 2O 、Na 2CO 3·10H 2O ――→水对应________、________。
(2)确定溶液体积:溶液体积不是溶剂体积,也不是溶剂体积与溶质体积的简单加和,可以根据V =m (溶液)ρ(溶液)求算。
3.溶液的稀释与混合 (1)溶液的稀释①溶质的质量在稀释前后保持不变,即m 浓w 浓=m 稀w 稀,溶液的质量m 稀=m 浓+m 水; ②溶质的物质的量在稀释前后保持不变,即c 稀V 稀=c 浓V 浓,但溶液的体积V 稀≠V 浓+V 水。
(2)溶液(溶质相同)的混合①物质的量浓度不同(分别为c 1、c 2)的两溶液:混合前后溶质的物质的量保持不变,即c 1V 1+c 2V 2=c 混V 混。
新教材高中化学 第1章 认识化学科学 第3节 第3课时 物质的量浓度课件 鲁科版必修第一册

里的“5.04×10-3 mol·L-1”表示葡萄糖的( )
A.物质的量
B.摩尔质量
C.质量分数
D.物质的量浓度
解析 根据单位可确定“5.04×10-3 mol·L-1”表示葡萄糖的物质的
量浓度。
解析 答案
3.下列关于 1 mol/L 的硫酸钠溶液的叙述正确的是( ) A.溶液中含有 1 mol 硫酸钠 B.1 L 溶液中含有 142 g 硫酸钠 C.1 mol 硫酸钠溶于 1 L 水,可得到上述浓度的溶液 D.从 1 L 溶液中取出 500 mL,剩余溶液的物质的量浓度为 0.5 mol/L
答案
解析 A 项,58.5 g NaCl 的物质的量为 1 mol,溶于水配成 1 L 溶液, 所得溶液浓度为 1 mol·L-1,但题目中的 1 L 是溶剂的体积,不是溶液的体 积,故溶质的物质的量浓度不是 1 mol·L-1;B 项,SO3 的物质的量为 6.02×1022÷6.02×1023mol-1=0.1 mol,SO3 溶于水生成 H2SO4,而 n(H2SO4) =n(SO3)=0.1 mol,溶液体积为 1 L,则溶质的物质的量浓度为 0.1 mol·L- 1,不是 1 mol·L-1;C 项,标准状况下 22.4 L HCl 气体的物质的量为 1 mol, 配成 1 L 溶液,所得溶液中溶质的物质的量浓度为 1 mol·L-1;D 项,含 2 mol K+的 K2SO4 的物质的量为 1 mol,但溶液体积未知,不能确定溶质的物质 的量浓度。
的物质的量浓度仍然为 1 mol/L,D 错误。
解析 答案
4.在容量瓶上没有标记的是( )
A.刻度线
B.温度
C.物质的量浓度
D.容积
解析 容量瓶上标有温度、容积和刻度线,没有标溶液的物质的量浓
高中化学 第2节 第3课时物质的量浓度教学课件 新人教版必修1

三、物质的量浓度
【问题3】
物质的量浓度与溶质质量分数的比较
溶质的物质的量浓度
溶质的质量分数
符ห้องสมุดไป่ตู้ 定义
相似处
c(溶质)
w(溶质)
单位体积溶液里所含溶质B的物质的量称 溶质的质量分数是溶质质量与溶液质
为B的物质的量浓度
量之比
都是表示溶液中溶质组成的物理量
不 溶质的物理量 同 (及单位) 处 溶液的物理量
,溶质的质量分数变为21.2%,则浓缩后氢氧化钠溶液的物质的 量浓度为多少?
答案:0.5 mol/L
【方法】稀释前后,溶液中溶质的质量和物质的量不变。即
、、、分别是稀释前后溶液的物质的量浓度和体积。) 、、、分别为稀释前后溶液的质量和质量分数。)
三、物质的量浓度
3.一定物质的量浓度溶液的配制 【问题6】
如何配制100 mL 1.00 mol/L的NaCl溶液? 答案:(1)操作步骤①计算:所需NaCl固体的质量为5.85 g;②称量 :准确称量NaCl固体;③溶解:将称量好的NaCl固体放入烧杯中,然 后用适量蒸馏水溶解,该步操作用到的仪器有烧杯、玻璃棒;④冷 却:将烧杯中的溶液冷却至室温;⑤转移:将烧杯中的溶液沿玻璃 棒缓缓注入100 mL容量瓶中;用适量蒸馏水洗涤烧杯内壁和玻璃棒2 ~3次,并将洗涤液也注入容量瓶中;⑥振荡:用手轻轻摇动容量瓶 ,使溶液混合均匀;⑦定容:把蒸馏水沿着玻璃棒缓缓注入容量瓶 中,当液面距离容量瓶颈刻度线下 1~2 cm时,改用胶头滴管加蒸馏 水至凹液面的最低处与刻度线相切(视线要保持水平)。⑧摇匀:盖 好瓶塞,反复上下颠倒,摇匀。
(及单位)
计算式
物质的量n (摩尔/mol) 质量m (克/g)(千克/kg)
2022新教材高中化学第二章第三节第三课时物质的量浓度教案新人教版必修第一册

第三课时 物质的量浓度[明确学习目标] 1.能够根据物质的量浓度的概念表达式进展简单的计算。
2.学会容量瓶的使用方法、一定物质的量浓度溶液配制的实验操作和误差分析。
学生自主学习物质的量浓度在公式c B =n BV中V 指□05溶液的体积而非溶剂的体积。
一定物质的量浓度溶液的配制以配制100 mL 1.0 mol·L -1的NaCl 溶液为例。
1.主要仪器(1)托盘天平、药匙、烧杯、量筒、□01玻璃棒、□02胶头滴管、□03100_mL_容量瓶。
(2)容量瓶的构造及使用2.配制步骤1.98 g H2SO4溶于1 L水中配成的溶液即是1 mol/L的H2SO4溶液,这句话正确吗?为什么?提示:不正确,将98 g H2SO4(即1 mol)溶于1 L水后所得溶液体积不是1 L,故H2SO4的物质的量浓度不是1 mol/L。
2.实验室需要450 mL 0.1 mol/L的NaOH溶液,要配制该溶液是否选择200 mL和250 mL 的容量瓶?提示:否,当所配溶液体积没有对应容积的容量瓶(常用的容量瓶容积有100 mL、250 mL、500 mL和1000 mL)时,应选择比所配制溶液体积大且最接近的容量瓶,故配制450 mL溶液应选择500 mL容量瓶。
课堂互动探究知识点一物质的量浓度一、运用c B 的考前须知1.物质的量浓度的概念中的“单位体积〞指的是溶液的体积,而不是溶剂的体积。
2.溶质B 表示任意的溶质,B 的组成可以是分子、离子等,也可以是由阴、阳离子构成的构造单元。
3.对于一定物质的量浓度的溶液,不管取用多少体积,各份溶液中溶质的物质的量浓度始终不变,只是在不同体积的溶液中,溶质的物质的量不同。
例如,1 L 1 mol·L-1的NaCl溶液中,Cl -的物质的量浓度为1 mol·L -1,Cl -的物质的量为1 mol ;从中取出0.5 L ,该份溶液中Cl -的物质的量浓度仍为1 mol·L -1,而Cl -的物质的量变为0.5 mol 。
《物质的量的浓度》教案

物质的量的浓度[第一课时]教学目标知识目标1.使学生理解物质的量浓度的概念。
2.使学生掌握有关物质的量浓度概念的计算。
3.使学生掌握溶液的质量分数和物质的量浓度的换算。
4.使学生初步学会配制一定物质的量浓度溶液的方法。
能力目标1.在概念的教学中,培养学生的思维能力。
2.通过有关物质的量浓度计算的教学,培养学生的计算能力。
3.通过配制一定物质的量浓度溶液的教学,培养学生的观察和动手实验能力。
情感目标1.与初中知识的衔接,使学生感到获取新知识、新方法的喜悦。
2.通过实验激发学生学习化学的兴趣,培养学生严谨求实的科学作风。
教学建议教材分析本节主要包括物质的量浓度的概念,有关物质的量浓度的计算和配制一定物质的量浓度的溶液的方法等几部分。
本节教材是在学生学习了质量分数和物质的量的概念的基础上,使学生掌握另一种表示溶液组成的方法。
通过本节的学习,可以使学生扩大知识面,提高计算能力,初步学会配制一定物质的量浓度溶液的实验技能,为以后的学习打下基础。
因此,本节是高中的重点内容,也是有关化学计算和化学实验基本操作的重点内容之一。
本节教材的引入是从初中学习过的质量分数开始的。
通过复习旧知识,回忆溶液的组成,表示浓度的方法,分析质量分数在实际使用中的不便之处。
自然顺畅的引出表示溶液组成的另一种方法。
量体积是很方便的,同时物质的量的使用比起质量来也很简便。
由此展示出学习新知识的必要性和实用性。
对于物质的量浓度着重分析了以下几点:概念的理解。
表达式更加简洁明了。
与质量分数有明显的区别。
而且通过公式的变形可以求出溶质的物质的量或溶液的体积,也就是说为物质的量浓度的有关计算提供了便利条件。
教材中以讨论的形式提出了学生容易出错的问题。
其一:物质的量浓度中涉及的体积是溶液的体积,不是溶剂的体积。
其二:从一定的物质的量浓度的溶液中取出一定体积的溶液,其浓度不变。
变化的是溶质的物质的量和溶液体积,但是二者的比值没变。
对于这一点必须给学生澄清。
新版高中化学讲义:物质的量浓度

题型三:溶液的稀释/混合计算
【变 4-1】(2021·邓州市第一高级中学校高一月考)将 5 mol L1 的 Mg NO 3 2 溶液 a mL 稀释至 b mL,稀释后
溶液中 NO3 的物质的量浓度为
A.5a/b mol L1
B.b/5a mol L1
C.10a/b mol L1
C.0.3 mol/L
D.0.5mol/L
【答案】B
【详解】
2
某溶液中 c(Na+)=0.2mol/L,c(Mg2+)=0.25 mol/L,c(Cl-)=0.4mol/L,如果溶液中还有 SO 4 ,根据溶液呈电中
2
1
性,则 c(SO 4 )= 2 [(0.2mol/L×1)+(0.25mol/L×2)-(0.4mol/L×1)]=0.15mol/L,故答案选 B。
综上所述答案为 C。
题型二:溶液呈电中性的计算
【例 3】(2021·普宁市大长陇中学高三月考)已知某溶液中 c(Na+)=0.2mol/L,c(Mg2+)=0.25 mol/L,
2
2
c(Cl-)=0.4mol/L,如果溶液中还有 SO 4 ,那么 c(SO 4 )应为
A.0.1 mol/L
B.0.15molL
D.a/b mol L1
【答案】C
【详解】
溶液稀释时,溶质的物质的量不变,c(Mg(NO3)2)=
根离子,则 c( NO3 )= c(Mg(NO3)2)×2=
5mo1 ‧L-1×amL 5a
=
mol L1 ,Mg(NO3)2 中含有 2 个硝酸
b
bmL
10a
高考化学一轮第2章物质的量第5讲物质的量浓度新人教版

项正确。
突破命题视角
角度一 一定物质的量浓度溶液的配制
1.(2023·浙江宁海知恩中学月考)用胆矾(CuSO4·5H2O)配制480 mL 0.100
mol·L-1 CuSO4溶液,下列做法中正确的是( A )
A.可选用500 mL容量瓶
L-1,浓硫酸的浓
度为18.4 mol·
L-1,由稀释定律可知:4.6 mol·
L-1×0.25 L=18.4 mol·
L-1×V,
V=0.062 5 L,故需浓硫酸62.5 mL,C正确;50 mL 1 mol·
L-1的AlCl3溶液中氯
离子浓度为3 mol·
L-1,75 mL 2 mol·
L-1的NaCl溶液中Cl-浓度为2 mol·
1
c<9.2 mol·
L-1。
2.(2023·浙江嘉兴高级中学月考)用密度为ρ1 g·cm-3、质量分数是w的浓盐
酸,与水配制成体积比为1∶4的稀盐酸,密度为ρ2 g·cm-3,则所配制稀盐酸的
物质的量浓度(单位:mol·L-1)为( C )
1 000 1 2
A.
182.5
1 000 1 2
第5讲 物质的量浓度
选考目标要求
1.了解物质的量浓度的概念和有关物质的量浓度的计算。
2.掌握一定物质的量浓度溶液配制的操作并能正确进行误差分析,在探究
中学会合作,面对“异常”现象敢于提出自己的见解。
命题分析
近三年浙江选考试题中物质的量浓度的考查主要是一定体积物质的量浓
度溶液的配制实验,表现为实验仪器的选择以及实验过程中实验操作。另
物质的量的浓度【最新3篇】

物质的量的浓度【最新3篇】物质的量的浓度篇一教学设计示例二第三节物质的量浓度第二课时知识目标进一步巩固物质的量浓度的概念使学生初步学会配制一定物质的量浓度溶液的方法。
能力目标通过配制一定物质的量浓度溶液的教学,培养学生的观察和动手实验能力。
情感目标通过实验激发学生学习化学的兴趣,培养学生严谨求实的科学作风。
教学重点:一定物质的量浓度的溶液的配制方法。
教学难点:正确配制一定物质的量浓度的溶液。
教学方法:启发式教学手段:多媒体辅助教学过程:引入:物质的量浓度是表示溶液浓度的一种重要的方法,在学习了概念之后,今天我们学习如何配制一定物质的量浓度溶液的方法。
板书:二、物质的量浓度溶液的配制例如:配制500mL0.1mol/LNa2CO3溶液。
提问:配制的第一步要做什么?板书:1.计算学生计算,教师加以订正。
提问:知道了质量如果取固体?如果是液体呢?板书:2.称量提问:天平使用时的注意事项演示:用托盘天平称量无水碳酸钠。
设问:如果需要配制氢氧化钠溶液,如果称量其固体?讲述:配制用的主要仪器――容量瓶。
让学生观察容量瓶,注意有体积、温度和刻度线。
介绍其规格,如何检验是否漏水及其使用方法。
(此处也可以播放动画“配制一定物质的量浓度溶液”中的相关部分。
板书:3.溶解提问:溶解能够在容量瓶中进行吗?演示:在烧杯中溶解固体,用玻璃棒搅拌加速溶解。
边演示边讲解注意事项:溶解时不能加入太多的水;搅拌时玻璃棒不能碰烧杯壁;不能把玻璃棒直接放在实验台上;待溶液冷却后,再转移到容量瓶中,因此第四步是转移。
板书:4.转移讲述:由于容量瓶瓶颈很细,为了避免溶液洒落,应用玻璃棒引流。
演示:把烧杯中的溶液转移到容量瓶中提问:烧杯和玻璃棒上残留的液体应如何处理?板书:5.洗涤演示:洗涤2~3次,每次的洗涤液也转移到容量瓶中。
边演示边讲解注意事项。
提示:如果用量筒量取液体药品,量筒不必洗涤。
因为这是量筒的“自然残留液”,若洗涤后转移到容量瓶中会导致所配溶液浓度偏高。
高中化学第三节物质的量第3课时物质的量浓度课件新人教版必修第一册

1 mol
特别提醒
对物质的量浓度的理解 (1)溶质用物质的量表示,而不是质量,如给出溶质的质量或气体的 体积时,要换算成物质的量。 (2)“溶质”指溶液中的溶质,可以指化合物也可以指离子或其他特 定 组 合 , 分 析 溶 质 时 要 注 意 有 关 变 化 。 如 : Na 、 Na2O 、 Na2O2 H2O NaOH,溶液中的溶质都是NaOH。 (3)表达式中“V”指溶液的体积,不是溶剂的体积,也不是溶质体积 和溶剂体积之和,要根据混合后溶液的密度计算溶液体积。V的单位 是升(L)。 (4)溶质的物质的量浓度是溶液的固有属性之一,当从一定物质的量 浓度的溶液中取出任意体积的溶液时,其物质的量浓度、密度、质量 分数不变,但随溶液体积的变化,溶质的质量、物质的量不同。
第3课时 物质的量浓度
学业基础 学考评价
核心素养
核心微网络
素养新要求
1. 认识物质的量浓度的含义。 2.学会物质的量浓度的简单计算方法。 3.学会配制一定物质的量浓度的溶液。 4.了解并应用浓溶液稀释的计算原理。
学业基础
一、物质的量浓度
单位体积
物质的量
cB
mol·L-1 nB V
mol/L
核心素养
目标1 物质的量浓度的基本计算和判断 例1 下列溶液中物质的量浓度为1 mol·L-1的是( ) A.将40 g NaOH溶解在1 L水中 B.将22.4 L HCl气体溶于水配成1 L溶液 C.将1 L 10 mol·L-1浓盐酸加入9 L水中 D.将10 g NaOH溶解在少量水中,再加蒸馏水直到溶液体积为250
A.硫酸铜的物质的量为0.5 mol B.溶于500 mL水中 C.溶解后溶液的总体积为500 mL D.溶解后溶液的总体积为1 L
新教材高中化学23第3课时物质的量浓度教案新人教版

第3课时 物质的量浓度课程标准核心素养,体会定量研究对化学科学的重要作用。
2.能基于物质的量认识物质的组成及其化学变化,并运用物质的量、摩尔质量、气体摩尔体积、物质的量浓度之间的相互关系进行简单计算。
3.能配制一定物质的量浓度的溶液。
1.变化观念:认识物质的量浓度在化学定量研究中的重要作用。
2.宏观辨识与微观探析:建立物质的量浓度的概念,基于物质的量浓度定量认识物质的组成及物质的化学变化。
3.科学探究:选择常见实验仪器、装置和试剂,配制一定物质的量浓度的溶液。
物质的量浓度及其计算1.概念:单位体积的溶液里所含溶质B 的物质的量,符号为c B ,常用单位为mol/L 或mol·L-1。
2.表达式:c B =n BV,其中的“V ”指的是溶液的体积,而非溶剂的体积。
3.简单计算(1)已知溶液中某种离子的浓度,求其他离子的浓度溶液中阴、阳离子的物质的量浓度之比=化学组成中的离子个数之比。
例如:Na 2SO 4溶液中,c (SO 2-4)=1 mol·L -1,则 c (Na +)=2__mol ·L -1,c (Na 2SO 4)=1__mol·L-1。
(2)已知一定体积的溶液中溶质的质量计算浓度例如:2.0 g NaOH 固体溶于水配成500 mL 溶液,则该溶液的浓度为____mol·L -1。
(3)标准状况下,一定体积的气体溶于水形成V L 溶液计算浓度例如:标准状况下,11.2 L HCl 气体溶于水配成200 mL 溶液,则该溶液的浓度为__mol·L-1。
1.物质的量浓度与溶质的质量分数的换算 (1)换算公式:c B =1 000ρw Mmol ·L -1M :溶质B 的摩尔质量(单位:g·mol -1);ρ:溶液密度(单位:g·mL -1);w :溶质的质量分数。
(2)推导方法设溶液体积为1 L ,则c B =n BV=ρ g ·mL -1×1 000 mL ×wM g ·mol -11 L =1 000ρw Mmol ·L -1。
物质的量浓度的计算 高考化学一轮复习(新教材新高考)
ω1·m1 = ω2·m2
C1V1 = C2V2
1
(1)加入质量的水,即ω变为原来的 ,求c的变化
2
① > 1 g·cm-3 eg: H2SO4 HNO3 NaOH c↑ ↑
1000 ω
↓
c↓ =
c稀 <
2
② < 1 g·cm-3 eg:NH3·H2O CH3CH2OH
÷c
÷M
n(溶质)
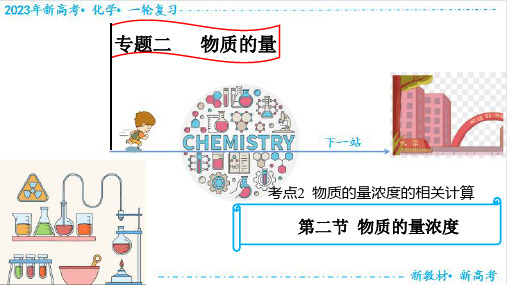
一、物质的量浓度相关计算
1.溶质的质量分数ω与物质的量浓度c的关系
c=
n
V
m质 /M 质
m质 /M 质
=
=
m液 /1000 液
m液 /1000 液
1000 液
=
M质
(液 单位为g/cm3)
ω=
1000
一、物质的量浓度相关计算
2.饱和溶液溶质的质量分数ω与溶解度S
c= =
质
剂
/22.4
液/
=
× 100% =
/22.4
质+ 剂
=
/22.4
22.4× +1000×1
1000
×
22.4
1000×1+22.4×
×
=
1000
22400+
22400+
=
100
%
22400+
−3
一、物质的量浓度相关计算
4.溶液的稀释
5.溶液的混合
若混合后溶液的体积保持不变时
C1V1 + C2V2 = C混 × (V1 + V2)
物质的量浓度教案

物质的量浓度教案物质的量浓度教案在教学工作者开展教学活动前,总不可避免地需要编写教案,教案是教学活动的依据,有着重要的地位。
快来参考教案是怎么写的吧!下面是小编为大家整理的物质的量浓度教案,希望能够帮助到大家。
物质的量浓度教案篇1第二课时[复习巩固][投影]1.已知某1 L H2SO4溶液中含有250 mL浓H2SO4,可以算出这种溶液的物质的量浓度吗?(不能)2.已知每100克H2SO4溶液中含有37克H2SO4,可以算出这种溶液的物质的量浓度吗?(不能)[设问]那么,要算出溶液中溶质的物质的量浓度,必须从哪方面着手呢?[结论]必须设法找出溶液的体积和溶液中溶质的物质的量。
[教师]请大家根据刚才的分析,做如下练习。
[投影]3.将质量为m,相对分子质量为Mr的物质溶解于水,得到体积为V的溶液,此溶液中溶质的物质的量浓度为 (c= ) [引言]上节课我们知道了物质的量浓度的概念及其与质量分数的区别,本节课我们来学习物质的量浓度与溶质的质量分数之间的联系及有关溶液稀释的计算。
[板书]二、溶液中溶质的质量分数与物质的量浓度的换算[投影]例1.已知37%的H2SO4溶液的密度为1.28 g·cm-3,求其物质的量浓度。
[分析]从上节课的知识我们知道,溶质的质量分数和物质的量浓度都可用来表示溶液的组成。
因此,二者之间必定可以通过一定的关系进行换算。
根据我们刚才的讨论分析可知,要算出物质的量浓度,必须设法找出所取溶液的体积及其中所含溶质的物质的量。
由于浓度是与所取溶液的多少无关的物理量,所以,我们既可取一定质量的溶液来计算,也可取一定体积的溶液来计算,为此,我们可以采用以下两种方法。
解法一:取100 g溶液来计算m(H2SO4)=100 g×37%=37 gn(H2SO4)= =0.37 molV(液)= =78.12 mL=0.078 Lc(H2SO4)= =4.8 mol·L-1答:37%的H2SO4溶液的物质的量浓度为4.8 mol·L-1。
高一化学上学期物质的量浓度--新人教版

托盘天平 100mL容量瓶
小
结
物质的量浓度的概念、简单计算 及物质的量浓度溶液配制
C(B)=
n(B)
V
n==C V
练
习
1、下列说法是否正确?为什么?
1)将1mol的NaOH溶于1L水中所得溶液的 物质的量浓度为1mol/L 2)将22.4LHCl溶于水配成1L溶液,则所得溶液 的物质的量浓度为1mol/L
(或mol·L-1)
单位: mol/L
思考:1mol/L的NaCl溶液所表示的含义
V 练习:1、将2mol的HCl溶于水配成4L溶液, 求所得溶液的物质的量浓度是多少? n(HCl) 2mol =0.5 mol/L C(HCl)= = 4L V 2、100mL1.00mol/LNaCl溶液中含有NaCl的
定容
摇匀
称 量
1、用托盘天平能称量出5.85g的NaCl吗? 2、称量时能将NaCl固体直接放置于托盘 上吗? 如果称量NaOH呢?
溶 解
某同学为了加快溶解速度,溶解时所 加的水为100mL,你认为可以吗?
否
转 移
如何将烧杯中的液体 转移到容量瓶中?
如不慎将烧杯中的溶液洒到 容量瓶外,最后所得的溶液 中溶质的实际浓度比所要求 的变 小 容量瓶在实验之前用蒸馏水洗涤 对实验结果有无影响?
2、用固体Na2SO4配制500ml1mol/L的Na2SO4 溶液需要仪器哪些玻璃仪器? 烧杯、玻璃棒、500mL容量瓶、胶头滴管
作
业
1、将标准状况下13.44L的HCl气体溶于水 配成250mL溶液,求溶液中HCl的物质 的量浓度。 2、课本P18 第4题
选 作 题
98%的浓硫酸的物质的量浓度是多少? (已知其密度为1.84g/cm3 )
高一化学上学期物质的量浓度--新人教版

- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2、容量瓶上的标识
3、容量瓶不能用于溶解、稀释、加热、长久 储存溶液等——专用于配制溶液。 4、容量瓶使用前要检查是否漏水。
误差分析:
⑴称量NaOH的时间过长 ⑵在转移过程中 有少量溶液溅出 ⑷在称量的过程中天平 指针左偏⑸未做充分冷却 ⑹ 定容时俯视 刻度线 ⑺定容时仰视刻度线 ⑻容量瓶中 原来有少量的水 ⑼在加水的过程中有少量 的水漏出 (10)定容摇匀时,液面下降再 加水 (11)定容时加水加多了,用滴管吸 出 (12)称量前小烧杯内有水。
是____________, 此时溶液中所含Na2SO4的物质的量是 5mol/L
71g 0.5mol/L _________质量是________
(3)若将上述100mL溶液再加水稀释至1L,则Na2SO4的物 0.5mol/L 质的量浓度是_________
3、1mol/L的Na2SO4溶液是 A、溶液中含有1molNa2SO4
2、在200mL某硫酸盐溶液中,含硫酸根离子1.5NA 个,含金属离子NA个,则该硫酸盐溶液的物质的量 浓度为 A、2.5mol/L B、5mol/L
C、7.5mol/L
D、2mol/L
1、下列溶液与100mL0.5mol/LNa2SO4溶液中的 Na+的物质的量浓度相等的是 A、200mL0.5mol/LNaCl溶液
14)未等溶液冷却就定容
的质量分数为 a%,而等体积混 小,则 c<a。故答案为 B。 合后,溶液的质量分数为 c%, 那么 a、 b、 c 数值的关系是( B ) A.a>b>c C.c>b>a B.b>a>c D.c>a>b
溶液的物质的量浓度(mol/L)
溶 液 体 积 (
÷阿伏加德罗常数 )
×
溶 液 体 积 ( )
B、1L溶液中含有142gNa2SO4
C、1molNa2SO4溶于1L水中 D、将322gNa2SO4.10H2O溶于少量水后再稀释 成1000mL。
3:配制500mL0.40mol/L的CuSO4溶液
需要CuSO4的质量是多少? 需要CuSO4· 5H2O的质量是多少 4:
将13.44L(标准状况)HCl 气体溶于水 配成250mL溶液,该溶液中HCl的物质的 量浓度是多少?
将标准状况下的a 升HCl气体溶于1 升水 中,得到的盐酸密度为b g· cm-3,则该盐 酸的物质的量浓度是( )
例 1 将标准状况下的 a L HCl(g)溶于 1 000 g 水 中,得到的盐酸密度为 b g·cm ,则该盐酸的物质的 量浓度是( )
-3
a A. mol·L-1 224 ab -1 B. mol·L 22 400 ab -1 C. mol·L 22 400+36.5a 1 000ab D. mol·L-1 22 400+36.5a
2、溶解、转移、洗涤产生误差
5)溶解过程中有少量液体溅 出烧杯
6)未洗涤溶解用的玻璃棒和烧杯 7)洗涤液未转入容量瓶中而倒入废 液缸中
3、定容误差 8)定容时仰视刻度
9)定容时俯视刻度 10)定容时液面低于刻度线 11)未等溶液冷却就定容 12)定容后发现液面高于刻度线 后,用滴管吸出少量溶液
13)摇匀后发现液面低于刻度再加水
4、溶质相同、质量分数不同的两溶液混合定律 同一溶质、质量分数分别为a%、b%的两溶液 混合。
(1)等质量混合
两溶液等质量混合时(无论ρ>1 g· cm-3还是ρ<1
g· cm-3),则混合后溶液中溶质的质量分数
w=(a%+b%)/2。
(2)等体积混合
①当溶液密度大于1 g· cm-3时,必然是 溶液浓度越大,密度越大,(如H2SO4、 HNO3、HCl、NaOH等多数溶液)等体积 混合后质量分数w>(a%+b%)/2。 ②当溶液密度小于1 g· cm-3时,必然是 溶液越浓,密度越小,(如酒精、氨水溶 液)等体积混合后,质量分数w<(a%+ b%)/2。
×摩尔质量
÷
L
L
微粒数(个)
物质的量(mol)
÷摩尔质量 ×22.4L/mol ÷22.4L/mol
物质的质量(g)
×阿伏加德罗常数
标准状况下气体体积(L)
配制100ml 1.00mol/L的NaCl溶液?
一种容量瓶只能配置规定体积的溶液 使用容量瓶必须注明其容量。 1、常用规格
注 意 问 题
50ml. 100ml. 250ml. 500ml. 1000ml
应量取浓盐酸体积/mL
பைடு நூலகம்应选用容量瓶的规格/mL
2
250
有一浓度为14%的KOH溶液, 加热蒸发掉100g水后,得到浓度为 28%的KOH溶液80mL,则浓缩后 溶液的物质的量浓度为多少。
25、将标准状况下的a升HCl气体溶于水配成 1升溶液,得到盐酸密度为bgcm-3,则该盐 酸的物质的量浓度是 ( ) A、a/22.4molL-1 B、ab/22400molL-1 C、ab/(22400+36.5a)molL-1 D、1000ab/(22400+36.5a)molL-1
物质的量浓度
什么是溶液中溶质的质量分数?
溶质的质量分数=
溶质质量
溶液质量
×100%
1、定义 以单位体积溶液里所含溶质B的物质的 量来表示溶液组成的物理量,叫溶质B的物质 的量浓度.
cB=
nB V
单位是mol /L
V是指溶液体积,单位是L
1.将1 mol NaCl加到1 L水中,得到的NaCl溶液的浓度 是1 mol·L-1吗?
1 .①在稀 H2SO4 中,若 c(H2SO4)= 0.2 mol· L 1 ,则 c(H ) =
- + - -1 ________ mol· L-1,c(SO2 ) = ________ mol· L 。 4
2- ②在 Al2(SO4)3 溶液中,若 c(SO4 )=0.3 mol· L-1,则 c(Al3+)
【例 3】 浓度不等的两种硫酸溶液 等质量混合后,溶液的质量分数 为 a%,而等体积混合后,溶液
解析
由混合后溶质质量分数的
判定规律知,硫酸溶液密度大于
-3 1 g· cm ,故 b>a;氨水密度小于 的质量分数为 b%;浓度不等的 -3 1 g· cm ,且浓度越大,密度越 两种氨水等质量混合时,其溶质
B、100mL1mol/LNa2CO3溶液
C、100mL0.5mol/LNa3PO4溶液
D、1L1mol/LNaOH溶液
3.有硫酸镁溶液 500 mL,它的密 度是 1.20 g· cm-3, 其中镁离子的 质量分数是 4.8%,则有关该溶 液的说法不正确的是 ( )
C
基础再现·深度思考
A.溶质的质量分数是 24.0% B.溶液的物质的量浓度是 2.4 mol· L-1 C.溶质和溶剂的物质的量之比 是 1∶40 D.硫酸根离子的质量分数是 19.2%
刻度线
俯视读数时到达刻度线却以为超过了
刻度线
平视读数、液面与刻度线相切
刻度线
正确
仰视读数、本来到刻度线却以为没到
15.原容量瓶洗净后未干燥 16.容量瓶中含有少量的水 17.往容量瓶中加水时有少量加到瓶外
均无影响
1、称量产生误差
1)称量时左盘高,右盘低
2)称量时称量物放在右盘,而砝 码放在左盘 3)量筒量取液体药品时仰视读数 4)量筒量取液体药品时俯视读数
2:将60gNaOH溶于水配成500mL溶液,求所得溶 液的物质的量浓度
从一定物质的量浓度的溶液中取出任意体积的溶 液,其浓度不变。稀释时按倍数缩小。
练习1:现有1L 5.00mol/L的Na2SO4溶液
(1)溶液中的Na2SO4物质的量为___________ 5mol
(2)取100mL上述溶液,其中Na2SO4的物质的量浓度
基础再现·深度思考
7.实验室用密度为 1.25 g· mL-1,质量分数为 36.5%的浓盐酸配 制 240 mL 0.1 mol· L-1 的盐酸,请回答下列问题:
12.5 mol· L-1 。 (1)浓盐酸的物质的量浓度为____________
(2)配制 240 mL 0.1 mol· L-1 的盐酸
3.溶质相同、质量分数不同的两溶液混合定律 同一溶质、质量分数分别为 a%、b%的两溶液混合。 (1)等体积混合 ①当溶液密度大于 1 g· cm
-3
时, 必然是溶液浓度越大, 密度越大,
(如 H2SO4、HNO3、HCl、NaOH 等多数溶液)等体积混合后质量 1 分数 w> (a%+b%)。 2 ②当溶液密度小于 1 g· cm-3 时,必然是溶液越浓,密度越小,(如 1 酒精、氨水溶液)等体积混合后,质量分数 w< (a%+b%)。 2 (2)等质量混合 两溶液等质量混合时(无论 ρ>1 g· cm 3 还是 ρ<1 g· cm 3),则混合 1 后溶液中溶质的质量分数 w= (a%+b%)。 2
- -
【例2】
(1)将3p%的硫酸与同体
积的p%的硫酸混合得到q%的稀 硫酸,则p、q的关系正确的是
② ________ 。
①q=2p ③q<2p
②q>2p ④无法确定
(2)若上题中的溶质是乙醇而非
③ 硫酸,则p、q的关系是_____ 。
①q=2p ③q<2p
②q>2p ④无法确定
规律方法·解题指导
=________ mol· L 1,c[Al2(SO4)3]=________ mol· L 1。
- -
答案:①0.4
0.2
②0.2
0.1
电离方程式中的系数可表示出各物质的浓度比。
2、b mlAl2(SO4)3溶液中含有Al3+ag,
