第13章 羧酸及其衍生物
09-第十三章 羧酸衍生物.

邻苯二甲酰亚胺钾
RX -KX
O NR O
NaOH H2O,
RNH2 +
COOCOO-
伯胺 (高纯度)
13.4.6.2 酰胺脱水
CONH2
P2O5 强热
CN + H O 2
CH2CH3 CH3CH2CH2CH2CHCONH2
SOCl2, 苯
CH2CH3 CH3CH2CH2CH2CHCN + H2O
13.4.6.3 Hofmann降解反应
乙腈
苯甲腈
丙烯腈
己二腈
3-甲基戊腈
13.1.3 酯
酯是按照形成它的酸和醇来命名的。
O CH3C OC2H5 O CH3
CH3COCH2CH2CHCH3
COOCH3
乙酸乙酯
乙酸异戊酯 (香蕉水)
苯甲酸甲酯
C OCH CH2 O
CH3CO OCH2 CH3CO OCH2 O
O
β-萘甲酸乙烯酯
乙二醇二乙酸酯
O R C NH2
Br2, NaOH
RNH2
少一个碳原子的伯胺
(CH3)3CCH2CONH2
Br2, NaOH
(CH3)3CCH2NH2
O C NH2
Br2, NaOH
NH2
回忆一下已学知识中有关降解 (减碳) 反应的内容有哪些?
课堂练习:p. 458
13.8、13.9
p.462 (七)
13.5 碳酸衍生物
丁二酰亚胺
己内酰胺
13.1.2 酸酐和腈
酸酐和腈的命名是由它们水解后所得的酸来命名的。
O O CH3COCCH3 O O CH3COCCH2CH3 O O O
乙酸酐
大学有机化学第十三章羧酸

CH3-C CH-COOH CH3
4
3
2
1
3-甲基-2-丁烯酸
取代酸
CH
CHCOOH
3-苯基丙烯酸(肉桂酸) ( -苯基丙烯酸)
◆ 羧酸的物理性质
O R C
=
O
H O
H H H
R C
=
O
H O O
O H
O H
=
C R
羧酸是极性分子,能与水形成氢键,故低级一元酸可 与水互溶,但随M↑,在水中的溶解度↓,从正戊酸开始 在水中的溶解度只有3.7 %,>C10的羧酸不溶于水。
O CH3C OH + NH3
CH3COOH + NH3
O
CH3C O.NH4 200℃CH C NH 3 2
CH3COONH4 Δ CH3CONH2 + H2O
-+
O
二元酸的二铵盐受热则发生分子内脱水兼脱氨,
生成五元或六元环状酰亚胺。
C H2C O O NH 4 C H2C O O NH 4
O
300℃
回流
ClCH2COOH
Cl2 , P
一氯乙酸
Cl2CHCOOH
回流
Cl2 , P Cl3CCOOH
二氯乙酸
回流
三氯乙酸
α-卤代酸是一种重要的取代酸,它可以发生与卤代烃相 似的亲核取代或消去反应,从而转变成其它的取代酸。
如:
CH3COOH Br2 ,P BrCH2COOH NaCN NCCH2COOH α-氰基乙酸
b.p: 羧酸 > M 相同的醇。
IR谱:
OH伸缩振动—
二聚体:2500~3300cm-1(宽而散);
单体: 3550cm-1(气态或非极性溶剂的稀溶液)。 C=O伸缩振动——脂肪族羧酸:1700~1725cm-1 芳香族羧酸:1680~1700cm-1
大学化学 羧酸及其衍生物
产物是酰胺。酰胺的氨(胺)解比较困难。
9.7.2 还原反应
羧酸衍生物分子中的羰基可被还原,比羧酸容 易。被还原难易程度,与酰化能力的强弱次序一致。 与羧酸相同,酰氯、酸酐、酯和酰胺也可被氢化 铝锂还原。除酰胺生成胺外,其他均生成伯醇。
一定条件下,采用还原剂可将酰卤、酰胺等还 原成醛。其中常用的是采用硫脲或硫—喹啉部分毒
化了的Pd-BaS04为催化剂,使酰氯加氢,可得到高
产率的醛。
酯被钠和乙醇或LiBH4还原成伯醇。例如:
•
•
9.2 羧基的结构
1. 羧基中碳原子是sp2杂化; 2. 与烃基----C sp3,及C=O和-OH中O的各一个原子 轨道形成三个σ 键,共处同一平面,键角120°。 3. 羰基 C未参与杂化的 p轨道与羰基O的一个p轨道 侧面交盖形成π 键。 4. 羟基O的未共用电子对的p轨道,与羰基的π 轨道 形成p,π -共轭体系。
脂肪族羧酸
脂环族羧酸
芳香族羧酸
9.1.2 命名 1.俗名: 甲酸来自蚂蚁,称蚁酸; 乙酸存在于食醋,称醋酸; 丁酸在奶油中,称酪酸;
十八酸在于油脂,称硬脂酸;
苯甲酸于安息香胶中,称安息香酸等。
2.系统命名法: 饱和一元羧酸命名:
1) 选择含有羧基碳原子在内的最长碳链作为主链, 根据主链碳原子数目称为“某酸”; 2) 主链碳原子可从羧基开始用 1 、 2 、 3… 阿拉伯 数字编号,或从与羧基碳原子直接相连的碳原 子开始用α 、β 、γ …希腊字母编号; 3) 取代基的名称和位次放在“某酸”之前,其排 列的顺序则按照“次序规则”。
2. 电子离域:
解离成羧酸根负离子后,由于p , π - 共轭效应影
响,电子发生离域,负电荷均匀分布在两个氧原子上:
第十三章-+羧酸衍生物

Ac2O
H2N CH3
KMnO4 / H+ AcHN CH3
AcHN
COOH
H+ / H2O
H2N
COOH
降低反应活性,制备酚、芳胺的单卤代化合物
OH
Ac2O
OAc
Br2 / Fe
OAc
H+ / H2O
OH
Br
Br
23
五、格氏反应
O Ph C Cl CH3MgBr Et2O OMgBr Ph C Cl CH3 -MgBrCl O Ph C CH3 CH3MgBr OMgBr Ph C CH3 CH3 H3O+ OH Ph C CH3 CH3
R CO2C2H5 O NaOC2H5 C2H5OH
R CO2C2H5 O
R R' R'X CO2C2H5 O 1) NaOH 2) H3O O R R' 双烷基化
乙酰乙酸乙酯制备甲基酮衍生物
甲酸己酯:苹果香味 甲酸苄酯:香蕉香气 乙酸苯乙酯:玫瑰清甜蜜香 苯乙酸苄酯:茉莉香气
11
二、化学性质:亲核取代反应
1.水解反应(hydrolysis)
O R C O R C O R C O R C NH2(R') OR' O X H 2O HX O C R' O O R H2 O HOR' H+ or OH H2 O H+ or OH HNH2 (HNHR') C OH + HO C R'
苯甲酰溴
4
2、酸酐的命名
以酐为母体,前面加酸的名称
CH3CH2CO-O-OCCH3
O O H C O C H
有机化学第十三章 羧酸及其衍生物
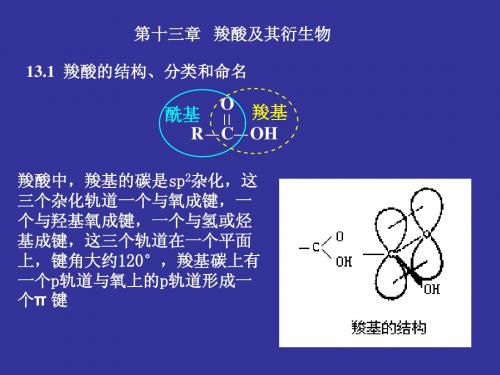
2) 与羰基相连的基团(Y) 空间体积; 3) 与羰基相连的基团(Y)
离去能力; 4) 反应物稳定化程度。
离去基团的离去能力: X- > RCOO- > RO > H2N
O R C Y
OR C Y+
羧酸衍生物亲核取代反应活性顺序:
O O O O > RCNH2 ~ ~ RCN
RCX > RCOCR >
RCH2Cl3 + H2O RCH2CN + H2O RCH2COOR' + H2O ......
RCH2COOH
13.3 羧酸的物理性质(P309) 13.4 羧酸的化学性质(P311) 1、酸性和成盐
sp
2
自学
R C
O OH R C
O
O OH
O C O
R C O-
两个碳氧键键长不同
四电子三中心的分子轨道 两个碳氧键键长等同。
O HO HC HOH2C OH
O
CH3
OH
Erythromycin A (红霉素) A
Vitamin C
• 酰胺
CH3 O O HCN-CH3 CH3
N,3-二甲基戊酰胺 N,N-二甲基甲酰胺
COOH
CH3CH2CHCH2CNHCH3
NHCOCH3
4-乙酰氨基-1萘羧酸
氮原子上有取代基, 在取代基名称前加N标出。
O NH R O R-C-NH N O S CH3 CH3 COOH
R=C6H5CH2(penicillin G)
γ -内酰胺
青霉素 ( penicillin )
物理性质(自学)
13.9 羧酸衍生物的物理性质
[工学]第十三章--羧酸及其衍生物PPT课件
![[工学]第十三章--羧酸及其衍生物PPT课件](https://img.taocdn.com/s3/m/b7c4094d53d380eb6294dd88d0d233d4b04e3f5c.png)
强、宽谱带
NMR:
-COOH 上质子的化学位移9.5~13ppm
-
11
§13.3 羧酸的化学性质
-COOH的结构: C(近似)sp2杂化
O
O
P-π共轭,羟基、
R
C O
R H
C
O.. H
羰基不是独立的
H离解后负电荷为- 三原子共同承担
12
O
O-
RC
RC
O-
O
共 振酸 结根 构的 式
亲核试剂进攻生成羧酸衍生物
反丁烯二酸 (富马酸)
-
6
§13.2 羧酸的物理性质和波谱性质
• C1~3:无色透明液体 C4~10: 油状液体 C10以上:蜡状固体。 • 饱和一元羧酸的沸点随分子量的增加而升高。
分子量相近时,沸点:羧酸>醇。
原因:羧酸氢键较稳定,并形成双分子缔合。
O HO
H3CC OH
CCH3 O
例:甲酸 (101℃) > 乙醇 (78℃)
解: -Cl 连在开链烃上主要为诱导效应,距离越近作用越大。
酸性:CH3CHClCOOH > CH2ClCH2COOH
-
18
例:比较酸性
COOH
COOHCOOH COOH
OC3H HO
H2N
解:供电子强弱顺序:-NH2 > -OH > -OCH3 都使酸性减弱
COOH COOH COOH COOH
-
30
二.由烃氧化制备
CH 3
KMnO4
H+
COOH
烯烃、有α-H的烷基苯氧化
三.由R-MgX制备
R-MgX + O=C=O
有机化学第十三章羧酸衍生物总结

反应活性较差
叔醇
吡啶
O C OC(CH3)3
不仅起催化作用 还可吸收产生的HCl
2) 酯交换:由低级醇酯制高级醇酯
= H+
CH2 CHCOOCH3 + CH3(CH2)2CH2OH
b.p: 80.5℃ 低沸点酯
= CH2 CHCOO(CH2)3CH3 + CH3OH
b.p: 145℃
b.p: 64.7℃
R C =O > X
=
R C =O
O RC
O
> R C =O > R C =O
OR′
NH2
第二步——取决于离去基团的离去能力。
基团的离去能力:
! 试解释之
X > RCOO > RO > NH2
碱性越小离去能力越强。
碱性强弱:
X < RCOO < RO < NH2
结论:
羧酸衍生物的反应活性顺序为
R C =O > X
== =
== =
O C O C4H9_ n
C OH
O
邻苯二甲酸单正丁酯
O CH3 C O CH2 CH3 C O CH2
O
乙二醇二乙酸酯
CH2OCOR CHOCOR'
甘油三酯:脂肪和油
CH2OCOR''
O
H3C
CH3
H3C
HO H3CH2CH
OH O
O
CH3
CH3 OH HO O
O O
N(CH3)2
青霉素 ( penicillin )
酸酐:两个羧酸名加“酐”字。
O
OO
OO
COC
羧酸及其衍生物

2. 比较下列两组化合物酯化反应速率大小:
CH3COOH (1) A
CH3CH2COOH B
(CH3)3CCOOH (C2H5)3CCOOH
C
D
CH3OH CH3CH2OH (CH3)2CHOH (CH3)3COH
(2) A
B
C
D
解答:(1)A>B>C>D (2)A>B>C>D
有机羧酸与醇的酯化反应的速率受酸和醇的烃基结构的影响,烃基结构越大,酯
£¬
饱和
NaHSO3
CH2OH
²» ·´ Ó¦
8. 写出下列反应的机理:
CH3CH2CO2CH3 NaOCH3
解答:
CH3 OCH3
OO
CH3CH2CO2CH3
CH3O
O
CH3CHCO2CH3 CH3CH2C OCH3
OCH3
O CH3CH2C CH CO2CH3
CH3
O
CH3CH2C OCH3 CHCO2CH3 CH3
6. 鉴别下列化合物:
a. 甲酸
b. 草酸
c. 丙二酸
解答:甲酸是液体,其余为固体
a
+
b
AgNO3/NH3 +
c
d
¡÷
CO2
¡÷
CO2
d. 丁二酸
7. 用化学方法分离下列化合物:
CHபைடு நூலகம்OH
CHO
COOH
£¬
£¬
解答:
NaOH(aq)
COONa
Ë®²ã
H+
COOH
CHO
CH2OH CHO
°×É«¾§Ìå H3+O
有机化学:第十三章羧酸及其衍生物

2. 酸酐的生成
用P2O5作脱水剂制备酸酐
O CH3 C OH O O P2O5 CH3 C O O C CH3
+
HO
C CH3
+
H2O
用低沸点酸酐作脱水剂制备较高沸点的酸酐
O 2 COOH + (CH3CO)2O
(
C
) 2O + 2 CH COOH
3
能形成五元、六元环酸酐的二元羧酸可直接加热制备酸酐
羧酸与PX3 、PCl5(X=Cl、Br)、SOCl2反应
3CH3COOH + PCl3
3 CH3 COCl + H3PO3
COOH+PCl5
(CH3)2CHCH2COOH + SOCl 2
COCl + POCl3+ HCl
(CH3)2CHCH2COCl
+
SO2
+ HCl
注:HX不能与羧酸反应生成酰卤 。 应用:酰卤的反应活性比较高,广泛应于药物合成中 。
( 2)编号:从羧基碳原子开始用阿拉伯数字编号,按所含碳原
子数目称为某酸,取代基名称及位次写在某酸之前。
( 3)简单的酸酸,常用希腊字母表明取代基的位置,从羧基相 邻碳原子开始编号为 ,依次为 、 、 等,将编号写在取代基 名称前面。
CH3CH2CHCH2COOH CH3
-甲基戊酸(3-甲基戊酸)
第十三章
羧酸及其衍生物 主要内容
1、掌握羧酸和取代羧酸的结构、命名和化学性质 2、掌握羧酸衍生物的结构、分类及命名和化学性质
3、熟悉羧酸和取代羧酸的物理性质
4、掌握羟基酸、酮酸的命名及主要化学性质。
羧酸:
羧酸及其衍生物

羧酸及其衍生物羧酸及其衍生物Ⅰ 目的要求羧酸是含有羧基(―COOH)的含氧有机化合物,我们平常所说的有机酸就是指的这类化合物。
所谓羧酸衍生物,包括的化合物种类很多,诸如羧酸盐类、酰卤类、酯类(包括内酯、交酯、聚酯等)、酸酐类、酰胺类(包括酰亚胺、内酰胺)等都是羧酸衍生物,有人甚至把腈类也包括在羧酸衍生物的范围之内。
其实,比较常见的而又比较重要的是酰卤、酸酐、酯和酰胺这四类化合物。
羧酸盐与一般无机酸盐在键价类型上没大区别,不作专门介绍。
至于腈类,将放在含氮化合物中加以介绍。
这四类化合物都是羧酸分子中,因酰基转移而产生的衍生物,所以又叫羧酸的酰基衍生物。
羧酸及其衍生物RCOL(L:-OH、-X、-OOCR′、-OR′、-NH2)在许多重要天然产物的构成以及在生物代谢过程中均占有重要地位。
本章将以饱和一元脂肪酸为重点,讨论羧酸及其衍生物的结构和性质。
鉴于乙酰乙酸乙酯和丙二酸二乙酯在有机合成上的重要地位,本章作概括介绍。
希望学生在此基础上,探讨设计合成路线的一般方法。
本章学习的具体要求1、掌握羧酸的结构与性质之间的关系。
2、掌握羧酸衍生物的主要化学性质。
3、了解羧酸衍生物的亲核取代反应机理。
4、掌握羧酸与羧酸衍生物之间相互转变条件。
5、了解卤代酸、羟基酸的特性。
6、掌握乙酰乙酸乙酯和丙二酸二乙酯的制法、性质和在有机合成上的应用。
这也是本章的重点之一。
Ⅱ 学习提要(一)羧酸一、概述羧酸往往有俗名,希望学生有所了解,尽可能记忆一些,脂肪酸的系统命名原则和醛相β α同。
γCH3-CH-CH2-COOH2 14 3 OH 芳香酸命名是把芳环视作取代基。
76羧酸的沸点比分子量相近的其它有机物高,这是由于羧酸能以氢键缔合。
同时,即使在气态时,羧酸也是双分子缔合的,所以羧酸的沸点比分子量相近的醇还要高。
二、羧酸结构和化学性质亲核取代O 还原R-C-C-O-H α-H反应H 脱羧酸性1、酸性?E O O O +?R-C H + R-C R-C E EO-H O OO O NaOH/Na2CO3/ NaHCO3H2O + R-C E R-C EH+ O-Na O-H应用:①鉴别:与酚不同,与非酸性物质不同。
第十三章 醛、酮羧酸及其衍生物

OCOCH3
布洛芬
阿司匹林
13.1 羧酸的结构、分类和命名
1、结构
C
醛酮中 醇中
O OH
O 形式上看羧基是由一个 C 和一个OH 组成 实质上并非两者的简单组合
O 键长 0.122nm H C OH (甲酸) 0.1245nm 0.1312nm 电子衍射实验证明
C O C OH
键长 0.143nm
俗名:
• 羧酸是极性化合物, 沸点高于相应分子质量的醇。
13.2. 羧酸的制备
1. 伯醇或醛的氧化——制备同碳数的羧酸
(CH3)3C CH C(CH3)3 CH2OH CH3CH2CHO
KMnO4/H2SO4 K2Cr2O7, H2SO4
(CH3)3C CH C(CH3)3 COOH CH3CH2COOH
H2C O3 6.38
羧酸离解后生成的RCOO  ̄负离子,由于共轭效应 的存在,氧原子上的负电荷则均匀地分散在两个原子 上,因而稳定容易生成。
O R C O
1 2 1 2
R
C=
O R C
O R O C
O O
1 2 1 2
O
相对酸性:
RCOOH > HOH > ROH > HC
=
CH > NH3 > RH
=
O O H O OH R C OH O
两个碳氧键键长不同
四电子三中心的分子轨道 两个碳氧键键长等同。
酸性
RCOOH
RC O O H pKa 4~5 (甲酸除外) H2O 15.7
RCOO + H
RO H 16~19
+
羧酸的酸性比水、醇强,甚至比碳酸的酸性还要强。
R-COOH
第13章 羧酸及其衍生物

HOCH2CH2CH2CH2COOH
d
-羟基戊酸
CH3CH2C CHCOOH CH3
-甲基--戊烯酸
1.用系统命名法命名下列化合物:
1. CH 3(CH 2)4COOH .
1
CH3(CH 2)4COOH
2.CH 3CH(CH 3)C(CH 3)2COOH
2.CH 3CH(CH 3)C(CH 3)2COOH
CH3 (CH3)2CHCH2 CHCOOH
COOH OCCH3 O
阿司匹林(解热镇痛药)
布洛芬(抗炎镇痛药)
生命活动与之息息相关
― 生物体内大多数代谢反应都发生在羧基等官能Байду номын сангаас或强烈的受其影响的 邻位上
第十三章
羧酸及其衍生物
(一)羧酸
13.1 羧酸的结构、分类和命名 13.1.1 羧酸的结构
O
分子中含有
丁酸
丁酸 丁酸
5 23 1 2 1 4 5 34 3 5 4 2 1 C H3 CC H CCH CCHCOOHC3,OH 3,,4-二甲基戊酸 H H CH CH O4- 二甲基戊酸 C H3 C H H2 CH22COOH 34- 二甲基戊酸 3 - 二甲基戊酸 -二甲基戊酸 - 二甲基戊酸 CH3 CCH C H H3 C H CH33 3 3
C3H7CHO C3H7CH CN 醛出发制备带有其他官能团的羧酸:
HCN C3H7CHO OH C3H7CH CN H2O, HCl
HCN
OH H2O, HCl
OH C3H7CH
OH C3H7CH COOH
COOH
C3H7CHO
HCN (NH4)2CO3
有机化学II-13羧酸及其衍生物
羧酸和芳香族羧酸都是固体。
水溶性:
C1~C4羧酸可以和水混溶。芳香族羧酸分子量大,
难溶于水。 4-11碳部分溶解;羧酸盐水中溶 解性好
(长链羧酸盐为好的表面活性剂)。
实 例
O O H H
COOH OH
COOH
O
OH
邻位
诱导吸电子作用大、 共轭给电子作用大、 氢键效应吸电子作用大。 pka 2.98 苯甲酸的pka 4.20
间位
诱导吸电子作用中、 共轭给电子作用小。
对位
诱导吸电子作用小、
共轭给电子作用大。
pka 4.08
pka 4.57
二元酸: 有两个解离常数 举例:
十八酸 硬脂酸
CH2 COOH CH2 COOH
乙二酸(草酸) 丙二酸(胡萝卜酸) 丁二酸(琥珀酸)
HOOC
COOH
顺丁烯二酸 (马来酸)
反丁烯二酸 (富马酸)
苯甲酸(安息香酸)
(乙)系统命名法
(A)脂肪族羧酸
母体: 选含羧基的最长连续碳链,不饱和羧酸选含羧 基和不饱和键在内的最长连续碳链为主链.
内酐
COOH 230oC COOH
CO O + H2O CO
二元酸酐
邻苯二甲酸酐
混合酸酐
O
O
CH3CH2 C Cl + Na OCCH3
△
O O CH3CH2C OCCH3
3. 酯的生成
RCOOH + R'OH H+
RCOOR' + H2O
第13章羧酸及其衍生物

CH3CH2CH2COOH CH3CH2CH2CH2OH CH3CH2CH2CHO CH3CH2COCH2CH3
CH3CH2CH2CH2OH CH3CH2CH2CHO CH3CH2COCH2CH3
CH3CH2CH2CH2OH CH3CH2COCH2CH3
NaOHaq NH23NHOH
用氢氧化钠水溶液处理,再酸化分出丁酸
O
CH3
CO
CH3
CC
CH3 O C CH3
O
2. β-羟基丁酸
CH3CHCH2COOH OH
3. β-甲基-γ-羟基戊酸
CH3 CH3CHCHCH2COOH
OH
C H 3 C H = C H C O O H
CH3
CO O
4. δ-羟基戊酸
5. 乙二酸
H O C H 2 C H 2 C H 2 C H 2 C O O H
OO
CH3
Mg
OO
CH3
CH3CCH2CH2C Br
CH3CCH2CH2C MgBr
(C2H5)2O CH3
CH3
十一、试写出下列反应的主要产物:
1
CH2CH2COOH P2O5
CH2CH2COOH
O C
O C
CCOOC2H5
2
+
CCOOC2H5
O
CCOOC2H5
CCOOC2H5
3
Na2Cr2O7 H2SO4
HOC OH C=2C CH OC OH H C3HC COOH HOOCCC3H
H C COOH
H C CO
2-戊烯-1,5-二酸; 2-甲基-顺丁烯二酸; 2-甲基-反丁烯二酸
四、比较下列各组化合物的酸性强度: 1 醋酸, 丙二酸,草酸,苯酚, 甲酸酸性强度顺序:
有机化学羧酸及其衍生物

O
CH2C
CH3CH2CH
O
CH2C
O
Ⅱ 羧酸的衍生物
★ 酰氯、酸酐、酯和酰胺都是羧酸中的羟基被不同 基团取代的产物,统称为羧酸衍生物。
10.6 命名:
① 酰氯和酰胺以其所含的酰基来命名; ② 酸酐根据其来源的酸命名; ③ 酯按其来源的酸和醇,叫某酸某酯。
O
酰氯
H3CC Cl
O
OH
R COH LiAlH4 RCH2
4)烃基上的反应: ① α—卤代作用:脂肪羧酸中的α—H比其它C原子
上的H活泼,可被卤素取代:
C3 C HOO 2o H 日 红 r 光 磷 + C 一 l2 C C C 氯 O H l 日 乙 C O 2 l光 C H 酸 二 2 C l H 氯 C 日 C 乙 2O l光 C 三 酸 O 3 C l H 氯 CO 乙
O CH 3COC2H5
NaO2HC 5
O
-CH 2CO OC2H5CH 3 COC2H5
(Ⅰ)
OO CH 3CCH 2COC2H5+-OC2H5
乙 乙酰酸 乙酸乙乙酰 酯 乙酯
O- O
[CH 3CCH 2 COC2H5] OC2H5 (Ⅱ)
5)酰胺的酸碱性:氨是碱性的,但酰胺是中性 物质。这是由于氮上未共用电子对与碳—氧 双键共轭而氮原子上电子密度降低所致。O .. R C NH 2
O
RC O
HCOOH
CH3CO2H
CH3CH2CH2CO2H
CH3CH2CHCO2H Cl
CH3CHCH2CO2H Cl
ClCH2CH2CH2CO2H
pKa 3.75
4.75
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
13.10 酰基碳上的亲核取代(加成-消除)反应
(1)
亲核加成 R的性质影响
(2)
消除反应
•碱性越弱 越易离去
亲核反应活性
O C O C O C O C O C 酯 O C R' N R" 酰胺
R
X
R
O
R'
R
OH
R
OR
R
酰卤
酸酐
羧酸
酰卤 > 酸酐 > 醛 > 酮 > 羧酸 ~ 酯 > 酰胺 • 在亲核取代反应中,酰氯的活泼性最大,酸酐次之。 所以酰氯、酸酐在有机合成中常用为酰基化剂。
上酰卤、酸酐、酰胺等。
• 酯的命名可在酯前加上相应的羧酸和醇来命名,称 为“某酸某酯”。
• 酰胺分子中氮上的氢原子被烃基取代后所生成的 取代酰胺,称为N-烃基“某”酰胺.
• 含 有 —CONH— 基 的 环 状结构的酰胺,称为“内 酰胺”。
13.9 羧酸衍生物的物理性质 •它们都是极性化合物 • 酰卤的沸点较相应的羧酸低(无氢键缔合); 酸酐 的沸点较相对分子量相当的羧酸低,但比相应的羧酸 高; 酯的沸点比相应的酸和醇都要低(与同碳数的醛 酮差不多)。 • 酰胺的氨基上的氢原子可在分子间形成强的氢键: 所以,酰胺的沸点比相 应的羧酸高。
3-苯丙烯酸 苯乙酸(苯醋酸) (-苯丙烯酸,肉桂酸)
-萘乙酸
2. 羧基直接与苯环相连——苯甲酸作为母体
COOH
COOH
苯甲酸(安息香酸)
CH3
对甲苯甲酸
• 多元芳香族羧酸的命名 • 用“羧酸”或“甲酸”作字尾,其它作为取 代基
COOH
COOH
COOH
COOH
对苯二羧酸
环己烷羧酸
-萘羧酸
-萘甲酸;1- 萘甲酸
第1步生成酮
第2步生成叔 醇,2个支链 是一样的!
• 格氏试剂的应用(总结)
R COOH 羧酸 OH O 1.CO2 1.HCHO RMgX R CH R R CH2OH 2.H2O R CH 2.H3O 2°醇 1°醇 醛 OH 1. O R MgX O R CH2CH2OH RMgX R C R' R'COOR'' 2.H3O R Li R CR' 1°醇 R 酮 醇 3° OH 1.R'COR'' O 1.R'CHO OH RMgX R'COCl 2.H O R CHR' 3 R CR' 2.H3O R C R' 1. R'CN 2°醇 R 酮 OH 2.H3O 3°醇 R C R' O 低温和空间位阻作用 R'' R CR' 使用不活泼的金属试剂 3°醇 酮
羧酸根负离子的共振结构式
• 羧酸显示酸性的原因——羧酸根负离子的稳定性
• 羧酸根负离子的共振杂化体由相同的两个共振结构 式组成,比羧酸(两个不同共振结构)要稳定得多。 指离解趋势 大
13.4.2 卤代酸的酸性、诱导效应
• 羧酸碳原子的 -H比较活泼,可被卤素取代。(需
要红磷存在)(可停留在一取代产物)。
氯乙酸
二氯乙酸
三氯乙酸
这种制备 -卤代酸的方法叫赫尔-乌尔哈-泽林斯基反应。
• 羧酸中的-H没有醛酮中的活泼,需要P或S作催化剂
才可发生取代。这是由于羧基中的羟基氧原子上的电 子可弥补羰基碳原子的缺电子性质,使它少从-C原子
上获得电子,因此-H较不活泼。
• -卤代酸的卤素像在卤烷中一样,可以发生亲核取代
羧酸的化学反应包括: (1) O—H键的酸性; (3) —OH基取代反应; (4) 脱羧反应
(2) —H取代反应 (4) C=O亲核加成
13.4.1 酸性
•羧酸呈明显的弱酸性,在水溶液中,羧基中的氢 氧键断裂,离解的氢离子与水结合成水合氢离子。
羧酸的pKa=45, 但比碳酸的酸性(pKa=6.5)要强,所 以羧酸可以分解碳酸盐,而苯酚(pKa=10)不能分解碳 酸盐,由此可以区别或分离酚和羧酸。
NaOH
C2H6 + CH4 + H2 + 不饱和化合物
44% 20% 33%
存在下列情况容易发生脱羧反应 1、羧酸的-C上连有强吸电子基团时,容易脱羧
O Cl3C C O H CHCl3 + CO2
2、-C原子为羰基碳的羧酸,也容易脱羧
O R C CH2COOH O R C CH3 + CO2
可能将反应控制在酮的阶段
O H COR'
13.11 各类羧酸衍生物及其重要代表 13.11.1 酰氯 (1)酰氯的制备
O 3 CH3CH2CH2COH + PCl3
酰溴的制备: 用PBr3
O 3 CH3CH2CH2CCl + H3PO3
O CH3(CH2)6COH + PCl5
COOH + SOCl2
俗名
O C
系统名 6
C
5
C
4
C
3
C
2
C OH
1
例如:
CH2=CH-COOH
丙烯酸(败脂酸)
CH3 -CH=CH-COOH
2-丁烯酸(巴豆酸)
CH 3 CH 3-CH-CH-COOH CH 3
俗称:,-二甲基丁酸 (,-二甲基酪酸) 系统名称: 2,3-二甲基丁酸
• 脂肪族二元羧酸的命名 • 选择分子中含有两个羰基的碳原子在内的最长碳链 作主链,称为某二酸.
加热 加热 H+
R—COOH + NH4Cl R—COONa + NH3 CH3CH2CH2CH2COOH ( 90% )
Ph-CH2CN + 2H2O 苯乙腈 •
浓H2SO4 加热
Ph-CH2COOH + NH3 苯乙酸 (78%)
注意: 此法不适用于仲卤烷和叔卤烷 (NaCN, KCN 的碱性强,易使仲或叔卤烷脱去卤化氢而成烯烃)。
COOH COOH
乙二酸(草酸)
HCOOH-CH2 -COOH
丙二酸(胡萝卜酸)
H C C HOOC 富马酸
COOH H
H C C HOOC
H COOH 马来酸
(反丁烯二酸)
(顺丁烯二酸)
• 芳香族羧酸的命名 1. 羧基与苯环支链相连——脂肪酸作为母体
CH 2COOH
CH2COOH
CH=CHCOOH
(2) 从油脂水解制备羧酸
• 肥皂就是碱性条件下生成的高级脂肪酸盐. (3) 苯甲酸的制备
CH3 3Cl 2 光 100~150℃
一取代?二取 代?水解?
CC l3 3 H2O, ZnCl2 100~115℃ COOH
13.2.4 从格利雅试剂制备
• 格氏试剂与CO2反应,再水解,可制备增加一个碳原子的羧酸
(环己烷甲酸) (对苯二甲酸,1,4-苯二甲酸)
13.2 羧酸的制备方法 13.2.1 从伯醇或醛制备羧酸
• 不饱和醇或醛须用弱氧化剂制备 CH3—CH=CH—CHO + [O]
AgNO3,NH3
托伦斯试剂
CH3—CH=CH-COOH
13.2.2 从烃氧化制备羧酸
1. 高级烷烃混合物氧化制取高级脂肪酸混合物,作为制皂原料.
(二)羧酸衍生物
13.8 羧酸衍生物的结构和命名 羧酸衍生物 —— 一般指羧基中的羟基被其他原子或 基团取代后所生成的化合物。羧酸和羧酸衍生物中都 含有酰基,因此也统称为酰基化合物。
• 羧酸分子中—OH被不同取代基取代,分别称为酰卤、 酸酐、酰胺和酯:
• 羧酸衍生物的命名 —将相应的羧酸去掉“酸”后,加
13.1.2 羧酸的分类和命名
(1) 分类
• 按羧基所连接的烃基种类: • 按烃基是否饱和: 脂肪族羧酸 饱和羧酸 脂环族羧酸 不饱和羧酸 芳香族羧酸
• 按所含羧基的数目: 一元羧酸 二元羧酸 三元羧酸
(2) 羧酸的命名 •俗名——根据天然来源(蚁酸(甲酸)、醋酸(乙酸)等) •系统命名法 (1)选择含有羧基的最长碳链为主链,称为某酸; (2)碳链编号时,从羧基的碳原子开始; (3) 其它同烷烃的命名规则
补充:二元酸加热后的变化规律
HOOCCOOH HOOCCH2COOH
O CH2COOH CH2COOH O + H2O O CH2 CH2COOH CH2COOH O O + H2O O 脱水
HCOOH + CO2 CH3COOH + CO2
脱羧
(-CO2)
Blanc规则:在可能形成环状化合物的条件下,总是比较容易 (布朗克) 形成五元或六元环状化合物(即五、六元环易形成)。
• 吸电子基团使酸性增强。
• 供电子基团使酸性减弱。
• 取代基的吸电子(-I效应)强弱次序(以饱和C-H键
的诱导效应为零。)
• 取代基的供电子(+I效应)强弱次序:
• [补充]——共轭效应是指在共轭体系中原子间的一种相 互影响 ,这种影响造成分子更加稳定 ,内能更小 ,键长趋于 平均化. 共轭效应常与诱导效应同时存在,共同起作用。
• 如石蜡C20~C30烷烃,得50~60%高级脂肪酸(C10~C20): RCH2-CH2-R’
高级烷烃混合物
O2, 120℃ 锰盐,1.5~3MPa
RCOOH + R’COOH
高级脂肪酸混合物
2. 低级烷烃直接氧化制取低级羧酸(往往得到混合物):
O2, 醋酸盐(或环烷酸钴) C4H10 CH3COOH+HCOOH+CH3CH2COOH 6MPa,150~250℃
13.4.3 羧酸衍生物的生成
• 卤素取代 生成酰卤
• 羧酸根取 代生成酸酐
