第二章 化学反应动力学
化学反应工程-第2章

移项并积分得:
dCA kCA a CB b dt
CA 0
kt
dCA CA mCBn
CA
这时假设a,b分别为m, n ,则以时间t为横 坐标,以积分项 C
A0
CA
dC A m n C A CB
为纵坐标,当以具体数据代入时,作图就可 以得到斜率为k的直线。如果得到直线,则表明此 动力学方程是适合于所研究的反应的。若得到曲 线,则表明此动力学应被排除,应该重新假设a, b的值而加以检验。
即:
ln
C Ae
C A0 C Ae C A C Ae
1 k1 1 t K
代入2-20式得:
将实验测得的CA-t数据,按照上式 C
ln
C A0
A
C Ae C Ae
与t作图可以得一条直线,斜率为k1+k2, 又因为k1/k2可知,因此可以求出 k1,k2 值。
2.2 等温恒容过程 ⑵ 反应转化率
第二章 均相反应动力学基础
反应物A的转化率可以用下式定义
反应物A的转化量 n A 0 n A xA = A的起始量 n A0
注意: ① 转化率恒为正。 ② 反应物一般指关键反应物(限制反应物、着眼反应物), 其是以最小化学计量量存在的反应物。 ③ 根据nA0的选择不同,有单程转化率(以反应器进口物料 为基准,如氨合成过程的合成塔进口循环气。)和总转化率 (以过程进口物料为基准,如氨合成过程的新鲜气。)。
如果cA0远远小于cB0,cB在全部反应时间里近似 于不变,则二级反应可以作为拟一级反应处理。
适用范围:
利用积分法求取动力学方程式的过程, 实际上是个试差的过程,它一般在反应级 数是简单整数时使用。当级数为分数时, 试差就比较困难,这时应该用微分法。 其他不可逆反应动力学方程式的 积分式见书上表2-4.
化学反应动力学

环境科学:化学反应机理在环境科学中用于研究污染物在环境中的转化和降解过程,有助于理解和解决环境污染问 题。
工业生产:通过应用化学反应机理,可以优化工业生产过程,提高生产效率和产品质量。
化学反应速率方 程
化学反应速率方程的概念
化学反应动力学 的应用
在工业生产中的应用
化学反应动力学在工业生产中用于 优化反应过程,提高生产效率和产 品质量。
化学反应动力学在工业生产中可用 于指导工艺参数的优化,降低能耗 和减少环境污染。
添加标题
添加标题
添加标题
添加标题
通过化学反应动力学模型,可以预 测反应过程和产物性质,为新产品 的研发提供理论支持。
化学反应动力学
汇报人:XX
目录
化学反应动力学的定义
01
化学反应速率
02
化学反应机理
03
化学反应速率方程
04
化学反应动力学的应用
05
化学反应动力学 的定义
化学反应动力学的概念
化学反应动力学是一门研究化学反应速率以及影响反应速率的因素的学科。 它涉及到反应速率常数、反应机理、活化能等概念,是化学学科中的重要分支。 化学反应动力学的研究成果对于工业生产、药物合成等领域具有重要的指导意义。 通过对化学反应动力学的深入学习,可以更好地理解化学反应的本质和规律。
数值解法:通过迭代或插值方 法求解,适用于多参数和多变
量的复杂反应
代数法:通过方程组求解,适 用于简单反应或复杂反应的近 似解
稳态法:适用于可逆反应或平 衡态反应,通过平衡常数求解
化学反应速率方程的应用
预测反应进程:通过化学反应速率方程,可以预测反应的进程和产物 指导实验设计:根据化学反应速率方程,可以优化实验条件和参数 工业生产控制:在工业生产中,化学反应速率方程可以帮助控制生产过程,提高产量和效率 药物研发:在药物研发中,化学反应速率方程可以帮助研究药物的代谢和药效
化学反应工程第二章

nA = nA0(1− xA )
亦可得到任意组分在任意时刻的摩尔数 可得到任意组分在任意时刻的摩尔数 αI nI = nI0 + nA0xA (−αA )
7
1.计算转化率起始状态的选择: 计算转化率起始状态的选择: 计算转化率起始状态的选择 反应起始原料组成; (1)间歇反应器 :反应起始原料组成; ) (2)连续流动反应器:进口原料组成; )连续流动反应器:进口原料组成; 2.等容反应 CA=CA0(1- XA) 等容反应 3.可逆等容反应 CAe=CA0(1- XAe) 可逆等容反应 4.单程转化率:原料通过反应器一次达到 单程转化率: 单程转化率 的转化率 5.全程转化率:新鲜原料进入反应系统到 全程转化率: 全程转化率 离开系统所达到的转化率。 离开系统所达到的转化率。
4
(-a)A + (− b)B +L+ rR+ sS +L= 0
a A A + a B B + L + a R R + aS S + L = 0
∑a I = 0
I
•特点: 特点: 特点 •1 只反映组份间的计量关系 •2 乘以非零常数,计量关系不变 乘以非零常数, •3 不得含有除 之外的其它公因子 不得含有除1之外的其它公因子
• 必有
1 1 − rA = (− rB ) = (rC ) = (rD ) 2 2
−r I r= −αI
• 当I为反应物时, 为反应物时, 为反应物时 • I为产物时, 为产物时, 为产物时
r=
αI
19
r I
• 用转化率表示反应速率: 用转化率表示反应速率: nA0 dx A kmol -rA = 一般式 3 V dt m s • 用浓度表示反应速率: 用浓度表示反应速率:
化学反应动力学--第一、二章

i
i
Δni是反应体系中某种组分的物质的量的
产物。 特点:欲测的物理量不随空间位置而变化, 但却随时间而变化。
开放体系流动体系:反应过程中有物质的交 换,即不断补充作用物和取走产物。
特点:体系中某物理量随空间位置而变化, 但流动中某位置的物理量却不随时间而变 化。
流动体系示例图
2. 按参加反应的物质状态分类: 均相反应体系单相反应体系:只有一个相。
上述历程反应的组合为:
H2 + Br2→2HBr
还要注意:有些总反应也是基元反应。
如已知反应:2NO+O2→2NO2是基元反 应。也即该反应从历程上说:是一步完成 的,符合基元反应的定义,是基元反应。
因历程反应的组合构成总包反应。所以 该反应也是总反应。
因此,为了区分,人们引进了简单反应 和复杂反应的概念。
我们说:上述反应满足了热力学条件, 但未满足动力学条件。
如果点火或加催化剂(如铂黑),加热到 800℃以上,则上述反应能在瞬时完成,以 至于发生爆炸。
可见,改变反应条件,可改变了动力学 上的不利情况。
所以从控制化学反应过程而言,化学动 力学的研究是非常重要的。
另外,化学动力学须考虑过程和途径。 化学反应方程式只表示:
(2) 简单反应和复杂反应 描述的对象:总(包)反应。 如果总反应是一步完成的,即是基元反 应的话,则该反应称为简单反应。 如: 2NO+O2→2NO2 如果总反应是分步完成的,即是由若干 个基元反应构成,则该反应为复杂反应。 如:H2 + Br2→2HBr
几个注意点: ✓ 从反应方程式是无法判定一个总包反应
即反应的机理或历程是如何的? 目的:能使我们较好的控制反应的进行。
二、动力学和热力学的关系 研究化学反应,必须考虑二方面的因素: 一是热力学方面的因素;(方向与程度) 二是动力学因素。(反应速率)
化学反应工程第二章

1 1 - xA kt
=
nA0
CA nA
CA C A0
=1 - x A
ln
ln
1 1 - xA
斜率﹦k 或
ln
C A0 CA
t
二级不可逆反应 A﹢B→产物
若 CA0﹦CB0
CA
( rA ) kC A
2
dC A dt
kC A C B
dC A dt
1 CA
dC A CA
2.13 93 k 5.02 86.8 k 0.0181 0.0309 1 2.13 K 1 5.02 K B B
2
2
2
9.58 89.3 k 6.46 86.3 k 0.0408 0.0338 1 9.58 K 1 6.46 K B B 3.3 92.2 k 0.0263 1 3.3 K B
第2章 均相反应动力学基础
2.1 概述
均相反应 均相反应是指参予反应的各物质均 处同一个相内进行的化学反应。
烃类的高温裂解为气相均相反应,酸碱中 和、酯化反应为典型的液相均相反应。
2.1.1化学反应速率及其表示
化学反应速率 :单位时间、单位反应体积、组分A 的摩尔数变化量称为A组分的反应速率。 例 反应物
1 xA C A0 1 xA
斜率﹦k 或
1 CA
1 C A0
t
若 CA0≠CB0 ,设β﹦ CB0 /CA0
dC A dt
kC A C B
CA
第二章动力学

第二章化学动力学三复习题和习题解答3.1 宏观反应动力学3.1.1判断正误1. 质量作用定律只适用于基元反应。
()2. 对于平行反应,其产物浓度之比等于速率常数之比。
()3. 一般来说,活化能较大的反应对温度更敏感。
()4. 确定动力学速率方程的关键是确定反应级数。
()5. 确定反应级数的常用方法有积分法和微分法。
()6. 利用尝试法确定反应级数只适用于简单级数的反应。
()7.阿伦尼乌斯方程仅适用于基元反应。
()8. 化学反应的摩尔恒容反应热与正向反应和逆向反应的活化能有一定关系。
()9. 基元反应的分子数是个微观的概念。
()10.化学反应的反应级数与反应分子数是一回事。
()11. 化学反应的反应级数只能是正整数。
()12. 在工业上,放热的对行反应存在一个最佳反应温度。
()13. 对于酶催化反应,通常作用条件较温和。
()14. 不同级数反应的速率常数,其量纲是不一样。
()15. 不能只利用速率常数的量纲来判断反应级数。
()16. 不同级数反应的半衰期与浓度的关系是不一样的。
()17. 若某反应的半衰期与浓度无关,则该反应为零级反应。
()18. 在一级、二级和三级反应速率方程中,浓度与时间的直线关系是不同的。
()19. 化学反应动力学主要研究反应的速率与机理问题。
()20. 通常用瞬时速率表示反应速率。
()答案除7,10,11,15,17错外,其余都正确。
3.1. 2 选择题1. 基元反应的分子数是个微观的概念,其值()(a)可为0、l、2、3 (b)只能是1、2、3这三个正整数(c)也可是小于1的数值(d)可正,可负,可为零2. 化学反应的反应级数是个宏观的概念、实验的结果,其值()(a)只能是正整数(b)一定是大于1的正整数(c)可以是任意值(d)一定是小于1的负数3. 已知某反应的级数是一级,则可确定该反应一定是()(a)简单反应(b)单分子反应(c)复杂反应(d)上述都不对4. 基元反应2A→B,为双分子反应,此反应的级数()(a)可能小于2 (b)必然为1(c)可能大于2 (d)必然为25. 某反应速率常数单位是mol·l-1·s-1,该反应级数为()(a)3级 (b)2级(c)1级 (d)0级6. 某反应物反应了3/4所需时间是反应了1/2所需时间的2倍,则该反应级数为()(a) 0级 (b) 1级(c) 2级 (d) 3级7. 某反应在指定温度下,速率常数是k=4.62×10-2min-1,反应物的初始浓度为0.1mol·l-1,则该反应的半衰期为()(a) 15min (b) 30min(c) 150min (d) 不能求解8. 某反应进行时,反应物浓度与时间成线性关系,则此反应的半衰期与反应物初始浓度的关系是()38(a) 成正比(b) 成反比(c) 平方成反比(d) 无关9. 一个反应的活化能为83.68kJ/mol,在室温27℃时,温度每升高1K,反应速率常数增加的百分数()(a) 4% (b) 90%(c) 11% (d) 50%10. 反应A + B→C + D 的速率方程r = k[A ][B ],则反应(a) 是二分子反应(b) 是二级反应,不一定是二分子反应(c) 不是二分子反应(d) 是对A、B 各为一级的二分子反应11. 有关基元反应的描述在下列诸说法中哪一个是不正确的()(a) 基元反应的反应级数一定是正整数(b) 基元反应是“态-态”反应的统计平均结果(c) 基元反应进行时无中间产物,一步完成(d) 基元反应不一定符合质量作用定律12. 下列有关反应级数的说法中,正确的是()(a) 反应级数只能是大于零的数(b) 具有简单级数的反应都是基元反应(c) 反应级数等于反应分子数(d) 反应级数不一定是正整数,如果反应物A的初始浓度减少一半,A的半衰期增大1倍,则该反13. 对于反应A P应为()(a) 零级反应(b) 一级反应(c) 二级反应(d) 三级反应14. 某反应,无论反应物初始浓度为多少,在相同时间和温度时,反应物消耗的浓度为定值,此反应是()(a)负级数反应(b)一级反应(c) 零级反应(d) 二级反应15. 某反应物反应掉7/8所需的时间恰好是它反应掉1/2所需时间的3倍,则该反应的级数是()3940 (a ) 零级 (b ) 一级反应(c ) 二级反应 (d ) 三级反应16. 某反应无论反应物的起始浓度如何,完成65%反应的时间都相同,则反应的级数为( ) (a ) 零级反应 (b ) 一级反应 (c ) 二级反应 (d ) 三级反应17. 某气相化学反应用浓度表示的速率系数c k 和用压力表示的速率系数p k 相等,该反应的半衰期( )(a ) 与初始浓度无关 (b ) 与初始浓度成正比 (c ) 与初始浓度成反比 (d ) 与反应温度无关 18. 动力学研究中,任意给定的化学反应 A + B → 2D ,是( ) (a ) 表明为二级反应 (b ) 表明是双分子反应 (c ) 表示了反应的计量关系 (d ) 表明为基元反应19. 某个反应,其正反应活化能为逆反应活化能的 2 倍,反应时吸热120 kJ·mol -1,则正反应的活化能为( )(a ) 120 kJ·mol -1 (b ) 240 kJ·mol -1(c ) 360 kJ·mol -1 (d ) 60 kJ·mol -120. 对于平行反应,各反应的活化能不同,以下措施不能改变主、副产物比例的是 (a ) 提高反应温度 (b ) 延长反应时间 (c ) 加入适当的催化剂 (d ) 降低反应温度答案1 b 2 c 3 a 4 d 5 d 6 b 7 a 8 a 9 c 10 b11 d 12 d 13 c 14 c 15 b 16 b 17 a 18 c 19 b 20b3.1.3 填空题1. 质量作用定律只适于________________反应。
反应动力学基础

一氧化氮氧化动力学方程建立
由于第二步为速率的控制步骤因此有:
r k2C( NO ) 2Co2
2 C K C 1 NO 第一步达到平衡,则 有: ( NO) 2
代入上式得
r k2 K1C Co2 k2C Co2
2 NO 2 NO
因此,当得到的速率方程与由质量作用定律得到的形
r dW
8
空速与接触时间
空速:单位反应体积所处理的混合物的体积流量。因
次为时间的倒数(1/h)。
VS 0 VSP VR
计算空速时的体积流量一般使用标态体积,特殊说明
时可使用操作状态流量。也有使用摩尔流量的,称为 摩尔空速。 是衡量反应器生产强度的重要操作参数。例如:氨合 成反应,压力为10Mpa时,空速为10000(1/h);而当压 力为30Mpa时,空速则为28000-30000(1/h)。
例:NO氧化反应速率方程
对于反应 2 NO O2 2 NO2 得到的速率方程为: r kC 2 C NO O 2 该动力学方程并非是由基元反应的质量
作用定律得出.有学者认为该反应由下列 两步组成 :
NO NO ( NO) 2 ( NO) 2 O2 2 NO2
并且第二步为速率的控制步骤.
式中 A为指前因子,其因次与k相同;E为活化 能;R为气体常数。
30
反应速率常数因次
反应速率常数的因次与反应速率的表示方式,速率方
程的形式以及反应物系组成的表示方式有关。 反应级数(一级、二级)、反应速率的因次(以反应 体积计、以催化剂质量计、以相界面计的反应速率)、 对于气相反应,常用分压、 浓度和摩尔分率 来表示 反应物系的组成, 则 之间有下列关系 k ,k ,k
均相反应的动力学基础

均相反应的动力学基础化学反应工程第二章均相反应动力学基础1§2.1基本概念和术语若参于反应的各物质均处同一个相内进行化学反应则称为均相反应。
均相反应动力学:研究各种因素如温度、催化剂、反应物组成和压力等对反应速率、反应产物分布的影响,并确定表达这些影响因素与反应速率之间定量关系的速率方程。
§2.1.1化学计量方程化学计量方程:表示各反应物、生成物在反应过程中量的变化关系的方程。
一个由S个组分参予的反应体系,其计量方程可写成:Si1iAi0式中:Ai表示i组分,i为i组分的计量系数。
通常反应物的计量系数为负数,反应产物的计量系数为正值。
注意:1.计量方程本身与反应的实际历程无关,仅表示由于反应引起的各个参予反应的物质之间量的变化关系。
2.规定在计量方程的计量系数之间不应含有除1以外的任何公因子。
这是为了消除计量系数在数值上的不确定性。
单一反应:只用一个计量方程即可唯一给出各反应组分之间量的变化关系的反应体系。
复杂反应:必须用两个或多个计量方程方能确定各反应组分之间量的变化关系的反应体系例如,合成氨反应的计量方程通常写成:N23H写成一般化的形式为:N23H而错误的形式有:2N26H2222NH32NH304NH30§2.1.2反应程度和转化率反应程度是各组分在反应前后的摩尔数变化与其计量系数的比值,用符化学反应工程第二章均相反应动力学基础2号ξ来表示,即:n1n10nini0nknk01ik或写成:nini0ii1.不论哪一个组分,其反应程度均是一致的,且恒为正值。
2.如果在一个反应体系中同时进行数个反应,各个反应各自有自己的反应程度,则任一反应组分i的反应量应等于各个反应所作贡献的代数和,即:Mnini0j1ijj其中:M为化学反应数,ij为第j个反应中组分I的化学计量系数。
转化率是指某一反应物转化的百分率或分率,其定义为:某某一反应物的转化量该反应物的起始量nk0nknk01.如果反应物不只一种,根据不同反应物计算所得的转化率数值可能是不一样的,但它们反映的都是同一个客观事实。
化学反应动力学

(2)流---固相反应
ri 1 dni W dt
W--固体质量
a. 对流固相非催化反应,W为固体反应物质量 b. 对流固相催化反应,W为固体催化剂质量
5
二、连续流动系统反应速率表示方式 6
流动系统:
反应物料处于连续稳定流动状态,物料在反应器
内没有积累,物系参数随空间位置变化
表示方式:
ri
d Ni d VR
S r
d Ni dS
ρb
d Ni dW
Sr
式中:b ---单位堆体积固体或催化剂中反应的
表 Kg面/m积3 ,--m-2固/m体3 反应物或固体催化Ri剂R的i堆密r度i,
8
2.复合反应
例
入Ri
对Q、P有rQ、rP 对 A、S 用 ri 无 法 描 述 , 引
对献复,合某反一应组需分R考i的虑 每m一组ij 分r_j 在整体反应中的贡 j 1
Ri的应代等数_于ij和按该组分计算的各个反应的反应速率
rj
即R:i
§2 化学反应速率方程(幂函数型)
ri f T、C、P、催化剂或溶剂
对特定反应,且
P P
10%
时可忽略P对ri的影响
ri f T、C
则:
(反应动力学模型)
32
33
2. 控制阶段 外扩散控制:第1或7步速率最慢
内扩散控制:第2或6步速率最慢
化学动力学控制:第3、4、5步其中一步速率最慢
(1) 有控制步骤的反应:
r总 r控 r非控 (r1)控 (r1)控 (r1)非控 (r1)非控
(2) 无控制步骤的反应:各反应步骤速率接近
34
二、化学吸附与平衡
型式: a. 幂函数型----经验模型
化学反应动力学-2

( 1 )
2、动力学方程推导
设t = 0时,[A1] = [A1]0, [A2] = [A2]0, [A3] = [A3]0, 引入进度变量 x = [A1]0 - [A1] [A1] = [A1]0 - x [A2] = [A2]0 + x 代入(1)式 [A3] = [A3]0 + x
9
整理得:
k [ A ] 1 1 0 [ A ] {exp( k t ) exp( k t )} 2 1 2 k k 2 1
17
[A2]出现极大值时的时间( tmax )和极大值时 [A2]的浓度( [A2]max ) :
d [ A ] 2 极大值时, 0 dt k [ A ] 1 1 0 [ A ] {exp( k t ) exp( k t )} 2 1 2 k k 2 1
d [ A ] k k [ A ] 3 1 2 1 0 {exp( k t ) exp( k t )} 1 2 dt k k 2 1
A 1
k 1
A 2
k 2
A 3
23
(3)表观活化能曲线 k2 k1 A1 A2 A3 E E a 1 a 2 ln k ln A ( L ) ln k ln A ( L ) 1 ( 1 ) 1 2 ( 2 ) 2 RT RT (a)若A(1) > A(2) Ea1 > Ea2,lnk~1/T作图, Arrhenius 活化能曲线具有向下凹的形状。高 温时,总包反应的表观活化能与反应速率常数 均由指数前因子与活化能都较小的反应步决定。 (b)若A(1) < A(2) Ea1 > Ea2, k1 < k2恒成立。 总包反应Arrhenius活化能曲线为一直线。
化学反应工程 第二章 均相反应动力学基础

或者,
nK nK 0 (1 xK )
反应转化率和反应程度
以转化率表示的反应速率
rA
1 V
dnA dt
1 V
d[nA0(1 dt
xA )]
nA0 V
dxA dt
反应转化率和反应程度
反应程度
反应各组分在反应前后摩尔数的变化与其计 量系数的比值,即:
ni ni 0 i
不论对哪一组分,反应程度ξ均相同。
Example, THE ROCKET ENGINE
A rocket engine burns a stoichiometric mixture of fuel (liquid hydrogen) in oxidant (liquid oxygen). The combustion chamber is cylindrical, 75cm long and 60cm in diameter, and the combustion process produces 108kg/s of exhaust gases. If combustion is complete, find the rate of reaction of hydrogen and of oxygen.
for the volume of the person in
question
V person
75kg 1000kg / m3
0.075m 3
Next, noting that each mole of glucose
consumed uses 6moles of oxygen and
release 2816kJ of energy, we see that
the reaction equation
第2章 化学反应动力学基础
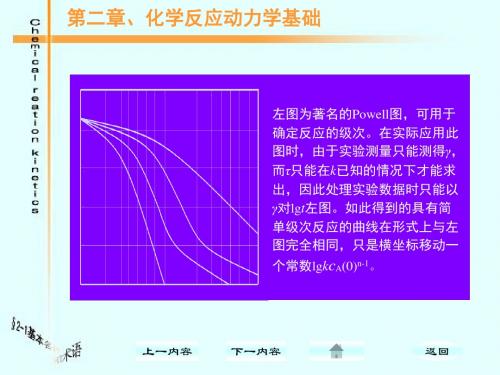
1.3.2 活化能因素: 对于基元反应来说,如果体系中一个组分有两 个以上的基元反应发生,则以活化能最低的发生反 应几率最大,这也是探索历程的一个重要线索依 据,由此因素,我们可以确定基元反应那些反应可 以发生,那些反应的发生可能性最小。
1.3.3 中间物和分子结构因素: 如果能从反应中检验某种中间物,则对反应历 程的确定将起重要作用,某些物质容易捕捉自由 基,反应体系加入这些物质,观察反应速率是否 下降,以判断体系中是否有自由基存在,而自由 基的存在常能导致链反应,此外,所设想的中间 物应与结构化学规律相符合,这就是需要考虑的 结构因素。
cCH3CHO(0)为乙醛的初始浓度。 式中,
上一内容 下一内容 返回
反应级数 当固定乙醛的初始浓度,可见在不同反应时间 测量反应速率时,r与
cCH3CHO 的平方成正比,
即称其时间级数为二级。如果以不同的初始浓
度进行试验,测定反应的初始反应速率,则与 乙醛的初始浓度的一次方成正比,即称为反应 级数为一级。许多反应的时间级数与浓度级数 是相同的,但也有一些不同。
在我们通过考虑三因素后,则基本上对反应的历 程有了某些线索和启发,然后可以进行初步探索 拟定历程,当初步拟定历程后,如何检验所草拟 的历程有一定的正确性和认为可以接受呢? 这就要求我们必须记住服从下面两个一致性:由 拟定的反应历程所得到的反应动力学方程应该和 由实验得到的动力学方程相一致。由拟定的反应 历程所得到的表观活化能应该和由实验测得的活 化能相一致。
t1/2 =
1 n-1-1 ] [ (2) (n-1)αkcA(0)n-1
上一内容 下一内容
[n(≠1)级反应]
返回
八、收率、转化率和选择收率 收率是指一个反应过程的产物量占反应物量的 百分数
化学反应的反应动力学

化学反应的反应动力学化学反应是物质转化的过程,其中反应速率是一个重要的性质。
反应动力学研究的就是反应速率随时间的变化规律,旨在揭示反应速率与反应条件和反应物浓度之间的关系。
本文将介绍反应动力学的基本概念、影响因素以及实验方法。
一、反应动力学的基本概念反应速率指的是在单位时间内,反应物浓度的变化量。
反应动力学则是研究反应速率与反应条件和反应物浓度之间的关系。
反应速率可以用反应物消失速率或产物生成速率来表示。
1. 反应物消失速率(消失相速率):当反应物A以浓度a参与反应,反应速率可以用A消失的速率来表示,可以用下式表示:v = -(Δ[A] / Δt)其中,v表示反应速率,Δ[A]表示反应物A浓度的变化量,Δt表示时间的变化量。
2. 产物生成速率(生成相速率):当产物B以浓度b生成,反应速率可以用B生成的速率来表示,可以用下式表示:v = (Δ[B] / Δt)二、影响反应速率的因素反应速率受多个因素的影响,包括温度、浓度、催化剂等。
1. 温度:温度对反应速率有显著影响。
一般来说,温度升高会使反应速率增加,因为高温下分子动能增加,反应物分子的能量更容易达到活化能,促使反应发生。
2. 浓度:反应物浓度的增加会导致反应速率的增加。
这是因为反应物浓度越高,其中的分子碰撞的次数越多,发生反应的几率也就越大。
3. 催化剂:催化剂可以降低反应的活化能,从而提高反应速率。
它通过提供一个新的反应途径,降低了反应物分子之间的碰撞能量要求,使得反应更容易进行。
三、实验方法反应动力学的研究通常采用实验方法来获得反应速率与反应物浓度之间的关系。
1. 初始速率法:通过在反应初期测量多个不同浓度下的反应速率,可以得到反应速率与反应物浓度之间的关系。
这种方法需要在反应初期进行测量,比较适用于反应物快速消耗的反应。
2. 变温法:通过在不同温度下测量反应速率,可以研究温度对反应速率的影响。
变温法需要控制其他条件不变,只改变温度来观察反应速率的变化。
化学反应工程2(第二章-均相反应动力学基础)

◆自催化反应:
特点:反应产物中某一产物对反应有催化作用,同时,为了使反应进
行 , 常 事 先 加 入 一 定 浓 度 的 催 化 剂 C , 设 浓 度 为 CC0 。
A+C2C+R……
设对各组分均为一级,则: rA
dCA dt
kCCCA
t=0, CA=CA0 CC=CC0 CR=CR0=0
continue
非等分子反应的膨胀因子及相关计算
膨胀因子:
K
1 K
s i1
i
n n0 n0yK0xK
K 的定义:
s
i Ai 0
i 1
的情况
每反应1mol的组分K所引起反应物系总摩尔数的变化量。
(举例:如合成氨的反应,求膨胀因子)
设关键组分K的转化率为xK,则:
yK
反应开始时总mol数(单位体积):CM0= CA0+ CC0
两参数是无法积 分的,设法变为 单参数微分形式
任何时刻:CC=CC0+(CA0-CA)=CM0- CA
rA
dCA dt
kCA CM 0
CA
积分得C
MO
k
t
ln
C C
A CM 0 A0 CM
C A0 0 CA
●幂函数型
对反应:AA+BB
kC
LL+MM
l CMm
kC'
Ca' A
Cb' B
Cl' L
C m' M
若为不可逆反应,则:
rA
k
c
化学反应动力学-第二章-链反应动力学

上一内容
下一内容
返回
四、链反应的表观特征
(7)惰性添加物也可能起到产生或消灭链载体的 作用,故链式反应对惰性添加物也敏感。这时, 惰性添加物起的是能量传递作用,即它本身成为 能量的施主或受体,以碰撞物的形式出现。
(8)链式反应的速率方程和动力学方程都很复杂
上一内容
下一内容
返回
四、链反应的表观特征
链反应的引发过程(均相引发)
1.均相引发——由单相中反应物或催化剂的热化 学、光化学或放射化学反应来引发的过程。
(1)热引发——以加热的方式供给体系能量,增加 分子的热运动,加速分子间的碰撞,使一个共价 键的单分子的一个键发生对称分裂,形成两个 自由基或自由态原子。 例如在合成HBr的热反应中:H2Br22HBr 链载体Br原子就是由 Br2 2Br 引发的。
应,有时会发生爆炸反应。
上一内容
下一内容
返回
四、链反应的表观特征
(3)反应的速率曲线有不同特征。 ①反应物及产物的动力学曲线(浓度随时间变化 的曲线)表现不同。一般反应物及产物的浓度随 时间的延长而以简单形式下降及上升, 而链式 反应的相应曲线则呈S形下降及上升。 ②反应速率随时间的变化曲线具有不同的特征, 如图所示。
链的终止过程常借助于阻化剂来实现。阻 化剂一般是稳定自由基、潜在自由基以及易于 和链载体反应生成稳定自由基的分子等。
上一内容
下一内容
返回Βιβλιοθήκη 链反应的终止过程(复相终止)
2.复相终止
复相终止过程常常发生于气体反应中,尤其是在
低压情况下,有时还是主要的链终止方式。当表
面存在自由价(S),链载体与之结合:
X
上一内容
下一内容
返回
(完整版)化学反应动力学..

(2)流---固相反应
ri 1 dni W dt
5
W--固体质量
a. 对流固相非催化反应,W为固体反应物质量 b. 对流固相催化反应,W为固体催化剂质量
二、连续流动系统反应速率表示方式 6
流动系统: 反应物料处于连续稳定流动状态,物料在反应器 内没有积累,物系参数随空间位置变化
表示方式:
ri
Ri — 为“-”时表示转化速率,为“+”时表示生成
9
§2 化学反应速率方程(幂函数型)
ri f T、C、P、催化剂或溶剂
对特定反应,且 P 10% 时可忽略P对ri的影响
P
则: ri f T、C (反应动力学模型)
型式: a. 幂函数型----经验模型 b. 双曲函数型----机理模型 c. 级数型----经验模型
r
,,, A
k C r 1
1A
1
A
rQ
2
k C 2U
,,,r2
rQ
Q
R r r r k C A转化速率:
m
A
A
Aj j
A
A
1A
j 1
A
m
R r r r k C Q生成速率:
1
第二章 化学反应动力学
§1 化学反应速率的工程表示 §2 化学反应速率方程(幂函数型) §3 动力学方程的转换 §4 多相催化反应的表面反应动力学
(双曲型动力学方程)
§1 化学反应速率的工程表示 2
一、间歇系统反应速率表示方式
间歇系统:非定态过程,反应器内物系参数随t变化
1.均相反应速率表示方式
一、单一反应动力学方程
10
简单反应、并列反应、自催化反应
《化学反应动力学》课件

反应活化能
反应活化能是使反应物通过反应过渡态的能垒。 它的高低决定了反应的速率和温度对反应速率 的影响程度。
反应级数与反应机理
反应级数指的是反应速率对各反应物浓度的指数。通过实验测定速率随浓度的变化规律,可以确 定反应级数并推断反应机理。
化学平衡和动力学的关系
化学平衡是指在闭合系统中,反应物与生成物浓度达到一定比例,反应速率 相等的状态。动力学研究反应速率,而平衡研究反应终点。两者密切相关, 但研究的角度不同。
反应程是描述反应速率与反应物
浓度之间关系的数学表达式。它的
形式由实验数据决定,允许我们推
断反应的机理和确定反应物底数。
3
反应速率
反应速率是单位时间内反应物消失 或生成的物质的数量的变化量。它 可以通过实验测量,并用数学模型 表示。
反应级数
反应级数是描述反应速率与反应物 浓度之间关系的指数。通过测定速 率对浓度的实验数据,可以确定反 应级数并推断反应机理。
应用和实例
化学反应动力学的研究对于了解和优化化学过程具有重要意义。它被广泛应 用于药物合成、环境保护、能源开发等领域。实例包括酶催化反应、催化剂 设计和反应动力学模拟等。
影响化学反应速率的因素
反应物浓度
反应物浓度的增加会增加 碰撞频率,从而提高反应 速率。
温度
提高温度会增加分子的平 均动能,促使反应物分子 更容易发生有效碰撞,从 而加快反应速率。
催化剂
催化剂通过提供新的反应 路径,降低反应活化能, 从而加速反应速率。
动力学常数与反应活化能
动力学常数
动力学常数是速率方程中的常数,代表了反应 速率与反应物浓度之间的比例关系。它的值由 实验测定。
《化学反应动力学》PPT 课件
化学反应的动力学解释

化学反应的动力学解释当我们燃烧木材、煮水煮鸡蛋,甚至进行生命活动时,我们都能感受到化学反应的存在。
反应是化学的基本概念之一,它指两种或更多的物质相互作用,以形成新的物质,这些物质称为产物。
但是,如何描述和理解化学反应的速度和动力学过程呢?一、动力学反应的定义和基本概念动力学反应是指在反应物分子之间相互碰撞和重新配对的过程中,形成化学键以形成产物的速度。
反应速度是化学反应发生的关键指标之一。
它被定义为单位时间内反应物被转化为产物的量。
为了描述反应速率,我们必须了解反应的酶动力学方程和反应机理。
酶动力学方程包括描述反应动力学的关键参数,如反应速度常数、反应机理、活化能等。
当反应速度受到多个参数的影响时,这些参数的值必须在方程的预测下进行调整。
反应机理是描述反应的步骤和反应中间体的过程,其中包括化学键的形成和断裂等步骤。
反应的机理可以通过实验数据来确定。
二、影响反应速率的因素考虑到反应速率可以通过下面这个反应来评估:A +B → C其他一切变量保持不变的情况下,反应速率是如何受到各种因素的影响的呢?1.浓度更高的浓度会增加反应物之间的碰撞,从而提高反应速率。
反之,较低的浓度会导致反应速率缓慢。
2.温度增加温度会增加分子的能量,从而增加反应物之间的碰撞频率和强度。
因此,增加温度可以提高反应速率。
反之,降低温度会减缓反应速率。
3.催化剂催化剂是一个物质,可以降低反应活化能,从而减少反应的能量要求。
由于活化能的降低,催化剂可以显着提高反应速率。
三、化学反应动力学的重要性和应用了解反应动力学的基础原理和参数可以帮助我们确定如何优化工业过程和生产方式。
例如,在某一化学反应中,降低成本或增加产量需要了解反应速率和反应机理。
此外,理解反应动力学还可以帮助提高化学品的采购和处理。
另外,对于医学和生命科学研究,研究在生命过程中发生的化学反应动力学是至关重要的。
深入了解代谢反应速率、酶催化反应以及克服生命过程中的障碍的过程可以使我们更好地了解生命过程。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
两点法
FLOTU
通过实验得到若干组反应的实验数据,便可由 实验数据组成的矩阵[ Anxm(t)Anxm-1(0)]求得该 复杂反应动力学网络速度常数矩阵K。 条件是实验数据不要线性相关,且实验组数M 一定要大于或等于反应的组分数N。这一方法 称为两点法。 实验可由等时间间隔的一组实验数据得到整个 速度常数矩阵K,所用实验点较少。 求解方法还有试差法及曲线拟合法,从方法上 来说,两点法及试差法的自由度小,所得参数 较为可靠。
机理化学计量子空间
FLOTU
机理化学计量子空间: ∑αji (yj - yi ) 其中yi为复合体。 机理化学计量子空间的维数: 一个复杂反应机理中,由该机理的相应向量所 组成的一个线性无关集合中能够包含的元素的
最大数目是多少?这个数目被记为s。 s是由反应物料数组成的列数及反应机理中反 应的行数组成的行列式的秩,可由线性代数的 方法求得。
原料 汽油
气体+焦炭
十集总动力学网络
Nh l l l l l l l l l C Ph>343℃的烷烃, Nh>343℃的环烷烃; Cah>343℃的芳香核; Ch>343℃芳香烃中的烷基侧链; Pl 221~343 ℃的烷烃; Nl 221~343℃的环烷烃; Cal 221~343℃的芳香核; Cl 221~343℃香烃中的烷基侧链; G C5~221℃汽油; C1~C4 气体及焦炭。
速率方程解
FLOTU
c1 (t) = c11 exp(λ1 t) + c12 exp(λ2 t) + ...c1n exp(λn t) c2 (t) = c21 exp(λ1 t) + c22 exp(λ2 t) + ...c2n exp(λn t) ..... cn (t) = cn1 exp(λ1 t) + cn2 exp(λ2 t) + n exp(λn t) 由 K X = X Λ; 其中X为K的特征向量,Λ为K的特征 值有: α(t) = Xexp(Λt)X-1 α(0)
k12
k13 k31
FLOTU
A
复杂反应过程的数学表达
A1
FLOTU
A2 A3 机理、动力学和平衡 复合体:反应计量方程(机理方程)箭头前后的 化合物实体称为复合体。复合体个数,n。 链系类别:使机理方程中每个复合体只出现一次 的机理方程表示方法称之为链系类别。链系类别 个数,l。 机理的数学表征:向量表示方法 以物料为单位向量组成物料空间, V, 复合体的向量表示方法: 2A1 + A2 ; 2e1 + e2 机理的向量表示方法: 2A1 → A2 ; 2e1 - e2
第二章、反应动力学
清华大学化工系 魏飞
反应动力学
FLOTU
为什么需要反应动力学
动力学速率方程 方程简化 反应控制步骤 初始反应速率
A1
A2
A3
催化反应器设计方程
FLOTU I组分转化率 化学计量系数
dxi i r d (W / Fi ) 失活速率方程
复杂反应动力学体系
FLOTU
组分较多的反应体系称
A1
为复杂反应体系 两大难点:反应体系各 组分间的强耦联性 组分数巨大,难以处理 A2 每一种化合物的反应
A3
1、可逆单分子反应体系
A1
k21
3组元反应体系: dc1/dt = -(k21+k31) c1 + k12 c2 +k13c3 A2 k23 dc2/dt = k21 c1 -(k12+k32) c2 + k23 c3 dc3/dt = k31 c1 + k32 c2 -(k13+k23) c3 k32 三元一次常微分方程组 写为矩阵的形式为 :α'(t) = K α(t) 其通解为 c1 (t) = c11 exp(λ1 t) + c12 exp(λ2 t) +c13 exp(λ3 t) c2 (t) = c21 exp(λ1 t) + c22 exp(λ2 t) + c23 exp(λ3 t) c3 (t) = c31 exp(λ1 t) + c32 exp(λ2 t) + c33 exp(λ3 t) 12个未知参数,中求6个动力学常数,实验工作量大, 准确性差!
空速
催化剂有效因子
反应速率表达式
与热量平衡(T曲线),动量平衡(曲线)耦合
反应动力学
FLOTU
反应动力学对于
-反应器设计 – 过程开车及控制 – 过程开发及改进 反应动力学方程选取 – 指数型动力学方程 – 基于基元反应推导出的方程 外推更为可靠 更为实质性地了解过程
动力学研究
FLOTU
复杂反应动力学
FLOTU
• 机理看作构成动力学的骨架,所谓动力学,是 指为机理中的每一个反应指定一个具有非负性 的纯量速度函数 • c'(t) = ∑fji (c) (yj - yi ) • c(t) = c(0) + ∑∫fji (c)dt (yj - yi ) • S是V中所有向量的集合,V可以表示为该机 理的反应向量的线性组合。 • 随着反应进间的进展,浓度向量在V中所遵循 的途径称为组成轨线。
CH4
C2H6
引言 基于自由基机理的动力学模型
FLOTU
日,平户赖川等。活化能一般>200 kJ/mol
碳正离子反应
碳正离子反应机理 1.碳正离子的形成:
H R1 C H R2 + L R1 + C H R2 + LH
FLOTU
40
30
R1CH
+ CHR 2 + H
+ R1CHCH 2R2
Yield(m%)
FLOTU
复杂反应动力学
FLOTU
• 机理看作构成动力学的骨架,所谓动力学,是 指为机理中的每一个反应指定一个具有非负性 的纯量速度函数 • c'(t) = ∑fji (c) (yj - yi ) • c(t) = c(0) + ∑∫fji (c)dt (yj - yi ) • S是V中所有向量的集合,V可以表示为该机 理的反应向量的线性组合。 • 随着反应进间的进展,浓度向量在V中所遵循 的途径称为组成轨线。
机理差数
FLOTU
δ=n-l-s 复合体数目n,链系类别数目l,和化学计量 子空间的维数s。 它是一个整数,且是一个非负的数 差数不为零的反应机理是很不寻常的。 机理差数对于讨论复杂化学反应情况下质量作 用速度常数的确定,任意动力学的平衡属性及 具有复杂机理的敝开式等温反应器的安定性都 是十分重要的。
微分反应器:平推流,CSTR,低转化率
积分反应器 注意有效因子是否为1 速率方程式选取 速率方程参数确定
动力学方程选择
FLOTU
• • • • •
机理信息 初始反应速度测量 参数回归 (非线性最小二乘法) 最佳的模型方程: 低残均方差 残差无偏性 参数敏感性 参数符合热力学定律 线性化的
20
Cat / Oil = 10.63 Contact Time = 0.09s Ethene Propylene
R + +H +
R H
10
+ R1 + R 2H + R1H + R 2
0
600 650 700 750 800 850 900 Temp( C))
o
碳正离子反应
2.碳正离子反应:
FLOTU
包括异构,β裂化,环化,氢转移,缩合等 一系列反应。 β裂化反应:
+ R1CH 2CHCH 2 + CH 2CH 2R2 + CH 3CHR 2 CH 2CH 2R2 + CH 3CHR 2 CH 3CH + CH 2 + R3 R1CH 2CH + CH 2 + CH 2CH 2R2
C4
0
0
0
1
0.2024 0.0042 0.0085 0.8792
第三节、集总反应动力学网络
FLOTU
两物质间均有反应的过程:与化学无关 对于稀疏矩阵,化学性质更为关键。 集总即是将复杂的一类物质当做一种物质处理。 Weekman (1968)提出三集总催化裂化模型,将原料、 产物、副产物分为三层,用三个动力学常数可描述。
解的相向空间
FLOTU
一组M个初始组成向量αi (0)经t时间的反应可 得其反应物的向量组成αi (t)则有: (α1(t)α2(t)...αm(t))=Xexp(Λt)X-1 (α1(0)α2(0)...αm(0)αi (0) 可写成矩阵的形式: Anxm(t)=Xexp(Λt)X-1Anxm(0) [ Anxm(t)Anxm-1(0)]X=Xexp(Λt) [ Anxm(t)Anxm-1(0)]具的与K相同的特征向量,只 是特征值不同。
动力学复杂反应动力学
FLOTU 令cL(t)为物料L在时间t的化学状态则V中的向量c(t)按下 列定义: c(t)= c1(t)e1 + c2(t)e2 + c3(t)e3 + ... +cM(t)eM 浓度为非负的,这一向量必为非负的记为V+。 另c'L(t)为物料L的分子浓度在时间t时的导数,则V的向 量c'(t) c(t)= c1(t)e1 + c2(t)e2 + c3(t)e3 + ... +cM(t)eM 总包速度函数F(C)为: F(C) = ∑fji (c)(yj - yi ) 反应进间的进展,浓度向量在V中所遵循的途径称为 组成轨线。
