化学必修1物质的分散系
高一化学物质的分散系

•②实验现象 •NaCl、NaOH、HCl溶于水
后能导电,酒精、蔗糖溶于 水后不能导电。
问题一:NaCl NaOH
HCl三种溶液为什么
能导电?
它们的溶液中有自由移动的离子存在
问题二:上述三种溶液中的自由移动的离 子是怎样产生的?
电离产生的
问题三:物质在哪些情况下可以电离呢?
水溶液或熔化状态下可发生电离
胶体的聚沉
由于同种胶体颗粒可以吸附同种离子而带 同种电荷,它们之间相互排斥使得胶粒不 容易聚集。但在一定条件下,胶体中的粒 子会聚集成较大的颗粒,形成沉淀从分散 剂中析出,这个过程叫胶体的聚沉。通常 使胶体聚沉的方法有:加热,加入电解质, 加入带相反电荷胶粒的胶体。
土壤的性质
化学工业
食品
建筑材料
性质:具有丁达尔效应(可利用此性质区
分胶体和溶液)
本质特征:分散质粒子直径在10-9——10-7之间
常见胶体:Fe(OH)3胶体、 Al(OH)3胶体、 烟、云、 雾、豆浆、墨水、蛋清、淀粉溶液、肥皂水、 有尘
埃的空气、血液等.
应用:生活,医学,国防,材料等领域
自然界中的丁达尔效应
实验探究:溶液的导电性实验
• ①实验步骤 • 在五只小烧杯中分别加入NaCl溶液、 NaOH溶液、稀盐酸、酒精溶液和蔗糖溶 液,组装好仪器,接通电源。
我们发现了胶体!
性质:具有丁达尔效应(可利用此性
质鉴别胶体和溶液)
现象揭密:
当光束照到不同物体上时,由于物体的粒子大 小不同,会产生不同现象。若粒子过大,主要 发生反射现象;若粒子较小,主要发生透射现 象;当粒子直径在10-9m——10-7m时,就会 发生散射现象。
分散系的分类
•分散系
高中化学 必修第一册 第1章 第1节 第2课时 分散系及其分类
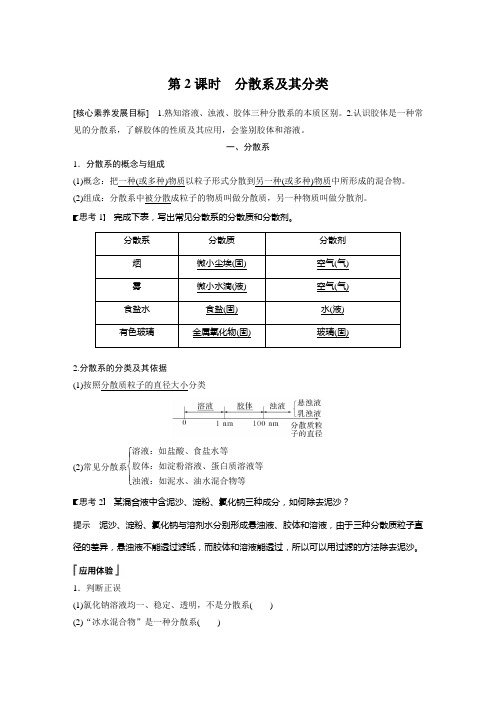
第2课时 分散系及其分类[核心素养发展目标] 1.熟知溶液、浊液、胶体三种分散系的本质区别。
2.认识胶体是一种常见的分散系,了解胶体的性质及其应用,会鉴别胶体和溶液。
一、分散系1.分散系的概念与组成(1)概念:把一种(或多种)物质以粒子形式分散到另一种(或多种)物质中所形成的混合物。
(2)组成:分散系中被分散成粒子的物质叫做分散质,另一种物质叫做分散剂。
思考1 完成下表,写出常见分散系的分散质和分散剂。
分散系分散质 分散剂 烟微小尘埃(固) 空气(气) 雾微小水滴(液) 空气(气) 食盐水食盐(固) 水(液) 有色玻璃金属氧化物(固) 玻璃(固)2.分散系的分类及其依据(1)按照分散质粒子的直径大小分类(2)常见分散系⎩⎪⎨⎪⎧ 溶液:如盐酸、食盐水等胶体:如淀粉溶液、蛋白质溶液等浊液:如泥水、油水混合物等思考2 某混合液中含泥沙、淀粉、氯化钠三种成分,如何除去泥沙?提示 泥沙、淀粉、氯化钠与溶剂水分别形成悬浊液、胶体和溶液,由于三种分散质粒子直径的差异,悬浊液不能透过滤纸,而胶体和溶液能透过,所以可以用过滤的方法除去泥沙。
1.判断正误(1)氯化钠溶液均一、稳定、透明,不是分散系( )(2)“冰水混合物”是一种分散系( )(3)分散系有的是纯净物,有的是混合物( )(4)分散系可以是固态、液态或气态( )(5)油水混合物属于乳浊液( )答案 (1)× (2)× (3)× (4)√ (5)√2.溶液、胶体和浊液三种分散系的本质区别是( )A .是否是大量分子或离子的集合体B .是否能通过滤纸C .分散质粒子直径的大小D .是否均一、透明、稳定答案 C解析 溶液、胶体和浊液三种分散系的本质区别在于分散质粒子直径的大小。
二、胶体1.胶体的树状分类思考1 (1)Fe(OH)3胶体中的分散质粒子与淀粉溶液中分散质粒子在组成上有什么区别? 提示 Fe(OH)3胶体中的分散质粒子是Fe(OH)3集合体,而淀粉胶体中一个淀粉分子就是一个分散质粒子。
物质的分散系

溶质
一种或几 种物质
分散到
另一种 物质中
溶剂
形成 均一、稳定 的混合物 溶液的基本特征
溶液
一、物质的分散系
1、分散系概念: (称为分散质) 一种或几种物质 分散到另一种物 质(称为分散剂) 中形成的混合物
2、分散系的组成:分散系包括分散质和分散剂 ①分散系:混合物 ②相对多少:分散剂>分散质
本 质 区 别
丁达尔效应 2.胶体的性质 鉴别溶液与胶体的方法 吸附作用 净水方法
3.电解质与非电解质 (1)它们都是化合物 (2)是否是电解质与溶解性无关 (3)自身能电离出离子的化合物才是电解质 (4)常见电解质和非电解质的判断
课堂检测 1、下列关于胶体的叙述不正确的( C ) A.胶体区别于其他分散系的本质特征是分 散质的微粒直径在10-9 ~ 10-7m之间 B.光线透过胶体时,胶体中可发生丁达尔 效应 C.用平行光照射NaCl溶液和Fe(OH)3胶体时, 产生的现象相同 D.Fe(OH)3胶体能够使水中悬浮的固体颗粒 沉降,达到净水目的
分散系
分散质
分散剂
NaCl溶液
泥水
Na+和Cl小土粒 小油滴
水 水 水
油水
3、分散系的分类: (1)按照分散质或分散剂所处的状态分
分散质
气态 液态
分散剂
气态
液态 固态
九种分散系
固态
分散质 气 液 固 气 液 固 气 液 固
分散剂 气 气 气 液 液 液 固 固 固
实例 空气 云、雾
烟、灰尘 泡沫
①金属导电与电解质溶液导电有什么不同?
金属导电是因为有自由移动的电子,电解质溶液导电 是因为有自由移动的离子 ②H2SO4溶液能导电,硫酸溶液是电解质吗? 不是 ③铁能导电,铁是电解质吗?不是 电解质 1、化合物 非电解质
物质的分散系

(2)物理方法
4、分类:
根据分散质 微粒的构成
粒子胶体:Fe(OH)3胶体、AgI胶体 分子胶体:淀粉溶液、蛋白质溶液
根据分散剂 的状态
气溶胶:烟、云)3胶体、 血液、豆浆、墨水、肥皂水
固溶胶:有色玻璃、烟水晶、珍珠
聚沉现象
C.一束平行光线照射蛋白质溶液时,从侧面可以看到一
束光亮的通路
丁达尔现象
D.三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀
溶液的导电性实验
溶液的导电性实验
结论:氯化钠、硝酸钾、氢氧化钠、磷酸的水溶液能够导电, 蔗糖和酒精的水溶液不能够导电。
三、电解质和非电解质
1、定义:
电解质:在水溶液里或熔融状态下能够导电的化合物
(3)酸、碱、盐的电离
盐酸、硝酸和硫酸都能够导电,说明在水溶液中电离生 成了能够自由移动的离子。
电离方程式: HCl = H+ + ClHNO3 = H+ + NO3H2SO4 =2 H+ + SO4-
①电离时生成的阳离子全全部部是氢离子的化合物叫做酸
同样,氢氧化钠、氢氧化钾和氢氧化钡的溶液 也能够导电,说明在水溶液中电离出能够自由移动 的离子。
②加入电解质
③加入带相反电荷胶粒的胶体
向氢氧化铁胶体中滴加硫酸溶液现象?
3、制备: (1)化学方法:
氢氧化铁胶体的制备
取100mL烧杯,加入50mL水并加热至沸腾,向沸水中滴 几滴饱和氯化铁溶液,继续煮沸至溶液呈红褐色,停止加热
注意:①不能用玻璃棒搅拌,否则会出现浑浊 ②不宜在加饱和氯化铁溶液后再长时间煮沸 ③用蒸馏水,不能用自来水
气溶胶
雾
高一化学分散系及分类

能否透过滤 纸
能否透过半 透膜
能 能
不能 不能
??
??
?
科学探究2
3.分别用激光笔照射Fe(OH)3胶体和CuSO4溶液, 在与光束垂直的方向进行观察。
胶体的性质
1、丁达尔现象(光学性质)
实验:光束分别通过Fe(OH)3胶体和CuSO4溶液,观察现象。 现象:一束光通过胶体时,从侧面可观察到胶体里 产生一条光亮的“通路”。
;
/shangshigongsi/ 上市路崎岖蜿蜒,狭窄处两边的杂草和荆棘遮挡了路面,我只好把自行车扔在半道上,徒步前行,脚下的碎石把脚硌 得生疼。 一只野兔突然从身旁的草丛里窜出来渐渐地在我的视线里消失,惊动了不远处的山鸡,山鸡便呱呱地叫着飞向远方。 这真是多见兔子少见人的鬼地方!我心里这么想着,喘着粗气一惊一乍地向山里走去„„ “苏林——”山间小道上传来了肖艳的喊声。 我不顾一切地冲向前去„„ “荷花„„怎么样了?”我气喘吁吁地问。 “快„„快„„去已院!”肖艳来不及多说。 我接过肖艳怀里的荷花,飞也似地向山下跑去。 肖艳骑着自行车追了上来,“快„„快上车!” 还没等车子停稳,我一只手抱着荷花,一只手抓住后座跳了上去。 “你们快去„„我随后就到„„”马大嫂被远远地甩在身后。 也不知肖艳从哪儿来了这股力量,一口气窜出了七八里路,来到了镇已院。 诊室里亮着灯,三哥正在灯下看书。 这时,我们才意识到天已黑了下来。 “三哥,荷花病了„„”我一边说一边把荷花抱到他跟前。 掀开襁褓的盖头,露出了荷花圆圆的小脸。三哥仔细地端详一番后,小心翼翼地把体温表放到荷花的腋下。 这时,马天栓夫妻也开着拖拉机赶到了已院。 “荷花究竟是怎么了?”马大嫂进门就问。 三哥紧皱着眉头思索良久,终于发问了,“这孩子是不是没有定时打防疫针?” “这„„”马天栓支吾着说不出话来,瞪着大眼偷偷地看他的妻子。看他的样子,我知道他要马大嫂去解围。
高一化学《分散系及其分类》课件

分散系在受到外力作用时,需要克 服一定的屈服值才能开始流动。
03
分散系的分类与识别
溶液型分散系
总结词
均一、透明、稳定
详细描述
溶液型分散系是由溶质和溶剂组成的,其中溶质以分子或离子状态均匀分散在溶剂中,形成均一、透 明、稳定的分散体系。常见的溶液型分散系有食盐水、糖水等。
悬浊液型分散系
总结词
03
热力学稳定性
分散系在热力学条件下保 持稳定,不发生自发聚集 或沉淀现象。
动力学稳定性
分散系在动力学上不易发 生沉淀或聚集,保持长时 间内的均匀分散状态。
胶体稳定性
胶体分散系具有较高的稳 定性,不易发生聚沉,能 保持较长时间的稳定状态。
分散系的电性质
电荷性质
分散系中的分散相颗粒带 有电荷,产生电场,影响 分散系的稳定性。
总结词
分散系在日常生活和工业生产中有着广泛的应用。
详细描述
分散系在日常生活和工业生产中有着广泛的应用。例如,食品中的饮料、化妆品 中的乳液、颜料中的水彩画等都是分散系的应用。此外,在化学反应中,许多化 学反应都是在分散系中进行的,如燃料电池中的电解质溶液等。
02
分散系的性质
分散系的稳定性
01
02
乳浊液在食品中很常见,如酸奶、黄油和蛋黄酱。它们由 不溶于水的油和不溶于油的蛋白质组成,使油在水中均匀 分散。
固体分散体
固体分散体在面粉、糖和其他食品成分中很常见。它们通 过将一种物质均匀地分散在另一种物质中来改善食品的质 地和口感。
化妆品中的分散系
化妆品中的分散系
化妆品通常包含各种分散系,如乳浊 液、悬浮液和固体分散体,以提供所 需的质地、颜色和效果。
固体颗粒分散于液体中、不均一、不 稳定
高一化学必修1 第二章第一节 分散系及胶体

FeCl3 + 3H2O
Fe(OH)3 (胶体)+ 3HCl
注意:
① Fe(OH)3 (胶体)不能打“↓” ②不能用自来水,也不能搅拌 ③加热至溶液呈红褐色后停止加热,不能过度加热
16
应 用 思 考
1.制备 Fe(OH) 3 ,胶体时,为什么使用饱和氯化
铁溶液?
提示:为了提高Fe3+ 的浓度,从而提高生成氢氧化铁的速
(1)正电荷的:金属氢氧化物、金属氧化物等。吸附它组
成离子的阳离子,如: Fe(OH)3 (胶体)吸附的是Fe3+ (2)负电荷的:金属硫化物、非金属氧化物、硅酸。吸附 它组成离子的阴离子,如:硅胶胶体、泥沙胶粒吸附它的阴 离子SiO44(3)中性分子胶体:淀粉、蛋白质等,不带电 (4)AgI:若Ag+过量,胶粒吸附Ag+而带正电;若I-过量, 胶粒吸附I-而带负电
烟 水 晶
有 Cu2O——红色; 色 CuO——蓝绿色; 玻 Co2O3——蓝色; 璃 Ni2O3——墨绿色; MnO2——紫色;
Wednesday, June 01, 2016 14
气溶胶
雾
烟
白 云
Wednesday, June 01, 2016 15
如何制备Fe(OH)3胶体? 往沸水中逐滴滴加饱和FeCl3溶液, 继续加热至溶液呈红褐色,停止加热。
第一节 物质的分类
分散系及胶体
红安国际育才实验学校高一化学组 胡争
蛋白质溶液
肥皂水
稀豆浆
FeCl3溶液
CuSO4溶液
水
CCl4
泥水
2
蛋白质溶液
肥皂水
稀豆浆
FeCl3溶液
这些混合物有 什么共同特点?
《物质的分散系》课件

分散相的粒子大小、分散相的体积分 数、分散介质的种类和性质等。
分散系的分类
01
02
03
分子分散系
分散相与分散介质以分子 形式相互分散,粒径小于 1nm。
胶体分散系
分散相粒径在1~100nm 之间,具有胶体性质,如 氢氧化铁胶体。
粗分散系
分散相粒径大于100nm, 肉眼可见,如泥浆。
分散系的应用
01
在沉降分离过程中,颗粒的沉降速度 与颗粒的形状、大小、密度以及介质 的密度、粘度等因素有关。
沉降分离法通常适用于颗粒较大、密 度差异明显的物质分离,如沙子和水 的分离。
沉降分离法操作简单,但分离效率较 低,通常需要较长时间才能达到分离 效果。
过滤分离法
01
02
03
04
过滤分离法是利用多孔介质对 物质颗粒进行拦截,从而实现
现物质分离的方法。
离心分离法适用于颗粒大小和 密度差异明显的物质分离,如 血液中的细胞和血浆的分离。
在离心分离过程中,离心力的 大小和方向对物质颗粒的运动 轨迹和分离效果有重要影响。
离心分离法具有较高的分离效 率和较快的处理速度,但需要 较高的能耗和较大的设备体积 。
05
分散系的实际应用
分散系在化学工业中的应用
分散系在食品加工过程中也用于控制食品的物理性质,如悬浮液、乳浊液等。这些分散体系在食品加工过程中起着重要的作 用,如饮料的口感和稳定性、调味品的均匀混合等。通过选择适当的分散剂和控制分散系的稳定性,可以优化食品的加工工 艺和质量。
分散系在医药工业中的应用
分散系在医药工业中主要用于药物的制备和药物控制释放的研究。药物通常需要以一定的粒度和稳定 性分散在介质中,以便于给药和吸收。通过控制分散系的粒度和稳定性,可以调节药物的释放速率和 吸收程度,从而优化药物的疗效和降低副作用。
新人教高中化学必修1讲义03 第一章第一节第3讲 分散系及胶体

第一章物质及其变化第一节物质的分类及转化第3讲分散系及其分类【讲】知识点1分散系1.分散系的概念与组成(1)概念:把一种(或多种)物质以粒子形式分散到另一种(或多种)物质中所形成的混合物。
(2)组成:分散系中被分散成粒子的物质叫做分散质,另一种物质叫做分散剂。
(3)常见分散系及其组成2.分散系的分类及其依据①溶液、浊液、胶体三种分散系本质的区别是粒子直径大小②分散系都是混合物【练】1、下列分散系中,分散质微粒直径最大的是()A.新制氢氧化铜悬浊液B.淀粉溶液C.氢氧化钠溶液D.豆浆答案:A。
解析:A为浊液,B、D为胶体,C为溶液,答案选A。
2、下列关于硫酸铜溶液和泥水的说法中不正确的是()A.都是混合物B.都是分散系C.分散剂相同D.分散质粒子相同答案:D。
解析:硫酸铜溶液和泥水两种分散系都是混合物,它们的分散剂都是水,但分散质粒子不同,硫酸铜溶液的分散质粒子是铜离子和硫酸根离子,泥水(悬浊液)的分散质粒子是固体小颗粒。
3、下列物质不属于分散系的是()A.食盐水B.酒精C.盐酸D.泥浆答案:B。
解析:酒精是乙醇的俗名,是纯净物。
知识点2 胶体1.胶体:分散质粒子直径在 之间的分散系是胶体2.常见胶体:氢氧化铁胶体、氢氧化铝胶体、鸡蛋清、淀粉胶体、血液、墨水、硅酸胶体 、 蛋白质胶体、豆浆、墨水、云、烟、雾、有色玻璃等 3胶体的分类根据分散剂的状态分类⎩⎨⎧气溶胶:如烟、云、雾液溶胶:如豆浆、稀牛奶固溶胶:如烟水晶、有色玻璃4氢氧化铁胶体的制备①实验操作:在小烧杯中加入40 mL 蒸馏水,加热至沸腾,向沸水中逐滴加入5~6滴氯化铁饱和溶液,继续煮沸至溶液呈红褐色,停止加热,即可得到氢氧化铁胶体。
②反应原理:FeCl 3+3H 2O=====△Fe(OH)3(胶体)+3HCl 。
Fe(OH)3胶体不能写成“Fe(OH)3↓”。
注意事项:①实验操作中,必须选用氯化铁饱和溶液而不能用氯化铁稀溶液。
若氯化铁溶液浓度过低,则不利于氢氧化铁胶体的形成②向沸水中滴加FeCl 3饱和溶液,而不是直接加热煮沸FeCl 3饱和溶液,否则会因溶液浓度过大直接生成Fe(OH)3沉淀而无法得到Fe(OH)3胶体③实验中必须用蒸馏水,而不能用自来水。
必修一第二章第一节分散系及其分类

分散系及其分类
3.胶体
(1)胶体制备
FeCl3+3H2O
△
Fe(OH)3(胶体)+3HCl
◆注意:①加热至溶液呈红褐色后停止加热
②不能用自来水,也不能搅拌 ③不用“↓”,写胶体
若向FeCl3饱和溶液中滴入NaOH溶液会 得到氢氧化铁胶体吗?会观察到什么现 象?写出反应的化学方程式。 现象:产生红褐色沉 淀 FeCl3+3NaOH 〓〓〓 Fe(OH)3↓+3NaCl
3.胶体
(3)胶体聚沉
•方法一:加带相反电荷胶粒的胶体 •方法二:加电解质溶液 •方法三:加热
分散系及其分类
3.胶体
(3)胶体应用 •豆浆里加石膏制成豆腐 •手指不慎被划破用氯化铁溶液止血
•河流入海处易形成三角洲
•不同品牌墨水不能混用
•工厂用静电除尘
•明矾净水
•土壤保肥
1、下列现象与胶体的性质无关的是( ) A、将盐卤或石膏加入豆浆,制成豆腐 B、一枝钢笔使用两种不同型号的蓝黑墨水, 易出现堵塞 C、向FeCl3溶液中加入NaOH溶液,会出现 红褐色沉淀 D、清晨,人们经常看到的阳光穿过茂密的树 木枝叶所产生的美丽景象
:请试着举出几种分散系的实例
分散质 气 液 固 分散剂 气 气 气 实 空气 云、雾 烟、灰尘 泡沫、盐酸 牛奶、酒精的水溶液 糖水、油漆 泡沫塑料 珍珠(包藏着水的碳酸钙) 例
气
液 固 气 液
液
液 液 固 固
固
固
有色玻璃、合金
分散系
实例 外观 稳定性 能否透过 滤纸 分散质粒 子大小
溶液
CuSO4溶液
2、有关分散系的下列说法正确的是
( A、 D ) A.悬浊液的分散质可用过滤的方法从分散剂中 分离出来 B.任何物质在水中溶解时都有一定的溶解度 C.同一种溶质的饱和溶液要比不饱和溶液的 浓度大一些 D.分散质粒子直径大小为1nm及其分类
必修1 2.1分散系及其分类胶体

1、为什么CuSO4溶液看不到丁达尔现象, 而Fe(OH)3胶体能看到丁达尔现象? 2、泥水的残渣不能通过滤纸,而Fe(OH)3 胶体却能通过滤纸,说明了什么?
3、造成上述实验现象不同的本质原因是什 么?
五、胶体的重要性质
1、丁达尔现象
原因:胶体粒子较大(1~100nm),对 光具有散 射作用,光在胶体的通路中出现一条明亮的光 带。
分散系 浊液:分散质粒子直径大于100nm
胶体:分散质粒子直径在1~100nm
思考
1、下列哪些属于溶液、浊液或胶体? 泥浆水、Ca(OH)2悬浊液、澄清石灰水、海水、
江河水、豆浆.
2、上述不同分散系的本质区别是什么?
3、三种分散系的稳定性与分散质粒子的大 小有何关系?
四、科学探究
• 教材第26页实验1、实验2、实验3
生活中常见的胶体:豆浆 雾 墨水 肥皂水 鸡蛋清
2、胶体的电泳 原因:带电的胶体微粒在电场作用下发生了定向
移动。 3、胶体的凝聚 原因:当破坏胶体微粒原来带有相同电荷的特点
时,就会使它从不容易凝聚的状态变成聚集状 态而沉淀 胶体凝聚的方法:
⑴加热
⑵加电解质溶液
⑶加带相反电荷胶粒的胶体
三、胶体的应用
根据分散质、分散剂的状态对分散系进行分类
分散质 气 液 固 气 液 固 气
分散剂 气 气 气 液 液 液 固
举例
空气 云、雾 烟灰尘 泡沫、溶有空气的水 牛奶 氯化钠溶液、油漆 泡沫塑料
液
ห้องสมุดไป่ตู้
固
珍珠(含水碳酸钙)
固
固
有色玻璃、合金
三、当分散剂是水或其他液体时,按照分 散质粒子的大小分类
溶液:分散质粒子直径小于1 nm
高中化学必修1 第一单元 物质的分散系

淀粉溶胶
血液
有色玻璃和水晶
二 电解质和非电解质
活动探究 溶液的导电性实验
结论:氯化钠、硝酸钾、氢氧化钠、磷酸的水溶液却能够导电, 蔗糖和酒精的水溶液不能够导电。
定义 1.电解质:在水溶液中或熔融状态下能够 导电的化合物。 如:酸、碱、盐以及活泼金属氧化物 (HNO3、H2SO4、KOH、Ba(OH)2、NaCl、 BaSO4)等。 2.非电解质:在水溶液中和熔融状态下不 能导电的化合物。 如:乙醇(C2H5OH),蔗糖(C12H22011), 淀粉,CO2,SO等)。
3.固体NaCl不导电,但NaCl是电解质; (√) 4.BaSO4的水溶液不导电,所以BaSO4 是非电解质 (×)
(电解质在熔融状态下或者水溶液状态下能 够导电的化合物。)
5.液态酒精、酒精的水溶液不导电,所以酒精 是非电解质… ( √) 6.SO3溶于水能导电,所以SO3是电解质;
(×) (电解质导电必须是该化合物本身电离出自由移动 的离子而导电)
小结
1、分散系
分散质粒子直径 的大小
溶液 (粒子直径d<10-9m/1nm)
胶体(粒子直径10-9<d<10-7m /1nm~100nm) 浊液(粒子直径d>10-7/100nm)
2、胶体的性质 丁达尔效应——区别溶液与胶体 吸附性——净水 3、电解质与非电解质,电离方程式的书写
电解质
相同点 不同点
分析 溶液导电性不同的原因
氯化钠溶解 的微观过程
蔗糖溶解的 微观过程
3、电离:电解质在水溶液或熔融状态下产 生自由移动的离子的过程。
4、电离方程式:表示酸、碱、盐等电 解质在溶液中或熔融状态下电离成能够 自由移动的离子的式子 。
化学高一分散系知识点

化学高一分散系知识点【化学高一分散系知识点】本文将介绍化学高一学年的分散系知识点,包括什么是分散系、分散系的类型、分散系的性质以及应用。
通过学习本文,你将对分散系有更深入的了解。
1. 什么是分散系分散系是指由两个或多个物质组成的混合物,其中一个物质被均匀地分散在另一个物质中。
在分散系中,被分散的物质称为分散相,将其分散在其中的物质称为分散介质。
分散系广泛存在于日常生活中,比如溶液、胶体和悬浮液等。
2. 分散系的类型根据分散相和分散介质的形态和状态,分散系可以分为以下几种类型:2.1 溶液:分散相是固体、液体或气体,分散介质是液体,如盐水、糖水等。
2.2 胶体:分散相是固体或液体,分散介质是液体或固体,如牛奶、胶水等。
2.3 悬浮液:分散相是固体,分散介质是液体,如泥浆、沉淀物悬浮液等。
3. 分散系的性质分散系具有一些独特的性质,包括粒径分布、稳定性和光学性质等。
3.1 粒径分布:分散系中的分散相粒子的尺寸大小会影响到分散系的性质。
一般来说,分散相粒子较小,分散系的稳定性和光学性质较好。
3.2 稳定性:分散系的稳定性是指分散相在分散介质中均匀分散的能力。
稳定的分散系不易分离、沉淀或聚集,而不稳定的分散系容易出现分层、沉淀或析出。
3.3 光学性质:分散系对光的散射和吸收能力不同,从而呈现不同的光学性质。
胶体和悬浮液常常表现出浑浊或混浊的现象,而溶液则通透透明。
4. 分散系的应用分散系广泛应用于科学研究和生产实践中。
4.1 科学研究:研究分散系的性质和行为有助于深入了解物质的微观结构和相互作用,为解释化学和生物现象提供基础。
4.2 材料科学:利用分散系的稳定性和光学性质,可以制备出具有特殊功能的材料,如纳米材料、光学材料等。
4.3 医药领域:药物的分散和吸收性能与其溶解度有关,研究分散系有助于提高药物的溶解度和生物利用度。
4.4 环境保护:研究废水中的悬浮液和胶体等分散系,可以有效地处理和净化废水,保护环境。
高中化学备课参考 物质的分散系

一、分散系的概念 分散系:一种(或几种)物质的微粒分散到另一种物质里形成的混合物,有分散质和分散剂
组成. 分散质:被分散成微粒的物质叫分散质; 分散剂:微粒分散在其中的物质叫分散剂.
二、几种分散系的分类:
分散质状态 气 液 固 气
液
固 气 液 固
分散剂状态 气 气 气 液
液
液 固 固 固
实例 空气、爆鸣气,排气法收集的气体 云、雾 烟、尘 肥皂水泡沫、汽水、自来水、盐酸 白酒,醋,煤油在水中形成乳浊液,牛奶,豆浆, 石油,酒精水溶液 食盐水、糖水、油漆 馒头、木炭、砖块、泡沫塑料、冰箱吸味剂 湿砖块、珍珠、受潮固体物品、吸潮干燥剂 合金、有色玻璃、有色塑料制品、蓝绿宝石
三.常见三种分散系的分类、粒子大小、特征、本质区别
稳定性 均一性 丁达尔效应 过滤情况 分散质粒子大小 是否具有丁达尔
效应
溶液 稳定 均一 无 通过滤纸 小于 1nm
无
四、胶体 1.胶体的分类 (1)根据分散质微粒的组成的状况分:
离子胶体:Fe(OH)3胶体
分子胶体:淀粉胶体、蛋白质胶体 (2)根据分散剂的状态分: 气溶胶:如烟、云、雾,分散剂为天气
净水剂,主要原因是( ) A. 发生了化学反应 B. 明矾溶液中的胶粒具有很强的吸附作用 C. 明矾溶液中的胶粒与泥沙胶粒所带的电荷电性相反 D. 溶液中的胶粒与泥沙碰撞而沉淀
答案:B
解析:是明矾中的 Al3+与水发生反应生成 Al(OH)3 (胶体)有很强的吸附性,吸附了水中
的杂质形成沉淀. 例 13. 在实验中因装配仪器不慎划破手指,可立即在出血处滴加三氯化铁溶液应急止血,
答案:AD 解析:胶体和溶液都稳定,但溶液没有丁达尔效应,他们的粒子直径都可以通过滤纸.
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二、胶体的性质和应用
1、定义:
分散质微粒的直径大小在10-9~10-7m 之间的分散系
(1nm—100nm)
2、性质: P14 ——观察与思考
试比较硫酸铜溶液与氢氧化铁胶体有何异同?
实验报告单
实验内容 实验现象 实验结论 1、溶液、 氢氧化铁胶体中有 胶体被光 胶体具有“丁达尔 “一条光亮的通路”, 效应” 照射 硫酸铜溶液中没有 2、在悬浊 液中加入 氢氧化铁 胶体
加入氢氧化铁胶体的烧杯 胶体具有较强的 中浑浊现象消失,在烧杯 吸附性,能吸附 底部出现沉淀,另一个烧 溶液中悬浮的颗 杯仍然浑浊
粒
——光学性质 丁达尔效应
当一束强光透过胶体时,可以看到一条光
亮的通路,这种现象叫做丁达尔效应
用这种方法可以区别溶液和胶体
丁达尔现象 的微观示图
丁达尔现象
CuSO4溶液
同样,氢氧化钠、氢氧化钾和氢氧化钡的溶液也 能够导电,说明在水溶液中电离出能够自由移动的离 子。 电离方程式:
Ba(OH)2 = Ba2+ + 2 OHNaOH = Na+ + OH-
电离时生成的阴离子 全部 是氢氧根离子的化合物 全部 叫做碱。
同样,碳酸钠和氯化钡的溶液也能够导电,说明在 水溶液中电离出能够自由移动的离子。
2.Fe(OH)3胶体和MgCl2溶液共同具备
的性质是( AD) A.都比较稳定,密封放置不产生沉淀 B.都有丁达尔现象 C.加入氢氧化钠溶先产生沉淀
D.分散质粒子可通过滤纸
物质溶于水后的存在形式与
所得溶液的性质如何?
三、电解质和非电解质
1、定义: 电解质:在水溶液里或熔融状态下能够导电的化 合物,如酸、碱、盐等 非电解质:在水溶液里和熔融状态下都不导电的 化合物,如蔗糖、酒精等
溶液 (NaCl溶液) 悬浊液 (泥水) 乳浊液(油水)
Na+和Cl- 小土粒 小油滴
水 水 水
思考:分散系的区别
逐层过滤(滤纸、半透膜原理)
由此可见,不同的分散系取决于分散质 微粒大小的不同
分散质微粒的直径:
1、溶液:
< 1nm(10-9m)
2、悬浊液、乳浊液: > 100nm (10-7m) 3、胶体:
5、胶体的应用与危害
应用:在日常生活中如,墨水、墨汁、明矾 净水、土壤保肥中均应用胶体原理 ——阅读p14 危害:烟、雾对生活、交通带来的危害也不可 小视
不同分散系的比较
分散系 溶液 浊液 胶体
分散质微 粒大小 分散质微 粒组成 外观特征 稳定性 能否透过 滤纸
能否透过 半透膜
<1nm
小分子 离子
>100nm
很多分子 集合体 不均一、 不稳定 不能
1nm~100nm
分子集 合体 均一透明 较稳定 能 不能
均一、透 明、稳定
能 能
不能
胶体能稳定存在的原因
1.用特殊方法把固体物质加工到纳米级 (1 nm~100 nm,1 nm = 10-9 m)超细 粉末粒子,然后制得纳米材料。下列分散 系中分散质粒子直径和这种粒子具有相同 数量级的是(C) A.溶液 C.胶体 B.悬浊液 D.乳浊液
(5)酸、碱、盐、水是电解质,蔗糖、酒精等是非电 解质。
3、电离方程式
请写出下列物质的电离方程式: HCl、NaCl、NaOH、H2SO4、Ba(OH)2、 AlCl3
注意事项:
1、正确书写离子符号前的化学计量数
2、正确书写离子的电荷数
3.下列物质中:⑴CH3COOH ⑵HCl ⑶NaOH ⑷HNO3 ⑸Cu(OH)2 ⑹AgCl ⑺Na2CO3 ⑻C2H5OH ⑼H2O ⑽Fe ⑾ SO2 ⑿石墨 ⒀C6H12O6
下列物质中哪些是电解质?
Cu、NaCl固体、NaOH固体、K2SO4溶液、CO2、 蔗糖、NaCl溶液、酒精
2、注意:
(1)电解质、非电解质应是化合物。 (2)电解质的导电条件:水溶液里或熔融状态下。 如:碳酸钙虽然其水溶液几乎不导电,但在熔融状态 下导电,因此它是电解质。
(3)电解质导电必须是该化合物本身能电离出自由移 动的离子而导电,不能是发生化学反应而生成的物质 导电。如:CO2、SO2不是电解质。 (4)某些难溶于水的化合物。如:BaSO4、AgCl在水 中溶解的部分完全电离,是电解质。
物质的分散系
在冬季时,我们经常会看见这样一种景 象:早晨大雾笼罩。或者在某些地区, 经常出现雨后晴朗的天空里挂着一轮美 丽的彩虹。这些现象是怎样产生的?
物质的分散体系
一、分散系、分散质、分散 剂
分散系:一种物质(或多种物质)以粒子形 式分散到另一种物质里所形成的混合物 分散成微粒的物质—分散质 微粒分布在其中的物质—分散剂 分散系 分散质 分散剂
①属于电解质的是 ②属于非电解质的是
⑴⑵⑶⑷⑸⑹⑺⑼ ⑻⑾⒀ ⑵⑶⑷⑺
③在溶液中主要以离子形式存在的是
四、酸、碱、盐
盐酸、硝酸和硫酸都能够导电,说明在水溶液中电 离生成了能够自由移动的离子。 电离方程式: HCl = H+ + Cl-
HNO3 = H+
+ NO3SO4-
H2SO4 = 2H+ +
电离时生成的阳离子全部是氢离子的化合物叫做酸。 全部
Fe(OH)3胶体
3、性质:
(2)Fe(OH)3等胶体 (1)丁达尔效应
有吸附性
(3)胶粒可透过滤纸不能透半透膜
(渗析)
4、胶体的分类
根据分散质
粒子胶体:Fe(OH)3胶体、AgI胶体 分子胶体:淀粉溶液、蛋白质溶液 气溶胶:烟、云、雾
微粒的构成分
根据分散剂 状态分
液溶胶:AgI胶体、Fe(OH)3胶体 固溶胶:有色玻璃、烟水晶
电离方程式:
Na2CO3 = 2Na+ + CO32-
BaCl2
= Ba2+ + 2Cl-
电离时生成金属离子和酸根离子的化合物叫做盐。
通过对酸、碱、盐电离出离子的特点,你判断一下 NaHSO4、Cu2(OH)2CO3应该属于哪一类化合物?
灯泡的明暗程度,试分析为什么会 发生这样的变化
