水环境化学3---氧化还原反应(11.18)备课讲稿
《氧化还原反应》说播课讲稿

《氧化还原反应》说播课讲稿氧化还原反应说播课讲稿
介绍
大家好,我是你们的讲师。
今天我将为大家介绍氧化还原反应,希望能帮助你们更好地理解这个概念。
什么是氧化还原反应
氧化还原反应,也称为红ox反应,是化学反应中一种常见的
类型。
它涉及原子的电荷转移,其中一个物质(被氧化剂)失去电子,而另一个物质(还原剂)获得电子。
反应的示例
1. 一个经典的氧化还原反应是金属与非金属氧化物之间的反应。
例如,铁可以与氧反应生成二氧化铁:
2Fe + 3O2 → 2Fe2O3
2. 另一个例子是酸与金属的反应。
例如,硫酸和锌的反应可以
形成硫酸锌和氢气:
H2SO4 + Zn → ZnSO4 + H2
3. 还有一些生物过程也涉及氧化还原反应,比如呼吸作用中的氧气和葡萄糖之间的反应。
氧化与还原
在氧化还原反应中,被氧化的物质会失去电子,同时被还原的物质会获得电子。
这是因为氧化剂在反应中接受了电子,而还原剂在反应中失去了电子。
氧化数和氧化还原反应的平衡
氧化数是用来追踪原子电子的转移的数字表示。
在氧化还原反应中,氧化数可能会增加或减少,以确保电荷的平衡。
为了平衡氧化还原反应,我们需要调整反应方程式中的系数。
通过增加或减少原子数量来平衡反应方程式,以确保在反应前后原子的总数和电荷数保持一致。
总结
氧化还原反应是化学中一个重要的概念。
在这种反应中,发生了电子的转移,其中一个物质被氧化,而另一个物质被还原。
通过平衡氧化还原反应的方程式,我们可以确定反应前后原子和电荷的平衡。
水环境化学3---氧化还原反应(11.18)

Ex:
正常水体中其决定电位作用的物质是______。 天然水的pe随水中溶解氧的减少而 而表层水呈 环境。 ,因
本节课小结
1. 电子活度 2. pe and E的关系 pe与△G 的关系 3.天然水体的pe (一)决定电位 (二)天然水体的氧化还原限度 (三)天然水体的pe值计算
实际上, 实际上,在水环境中,氧化还原反应 通常伴随着水的酸度变化,因此,水体的 pH和pe在一起能更好地反映水体氧化还原 反应的实际情况。
天然水体的pe 天然水体的pe
天然水体的pe pe值计算 (三) 天然水体的pe值计算
eg2. 若在一个有微生物作用产生CH4及CO2的 厌氧水中,假定 pCO2=pCH4,pH=7.00, 相关半反应为1/8CO2+ H+ + e =1/8CH4+1/4H2O peo = 2.87,求pe值. pe = -4.13 (说明水体是一还原环境,有提供电子的倾向。)
天然水体的pe 天然水体的pe
(二)天然水体的氧化还原限度
边界条件: 氧化限度 还原限度 1.0130×105Pa 氧分压 1.0130×105Pa 氢分压
天然水体的pe 天然水体的pe
(二)天然水体的氧化还原限度
1.氧化限 1.氧化限度 电对:1/4O2+H++e = 1/2H2O 水体的氧化限度: pe= 20.75 - pH 当pH=7时, pe= 13.75。在这种好氧水 的条件下,水有夺取电子的倾向。 E0=1.224v
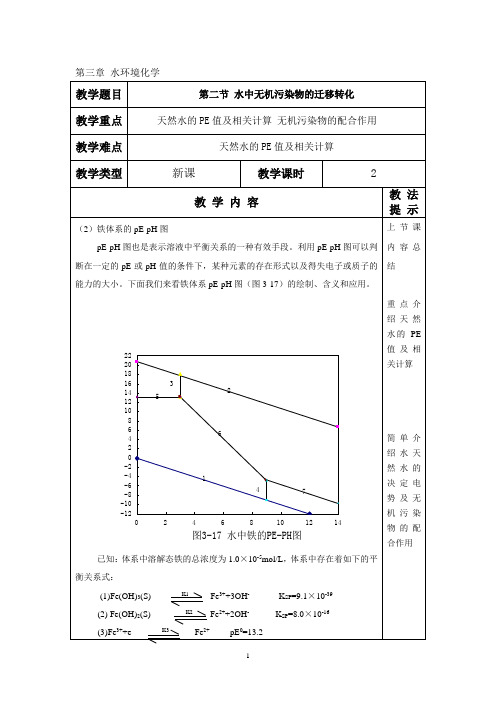
铁体系的pe-pH图 铁体系的pe-pH图 pe
(1)Fe3+与Fe2+的边界 pe = 13.05
(2)Fe2+与Fe(OH)2(s)的边界 pH = 8.95 (3)Fe2+与Fe(OH)3(s)的边界 pe = 22.0 -3pH (4)Fe3+与Fe(OH)3(s)的边界 pH = 2.99 (5)Fe(OH)2(s)与Fe(OH)3(s)边界pe = 4.1 – pH (a)H2O 氧化边界: pe = 20.75 - pH (b)H2O 还原边界: pe = - pH
环境化学教案 第三节水中无机污染物的迁移转化(氧化还原2)
由此反应可知,当有机物进入天然水后,水体中溶解氧的含量会迅速降低。如果有机物的数量非常多的话,可以使水体中溶解氧全部被消耗掉,甚至可以使水体转换成为沼泽。在水中,NH4+只有被氧化成NO3-后,氮才能被藻类利用。
例2求被大气氧所饱合的中性天然水的pE值。
解:该体系溶解氧起决定电势作用,溶解氧的氧化还原反应为:
pE=pE0+ [H+]
已知:pE0=20.75
pH=7 [H+]=10-7
将已知条件代入pE的表达式,得:pE=13.58。该体系pE值较高,是一个氧化性体系。
例3求微生物作用产生甲烷的中性厌氧水的pE值及溶解氧的分压
天然水是一个非常复杂的混合体系,其中存在着众多的氧化剂和还原剂。其中常见的氧化剂包括溶解氧、Mn(IV)、Fe(III)、和S(VI),常见的还原剂包括有机物、Mn(II)、Fe(II)、S(-II)。当我们要求得某种天然水的pE值时,首先需要确定哪种物质起决定电势作用,然后根据起决定电势作用物质的氧化还原反应,求得体系的pE值。一般的天然水体中起决定电势作用的物质是溶解氧,当有机物含量非常高时,则有机物起决定电势作用。铁和锰起决定电势作用的情况则比较少见。下面我们来看两种极端情况下体系的pE值。
pE=-4.13
将已知条件代入pE的表达式,得: =3.0×10-72atm。
由此可见该体系中溶解氧的分压非常低,一般水体中的溶解氧的分压均超过此值。由于天然水的pE值随水中溶解氧的减少而降低,因此表层水pE值较高,底层水pE值较低。
例3:从湖水中取出深层水,其PH=7.0,含溶解氧浓度0.32mg/L,请计算PE和Eh。(KH=1.26*10-8[mol/(L·Pa)]
氧化还原反应说课ppt课件

应的规律和原理。
误差分析
分析实验误差产生的原因,提高实 验的准确性和可靠性。
讨论
引导学生对实验结果进行讨论,提 出改进意见和建议。
氧化还原反应案例分析
案例选择
选择具有代表性的氧化还原反应 案例,如电池原理、钢铁腐蚀等
。
案例分析
引导学生分析案例中氧化还原反 应的原理和应用,加深对氧化还
03
氧化还原反应的原理及应用
氧化还原反应的原理
氧化还原反应的定义
氧化还原反应是指化学反应中,物质 中的元素被氧化或被还原的过程。
氧化和还原的定义
氧化是指电子从原子或分子中失去的 过程,而还原则是电子从外部加入原 子或分子的过程。
氧化还原反应的实质
氧化还原反应的实质是电子的转移。
氧化还原反应的表示方法
02 教学目标
明确说课的目标和意义,以及学生需要掌握的知 识和技能。
03 教学内容
详细介绍说课的主题和内容,包括氧化还原反应 的定义、分类、反应机理和相关应用。
说课目标及意义
01 知识目标
让学生掌握氧化还原反应的基本概念、分类、反 应机理和应用。
02 能力目标
培养学生分析和解决问题的能力,能够运用氧化 还原反应知识解决实际问题。
用双线桥法表示电子转移的方向和数 目。
氧化还原反应在日常生活中的应用
金属腐蚀
金属在接触空气、水等物 质时,会发生氧化还原反 应,导致金属腐蚀。
植物生长
植物通过氧化还原反应将 阳光转化为化学能,维持 生命活动。
人体健康
人体内的氧化还原反应对 维持身体健康至关重要, 如细胞呼吸、免疫反应等 。
氧化还原反应说课课件.ppt

二、氧化还原概念形成
【追问3】氧化还原反应中一定有氧元素 参加吗?
设计意图: 激发兴趣,激活思维,使学生带着探索未 知的欲望进入新的学习。
二、氧化还原概念形成
【问题4】下面是氧化还原反应的正反例证,请同学 们从化合价角度归纳总结氧化还原反应的特征?
【投影】 例证1:H2+CuO=Cu+H2O (氧化还原反应) 例证2:Fe+CuSO4=Cu+FeSO4 (氧化还原反应) 例证3:2Na+Cl2=2NaCl (氧化还原反应) 例证4:CaO+H2O =Ca(OH)2 (非氧化还原反应) 例证5:CaCO3 = CaO+CO2↑ (非氧化还原反应) 例证6;2H2O2=2H2O+O2↑ (氧化还原反应) 例证7:2HCl+CaCO3=CaCl2+CO2 ↑+H2O(非氧化还原反应) 例证8:2NaOH+CuSO4=Cu(OH)2+Na2SO4(非氧化还原反应)
三维教学目标
•知识与技能目标 ••1过情.程感能方态从法度化目目合标标价的变化,认识并建 立氧从通化氧过还化氧原还化反原还应这原的一概对念典的;型演的变矛,盾培, 养领2 学.悟通生对过用立对发统典展一型的的化眼辨学光证反、唯应科物的学主分的义析态观,度点、 理勇。解于氧探化索还的原品反质应学的习本化质学是 。电子转 移。
【结论形成】
得氧-氧化反应-化合价升高 失氧-还原反应-化合价降低
【设计意图】 通过与初中 对氧化还原 反应的判断 对比,让学 生体会概念 的形成是由 浅入深的一 个过程。
针对练习: 判断下列方程式哪些是氧化还原反应 Zn+2HCl=ZnCl2+H2↑
Cl2 + 2NaOH = NaCl + NaClO + H2O 2Na2O2 + 2H2O = 4NaOH + O2 ↑
氧化还原反应说课稿

氧化还原反应说课稿摘要本次说课将介绍氧化还原反应,主要涉及以下内容:氧化还原反应的概念和基本特征、氧化还原反应的本质、氧化还原反应的分类、氧化还原反应的应用场景等。
正文一、概述氧化还原反应(Redox Reaction)是指在化学反应中,原子、离子或分子的氧化态(根据电负性)发生变化的过程。
在这个过程中,氧化剂将电子从还原剂转移到自己身上,同时还原剂失去电子。
因此,氧化还原反应也被称为电子转移反应。
根据伟大的德国化学家弗奥伊德尔的说法,氧化还原反应就是电荷的转移过程。
二、特征1.先进共存:在氧化还原反应中,氧化剂和还原剂同时存在。
2.原子数守恒:氧化还原反应总的原子数不变,但电子数会发生变化。
3.改变电性:氧化还原反应是一种电化学反应,通过电荷转移改变化合物的电性质。
三、本质氧化还原反应在本质上是电子转移反应,它是由于物质内部的原子和分子的电子数发生变化而引起的物化反应,而这种电子转移的过程又常常与离子的迁移或化学键的形成和断裂一起发生。
氧化还原反应的本质就是电子的转移和流动,电子的流动需要一个载流体,也即是电解质。
四、分类氧化还原反应根据反应的类型和特点,可以分为以下几类:1.金属或半金属与卤素、氧气或氢气发生反应,或碱金属或碱土金属与水发生反应的反应。
2.化合物的各组成元素之间发生电子转移反应,即离子化反应和非离子化反应(共价分子之间的氧化还原反应)。
3.相间氧化还原反应(如有机醇氧化制酮、酸的不同氧化还原等)。
4.氧化剂和还原剂对反应物的氧化还原程度的不同,产生不同的氧化还原反应,如氧化、还原、半还原等。
五、应用场景氧化还原反应在生产和生活中有广泛的应用,如:1.在钢铁冶炼过程中,氧化还原反应起着重要作用,通过杂质与考核的去除,以及改变合金的成分和性能。
2.在化肥生产和环保中,氧化还原反应是处理废气废水、去除污染物和恢复空气质量的重要手段。
3.化学合成中,氧化还原反应主要用于合成高附加值的有机化合物和进行催化反应。
氧化还原反应说课稿

--氧化还原反应
金正仕
说 课 流 程 图
氧化还原反应
教 材 分 析
学 情 分 析
教 学
目 标
教 学 重 难 点
教 学 方 法
教 学 过 程
板 书 设 计
一、教材分析
氧化还原反应中学新课标体系分三个阶段学习 (1)初中阶段要求学生能从得失氧的角度理
解氧化反应和还原反应;
(2)化学必修1要求学生能从化合价升降和电
二、学生情况分析
学生已具备的知识: 1.学习了简单的分类法及其应用; 2.学习过氧化反应和还原反应; 3.学习了四种基本反应类型; 4.初步认识了化合价的变化跟电 子转移有一定的关系。
三、教学目标
学会用化合价的变化和电子转移 的观点判断氧化还原反应 理解氧化还原反应的本质
知识与技能
过程与方法
通过氧化还原反应的教学,培养学 生准确描述概念,深刻理解概念的能力 培养学生思考、分析和解决问题的 能力 培养学生透过现象看本质和对立 统一的辩证唯物主义观点 通过创设问题情境,引导学生积 极思维,激发学生学习化学的兴趣
CuO + H2 == Cu + H2O
Cu得氧,发生氧化反应 O2 失氧,发生还原反应 H2得氧,发生氧化反应 CuO失氧,发生还原反应
氧化反应和还原反应是同时发生的,这样的反应 称为氧化还原反应。
借此对学生进行“对立统一”的辨证唯物主义观点教育
六、教学过程
问题三:两个反应都属于化合反应,外 观相似,它们还有什么相似之处呢?请 同学们标出各元素的化合价,分析有什 么变化?
情感态度与价值观
四、教学重点和难点
1
教学重点
– 用化合价升降和电子转移的观点理解和判 断氧化还原反应
氧化还原反应讲课稿

氧化还原反应讲课稿氧化还原反应尊敬的各位领导、老师:大家好!今天我讲课的题目是《氧化还原反应》,在初中的时候我们学习过木炭还原CuO的反应,木炭在高温的条件下和CuO反应,结果CuO失去氧原子还原成了单质Cu,发生的是还原反应;我们在分析一下C的变化,起还原作用的C夺走了CuO的O原子变成了CO2 发生的是氧化反应。
也就是说,在化学反应中氧化反应和还原反应是同时进行的,有一种物质被还原,必然会有一种物质被氧化。
C+2CuO=2Cu+CO2↑初中的时候我们还学习过这样的两个化学反应,C在高温的情况下和H2O 的反应,结果是H2O失去了O原子还原成H2,木炭夺走了H2O中的氧被氧化成了CO ;另一个反应H2还原CuO生成了Cu 和H2O,刚才我们是从得氧和失氧的角度来分析氧化还原反应,我们说失去氧的物质被还原,得到氧的物质被氧化,现在我们从化合价的角度来分析这些氧化还原反应:C+H2O= H2+CO;H2+CuO=Cu+ H2O(1)CuO中的Cu是+2价,发生还原反应后变成了0价的单质Cu;C单质为0价,发生氧化反应变成CO2,为+4价。
(2)再看一下H2O和C的反应,反应前H2O中的H原子为+1价,被碳还原为H2后变成了0价;而C由0价变成了+2价的CO,发生额是氧化反应。
(3)最后我们再看一个H2还原CuO的反应,0价的H变成+1价,+2价的Cu 变成0价的Cu这些反应都是典型的氧化还原反应,我们分别分析了反应前后各物质化合价的变化,不难发现他们有一个共同的特征:某些元素的化合价在反应前后会发生变化并且化合价升高的物质发生的是氧化反应,化合价降低的物质发生的还原反应。
我们再看一个初中学习过的Fe置换Cu的反应:Fe和CuSO4的反应生成FeSO4和Cu,单质Fe由0价变成+2价的FeSO4化合价升高,发生的是氧化反应,+2价的Cu由+2价变成0价的Cu单质,化合价降低发生的是还原反应。
我们看整个反应过程并没有氧原子的得失,只有化合价的变化,他也是氧化还原反应。
-氧化还原培训课件

1.12 氧化还原大纲要求:了解氧化还原处理技术1.12.1氧化还原法原理氧化还原法:通过氧化还原反应将废水中的溶解性污染物质去除的方法。
化学反应中,失去电子的过程叫氧化,失去电子的物质称还原剂,在反应中被氧化,得到电子的过程叫还原,而得到电子的物质叫氧化剂,在反应中被还原。
每个物质都有各自的氧化态和还原态,其氧化还原电位的高低决定了该物质的氧化还原能力。
废水的氧化还原处理法又可分为氧化法和还原法两类。
1.12.2氧化法常用的氧化剂:空气中的氧、纯氧、臭氧、氯气、漂白粉、次氯酸钠、二氧化氯、三氯化铁、过氧化氢和电解槽的阳极等。
1、氯氧化法⑴原理:氯氧化法采用氯系氧化剂,如次氯酸钠、漂白粉和液氯等,主要用于去除废水中的氰化物、硫化物、酚、醇、醛、油类以及对废水进行脱色、脱臭、杀菌等处理。
⑵氯氧化法处理含氰废水电镀含氰废水中的氰主要以游离氰和络合离子氰两种形态存在。
一般游离状态的毒性较大,而络合离子状态的毒性较小。
氯氧化氰化物的过程分两个阶段进行:首先是在碱性条件下氰化物被氧化成毒性和氰化氢差不多的挥发性物质氯化氰,在pH值为10~11时,在10多分钟内可将氯化氰转化为毒性很小的氰酸根离子,这也称作局部氧化法。
为防止处理水中含有剧毒物质氯化氰,其处理工艺条件应进行如下控制:①废水的pH值宜大于11。
②废水中除含游离氰外还常常含有络合氰,考虑到废水中同时还含有其它还原性物质存在,实际氧化剂的用量要比用公式计算的理论用量有所增加,以次氯酸纳计为含氰量的5~8倍。
③温度对反应的影响不大④对废水进行搅拌可以加速反应。
第二阶段是进行完全氧化反应,即进一步投加氯氧化剂,破坏碳—氮键,使其转化为二氧化碳和氮气。
完全氧化处理法工艺条件是:必须在局部氧化处理的基础上,一般pH值为7.5~8.5,氧化剂的用量为局部氧化法的1.1~1.2倍,药剂应分两次投加。
⑶用于含酚废水的处理⑷处理设备主要要是反应池及沉淀池。
2、臭氧氧化法⑴臭氧的特性臭氧是一种强氧化剂,其氧化能力仅次于氟,比氧、氯及高锰酸盐等常用的氧化剂都高。
氧化还原反应化学教案

氧化还原反应化学教案(经典版)编制人:__________________审核人:__________________审批人:__________________编制单位:__________________编制时间:____年____月____日序言下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!并且,本店铺为大家提供各种类型的经典范文,如工作总结、工作计划、演讲致辞、规章制度、合同协议、条据文书、励志名言、好词好句、教学资料、其他范文等等,想了解不同范文格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!Moreover, our store provides various types of classic sample essays, such as work summaries, work plans, speeches, rules and regulations, contract agreements, policy documents, inspirational quotes, good words and sentences, teaching materials, other sample essays, and more. If you want to learn about different sample formats and writing methods, please stay tuned!氧化还原反应化学教案关于氧化还原反应化学教案5篇教案提供了教学过程的规范和指导,帮助教师组织教学活动、安排教学时间和选择教学方法。
说课氧化还原反应.pptx
思考与交流2
请分析下列3个氧化还原反应中各种元素 的化合价在反应前后有无变化,讨论氧化还
突 破 氧
原反应与元素化合价的升降有什么关系。
化
还
+2 -2 0
0 +4-2
原
2CuO
+
C
高温
==
2Cu
+
CO2↑
反 应
与
+1 -2 0 0 +2-2
化
高温
H2O + C == H2 + CO
合 价
分解反应
2KClO3==△=2KCl+3O2 ↑
Fe+CuSO4 == Cu+FeSO4 置换反应
NaOH+HCl==NaCl+H2O 复分解反应 第14页/共22页
结论:3、氧化还原反应与四种基本反应类 型的关系
非氧化还原反应
置换反应
化合反应化学反应分解反应 氧化还原反应
复分解反应
第15页/共22页
原反应的是( C )
A.化合反应
B.分解反应
C.置换反应
第1D6页.复/共2分2页解反应
3、下列叙述正确的是( BD )
A、在氧化还原反应中,失去电子的物质,所含 元素化合价降低 B、凡是有元素化合价升降的化学反应都是 氧化还原反应 C、在氧化还原反应中一定所有的元素化合 价都发生变化 D、氧化还原反应的本质是电子的转移(得 失或偏移)
第17页/共22页
分层训练2:选做题
能力综合
1.某元素在化学反应中由化合态(化合物)
变为游离态(单质),则该元素( )
A.C一定被氧化
B.一定被还原
