浙教版科学九上第1章物质及其变化章末总结课
浙教版九年级科学上册第1章 物质及其变化复习课件(共33张PPT)

本章考法
物 质 及 其 变 化
复 分 解
定义:由于 化合物 互相交换成分生成新化合物的反应 发生的条件:生成物中有 沉淀 析出,或有 气体
反 应
放出,或有 水 生成
本章考法
考法透视
考点一 酸的性质
考点分析:通常以填空题、实验探究题等方式,结合现实生活 或科学探究等实际问题考查酸的化学性质,或以酸的化学性质为 依托考查科学探究的方法。熟记酸的化学性质及相关知识是解题 的知识基础。
质
酸
及 其
酸
的 通
变
性
化
1.能使指示剂变色
2.酸+活泼金属→ 盐 + 氢气
3.酸+某些金属氧化物→盐+
水
4.酸+某些盐→新酸 + 新盐
5.酸+碱→ 盐 +
水
本章考法
氢氧化钠:俗称烧碱或苛性钠,是白色固体、易
常
物
见
溶于水、易潮解
质
的 氢氧化钙:俗称熟石灰或消石灰
及 其
碱 碱
变 化
碱 1.能使指示剂变色 的 2.碱+某些非金属氧化物→盐+
水
通 性
3.碱+某些盐→新碱 +
4.酸+碱→ 盐 +
新盐 水
本章考法
氯化钠(NaCl):食盐的主要成分
常
物
见 碳酸钠(Na2CO3):水溶液呈碱性
质 及 其 变 化
的 盐
碳酸钙(CaCO3):大理石、石灰石等的主要成分
盐
盐 的
1.盐+某些酸→新盐 +
新酸
化 学
2.盐+某些碱→新盐+
新碱
性 质
3.盐+某些盐→另两种盐
关。为了验证与酸的浓度有关,还缺少的试剂是____C____(填字母)。
浙教版九年级上册科学 第1章物质及其变化知识点总结

浙教版九年级上册科学第1章 物质及其变化 知识点总结第1节 物质的变化B. 探究物质变化的方法1. 观察和实验等方法是探究物质变化的基本方法 1) 变化前:观察并记录物质的形态、颜色等2) 变化中:观察并记录物质的形态、能量变化等现象 3) 变化后:记录生成物的形态和颜色等2. 物质变化规律的应用4. 化学性质和物理性质 1) 化学性质a) 定义:物质在化学变化中表现出来的性质b) 内容:物质的可燃性、还原性、毒性、氧化性、稳定性、助燃性等 2) 物理性质物质的变化规律 物质的性质物质的用途决定 反映决定 反映a)定义:物质不需要发生化学变化就能表现出来的性质b)内容:物质的颜色、状态、气味、熔点、沸点、硬度、溶解性、挥发性、密度、光泽、导电性等第2节物质的酸碱性A.酸性物质和碱性物质1.电离:物质溶解于水或受热融化而形成自由移动离子的过程2.酸性物质1)常见的酸性物质:a)强酸:盐酸(HCl)、硫酸(H2SO4)、硝酸(HNO3)b)2)3)酸的电离HCl = H+ + Cl—H2SO4 = H+ + SO42−HNO3 = H+ + NO3−4)酸根离子:某种酸电离产生的阴离子3.碱性物质1)常见的碱性物质:a)强碱:氢氧化钾(KOH)、氢氧化钙(Ca(OH)2)、氢氧化钠(NaOH)、氢氧化钡(Ba(OH)2)b)2)3)碱的电离NaOH = Na+ + OH—Ba(OH)2 = Ba2+ + 2OH—B.酸碱指示剂1.酸碱指示剂:在酸性或碱性溶液里能显示出不同颜色的物质,简称指示剂某溶液滴入无色酚酞试液不变色,该溶液不一定是酸性溶液,也可能是中性溶液2)指示剂遇酸性或碱性溶液变色的过程是化学变化3)不溶于水的酸或碱不能使指示剂变色,如氢氧化铜是一种难溶于水的碱,它不能使无色酚酞试液变红C.溶液酸碱性的强弱程度1.pH和酸碱性1)2)pH和酸碱性2.测定物质酸碱性强弱1)用品:pH试纸2)方法:用洁净的玻璃棒蘸取被测试的溶液,滴在pH试纸上,将试纸显示的颜色与标准比色卡对照,看与哪种颜色最接近,从而确定被测溶液的pH3)用pH试纸测试的方法比较粗略,精确的测试可使用一种称为酸度计的仪器第3节常见的酸A.盐酸2.化学性质现象:鸡蛋壳逐渐溶解,有气泡产生,放在试管口的燃着的火柴熄灭3)与铁锈和铁反应说明:生锈的铁钉长时间放在盐酸中会有无色气体生成,因铁锈与盐酸反应完毕后,铁继续与盐酸反应4)与氧化铜反应B.硫酸2.硫酸的化学性质1)与锌粒反应3)与Cu(OH)2反应4.浓硫酸的稀释和特性1)浓硫酸的稀释由于浓硫酸的密度比水大,且溶解时放出大量的热,因此在稀释浓硫酸时,一定要把浓硫酸沿器壁慢慢注入水中,并用玻璃棒不断搅拌,一定不要把水倒入浓硫酸里2)特性a)强腐蚀性:浓硫酸对皮肤、衣物等有强烈的腐蚀性如果浓硫酸不慎溅到皮肤上,要先用干布拭去,然后用大量水冲洗,最后用小苏打溶液冲洗,严重时应立即送医院b)脱水性:浓硫酸能把植物纤维(如棉花、麻、造纸的木纤维)、人的皮肤中的氢元素和氧元素“脱出”结合成水c)吸水性:能直接吸收空气中的水分,因此实验室常用作干燥剂,可用于干燥一些气体,如H2、O2、SO2、Cl2、HCl、CO2等。
浙教版九年级上册科学第1章《物质及其变化》复习课件

2.CaCO3和BaCl2溶液能发生复分解反应吗? 3.写出四种不同方法制取ZnCl2的化学方程式。 4.常见的的化肥有哪几类?有什么作用?
上一页 下一页
1.氮肥(铵盐)是否可以与草木灰混合使用?
2.在农村,人们常取少量白色粉末状的化肥和 消石灰一起放在手掌心搓,通过闻气味来检 验是否是氮肥,这是根据什么原理?
上一页 下一页
6.物质酸碱性强弱的测定
(1)pH值
范围通常在 0 ~14 之间。 pH等于7 呈中性。 pH小于7 的呈酸性;pH大于7 的呈碱性。
pH越低,酸性越强;pH越高,碱性越强;
(2)测定方法
测定物质酸碱性强弱最常用、最简单的方法是
上一页
使用pH试纸。
下一页
第3节 常见的酸
一、盐酸(HCl)的个性
上一页 下一页
三、硝酸(HNO3)的个性
1.纯硝酸是无色、易挥发、有刺激性气味的液体。
2.浓硝酸具有挥发性;
3.硝酸具有很强的氧化性;
4.具有很强的腐蚀性;
5.浓硝酸见光易分解,故浓硝酸一般密封保存在棕
色的瓶中。
上一页 下一页
四、酸的通性 1.酸能与指示剂反应 能使紫色石蕊试液变红,无色酚酞试液不变色。 2.酸 +(活泼)金属 = 盐 + 氢气 3.酸 + 某些金属氧化物 = 盐 + 水 4.酸 + 碱 = 盐 + 水 5.酸 + 某些盐 = 新盐 + 新酸
浙教版科学九年级上册第一章
第一章 复习课
第1节 物质的变化
思考:什么是物理变化?什么是化学变化? 1.物理变化:没有新物质产生的变化,只是形态、状态的 改变。 2.化学变化:产生新的物质的变化。
(完整word版)浙教版科学九年级上册知识点总结

浙教版科学九年级上册常考知识点总结第一章探索物质的变化第1节、物质的变化1、物理变化和化学变化的区别在于有没产生新的物质.有新物质产生的属于化学变化.注意:燃烧一定是化学变化。
爆炸不一定发生化学变化,如:气球或轮胎爆炸是物理变化。
2、蓝色的硫酸铜晶体加热变成白色的硫酸铜、以及白色硫酸铜遇水变成蓝色都属于化学变化。
3、鸡蛋清(蛋白质)遇到硫酸铜会凝固,利用这性质可以用硫酸铜检验蛋白质的存在.(考点:重金属铜、铬或铅中毒可以喝牛奶、豆浆或鸡蛋清缓解)第2节、探索酸的性质1、酸的定义:在水中电离时,生成的阳离子全部都是氢离子(H+)2、酸能使紫色石蕊变红色,不能使无色酚酞变色。
(注意:紫色石蕊遇中性溶液是紫色而不是无色。
酚酞遇中性溶液是无色,因此不能用酚酞区分酸溶液和中性溶液)3、酸 + 碱—-—盐 + 水(复分解反应)①用胃舒平(氢氧化铝)中和过多胃酸3HCl + Al(OH)3 ==== AlCl3 + 3H2O 。
②硫酸和氢氧化铜反应Cu(OH)2 + H2SO4 === CuSO4 + 2H2O。
4、金属氧化物 +酸——-—盐 + 水(复分解反应)①用盐酸除铁锈Fe2O3 + 6HCl === 2FeCl3 + 3H2O②变黑的铜丝和稀硫酸反应CuO + H2SO4 ==== CuSO4 + H2O5、金属单质 + 酸————盐 + 氢气(置换反应)①铁钉在足量盐酸中产生气泡Fe + H2SO4 = FeSO4 + H2↑(注意:铁不管是与盐酸还是硫酸或者硫酸铜反应生成的都是+2价的亚铁,不是+3价的铁!)②实验室制氢气Zn + H2SO4 = ZnSO4 + H2↑6、酸 + 盐 -—-—- 另一种酸 + 另一种盐(复分解反应)①检验氢氧化钠已变质(加盐酸) Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑,(氢氧化钠变质是吸收空气中的CO2变成了碳酸钠和水,质量会增加,检验是否变质的实质就是检验氢氧化钠中有无CO32+离子,可以使用酸、BaCl2、或者CaCl2等)②检验盐酸中的氯离子HCl + AgNO3 === AgCl↓ + HNO3 (AgCl是不溶于稀硝酸的白色沉淀)③检验硫酸中的硫酸根离子H2SO4 + BaCl2 ==== BaSO4↓+ 2HCl(BaSO4也是不溶于稀硝酸的白色沉淀,但是碳酸钙和碳酸钡都会溶解在稀硝酸里)(注意:某溶液加入BaCl2产生不溶于稀硝酸的白色沉淀不能证明该溶液一定含有SO42-,因为也可能溶液中有银离子产生的沉淀是AgCl,只能说该溶液可能含有SO42—离子或Ag+或两种离子都有 )7、酸的个性1)浓盐酸(HCl)浓盐酸具有很强的挥发性,因此打开瓶盖可以看到白雾(注意不是白烟),闻到刺激性气味。
浙教版科学九年级上册第一章知识点总结

第一章笔记内容大全第一节:物质的变化一、物质是在不断变化着的物理变化:变化中没有新物质产生,只有形态、状态的改变。
化学变化:变化中会产生新的物质。
物理性质:不需要发生化学变化就能表现出来的性质化学性质:只在化学变化中表现出来的性质·物质的性质物理性质: 颜色、气味、软硬、物质的溶解性、液体的沸点、熔点金属的延展性、光泽化学性质:可燃性、氧化性、还原性、酸碱性。
2NaOH+CuSO4=Na2SO4 +Cu(OH)2↓现象:形成蓝色絮状沉淀4242现象:蓝色固体逐渐变白CuSO4 + 5H2O = CuSO4·5H2O 现象:白色固体逐渐变蓝――利用硫酸铜可以检验蛋白质的存在!-----白色硫酸铜固体遇水会呈蓝色,利用这一性质可以检验水的存在第二节:酸一、酸:酸是在水中电离时,生成的阳离子都是(H+)这一种粒子的一类物质酸的共同特点——电离产生的阳离子都只有H+二、酸碱指示剂1).定义: 在酸或碱溶液里能显示出不同颜色的物质叫做酸碱指示剂.2)常见的酸碱指示剂有: 紫色石蕊试液和无色酚酞试液.~①pH试纸能显示酸性的强弱,而酸碱指示剂则只能指示溶液是否显酸性。
②酸能使指示剂变色,其中能使紫色石蕊试液变红色,使无色酚酞试液不变色。
三、盐酸的性质:由蓝色逐渐变成紫色最后变成红色HCl +NaOH = NaCl + H2O3 HCl + Al(OH)3= AlCl3 + 3H2O2HCl + CaCO3=CaCl2 + H2O + CO2↑现象:蛋壳表面产生气泡,燃着的木条伸入后会熄灭~2HCl + Na2CO3=2NaCl + H2O + CO2↑Ca(OH)2+ CO2=CaCO3↓+H2O6HCl + Fe2O3= 2FeCl3+3H2O现象:铁锈消失,溶液变成黄色2HCl + CuO = CuCl2 + H2O现象:黑色粉末消失,溶液变成蓝色Fe2O3+ 6HCl = 2FeCl3+ 3 H2O 现象:铁锈逐渐溶解,溶液变成黄色Fe + 2HCl ==FeCl2 + H2↑Zn + 2HCl == ZnCl2 + H2↑]四、稀硫酸酸性实验:Zn + H2SO4 === ZnSO4 + H2↑(实验室用来制取氢气)CuO + H2SO4 = CuSO4 + H2O现象:黑色氧化铜溶解消失,溶液变成蓝色。
浙教版科学九年级上册-第1章-物质及其变化-本章总结-习题课件(41张ppt)

第 1 章 物质及其变化
二 常见的碱及其性质
【考点扫描】 知道碱的含义,并能列举常见的碱;掌握氢氧化 钠、氢氧化钙等常见碱的性质和用途;掌握氢氧化钠、氢氧化钙 的共性,并说明原因;知道中和反应的概念、实质。
第 1 章 物质及其变化
例2 某兴趣小组同学将 CO2 分别通入澄清石灰水和氢氧化钠溶液 中,观察到前者变浑浊,后者无明显现象。
解析 (1)CO2 与 Ca(OH)2 反应生成 CaCO3 白色沉淀而使溶液变浑浊。
第 1 章 物质及其变化
①王强认为上述实验是可行的,其共同原理 是氢氧化钠溶液与 CO2 发生反应,使容器内气压降低 。 ②李莉提出质疑,她认为上述实验不严谨,其理由 是 CO2 能溶于水,也能使容器内气压降低。要得到科学严谨的结论,仍 利用该装置,需补做的对比实验是 将氢氧化钠溶液换成等体积的水 。 ③你认为两实验中存在安全隐患的是 A (填代号),理由 是 氢氧化钠有腐蚀性,易伤到手 。
பைடு நூலகம்
变酸 化
酸
盐酸的特性:与AgNO3作用生成不溶于稀硝酸的 AgCl沉淀
的 个 性
硫酸 的特 性
浓硫酸:吸水性、脱水性
稀硫酸:与可溶性钡盐作用生成不溶于 稀硝酸的BaSO4沉淀
第 1 章 物质及其变化
碱
的
通
物
性
质常
及见
其的 碱
变碱 的
化
个
性
能使紫色石蕊试液变蓝,使无色酚酞试液变红 与某些非金属氧化物反应 与酸发生中和反应 与某些可溶性盐反应
第1章 物质及其变化
本章总结
第 1 章 物质及其变化
本章总结
知识框架 本章中考 挑战自我
浙教版2023-2024学年第一学期九年级科学第一章《物质及其变化》知识梳理

浙教版2023-2024学年第一学期九年级科学第一章《物质及其变化》知识梳理第一章《物质及其变化》知识梳理第1节物质的变化1.常见的变化(1)物质的变化包括物理变化和化学变化,二者根本区别:①宏观上变化中是否生成新物质;②微观上变化中是否生成新分子。
(2)化学变化的实质是构成物质分子的原子重新进行组合,形成了新的分子;在化学变化中同时伴随有物理变化;而物理变化中不一定有化学变化。
2.物质的性质(1)物质的性质包括:物理性质和化学性质;(2)物理性质是指物质不需发生化学变化就表现出来的性质,它可通过人体感官直接感知或用仪器测量出来,如颜色、状态、气味、味道、密度、溶解性、熔点、沸点、硬度、吸附性、挥发性、导热性、导电性、延展性、铁磁性等;(3)化学性质是物质在化学变化中表现出来的性质,如可燃性、助燃性、稳定性、还原性、氧化性、毒性、酸碱性等。
第2节物质的酸碱性1.一些物质溶解于水或受热熔化而离解成自由移动离子的过程。
(1)在溶液里,所有的阳离子带的正电荷总数和所有阴离子带的负电荷总数相等,整个溶液不显电性;(2)书写时要注意配平,使方程式两边各元素的原子个数相等;(3)阴、阳离子所带的电荷数一般可以根据它们在化合物中的化合价来判断。
2.表示方法:电离方程式。
3.酸性物质:具有酸性的物质。
常见的酸性物质有盐酸、碳酸、醋酸(食醋)、草酸、柠檬酸、苹果酸等。
4.酸:酸在水中电离时,产生的阳离子全部都是H+。
5.酸的溶液一定是酸性溶液;酸性溶液不一定是酸的溶液。
6.碱性物质:具有碱性的物质。
常见的碱性物质有氢氧化钠、苏打、熟石灰、氨水、肥皂水等。
7.碱:碱在水中电离时,产生的阴离子全部都是OH-。
8.碱的溶液一定是碱性溶液;碱性溶液不一定是碱的溶液。
9.在酸性或碱性溶液里能显示出不同颜色的物质,叫做酸碱指示剂,通常简称指示剂。
常见的酸碱指示剂有紫色石蕊试液和无色酚酞试液。
(1)某一酸性溶液,能使紫色石蕊试液变红色,无色酚酞试液不变色;(2)某一碱性溶液,能使紫色石蕊试液变蓝色,无色酚酞试液变红色。
新浙教版九年级上册科学第一章物质的变化详细知识点和笔记

第一章笔记内容大全§1-1物质的变化一、物质是在不断变化着的物理变化:变化中没有新物质产生,只有形态、状态的改变。
化学变化:变化中会产生新的物质。
【思考】物理变化和化学变化在本质上有什么不同?化学变化的实质是:构成物质的分子的原子重新组合,形成了新的分子。
而物理变化的实质:分子间的距离发生改变。
物理性质:不需要发生化学变化就能表现出来的性质:如颜色、气味、软硬、物质的溶解性、液体的沸点、晶体的熔点、吸水性等化学性质:只在化学变化中表现出来的性质如:酸碱性、可燃性、氧化性、还原性、腐蚀性、脱水性、毒性等二、探究物质变化的方法通过观察和实验等来寻找物质变化的证据。
物质变化的证据:生成沉淀、颜色改变、气体产生、温度变化、性质变化、发光发热、PH 变化、状态变化等。
小结:根据物质变化中所获得的信息对物质的性质进行分析推测的方法,是认识物质、探索物质变化规律的基本方法。
三、物质变化规律的应用――根据物质的变化规律,我们可以推测物质的性质和用途。
白色硫酸铜固体遇水会呈蓝色,这一性质有什么应用?――白色硫酸铜粉末可以作某种物质是否含有水分的检测剂,或少量水分的吸收剂。
【小结】探究物质的变化,可以以观察、实验为方法,从不同的方面寻找证据,进行分析,从而认识物质的变化和规律,推测它们的性质,并利用这些变化规律造福人类。
四、应用1、学校购买了几瓶无水酒精,有人怀疑有假。
请你设计一个实验证明该酒精中是否真的含有水分?答:取少量酒精样品装入试管,加入适量的白色CuSO4粉末,如果变蓝色,证明该酒精中含水。
如不变色,证明是无水酒精。
§1-2物质的酸碱性一、酸:酸是在电离时,生成的阳离子都是(H+)化合物碱:碱是电离时产生的阴离子全部是OH-的化合物二、酸碱指示剂1).定义:在酸或碱溶液里能显示出不同颜色的物质叫做酸碱指示剂.2)常见的酸碱指示剂有:紫色石蕊试液和无色酚酞试液.3)作用:可以定性地测量溶液的酸碱性.4②酸能使指示剂变色,其中能使紫色石蕊试液变红色,使无色酚酞试液不变色。
浙教版《科学》九年级上册知识点总结

第一章物质及其变化第1节物质的变化(二) 探究物质变化的方法1.通过观察和实验等来寻找物质变化的证据。
物质变化的证据:生成沉淀、颜色改变、气体产生、温度变化、性质变化、发光发热、PH变化、状态变化等。
2.物质变化规律的应用――根据物质的变化规律,我们可以推测物质的性质和用途。
如在鸡蛋清中加入硫酸铜溶液,鸡蛋清发生凝固。
我们就能得出硫酸铜能使蛋白质变性。
因此,能用这个性质,检验蛋白质的存在。
――寻找未知物质、探索物质变化规律等。
第2节物质的酸碱性(一)酸性物质和碱性物质1.酸性物质(具有酸性的物质)强酸性物质:盐酸、硫酸和硝酸弱酸性物质:食醋、番茄酱、苹果2.一些物质溶于水或受热熔化而离解成自由移动离子的过程叫电离;(酸在水中电离时生成的阳离子只有氢离子(H+),产生的阴离子叫这种酸的酸根离子;同理,碱在水中电离时生成的阴离子只有氢氧根离子(OH-))3.碱性物质(具有碱性的物质)强碱性物质:氢氧化钠、熟石灰、氢氧化钾、氢氧化钡等弱碱性物质:纯碱、洗涤剂等注:某些碱性物质有一定的去污能力(二)酸碱指示剂1.定义:在酸或碱溶液里能显示出不同颜色的物质,叫做酸碱指示剂.2. 常见的酸碱指示剂有:紫色石蕊试液和无色酚酞试液.3. 作用:可以定性地测量溶液的酸碱性.蓝色石蕊试纸红色不变色红色石蕊试纸不变色蓝色(三) 溶液酸碱性的强弱程度1. pH:反应物质酸碱性强弱的指标。
范围在0~14之间2. pH试纸测定pH的方法:用洁净的玻璃棒蘸取被测试的溶液,滴在pH试纸上,将试纸显示的颜色与标准比色卡对照,从最接近的颜色来确定被测溶液的pH注:①pH试纸能显示酸性的强弱,而酸碱指示剂则只能定性地测量溶液的酸碱性。
②酸能使指示剂变色,其中能使紫色石蕊试液变红色,使无色酚酞试液不变色。
第3节常见的酸酸:是在水中电离时,生成的阳离子全部是(H+)这一种粒子的化合物酸的共同特点——电离产生的阳离子都只有H+(一)盐酸A.重要的物理性质1.纯净盐酸是无色液体(工业盐酸由于混有Fe3+而呈黄色),有刺激性气味,有酸味。
新浙教版九年级上册科学第一章《物质及其变化》知识点归纳
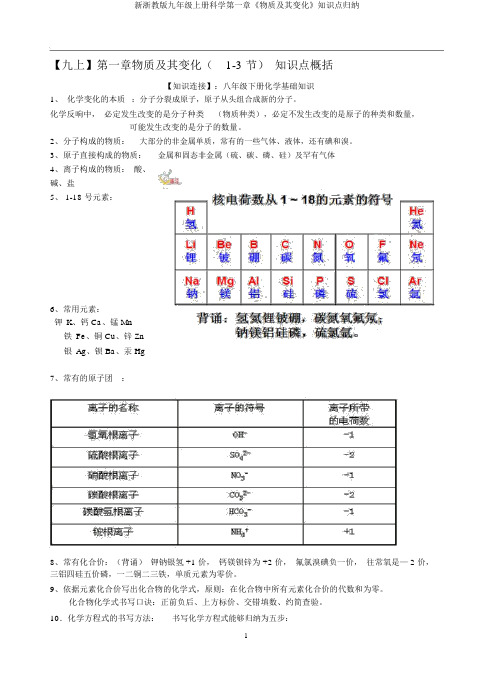
【九上】第一章物质及其变化(1-3 节)知识点概括【知识连接】:八年级下册化学基础知识1、化学变化的本质:分子分裂成原子,原子从头组合成新的分子。
化学反响中,必定发生改变的是分子种类(物质种类),必定不发生改变的是原子的种类和数量,可能发生改变的是分子的数量。
2、分子构成的物质:大部分的非金属单质,常有的一些气体、液体,还有碘和溴。
3、原子直接构成的物质:金属和固态非金属(硫、碳、磷、硅)及罕有气体4、离子构成的物质:酸、碱、盐5、 1-18 号元素:6、常用元素:钾K、钙 Ca、锰 Mn铁Fe、铜 Cu、锌 Zn银Ag、钡 Ba、汞 Hg7、常有的原子团:8、常有化合价:(背诵)钾钠银氢 +1 价,钙镁钡锌为 +2 价,氟氯溴碘负一价,往常氧是— 2 价,三铝四硅五价磷,一二铜二三铁,单质元素为零价。
9、依据元素化合价写出化合物的化学式,原则:在化合物中所有元素化合价的代数和为零。
化合物化学式书写口诀:正前负后、上方标价、交错填数、约简查验。
10.化学方程式的书写方法:书写化学方程式能够归纳为五步:①写:反响物的化学式写在“ =”的左侧,生成物的化学式写在“ =”的右侧,多种反响物或生成物之间用“ +”相连。
②配:在反响物、生成物的化学式前配上适合的化学计量数,使式子两边每一种元素的原子总数相等。
往常用最小公倍数法配平。
③注:注明反响条件,往常写在“=”的上方或下方。
“加热”常用“△”表示。
④标:假如反响物中没有气体,而生成物中有气体产生,那么在气体的化学式右侧用“↑”号表示;假如是溶液中发生的反响,反响物中无固体,而生成物中有固体的,那么在固体的化学式右侧用“↓”号表示。
⑤查:检查化学式能否正确,化学方程式能否配平,条件和物质状态能否标明,标明能否适合。
11.依据化学方程式计算的基本步骤( 1)设未知量x(此时 x 不带单位,如“设某物质的质量为x 克”是错误的);( 2)正确书写相关的化学方程式(别忘了配平);( 3)计算出相关物质的相对分子质量(要乘上配平的系数),写在相应化学式的正下方(包含x);( 4)在相关物质的相对分子质量下边写出已知质量(纯净物质量)和未知量x;( 5)将相关的四个量列成比率式,求出未知量x(此时 x 要带单位,如x=1 克);( 6)简洁地写出答案。
新浙教版九年级科学目录 (3)

科学九年级上册目录第1章物质及其变化
第1节物质的变化
第2节物质的酸碱性
第3节常见的酸
第4节常见的碱
第5节酸和碱之间发生的反应
第6节几种重要的盐
第2章材料及其利用
第1节金属材料
第2节金属的化学性质
第3节有机物和有机合成材料
第4节物质的分类
第5节物质的转化
第6节材料的利用与发展
第3章能量的转化与守恒
第1节能量及其形式
第2节机械能
第3节能量转化的量度
第4节简单机械
第5节物体的内能
第6节电能
第7节核能
第8节能量的转化与守恒
第4章代谢与平衡
第1节食物与营养
第2节食物的消化与吸收
第3节体内物质的运输
第4节能量的获得
1
第5节体内物质的动态平衡
科学九年级下册目录第 1 章演化的自然
第1节人类对宇宙的认识
第2节太阳系的形成和恒星的演化
第3节地球的演化和生命的起源
第4节生物的进化
第5节遗传与进化
第 2 章生物与环境
第1节生物与环境的相互关系
第2节种群
第3节生物群落
第4节生态系统的结构和功能
第5节生态系统的稳定性
第 3 章人的健康
第1节健康
第2节来自微生物的威胁
第3节身体的防卫
第4节非传染性疾病
第5节人的运动系统和保健
第6节健康生活
第 4 章可持续发展
第1节人类发展与环境问题
第2节能源及其利用
第3节低碳生活
第4节实现可持续发展
2。
浙教版 九年级科学第一章 物质及其变化 知识归纳(整理版)

九年级科学第一章知识归纳一、概念:1、酸:电离出的阳离子都是氢离子的化合物,书写——氢离子+酸根离子2、碱:电离出的阴离子都是氢氧根离子的化合物,书写——金属离子+氢氧根离子3、盐:由金属离子和酸根离子组成的化合物。
书写——金属离子+酸根离子备注:酸根离子不一定有氧元素(Cl-),可能有金属元素( );金属离子不一定有金属元素( )4、复分解反应——由两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应。
AB+CD=AD+CB 复分解反应化合价一定不变二、物理变化和化学变化以及相关性质(一)物理变化:没有新物质生成的变化,三态转化,形状改变,挥发,潮解等化学变化:有新物质生成的变化,燃烧,爆炸,生锈,氧化还原反应等(二)物理性质:不需要通过化学变化就能体现的性质:溶解性,挥发性,易潮解,吸水性等化学性质:需要通过化学变化才能体现的性质:脱水性,易风化,有毒,酸碱性等三、实验现象的描述1.溶液颜色是否改变:溶液从X色变为Y色2.是否有X色沉淀或者气体生成:有X色沉淀/气体生成需要描述现象,3.固体物质是否逐渐消失/溶解:X色固体逐渐消失/溶解但不可直接说出4.和气压有关的现象:液面上升,U形管液面左低右高,气球胀大生成物的名称5.导致气压变化的原因:气体增多,气压增大,气体减少,气压减小热胀冷缩:受热膨胀,气压增大四、溶解性表(是指物质放在水中的溶解性)(1)大多数酸可溶()(2)碱的溶解性:钾、钠、钡、铵溶、钙微溶,其余碱全不溶。
(3)盐的溶解性:钾、钠、铵、硝四盐溶。
氯化物除AgCl不溶外,其余全溶。
硫酸盐除BaSO4不溶,Ag2SO4微溶,其余全溶。
碳酸盐除钾、钠、铵盐全溶,其余全不溶。
两种有色沉淀:氢氧化铜——蓝色沉淀氢氧化铁——红褐色沉淀以上说的不溶是指物质不溶于水会生成沉淀,但有的沉淀会溶于酸,将沉淀分类:既不溶于水,也不溶于酸的沉淀:氯化银( )、硫酸钡( )两者都是白色沉淀溶于酸,会有气体产生:碳酸盐沉淀,如碳酸钙( )、碳酸钡( )等溶于酸,但没有气体产生:氢氧化物沉淀:如氢氧化铜、氢氧化铁附:医院里常用BaSO4做胃的透视检查,虽然Ba2+是重金属离子,会让我们体内的蛋白质变性沉淀,但BaSO4不溶于水也不溶于酸,不会电离出Ba2+,所以对人体无害。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
C.Na2SO3+CaCl2===CaSO3↓+2NaCl
D.H2SO3+2NaOH===Na2SO3+2H2O
考点 3
酸与碱的反应
5.下图是对实验绘制的相关物质变化图形,其中实验结 果与图形对应准确的是( A )
①
② 第5题图
③
④
A .图①是向一定量的稀盐酸和氯化钙的混合溶液中不
断加入碳酸钠溶液至过量
失; 猜想②:可能是氢氧化钠溶液与空气中的二氧化碳反应,
使红色消失。
(1) 为验证猜想①,该组同学将配制的氢氧化钠溶液加热
后,在液面上方滴一些植物油,然后在冷却后的溶液中滴 入酚酞试液。实验中 “ 加热 ” 和 “ 滴入植物油 ” 的目的是 把氢氧化钠溶液中的氧气排尽和隔绝氧气 。 实 验 结 果 _______________________________________ 表明酚酞试液红色消失与空气中的氧气无关。
B.图②是用H2还原CuO来测定CuO中铜元素的含量 C.图③是向饱和的NaCl溶液中不断加水 D.图④是向 10 g质量分数为 2%的 NaOH溶液中逐滴加 入溶液质量分数为2%的盐酸溶液
6. 某兴趣小组为证明 NaOH溶液与稀盐酸发生了中和反
应,从不同角度设计了如下实验方案,并进行实验。 [方案一]先在NaOH溶液中滴加几滴酚酞试液,溶液显红
接着能使酚酞试液褪色 __________________________。
[方案二]化学反应中通常伴随有能量的变化,可借助反应
前后的温度变化来判断反应的发生。如果NaOH溶液与稀
盐酸混合前后温度有变化,则证明发生了化学反应。 该组同学将不同溶质质量分数的盐酸和 NaOH 溶液各 10 mL混合,用温度计测定室温下混合前后温度的变化,并 记录了每次混合前后温度的升高值Δ t(如下表)。
色,然后再滴加稀盐酸,可观察到红色逐渐消失,则证明
NaOH溶液与稀盐酸发生了化学反应。
该组同学在向NaOH溶液中滴加酚酞试液时,发现了一个 意外现象:氢氧化钠溶液中滴入酚酞试液,溶液变成了红 色,过了一会儿红色就消失了。该小组对这种意外现象的 原因作了如下猜想:
猜想①:可能是酚酞试液与空气中的氧气反应,使红色消
第8题图
回答下列问题。
不能,若用 (1)操作②能否用硝酸钡溶液?说明理由:____________
硝酸钡溶液,则会引入新的硝酸钠杂质无法除去 。 ____________________________________________
(2)进行操作②后,如何判断硫酸钠已除尽,方法是
取上层澄清液体于试管中,向试管中滴加氯化钡溶液, _________________________________________________
剂(试纸)中宜取用____ D 。
A.蓝色石蕊试纸 C.无色酚酞试剂 B.紫色石蕊试液 D.pH试纸
第4题图 (2) 已知 CO2 的饱和溶液常温下 pH 不小于 5.6 。通常空气 中 CO2 的含量大于 SO2 的含量,但人们反而将空气中的 SO2 认定为形成酸雨的主要原因之一。有同学想通过如
学们进行如下探究: 小张同学取待测液测得pH=10,他得出的关于溶液成分的 一定不是NaCl溶液(可能是NaOH、Na2CO3或 结论是____________________________________________ NaOH和Na2CO3的混合溶液) 。 ____________________________
(2) 为验证猜想②,该组同学做了如下实验:取了一定量
的 Na2CO3 溶液,在其中滴入酚酞试液,发现溶液也呈现 红色,请解释这一现象产生的原因:碳酸钠溶液显碱性 ________________。 由此说明酚酞试液红色消失与空气中的二氧化碳无关。
(3)该小组同学通过查阅资料得知:当氢氧化钠溶液溶质
_________________ 看是否有沉淀生成 。
(3) 操作③的目的是 _________________ 使钡离子完全沉淀 ,③④操作顺序 能否交换,其理由是___________________ 不能,得不到滤液 。 (4)此设计方案是否严密,说明理由:________________ 不严密,过量的 碳酸钠没有除去 。 ________________
理性质;氢氧化钠去除油污、氧气用于医疗急救、碳酸氢钠
用于治疗胃酸过多等都需要通过化学变化才表现出来,都是 利用了其化学性质。 2. 硫酸是常见的酸,也是常用的化工原料。由于浓度不同, 浓硫酸与稀硫酸在性质上存在较大差异。某课外兴。
趣小组为探究浓硫酸的某些特性做了如下一些实验。请
结合有关实验,按要求回答下列问题。
小苏打 (NaHCO3)、凉开水,还需加入柠檬酸,加入柠檬 柠檬酸和小苏打反应产生二氧化碳气体 。 酸的目的是_____________________________________ 4 .雨、雪在形成和降落过程中吸收、溶解了空气中 SO2 及氮氧化物等物质,形成了pH小于5.6的降水称为酸雨, 请回答下列有关酸雨的问题。 (1) 要测定某地采集到的雨水是否为酸雨,下列提供的试
第6题图
______________ 右边液面上升 现象可以判断 NaOH 溶液与稀盐酸发生 了中和反应。
考点 4
盐的性质
7.2014· 山西同学们在初中化学实验室
中,发现一瓶如图所示久置的瓶口有白
第7题图
色固体、瓶塞丢失的无色溶液。已知原溶液可能是NaCl、
NaOH或Na2CO3三种溶液中的一种,为确定溶液成分,同
第1 章 物质及其变化
章末总结课
考点 1
物质的变化
1 . 2014· 哈尔滨物质的性质很大程度上决定了物质的用
途。以下是生产、生活中一些物质的用途。 ①铜制成导线 ②氢氧化钠去除油污 ③氧气用于医疗急救 ④金刚石用于裁玻璃 ⑤石墨可制铅笔芯
⑥碳酸氢钠用于治疗胃酸过多
请你从用途中体现出的主要性质角度,将上述用途平均分为 体现物质的物理性质 ,包 两类:其中一类的分类标准是 _____________________ ①④⑤ 填序号)。 括事例为_________( 【解析】 铜制成导线、金刚石用于裁玻璃、石墨可制铅笔 芯等都不需要发生化学变化就能表现出来,都是利用了其物
图所示的实验寻找证据,你认为下一步的实验步骤是测
pH小于5.6 的实 试管中溶液的酸碱性 ,只要出现 ____________ 定 ____________________
验结果,就可认定SO2溶于水有形成酸雨的可能。
(3) 已知 SO2 与 CO2 有许多化学性质是相似的,亚硫酸钙 (CaSO3)是白色难溶于水但可溶于酸的固体。某同学向一 酸雨样品中滴加CaCl2溶液,未观察到有浑浊现象,继续 滴入 NaOH 溶液后即有白色沉淀产生。在以上实验过程 A 。 中,下列不可能发生的化学反应是____ A.SO2+CaCl2+H2O===CaSO3↓+2HCl B.SO2+2NaOH===Na2SO3+H2O
图所示。
第2题图 ①稀释浓硫酸时,应将 ________ 浓硫酸 缓缓地注入盛有 ____ 水 的 烧杯中并不断搅拌。
②由图中所示曲线你能得到的实验结论有哪些?
浓硫酸和一定浓度以上的稀硫酸都具有吸水性 ; __________________________________________
浓硫酸吸水能力比稀硫酸强(吸水速度快、吸水量大) _______________________________________________
(1)用玻璃棒蘸取少量浓硫酸在滤纸上写字,过后观察, 脱水 性,使纸 字迹显黑色,这主要是由于浓硫酸具有 ______ 中的纤维素碳化的缘故;在洗气瓶中盛放浓硫酸,除去 氢气或氧气中的水分,是利用其_______ 吸水 性。
(2)探究浓硫酸的吸水性。兴趣小组把98%的硫酸10 mL
和63.3%的硫酸(用10 mL 98%的硫酸与10 mL水配成)约 20 mL分别放入两个相同的大表面皿中,称量、观察、 记录、分析。根据室温环境下实验的数据绘成的曲线如
(写两点)。
考点 2
物质的酸碱性
3.2014沧州生活中处处充满化学,请用你学过的化 学知识回答下列问题。 (1)石蕊试液遇酸变红。举一生活中与之原理相似的实 二氧化碳气体通入紫色石蕊试液后试液会变红 。 例:__________________________________________
(2)在家庭中自制汽水时需要在饮料中加入白糖、果汁、
_________________________________________________ 了红色,过了一会儿红色就消失了;加水稀释的氢氧化
钠溶液变成红色,并且红色不消失,说明氢氧化钠溶液 _________________________________________________
的溶质质量分数达到一定程度时,能使酚酞试液变红, _________________________________________________
编号 1 2 3 盐酸 3.65% 3.65% 7.30% NaOH 溶液 2.00% 4.00% 8.00% Δ t/℃ 3.5 x 14Biblioteka 7 。 (1)表中x=____
(2)某同学在没使用温度计的情况下,
通过如图所示装置完成了实验。则 U形管中左边液面下降 该同学根据_____________________
质量分数大于10%时,就会出现上述意外现象。请设计
实验证明该方案中取用的氢氧化钠溶液中溶质质量分数 过大:___________________________________________ 取相同质量的氢氧化钠溶液分别置于两个烧杯中, _________________________________________________ 向其中一个烧杯中加入足量的水,再分别向两个烧杯中 滴加几滴酚酞试液,没有加水稀释的氢氧化钠溶液变成 _________________________________________________
