平衡常数计算 答案
2.3.3 化学平衡常数【含答案及解析】

2.3.3 化学平衡常数【含答案及解析】姓名___________ 班级____________ 分数__________一、选择题1. 下列关于化学平衡常数说法中错误的是A .某特定反应的平衡常数仅是温度的函数B .化学平衡发生移动,平衡常数必发生改变C .平衡常数发生变化,化学平衡必定发生移动D .催化剂不能改变平衡常数的大小2. 将固体NH 4 I置于密闭容器中,在一定温度下发生下列反应:① NH 4 I(s)NH 3 (g)+HI(g);② 2HI(g) H 2 (g)+I 2 (g)。
达到平衡时,c(H 2 )=0 . 5mol/L,c(HI)=3 mol/L,则此温度下反应① 的平衡常数为A.9_________ B.16_________ C.12_________ D.253. 在一密闭容器中,用等物质的量的A和B发生如下反应A(g)+2B(g) 2C(g),反应达到平衡时,若混合气体中A 和B的物质的量之和与C的物质的量相等,则这时A的转化率为A.40% B.50% C.60% D.70%4. 某温度下,在一个2 L的密闭容器中,加入4 mol A 和2 mol B进行如下反应:3A(g)+2B(g) 4C(s)+2D(g),反应一段时间后达到平衡,测得生成1 . 6 mol C,则下列说法正确的是A .该反应的化学平衡常数表达式是 k =B .此时B的平衡转化率是40%C .增大该体系的压强,平衡向右移动,化学平衡常数增大D .增加B,平衡向右移动,B的平衡转化率增大5. 反应Fe(s) +CO 2 (g) FeO(s)+CO(g) ,700 ℃ 时平衡常数为1 . 47 ,900 ℃ 时平衡常数为2 . 15。
下列说法正确的是A .升高温度该反应的正反应速率增大,逆反应速率减小B .该反应的化学平衡常数表达式为K=C .绝热容器中进行该反应,温度不再变化,则达到化学平衡状态D .该反应的正反应是放热反应6. 在25 ℃ 时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:7. 物质 X Y Z 初始浓度/( mol · L − 1 ) 0 . 1 0 . 2 0 平衡浓度/( mol · L −1 ) 0 . 05 0 . 05 0 . 18. 一定量的CO 2 与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO 2 (g)2CO(g)。
化学平衡常数及计算练习(附答案)

化学平衡常数练习一、单选题1.在一密闭容器中,反应aX(g)+bY(g)cZ(g)达到平衡时平衡常数为K1;在温度不变的条件下向容器中通入一定量的X和Y气体,达到新的平衡后Z的浓度为原来的1.2倍,平衡常数为K2,则K1与K2的大小关系是()A.K1<K2B.K1=K2C.K1>K2D.无法确定2.在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)⇌Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表:温度/℃25 80 230平衡常数5×104 2 1.9×10-5下列说法不正确的是( )A.上述生成Ni(CO)4(g)的反应为放热反应B.在25 ℃时,反应Ni(CO)4(g)⇌Ni(s)+4CO(g)的平衡常数为2×10-5C.在80 ℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5 mol·L-1,则此时v正>v逆D.在80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol·L-13.在一定温度下,改变反应物中n(SO2),对反应2SO2(g)+O2(g)⇌2SO3(g)ΔH<0的影响如图所示,下列说法正确的是( )A .反应b 、c 点均为平衡点,a 点未达到平衡且向正反应方向进行B .a 、b 、c 三点的平衡常数K b >K c >K aC .上述图象可以得出SO 2的含量越高得到的混合气体中SO 3的体积分数越高D .a 、b 、c 三点中,a 点时SO 2的转化率最高 4.下列关于化学平衡常数的说法中,正确的是( ) A .可以用化学平衡常数来定量描述化学反应的限度B .在平衡常数表达式中,反应物浓度用起始浓度表示,生产物浓度用平衡浓度表示C .平衡常数的大小与浓度、压强、催化剂有关D .化学平衡发生移动,平衡常数必定发生变化5.在一定温度下,向2L 体积固定的密闭容器中加入1molHI ,发生反应:2HI(g)⇌H 2(g)+I 2(g) ∆H>0,测得2H 的物质的量随时间变化如表,下列说法正确的是( )t /min123()2n H /mol0.060.10.1A .2 min 内的HI 的分解速度为0.0511mol L min --⋅⋅B .该温度下,平衡时HI 的转化率为10%C .该温度下的平衡常数为1K ,温度升高10℃后平衡常数为2K ,则K 1>K 2D .达平衡后其他条件不变,压缩容器体积,平衡不移动,()c HI 不变6.关于 C(s)+H 2O(g)CO(g)+H 2(g)的平衡常数(K)书写形式,正确的是( )A .K=22c(C)c()c(CO)c O (H H )B .K=22c(CO)c()c(C)c(H H O)C .K=22c(CO)c()c(H H O)D .K=22c()c(C O O)c(H H )7.吸热反应N 2(g )+O 2(g )2NO (g ),在2000℃时,K =6.2×10-4。
化学复习:有关水溶液中平衡常数关系计算

因而该比值减小。
5.高铁酸钾(K2FeO4)是一种优良的水处理剂。25 ℃时, 其水溶液中加酸或碱改变溶液的pH时,含铁粒子的物 质的量分数δ(X)随pH的变化如图,已知δ(X)=nnFXe 。 (1)由B点数据可知,FeO4的第一步电离常数Ka1= __4_.0_×__1_0_-_4_。
B 点 pH=4,δ(HFeO- 4 )=0.8,则 δ(H2FeO4)=0.2,由于溶液体积相同,则ccHH2FFeeOO- 44 =00..82=4.0,则 H2FeO4 的第一步电离常数 Ka1=cHcFHeO2F- 4 e·Oc4H+=4.0×10-4。
化热精点讲学复习:有关水溶液中平衡常数关系计算
1.水解常数与电离常数、水的离子积之间的关系 常温下,H2S的电离常数为Ka1、Ka2,推导Na2S溶液中S2-水解常数Kh1、Kh2与Ka1、 Ka2的关系。 答案 (1)S2-+H2O HS-+OH-
Kh1=cHSc-S·c2-O H-=cHSc-S·c2-H·+ cH·c+O H-=KKaw2。 (2)HS-+H2O H2S+OH- Kh2=cH2cSH·cS-OH-=cH2cSH·cS-O·Hc-H·+cH+=KKaw1。
2.水解常数与溶度积、水的离子积之间的关系 常温下推导Cu2+的水解常数与溶度积、水的离子积之间的关系。
答案 Cu2++2H2O Cu(OH)2+2H+ Kh=cc2CHu2++=cc2CHu2++··cc22OOHH--=Ksp[CKu2wOH2]。
3.平衡常数与电离常数、溶度积之间的关系 (1)以反应CuS(s)+2Ag+(aq) Cu2+(aq)+Ag2S(s)为例,推导沉淀转化的平衡常数K。 答案 K=cc2CAug2++=cc2CAug2++··ccSS22--=KKssppACgu2SS。
化学平衡常数及计算练习(附答案)

化学平衡常数练习一、单选题1.在一密闭容器中,反应aX(g)+bY(g)cZ(g)达到平衡时平衡常数为K1;在温度不变得条件下向容器中通入一定量得X与Y气体,达到新得平衡后Z得浓度为原来得1、2倍,平衡常数为K2,则K1与K2得大小关系就是( )A.K1<K2ﻩB.K1=K2ﻩC.K1〉K2D。
无法确定2.在300 mL得密闭容器中,放入镍粉并充入一定量得CO气体,一定条件下发生反应:Ni(s)+4CO(g)⇌Ni(CO)4(g),已知该反应平衡常数与温度得关系如下表:下列说法不正确得就是( )A.上述生成Ni(CO)4(g)得反应为放热反应B。
在25 ℃时,反应Ni(CO)4(g)⇌Ni(s)+4CO(g)得平衡常数为2×10-5C.在80 ℃时,测得某时刻,Ni(CO)4、CO浓度均为0、5 mol·L-1,则此时v正>v逆D.在80 ℃达到平衡时,测得n(CO)=0、3 mol,则Ni(CO)4得平衡浓度为2 mol·L-13.在一定温度下,改变反应物中n(SO2),对反应2SO2(g)+O2(g)⇌2SO3(g) ΔH<0得影响如图所示,下列说法正确得就是()A。
反应b、c点均为平衡点,a点未达到平衡且向正反应方向进行B.a、b、c三点得平衡常数Kb>K c〉K aC.上述图象可以得出SO2得含量越高得到得混合气体中SO3得体积分数越高D.a、b、c三点中,a点时SO2得转化率最高4。
下列关于化学平衡常数得说法中,正确得就是()A。
可以用化学平衡常数来定量描述化学反应得限度B.在平衡常数表达式中,反应物浓度用起始浓度表示,生产物浓度用平衡浓度表示C.平衡常数得大小与浓度、压强、催化剂有关D.化学平衡发生移动,平衡常数必定发生变化5.在一定温度下,向2L体积固定得密闭容器中加入1molHI,发生反应:2HI(g)⇌H2(g)+I2(g) ∆H>0,测得得物质得量随时间变化如表,下列说法正确得就是()1 2 3A。
平衡常数计算答案

化学平衡常数和化学平衡计算答案时间:45分钟 分值:100分一、选择题(每小题4分,共48分)1.答案:A 2.答案:D 3.答案:A4.解析:由于C 、D 的计量数未知,则A 、B 的平衡浓度无法求得,但由已知条件可以求得C 、D 转化量之比为2:1,所以x :y =2:1。
答案:D5.解析:因为平衡时,n (A)平=0.3mol·L -1×2L =0.6mol ,n (B)平=0.2mol·L -1×2L =0.4mol ,n (C)平=0.05mol·L -1×2L =0.1mol ,所以n (B)转=2n (C)平=0.2mol ,n (B)=n (B)平+n (B)转=0.6mol ,n (A)转=12n (B)=0.3mol ,n (A)=n (A)平+n (A)转=0.9mol 。
答案:C6.解析:c (SO 2)=0.1mol·L -1为SO 2的平衡量也是转化量,v (SO 2)=0.01mol·L -1·min -1,v (O 2)=12v (SO 2)=0.005mol·L -1·min -1,c (SO 3)转=c (SO 2)=0.1mol·L -1,c (SO 3)平=0.4mol·L -1,c (SO 3)始=0.4mol·L -1+0.1mol·L -1=0.5mol·L -1,α(SO 3)=0.1 mol·L -10.5 mol·L -1×100%=20%,c (SO 3)始即为Ag 2SO 4分解最初生成的SO 3量。
答案:A 7.解析:A 中若v (Z)=0.02mol·(L·min)-1,则2min 内Z 的浓度增加0.04mol·L -1,由起始时Z 的浓度不为0,因此A 错;B 项符合平衡时正、逆反应速率相等及反应速率之比与计量数之间的关系;由于X 、Y 的变化量之比为1:3,平衡时X 、Y 的浓度之比为1:3,因此C 、D 正确。
化学平衡常数及计算练习(附答案)

化学平衡常数练习一、单选题1.在一密闭容器中,反应aX(g)+bY(g)cZ(g)达到平衡时平衡常数为K1;在温度不变的条件下向容器中通入一定量的X和Y气体,达到新的平衡后Z的浓度为原来的1。
2倍,平衡常数为K2,则K1与K2的大小关系是( )A.K1〈K2B.K1=K2C.K1〉K2D.无法确定2.在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)⇌Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表:温度/℃25 80 230平衡常数5×104 2 1。
9×10-5下列说法不正确的是()A.上述生成Ni(CO)4(g)的反应为放热反应B.在25 ℃时,反应Ni(CO)4(g)⇌Ni(s)+4CO(g)的平衡常数为2×10-5C.在80 ℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5 mol·L-1,则此时v正〉v逆D.在80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol·L-13.在一定温度下,改变反应物中n(SO2),对反应2SO2(g)+O2(g)⇌2SO3(g)ΔH〈0的影响如图所示,下列说法正确的是( )A.反应b、c点均为平衡点,a点未达到平衡且向正反应方向进行B.a、b、c三点的平衡常数K b>K c〉K aC.上述图象可以得出SO2的含量越高得到的混合气体中SO3的体积分数越高D.a、b、c三点中,a点时SO2的转化率最高4.下列关于化学平衡常数的说法中,正确的是()A.可以用化学平衡常数来定量描述化学反应的限度B.在平衡常数表达式中,反应物浓度用起始浓度表示,生产物浓度用平衡浓度表示C.平衡常数的大小与浓度、压强、催化剂有关D.化学平衡发生移动,平衡常数必定发生变化5.在一定温度下,向2L体积固定的密闭容器中加入1molHI,发生反应:2HI(g)⇌H2(g)+I2(g) ∆H〉0,测得2H的物质的量随时间变化如表,下列说法正确的是( )t/min 1 2 3()n H/mol0.060.10.1 2A .2 min 内的HI 的分解速度为0.0511mol L min --⋅⋅B .该温度下,平衡时HI 的转化率为10%C .该温度下的平衡常数为1K ,温度升高10℃后平衡常数为2K ,则K 1〉K 2D .达平衡后其他条件不变,压缩容器体积,平衡不移动,()c HI 不变6.关于 C (s )+H 2O (g )CO(g )+H 2(g )的平衡常数(K )书写形式,正确的是( )A .K=22c(C)c()c(CO)c O (H H )B .K=22c(CO)c()c(C)c(H H O)C .K=22c(CO)c()c(H H O)D .K=22c()c(C O O)c(H H )7.吸热反应N 2(g )+O 2(g )2NO(g),在2000℃时,K =6。
高考化学热点:化学平衡常数及平衡转化率的计算
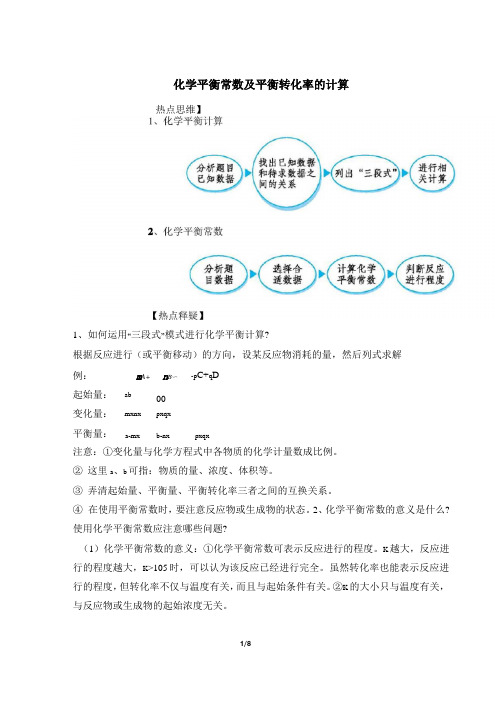
化学平衡常数及平衡转化率的计算热点思维】1、如何运用“三段式”模式进行化学平衡计算?根据反应进行(或平衡移动)的方向,设某反应物消耗的量,然后列式求解例:m A+n B〜-p C+q D起始量:ab00变化量:mxnx pxqx平衡量:a-mx b-nx pxqx注意:①变化量与化学方程式中各物质的化学计量数成比例。
②这里a、b可指:物质的量、浓度、体积等。
③弄清起始量、平衡量、平衡转化率三者之间的互换关系。
④在使用平衡常数时,要注意反应物或生成物的状态。
2、化学平衡常数的意义是什么?使用化学平衡常数应注意哪些问题?(1)化学平衡常数的意义:①化学平衡常数可表示反应进行的程度。
K越大,反应进行的程度越大,K>105时,可以认为该反应已经进行完全。
虽然转化率也能表示反应进行的程度,但转化率不仅与温度有关,而且与起始条件有关。
②K的大小只与温度有关,与反应物或生成物的起始浓度无关。
(2)在使用化学平衡常数时应注意:①不要把反应体系中纯固体、纯液体以及稀溶液中水的浓度写进平衡常数表达式中,但非水溶液中,若有水参加或生成,则此时水的浓度不可视为常数,应写进平衡常数表达式中。
②同一化学反应,化学反应方程式写法不同,其平衡常数表达式及数值亦不同。
因此书写平衡常数表达式及数值时,要与化学反应方程式相对应,否则就没有意义。
【热点考题】【典例】【2014年高考四川卷第7题】在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)=M(g)+N(g),所得实验数据如下表:下列说法正确的是A.实验①中,若5min时测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速率u(N)1.0x10」2mol/(L・min)B.实验②中,该反应的平衡常数K=2.0C.实验③中,达到平衡是,X的转化率为60%D.实验④中,达到平衡时,b>0.060【答案】C【解析】取冥验①中,若血in时测得n(M)=0.050mol;浓度是0.0050mol/L^贝H根据反应的化学方程式可知,同时主成的N的物质的量也是O.OOBOmol/L,因此0至血山时间内,用M 表示的平均反应辭U(N)=0.0050mol/L-r-5min=l.OX10_3mol/(L■min);A不正确;E、实验②中,平衡时M的浓度是0.OOSOmol/L;则同时生成的N的浓度是0.OOSOmol/L,'消耗X与Y的浓度均是0.0080moL/L,因此平衡时蓝和Y的浓度分别为0.01mol/L-0.0080jnoL/L=0.002jnoL/L,0.04mol/L-0.0080mol/L=0.032mol/L,因此反应的平衡常数^To02X0.032°=b B 不正确'亡、根据反应的化学方程式可灿如果X的转化率为旳虬则X(g)+Y(g)亍二M(g)+N(g)转化浓度(mol/L)0.0120.0120.0120.012为砂緞C 正确;70013时X(g)++N(g)起始液度(mol/L)0.040 0.010 0 转化液度(mol/ll)0.009 0.009 0.009 平衡浓度(mol/L)0.031 0.0010.0090 0.009 0.0090.009x0.0090.031x0.001 =2.9>1,这说明升高温度平衡常数减小,温度不变,平衡常数不变,则在;:鶯;囂=1,即反应达到平衡状态,因此最终平衡时蓝的转化率即平衡向逆反应方向移动,因此正方应是放热反应。
多重平衡中平衡常数计算

高考热点专题多重平衡中平衡常数计算一、连续反应真题演练1.【2008 年宁夏】将固体 N H 4I 置于密闭容器中,在一定温度下发生下列反应:①NH 4I(s)NH 3(g)+HI(g) ②2HI(g)H 2(g)+I 2(g)达到平衡时,c (H 2)=0.5mol·L -1,c (HI)=4mol·L -1,则此温度下反应① 的平衡常数为( ) A .9 B .16 C .20 D .25【答案】:C2.【2018新课标1卷】采用N 2O 5为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用。
回答下列问题:F .Daniels 等曾利用测压法在刚性反应器中研究了25℃时N 2O 5(g)分解反应:其中NO 2二聚为N 2O 4的反应可以迅速达到平衡。
体系的总压强p 随时间t 的变化如下表所示(t =∞时,N 2O 5(g)完全分解):①已知:2N 2O 5(g)=2N 2O 4(g)+O 2(g) ΔH 1=−4.4 kJ·mol −1 2NO 2(g)N 2O 4(g) ΔH 2=−55.3 kJ·mol −1则反应N 2O 5(g)=2NO 2(g)+12O 2(g)的ΔH =_______ kJ·mol −1。
②研究表明,N 2O 5(g)分解的反应速率()2531210?min N O p kPa υ--=⨯⨯。
t =62 min 时,测得体系中pO 2=2.9 kPa ,则此时的25N O p =________kPa ,v =_______kPa·min −1。
③若提高反应温度至35℃,则N 2O 5(g)完全分解后体系压强p ∞(35℃)____63.1 kPa (填“大于”“等于”或“小于”),原因是________。
④25℃时N 2O 4(g)2NO 2(g)反应的平衡常数K p =_______kPa (K p 为以分压表示的平衡常数,计算结果保留1位小数)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3月18日课后作业答案
1、4y 3/(x-y)2解析
反应前,三种溶液混合后,Na 3AsO 3的浓度为3xmol/L×(20÷(20+20+20))=xmol/L ,
同理I 2的浓度为xmol/L ,反应达到平衡时,生产c(AsO 43﹣
)为ymol/L ,则反应生产的c(I ﹣
)=2ymol/L ,消耗的AsO 33﹣
、I 2的浓度均为ymol/L ,平衡时c c(AsO 33﹣
)=(x ﹣y)mol/L ,c(I 2)
=(x ﹣y)mol/L ,溶液中c(OH ﹣
)=1mol/L ,则K=y ×(2y)2/[(x-y)×(x-y)12]=4y 3/(x-y)2也可以根据三段式进行求解。
2、8045kPa 3、(1)225(2)<
>
解析
(1)到达平衡时,c (NO 2)=0.02mol·L -
1,c (N 2O 4)=0.09mol·L -
1,K =
0.09
0.022
=225。
(2)甲为绝热容器,乙为恒温容器,该反应为放热反应,则到达平衡时甲的温度高于乙,故K 甲<K 乙,甲中反应正向进行的程度小于乙,气体总体积大于乙,故p 甲>p 乙。
4、(1)
k 正
k 逆(2)2
120
解析
(1)可逆反应达到平衡状态时,v 正=v 逆,由于v 正=k 正·c (Mb)·p (O 2),v 逆=k 逆·c (MbO 2),
所以k 正·c (Mb)·p (O 2)=k 逆·c (MbO 2),k 正k 逆=c (MbO 2)
c (Mb )·p (O 2),而反应Mb(aq)+O 2(g)
MbO 2(aq)
的平衡常数K =
c (MbO 2)
c (Mb )·p (O 2)=k 正k 逆。
(2)将c 点时,p (O 2)=4.5kPa ,肌红蛋白的结合度(α)是90%带入平衡常数表达式中可得K =c (MbO 2)c (Mb )·p (O 2)=0.9(1-0.9)×4.5=2;K =k 正k 逆,由于K =2,k 逆=60s -
1代入该式子,可得k 正=K ·
k 逆=2×60s -1·kPa -1=120s -1·kPa -1。
5、0.59
解析曲线Ⅱ中水碳比为1,初始时CO 2浓度为1mol·L -
1,则c (H 2O)=1mol·L -
1,氨碳比为
4时,CO 2的转化率为63%,c (NH 3)=4mol·L -
1,
2NH 3(g)+CO 2(g)
CO(NH 2)2(l)+H 2O(g),
起始(mol·L -
1):
411
变化(mol·L -
1):
1.260.630.63
平衡(mol·L -
1):
2.740.37 1.63
平衡常数K =c (H 2O )c 2(NH 3)·c (CO 2)= 1.632.742×0.37
≈0.59。
6、(1)(2a +2b +c )kJ·mol -1(2)①1050K 前反应未达到平衡状态,随着温度升高,反应速率加快,NO 转化率增大20%
②4
(3)A
(4)①<
②0.25
解析
(1)利用盖斯定律,将①×2+②×2+③可得2SO 2(g)+4NH 3·H 2O(aq)+
O 2(g)===2(NH 4)2SO 4(aq)+2H 2O(l)的ΔH =(2a +2b +c )kJ·mol -
1。
(2)
①在1050K 前反应未达到平衡状态,随着温度升高,
反应速率加快,NO 转化率增大;达到平衡后,升高温度,平衡左移,NO 的转化率降低。
根据反应C(s)+2NO(g)
N 2(g)+CO 2(g),假设加入1mol NO ,在1100K 时,NO 的转化
率为40%,则Δn (NO)=0.4mol ,故n (CO 2)=0.2mol ,由于反应前后气体的总物质的量不变,故混合气体中CO 2的体积分数为
0.2mol
1mol
×100%=20%。
②根据反应C(s)+2NO(g)N 2(g)
+CO 2(g),假设加入1mol NO ,在1050K 时,α(NO)=80%,平衡时n (NO)=0.2mol ,n (N 2)=0.4mol ,n (CO 2)=0.4mol ,各物质的平衡分压p 分(NO)=0.2mol
1mol
×1.1×106Pa ,p 分(N 2)=0.4mol
1mol
×1.1×106Pa ,p 分
(CO 2)=
0.4mol
1mol
×1.1×106Pa ,故反应的化学平衡常数K p =0.4mol 1mol ×1.1×106×0.4mol 1mol ×1.1×106÷(0.2mol
1mol
×1.1×106)2=4。
(3)A 反应速率快,先达到平衡,故活化能最小。
(4)①正反应为放热反应,升高温度平衡左移,则正反应速率增大的倍数小于逆反应速率增大的倍数,故k 正增大的倍数小于k 逆增大的倍数。
②当反应达到平衡时,v 正=v 逆,故k 正k 逆=c (N 2)·c 2(CO 2)c 2(NO )·c 2(CO )=K ,根据化学方程式可知,
平衡时c (NO)=c (CO)=0.6mol·L
-1
,c (N 2)=0.2mol·L
-1
,c (CO 2)=0.4mol·L
-1
,故
k 正
k 逆
=c (N 2)·c 2(CO 2)c 2(NO )·c 2(CO )=0.2×0.420.62×0.62=20
81
≈0.25。
7、(1)0.03(2)363(3)
k 正
k 逆
>解析(1)从0~2s 内该反应的平均速率v (NO)=0.20mol -0.08mol
2L 2s
=0.03mol·L -1·s -
1。
(2)
2NO(g)+O 2(g)2NO 2(g)n (始)/mol 0.200.100Δn /mol 0.140.070.14n (平)/mol
0.06
0.03
0.14
所以根据化学平衡常数的定义可得K =(
0.142)
2
(0.062)2×0.032
≈363。
(3)v 正=v (NO)消耗=2v (O 2)消耗=k 正c 2(NO)·c (O 2),v 逆=v (NO 2)
消耗
=k 逆c 2(NO 2),可逆反应达到
化学平衡时,同一物质表示的v 正=v 逆,不同物质表示的正逆反应速率之比等于化学计量数之比,所以k 正c 2
(NO)·c (O 2)=k 逆c 2
(NO 2),则c 2(NO 2)
c 2(NO )·c (O 2)=k 正k 逆
=K ;若将容器的温度改变为
T 2时其k 正=k 逆,则由于K =
k 正
k 逆
=1<363,说明平衡逆向移动,根据温度对化学平衡移动的影响,升高温度,化学平衡向吸热的逆反应方向移动,所以T 2>T 1。
8、K p=20×180/(802×7.85MPa)=0.07MPa -1
9、
解析
10、解析
也可以尝试三段式计算。
11、1212、8.5解析
设N 2O 5的转化浓度为x ,N 2O 3的转化浓度为y 。
N 2O 5(g)
N 2O 3(g)+O 2(g)开始/mol·L -1400转化/mol·L
-1
x x x 平衡/mol·L -1
4-x x
x
N 2O 3(g)
N 2O(g)+O 2(g)开始/mol·L -1x 0x 转化/mol·L -1y y y 平衡/mol·L
-1
x -y
y
x +
y
mol/L
mol/L
+y=4.5mol·L-1
-y=1.7mol·L-1
所以x=3.1mol·L-1
y=1.4mol·L-1
所以反应①的平衡常数为:
K=c(O2)·c(N2O3)
c(N2O5)=
4.5×1.7
4-3.1=8.5。
