化工工艺学章硫酸和硝酸
硫酸制备硝酸方程式

硫酸制备硝酸方程式
全文共四篇示例,供读者参考
第一篇示例:
硫酸(化学式H2SO4)和硝酸(化学式HNO3)都是常见的化学试剂,广泛用于实验室和工业生产中。硝酸与硫酸之间可以通过化学反应相互转化,其中硫酸可以被用来制备硝酸。下面将详细介绍硫酸制备硝酸的方程式及相关反应过程。
硫酸制备硝酸的反应方程式为:
H2SO4 + HNO3 → H2O + NO2 + SO2 + O2
在这个反应中,硫酸(H2SO4)和硝酸(HNO3)发生反应,生成水(H2O)、一氧化氮(NO2)、二氧化硫(SO2)和氧气(O2)。这是一个复杂的反应过程,需要在适当的条件下进行。
硫酸制备硝酸的具体步骤如下:
在实验室中准备硝酸,可以采用硫酸与硝基盐反应生成的方法。将硝基盐(如硝酸铁)与硫酸混合,加热反应,会生成气体和混合酸。
通过升华、干燥、结晶等步骤,将混合酸制备成为纯净的硝酸。硝酸是无色透明的液体,具有刺激性气味,可溶于水。硝酸在工业上广泛应用于合成化工原料、制造炸药、肥料和金属表面处理等领域。
然后,通过将硫酸与制备好的硝酸混合,在适当的条件下进行反
应制备硝酸。在硫酸的存在下,硝酸会发生分解反应,生成氧气和一
氧化氮等气体产物。这个反应是一个放热反应,需要控制反应条件以
确保反应可以进行顺利。
通过适当的分离、提纯等步骤,可以获得纯净的硝酸产品。硝酸
是一种强氧化剂,具有很强的腐蚀性和毒性,需要在实验室和工业中
谨慎使用。
硫酸制备硝酸的过程需要掌握一定的化学知识和实验技巧,确保
实验安全和产品质量。熟悉硫酸和硝酸的性质和用途,可以更好地理
化工工艺学(本科)习题

1. 合成氨
1什么是间歇制气法?
2以煤为原料的半水煤气制备过程中,大多采用间歇法制气的原因是什么?如何才能使生产连续化?答:半水煤气中(CO+H2)/N2为3.1—3.2,由反应过程可以看出,以空气为气化剂时,可得含N2的吹风气,以水蒸汽为气化剂时,可得含H2的吹风气。从气化系统的热平衡看,碳和空气反应是放热的,碳和水蒸气反应是吸热的,如果外界不提供热源,而是通过前者的反应热为后者提供反应所需的热,并能维持系统自热平衡的话,是不可能获得合格组成的半水煤气,反之,欲获得合格组成的半水煤气,该系统就不能维持系统的自热平衡。为了解决供热和制备合格半水煤气这一矛盾,采用间歇制气法。采用富氧空气(或纯氧)气化法和外热发能使生产连续化。
3间歇式制取半水煤气一个工作循环要分为几个阶段?各阶段的作用及时间分配的原则是什么?
答:①吹风阶段,煤气发生炉底部吹入空气,作用是提高燃料层的温度,吹风气放空②上吹制气阶段,水蒸气由炉底送入,经灰渣层预热,进入气化层进行气化。
4气态烃蒸汽转化为什么要采用两段法?是如何操作的?
5在天然气蒸汽转化系统中,水碳比从3.5~4.0降至2.5,试分析一段炉可能出现的问题及其解决办法.答:水碳比下降,一段转化炉出口气残余甲烷含量将不能达到所需要求的10%,解决方法是需要提高出炉气体温度,但不要太高,需视转化压力的不同而有所区别,转化压力低,出口温度可稍低,转化压力高,出口温度宜稍高,相应可采用较大的空速。
6试分析烃类蒸汽转化过程中加压的原因和确定操作温度的依据。
答:1)①节约动力消耗②提高过量蒸汽的热回收价值③减小设备容积,降低投资费用。
第三章硫酸与硝酸

化工工艺学
42
化工及物化教研室
斜管沉降器 化工及物化教研室
43
化工工艺学
两塔一器两电稀酸流程
44
化工及物化教研室
属硫酸盐。
硫酸与氨及其水溶液反应,生成硫酸氨。
硫酸与其它酸类盐反应,生成较弱和较 易挥发的酸。 硫酸与水的强烈反应。
在有机合成工业中,硫酸常用作磺化剂。
化工工艺学
6
化工及物化教研室
(三)硫酸的用途
石油精练
炸药制造 印染、漂白 洗涤剂 化学肥料
硫
人造纤维
酸
淀粉生产 蓄电池
塑料、橡胶
7
化工及物化教研室
(1)氧化焙烧:常规焙烧 (2)磁性焙烧:控制弱氧化性气氛焙烧,使绝大部分
烧渣为四氧化三铁。
(3)硫酸化焙烧:综合利用硫铁矿伴生的有色金属。
氧过量150%~200%,生成较多三氧化硫,使金属 氧化物生成金属硫酸盐。
(4)脱砷焙烧:两段焙烧法
化工工艺学
22
化工及物化教研室
几种焙烧方法工艺条件
酸出口
知识讲解_硫酸和硝酸(提高)

硫酸和硝酸
【学习目标】
1.以稀硫酸、硝酸为例复习酸的通性;
2.理解浓硫酸的吸水性、脱水性以及氧化性等三大特性;
3.理解硝酸的强氧化性及硫酸和硝酸的用途。
重点:浓硫酸、硝酸的化学性质
难点:浓硫酸和硝酸的氧化性
【要点梳理】
要点一、稀硫酸
要点诠释:
稀硫酸中存在着电离方程式:H2SO4=2H+ +SO42-,由于硫酸是强电解质,在水中完全电离,所以在稀硫酸中存在的微粒是H+、SO42-和H2O。浓硫酸(质量分数为98%)中,几乎不含水,所以在浓硫酸中几乎不存在硫酸的电离,也就几乎不存在H+和SO42-离子,几乎全以硫酸分子形式存在。所以如果说稀硫酸体现的是H+的性质(只要是酸都能电离出氢离子,所以稀硫酸体现的是酸的通性。),那么浓硫酸则体现出硫酸分子的性质,也就是具有特性。
稀硫酸具有酸的通性:
(1)指示剂变色:石蕊变红;酚酞不变色。
(2)与金属反应:Fe+H2SO4==FeSO4+H2↑;2Al + 3H2SO4 ==Al2(SO4)3 + 3H2↑
(3)与碱的反应:2NaOH+H2SO4==Na2SO4+2H2O
(4)与碱性氧化物反应:CuO +H2SO4 == CuSO4 +H2O
(5)与某些盐的反应:BaCl2+H2SO4==BaSO4↓+ 2HCl
要点二、浓硫酸
【高清课堂:硫酸和硝酸ID:395524#浓硫酸】
(一)物理性质
(1)纯硫酸:无色、粘稠的油状液体、难挥发
(2)98%的浓硫酸的密度为1.84g/cm3
(3)沸点高:沸点338℃,高沸点酸能用于制备低沸点酸
(4)硫酸与水任意比例混溶;
浓硫酸和硝酸PPT课件

2021
(2)氧化性: ①与金属反应(除Au和Pt外) 现象:浓硝酸与铜常温下即能反应,生成红棕色气 体和蓝色溶液。 稀硝酸与铜反应,生成无色气体和蓝色溶液;生成 的气体与空气接触后,变为红棕色气体。
2021
反应原理: 4HNO3(浓)+Cu ═ Cu(NO3)2+2NO2↑+2H2O
2021
Leabharlann Baidu
一、浓硫酸
1、物理性质: 色态:无色、粘稠的油状液体(常用浓硫酸质量分数为98.3%)。 沸点:约338℃——难挥发酸(高沸点酸) 密度:质量分数为98.3%的硫酸1.84g·cm-3——高密度酸 溶解性:易溶于水,跟水任意比互溶,溶解放出大量热。
【复习思考】浓硫酸应如何稀释?
2021
思考·交流 如何稀释浓硫酸?
8HNO3(稀)+3Cu ═ 3Cu(NO3)2+2NO↑+4H2O
分析上述反应中电子转移的方向和数目,并指出氧化
剂和还原剂。 反应规律:金属
浓硝酸 稀硝酸
高价金属 + NO2↑ 高价金属 + NO↑
2021
【思考】一定量的浓硝酸里加入过量铜会发生哪些变化? ①一开始是铜与浓硝酸反应: Cu+4HNO3(浓) ═ Cu(NO3)2+2NO2↑+2H2O ②随着反应进行, 硝酸由浓变稀,则发生:
硫酸和硝酸的性质比较

硫酸和硝酸的性质比较
硫酸和硝酸都是常见的无机酸,它们在实验室和工业中具有广泛的
应用。本文将对硫酸和硝酸的性质进行比较,并探讨它们在不同领域
的应用。
1. 硫酸的性质
硫酸(化学式H2SO4)是一种无色至淡黄色的高度腐蚀性液体。以下是硫酸的一些主要性质:
1.1 酸性:硫酸是一种强酸,具有强烈的腐蚀性,可以与碱反应生
成盐和水,并释放出大量的热量。
1.2 溶解性:硫酸可以溶解许多物质,包括金属、碱和盐类等。
1.3 脱水性:硫酸具有很强的脱水性,能够从许多物质中除去水分,导致物质的浓缩和干燥。
1.4 氧化性:硫酸具有一定的氧化性,它可以被还原剂还原为二氧
化硫(SO2)或硫(S)。
2. 硝酸的性质
硝酸(化学式HNO3)是一种无色至微黄色的液体,也是一种强酸。下面是硝酸的主要性质:
2.1 酸性:硝酸是一种强酸,它可以与碱反应生成相应的盐和水。
和硫酸一样,硝酸也具有强烈的腐蚀性。
2.2 氧化性:硝酸是一种强氧化剂,它能够氧化许多物质,包括金属、非金属和有机物等。
2.3 反应活性:硝酸能够与许多物质发生剧烈的反应,特别是和有机物混合反应时,常常会发生爆炸。
3. 硫酸和硝酸的应用
硫酸和硝酸由于其特殊的性质,在许多领域都有重要的应用。
3.1 工业应用:硫酸和硝酸广泛用于化肥、冶金、石油加工、纺织和制药等工业领域。它们可以被用作原料、反应媒介或者酸洗剂等。
3.2 实验室应用:硫酸和硝酸是实验室中常用的化学试剂,用于调节酸碱平衡、分离化合物和进行化学反应等。
3.3 农业应用:硫酸和硝酸也常用于农业领域,用于土壤酸碱度调节和植物营养补充。
配制混酸(硝酸加硫酸)的工艺流程·

配制混酸(硝酸加硫酸)的工艺流程
工艺概述
混酸是一种含有硝酸和硫酸的混合酸,常用于各种工业生
产过程中。本文将介绍配制混酸的工艺流程,包括原料准备、酸液配制、混合、贮存等步骤。
原料准备
1.硝酸(Nitric Acid):纯度不低于98%,数量根据生
产需求确定。
2.硫酸(Sulfuric Acid):纯度不低于98%,数量根据生
产需求确定。
酸液配制
1.将一定量的硝酸倒入酸液配制槽中。
2.将相应的硫酸缓慢加入酸液配制槽中,并同时搅拌。
3.继续缓慢添加硫酸,直至达到所需的混酸浓度。
4.搅拌酸液,使其均匀混合。
酸液混合
1.确保混酸配制槽的清洁和干燥。
2.将酸液配制槽中的混酸倒入混酸贮存容器中。
3.使用搅拌器轻轻搅拌混酸,使其充分混合。
贮存
1.将混酸贮存容器密封,以防止酸液挥发。
2.将贮存容器放置在室内,远离明火和易燃材料。
3.根据安全要求,将混酸贮存容器放置在酸液储存区域。
安全注意事项
1.在配制和混合酸液时,需佩戴防护眼镜、乳胶手套等个人防护用品。
2.酸液配制和混合的操作应在通风良好的环境下进行,
以避免有害气体的溢出。
3.避免酸液接触皮肤、眼睛和衣物,如不慎接触,立
即用大量清水冲洗,并寻求医生的帮助。
4.混酸贮存容器务必紧闭,防止酸液挥发和泄漏。
结论
通过以上工艺流程,我们可以成功配制出混酸(硝酸加硫酸)。在进行酸液配制和混合操作时,务必注意安全事项,并妥善贮存混酸,以确保工作场所的安全和人员健康。
3化工工艺学-第三章硫酸与硝酸.ppt
不足之处:炉尘量大,炉尘占总烧渣的60~70%。除尘 净化系统负荷大。需将硫铁矿粉碎至较小粒度,需高压鼓风 机,动力消耗大。
《化工工艺学》第3源自文库 硫酸与硝酸
如果氧气(O2)过剩,还发生下列反应:
A 2 O s 3O 2A 2 O 5(ss) A2O s5F 2O 3 e2Fe4 A (s)sO
所以脱砷焙烧要求低O2高SO2。通常采用二段焙烧流程, 一段主要脱砷,二段主要烧尽硫铁矿。一段焙烧温度控制为 900℃,一段炉气SO2含量约20%;渣再进入二段焙烧,二段 温度为800℃,出二段炉气SO2含量约10%。
焙烧炉气除尘后,其中的砷、硒氧化物及氟化物可使SO2转 化催化剂中毒并腐蚀管道,需要除去。SO2微溶于水,可水洗涤 净化。但少量SO3会形成酸雾,所以还需用电除尘方法除去酸雾。 水洗流程排污量大,污水处理困难,已被淘汰。典型酸洗如三 塔二电净化流程如下图。
《化工工艺学》第3章 硫酸与硝酸
3.1.3.1 炉气的净化
二者的在水中饱和蒸汽压随温度下降显著降低。温度降到 50℃以下气相中含量已经很少。洗涤形成的固体颗粒,浮在气 体中是形成酸雾的凝聚中心,必须除雾器可以将其除去。
《化工工艺学》第3章 硫酸与硝酸
化工工艺学3章
• nSO3(g) + H2O(l) = H2SO4(aq) + (n-1)SO3(aq) • n>1时生成发烟硫酸, n=1时生成无水硫酸, n<1时生成含水硫酸。
• 3.1.5.1 发烟硫酸吸收过程的原理和影响因素
2 酸雾的形成和清除
• 酸雾的形成
• 炉气中少量三氧化硫要与水反应生成硫酸,温度较低时,炉气中
大多数三氧化硫都转化成硫酸蒸汽。当气相中硫酸蒸汽压大于其
饱和蒸汽压时,硫酸蒸汽就会冷凝。实际情况是,洗涤过程中降
温速度很快,气相中硫酸分压迅速增加,很快就可达到饱和。其
过饱和度定义为
S
pH 2 SO4
/
3.1.5.4 生产浓硫酸的吸收流程
• 一种普遍采用的一次吸收流程如 图3.26。
• 转化气从塔底送入,浓硫酸从塔 顶喷淋。进塔气温度140~160°C, 喷淋酸温控制在50°C以下,出塔 酸温用喷淋量控制,使出塔酸温 <70°C。
• 吸收酸同样要冷却和稀释后循环。
图 3.26
3.1.6 三废治理与综合利用 Father and integrated utilization of
• 用发烟硫酸吸收SO3的过程为物理过程,吸收速率主要取决于推动 力p(pSO3- p*SO3 )。
硝酸和硫酸反应方程式

硝酸和硫酸反应方程式
硝酸和硫酸是化学中常见的酸性物质,它们之间的反应方程式如下:
HNO3 + H2SO4 → NO2+ + H3O+ + HSO4-
在这个反应中,硝酸和硫酸发生了反应,产生了亚硝酸离子(NO2+)、氢离子(H3O+)和氢氧化根离子(HSO4-)。这个反应是一个强酸和弱酸的反应,其中硝酸是强酸,硫酸是较弱的酸。
此外,硝酸和硫酸的反应也可以产生亚硝酸和二氧化氮:
HNO3 + H2SO4 → NO + NO2 + H2O + HSO4-
这个反应中,硝酸与硫酸反应,产生了亚硝酸(NO)和二氧化氮(NO2),以及水和氢氧化根离子(HSO4-)。
这些反应方程式可以在实验室中进行,并广泛用于化学生产、研究和分析中。
- 1 -
硫酸硝酸

①与金属(除Au、Pt外)反应: Cu+4HNO3(浓) Cu(NO3)2+2NO2↑+2H2O
Cu+4H++2NO3
3Cu+8HNO3(稀)
Cu2++2NO2 +2H2O
3Cu(NO3)2+2NO↑+4H2O
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
HNO3的作用: 酸性、强氧化性
思考:浓硫酸的稀释? 稀释浓硫酸的时候,要把浓硫酸沿着器
壁 慢慢地 注入水里,并不断搅拌。
一.硫酸----浓硫酸的性质
1.物理性质: (1)色态:无色、粘稠的油状液体 (2)密度:质量分数为98.3%的浓硫酸的 密度是 1.84克/立方厘米,物质的量浓度是18.4mol/L (3)沸点:质量分数为98.3%的浓硫酸的沸点是 338°C(高沸点酸) (4)溶解度:易溶于水,跟水以任意比互溶。
浓硫酸表现强氧化性、酸性
△
铜与浓硫酸.td
b)在常温下,使铝、铁等金属钝化。 钝化是因为形成了致密、坚固的氧化物薄膜, 应用:常温下,用Fe、Al制容器来盛装浓硫酸。
注意:浓硫酸与金属反应时,产生的是相应的硫酸盐 (高价)、二氧化硫和水;与非金属反应时,产物是 该非金属的最高价氧化物(或酸)、二氧化硫、和水。
硝酸硫酸的沸点

硝酸硫酸的沸点
硝酸和硫酸是大多数工业化学品中广泛使用的化学品,它们有着
很高的沸点,这使得它们在蒸馏和其他加热过程中有着很广泛的应用。
首先,我们来了解一下硝酸和硫酸的沸点。硝酸的沸点为83℃,比水的沸点要高得多,而硫酸的沸点为338℃,是大多数化学物质中沸点最高之一。这些高沸点的化学品使用时需要特别小心,在操作过程
中需要遵循特殊的措施,以保证安全。
接下来,我们来了解一些影响硝酸和硫酸沸点的因素。
第一个因素是压力。在大气压下,硝酸和硫酸的沸点分别为83℃和338℃。如果在较低的压力下加热硝酸和硫酸,它们的沸点将会下降。
第二个因素是纯度。纯度较高的硝酸和硫酸,沸点也就越高。这
是因为杂质会降低物质的热稳定性,从而降低沸点。纯度高、杂质少
的硝酸和硫酸在加热时更加稳定,沸点也就越高。
第三个因素是环境温度。在温度较高的环境下,硝酸和硫酸的沸
点也会相应地增加。
为了确保安全,使用硝酸和硫酸时需要遵循一些基本规则。首先,操作人员必须穿戴适当的防护装备,如手套、防护镜、呼吸器等。工
作场所必须保持良好的通风状况,以避免助长马上的形成和危险物质
浓度的积累。在加热硝酸和硫酸之前,需要先对设备进行检查,并确
保设备的可靠性和安全性。在加热硝酸和硫酸时必须格外小心,要避
免使用明火,最好使用加热油浴等加热手段。在所有情况下,必须谨
慎地处理硝酸和硫酸,以避免可能出现的危险情况。
总之,硝酸和硫酸是高沸点化学品,它们在许多行业中都有着广
泛的应用。在使用这些化学品时,必须要遵循安全规程,并遵循加热
过程中的特别小心的措施。只有这样,我们才能安全地利用硝酸和硫
化工工艺学--教学大纲

化工工艺学--教学大纲
《化工工艺学》课程教学大纲
一、编写说明
(一)本课程的性质、地位和作用
“化工工艺学”是化学工程与工艺专业的专业必修课。该课程主要介绍无机化工工艺,包括
合成氨、硫酸、硝酸、纯碱、烧碱的生产基本原理、工艺过程以及与过程涉及的设备等。该课程从化工生产的工艺角度出发,介绍典型产品的生产方法、工艺原理、流程、关键设备、工艺条件与节能降耗分析等,运用化工过程的基本原理,阐明化工工艺的基本概念和基本理论。其任务是使学生综合运用所学到的知识,掌握化工工艺的分析和流程组织的一般规律,认识化学加工工业的共性特征,培养综合应用相关基础科学知识处理化学工业实际问题的能力。目的是让学生初步掌握有效地组织工艺流程的方法, 科学地确定系统操作
条件,以实现工艺系统高效平稳运转,达到较优的技术经济目标。同时能够了解学科发展趋势,增强科学研究与技术开发的能力。在此基础上学生可选修其它更有专门特色的课程,如精细化工、煤化工、石油化工、材料化工等。
(二)教学基本要求
该课程内容包括典型无机化工产品的工艺实例,涵盖了原料的处理和准备、反应过程和工艺参数确定、反应器选择、产物的分离过程和产品后加工等内容。。本课程在教学上突出对工艺过程总体的掌握,强调工艺的综合分析优化。通过该课程的学习要求学生掌握化工工艺过程的理论,掌握有代表性的化工过程的物理化学原理、过程热力学特征、动力学特征、催化剂应用、工艺设计要求等,使学生对基本化学工业典型过程的共性和特性有比较深入的了解,并具有综合应用所学理论知识对工业化实际化工过程进行分析的能力。
工业制取硝酸的化学反应方程式

工业制取硝酸的化学反应方程式
硝酸(HNO3)是一种广泛应用于工业生产和实验室研究中的化合物。
它可通过不同的制备方法获得,包括与硫酸反应、与氨反应和与氯化铵反
应等。本文将介绍两种常用的工业制取硝酸的化学反应方程式。
1.硝酸的硫酸法制取:
硝酸的硫酸法制取是一种重要的工业制取方法。它的主要反应方程式
如下:
2H2SO4+2NaNO3->2HNO3+Na2SO4+H2O
反应过程中,硝酸与硫酸发生反应,并产生硝酸和硫酸钠(Na2SO4),同时释放出大量的水蒸气。
具体的反应过程如下:
首先,将硫酸(H2SO4)和硝酸钠(NaNO3)以适当的比例混合。例如,将2摩尔的硫酸和2摩尔的硝酸钠混合。
接着,将混合物加热至适当的温度,通常在90°C-100°C之间。
在加热的过程中,发生一系列的离解、氧化还原及酸碱中和反应,最
终生成硝酸和硫酸钠。该反应是一种酸碱中和反应,因为硫酸的酸性与硝
酸的碱性反应完全中和,故反应产物中不含硫酸。
2.硝酸的氨法制取:
硝酸的氨法制取是另一种常用的工业制取方法。它的主要反应方程式
如下:
8NH3+2O2->4HNO3+6H2O
反应过程中,氨气与氧气反应生成硝酸和水。
具体的反应过程如下:
首先,将氨气(NH3)和氧气(O2)以适当的比例混合。例如,将8
摩尔的氨气和2摩尔的氧气混合。
混合气体通过催化剂(通常是铂或钯)催化剂床,加入足够的热量,
使混合气体反应生成硝酸和水。这是一种氧化反应,氨气逐步氧化为硝酸。
该反应是一种非常剧烈的反应,由于氨气具有强大的还原剂性质,因
此需要严格的操作条件和安全措施。
硫酸硝酸混合生产工艺流程

硫酸硝酸混合生产工艺流程
1.首先,将硫酸加入反应釜中。
First, add sulfuric acid to the reactor.
2.然后,将硝酸逐渐加入硫酸中。
Then, gradually add nitric acid to the sulfuric acid.
3.接着,使用搅拌器将两种酸混合均匀。
Next, use a stirrer to mix the two acids evenly.
4.同时,调节反应釜的温度和压力。
At the same time, adjust the temperature and pressure of the reactor.
5.确保反应釜处于安全操作状态。
Ensure that the reactor is in a safe operating condition.
6.在反应过程中,监控反应物的消耗情况。
Monitor the consumption of reactants during the reaction.
7.确保反应釜内的混合物达到预期的浓度。
Ensure that the mixture in the reactor reaches the expected concentration.
8.在混合物达到预期浓度后,停止加热并待冷却。
After the mixture reaches the expected concentration, stop heating and allow it to cool.
9.将冷却后的混合物转移到储存容器中。
浓硫酸和浓硝酸酯化反应

浓硫酸和浓硝酸酯化反应
浓硫酸和浓硝酸发生酯化反应的反应条件如下:
反应物:浓硫酸(H2SO4)和浓硝酸(HNO3)。
反应条件:反应需要在酸性条件下进行,也可以在高温下加速反应速率。
反应方程式:酯化反应通常是一个酸催化的酯形成反应。具体反应机理比较复杂,但大致可以简化为以下方程式:
H2SO4 + HNO3 → H2O + H2SO4NO3
在这个方程式中,H2SO4NO3被称为硝基硫酸酯(nitrososulfuric acid),它是由硫酸和硝酸反应生成的一种中间产物。
总的来说,浓硫酸和浓硝酸的酯化反应会生成硝基硫酸酯作为中间产物,并释放出水分子。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
定了生产能力。焙烧反应的反应速率与温度的关系
如图3.1。
在460~560°C范围为第一阶
段,斜率大,活化能大。温 lgk
度升高,反应速率增加很快。
化学反应动力学控制。
1/T 441 560 727 977
● 560720C范围为过渡阶段,反应速度受温度影响 较小。> 720C为第三阶段,反应速度随温度升高 再增加,但增加幅度小。
速度范围应在uf<u<ut之间。上
部面积大是为了降低流速,增
图 3.2
加沉降机会。
2 余热的回收
● 焙烧时放出大量的热,炉气温度850~950°C,若 直接通入净化系统,设备要求高。直接冷却后净 化也是能量的极大浪费。通常设置废热锅炉来回 收热量,或产蒸汽发电或直接推动动力机械作功。
● 硫铁矿废热锅炉的特殊性:1.含尘量大,不要直 接冲击锅炉管,注意炉管排列间距要大,防止积 灰。2. 含S量大,腐蚀性强,注意防止SO3在壁 内冷凝。所以应采用较高压力以提高SO3露点, 防止腐蚀。3.防止炉气泄漏和空气进入炉内。一 种沸腾焙烧和废热回收流程如图3.3。
图 3.3
● 3 沸腾焙烧炉的特点 ● 生产强度大 ● 硫的烧出率高 ● 传热系数高 ● 产生的炉气二氧化硫浓度高 ● 适用的原料范围广 ● 结构简单、维修方便 ● 不足: ● 炉尘量大,炉尘占总烧渣的60%-70%,除尘净化系
统负荷大。 ● 需将硫铁矿粉碎至较小粒度,需高压鼓风机,动力
消耗大。
● 炉床温度约 800~850°C 炉顶温度 900~950°C
● 炉底压力
10-15kPa
● 出炉气SO2 13%~13.5%
● 2 磁性焙烧
● 控制进氧量,使过量氧较少,反应为
●
3FeS2+8O2 = Fe3O4 + 6SO2
●
3Fe7S8 +38O2 = 7Fe3O4 + 24SO2
● 焙烧后使渣中主要为磁性铁,以作炼铁的原料。
● 4. 提高入炉空气氧含量。
● 3.1.2.2 沸腾焙烧
1 沸腾焙烧炉的结构和操作
一典型沸腾焙烧炉结构如图3.2。
下部为沸腾区,中部为扩散区,
上部为焙烧空间。沸腾区耐火
砖较厚。而上部耐火砖较薄,
这是为了减小炉内与钢壁的温
度差,减小二氧化硫在壁上凝
结,从而减小腐蚀。沸腾焙烧
的空气流速是重要因素,操作
● 硫磺:使用天然硫磺生产硫酸最好,但我国矿少。
● 其它原料:硫酸盐、冶炼烟气、含硫工业废料等。
3.1.2 从硫铁矿制二氧化硫炉气
Making SO2 gases from sulfur-iron ore
● 3.1.2.1 硫铁矿的焙烧
● 1 硫铁矿的焙烧反应
●
2FeS2 = 2FeS + S2
●
● 4 脱砷焙烧
● 脱砷焙烧主要用于含砷量大的硫铁矿。
● 除了主要反应外,还发生下列反应:
无机化工工艺学 Chemical engineering
technics
应用化工技术专业
第3章 硫酸与硝酸 Vitriolic acid and nitric acid
3.1 硫酸
● 3.1.1 概述 ● 3.1.2 从硫铁矿制二氧化硫炉气 ● 3.1.3 炉气的净化与干燥 ● 3.1.4 二氧化硫的催化氧化 ● 3.1.5 三氧化硫的吸收 ● 3.1.6 三废治理与综合利用
● 实验证明,焙烧反应第三阶段活化能较小,受氧 的扩散控制。
● 提高焙烧速率的途径:
● 1. 提高操作温度。但不宜太高,温度太高会使炉 内结疤,焙烧反而不能顺利进行。通常温度范围 为850950C.
● 2. 减小硫铁矿粒度。可以减小扩散阻力,增加接 触面积,对第三阶段速度增加有利。
● 3. 增加空气与矿粒的相对运动。
3.1.1 概述 Introduction
● 硫酸是重要的基本化学工业原料。在化肥、冶金、 国防、有机合成、石油炼制等工业都有广泛用途。
● 硫酸的性质
● 硫酸与水的二组分体系最高恒沸点组成为98.4%。 硫酸浓度可大于100%,称为发烟硫酸,其中含 溶解在100%硫酸中的游离SO3。
● 生产方法
● 塔式法:直接用SO2,H2O,O2反应生成硫酸。
● 特点:炉气中二氧化硫含量高,三氧化硫含量低,低品位 硫铁矿也可得到较好的炼铁原料。其焙烧温度约900°C左右。
● 3 硫酸化焙烧
● 控制焙烧条件,使钴铜镍等金属生成硫酸盐,然后用水或 稀硫酸浸取焙烧物,分离出硫酸盐,从而获得某种金属。 控制条件:温度(600-700°C), 空气过剩量1.5-2.0%, 获得SO3 组成较高。
●
H= -2435kJ/mol
● 此外,由于Fe2O3的催化作用,SO2可再氧化成SO3, 高温下盐类分解成金属氧化物,同时再生成各种硫
酸盐的副反应。焙烧阶段生成SO3是有害的,会给 后续Baidu Nhomakorabea化工序产生很多问题。
● 2 硫铁矿焙烧的焙烧速度
● 硫铁矿焙烧是非均相反应,反应平衡常数很大,通
常认为可进行到底。所以生产中关键是反应速度决
S2 + O2 = SO2
●
4FeS + 7O2 = 2Fe2O3 +4SO2
● 上述反应的总反应式:
H>0 H<0 H<0
● 4FeS2 + 11O2 = 2Fe2O3 +8SO2
●
H= -3411kJ/mol
● 若氧气不足,还有生成Fe3O4的反应:
● 3FeS2 + 8O2 = Fe3O4 +6SO2
● 接触法:SO2
SO3 +H2O 硫酸
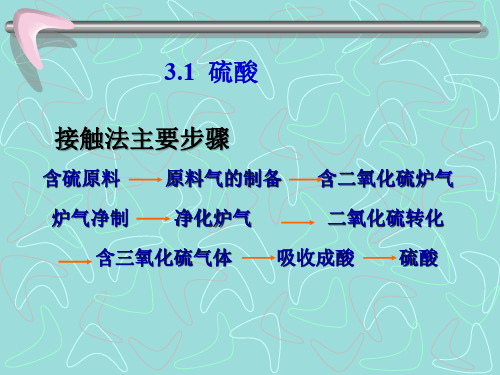
● 接触法主要步骤:
● 含硫原料 原原料料气气的的制制备备 含二氧化硫炉气
● 炉炉气气净净制制
净化炉气
二氧二化氧硫化转硫化转化
● 含三氧化硫气体 吸收吸成收酸成酸 硫酸
● 生产硫酸的原料
● 硫铁矿:主要成份是FeS2。磁硫铁矿:主要成份 为Fe7S8。含S量越高,锻烧时放热越多。两种矿 含S量相同时,磁硫铁矿锻烧放热量比普通硫铁矿 高30%左右。自然开采的硫铁矿都含有很多杂质, 使矿呈灰、褐、黄铜等不同颜色。通常含硫量只 有30%~50%。
3.1.2.3 几种焙烧方法
● 焙烧方法主要由硫铁矿成份和渣的处理方式决定。一 般硫铁矿多采用氧化焙烧。
● 1 氧化焙烧
● 氧过量,使硫铁矿完全氧化,主要反应为
●
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
● 焙烧过程为:
硫铁●矿+空气 沸腾焙烧炉 废热锅炉 电除尘 炉气去精制
旋风除尘
