2021届高考化学二轮专题练习:水溶液中的离子平衡
安徽省2021年高考化学二轮专题 11 水溶液中的离子平衡

安徽省2021年高考化学二轮专题 11 水溶液中的离子平衡姓名:________ 班级:________ 成绩:________一、单选题 (共13题;共26分)1. (2分) (2017高二上·吉林期末) 物质的量浓度相同的下列溶液中,NH4+浓度最大的是()A . NH4ClB . NH4HSO4C . CH3COONH4D . (NH4)2Fe(SO4)22. (2分) (2018高二上·九江期中) 已知在25℃时,AgCl的Ksp为1.8×10-10 , Ag2S的Ksp为6.3×10-50 ,将AgCl与Ag2S的饱和溶液等体积混合,再加入足量浓AgNO3溶液,发生的反应为()A . 只有Ag2S沉淀生成B . AgCl和Ag2S等物质的量生成C . AgCl沉淀多于Ag2S沉淀D . Ag2S沉淀多于AgCl沉淀3. (2分)(2017·合肥模拟) 欲证明一瓶无色液体是纯水,可靠的实验方法是()A . 1.01×105Pa时沸点为100℃B . 测得其pH=7C . 遇钠生成氢气D . 电解时得到H2与O2的体积比为2:14. (2分) (2016高三上·黑龙江开学考) 把下列溶液加水稀释,溶液中每种离子的浓度都不会增加的是()A . H2SO4溶液B . Na2SO4溶液C . Na2CO3溶液D . FeC13溶液5. (2分) (2016高二下·福州期末) 25℃时,三种难溶银盐的Ksp与颜色如表,下列说法正确的是()A . AgCl、Ag2CrO4、AgI饱和溶液中c(Ag+)依次减弱B . Ag2CrO4饱和溶液中c(Ag+)约为1.0×10﹣6mol•L﹣1C . 向AgCl悬浊液加入足量KI溶液,沉淀将由白色转化为黄色D . 向等浓度的KCl与K2CrO4混合溶液中滴加少量AgNO3溶液,将生成砖红色沉淀6. (2分) (2016高一上·上饶期末) 可证明次氯酸是弱酸的实验事实是()A . 次氯酸可与强碱反应B . 次氯酸有漂白性C . 次氯酸钙可与碳酸反应生成次氯酸D . 次氯酸见光分解7. (2分)为实现消除碘缺乏病的目标,卫生部规定食盐必须加碘,其中的碘以碘酸钾(KIO3)形式存在.已知在溶液中IO3-可以和I-发生反应: IO3-+5I-+6H+===3I2+3H2O,根据此反应,可用试纸和生活中常见的一些物质进行实验,证明在食盐中存在IO3-.进行上述实验时必须使用的物质是()①自来水②蓝色石蕊试纸③碘化钾淀粉试纸④淀粉⑤食糖⑥食醋⑦白酒A . ①③B . ③⑥C . ②④⑥D . ①②④⑤⑦8. (2分)(2017·新课标Ⅰ卷) 实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有碳等杂质,焦性没食子酸溶液用于吸收少量氧气),下列说法正确的是()A . ①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液B . 管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体浓度C . 结束反应时,先关闭活塞K,再停止加热D . 装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气9. (2分) (2015高二下·抚州期中) 下列溶液中有关物质的量浓度关系错误的是()A . pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)═c(OH﹣)+c(A﹣)B . pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa)C . 物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO﹣)+2c(OH﹣)═2c(H+)+c(CH3COOH)D . 0.1mol•L﹣1的NaHA溶液,其pH=4:c(Na+)>c(H+)>c(H2A)>c(A2﹣)10. (2分) (2016高二上·丰县月考) 下列溶液中,由水电离出的c(H+)<10﹣7mol•L﹣1的是()A . 25℃时,0.01mol•L﹣1NH4Cl溶液B . 25℃时,0.01mol•L﹣1NaHSO4溶液C . 100℃时,0.01mol•L﹣1NaNO3溶液D . 25℃时,0.01mol•L﹣1NaF溶液11. (2分)常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是()A . 某物质的溶液中由水电离出的c(H+)=1×10﹣amol/L,若a>7时,则该溶液的pH一定为14﹣aB . 某溶液中存在的离子有S2﹣、HS﹣、OH﹣、Na+、H+ ,则离子浓度一定是c(Na+)>c(S2﹣)>c(OH ﹣)>c(HS﹣)>c(H+)C . 将0.2 mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:2c(OH﹣)=2c(H+)+c(HA)﹣c(A﹣)D . ①Na2CO3溶液②CH3COONa溶液③NaOH溶液,若3种溶液pH均为9,则它们物质的量浓度大小顺序是①>②>③12. (2分) (2018高二上·黑龙江月考) 下列有关叙述中,正确的是()A . 一定温度下,向0.1mol/L的氨水中滴加相同浓度的醋酸,c(NH4+)/c(NH3·H2O) 减小B . 已知Ksp(BaSO4) = 1.1×10-10 ,Ksp(BaCO3) = 2.58×10-9 ,所以不能将BaSO4转化为BaCO3C . 用弱酸溶液滴定强碱溶液时可用甲基橙作指示剂D . 配制FeCl3溶液时,为了抑制水解,可加入少量盐酸13. (2分) (2018高二上·中山期末) 在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示.又知AgCl的Ksp=1.8×10-10。
高考化学二轮复习专题突破练九水溶液中的离子平衡含解析

专题突破练九水溶液中的离子平衡一、选择题:本题共10小题,每小题3分,共30分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
1.(2021河北选考模拟)醋酸为一元弱酸,25 ℃时,其电离常数K a=1.75×10-5。
下列说法错误的是( )A.0.1 mol·L-1 CH3COOH溶液的pH在2~3范围内B.CH3COONa溶液中,c(CH3COOH)+c(H+)=c(OH-)C.将0.1 mol·L-1 CH3COOH溶液加水稀释,其电离常数和均不变D.等体积的0.1 mol·L-1 NaOH溶液和0.1 mol·L-1 CH3COOH溶液混合后,溶液pH>7,且c(Na+)>c(CH3COO-)>c(OH-)>c(H+)2.(2021广东选考模拟)叠氮酸(HN3)与NaOH溶液反应生成NaN3。
已知NaN3溶液呈碱性,下列叙述正确的是( )A.0.01 mol·L-1 HN3溶液的pH=2B.HN3溶液的pH随温度升高而减小C.NaN3的电离方程式:NaN3Na++3D.0.01 mol·L-1 NaN3溶液中:c(H+)+c(Na+)=c()+c(HN3)3.(2021河北邯郸模拟)工业上向锅炉里注入Na2CO3溶液浸泡,将水垢中的CaSO4转化为CaCO3,而后用盐酸去除。
下列叙述不正确的是( )A.温度升高,Na2CO3溶液的K W和c(OH-)均会增大B.沉淀转化的离子方程式为C(aq)+CaSO4(s)CaCO3(s)+S(aq)C.盐酸中CaCO3的溶解性大于CaSO4D.Na2CO3溶液遇CO2后,阴离子浓度均减小4.(2021湖南浏阳模拟)25 ℃时,改变0.1 mol·L-1弱酸RCOOH溶液的pH,溶液中RCOOH分子的物质的量分数δ(RCOOH)随之改变[已知δ(RCOOH)=],甲酸(HCOOH)与丙酸(CH3CH2COOH)溶液中δ(RCOOH)与pH的关系如图所示。
2021届高考化学二轮精选题:电解质溶液、水溶液中的离子平衡含答案

2021届高考化学二轮精选题:电解质溶液、水溶液中的离子平衡含答案精选题:电解质溶液、水溶液中的离子平衡一、选择题1、某氨水中c(NH4+)=0.5 mol / L时达到电离平衡,若向其中加入c(NH4+)=0.5 mol / L的NH4Cl溶液后,NH3·H2O的电离程度将()A. 减少B. 不变C. 增大D. 无法判断2、原电池的电极名称不仅与电极的性质有关,也与电解质溶液有关,下列说法不正确的是A.由Zn、Cu、稀H2SO4组成原电池,其负极反应式为:Zn-2e−=Zn2+B.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Fe-2e−=Fe2+C.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e−=Al3+D.由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e−=Cu2+3、向三份均为100mL0.5mol·L-1NaHCO3溶液中,分别加入少量冰醋酸、Ca(OH)2固体、NaAlO2固体(忽略溶液体积变化),则三份溶液中c(CO32-)的变化依次为()A.减小、减小、增大B.减小、增大、增大C.增大、减小、减小D.减小、增大、减小4、室温下,向10 mL 0.1 mol·L-1 HX溶液中逐滴加入0.2 mol·L-1 YOH溶液,混合溶液的pH变化情况如图所示(温度和体积变化忽略不计)。
则下列结论错误的是( )A.HX为一元强酸,YOH为一元弱碱B.M点水的电离程度大于N点水的电离程度C.N点对应溶液中粒子浓度:c(YOH)>c(Y+)>c(X-)>c(OH-)>c(H+)D.25 ℃时pH=4的YX溶液中水电离出的c(H+)=1.0×10-4 mol/L5、常温下,浓度均为1.0 mol·L -1的NH 3·H 2O 和NH 4Cl 混合溶液10 mL ,测得其pH 为9.3。
水溶液中的离子平衡---2021年高考化学复习专项训练含解析答案

水溶液中的离子平衡1.下列说法不正确的是( ) A.pH>7的溶液不一定呈碱性B.中和pH 和体积均相等的氨水、NaOH 溶液,所需HCl 的物质的量相同C.相同温度下,pH 相等的盐酸、3CH COOH 溶液中,()-OH c 相等D.氨水和盐酸反应后的溶液,若溶液呈中性,则()()4Cl NH c c -= 1.答案:B解析:没有给出温度,pH>7的溶液不一定呈碱性,A 正确;pH 相同的氨水和氢氧化钠溶液,氨水的物质的量浓度大,所以中和pH 和体积均相等的氨水、氢氧化钠溶液,氨水消耗HCl 的物质的量多,B 错误;相同温度下,盐酸和醋酸溶液中pH 相等时,因为水的离子积常数相等,所以两溶液中的()OH c -也相等,C正确;混合后溶液中的电荷守恒式为()()()()4H NH Cl OH c c c c ++--+=+,溶液呈中性,即()()H OH c c +-=,所以()()4NH Cl c c +-=,D 正确。
2.室温下,向120.00mL.0.1000mol L -⋅盐酸中滴加10.1000mol L NaOH -⋅溶液,溶液的pH 随NaOH 溶液体积的变化如图。
已知lg5=0.7.下列说法不正确的是( )A.NaOH 与盐酸恰好完全反应时,pH=7B.选择变色范围在pH 突变范围内的指示剂,可减小实验误差C.选择甲基红指示反应终点,误差比甲基橙的大D.(NaOH)30.00mL V =, pH=12.3 2.答案:C解析:氢氧化钠与盐酸恰好完全反应生成氯化钠和水,氯化钠属于强酸强碱盐,溶液呈中性,即室温下pH=7,A 正确;指示剂的变色范围在pH 突变范围内,可减小实验误差,B 正确;指示剂的变色范围越接近反应的理论终点,实验误差越小,从题图可知,甲基红的变色范围更接近反应终点(pH=7),误差更小,C 错误;当加入NaOH 溶液的体积为30.00mL 时,盐酸不足,过量的31313(NaOH)30.0010L 0.1000mol L 20.0010L 0.1000mol L 10mol n -----=⨯⨯⋅-⨯⨯⋅=,所以溶液中3110mol (NaOH)0.02mol L 0.060L c --==⋅,()14113110H mol L 510mol L 0.02c -+---=⋅=⨯⋅,故pH=12.3,D正确。
《水溶液中的离子平衡》---2021年高考化学复习专项训练含解析答案

《水溶液中的离子平衡》1.现有常温下的四种溶液,pH见下表:下列有关叙述中正确的是( )A.分别加水稀释10倍,四种溶液的pH:①>②>④>③B.将③、④分别稀释到pH=5,由水电离出的氢离子的浓度均减小100倍C.在①、②中分别加入适量的NH4Cl晶体后,①的pH减小,②的pH不变D.将①、④两种溶液等体积混合,所得溶液中:<11.【答案】A【解析】A项,稀释相同倍数时,强酸、强碱的pH变化大,故分别加水稀释10倍后,NaOH溶液的pH=10,氨水的pH>10,盐酸的pH=4,醋酸溶液的pH<4;B项,酸碱加水稀释后,H2O的电离程度增大;C项,在①、②中分别加入适量NH4Cl晶体后,①、②的pH均减小;D项,将①、④两种溶液等体积混合,氨水过量,溶液呈碱性,则>1。
2.已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )A.水的电离程度始终增大B.先增大再减小C.c(CH3COOH)与c(CH3COO-)之和始终保持不变D.当加入氨水的体积为10 mL时,c(NH)=c(CH3COO-)2.【答案】D【解析】A项,醋酸显酸性,水的电离平衡受到抑制,在滴加NH3·H2O的过程中,酸性减弱,水的电离程度受到抑制的程度减小,电离程度增大,当CH3COOH反应完后,加入的NH3·H2O会抑制水的电离,电离程度减小,错误;B项,在向醋酸中滴加氨水的过程中,碱性增强酸性减弱,c(OH-)一直增大。
由NH 3·H2O NH+OH-可知,K=,则=,而K是常数,故一直减小,错误;C项,n(CH3COOH)和n(CH3COO-)保持不变,但溶液的体积是增大的,故c(CH3COOH)与c(CH3COO-)之和逐渐减小,错误;D项,当加入氨水10 mL 时,两者恰好完全反应生成CH3COONH4,由CH3COOH和NH3·H2O的电离常数相等可知,CH3COO-和NH的水解程度也相等,故c(NH)=c(CH3COO-),正确。
高考化学二轮复习专题10水溶液中的离子平衡专题卷(2021年整理)

2019年高考化学二轮复习专题10 水溶液中的离子平衡专题卷编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2019年高考化学二轮复习专题10 水溶液中的离子平衡专题卷)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2019年高考化学二轮复习专题10 水溶液中的离子平衡专题卷的全部内容。
专题10 水溶液中的离子平衡一、选择题1.将纯水加热至较高温度,下列叙述正确的是( )A.水的离子积变大、pH变小、呈酸性B.水的离子积不变、pH不变、呈中性C.水的离子积变小、pH变大、呈碱性D.水的离子积变大、pH变小、呈中性解析:将纯水加热,平衡H2O H++OH-向右移动,[H+]、[OH-]均变大,但仍然相等,所以K w变大pH变小,仍然呈中性。
答案:D2.下列事实不能证明氨水是弱碱的是( )A.pH=11的氨水加入水稀释到原溶液体积100倍时,pH大于9B.氯化铵溶液呈酸性C.常温下0.01 mol/L氨水的pH=10.6D.体积相同的0。
1 mol/L氨水和0.1 mol/L NaOH溶液中和盐酸的量相同答案:D3.(2018·德州模拟)将0.1 mol/L醋酸溶液加水稀释,下列说法正确的是( )A.溶液中[H+]和[OH-]都减小B.溶液中[H+]增大C.醋酸电离平衡向左移动D.溶液的pH增大解析:加水稀释,电离程度增大,[H+]减小,[OH-]增大,溶液的pH增大。
答案:D4.(2018·北京西城区测试)一定条件下,碳钢腐蚀与溶液pH的关系如下:pH2466。
5813.514腐蚀快慢较快慢较快主要产物Fe2+Fe3O4Fe2O3FeO2-下列说法不正确...的是( )A.在pH<4溶液中,碳钢主要发生析氢腐蚀B.在pH>6溶液中,碳钢主要发生吸氧腐蚀C.在pH>14溶液中,碳钢腐蚀的正极反应为O2+4H++4e-=2H2OD.在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减缓解析:A项,在pH<4溶液中,碳钢主要发生析氢腐蚀;B项,在pH>6溶液中,碳钢主要发生吸氧腐蚀;C项,在pH>14溶液中,碳钢腐蚀的正极反应为O2+2H2O+4e-=4OH-;D项,在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减缓。
【2021高考化学】水溶液中的离子平衡含答案

水溶液中的离子平衡1.(2021届·湖北高三月考)某温度下,向10 mL 0.1 mol ·L -1 NaCl 溶液和10 mL 0.1 mol ·L -1 K 2CrO 4溶液中分别滴加0.1 mol ·L -1 AgNO 3溶液。
滴加过程中pM[pM=-lgM ,M 为c (Cl -)或c (24CrO -)]与所加AgNO 3溶液体积之间的关系如图所示。
已知Ag 2CrO 4为深红色沉淀,100.1≈1.259≈1.265。
下列说法错误的是( )A .a 1、b 、c 三点所示溶液中c(Ag+):b>c>a 1B .若将上述NaCl 溶液的浓度改为0.2 mol ·L -1,则a 1点会平移至a 2点C .若将a 1与b 点溶液混合,则有AgCl 与Ag 2CrO 4固体析出D .用AgNO 3标准溶液滴定NaCl 溶液时,可用K 2CrO 4溶液作指示剂 【答案】C【解析】根据pM=-lgc(Cl -)或pM=-lgc(CrO 42-)可知,c(CrO 42-)越小,pM 越大。
根据图像,向10 mL 0.1 mol ·L -l NaCl 溶液和10 mL 0.1 mol ·L -l K 2CrO 4溶液中分别滴加0.1 mol ·L -l AgNO 3溶液。
当滴加10 mL0.1 mol ·L -l AgNO 3溶液时,氯化钠恰好反应,滴加20 mL0.1 mol ·L -l AgNO 3溶液时,K 2CrO 4恰好反应,因此a l 所在曲线为氯化钠,b 、c 所在曲线为K 2CrO 4。
A 项,a l 点恰好反应,-lgc(Cl -)=4.9,c(Cl -)=10-4.9mol ·L -l ,则c(Ag +)=10-4.9mol ·L -l ,b 点c(Ag +)=2× 10-4mol ·L -l ,c 点,K 2CrO 4过量,c(CrO 42-)约为原来的1/4,则c(CrO 42-)= 0.025mol ·L -l ,则c(Ag +×10-5mol ·L -l ,a l 、b 、c 三点所示溶液中b 点的c(Ag +)最大,A 正确;B 项,温度不变,氯化银的溶度积不变,若将上述NaCl 溶液浓度改为0.2mol ·L -1,平衡时,-lgc(Cl -)=4.9,但需要的硝酸银溶液的体积变成原来的2倍,因此a 1点会平移至a 2点,B 正确;C 项,将a 1与b 点溶液混合,AgCl 沉淀出来, 银离子量不足,Ag 2CrO 4不能沉淀.C 错误;D 项,根据上述分析,当溶液中同时存在Cl -和CrO 42-时,加入硝酸银溶液,Cl -先沉淀,用AgNO 3标准溶液滴定NaCl 溶液时,可用K 2CrO 4溶液作指示剂,滴定至终点时,会生成Ag 2CrO 4为红棕色沉淀,D 正确。
2021届高三化学二轮专题增分训练:水溶液中的离子平衡(原卷+解析卷)

水溶液中的离子平衡【原卷】1.(2020届广东省深圳市高三第一次调研)常温下,向141mol L NH Cl -⋅溶液中加入足量的镁条,该体系pH 随时间变化的曲线如图所示。
实验观察到b 点开始溶液中有白色沉淀生成,已知[]1sp 2K Mg(OH) 1.810-=⨯。
下列说法错误..的是A .常温下,4NH Cl 的水解平衡常数数量级为1010-B .体系中,水的电离程度大小关系为a>c>bC .b 点时,溶液中()2+1c Mg0.18mol L-=⋅D .a 点溶液中,()()()()++--4c NH +c H <c Cl +c OH2.(2020届河南省郑州市高三第二次质检)25℃时,用 0.1mol •L -1NaOH 溶液滴定 20 mL 0.1 mol •L -1 某二元弱酸 H 2A ( K a1 =1.1×10-3,K a2= 3.9×10-6 )溶液,滴定过程中溶液的 pH 变化曲线如图所示。
下列说法正确的是A.a 点的pH 大于2B.b 点溶液中c(H2A) > c(A2-)C.c 点溶液中c( HA-) + 2c(H2A ) = c( OH- )-c(H+)D.d 点溶液中c (Na+) +c(H+) =c(A2-) +c(HA-) +c(OH-)3.(2020届安徽省江淮十校联考)工业上常用(NH4)2SO3溶液吸收废气中的SO2,室温下测得溶液中lgY[Y=-323c(HSO)c(H SO)或2-3-3c(SO)c(HSO)],与pH的变化关系如图所示。
则下列说法一定错误的是A.通入少量SO2的过程中,直线Ⅱ中的N点向M点移动B.α1=α2一定等于45°C.当对应溶液的pH处于1.81<pH<6.91时,溶液中的微粒浓度一定存在c(HSO3-)>c(SO32-)>c(H2SO3)D.直线Ⅱ中M、N点一定存在c2(HSO3-)>c(SO32-)·c(H2SO3)4.(2020届广东省佛山市质检)向废水中加入硫化物可以依次获得CuS、 ZnS 纳米粒子。
2020-2021高考化学综合题专题复习【化水溶液中的离子平衡】专题解析附详细答案

2020-2021高考化学综合题专题复习【化水溶液中的离子平衡】专题解析附详细答案一、水溶液中的离子平衡1.亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂。
已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
利用下图所示装置制备亚氯酸钠。
完成下列填空:(1)装置②中产生ClO2的化学方程式为___________。
装置③的作用是_____________。
(2)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:①减压,55℃蒸发结晶;②__________;③_______;④低于60℃干燥,得到成品。
(3)准确称取所得亚氯酸钠样品10g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(ClO2-+ 4I-+4H+ →2H2O+2I2+Cl-)。
将所得混合液配成250mL待测溶液。
配制待测液需用到的定量玻璃仪器是____________;(4)取25.00mL待测液,用2.0 mol/L Na2S2O3标准液滴定(I2 +2S2O32-→2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为__________。
重复滴定2次,测得Na2S2O3溶液平均值为20.00 mL。
该样品中NaClO2的质量分数为_____________。
(5)通过分析说明装置①在本实验中的作用_______________________________。
【来源】2014届上海市金山区高三一模化学试卷(带解析)【答案】2NaClO3+ Na2SO3+ H2SO4→2ClO2+ 2Na2SO4+ H2O 防止倒吸趁热过滤用38-60℃的温水洗涤 250mL容量瓶溶液由蓝色变为无色且半分钟内不变色 90.5% 当关闭K2时,打开K1,可以吸收反应产生的气体。
专题10 水溶液中的离子平衡-2021年高考真题和模拟题化学分项汇编(解析版)
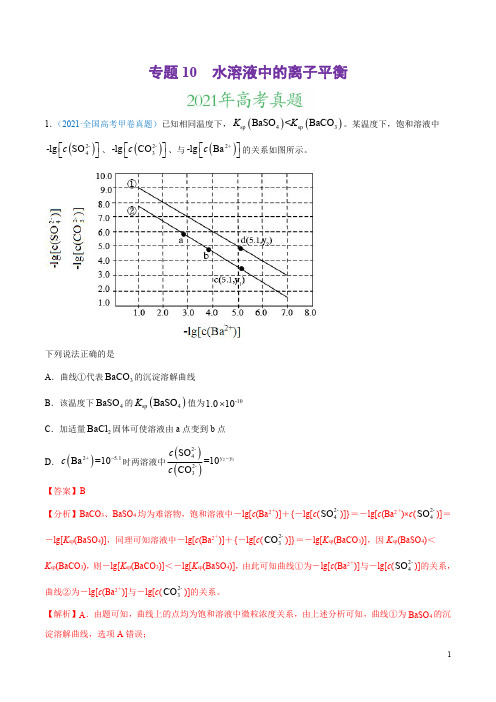
c
D.由图可知,当溶液中 c(Ba2+)=10-5.1 时,两溶液中
c
SO24CO32-
= 10y2 10 y1
=10y1y2 ,选项 D 错误;
答案选 B。
2.(2021·全国高考乙卷真题)HA 是一元弱酸,难溶盐 MA 的饱和溶液中 c(M ) 随 c(H+)而变化, M 不发
生水解。实验发现, 298K 时 c2 (M+ )-c(H+ ) 为线性关系,如下图中实线所示。
B.由电荷守恒可知, a b c 过程溶液中 c HCO3 2c CO32 c OH =c H c Na ,滴加 NaOH 溶液的过程中 c Na 保持不变, c H 逐渐减小,因此 c HCO3 2c CO32 c OH 逐渐减
小,故 B 正确;
答案为:B。
6.(2021·浙江高考真题)取两份10mL 0.05mol L1 的 NaHCO3 溶液,一份滴加 0.05mol L-1 的盐酸, 另一份滴加 0.05mol L1NaOH 溶液,溶液的 pH 随加入酸(或碱)体积的变化如图。
下列说法不.正.确.的是
5
A.由 a 点可知: NaHCO3 溶液中 HCO3- 的水解程度大于电离程度
综上所述,说法不正确的是 C 项,故答案为 C。 7.(2021·浙江高考真题)25℃时,下列说法正确的是 A.NaHA 溶液呈酸性,可以推测 H2A 为强酸 B.可溶性正盐 BA 溶液呈中性,可以推测 BA 为强酸强碱盐 C.0.010 mol·L-1、0.10mol·L-1 的醋酸溶液的电离度分别为α1、α2,则α1<α2 D.100 mL pH=10.00 的 Na2CO3 溶液中水电离出 H+的物质的量为 1.0×10-5mol 【答案】D 【解析】A.NaHA 溶液呈酸性,可能是 HA-的电离程度大于其水解程度,不能据此得出 H2A 为强酸的结
2021届高三化学水溶液中的离子平衡专题复习

2021届高三化学水溶液中的离子平衡专题复习一、单选题1.下列物质溶于水后水解显碱性的是A .NaClB .CaOC .CH 3COONaD .NH 4Cl2.少量下列物质放入滴有酚酞的水后,溶液最终显红色的是( )A .NaB .KClC .NH 4ClD .Fe 2O 33.下列属于强电解质的是A .AlB .3CH OHC .32NH H O ⋅D .4BaSO4.在 0.1mol/L 的醋酸中加入一定量的水,下列说法错误的是A .c(H +)减小B .n(H +)增大C .溶液的 pH 增大D .c(Ac -)增大5.常温下,一定浓度的某溶液,由水电离出的c(OH −)=1×10−4 mol/L ,则该溶液中的溶质可能是A .H 2SO 4B .NaOHC .KHSO 4D .CH 3COONa6.有人曾建议用AG 表示溶液的酸度(acidity),AG 的定义为AG=lg ()()H OH c c +- ,下列表述正确的是 A .25 ,时,若溶液呈中性,则pH=7,AG=1 B .25 ,时,若溶液呈酸性,则pH<7,AG<0C .25 ,时,若溶液呈碱性,则pH>7,AG>0D .25 ,时,溶液的pH 与AG 的换算公式为AG=2(7-pH) 7.下列说法中正确的是A .如果盐酸的浓度是醋酸的两倍,则盐酸中的H +浓度也是醋酸中的两倍B .将NaOH 溶液和氨水各稀释一倍,两者的OH -浓度均减小到原来的C .中和等体积、等物质的量浓度的盐酸和醋酸溶液,盐酸所需氢氧化钠多于醋酸D .弱电解质溶液的导电能力也可能比强电解质溶液的强8.用下列仪器或装置进行相应实验,不能达到实验目的的是A .实验①配置100mL 0.1mol/L NaCl 溶液B .实验②制备并收集乙酸乙酯C .实验③准确量取15.00mL NaOH 溶液D .实验④制取SO 2气体并检验其还原性 9.已知K sp (AgA)=1.56×10-10,K sp (AgB)=7.7×10-13,K sp (Ag 2C)=9.0×10-12。
2021届高考化学二轮备考专题训练:水溶液中的离子平衡图像(原卷+解析卷)

水溶液中的电离平衡【原卷】1.(2021·江西高三二模)常温下,向1 L 浓度为0.4 mol·L -1的乙醇酸[CH 2(OH)COOH]溶液中加入8 g NaOH 固体得到X 溶液,将X 溶液平均分成两等份,一份通入HCl 气体,得到溶液Y ,另一份加入NaOH 固体得到溶液Z ,溶液Y 、Z 的pH 随所加物质的物质的量的变化情况如图所示(体积变化忽略不计)。
下列说法不正确的是( )A .c 点对应曲线代表的是加入HCl 的曲线B .溶液中水的电离程度:b >cC .a 点:c [CH 2(OH)COO -]>c (Na +)>c (H +)>c (OH - )D .稀释Y 溶液后,溶液中[]-2-2CH (OH)COO CH (OH)COOH (OH )c c c ⎡⎤⎣⎦⨯变大2.(2021·安徽马鞍山市·高三一模)室温下,体积均为20mL 、浓度均为0.1mol·L -1的HX 溶液、HY 溶液中分别滴加同浓度的NaOH 溶液,反应后溶液中水电离的c(H +)水的负对数[–lgc(H +)水]与滴加氢氧化钠溶液体积的关系如图所示。
下列说法正确的是( )A .室温时,Ka(HX)=10-6B .a 、b 、c 三点溶液均显中性C .b 、d 两点溶液的离子总浓度不同D .c 点溶液中c(X -)+c(HX)=0.1mol·L -13.(2021·山东潍坊市·高三一模)常温下,向含少量盐酸的0.1mol/L 的CrCl 3溶液中逐滴滴加NaOH 溶液,所加NaOH 溶液的体积与溶液pH 变化如图所示。
已知:Cr(OH)3为灰绿色的沉淀,当Cr 3+浓度为10-5mol/L 时,可认为沉淀完全,碱过量时生成[Cr(OH)4]-离子。
下列说法正确的是( )A .AB 段发生反应的离子方程式为:33Cr 3OH Cr(OH)+-+=↓B .A 到D 过程中,溶液中水的电离程度先减小后增大C .当溶液pH=5时,()3 3.81c Cr 110mol L +--=⨯⋅D .D 点溶液中()()()()4c Cl c Na c Cr(OH)c OH c H -+--+⎡⎤>>>>⎣⎦4.(2021·河北高三二模)常温下,向10.10mol L -⋅的二元弱酸2H A 溶液中滴加相同浓度的烧碱溶液,溶液中的22H A HA A --、、的物质的量分数(X)δ随pH 的变化如图所示[已知()()()22c(X)(X)c H A c HA c A δ--=++],下列说法错误的是( )A .()a22K H A 的数量级为510-B .常温下,10.1mol L -⋅的NaHA 溶液显酸性C .NaHA 溶液中:()()()()22OH A H H A c c c c --++=+D .pH 从1.2变化至4.2的过程中,()()22c H A c A -先增大后减小5.(2021·广东汕头市·高三一模)室温下,向 100mL 饱和 H 2S 溶液中通入 SO 2气体(气体体积换算成标准状况),发生反应: 222=2H S SO 3S 2H O +↓+,测得溶液 pH与通入 SO 2的关系如图。
2021 高考 水溶液中的离子平衡(攻克各种图像问题)含答案

2021高考水溶液中的离子平衡(攻克各种图像问题)1.已知25 ℃时有关弱酸的电离平衡常数见下表:则下列有关说法正确的是()A.等物质的量浓度的各溶液pH关系为:pH(Na2B)>pH(NaHB)>pH(NaA)B.将a mol·L-1的HA溶液与a mol·L-1的NaA溶液等体积混合,混合液中:c(Na+)>c(A-) C.向Na2B溶液中加入足量的HA溶液发生反应的离子方程式为:B2-=2HA===2A-=H2B D.NaHB溶液中部分微粒浓度的大小为:c(Na+)>c(HB-)>c(B2-)>c(H2B)2.下列说法正确的是A.以铜作阴极、铁作阳极、硫酸铜为电解液可完成铁上镀铜B.水的电离是吸热过程,升高温度,水的离子积增大、减小pHC.由反应2C+SiO2Si+2CO,可得出C的非金属性强于SiD.pH=9的醋酸钠溶液和pH=9的氨水中水的电离程度相同3.利用某些有机物的同分异构体间的转化可用来贮存热能,如降冰片二烯(NBD)经太阳照射后转化成四环烷(Q)的反应(—88.62kJ·mol—1),下列说法不正确的是A.NBD、Q、甲苯三者互为同系物B.降低温度有利于Q转化为NBDC.一定条件下遇HCl时Q比NBD稳定D.NBD、Q、甲苯三者是同分异构体4.下列说法不正确的是A.容量瓶在使用前均需要检漏B.取某盐溶液少量,滴加浓氢氧化钠溶液并加热,产生了能使湿润的红色石蕊试纸变蓝气体,说明该溶液中含有NH4+C.往某少量溶液中滴加少量BaCl2溶液,产生白色沉淀,说明溶液一定存在SO42-D.做焰色反应实验时,用稀盐酸清洗铂丝5.下列实验中.对应的现象以及结论都正确且两者具有因果关系的是A.A B.B C.C D.D6.在常温下,将体积相同,把pH=13的NaOH溶液、氨水,分别加水稀释m倍=n倍,溶液的pH都变成9,那么m与n的关系为A.4m=n B.m=n C.m<n D.m=n7.常温下,在“H2S—HS-—S2-”的水溶液体系中,H2S、HS-、S2-三种微粒的物质的量分数随溶液pH变化(仅用H2S和NaOH调节pH)的关系如图所示。
2021届高考化学二轮强化练习:水溶液中的离子平衡

水溶液中的离子平衡一、选择题1.常温下,浓度均为0.1 mol·L-1的四种盐溶液,其pH如表所示,下列说法正确的是()序号①②③④溶液CH3COONa NaHCO3Na2CO3NaClOpH8.89.711.610.3A.等浓度的3B.Na2CO3和NaHCO3溶液中离子种类不同C.溶液中水的电离程度:①>②>④>③D.NaHCO3溶液中:c(Na+)=c(CO2-3)+c(HCO-3)+c(H2CO3)2.下表是几种弱酸常温下的电离平衡常数:CH3COOH H2CO3H2S H3PO4K a=1.8×10-5K a1=4.3×10-7K a2=5.6×10-11K a1=9.1×10-8K a2=1.1×10-12K a1=7.5×10-3K a2=6.2×10-8K a3=2.2×10-13A.碳酸的酸性强于氢硫酸B.多元弱酸的酸性主要由第一步电离决定C.常温下,加水稀释醋酸,c(CH3COO-)c(CH3COOH)·c(OH-)增大D.向弱酸溶液中加少量NaOH溶液,电离平衡常数不变3.某温度时,卤化银(AgX,X=Cl、Br、I)的3条溶解平衡曲线如图所示,AgCl、AgBr、AgI的K sp依次减小。
已知pAg=-lg c(Ag+),pX=-lg c(X-),利用pX、pAg的坐标系可表示出AgX的浓度积与溶液中c(Ag+)和c(X-)的相互关系。
下列说法错误的是()A.A线是AgCl的溶解平衡曲线B.坐标点p形成的溶液是AgCl的不饱和溶液C.m点可以是在水中加入足量的AgBr形成的饱和溶液D.n点表示由过量的KI与AgNO3反应产生AgI沉淀4.下列说法错误的是()A.除去MgCl2溶液中少量的FeCl3,可选用MgCO3B.等物质的量浓度的(NH4)2SO4溶液和(NH4)2CO3溶液中NH4+的浓度前者大于后者C.在NaHS溶液中,滴入少量CuCl2溶液,产生黑色沉淀,HS-的水解程度增大,pH增大D.用饱和氯化铵溶液可以清洗金属表面的锈迹5.25 ℃时,几种弱酸的电离平衡常数如表所示,下列说法正确的是()化学式HCOOH H2CO3HCN电离平衡常数K=1.8×10-4K1=4.3×10-7K2=5.6×10-11K=4.9×10-10 A.H2CO3溶液和NaCN溶液反应的离子方程式为H2CO3+CN-===HCO-3+HCN B.HCOOH的电离平衡常数表达式为K=c(HCOOH)/[c(HCOO-)·c(H+)]C.Na2CO3溶液显碱性,NaHCO3溶液显酸性D.酸性强弱顺序是HCOOH>HCN>H2CO36.向湿法炼锌的电解液中同时加入Cu和CuSO4,可生成CuCl沉淀除去Cl-,降低对电解的影响,原理如下:Cu(s)+Cu2+(aq) 2Cu+(aq)ΔH1=a kJ·mol-1Cl-(aq)+Cu+(aq) CuCl(s)ΔH2=b kJ·mol-1实验测得电解液pH对溶液中残留c(Cl-)的影响如图所示。
高考化学复习水溶液中的离子平衡专题练习(带答案)

高考化学复习水溶液中的离子平衡专题练习(带答案).50℃时,下列各溶液中,离子的物质的量浓度关系正确的是A.pH=4的醋酸中:c(H+)= 4.0molL-1B.饱和小苏打溶液中:c(Na+)= c(HCO3-)C.饱和食盐水中:c(Na+)+ c(H+)= c(Cl-)+c(OH-)D.pH=12的纯碱溶液中:c(OH-)= 1.010-2molL-1.常温下,0.2 molL-1的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组成及浓度如图所示,下列说法正确的是( )A.HA为强酸B.该混合液pH=7C.图中X表示HA,Y表示OH-,Z表示H+D.该混合溶液中:c(A-)+c(Y)=c(Na+).对于常温下pH=pH=3的醋酸,下列说法正确的是()A.pH=c(H+)=c(-) + c(OH-)B.pH=3的醋酸c(H+)= molL-1C.pH=pH=3的醋酸D.pH=3的醋酸与pH=11的NaOH溶液等体积混合所得溶液中:c(Na+)=c(CH3COO-).对于常温下0.1 molL-1氨水和0.1 molL-1醋酸,下列说法正确的是()A.0.1 molL-1氨水,溶液的pH=13B.0.1 molL-1氨水加水稀释,溶液中c(H+)和c(OH-)都减小C.0.1 molL-1醋酸溶液中:c(H+)=c(CH3COO-)D.0.1 molL-1醋酸与0.1 molL-1NaOH溶液等体积混合所得溶液中:c(Na+)c(CH3COO-)c(OH-)c(H+).室温下,将一元酸HA溶液和NaOH溶液等体积混合,实验数据如表:实验编号起始浓度c(HA) 起始浓度c(NaOH) 反应后溶液的pH ① 0.1 molL-1 0.1 molL-1 9 ② x 0.2molL-1 7 下列说法正确的是()A.实验①反应前HA溶液中c(H+)=c(OH-)+ c(A-)B.实验①反应后溶液中c(A-)c(Na +)C.实验②反应前HA溶液浓度x0.2 molL-1D.实验②反应后溶液中c(A-)+ c(HA)= c(Na+).HF为一元弱酸,在0.1molL-1 NaF溶液中,离子浓度关系正确的是A.c(Na+)c(F-)c(H+)c(OH-)B.c(Na+)c(OH-)c(F-)c(H+)C.c(Na+) + c(OH-)=c(F-) + c(H+)D.c(Na+) + c(H+)=c(F-) + c(OH-).今有室温下四种溶液,有关叙述正确的是()① ② ③ ④ pH 11 11 3 3 溶液氨水氢氧化钠溶液醋酸盐酸 A.分别加水稀释10倍,四种溶液的pH ①④③B.①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小C.①、④两溶液等体积混合,所得溶液中c(NH4+)c(Cl-)c(H+)c(OH-)D.V aL ④与VbL ②溶液混合后,若混合后溶液pH=4则Va ∶Vb= 9∶11.关于0.1 molL-1 NH4Cl溶液,下列说法正确的是()A.c(Cl-)c(H+)c(NH4+)c(OH-)B.c(H+)=c(NH3H2O)+ c(OH-)C.加水稀释,溶液中所有离子的浓度均减小D.向溶液中加入少量CH3COONa固体,NH4+的水解程度增大2.对常温下0.1mo1/L的醋酸溶液,以下说法正确的是()A.由水电离出来的c(H+)=1.01013mo1/LB. c(CH3COOH)c(H+)c(CH3COOc(OH)C.与同浓度的盐酸分别加水稀释10倍:pH(醋酸)pH (盐酸)D.与等浓度等体积NaOH溶液反应后的溶液中:c(CH3COOH)+c(CH3COOˉ)=0.1mo1/L3.已知醋酸、醋酸根离子在溶液中存在下列平衡及其对应的平衡常数常温下,将等体积、等物质的量浓度的醋酸和醋酸钠溶液混合,下列叙述正确的是()A 对混合溶液进行微热,K1增大、K2减小B 混合溶液PH7C 混合溶液中c(CH3COOc(Na+)D 温度不变,若在混合溶液中加入少量NaOH固体,c(CH3COO)减小.下列关于电解质溶液的叙述正确的是()A.常温下,Na2CO3溶液的pH7B.0.1mol/L Na2CO3溶液在35℃时碱性比25℃强,说明该水解反应是是放热反应C.常温下.pH=7的NH4Cl与氨水的混合溶液中各离子浓度的关系为:c(Cl-)=c(NH4+)c(H+)=c(OH一)D.常温下,中和pH与体积均相同的盐酸和醋酸,消耗NaOH 的物质的量相同.下列说法不正确的是()A.NaHCO3和Na2CO3混合溶液中:c(Na+)+c(H+)=c(OH-)+c(HCO) +2c(CO)B.常温下,浓度均为0.1 molL-1下列各溶液的pH:NaOHNa2CO3 NaHCO3 NH4ClC.向冰醋酸中逐滴加水,醋酸的电离程度、pH均先增大后减小D.常温下,pH=1的稀硫酸与醋酸溶液中,c (SO42-)与c(CH3COO-)之比为2∶1.常温下,Na2CO3溶液中有平衡:CO32-+H2OHCO3-+OH-下列说法正确的是:A.Na2CO3溶液中:c(Na+)c(CO32-)c(OH-)c(H+)B.加入NaOH固体,溶液pH减小C.Na2CO3溶液中:c(Na+)+c(H+)= 2c(CO32-)+c(OH-)D.升高温度平衡向正反应方向移动.下列各溶液的叙述中的是()A.等pH的硫酸与醋酸稀释后pH的变化如右图所示,则曲线Ⅱ表示的是醋酸的稀释图像B.溶有等物质的量的NaClO、NaHCO3的溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-)C.若NH4HCO3溶液、NH4HSO4溶液中c(NH4+)相等,则:c(NH4HSO4)D.已知某温度下Ksp(CH3COOAg) = 2.810-3,浓度均为0.1 molL-1的AgNO3溶液和CH3COONa溶液等体积混合一定能产生CH3COOAg沉淀.下列叙述正确的是()A.pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7B.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+c(CH3COOH)=2c(Na+)C.常温下,向NH4Cl溶液中加入氨水至溶液的pH=7,此时溶液中cNH4+)cC1-D.0.1molL-1NaHCO3溶液:c(Na+)c(HCO3-)c(OH-)c(H+) .已知:25 ℃时,CaCO3的Ksp=2.810-9,CaCO3在水中的溶解平衡曲线如右图所示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
水溶液中的离子平衡一、选择题1.如图曲线a和b是盐酸与氢氧化钠溶液相互滴定的滴定曲线,下列叙述正确的是() A.盐酸的物质的量浓度为1 mol·L-1B.P点时恰好完全中和,溶液呈中性C.曲线a是盐酸滴定氢氧化钠溶液的滴定曲线D.酚酞不能用作本实验的指示剂2.20 ℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(单位:g·L-1)如图所示。
下列叙述正确的是()A.盐酸浓度越大,K sp(PbCl2)越大B.PbCl2能与一定浓度的盐酸反应C.x、y两点对应的溶液中c(Pb2+)相等D.往含Pb2+的溶液中加入过量浓盐酸,可将Pb2+完全转化为PbCl2(s)3.常温下,二甲胺[(CH3)2NH·H2O]是一元弱碱,其电离常数K b=1.6×10-4。
10 mL c mol·L-1二甲胺溶液中滴加0.1 mol·L-1盐酸,混合溶液的温度与盐酸体积的关系如图所示。
下列说法不正确的是()A.二甲胺溶液的浓度为0.2 mol·L-1B.在Y和Z点之间某点溶液的pH=7C.Y点存在:c(Cl-)>c[(CH3)2NH+2]>c(H+)>c(OH-)D.常温下,(CH3)2NH2Cl的水解常数K h≈6×10-114.关于滴定实验的下列说法正确的是()A.在酸碱中和滴定过程中,眼睛应注视锥形瓶内溶液颜色的变化B.用NaOH标准溶液滴定未知浓度的盐酸,达到滴定终点时发现滴定管尖嘴部分有悬滴,会使测定结果偏小C.用KMnO4标准溶液滴定草酸时,KMnO4标准溶液盛装在碱式滴定管中D.所有的滴定实验都需要加入指示剂5.25 ℃时,将浓度均为0.1 mol/L、体积分别为V a和V b的HA溶液与BOH溶液按不同体积比混合,保持V a+V b=100 mL,V a、V b与混合液的pH的关系如图所示。
下列说法正确的是()A.由图可知BOH一定是强碱B.K a(HA)=1×10-6C.b点时,c(B+)=c(A-)=c(OH-)=c(H+)D.a→b过程中水的电离程度始终增大6.常温下,下列各溶液的叙述中正确的是()A.等物质的量的NaHSO3与Na2SO3混合溶液中:3c(Na+)=c(HSO-3)+c(SO2-3)B.20 mL 0.1 mol/L的醋酸钠溶液与10 mL 0.1 mol/L盐酸混合后溶液显酸性:c(CH3COO -)>c(CH3COOH)>c(Cl-)>c(H+)C.等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c(Na+)=c(SO2-4)>c(NH+4)>c(H +)>c(OH-)D.向 1.00 L 0.3 mol/L NaOH溶液中缓慢通入0.2 mol CO2气体,溶液中:c(Na +)>c(CO2-3)>c(HCO-3)>c(OH-)>c(H+)7.常温时,用0.10mol•L-1NaOH滴定25.00mL0.10mol•L-1某一元酸HX,滴定过程中pH 变化曲线如图所示。
下列说法正确的是A.HX溶液显酸性的原因是HX=H++X-B.点a,c(Na+)>c(X-)>c(HX)>c(H+)>c(OH-)C.点b,HX与NaOH恰好完全反应D.点c,c(X-)+c(HX)=0.050mol•L-18.某温度时,AgCl(s)Ag+(aq)+Cl−(aq)在水中的沉淀溶解平衡曲线如图所示。
下列说法正确的是()A.加入AgNO3,可以使溶液由c点变到d点B.c点对应的K等于a点对应的KC.d点没有AgCl沉淀生成D.加入少量水,平衡右移,Cl−浓度减小9.用已知浓度的盐酸滴定未知浓度的NaOH溶液,选用酚酞作指示剂,下列操作会导致测定结果偏低的是()A.酸式滴定管用蒸馏水洗后未用标准液润洗就装标准液滴定B.锥形瓶未用待测液润洗C.读取标准液读数时,滴前仰视,滴定到终点后俯视D.滴定前酸式滴定管尖嘴处有气泡未排除,滴定后气泡消失10.已知NaHSO4在水中的电离方程式为NaHSO4Na++H++S O42-。
某温度下,向c(H+)=1×10-6mol·L-1的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的c(H+)=1×10-2mol·L-1。
下列对该溶液的叙述不正确...的是()。
A.该温度高于25 ℃B.由水电离出的c(H+)=1×10-10 mol·L-1C.加入NaHSO4晶体抑制了水的电离D.取该溶液加水稀释100倍,溶液中的c(OH-)减小11.25 ℃时,NiS、FeS沉淀溶解平衡曲线如图所示(已知NiS的溶解度比FeS小,lg2=0.3),图中p(S2-)=-lg c(S2-)、p(M2+)=-lg c(M2+),M表示Ni或Fe。
下列说法不正确...的是()。
A.曲线①表示的是NiSB.d点分别对应的NiS和FeS的分散系均是均一、稳定的C.25 ℃时,FeS(s)+Ni2+(aq)NiS(s)+Fe2+(aq)的平衡常数K=4000D.向a点溶液中加入硫化钠,可变为b点溶液12.在一定条件下,相同pH的硫酸和硫酸铁溶液中由水电离出的c(H+)分别是 1.0×10-a mol·L-1和1.0×10-b mol·L-1,在此温度下,下列说法正确的是()。
A.a<bB.a=bC.水的离子积为1.0×10-(7+a)D.水的离子积为1.0×10-(b+a)二、解答题13.中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。
某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。
(1)仪器A的名称是________,水通入A的进口为________。
(2)B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为________________________________________________________________________。
(3)除去C中过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的________;若滴定终点时溶液的pH=8.8,则选择的指示剂为________;若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)________。
①=10 mL ②=40 mL③<10 mL ④>40 mL(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为________g·L-1。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施______________________________________________________________________________________________________________。
14.难溶电解质的沉淀溶解平衡及其溶度积在生产、科研等领域有着许多的应用。
(1)AgCl在水中存在沉淀溶解平衡:AgCl Ag++Cl-。
25 ℃时,AgCl的K sp(AgCl)=1.8×10-10。
现将足量AgCl分别加入下列四种溶液:①100 mL蒸馏水;②100 mL 0.1 mol·L-1盐酸;③100 mL 0.1 mol·L-1 AlCl3溶液;④100 mL 0.1 mol·L-1 MgCl2溶液。
充分搅拌后,相同温度下,Ag+浓度由大到小的顺序是____________(填序号)。
在0.1 mol·L-1 AlCl3溶液中,Ag+的浓度最大可达到________mol·L-1。
(2)25 ℃时,1 L水中约能溶解2.4×10-3 g BaSO4。
①试计算25 ℃时BaSO4的溶度积常数:K sp(BaSO4)=________;运用题中所给数据,经计算回答下列②③两小题:②当人体中Ba2+浓度达到2×10-3mol·L-1时会影响健康,那么BaSO4能作钡餐的原因是______________________________________;③在25 ℃时,1 L水中约能溶解0.018 g BaCO3,且胃液是酸性的,BaCO3不能代替BaSO4作为钡餐的理由是__________________。
(3)锅炉水垢会降低燃料利用率,还会形成安全隐患,因此要定期除去锅炉水垢。
水垢中含有CaSO4[K sp(CaSO4)=7.1×10-5],若用1 mol·L-1碳酸钠溶液处理,能使之转化为疏松、易溶于酸的CaCO3[K sp(CaCO3)=4.96×10-9],试利用K sp计算反应的平衡常数说明这一转化的原理。
_______________________________________________________________________________ _______________________________________________________________________________ ________________________________________________。
参考答案一、选择题题号123456789101112答案B B B A D C D B C D D D二、解答题13.(1)冷凝管 b (2)SO 2+H 2O 2===H 2SO 4 (3)③ 酚酞 ④ (4)0.24(5)原因:盐酸的挥发;改进措施:用不挥发的强酸如硫酸代替盐酸,或用蒸馏水代替葡萄酒进行对比实验,消除盐酸挥发的影响解析 (1)A 仪器的名称为冷凝管;为使冷却效果好,应将冷却水从处于低处的b 口通入。
(2)SO 2具有强还原性,H 2O 2具有强氧化性,二者发生氧化还原反应:SO 2+H 2O 2===H 2SO 4。
(3)NaOH 盛装在碱式滴定管中,应将橡皮管向上弯曲以排出气泡,选③。
滴定至终点时溶液的pH =8.8,在酚酞的变色范围内,故可选用酚酞作指示剂。
液面在10 mL 时滴定管中有刻度的液体为40 mL ,因滴定管的下端有一段无刻度,故管内液体的体积大于40 mL 。
