2019年高考化学三轮复习选择题定时练(十)
2019高考化学一轮复习选训习题(10)(含解析)新人教版

亲爱的同学:这份试卷将再次记录你的自信、沉着、智慧和收获,我们一直投给你信任的目光……人教化学2019高考一轮选训习题(10)李仕才一、选择题1、下列有关金属的工业制法中,正确的是( B )A .制钠:用海水制得精盐,再电解纯净的NaCl 溶液B .制铁:用CO 还原铁矿石得铁C .制镁:用海水经一系列过程制得氧化镁固体,再用H 2还原得镁D .制铝:从铝土矿中获得氧化铝再得到氯化铝固体,电解熔融的氯化铝得到铝解析 电解法制取金属钠时,需要电解熔融的NaCl ,而不是其溶液,A 项错误;镁的还原性很强,不能用热还原法来制取,而应用电解熔融氯化镁的方法,C 项错误;熔融的氯化铝不导电,故不能电解其熔融物制取金属铝,而应电解熔融的氧化铝,D 项错误。
2、下列溶液中溶质的物质的量浓度为1 mol·L -1的是( B )A .将58.5 g NaCl 溶于1 L 水中配成的溶液B .将80 g SO 3溶于水并配成1 L 溶液C .将100 mL 0.5 mol·L -1的NaNO 3溶液加热蒸发掉50 g 水的溶液D .含K +为2 mol 的K 2SO 4溶液3、新型纳米材料氧缺位铁酸盐(MFe 2O x :3<x <4,M =Mn 、Co 、Zn 或Ni ,在该盐中均显+2价)由铁酸盐(MFe 2O 4)经高温与氢气反应制得,常温下,它能使工业废气中的氧化物(SO 2、NO 2等)转化为其单质除去,转化流程如图。
关于此转化过程的叙述不正确的是( C )A .MFe 2O 4在与H 2的反应中表现了氧化性B .MFe 2O 4与MFe 2O x 的相互转化反应均属于氧化还原反应C .MFe 2O x 与SO 2反应中MFe 2O x 被还原D .若4 mol MFe 2O x 与1 mol SO 2恰好完全反应,则MFe 2O x 中x 的值为3.5解析 MFe 2O 4在与H 2的反应中,Fe 元素的化合价降低,表现了氧化性,A 项正确;MFe 2O 4与MFe 2O x 的相互转化反应中有元素化合价的升降,属于氧化还原反应,B 项正确;MFe 2O x 与SO 2反应中,Fe 元素的化合价升高,MFe 2O x 被氧化,C 项错误;若4 mol MFe 2O x 与1 mol SO 2恰好完全反应,由电子守恒可知,4 mol×2×(3-2x -22)=1 mol×(4-0),解得x =3.5,D 项正确。
2019年高考化学选择题复习试题及答案全套.docx

最新2019年高考化学选择题复习试题及答案全套(共8套)(人教版)化学2019高考一轮练练题:选择题(1)含答案1、多年前,世界卫生组织把铝确定为食品的污染源之一而加以控制使用。
铝在下列应用中应加以控制的是()①制铝合金②制电线③制炊具④制银色漆颜料⑤用明矶净水⑥用明矶与苏打作食品膨松剂⑦制易拉罐⑧用氢氧化铝凝胶制胃舒平药品⑨包装糖果和食品A.③⑤⑧⑨B.②⑥⑧⑨C.③④⑤⑨D.③⑤⑥⑦⑧⑨解析解答本题时,要抓住题中的“把铝确定为食品的污染源之一”与“控制使用”。
D 项符合题意。
答案D2、(2017- 0喀则一中月考)已知:C(s)+H2O(g)===CO(g)+出@) A^akJ-mor12C(S)+O2(g)===2CO(g) AH= -220 kJ-mol1H—H 键、O=O 键和O—H 键的键能分别为436 kJ-mol"1.496 kJ-mol-1和462 kJ-mol1, 则a为()A.—332 B・—118C・ +350 D・ +130解析根据盖斯定律,由第一个反应X2—第二个反应得,2H2O(g)=O2(g)+2出@) AH = (2a+220)kJ ・molT。
根据反应热与键能的关系计算,则2a+220 = 4X462-(436X2+496), 解得a= + 130。
本题选D。
答案D3、(2017-新余市第一中学高三高考全真模拟考试)常温下,取pH = 2的两种二元酸H2A与H2B 各lmL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是()A.H2A 为二元弱酸,稀释前c(H2A) = 0.005 mol-L_1B.NaHA 水溶液中:c(Na+) + c(H+)= 2c(A2-) + c(OH「)C.含等物质的量的NaHA、NaHB的混合溶液中:c(Na+)= c(A2^) + c(B^)+c(HB「)D.pH=10 的NaHB 溶液中,离子浓度大小:c(Na+)>c(HB )>c(OH )>c(B2 )>c(H2B)答案B解析pH = 2的H2A稀释100倍时溶液的pH变为4,说明该酸完全电离,所以为强酸,A错误;根据电荷守恒可知NaHA水溶液中:c(Na+) + c(H+)= 2c(A2_) + c(OH"), B正确;根据物料守恒可知含等物质的量的NaHA、NaHB的混合溶液中:c(Na+) = c(A2_) + c(B2_) + c(HB_) + C(H2B), C错误;pH = 10的NaHB 溶液显碱性,说明HB「的电离程度小于水解程度,离子浓度大小:c(Na+)>c(HB_)>c(OH_)>c(H2B)>c(B2_),D 错误;答案选B。
2019年高考化学三轮冲刺练习(10-6)

2019年高考——化学三轮冲刺练习(6)可能用到的相对原子质量:H-1Li-7C-12N-14O-16Na-23Al-27S-32Cl-35.5 K-39Ca-40Fe-56Cu-64Zn-65一、选择题(本题共7小题,每小题6分,共42分。
在每小题给出的四个选项中,只有一项是符合题目要求的)1.化学在生活中有着广泛的应用,下列对应关系错误的是()2.中国传统文化对人类文明贡献巨大,古代文献中充分记载了古代化学研究成果。
我国晋代《抱朴子》中描述了大量的化学反应,其中有:①“丹砂(HgS)烧之成水银,积变又还成丹砂”;②“以曾青涂铁,铁赤色如铜”。
下列有关叙述正确的是()A.①中水银“积变又还成丹砂”说明水银发生了还原反应B.②中反应的离子方程式为2Fe+3Cu2+2Fe3++3CuC.根据①可知温度计打破后可以用硫粉覆盖水银,防止中毒D.水银能跟曾青发生置换反应生成单质铜3.下列实验操作能达到实验目的的是()4.下列各选项中符合条件的同分异构体种类最多的是(均不考虑立体异构)()A.异丁烷的二氯代物B.分子式为C6H14的有机物C.甲酸正丙酯属于酯的同分异构体D.分子式为C5H10O2并能与饱和NaHCO3溶液反应放出气体的有机物5.根据反应2Cr+2H+Cr2+H2O,拟用惰性电极电解Na2CrO4溶液制取Na2Cr2O7溶液的装置示意图(c为离子交换膜)如图D6-1所示,下列说法错误的是()图D6-1A.a极应连接电源负极B.b极反应的电极反应式为2H2O-4e-O2↑+4H+C.装置中应选择阳离子交换膜D.反应中有2 mol电子转移时会生成1 mol Cr26.X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Z元素形成的单质。
已知:甲+乙→丁+己,甲+丙→戊+己;25 ℃时,0.1 mol·L-1丁溶液的pH为13。
2019届高考化学(选考)三轮冲刺仿真模拟训练(三)(含参考答案)

2019届高考化学(选考)三轮冲刺仿真模拟训练(三)考生注意:1.本试卷分选择题和非选择题两部分,共4页,其中加试题部分为30分,用【加试题】标出。
2.答卷前,考生务必用蓝、黑色字迹的钢笔或圆珠笔将自己的姓名、班级、学号填写在相应位置上。
3.本次考试时间90分钟,满分100分。
可能用到的相对原子质量:H1 Li7 Be9 C12 N14 O16 Na23 Mg24 Al27 Si28 S32 Cl35.5 K39 Ca40 Fe56 Cu64 Ag108 Ba137选择题部分一、选择题(本大题共25小题,每小题2分,共50分。
每小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)1、每年3月22日为“世界水日”。
下列有关“废水”的处理正确的是( ) A.工业废水无需处理,直接用于农业灌溉B.废水经氯气消毒后,即可安全再利用C.寻找方式来减少和再利用废水可节约水资源D.收集和处理废水,弊大于利2、下列物质属于纯净物的是( )A.冰水混合物B.汽油C.漂白粉D.水玻璃3、下列可用于分离不互溶液体混合物的仪器是( )4、下列既不属于电解质也不属于非电解质的是( ) A .液溴 B .一水合氨 C .硫化氢D .二氧化氯5、下列物质的水溶液因水解而呈碱性的是( ) A .硫酸氢钠 B .氯气 C .硫化钠 D .明矾6、下列分散系属于胶体的是( ) A .纳米银 B .生理盐水 C .蛋白质溶液D .蔗糖溶液7.下列属于氧化还原反应的是( ) A .2NaHCO 3=====△Na 2CO 3+H 2O +CO 2↑ B .(NH 4)2SO 4+BaCl 2===BaSO 4↓+2NH 4Cl C .CaO +H 2O===Ca(OH)2 D .Cl 2+H 2OHCl +HClO8.下列有关化学用语的表示,正确的是( ) A .氨基(—NH 2)的电子式:B .钾离子的结构示意图:C .二氧化碳分子的比例模型:D.碳酸电离的方程式:H 2CO3CO2-3+2H+9.手机芯片是一种在半导体材料上集合多种电子元器件的电路模块。
2019年高考化学三轮冲刺练习(10-2)

2019年高考——化学三轮冲刺练习(2)可能用到的相对原子质量:H-1Li-7Be-9C-12N-14O-16Na-23Al-27S-32一、选择题(本题共7小题,每小题6分,共42分。
在每小题给出的四个选项中,只有一项是符合题目要求的)1.下列变化过程不涉及化学反应的是()A.陶瓷的烧制B.活字印刷排版术C.鞭炮和烟花的燃放D.后母戊鼎表面出现铜绿2.用H2O2溶液处理含NaCN的废水的反应原理为NaCN+H2O2+H2O NaHCO3+NH3,已知HCN 酸性比H2CO3弱。
下列有关说法正确的是()A.该反应中氮元素被氧化B.该反应中H2O2作还原剂C.实验室配制NaCN溶液时,需加入适量的NaOH溶液D.0.1 mol·L-1 NaCN溶液中含HCN和CN-总数目为0.1×6.02×10233.下列操作或装置能达到实验目的的是()B.A.收集NO2并防止其污染环境称取一定量的NaOHC.检验浓硫酸与铜反应后的产物中是否含有铜离子D.制取NaHCO3图D2-14.下列有关离子方程式书写或离子共存说法正确的是()A.在0.1 mol·L-1 Na2CO3溶液中:Al3+、N、S、N一定能大量共存B.常温下,=0.1 mol·L-1的溶液中,下列离子一定能大量共存:K+、Cl-、Fe2+、NC.清洗锅炉时先用纯碱溶液浸泡的主要原因:CaSO4(s)+C(aq)S(aq)+CaCO3(s)D.向Al2(SO4)3溶液中加入少量Ba(OH)2溶液:Ba2++S+Al3++3OH-BaSO4↓+Al(OH)3↓5.一种以NaBH4和H2O2为原料的新型电池的工作原理如图D2-2所示。
下列说法错误的是()图D2-2A.电池的正极反应为H2O2+2e-2OH-B.电池放电时Na+从a极区移向b极区C.电子从电极b经外电路流向电极aD.b极室的输出液经处理后可输入a极室循环利用6.分子式为C9H18O2的有机物A有如图D2-3所示转化关系。
2019届苏教版高中化学高考三轮冲刺复习综合测试卷I(含答案)

2019届苏教版高中化学高考三轮冲刺复习综合测试卷I一、单选题(共15小题)1.(多选)我国化学家侯德榜创立了著名的“侯氏制碱法”(流程简图如图),促进了世界制碱技术的发展.下列有关说法正确的是( )A.沉淀池中的反应物共含有六种元素B.过滤得到的“母液”中一定含有两种溶质C.图中X可能是氨气D.通入氨气的作用是使溶液呈碱性,促进二氧化碳的吸收,更多地析出沉淀2.在一个不导热的密闭反应器中,只发生两个反应:a(g)+b(g)2c(g);∆H<0x(g)+3y(g)2z(g);∆H>0进行相关操作且达到平衡后(忽略体积改变所做的功),下列叙述错误的是( )A.等压时,通入惰性气体,c的物质的量不变B.等压时,通入x气体,反应器中温度升高C.等容时,通入惰性气体,各反应速率不变D.等容时,通入x气体,y的物质的量浓度增大3.化学键使得一百多种元素构成了世界的万物。
关于化学键的下列叙述中,正确的是()A.离子化合物中一定含有共价键,共价化合物中不含离子键B.共价化合物中可能含离子键,离子化合物中只含离子键C.构成单质分子的粒子一定含有共价键D.在氧化钠中,除氧离子和钠离子的静电吸引作用外,还存在电子与电子、原子核与原子核之间的排斥作用4.下列浓度关系正确的是()A.氯水中:c(Cl2)=2[c(ClO-)+c(Cl-)+c(HClO)]B.氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-)C.等体积等浓度的氢氧化钠与醋酸混合:c(Na+)=c(CH3COO-)D. Na2CO3溶液中:c(Na+)>c(CO)>c(OH-)>c(HCO)>c(H+)5.下列关于有机物的判断错误的是()A.乙烯和苯使溴水褪色的原理不同B.乙醇、乙酸都能和金属钠反应C. C2H6O只代表一种物质D.淀粉和纤维素都可作为工业上生产葡萄糖的原料6.下图装置可用来监测空气中NO的含量,下列说法错误的是()A.外电路中电流由Pt电极流向NiO电极B. Pt电极上发生的是还原反应C. NiO电极的电极反应式为NO+O2--2e-====NO2D.每流经1 m3空气(假设NO被完全吸收),转移电子的物质的量为2×10-7mol,则该空气中NO的含量约为3×10-2mg·m-37.短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,乙位于第ⅤA族,甲与丙同主族,丁原子最外层电子数与电子层数相等,则()A.原子半径:丙>丁>乙B.单质的还原性:丁>丙>甲C.甲、乙、丙的氧化物均为共价化合物D.乙、丙、丁的最高价氧化物对应的水化物不能相互反应8.下列说法正确的是()A.在炽热碎瓷片的作用下,石蜡油分解产生了可以使酸性高锰酸钾溶液褪色的乙烯B.葡萄糖遇碘水会变蓝,油脂是产生能量最高的营养物质C.煤经过气化和液化等物理变化可以转化为清洁燃料D.甲苯能与溴水反生化学反应,乙醇不能发生加成反应9.把3体积NO2气体依次通过①饱和NaHCO3溶液;②浓硫酸;③Na2O2后(假设每一步的反应都是充分的),再用排水法收集残留气体,则收集到的气体是 ()。
2019年高考化学三轮冲刺练习(10-1)

2019年高考——化学三轮冲刺练习(1)可能用到的相对原子质量:H-1Li-7C-12N-14O-16Na-23Al-27S-32Cl-35.5 K-39Ca-40Fe-56Cu-64Zn-65Sn-118.7一、选择题(本题共7小题,每小题6分,共42分。
在每小题给出的四个选项中,只有一项是符合题目要求的)1.明朝《菽园杂记》有海水提取食盐的记载:“烧草为灰,布在摊场,然后以海水渍之,俟晒结浮白,扫而复淋”。
该过程中“灰”的作用是()A.萃取B.吸附C.结晶D.蒸发2.设N A为阿伏伽德罗常数的值。
下列说法正确的是()A.5.6 g铁与足量稀硝酸反应,转移电子的数目为0.2N AB.标准状况下,22.4 L二氯甲烷的分子数约为N AC.8.8 g乙酸乙酯中含共用电子对数为1.4N AD.1 L 0.1 mol·L-1氯化铜溶液中铜离子数为0.1N A3.薄荷醇的结构简式如下,下列说法正确的是()A.薄荷醇属于芳香烃的含氧衍生物B.薄荷醇分子式为C10H20O,它是环己醇的同系物C.薄荷醇环上的一氯取代物只有三种D.在一定条件下,薄荷醇能与氢气、溴水反应4.X、Y、Z、M是四种原子序数依次增大的主族元素。
已知X、Y、Z是短周期中的三种非金属元素,X元素原子的核外电子数等于其周期序数;Y原子的最外层电子数是内层电子数的2倍;Z单质为无色气体,性质稳定,常用作保护气;M是地壳中含量最高的金属元素。
下列说法正确的是()A.四种元素的原子半径从大到小的顺序是M>Z>Y>XB.元素X、Z可形成某种化合物,其分子内既含极性键又含非极性键C.化合物YO2、ZO2都能和氢氧化钠溶液反应,均属于酸性氧化物D.金属M制品具有较强的抗腐蚀能力,说明M元素的金属活动性较差5.海水资源开发利用的部分过程如图D1-1所示:图D1-1下列说法错误的是()A.海水淡化的常用方法有蒸馏法、电渗析法和离子交换法B.可通过分液的方法分离溴单质和苯的混合物C.“提纯”时,所加试剂可依次为BaCl2、NaOH、Na2CO3、盐酸D.精盐、NH3和CO2是侯德榜制碱工业的主要原料6.以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理如图D1-2。
2019年高考化学三轮冲刺练习(10-4)

2019年高考——化学三轮冲刺练习(4)可能用到的相对原子质量:H-1Li-7C-12N-14O-16Na-23Al-27S-32Cl-35.5 K-39Ca-40Fe-56Cu-64Zn-65一、选择题(本题共7小题,每小题6分,共42分。
在每小题给出的四个选项中,只有一项是符合题目要求的)1.化学在生产和日常生活中有着重要的作用,下列说法错误的是()A.过氧化氢、次氯酸钠等消毒液的消毒原理都是利用其强氧化性B.丝绸的主要成分是蛋白质,蛋白质是天然高分子化合物C.利用粮食酿酒经过了淀粉→葡萄糖→乙醇的化学变化过程D.日常生活中常用汽油去除衣物上的油污,用热的纯碱溶液洗涤炊具上的油污,二者的原理完全相同2.如图D4-1所示是常见四种有机物的比例模型示意图,下列说法中正确的是()图D4-1A.甲是甲烷,能使酸性KMnO4溶液褪色B.乙是乙烯,可与溴水发生取代反应使溴水褪色C.丙是苯,在空气中燃烧时产生带有浓烟的火焰D.丁是乙酸,一定条件下可与乙醇发生取代反应3.某化学兴趣小组进行了有关Cu、硝酸、硫酸化学性质的实验,实验过程如图D4-2所示。
下列有关说法正确的是()图D4-2A.实验步骤①中溶液呈蓝色,试管口有红棕色气体产生,说明稀硝酸被Cu还原为NO2B.实验步骤③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强C.实验步骤③发生反应的化学方程式为3Cu+Cu(NO3)2+4H2SO44CuSO4+2NO↑+4H2OD.由上述实验可得出结论:Cu在常温下既可以和稀硝酸反应,也可以和稀硫酸反应4.锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景。
如图D4-3所示,该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O2Cu+2Li++2OH-,下列说法错误的是()图D4-3A.正极附近溶液的pH增大B.负极的电极反应式为Li-e-Li+C.Li+透过固体电解质向Cu极移动D.当电路中通过0.2 mol电子时,正极上生成6.4 g Cu5.短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的质子数为1,Y的最外层电子数是内层电子数的2倍,Z的原子序数等于X和Y的原子序数之和,W 在自然界中既有游离态又有化合态,Q是短周期主族元素中原子半径最大的元素。
2019高考化学一轮复习训练选10含解析新人教版.docx
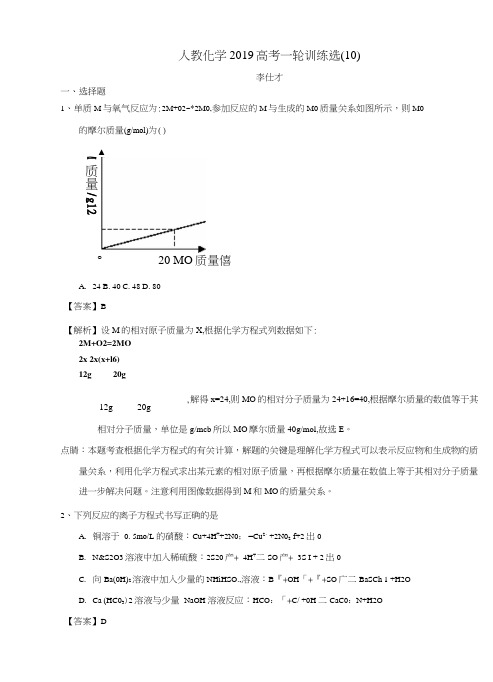
人教化学2019高考一轮训练选(10)李仕才一、选择题1、单质M 与氧气反应为:2M+02~*2M0,参加反应的M 与生成的M0质量关系如图所示,则M0的摩尔质量(g/mol)为()° 20 MO 质量僖A. 24B. 40C. 48D. 80【答案】B【解析】设M 的相对原子质量为X,根据化学方程式列数据如下:2M+O2=2MO2x 2x(x+l6)12g 20g,解得x=24,则MO 的相对分子质量为24+16=40,根据摩尔质量的数值等于其 相对分子质量,单位是g/mcb 所以MO 摩尔质量40g/mol,故选E 。
点睛:本题考查根据化学方程式的有关计算,解题的关键是理解化学方程式可以表示反应物和生成物的质量关系,利用化学方程式求出某元素的相对原子质量,再根据摩尔质量在数值上等于其相对分子质量 进一步解决问题。
注意利用图像数据得到M 和MO 的质量关系。
2、下列反应的离子方程式书写正确的是A. 铜溶于 0. 5mo/L 的硝酸:Cu+4H ++2N0; =Cu 2,+2N02 f+2出0 B. N&S2O3溶液中加入稀硫酸:2S20产+ 4H +二SO 产+ 3S I + 2出0C. 向Ba(0H)2溶液中加入少量的NHiHSO.,溶液:B 『+OH 「+『+SO 广二BaSCh 1 +H2OD. Ca (HC03)2溶液与少量 NaOH 溶液反应:HCO :「+C/ +0H 二CaC0:N+H2O【答案】DM质量/g12 12g 20g ▲【解析】铜濬于0. 5mo/L 的硝酸生成NO,离子方程式是3Cu+8FT+2N8 =3Cu 尹+2NO | +4曲0,故A 错 误;N H 2S 2O3滚'液中加入稀硫酸,+2价S 发生歧化反应2生成S 单质、S6气体,反应离子方程式是 S2O 产+ 2rf=S6 t +S | +H2O,故B 错误;向Ba (OH) 2溶液中加入少量的NHiHSd 溶液,反应离子方程式是 Ba 2>+2OH-+fT+SO42 +NH4-=BaSO41 +股6 NH 3 - H 2O ,故 C 错误:Ca (HCO3) 2 滚滋与少量 NaOH 溶液反应生成碳酸钙、碳酸氢钠、水,反应离子方程式是:HCCWhf 二CaCO 昇+HX ),故D 正确。
2019高考化学一轮训练学题(10)(含解析)新人教版

亲爱的同学:这份试卷将再次记录你的自信、沉着、智慧和收获,我们一直投给你信任的目光……人教化学2019高考一轮训练学题(10)李仕才一、选择题1、短周期主族元素X、Y、Z、W的原子序数依次增大。
四种元素形成的单质依次为m、n、p、q;这些元素组成的二元化合物r、t、u,其中u能使品红溶液退色,v的俗名叫烧碱。
上述物质的转化关系如图所示。
下列说法正确..的是( )A.原子半径的大小:W>Z>Y>XB.t与r反应时,r为氧化剂C.生活中可用u使食物增白D.Z分别与Y、W组成的化合物中化学健类型可能相同【参考答案】D、如图所示为.发生的反应可表示为:+的分解速率为0.1 mol·L-1·min.开始时,正逆反应同时开始物,根据浓度的变化量可以确定反应为+=0.1 mol·L-1·min-1,Bmin时,A、B、C的浓度分别为3、某反应过程中能量变化如图所示,下列有关叙述正确的是( )A.该反应为放热反应B.催化剂改变了化学反应的热效应C.催化剂不改变化学反应过程D.催化剂改变了化学反应速率解析:A项,反应物总能量低于生成物总能量应为吸热反应;催化剂降低反应所需活化能,改变反应过程,改变化学反应速率,但热效应不变,所以D正确。
答案:D4、常温下,稀释0.1 mol·L-1NH4Cl溶液,如图中的横坐标表示加水的量,则纵坐标可以表示的是( )A.NH+4水解的平衡常数B.溶液的pHC.溶液中NH+4数D.溶液中c(NH+4)解析:NH+4水解的平衡常数不变,A项不符合题意;NH4Cl水解呈酸性,加水稀释,水解程度增大,但酸性减弱,溶液的pH将增大,溶液中NH+4数将减小,c(NH+4)也减小,故C、D两项均不符合题意。
答案:B5、下列实验装置进行的相应实验,能达到实验目的的是( )A.装置甲可用于完成酸碱中和滴定实验B.装置乙可用于收集和吸收氨气C.装置丙可用于除去Cl2中混有的HCl气体D.装置丁可分离CH3COOC2H5和饱和碳酸钠溶液解析:NaOH 溶液应盛装在碱式滴定管中,题给是酸式滴定管,A 项错误;NH 3的密度小于空气,应短进长出,B 项错误;HCl 与NaHCO 3反应生成CO 2,引入新杂质,C 项错误;CH 3COOC 2H 5与饱和碳酸钠溶液分层,用分液的方法分离,D 项正确。
山东省2019年高三下学期三轮冲刺模拟理综试题化学试卷(Word版含答案)

2019高考模拟化学试题第I卷(必做题,共126分)注意事项:1.每小题选出答案后,用2B铅笔把答题卡上对应的答案标号涂黑。
如需改动,用橡皮擦干净以后,再涂写其他答案标号。
只答在试卷上不得分。
2.第I卷共21道小题,每小题6分,共126分。
以下数据可供答题时参考:相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl35.5 Cu 64 Br 80一、选择题(本题包括13道小题,每小题只有一个选项符合题意)7. 化学与人类社会生产、生活密切相关,下列说法正确的是()A.误食重金属盐引起人体中毒,可喝大量的食盐水解毒B.光纤通信使用的光缆主要成分是Si,太阳能电池使用的材料主要是SiO2C.陶瓷、砖瓦、玻璃、水泥等,都是硅酸盐产品D.钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀8.N A代表阿伏加德罗常数的数值,下列说法正确的是( )A. 标况下,2.24LNO2分子总数小于0.1N AB. 标准状况下2.24L氯气与水充分反应转移电子数为0.1N AC. 标准状况下2.24L的CCl4中含有的C—Cl键数为0.4N AD. 6.8g液态KHSO4中含有0.1N A个阳离子9.X、Y、Z、W为四种短周期主族元素,且原子序数依次递增,其中X、Z同族,Y是短周期主族元素中原子半径最大的,X原子最外层电子数是核外电子层数的3倍,下列说法正确的是A.因为X的氢化物分子间有氢键,所以X的氢化物较Z的氢化物稳定B.Y、Z、W单核离子均能破坏水的电离平衡C .W元素氧化物对应水化物的酸性一定强于ZD.南X、Y、Z三种元素组成的化合物不止2种10.屠呦呦1971年发现、分离、提纯并用于治疟新药“青蒿素”,拯救了数千万人的生命。
青蒿素分子结构如图。
下列说法错误的是A.青蒿素的分子式为C15 H22O5B.青蒿素是芳香族化合物C.青蒿素可以发生水解反直D.青蒿素不能使酸性KMnO4溶液褪色11.下列有关实验的操作、现象及结论解析都没有科学性错误的是12.我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应H2S+O2==H2O2+S。
2019年普通高等学校招生全国统一考试化学全国Ⅲ卷(解析版)

2019年普通高等学校招生全国统一考试全国Ⅲ卷(解析版)可能用到的相对原子质量:H—1C—12N—14O—16Mg—24P—31S—32 Mn—55Fe—56一、选择题:本题共7小题,每小题6分,共42分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
7.化学与生活密切相关。
下列叙述错误的是()A.高纯硅可用于制作光感电池B.铝合金大量用于高铁建设C.活性炭具有除异味和杀菌作用D.碘酒可用于皮肤外用消毒【命题意图】本题考查化学与生活,考查的核心素养是科学态度与社会责任。
解析:选C。
利用高纯硅的半导体性能,可制造光感电池,A正确;铝合金具有质地轻、强度高、抗腐蚀能力强等特点,可用于制造高铁车厢等,B正确;活性炭具有吸附作用,能除去异味,但没有杀菌消毒能力,C错误;碘酒能使蛋白质变性,可用于皮肤外用消毒,D 正确。
8.下列化合物的分子中,所有原子可能共平面的是()A.甲苯B.乙烷C.丙炔D.1,3丁二烯【命题意图】本题考查有机物的结构,考查的核心素养是宏观辨识与微观探析。
解析:选D。
A.甲苯中有甲基,根据甲烷的结构可知,甲苯分子中所有原子不可能在同一平面内;B.乙烷相当于2个甲基连接而成,根据甲烷的结构可知,乙烷分子中所有原子不可能在同一平面内;C.丙炔的结构简式为H3C—C≡CH,其中含有甲基,该分子中所有原子不可能在同一平面内;D.1,3丁二烯的结构简式为H2C===CH—CH===CH2,根据乙烯的结构可知,该分子中所有原子可能在同一平面内。
【方法总结】判断有机分子中的原子共面问题时,以甲烷、乙烯、苯、乙炔、甲醛等的结构为基础进行分析,甲烷分子中最多只有3个原子在同一平面内,所以只要分子中含有饱和碳原子,分子中所有原子不可能在同一平面内,乙烯分子中的6个原子、苯分子中的12个原子、乙炔分子中的4个原子、甲醛分子中的4个原子都在同一平面内。
9.X、Y、Z均为短周期主族元素,它们原子的最外层电子数之和为10。
2019年高考化学三轮冲刺练习(10-8)

2019年高考一一化学三轮冲刺练习(8)可能用到的相对原子质量:H-1 Li-7 C-12 N-14 O-16 Na-23 Al-27 P-31 S-32 Cl-35.5 K-39 Ca-40 Mn-55 Fe-56 Cu-64 Zn-65 Se-79一、选择题(本题共7小题,每小题6分,共42分。
在每小题给出的四个选项中,只有一项是符合题目要求的)1.化学与生活密切相关,下列说法正确的是()A.高纯度的硅单质广泛用于制作光导纤维8.绚丽缤纷的烟花中添加了含钾、钙、钠、铜等金属元素的化合物C汽车尾气中氮氧化物的产生主要是由于汽油中含有氮元素D.乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的9.下列关于有机化合物的说法错误的是()A.2,2-二甲基丙烷也称新戊烷B.由乙烯生成乙醇的反应属于加成反应C.分子式为C5H11CI的有机物共有8种(不含立体异构)D.糖类、油脂、蛋白质都可以发生水解反应10下列实验操作能达到目的的是()11图D8-1甲表示的是H2O2分解反应过程中的能量变化。
在不同温度下,分别向H2O2溶液(20 g L-1)中加入相同体积且物质的量浓度均为0.5 mol L-1的不同溶液,反应中H2O2浓度随时间的变化如图乙所示。
由图像变化得出的结论错误的是()A.H2O2的分解反应为放热反应B.断裂共价键所需的能量:2 XE(O-O)<1 XE(O= O)C.加入相同物质时,温度越高月2。
2分解的速率越快D.相同温度下,加入不同物质的溶液,碱性越强,H2O2分解的速率越快甲图 D8-1 5.A、B、C、D、E是五种短周期元素,A的某种原子失去一个电子后可形成一个质子,B的某种单质是自然界中最硬的物质,C的某种单质是生物呼吸必需的气体,D元素的K层和M层电子数相同正是短周期金属性最强的元素。
下列说法正确的是()A.C、D、E的简单离子半径由大到小的顺序是E>D>CB.含有E的盐溶液可能显酸性、可能显中性、也可能显碱性C.A和C形成的化合物中一定只有极性键D.BC2跟C、E形成的化合物发生的反应都是非氧化还原反应6.海水中含有大量 Na+、C「及少量Ca2+、Mg2+、S;,用电渗析法对该海水样品进行淡化处理如图D8-2所示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
选择题定时练(十)
7.化学与生活、社会发展息息相关。
下列说法错误的是
A.“霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
B.“用浓酒和糟入甑(蒸锅),蒸令气上,用器承滴露”涉及的操作是蒸馏
C.“世间丝、麻、裘皆具素质……”,这里丝、麻的主要成分是蛋白质
D.古剑“沈卢”以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金
8.N A代表阿伏加德罗常数的值。
下列说法正确的是
A.常温常压下,36g 18O2中所含的中子数为16N A
B.8.0g Cu2S和CuO的混合物中含有的铜原子数为0.1N A
C.电解饱和食盐水时,阳极生成22.4L气体时,转移的电子数为2N A
D.室温下向1L pH=1的醋酸溶液中加水,所得溶液中H+数目小于0.1N A
9.下列设计的实验方案不能达到实验目的的是
A.检验亚硫酸钠溶液是否变质:取少量溶液,向其中加入硝酸酸化的硝酸钡溶液
B.制取乙酸乙酯:向试管中加入碎瓷片,再依次加入3mL乙醇、2mL浓硫酸和2mL乙酸,用酒精灯加热,将产生的蒸气经导管通到饱和碳酸钠钠溶液的上方
C.除去溴化钠溶液中混有的碘化钠:向溶液中加入稍过量溴水,充分反应后,加入四氯化碳,振荡后静置、分液,取上层溶液
D.探究温度对反应速率的影响:将2支均装有5mL 0.1mol·L−1硫代硫酸钠溶液的试管分别置于冰水和热水中,再同时向试管中加入5mL 0.1 mol·L−1稀硫酸
10.有机化合物M、N的结构如图所示。
下列有关说法不正确的是
A.两者互为同分异构体B.M能使Br2的四氯化碳溶液褪色
C.N的二氯代物有3种不同结构D.M中所有原子不可能共平面
11.主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。
W、X、Y、Z的族序数之和为12;X 与Y的电子层数相同;向过量的ZWY溶液中滴入少量胆矾溶液,观察到既有黑色沉淀生成又有臭鸡蛋气味的气体放出。
下列说法正确的是
A .ZWY 是离子化合物,其水溶液呈酸性
B .晶体X 熔点高、硬度大,是信息技术的关键材料
C .原子半径由小到大的顺序为:r(W)<r(X)<r(Y)<r(Z)
D .最高价氧化物的水化物的酸性:H 2XO 3<H 2YO 3
12.一种新的低能量电解合成1,2一二氯乙烷的实验装置如下图所示。
下列说法正确的是
A .该装置工作时,化学能转变为电能
B .CuCl 2能将
C 2H 4还原为1,2一二氯乙烷
C .X 、Y 依次为阳离子交换膜、阴离子交换膜
D .该装置总反应为CH 2=CH 2+2H 2O +2NaCl=====电解H 2+2NaOH +ClCH 2CH 2Cl
13.常温下,将NaOH 溶液分别滴加到两种一元弱酸HA 和HB 中,两种混合溶液的pH 与离子浓度变化的关系如图所示。
下列叙述正确的是
A .K a (HA)的数量级为10−5
B .当NaOH 溶液与HB 混合至中性时:c(B −)<c(HB)
C .等浓度的NaA 、NaB 溶液中,水的电离程度:NaA<NaB
D .等浓度的HB 和NaA 的混合溶液中:c(Na +)>c(A −)>c(B −)>c(OH −)>c(H +)
化学答案(十)
7. C
【解析】A.气溶胶为胶体分散系,则有丁达尔效应,A正确;B.“用浓酒和糟入甑,蒸令气上,用器承滴露”为蒸馏原理,与酒精的沸点有关,B正确;C.“世间丝、麻、裘皆具素质……”,这里丝主要成分是蛋白质,麻的主要成分是纤维素,C错误;D.钢为Fe的合金,含C元素,D正确;故合理选项是C。
8.B
【解析】A.36g18O2的物质的量为=1mol,则所含中子数为2(18-8)N A=20N A,故A项错误;B.Cu2S 的摩尔质量是CuO摩尔质量的2倍,含有的铜原子个数也是CuO的2倍,故Cu2S和CuO的混合物可以看做均由“CuO”构成,则含有的“CuO”物质的量为n = = 0.1mol,则混合物中含有的铜原子数为0.1N A,故B 项正确;C.阳极上生成气体的状态不明确,故物质的量无法计算,则转移的电子数无法计算,故C项错误;D.1L pH=1的醋酸溶液中,氢离子的物质的量n(H+)=0.1mol,在加水稀释过程中,醋酸的电离程度增大,故所得溶液中H+数目略大于0.1N A,故D项错误;答案选B。
9.A
【解析】A.加入硝酸钡生成的亚硫酸钡沉淀,加入硝酸会被氧化为硫酸钡,不能证明亚硫酸根离子的存在,选项A错误;B.饱和碳酸钠溶液能吸收乙醇,中和乙酸,降低乙酸乙酯的溶解度,易于析出,将产生的蒸气经导管通到饱和碳酸钠溶液的上方,选项B正确;C.除去溴化钠溶液中混有的碘化钠:向溶液中加入稍过量溴水,充分反应后,碘离子被氧化生成碘单质,加入四氯化碳,振荡后静置、分液,过量的溴和碘被萃取在下层有机层,取上层溶液为溴化钠溶液,选项C正确;D.探究温度对反应速率的影响:将2支均装有5mL 0.1 mol·L−1硫代硫酸钠溶液的试管分别置于冰水和热水中,再同时向试管中加入5mL 0.1mol·L−1稀硫酸,其他条件相同时,温度高的反应速率快,则先产生沉淀,选项D正确。
答案选A。
10.D
【解析】A.两者化学式均为C8H8,但结构不同,两者互为同分异构体,故A选项正确;B.M中有C=C 双键,可以和Br2发生加成反应而使Br2的四氯化碳溶液褪色,故B选项正确;C.N的二氯代物有:2个氯原子相邻、面对角线相间、体对角线相间3种,故C选项正确;D.苯和乙烯均为平面结构,旋转苯基与乙烯基之间的C-C单键可能使苯基平面结构和乙烯基平面结构处于同一平面,故D选项错误。
答案:D。
11.B
【解析】根据“向过量的ZWY溶液中滴入少量胆矾溶液,观察到既有黑色沉淀生成又有臭鸡蛋气味的气体放出”,黑色沉淀是CuS,臭鸡蛋气体是H2S,发生反应的离子方程式为2HS−(过量)+Cu2+=CuS↓+H2S↑。
可推知
Y 是S ,W 是氢,因Z 的原子序数比Y 大且小于等于20,故Z 是钾,即ZWY 的化学式为KHS 。
W 在IA 族,Y 在VIA 族、Z 在IA 族,所以X 的族序数=12-1-6-1=4,又X 与Y 同周期,即X 在第三周期IVA 族,故X 为硅。
A .KHS 中K +与HS -之间是离子键结合,所以KHS 是离子化合物,但KHS 属于强碱弱酸盐,故能发生水解反应:HS −+H 2O H 2S+OH −,使KHS 溶液呈碱性,A 项错误;B .硅晶体属于共价晶体(原子晶体),原子之间是以较强Si-Si 共价键相互作用,所以熔点高、硬度大,硅晶体具有半导体性质,故硅是信息技术的关键材料,B 项正确;C .氢原子只有1个质子和1个电子,所以氢原子半径最小。
根据原子半径的周期性,钾和钠同主族,所以原子半径:Na <K ,钠、硅、硫同周期,所以原子半径:S <Si< Na ,因此题干中四种元素原子半径大小关系是:H<S<Si<K 。
C 项错误;D .因为H 2SO 3中硫元素的化合价是+4价,不是硫元素的最高价,所以H 2SiO 3与H 2SO 3的酸性强弱不能应用硅与硫两元素的非金属强弱来判断,D 项错误;答案选B 。
12. D
【解析】A .该装置的工作原理为电解池原理,则工作时,电能转变为化学能,故A 项错误; B .C 2H 4中C 元素化合价为-2价,ClCH 2CH 2Cl 中C 元素化合价为-1价,则CuCl 2能将C 2H 4氧化为1,2一二氯乙烷,故B 项错误;C .该电解池中,阳极发生的电极反应式为:CuCl-e −+Cl −=CuCl 2,阳极区需要氯离子参与,则X 为阴离子交换膜,而阴极区发生的电极反应式为:2H 2O+2e −=H 2↑+2OH −,有阴离子生成,为保持电中性,需要电解质溶液中的钠离子,则Y 为阳离子交换膜,故C 项错误;
D .该装置中发生阳极首先发生反应:CuCl-e −+Cl −=CuCl 2,生成的CuCl 2再继续与C 2H 4反应生成1,2一二氯乙烷和CuCl ,在阳极区循环利用,而阴极水中的氢离子放电生成氢气,其总反应方程式为:CH 2=CH 2+2H 2O
+2NaCl=====电解H 2+2NaOH +ClCH 2CH 2Cl ,故D 项正确;答案选D 。
13. C
【解析】A .K a (HA)= H + - H ,当c(A −)=c(HA)时,K a (HA)=c(H +),则K a (HA)在10−3.0~10−3.5之间,K a (HA)
的数量级为10−4,A 错误;B .根据图知,当溶液中c(B −)=c(HB)时溶液呈酸性,说明HB 的电离作用大于B -的水解作用,所以c(B −)>c(HB),B 错误;C .根据图象可知,当溶液中酸分子的浓度等于酸电离产生的离子浓度时,溶液的pH 大小关系HA<HB ,说明HA 电离程度大,即HA 的酸性强,根据盐的水解规律可知,等浓度的NaA 、NaB 溶液中,水的电离程度:NaA<NaB ,C 正确;
D .NaA 是强碱弱酸盐,A −发生水解反应消耗,所以c(Na +)>c(A −),HB 是弱酸,存在电离平衡,所以等浓度的盐电离产生的离子浓度大于弱酸电离产生的离子浓度,故c(A −)>c(B −);由于溶液中c(B −)=c(HB)时,溶液呈酸性,又根据选项C 分析可知酸性:HA>HB ,可见等浓度的HB 和NaA 的混合溶液显酸性,c(H +)>c(OH −),故该溶液中离子浓度大小关系为:c(Na +)>c(A −)>c(B −)>c(H +)>c(OH −),D 错误;故合理选项是C 。
