包装材料表面微生物检验记录
原材料送检记录范文

原材料送检记录范文日期:2024年10月1日送检单位:XXX有限公司送检原材料:XXX原材料送检数量:1000千克一、送检目的本次送检旨在对所购得的XXX原材料进行质量检测,确保其符合我公司生产要求和国家法律法规的相关标准,以保证产品的质量和安全。
二、送检要求1.外观检查:查看原材料外观,检查是否存在明显的污染、异味或其他异常情况。
2.检测项目:对原材料进行化学成分、微生物和重金属等项目的检测。
3.检验标准:按照国家相关标准和我公司的内部质量控制标准进行检验。
三、送检过程1.外观检查a.打开原材料包装,观察外观是否干净整齐,无异物、无明显破损。
b.闻气味,检查是否有异常香味或异味。
c.通过目测,检查原材料颜色是否符合标准要求。
d.记录外观检查结果:无明显污染、无异味、颜色正常。
2.化学成分检测a.根据产品标准,取一定量的原材料样品。
b.将样品送至实验室进行化学成分检测,包括含水率、蛋白质含量、脂肪含量等项目。
c.检测结果与产品标准进行对比,判断是否符合要求。
d. 记录化学成分检测结果:水分含量为xx%,蛋白质含量为xx%,脂肪含量为xx%。
3.微生物检测a.依照产品标准,取一定量的原材料样品。
b.将样品送至实验室进行微生物检测,包括总菌落计数、大肠菌群检测等项目。
c.检测结果与产品标准进行对比,判断是否符合要求。
d. 记录微生物检测结果:总菌落计数为xx CFU/g,大肠菌群检测结果符合标准。
4.重金属检测a.根据产品标准,取一定量的原材料样品。
b.将样品送至实验室进行重金属检测,包括铅、汞、镉、铬等项目。
c.检测结果与产品标准进行对比,判断是否符合要求。
d. 记录重金属检测结果:铅含量为xx mg/kg,汞含量为xx mg/kg,镉含量为xx mg/kg,铬含量为xx mg/kg。
四、送检结论根据以上送检过程和检测结果,对所购得的XXX原材料进行总体评估:1.外观检查结果良好,无明显污染、异味,颜色正常。
包装材料微生物限度检查检验记录
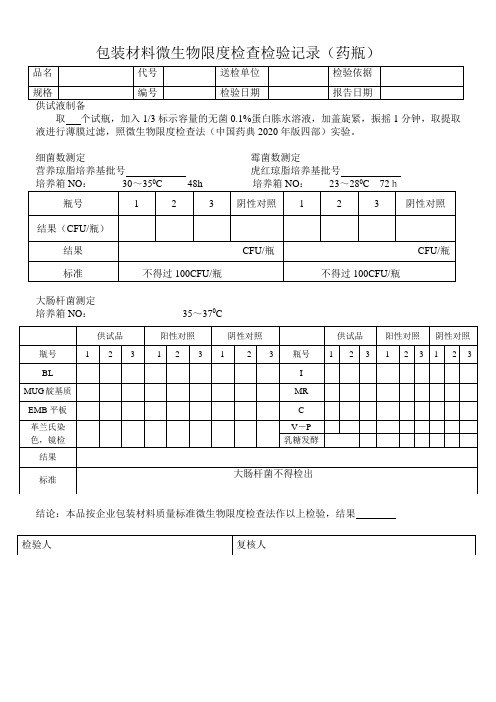
包装材料微生物限度检查检验记录(药瓶)
取个试瓶,加入1/3标示容量的无菌0.1%蛋白胨水溶液,加盖旋紧,振摇1分钟,取提取液进行薄膜过滤,照微生物限度检查法(中国药典2020年版四部)实验。
细菌数测定霉菌数测定
营养琼脂培养基批号虎红琼脂培养基批号
00
大肠杆菌测定
培养箱NO:35~370C
结论:本品按企业包装材料质量标准微生物限度检查法作以上检验,结果
包装材料(复合膜、袋)微生物限度检查检验记录
供试液制备
取试样用开孔面积为20cm2的消毒过的金属模板压在内层面上,将无菌棉签用无菌0.1%蛋白胨水溶液稍沾湿,在板孔范围内擦抹5次,换1支棉签再擦抹5次,每个位置用2支棉签共擦抹10次。
共擦抹5个位置100cm2。
每支棉签擦抹完后立即剪短,投入盛有30ml无菌0.1%蛋白胨水溶液的锥形瓶中,全部擦抹棉签均投入瓶中后。
迅速摇晃1分钟,即得供试液。
细菌数测定:霉菌数测定:
营养琼脂培养基批号玫瑰红纳琼脂培养基批号
培养箱NO:℃48h 培养箱NO:℃72h
大肠杆菌测定:
胆盐乳糖培养基批号:MUG培养基批号:
培养箱NO:36℃±1℃
结论:本品按国家药品监督管理局,国家药品包装容器(材料)标准(试行),药品包装通则,微生物限度检查法检验,结果规定。
原料、包材、工用具微生物检验内控标准

原料、包材、工用具微生物检验内控标准Internal control stangards for rawmaterials, packaging materials,instruments and equpment,microbiological examination1.目的- PURPOSE提供化妆品原料、包装材料、GMP车间仪器设备等微生物检验内控标准,从而确保产品微生物质量。
2.责任- RESPONSIBIRITY微检员:依据此内控标准对化妆品原料、包装材料、GMP车间仪器设备等微生物质量进行判定。
实验室主管:负责对检测结果进行审核。
3. 范围- SCOPE适用于化妆品原料、包装材料、GMP车间仪器设备等微生物控制。
4. 操作程序- OPERATION PROCEDURE4.1原料微生物检验内控标准4.2进料包材微生物质量企业内控标准4.3GMP车间仪器设备微生物质量企业内控标准4.3.1GMP车间仪器设备菌落总数≤20CFU/cm24.3.2GMP车间仪器设备监测点按照《环境监测频次》实行。
4.4当顾客的标准松于本标准时,都应采纳本标准,如严于本标准时则按顾客标准。
5. 附件- APPENDIX5.1 KE12-66附件一《紫外线消毒的阀门微生物检测报告》5.2 KE12-66附件二《臭氧消毒的罐子微生物检测报告》5.3 附件三《环境监测频次》6.修改记录-MODIFICATION RECORD问题1. 原料微生物检验内控标准细菌总数为<100CFU/g(ml)。
问题2. 阀门微生物检验内控标准细菌总数为<20CFU/个,霉菌和酵母菌总数为不得检出。
问题3.铝罐微生物检验内控标准细菌总数为<20CFU/个,霉菌和酵母菌总数为不得检出。
药品包装材料检验标准

药品包装材料检验标准一、外观检验药品包装材料的外观应符合以下要求:1.表面平整,无划痕、压痕、凹陷、凸起、变形等。
2.表面清洁,无灰尘、油污、异物的痕迹。
3.印刷图案清晰、完整,颜色鲜艳、均匀。
4.封口处无气泡、皱褶、破损等现象。
二、物理性能检验药品包装材料的物理性能应符合以下要求:1.拉伸强度:包装材料在拉伸过程中应能承受一定的拉力,且不断裂。
2.撕裂强度:包装材料在撕裂过程中应能承受一定的撕裂力,且不破裂。
3.冲击强度:包装材料应能承受一定冲击力,且不破裂。
4.压缩强度:包装材料应能承受一定的压缩力,且不破裂。
5.耐磨性:包装材料应具有一定的耐磨性,以保证药品的包装质量。
三、化学性能检验药品包装材料的化学性能应符合以下要求:1.耐腐蚀性:包装材料应具有一定的耐腐蚀性,以保证药品的安全性和稳定性。
2.抗氧化性:包装材料应具有一定的抗氧化性,以保证药品的质量和安全性。
3.密封性能:包装材料的密封性能应符合要求,以保证药品的密封性和防潮性。
4.抗老化性能:包装材料应具有一定的抗老化性能,以保证药品的包装质量和安全性。
四、生物学性能检验药品包装材料的生物学性能应符合以下要求:1.无毒无害:包装材料不应含有对人体健康有害的物质。
2.微生物指标:包装材料应符合国家相关标准,以保证药品的卫生质量和安全性。
3.细胞毒性:包装材料应对人体细胞无毒性作用。
4.致敏性:包装材料应对人体无致敏反应。
五、阻隔性能检验药品包装材料的阻隔性能应符合以下要求:1.水蒸气透过性能:包装材料应具有一定的水蒸气阻隔性能,以保持药品的干燥性和稳定性。
2.气体透过性能:包装材料应具有一定的气体阻隔性能,以保持药品的抗氧化性和防止变质。
3.光线透过性能:包装材料应具有一定的光线阻隔性能,以保证药品不受光线影响。
微生物检测原始记录

室温:湿度:
样品名称
规格
检验类别
出厂检验
抽样基数
抽样方式
抽样数量
检测依据
GB/T4789.2-2010
接种时间
使用主要仪器
恒温培养箱
培养基名称
平板计数琼脂培养基
报告时间
样号
36+1℃培养24~48h
稀释度
报告数cfu/ml(g)
1:10
1:100
1:1000
空白
1
接种量ml
1
1
1
1
0.1
0.01
分析号
1
2
3
4
5
6
7
8
9
1
初发酵产酸、气
复发酵产酸、气
BGLB分离培养
2
初发酵产酸、气复发酵产酸、气BGL Nhomakorabea分离培养
检测结果
检验结论
备注:月桂基硫酸盐胰蛋白胨发酵阳性管转种培养实验:1.复发酵:+/+表示产酸、产气为阳性;-/-表示不产酸、不产气为阴性;+/-表示产酸、不产气。接种量在1ml以上者,用双料发酵管;1ml以下者,用单料发酵管。
检验员:审核人:审核时间:
大肠菌群检测原始记录
室温:湿度:
样品名称
规格
检验类别
出厂检验
抽样基数
抽样方式
抽样数量
检测依据
GB/T4789.3-2010
接种时间
使用主要仪器
恒温培养箱
报告时间
样号
培养温度、时间
培养基名称
结果判定报告数(MPN)/100ml(g)
36±1℃24h±2
微生物检验原始记录表
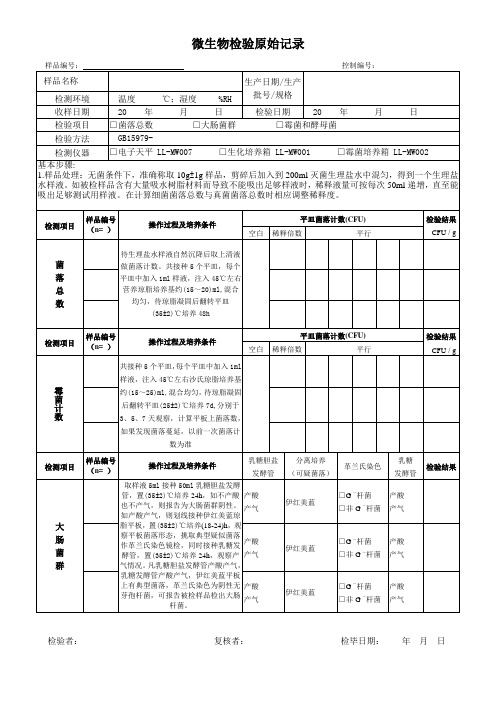
生产日期/生产批号/规格
检测环境
温度 ℃;湿度 %RH
收样日期
20 年 月 日
检验日期
20 年 月 日
检验项目
□菌落总数 □大肠菌群 □霉菌和酵母菌
检验方法
GB15979-
检测仪器
□电子天平LL-MW007□生化培养箱LL-MW001□霉菌培养箱LL-MW002
基本步骤:
1.样品处理:无菌条件下,准确称取10g±1g样品,剪碎后加入到200ml灭菌生理盐水中混匀,得到一个生理盐水样液。如被检样品含有大量吸水树脂材料而导致不能吸出足够样液时,稀释液量可按每次50ml递增,直至能吸出足够测试用样液。在计算细菌菌落总数与真菌菌落总数时相应调整稀释度。
检测项目
样品编号(n=)
操作过程及培养条件乳Fra bibliotek胆盐发酵管
分离培养
(可疑菌落)
革兰氏染色
乳糖
发酵管
检验结果
大
肠
菌
群
取样液5ml接种50ml乳糖胆盐发酵管,置(35±2)℃培养24h,如不产酸也不产气,则报告为大肠菌群阴性。如产酸产气,则划线接种伊红美蓝琼脂平板,置(35±2)℃培养(18-24)h,观察平板菌落形态,挑取典型疑似菌落作革兰氏染色镜检,同时接种乳糖发酵管,置(35±2)℃培养24h,观察产气情况。凡乳糖胆盐发酵管产酸产气,乳糖发酵管产酸产气,伊红美蓝平板上有典型菌落,革兰氏染色为阴性无芽孢杆菌,可报告被检样品检出大肠杆菌。
样品编号(n=)
操作过程及培养条件
平皿菌落计数(CFU)
检验结果
CFU/g
空白
稀释倍数
平行
霉菌计数
共接种5个平皿,每个平皿中加入1ml样液,注入45℃左右沙氏琼脂培养基约(15~25)ml,混合均匀,待琼脂凝固后翻转平皿(25±2)℃培养7d,分别于3、5、7天观察,计算平板上菌落数,如果发现菌落蔓延,以前一次菌落计数为准
包装材料检测工作总结报告

包装材料检测工作总结报告
近年来,随着消费品市场的不断扩大,对包装材料的质量和安全性要求也越来
越高。
为了保障消费者的权益,包装材料检测工作显得尤为重要。
在过去的一段时间里,我们对各种包装材料进行了全面的检测和分析,现就此总结报告如下:首先,我们对包装材料的物理性能进行了检测。
通过对包装材料的拉伸、压缩、撕裂等性能进行测试,我们可以了解其强度、韧性、耐磨性等指标,从而评估其是否符合相关标准和要求。
其次,我们对包装材料的化学成分进行了分析。
通过对包装材料中可能存在的
有害物质进行检测,如重金属、有机溶剂、塑化剂等,以确保其不会对食品、药品等产品造成污染,保障消费者的健康安全。
另外,我们还对包装材料的印刷和涂层进行了检测。
通过对包装材料表面的油墨、涂料等成分进行分析,以确保其不会释放出有害物质,同时保证印刷图案的清晰度和耐久性。
最后,我们对包装材料的微生物污染进行了检测。
通过对包装材料表面和内部
进行微生物检测,以确保其不会成为细菌、霉菌等微生物的滋生场所,从而保障产品的卫生安全。
通过以上的检测工作,我们发现大部分包装材料的质量安全性都得到了保障,
但也发现了一些问题和隐患,如部分包装材料中存在化学污染物,部分印刷图案不符合标准要求等。
因此,我们将进一步加强对包装材料的检测工作,完善相关标准和规范,以确保市场上的包装材料都能够符合质量和安全的要求,保障消费者的权益。
同时,我们也将加强与相关企业的沟通和合作,共同推动包装材料质量安全工作的改进和提升。
希望通过我们的努力,能够为消费者提供更加安全、放心的包装材料,为消费品市场的健康发展贡献一份力量。
微生物检验作业作业指导书.

1 目的通过对微生物检测流程的规范确保检验工作有序进行.2 范围适用于微生物检测的全过程。
3 职责3.1 检验人员严格按检测流程做好各项工作。
3.2 检测主管做好监督检查工作.4 内容4.1 准备工作4。
1.1 卫生清洁整理普通检验室内的各类检验物品,检查工作台面和地面卫生。
4.1.2样品收集登记4。
1.2。
1与收样员沟通,确定检样品种、数量(如仓库到货的茶原料、内包膜,车间生产的半成品、成品,研发样品,采购样品,稳定性试验的样品、定期跟踪检测的样品)。
4.1.2。
2与质保员沟通,确定检样品种、数量(如自来水、纯水、一楼生产过程跟踪的各阶段液体)。
4.1。
2。
3 按检测计划自行确定的检样品种、数量(如工作间空气、设备内表面、员工手部)。
4.1。
2.4各项确定后,收集并登记样品。
4。
1.3检测方法的确定4.1.3。
1样品收集后进行分类,确定样品的检测方法,若无方法的要尽快上报或查找相关方法。
4.1。
3.2微生物各项目所采用的检测方法(见附表1)4.2 试剂配制、物品包扎4。
2。
1玻璃容器的包扎:灭菌前器皿应包扎紧密完整后才进行灭菌,以防止灭菌后器皿受到污染。
4。
2。
2平皿、吸管按量分成若干单元用牛皮纸、报纸包扎;4.2.3试管及三角瓶应塞硅胶塞,在瓶口再用报纸包扎;4.2.4其它玻璃或金属取样工具也要用报纸包扎;4。
2。
5生理盐水按氯化钠加水比例0.84%配制;平板计数琼脂(PCA)、孟加拉红、月桂基硫酸盐胰蛋白胨肉汤(LST)、煌绿乳糖胆盐肉汤(BGLB)则以标签上规定的比例进行配制。
按需要量分装成于不同规格的容器中。
4。
3 高压灭菌4。
3。
1培养基及器皿的灭菌:4.3.1.1高压蒸汽灭菌:金属器具、玻璃器皿、基础培养基及其它耐热物品均放入锅内灭菌。
4。
3。
1.2灭菌参数:121℃(0。
1034MPa),15~20min;4.3.2染菌培养物:121℃(0.1034MPa),30min;4.3.3含糖类不耐热培养基(按试剂要求):115℃(0。
包装验证试验方法

无菌医疗器械包装验证试验方法
• ASTM F 1980:07
• 加速老化试验的意义
•
新产品投入市场。
•
尽早了解包装性能状况。
• 为确保加速老化试验真实地代表实际
时间效应,实际时间老化研究必须与加速 研究同步进行。
无菌医疗器械包装验证试验方法
ASTM F 1980:07
低湿
高湿
低温
(HR﹤20 ﹪) (HR70-80 ﹪) (-20℃)
• 2)平滑玻璃
度、透气性、耐破度 • 化学性能:pH、重金属、硫酸盐 • 生物性能:生物负载、毒性(生物相容性)
无菌医疗器械包装验证试验方法 • 医疗器械包装的独特功能:
灭菌适应性 • 必须阻隔微生物(术语和定义13/29) • 在货架寿命期能维持产品的无菌状态
无菌医疗器械包装验证试验方法
• 包装材料的类型:
位滴入试验液,使其充分接触密封边,除去多余测试溶液
,在60℃烘15min后,观察颜料渗漏和剥离情况。
无菌医疗器械包装验证试验方法
• ASTM F1929 • 注意事项 • 在实验时注意染料试剂不要加得太多。 • 操作时不要随意折叠样品,以免造成假阳
性。
无菌医疗器械包装验证试验方法
• EN 868-1 试剂配制
• 1.将样品裁成边长为50mm的正方形,灭菌备 用。
• 2 .将灭菌样品转移至无菌平皿,取107cfu/ml的 枯草杆菌菌悬液5滴,每滴0.1ml,均匀滴在样品 外表面,互不触碰,在温度20℃-25℃,相对湿度 40%-50%条件下直至干燥(6-16h)。
• 3. 将染菌样片的内表面完全平铺于营养琼脂培 养基表面, 5s-6s后将样片丢弃;营养琼脂培养 基于37℃培养16h-24h,观察细菌生长情况。
药包材微生物检验

已配制好的培养基必须立即灭菌 湿热灭菌必须严格控制灭菌温度和时间(121度,15-30分钟,20分钟)
培养基制备过程中的注意事项
培养基的保温
培养基灭菌后应立即取出,不得储藏在高压灭菌器中,避免造成过度 灭菌,影响培养基的营养成分或选择性效果。建议用45℃—55℃水浴 锅保温不得超过8小时(60℃的培养箱,温度不同,长时间高温影响 培养基质量)。
培养基水化使用的容器应是玻璃器皿或搪瓷器皿如三角烧瓶。蒸馏水洗 净,烘干后方可使用。不得用铜锅或铁锅,以防有离子混入培养基中,影 响微生物的生长;
配制培养基最常用的溶剂是纯化水 ,不能含有任何可能抑制或影响微生 物生长的物质;
培养基的溶解
在培养基分装灭菌前, 应溶解均匀, 使用电炉等设备煮沸培养基时,应用 小火加热,并边加热边搅拌,避免培养基焦化或爆沸溢出。
• 实验器材、消耗品的准备
a.无菌衣、手套、口罩、试管、瓶子、培养皿、消毒剂 配制缸、脱脂棉花球
b.一次性薄膜过滤滤器、微生物检查薄膜过滤仪 c.消毒剂、酒精灯
培养基的制备
培养基是微生物试验的基础,直接影响微生 物试验结果。培养基的制备是检验的重要一 环。
培养基制备过程中的注意事项
培养基的水化
培养基的贮藏
配制好的培养基应保存在避光的环境。一般在三周内使用(琼脂培养 基不得在0℃或0℃以下存放,防止冷冻破坏凝胶特性)。
固体培养基灭菌后的再融化应在加热的水浴中或采用流通蒸汽进行, 只允许一次,不得再灭菌。
人流、物流程序
➢物流
将样品、灭菌后的物品、集菌过滤器等转移入传递窗内,打开传递窗 内的紫外灯,照射不少于0.5小时。
实验准备
洁净室的启用
微生物限度检查应在环境洁净度10000级下的局部洁净 度100级的单向流空气区域内进行。在检验开始前,应 确保: a.洁净室房间、台面等已清洁消毒 b.洁净室已臭氧灭菌不少于半小时 c.洁净室净化空调系统持续运转不少于1小时,紫外灯已 开启 d.洁净室中有压差要求的房间压差达到规定
内包装材料微生物检验规程

类别:操作标准—检验规程起草人:日期:年月日颁发部门:质量技术部审核人:日期:年月日编码: QC-O-060批准人:日期:年月日标题:内包装材料微生物检验规程分发部门:总经理室、质量技术部,行政部(存档)生效日期:年月日总页数:3 页分发号:变更记载:变更摘要:修订号原批准日期原生效日期内包装材料微生物检验规程1目的为内包装材料微生物检验提供书面规范的检验操作程序。
2范围本程序适用于微生物检验人员在对内包装材料取样和检验时使用。
3职责:3.1微生物检验人员负责按此规程进行操作。
3.2质量部QC主管负责检查检验过程是否符合本规程。
4定义 :(薄膜类)内包装材料 : 直接接触药品的各种片材、薄膜类包装材料,如铝箔、PVC 、空胶囊、纸铝膜、塑料瓶等。
5程序:5.1取样5.1.1微生物检验用的样品,取样必须在取样间内进行,待检验的内包装材料放置无菌塑料袋内。
5.1.2薄膜类包装材料:铝箔、PVC、喷铝复合膜等,随机打开三个单独的包装单位,用2已灭菌的剪刀剪取所需样品放于无菌塑料袋中并注意及时封口。
检验量为200cm ,常规取样量为检验量的 3 倍。
如有特殊原因,检验量不能满足,应如实记录实际的检验量。
5.2 检验5.2.1 样品准备以无菌操作法从所取样品中等分地剪取共计100 cm2大小的薄膜加入到100 ml2/3内包装材料微生物检验操作规程QC-O-060无菌的生理盐水中,充分振摇,得100 ml样品供试液。
5.2.2操作1)用无菌吸管各取2ml均匀水样,分别置4个无菌干燥的平皿中,其中2个平皿注入于45℃的玫瑰红钠琼脂,混匀,待凝固。
约45℃的营养琼脂,另2个平皿注入约2)倒置营养琼脂培养基平板于30-35℃中至少培养 2 天。
3)倒置玫瑰红钠琼脂培养基平板于25-28℃中至少培养 3 天。
4)计算菌落数:菌落数(个)/100cm2= 2个平皿菌落数之和x 25 ,将结果记录在实验记录上。
5.2.3 阴性对照微生物计数实验中,每个样品所使用的每瓶营养琼脂培养基和玫瑰红钠琼脂培养基都必须做阴性对照。
食品生产企业必须填写的30项生产相关记录

食品生产企业必须填写的30 项记录1、原辅材料进货查验记录(《食品安全法》第五十条第二款)2、原料验收记录(《食品安全法》第五十条第一款)3、食品贮存记录(GB 14881-2013 食品生产通用卫生规范4、投料记录(《食品安全法》第四十六条) 25、关键控制点记录(《食品生产许可审查通则》 1.11 )6、清洁消毒记录(GB 14881-2013 食品生产通用卫生规范7、洗涤剂、消毒剂使用记录(《食品生产日常监督检查要点表》 1.6 )8、半成品检验(《食品安全法》第四十六条)(过程检验)9、包装记录(《食品安全法》第四十六条)10、成品检验记录(《食品安全法》第五十二条)11、产品留样记录(GB 14881-2013 食品生产通用卫生规范9.3 )12、产品销售记录(《GB 14881-2013 食品生产通用卫生规范》13、运输交付记录(《食品安全法》第四十六条)14、防鼠、防蝇、防虫害检查记录(《食品生产日常监督检查要点表》 1.7)15、温、湿度监测记录(《食品生产日常监督检查要点表》 3.12)16、生产设备、设施维护保养记录(《食品生产日常监督检查要点表》 3.13)17、卫生检查记录(《GB 14881-2013 食品生产通用卫生规范》6.1.3 )18、生产过程微生物监测记录(《GB 14881-2013 食品生产通用卫生规范》8.2 )19、废弃物处置记录(GB 14881-2013 食品生产通用卫生规范 6.5)20、食品召回记录(《食品安全法》第六十三条)21、不合格食品(原辅料、半成品、成品)处置记录22、职工培训计划(《食品生产许可审查通则(2016)》4.2)23、食品安全管理、检验和负责人员培训和考核记录。
(《食品生产日常监督检查要点表》7.2)24、职工培训记录(《食品安全法》第四十四条第一款)25、从业人员健康档案(《食品安全法》第四十五条)26、食品安全自查记录(《食品安全法》第四十七条)27、排查食品安全风险隐患记录(《食品生产日常监督检查要点表》8.1)28、食品安全追溯体系(《食品安全法》第四十二条)(采购到销售全程记录) 629、客户投诉记录(GB 14881-2013 食品生产通用卫生规范30、食品安全应急演练记录(《食品生产日常监督检查要点表》8.2)1.原辅材料进货查验记录(《食品安全法》第五十条第二款)《食品安全法》第五十条第二款食品生产企业应当建立食品原料、食品添加剂、食品相关产品进货查验记录制度,如实记录食品原料、食品添加剂、食品相关产品的名称、规格、数量、生产日期或者生产批号、保质期、进货日期以及供货者名称、地址、联系方式等内容,并保存相关凭证。
内包装材料微生物检验规程

类别:操作标准—检验规程起草人:日期:年月日颁发部门:质量技术部审核人:日期:年月日编码:QC-O-060批准人:日期:年月日标题:内包装材料微生物检验规程分发部门:总经理室、质量技术部,行政部(存档)生效日期:年月日总页数:3页分发号:变更记载:变更摘要:修订号原批准日期原生效日期内包装材料微生物检验规程1目的为内包装材料微生物检验提供书面规范的检验操作程序。
2范围本程序适用于微生物检验人员在对内包装材料取样和检验时使用。
3职责:3.1微生物检验人员负责按此规程进行操作。
3.2质量部QC主管负责检查检验过程是否符合本规程。
4定义:(薄膜类)内包装材料:直接接触药品的各种片材、薄膜类包装材料,如铝箔、PVC、空胶囊、纸铝膜、塑料瓶等。
5程序:5.1取样5.1.1微生物检验用的样品,取样必须在取样间内进行,待检验的内包装材料放置无菌塑料袋内。
5.1.2薄膜类包装材料:铝箔、PVC、喷铝复合膜等,随机打开三个单独的包装单位,用2 已灭菌的剪刀剪取所需样品放于无菌塑料袋中并注意及时封口。
检验量为200cm,常规取样量为检验量的3倍。
如有特殊原因,检验量不能满足,应如实记录实际的检验量。
5.2检验5.2.1样品准备2以无菌操作法从所取样品中等分地剪取共计100cm 大小的薄膜加入到100ml专业资料整理专业资料整理 2/3内包装材料微生物检验程QC-O-060 无菌的生理盐水中,充分振100m l 样品5.2.2操作 1)用无菌吸管各取2ml 均匀水样,分别置于4个无菌干燥的平皿中,其中2个平皿注入 45℃的营养琼2个平皿45℃的玫瑰红钠琼脂,混匀 2)倒置营养琼脂培养基平板于30-35℃中至少培养2天。
3)倒置玫瑰红钠琼脂培养基平板于25-28℃中至少培养3天。
2=2个平皿菌落数之和x25,将结果记 4)计算菌落数:菌落数(个)/100cm 录在录上。
5.2.3阴性对照 微生物计数实验中,每个样品所使用的每瓶营养琼脂培养基和玫瑰红钠琼脂培养基都 必须做阴。
医用防护口罩(无菌性)。包装完整性验证报告

医用防护口罩(无菌性)。
包装完整性验证报告100℃-200℃压力范围:0.2MPa-0.5MPab)验证结果:所有关键参数均符合要求,设备能够稳定有效地进行封口。
二、包装完好性验证1.包装完好性验证:1)目的:验证包装的完整性,确保包装在生产、运输、贮存等过程中不会被损坏。
2)范围:适用于本公司生产的医用防护口罩包装。
3)参与人员:4)验证步骤:a)检查包装外观是否完好b)进行包装压缩测试c)进行包装抗拉测试2.验证内容、程序:1)验证要求:a)包装外观完好,无破损、变形等情况b)包装在压缩和拉伸过程中无破损、裂纹等情况2)验证结果:包装外观完好,通过压缩和拉伸测试,包装无破损、裂纹等情况。
三、阻菌性试验(琼脂接触攻击试验)1.阻菌性试验:1)目的:验证包装的微生物屏障能力,确保包装能够有效防止微生物的侵入。
2)范围:适用于本公司生产的医用防护口罩包装。
3)参与人员:4)验证步骤:a)选取适当的微生物菌株b)将琼脂接触到包装表面c)观察琼脂培养基上的菌落情况2.验证内容、程序:1)验证要求:a)包装表面无菌b)琼脂培养基上无菌落生长2)验证结果:包装表面无菌,琼脂培养基上无菌落生长,包装具有良好的微生物屏障能力。
四、灭菌适应性试验1.灭菌适应性试验:1)目的:验证包装材料在灭菌过程中的耐受性,确保包装在灭菌过程中不会被破坏。
2)范围:适用于本公司生产的医用防护口罩包装。
3)参与人员:4)验证步骤:a)选取适当的灭菌方法b)将包装放入灭菌器中进行灭菌c)观察包装的完好性2.验证内容、程序:1)验证要求:a)包装在灭菌过程中无破损、变形等情况b)包装在灭菌后能够保持完整性和微生物屏障能力2)验证结果:包装在灭菌过程中无破损、变形等情况,能够保持完整性和微生物屏障能力。
五、贮存试验1.贮存试验:1)目的:验证包装在贮存过程中的稳定性和耐久性,确保包装在贮存期内能够保持完整性和微生物屏障能力。
2)范围:适用于本公司生产的医用防护口罩包装。
包装测试记录-标准模板

包装测试记录表
BX-JL05-001 1.产品信息
2.实验安排
3.实验标准
YY/T 0681.2-2010 无菌医疗器械包装试验方法第2部分:软性屏障材料的密封强度
YY/T 0681.4-2010 无菌医疗器械包装试验方法第4部分:染色液穿透法测定透气包装的密封泄露
YY/T 0681.14-2018 无菌医疗器械包装试验方法第14部分:透气包装材料湿性和干性微生物屏障试验
YY/T 0681.15-2019 无菌医疗器械包装试验方法第15部分:运输容器和系统的性能试验
4.实验负责人
XXX
附表1密封强度
附表2染料渗透
注:+表示发生渗漏;-表示未发生渗透。
附表3微生物屏障试验
注:+表示有菌落生长;-表示无菌落生长。
附表4运输验证试验
检验结论:
(盖章)
日期:年月日测试:审核:。
化妆品内包材微生物检测方法

《车间环境及卫生监控原始记录》
根据细菌的污染程度,可作适当稀释,取1ml注入平皿,倾注营养琼脂,置35℃±2℃培养箱内培养48小时,进行活菌计数,计算包装容器表面污染细菌。同时另用一个灭菌棉花平皿只倾注营养琼脂培养基作为空白对照。
4.最终执行检测标准要求:
项目
菌落总数
内包材
≤10cfu/皿
5 相关记录
《仪器使用记录》
《试剂配制记录》
1 适用范围
适用于包材类的微生物检测取样方法与检测方法。
参照GB15979-2002《一次性使用卫生用品卫生标准》
2 实验用具
2.1 实验用具 :
恒温培养箱、干燥箱、恒温水浴锅、高压灭菌锅、酒精喷壶、酒精灯、打火机、25cm²采样板、去离子水、棉签、直径9cm培养皿、25ml具塞刻度试管、移液枪、1ml吸头、150ml锥形瓶、酒精棉、剪刀、生理盐水、记号笔、镊子、500ml带塞锥形瓶。
2.2 ቤተ መጻሕፍቲ ባይዱ养基
参照GB15979-2002《一次性使用卫生用品卫生标准》附录G中营养琼脂配制方法,或按营养琼脂说明书操作。。
3 操作程序:
3.1内包材的检取样与检测方法
被采容器表面积小于100cm2取全部内面积,加适量无菌生理盐水到容器内,盖紧盖子充分振摇,使容器内面积全部与灭菌生理盐水接触;被采容器表面积大于100cm2,用无菌棉签均匀涂抹25cm2面积范围,然后放回三角锥形瓶中充分振荡。
包装材料微生物检验标准方法

1.0目的:确保包装材料的微生物质量,规范包材之微生物检验方法。
2.0适用范围:喷头、软管、乳液瓶、铝皿、内座、磨指器、内塞、眼毛修饰器、粉扑、假睫毛、眼影棒、睫毛刷、剃须刀。
3.0参考资料3.1、《化妆品微生物检验标准方法总则》(SOP-HYS-002)。
3.2《细菌总数检验标准方法》(SOP-HYS-003)。
3.3《霉菌、酵母菌总数检验标准方法》(SOP-HYS-004)。
3.4《金黄色葡萄球菌检验标准方法》(SOP-HYS-005)。
3.5《绿脓杆菌检验标准方法》(SOP-HYS-006)。
3.6《粪大肠菌群检验标准方法》(SOP-HYS-007。
4.0定义:略5.0所需设备:略6.0安全需求:略7.0程序:7.1检验前先核对化验申请单之样品编号与实际样品上的编号是否相符。
检查样品包装之完好性,包装完好之样品方可进行检验,包装不完整或疑有取样污染之样品退回IQC重新取样送检。
7.2样品稀释7.2.1磨指器、内塞、眼毛修饰器、粉扑、假睫毛、眼影棒、睫毛刷、剃须刀等体积较小的包装材料稀释:取10ml消毒过的生理盐水顷注于100ml 烧杯内,将内塞、眼毛修饰器、粉扑、假睫毛、剃须刀、眼影棒海棉端、睫毛刷毛端放于烧杯内与生理盐水混匀备用。
7.2.2铝皿、内座的稀释:取10ml消毒过的生理盐水顷注于100ml烧杯内,用消毒过的酒精棉球蘸取烧杯内的生理盐水擦拭铝皿、内座内表面3遍,将此酒精棉放于盛有生理水折烧杯中摇匀备用。
同时计算铝皿、内座内表面的表面积。
7.2.3喷头的稀释:取消毒过的生理盐水10ml顷注于100ml烧杯内,用喷头将此生理盐水吸于喷头内后喷出,如此 5遍,摇匀此生理盐水备用。
7.2.4软管、乳液瓶的稀释:取10ml消毒过的生理盐水倒入待测定的软管、乳液瓶内,并上下左右摇晃至少5次,使生理盐水与软管、服液瓶内壁完全接触清洗,倒出生理盐水于100ml烧杯内备用,同时计算出待测定之软管、乳液瓶内表面的总表面积。
