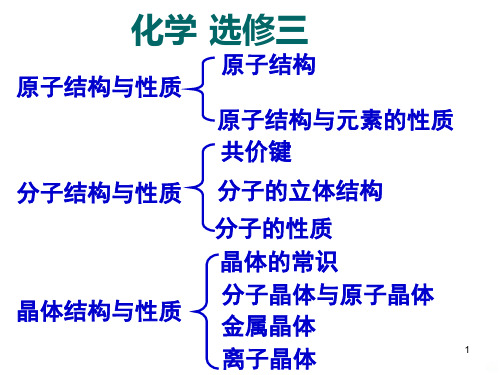
2018版高中化学苏教版选修3课件:专题4 专题知识网络构建 Word版含解析
高中化学苏教版选修3课件:专题4 第二单元 第1课时

实验操
作步骤 实验 现象 结论 三支试管中先生成 蓝色沉淀 ,之后随浓氨水的滴入,沉淀逐 渐 溶解 ,最后变为 深蓝色溶液 。 生成Cu(OH)2蓝色沉淀且溶于浓氨水 _________________________________
(1)写出上述反应的离子方程式。
答案 Cu2++2NH3· H2O===Cu(OH)2↓+2NH+ 4
故中心离子的化合价为+3; 配离子的电荷数为+1。
1
2
3
4
5
解析
答案
本课结束Βιβλιοθήκη 专题4 第二单元配合物的形成和应用
第1课时
配合物的形成与空间构型
学习目标定位 1.认识简单配合物的概念、基本组成及形成条件。 2.能够根据配位数及中心原子轨道杂化类型判断配离子 的空间构型。
内容索引
新知导学 —— 新知探究 达标检测 —— 当堂检测
点点落实 巩固反馈
新知导学
一、配合物的形成
1.按表中实验操作步骤完成实验,并填写下表:
4 ___
sp sp2
sp3
- 2+ NH 和 Cl Pt 2.配合物Pt(NH3)2Cl2的中心原子是 ,配位体是 。 3
(1)Pt(NH3)2Cl2 为平面正方形构型, 2 个相同的配位体在 Pt 原子的同一侧 的称为顺式 ( 常称为 “ 顺铂 ”) ,不在同一侧的称为反式 ( 常称为 “ 反 铂”)。分别写出其结构简式。 答案
[Cr(H2O)5Cl]Cl2· H2O,故选B。
解析 答案
学习小结
达标检测
1.向盛有少量NaCl溶液的试管中滴入少量AgNO3溶液,再加入氨水。下 列关于实验现象的叙述不正确的是 A.先生成白色沉淀,加入足量氨水后沉淀消失
高中化学选修三--全套课件

能层 K L
M
N
能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
能级 电子 2 2 6 2 6 10 2 6 10 14
数
能层 2 8 电子
18
32
数 2n2 2n2
2n2
2n2
三、构造原理与电子排布式
1、构造原理
多电子基态原子的电子按能级交错的形式排布
电子排布顺序 1s
→ 2s → 2p → 3s → 3p → 4s → 3d → 4p → → 5s → 4d → 5p → → 6s → 4f → 5d → 6p……
第二章
分子的结构与性质
第一节 共价键 高二化学组
第一课时
• 教学目标: • 1、复习化学键的概念,能用电子式表示常
见物质的离子键或共价键的形成过程。 • 2、知道共价键的主要类型δ键和π键。 • 3、说出δ键和π键的明显差别和一般规律。
一、共价键
1、化学键及其分类
相邻原子或离子之间强烈的相互作用
σ键 按成键方式 按电子云 π键 重叠方式
极性共价键 不同原子 成键
非极性共 同种原子
价键
成键
4、σ键
定义: 两个原子轨道沿键轴方向 以“头碰头”的方式重叠
H
H
HH
HH
Cl
Cl
H
H
①类型 s-s σ键 例:H2 s-p σ键 例:HCl p-p σ键 例:Cl2
HH
Cl H
HH
②特点 头碰头 重叠程度大,稳定性高
周期序数 起始原子序数 终止原子序数 元素种类
短
一
1
2
2
周
二
3
10
高中化学选修三全套共张PPT课件
处于一定空间运动状态的电子在原子核外空间
的概率密度分布的形象化描述
小黑点:概率密度
单位体积内出现的概率
小黑点越密概率密度越大
小黑点不是电子!
23
②电子云轮廓图
电子出现的概率约为90%的空间
即精简版电子云
③电子云轮廓图特点
a.形状
ns能级的电子云轮廓图:球形
np能级的电子云轮廓图:双纺锤形
nd能级的电子云轮廓图:多纺锤形
能级符号:ns、np、nd、nf…… n代表能层
最多容纳电子的数量 s:2 p:6 d:10 f:14
能层: 一
K
二
L
三
M
四……
N ……
能级: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
14
3、注意问题
①能层与能级的关系
每一能层的能级从s开始,s,p,d,f……
能层中能级的数量不超过能层的序数
2、电离能
①第一电离能
气态电中性基态原子失去一个电子转
化为气态基态正离子所需最低能量
同周期主族元素第一电离能从左至右逐渐升高
ⅡA、ⅤA反常!比下一主族的高
②逐级电离能
利用逐级电离能判断化合价
43
3、电负性(第三课时)
键合电子:参与化学键形成
原子的价电子
孤对电子:未参与化学键形成
①电负性
不同元素的原子对键合电子吸引能力
②特点
头碰头
重叠程度大,稳定性高
轴对称
可绕键轴旋转
H
Cl
s-p σ键
H
H
56
5、π键
定义:两个原子轨道以平行
即“肩并肩”方式重叠
苏教版高三化学选修3物质结构与性质(全套)精品课件

第二单元 离子键 离子晶体
苏教版高三化学选修3物质结构与 性质(全套)精品课件
苏教版高三化学选修3物质结构与 性质(全套)精品课件
第二单元 元素性质的递变规律
苏教版高三化学选修3物质结构与 性质(全套)精品课件
专题3 微粒间作用力与物质的 性质
苏教版高三化学选修3物质结构与 性质(全套)精品课件
第一单元 金属键 金属晶体
苏教版高三化学选修3物质结构 与性质(全套)精品课件目录
0002页 0066页 0091页 0167页 0Байду номын сангаас01页 0344页
专题1 揭示物质结构的奥秘 第一单元 原子核外电子的运动 专题3 微粒间作用力与物质的性质 第二单元 离子键 离子晶体 第四单元 分子间作用力分子晶体 第二单元 配合物的形成和应用
专题1 揭示物质结构的奥秘
苏教版高三化学选修3物质结构与 性质(全套)精品课件
专题2 原子结构与元素的性质
苏教版高三化学选修3物质结构与 性质(全套)精品课件
第一单元 原子核外电子的运动
2017-2018学年高中化学苏教版选修3课件: 专题4第一单元 分子构型与物质的性质 课件(49张)

2.价层电子对互斥模型
成键电子对 和_____________) 孤电子对 分子中的价电子对(包括_____________ 由 相互排斥 作用,而趋向于尽可能彼此远离以减小 于_____________
斥力 对称 _____________ ,分子尽可能采取___________ 的空间构型。 越小 电子对之间的夹角越大,排斥力_____________ 。 价电子 3.“等电子原理”是指具有相同_____________ 数和相同 原子 分子或离子 具有相同的结构特征。 ___________ 数的_______________
探究导引2 影响?
孤电子对和成键电子对对分子空间结构有哪些
提示:价层电子对包含孤电子对和成键电子对。价层电子对之间 存在相互排斥作用,它们总是趋向于尽可能相互远离。其相互关 系可简单表示如下: (价层电子对=成键电子对+孤电子对) 价层电子对数 价层电子对构型 2 直线形 3 平面三角形 4 正四面体形
180°
120° 平面三角形
BF3
109.5°
正四面体形 CH4、CCl4
直线形
BeCl2、C2H2
特别提醒
(1)杂化轨道间的夹角与分子内的键角不一定相
等,中心原子杂化类型相同时,孤电子对越多,键角越小; 无孤电子对时,键角相同。 (2)杂化轨道数与参与杂化的原子轨道数相同,但能量不同。 (3)杂化轨道应尽量占据整个空间使它们之间的排斥力最小。 (4)杂化轨道的类型与分子的空间构型有关。
1.下列关于苯分子结构或性质的描述错误的是( D ) A.苯分子呈平面正六边形,六个碳碳键完全相同,键角皆 为 120° B. 苯分子中的碳原子采取 sp2 杂化,6 个碳原子中未参与杂 化的 2p 轨道以“肩并肩”形式形成一个大 π 键 C.苯分子中的碳碳键是介于单键和双键之间的一种特殊类 型的键 D.苯能使溴水和酸性 KMnO4 溶液褪色
【新素养】苏教版化学选修三课件:专题4 分子空间结构与物质性质 第一单元 第2课时

01
一、 价层电子对互斥模型
1.价层电子对互斥模型的基本内容 分子中的 价电子对(包括成键电子对和孤电子对)由于相互 排斥 作用,而趋向于尽 可能彼此远离以减小斥力,分子尽可能采取对称的空间构型。 (1)当中心原子的价电子全部参与成键时,为使价电子 斥力最小 ,就要求尽可能采 取 对称 结构。 (2)当中心原子的价电子部分参与成键时,未参与成键的孤电子对与成键电子对之 间及孤电子对之间、成键电子对之间的斥力 不同 ,从而影响分子的空间构型。 (3)电子对之间的夹角越大,相互之间的斥力 越小 。
示例 CO2、BeCl2 CH2O、BF3 CH4、CCl4
2.中心原子上有孤电子对(价电子中未参与形成共价键的电子对)的分子的几何构 型:中心原子上的 孤电子对占据中心原子周围的空间,与 成键电子 互相排斥,
使分子的几何构型发生变化,如:H2O、NH3等。 ①H2O为AB2型分子,氧原子上有 两对孤电子对 参与互相排斥,所以H2O分子 的空间构型为V形而不是四面体型。 ②NH3分子中氮原子上有 一对孤电子对 参与互相排斥,故NH3的空间构型是三角 锥型。
D项,磷原子有一对未成键的价电子对。
二、价层电子对互斥模型的应用——预测分子的几何构型
1.中心原子中的价电子全部参与形成共价键的分子的几何构型如下表所示(由中心 原子周围的原子数m来预测):
ABm m=2 m=3 m=4
几何构型 _直__线__形__ _平__面__三__角__形__ _正__四__面__体___
注意 (1)价层电子对互斥模型是价电子对的空间构型,而分子的空间构型指的是 成键电子对的空间构型,不包括孤电子对。两者是否一致取决于中心原子上有无 孤电子对(未用于形成共价键的电子对),当中心原子上无孤电子对时,两者的构 型一致;当中心原子上有孤电子对时,两者的构型不一致。 (2)常见的分子空间构型:直线形、V形、平面三角形、三角锥型、四面体型等。
高中化学苏教版选修3课件:专题4 第一单元 第1课时

直线 形(如BeCl2)。 (3)sp杂化后,未参与杂化的两个np轨道可以用于形成π键,如乙炔分子中 的C≡C键的形成。
相关视频
2.sp2杂化——BF3分子的形成
(1)BF3分子的形成
(2)sp2杂化:sp2杂化轨道是由 1个ns 轨道和 2个np 轨道杂化而得,每个
2 1 p s 2 sp 杂化轨道含有 3 和 3 的成分。sp2杂化轨道间的夹角为 120°,呈
CH4为什么具有正四面体的空间构型?
答案 在形成CH4分子时,碳原子的一个2s轨道和三个2p轨道发生混杂, 形成四个能量相等的sp3杂化轨道。四个sp3杂化轨道分别与四个H原子的1s 轨道重叠成键形成CH4分子,所以四个C—H是等同的。可表示为
答案
2.由以上分析可知: (1)在外界条件影响下,原子内部能量相近的原子轨道重新组合形成一组 新轨道的过程叫做原子轨道的杂化,重新组合后的新的原子轨道,叫做 杂化原子轨道 ,简称 杂化轨道 。 (2)轨道杂化的过程: 激发→杂化→轨道重叠 。 3.杂化轨道理论要点 (2)参与杂化的原子轨道数 等于 形成的杂化轨道数。 (3)杂化改变了原子轨道的 形状、 方向 。杂化使原子的成键能力 增大 。
3.有关杂化轨道的说法不正确的是 A.杂化前后的轨道数不变,但轨道的形状发生了改变 B.sp3、sp2、sp杂化轨道的夹角分别为109.5°、120°、180° D.杂化轨道全部参与形成化学键 √ C.部分四面体型、三角锥型、V形分子的结构可以用sp3杂化轨道解释
解析
答案
学习小结
达标检测
1.下列叙述正确的是 A.BeCl2中Be原子的杂化方式为sp2 B.H2O分子中氧原子的杂化方式为sp2 C.BF3分子的构型呈三角锥型
3杂化 sp (4)H2S分子中的S:____________。
苏教版高中化学选修3《共价键的形成和类型》名师课件

z
πz
y
y
x
N
σ N
πy
σ键和π键的比较
键型
项目
σ键
成键方向
沿轴方向“头碰头”
电子云形状
轴对称
π键
平行方向“肩并肩” 镜像对称
牢固程度
强度大,不易断裂
强度较小,易断裂
成键判 断规律
共价单键是σ键,共价双键中一个是 σ键,另一 个是π键,共价三键中一个是σ键,另两个为π键。
小试身手
1、乙烯和乙炔分子中的共价键分别由几个σ键和 几个π键组成?
2、回忆乙烯、乙炔与溴发生加成反应的反应方程式。 并思考:在乙烯、乙炔和溴发生的加成反应中,乙烯、 乙炔分子断裂什么类型的共价键?为什么?
都断π键,因为形成σ键时电子云重叠程度要比形成 π键时大得多,所以,碳原子与碳原子之间形成的σ 键比π键牢固。一般在有机化学反应中,π键易断裂
【问题四】
结合F2和HF的电子式,依据元素电负性的强弱, 你能判断F2和HF中的共用电子对是否发生偏移?
合物属于共价化合物。
5.影响共价键强弱的主要因素 键长(成键原子的核间距)
一般键长越 小 ,键能越 大 ,共价键越 稳定 , 分子就越 牢固 。 6. 共价键的表示方法:电子式、结构式
练一练
请写出下列物质的电子式和结构式: H2O NH3 CCl4 C2H4共用电子对结合? 降低体系能量, 由不稳定趋于稳定
【问题五】
在水溶液中,NH3能与H+结合生成NH4+请用电子式 表示N和H形成NH3的过程并讨论NH3和H+是如何 形成NH4+的?
﹕﹕ ﹕﹕
H H ﹕N﹕ + H+→
H
H+ H ﹕N﹕ H 或
高中化学选修三__全套课件
2021/5/27
35
知识与技能目标:
• 1、掌握原子半径的变化规律
• 2、能说出元素电离能的涵义,能应用元素的电离能说明 元素的某些性质
• 3、进一步形成有关物质结构的基本观念,初步认识物质 的结构与性质之间的关系
• 4、认识主族元素电离能的变化与核外电子排布的关系
• 5、认识原子结构与元素周期系的关系,了解元素周期系 的应用价值
54
18
55
86
32
87
118/112 32/26
第七周期也称为不完全周期
镧系:57~71 锕系:89~103
2021/5/27
39
2、族元素周期表的纵行
7主族:A结尾 ,ⅠA~ⅦA 族 7副族:B结尾 , ⅢB~ⅦB,ⅠB,ⅡB
1 Ⅷ族: 16
1 0族:
特点:副族、Ⅷ族通称过渡元素,过渡金属 主族元素族序数=原子最外层电子数
2021/5/27
37
一、原子结构与元素周期表 (一课时)
1、周期 元素周期表的横行
①特点 同周期元素电子层数相同 同周期元素从左至右原子依次序数递增
2021/5/27
38
②周期的组成
周期序数 起始原子序数 终止原子序数 元素种类
短
一
1
2
2
周
二
3
10
8
期
三
11
18
8
长
四
周
五 六
期
七
19
36
18
37
能层: 一 二
三
KL
M
四…… N ……
能级: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
2018-2019学年化学苏教版选修四试题:专题3 第四单元 难溶电解质的沉淀溶解平衡 课后达标检测 Word版含答案

课后达标检测[基础巩固]1.下列说法不正确的是()A.K sp只与难溶电解质的性质和温度有关B.由于K sp(ZnS)>K sp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀C.其他条件不变,离子浓度改变时,K sp不变D.两种难溶电解质作比较时,K sp小的溶解度一定小解析:选D。
相同温度下不同的难溶电解质,溶度积常数不同,这是由物质本身的性质决定的,对同一难溶电解质来说,温度不同,K sp不同,K sp不受其他因素的影响。
同种类型的难溶电解质K sp越小,溶解度越小。
2.一定温度下,在Ba(OH)2的悬浊液中,存在Ba(OH)2固体与其电离的离子间的溶解平衡关系:Ba(OH)2(s)Ba2++2OH-,向此体系中再加入少量的BaO粉末,如果保持温度不变,则下列说法正确的是()A.c(Ba2+)增大B.溶液中Ba2+数目减少C.溶液pH减小D.溶液pH增大解析:选B。
一定温度下,在Ba(OH)2的悬浊液中,存在Ba(OH)2固体与其电离的离子间的溶解平衡关系:Ba(OH)2(s)Ba2++2OH-,加入少量的BaO粉末,BaO与H2O反应消耗了水,溶液中有部分沉淀析出,且溶液仍为饱和溶液,c(Ba2+)、c(OH-)、pH均不变。
3.已知K sp(AgCl)=1.56×10-10,K sp(AgBr)=7.7×10-13,K sp(Ag2CrO4)=9.0×10-12。
某溶液中含有Cl-、Br-和CrO2-4,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L -1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为()A.Cl-、Br-、CrO2-4B.CrO2-4、Br-、Cl-C.Br-、Cl-、CrO2-4D.Br-、CrO2-4、Cl-解析:选C。
利用沉淀溶解平衡原理,当Q c>K sp时,有沉淀析出。
2017-2018学年高中化学苏教版选修3课件: 专题4第二单元 配合物的形成和应用 课件(34张)

2.顺式Pt(NH3)2Cl2和反式Pt(NH3)2Cl2的化学式相同,它们
的性质也相似吗? 提示:不同,由于结构不同,所以其化学性质不相同。 配合物 顺式 [Pt(NH3)2Cl2] 反式 [Pt(NH3)2Cl2] 水中溶解 抗癌活性 性 0.257 7 g/100 g 棕黄色 极性 有活性 H2O 0.036 6 淡黄色 非极性 g/100 g 无活性 H2O 颜色 极性
二、配合物的应用 1.在实验研究中,人们常用形成配合物的方法来检验 金属离子 _______________ 、分离物质、定量测定物质的组成。
(1)向AgNO3溶液中逐滴加入氨水的现象为 先生成沉淀,然后沉淀再溶解 。产生的配合物是 ______________________________ [Ag(NH3)2]OH _______________________ 。 (2)向FeCl3溶液中滴入KSCN溶液的现象: 有血红色溶液出现 ________________________ 。产生的配合物是
________________________________.
(2)配位键:共用电子对由一个原子单方向提供而跟另一个 原 子共用的共价键。配位键可用A→B形式表示___ 的原子,叫做电 子对给 予体,B 是 接受孤电子对 ____________________ 的原子,叫做电子对接受体。 (3)形成配位键的条件 N、O、F 等。 孤电子对 的原子,如 _____________ ①有能够提供____________ 孤电子对 ②另一原子具有能够接受_______________ 的空轨道,如 Fe3+、Cu2+、Zn2+、Ag+ __________________________________ 等。
Fe(SCN)3 _______________ 。
