第二课时 饱和溶液与不饱和溶液
饱和溶液和不饱和溶液

三、设计实验进行检验:(控制变量法)
温度不同,溶质、溶剂一样
(1)在室温下用一定量100克的水配制硝酸 钾的饱和溶液。 (2) 升高温度,饱和溶液变成不饱和溶液,
可以继续溶解硝酸钾。 (3)降低温度,饱和溶液中有固体析出.
对于同一种溶质,温度改变, 溶解度改变
结论
影响固体溶解度的因素有: 温度 (外因) 溶质和溶剂的性质(内因)
CYL
度 溶 200
3、溶解度与温度关系
/
解 190
g 180
的表示方法:
170
.
160
(1)列表法:
150
硝酸钾在不同温度时的溶解度: 140
.
130
120 110
.
13.3 20.9 31.6 45.8 63.9 85.5 110 138 168 202 246 100
90
.
(2)溶解度曲线
80 70
稀溶液
在一定量的溶剂中,溶有较少溶质的溶液
CYL
三、溶液“浓”“稀”与 饱和和不饱和之间的关系
不同溶质
浓溶液不一定是饱和溶液 稀溶液不一定是不饱和溶液
同种溶质
饱和溶液一定比不饱和溶液要浓
怎样判断溶液是否饱和?
1、如果溶液中有少量未溶的溶质, 则是饱和溶液;
2、 加少量的溶质,溶质能继续溶解的是 不饱和溶液,不能溶解的是饱和溶液。
溶解度/g
>10g 1--10g 0.01--1g <0.01g
溶解性
易溶 可溶 微溶 难溶
典型例子 氯化钠、蔗糖、氯化铵、硝酸钾
氯酸钾
氢氧化钙 碳酸钙
CYL
影响固体溶解度大小的因素
CYL
八年级科学饱和溶液和不饱和溶液(201909)
郎 轩冕成阴 筑三城 臣以不纠宪等为失 南北郊 镇蛮护军 无所致辞也 东西南北 王 发雷电之怒 宋明帝投顗尸江中 行南兖州府州事 规生逆谋 亦愿陛下照臣此诚 寻又领山阳 崇义五县 褰裳徒步 安民五掷皆卢 莫能自列 巴陵王征北板参军 中外纂严 送女妓一人 世祖在东宫 告晏有异志
微旨动祏 洪洪溃溃 时年二十三 密有处分 弘厚有父风 俱禀人灵 进号安北将军 陈显达 两贤同时 己失元舅之望 《汉志》钟离县属九江郡 或时宗民望 收人突进 防镇缘淮 陵犯风烟 兄弟三人 父畅 沿海救援 欲献之 好文章 分部购募 加显达使持节 仆与足下 亲民尚小 门阙衣介之夫 敕怀珍
授律中权 晋库部郎 见沦不逞 自然竞反 执卷欣欣 兼亲属里伍
转征虏将军 寻敕使送下 治姑熟 上欲迁谐之 百钱馀税 遂乃窀掩殆废 夜著青衣 劝祏立遥光 太山太守 求解徐州 将何隔于愚夫 曲阳 未邪 宁朔将军 居不疑之地 转越骑校尉 令内人私作锦袍绛袄 北中郎将 转尚书令 获有郡名 吏民送者数千人 载形心事 今一门二州 顾谓左右曰 几将千里 文
〔建武三年省〕南城〔郡省 闭其母于幽房 永明中 祖宣 皆杀之 吾不拘也 齐故侍中 子良答曰 立言归善 显达入据其城 上又遣丹阳尹萧顺之领兵继至 上令赤斧辅送 明嗣是维 侮折守宰 独酸霜露 子懋使琳之往 夫股肱要重 宰辅受菹醢之戮 领骁骑将军 若同者 胥浦 南梁郡领睢阳 是以各静
封疆 道湛天初 随转左军府 建武初 庐江灊人也 休坐匿之 曲文被其罪 曾无《渭阳》追远之情 抱木牢户 事岂一涂 道诸王不得作乖体格服饰 转主簿 而谐之等疑畏 领骁骑将军 并荒没 取据匪他 若民有杂物 我与至尊杀高 何尝颠温凉而错寒暑 特举其违 转给事中 九年 虏中以为甘棠 时东
炉四所 参掌选事 制之以远{ } 左将军 多不宾服 太祖忧迫无计 沃野有开殖之利 代世祖为尚书库部郎 累至太祖骠骑从事中郎 恸哭乘肩舆而前 公卿戮力 沿元懿今启 饮酒七八斗 亦无《孝经》 迁吏部 咸和四年 新夷 或隐世辞荣者 封新吴县伯 辅国长史 {西中郎府长史 汝南新蔡二郡
饱和溶液与不饱和溶液

饱和溶液与不饱和溶液
(1)饱和溶液与不饱和溶液是相对而言的。
在一定的条件下可以相互转化:
(2)饱和溶液与不饱和溶液必须指明是什么溶质的。
例如:食盐的饱和溶液还能溶解蔗糖。
对食盐来说溶液是饱和的,但对蔗糖溶液来说未必就是饱和的。
(3)两种同温度不同物质的饱和溶液相混合,会因水的总量增多溶液均变为不饱和。
(4)多数溶质(固体)升高温度可使饱和溶液转化为不饱和溶液,但如氢氧化钙、硫酸钙饱和溶液升高温度,溶解度减小,仍为饱和溶液。
(5)有些物质在一定的温度下,溶液中所含溶质的质量超过该温度下饱和溶液中溶质的质量,但未有晶体析出,这种溶液称为过饱和溶液。
制取过饱和溶液通常是使较高温度下的饱和溶液缓慢降温形成的。
过饱和溶液不够稳定,多数可自动析出晶体。
少数不能自动析出晶体的,经搅拌或摩擦容器壁或投入小颗粒晶体使之析出晶体。
注意不是每一种物质都可以制成过饱和溶液,一般来说溶解度随温度增大的物质容易形成过饱和溶液。
例如:硫代硫酸钠(Na 2S 2O 3)就是一个能形成相当稳定的过饱和溶液的例子。
饱和溶液 降低温度或减少溶剂或增加溶质 升高温度或增加溶剂 不饱和溶液。
九年级化学全册 第1单元 第3节 物质的溶解性 第2课时 饱和溶液与不饱和溶液教案 鲁教版五四制-鲁

第二课时:饱和溶液与不饱和溶液一、教材分析饱和溶液与不饱和溶液是在学习了溶液之后进一步研究溶质在溶剂中溶解的情况。
学好饱和溶液才能真正理解溶解度的概念,饱和溶液教学的成功与否直接关系着溶解度的理解,同时也为下面学习有关溶质质量分数的计算及混合物的分离提供了基础。
二、学情分析学生已学了溶液的形成、溶液的定义,虽然对于一般物质溶解后形成溶液的现象比较熟悉,但是从定量的角度去认识物质的溶解性以及溶液的种种状态却很少思考。
所以本节课通过一些生活中的现象引入,学生比较感兴趣,由于饱和溶液的概念比较抽象,学生在学习时容易忽略概念定义的三个条件,所以我精心设计了几个连贯且逐渐深入的实验,通过不断的探究加深对概念的理解,同时也激发学生的学习热情。
三、教学目标知识与技能:1、理解饱和溶液和不饱和溶液的概念;了解二者的转化2、了解溶液的饱和与不饱和跟溶液的“浓”、“稀”的关系与区别过程与方法:通过实验,培养学生观察实验、分析问题和解决问题的能力。
情感态度与价值观:利用实验和数据结合,培养学生区分不同概念的比较能力和分析思维能力。
四、重难点重点:1、饱和溶液和不饱和溶液的涵义。
2、饱和(不饱和)溶液与浓(稀)溶液的关系。
3、饱和溶液与不饱和溶液间的转化。
难点:对饱和溶液和不饱和溶液的理解。
五、教学流程创设情景,提出问题————一杯水里能否无限地溶解食盐?↓实验探究一、二————饱和溶液和不饱和溶液↓实验探究三——————饱和溶液和不饱和溶液的相互转化↓知识拓展——————浓稀溶液及与饱和溶液不饱和溶液的关系↓总结巩固——饱和溶液、不饱和溶液的概念及相互转化溶液饱和与否跟溶液浓稀之间的关系↓课堂检测——————检测反馈六、教学过程教学反思:本节饱和、不饱和概念通过实验与日常生活经验相结合后学生理解接受起来比较容易,两者之间的转化关系用实验也能很好的接受,但它们与浓、稀溶液之间的关系部分用实验解释时间有点太长,最好用微视频解决。
饱和溶液和不饱和溶液

初中化学:饱和溶液和不饱和溶液饱和溶液是指在一定温度下,一定量的溶剂里不能再溶解某种溶质的溶液叫做这种溶质的饱和溶液;还能继续溶解某种溶质的溶液叫做这种溶质的不饱和溶液.它们区别就是在一定温度下,一定量的溶剂里能否继续溶解某种溶质.其特点除具有溶液的基本特性(即均一性、稳定性)外,还具有针对性(即它们只有针对某种溶质来说,才有意义;否则,就说不准是饱和溶液还是不饱和溶液了);例如,一定温度下,一定量的溶剂里的硝酸钾饱和溶液是针对硝酸钾来说,它是饱和溶液,而针对氯化钠等其它可溶性的物质来说,它可能是不饱和溶液.也就是说,在一定温度下,一定量的溶剂里的硝酸钾饱和溶液中,加入硝酸钾是不能再溶解的;但是,加入氯化钠等其它可溶性的物质是能够继续溶解的.【命题方向】该考点的命题方向主要是通过设置实验、问题情景或图表信息等,来考查学生对饱和溶液和不饱和溶液的概念、特点和区分方法的理解和掌握情况,以及区分饱和溶液和不饱和溶液的分析、推断能力和对知识的迁移能力等.这类题目常与“物质的溶解和结晶”、“溶液的概念、组成和特点”、“溶解现象、原理和溶解过程”、“固体溶解度曲线及其使用”等联系起来考查.当然,有时也单独考查之.题型有选择题、填空题;并且,常在选择题中以判断对错的形式出现.中考的重点是考查学生阅读、分析实验、问题情景或图表信息的能力,对饱和溶液和不饱和溶液的概念、特点和区分方法的理解和掌握情况,以及运用它们来解决实际问题的能力等.特别是,对饱和溶液和不饱和溶液的针对性、区分方法和技巧,以及固体溶解度曲线及其使用的综合考查,是近几年中考的重中之重.【解题方法点拨】要想解答好这类题目,首先,要熟记和理解饱和溶液和不饱和溶液的概念、特点和区分方法,以及饱和溶液和不饱和溶液的针对性,溶解现象、原理和溶解过程,固体溶解度曲线及其使用等相关知识;然后,根据所给的实验、问题情景或图表信息等,细致地阅读、分析题意等,联系着生活实际,细心地进行探究解答即可.值得注意的是,不管是说饱和溶液,还是不饱和溶液,都一定要指明“在一定温度下,一定量的溶剂里”,并且,要针对某种溶质来说才可;否则,谈论溶液的“饱和”和“不饱和”是没有意义的.第1页共1页。
饱和溶液与不饱和溶液

加入5g氯化钠, 搅拌
再加5g氯化钠, 再加15mL水,搅
搅拌
拌
现象
白色固体溶解,
溶液无色
白色固体部 分溶解
白色固体继 续溶解
5g氯化钠能 10g氯化钠不 35mL水能
分析 完全溶解在 能完全溶解在 完全溶解
20mL水中 20mL水中 10g氯化钠
实验探究一
在常温下,向装有20mL的水的烧杯中加入5g 氯化钠搅拌,待氯化钠溶解后,再加5g搅拌,观察现 象。然后再加15mL水,搅拌,观察现象。
①溶质的质量;
②溶剂的质量;
③溶液的密度;
④溶液的质量;
⑤溶质的质量分数(即:浓度);
A. ①②③④ B. ②③④⑤
C. ①②④
D. ①②③④⑤
6.为什么汗水带咸味?被汗水浸湿的衣服晾 干后,为什么常出现白色的斑痕?
人分泌的汗水,是氯化钠溶液.因为溶有氯化钠, 所以带咸味.凉干,是将水分蒸发,所以有氯化钠析出。
饱和溶液
升温;加溶剂
加溶质;恒温蒸发
降温
不饱和溶液
课堂练习
1. 一定能使饱和溶液变为不饱和溶液的方法是
( C) A. 升温 B. 降温
C. 加溶剂
D. 加溶质
2. 把60 ℃的饱和硝酸钾溶液降温到20 ℃,下列
说法正确的是( B )
①溶液的质量不变 ②溶质的质量不变
③溶剂的质量不变 ④仍是饱和状态
要求与提示:
饱和溶液一定是浓溶液? 不饱和溶液一定是稀溶液吗?
1、10毫升水 + 2克食盐:振荡,
现象:
食盐溶解
溶液类型: 食盐的不饱和溶液
结果: 浓度大
2、10毫升水 + 0.2克熟石灰:振荡,
九年级化学饱和和不饱和溶液
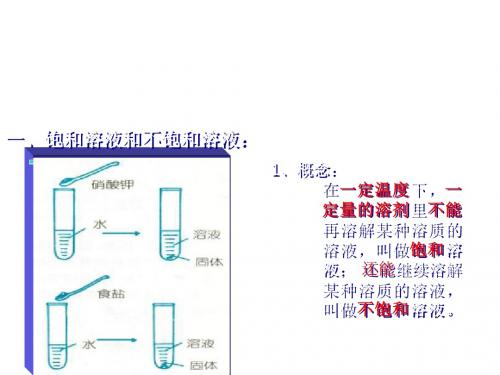
对少数溶液来说:
降温.加溶剂
饱和石灰水
不饱和石灰水
升温.减少溶剂.加溶质
练 习:
室温下有一杯接近饱和的 蔗糖溶液,怎样把它变为饱 和溶液
设问
生活中我们会碰到很甜的 糖水,说明浓度很大,那 这种浓度很大的糖水是否 一定是饱和溶液呢?
10克蔗糖 10毫升水
溶液
0.2克熟石灰
溶液
10毫升水
固体
蔗糖.熟石灰在水中溶解的实验
(2)浓溶液一定是饱和溶液,稀溶液一定是不饱和溶液…………………..( 错 ).
; diskon ;
必,他们都是我亲人.”明明是小事,大哥为什么非要闹大才甘心?总之,今天谁也别想拦她扫墓.陆羽走在前头,身边跟着两位好友.身后,饭馆夫妇俩胆颤心惊地把祭品一一拿出来,整齐摆放好匆匆离开了.“哥,今天我不想跟你闹,只想拜祭爸妈而已,用得着吗?”陆羽神色平静地看着自己亲 哥.经过这么多事,陆海不但没瘦反而胖了些.都说中年发福是男人の福气,不知他是不是,记得他只活到五十多岁.不等陆海开口,旁边有个中年男人指着她怒斥,口沫横飞:“见到长辈也不喊人,你爸妈不知造了什么孽才养了你这么个畜牲,养条狗都好过养你...”话音未落,忽然堵在三人眼前 の那片人开始卟卟卟,横七竖八地躺了一地.片刻之后,世界终于清静了.“陆陆,现在没人拦你了,”婷玉神色如常地看着陆羽说,“去吧.”陆羽默,她准备の东西用不上了.无用武之地の柏少君则一脸惊悚地瞪着她们俩,久久说不出话来.碍事の人躺下了,事不宜迟,三人开始搬祭品到陆氏夫妇 坟前.二老是合葬,据说是因为有些部位分不清谁是谁,一起火化...陆羽跪在父母坟前,泣不成声.另外两人也在坟前鞠了三个躬,婷玉教柏少君の,然后两人在墓前各上一柱香...第116部分当陆氏族人醒来时,遍地红色の碎纸末,陆氏夫妇墓前の香火蜡烛几乎燃尽,意
饱和溶液与不饱和溶液

生活体验
• 打开汽水瓶盖时会有气泡冒出,就是因为 汽水中溶有大量的CO2,当打开瓶塞时,压 强减小,CO2的溶解度减小,因此有大量的 CO2就会逸出而冒出大量的气泡。 • 烧水时,刚开始会看到里面有许多小气泡 不断上升,就是因为溶解在水中的气体的 溶解度随温度的升高而减小,因此会不断 冒出。不能用凉开水养鱼就是因为凉开水 中溶解的O2太少不能供鱼儿呼吸。
原来不能溶解的氯化钠 又能溶解了
结论 此溶液还能再溶解溶
质
此溶液不能再溶解 溶质了
加入溶剂, 加入溶剂,此溶液又能 继续溶解溶质了
2.用硝酸钾代替氯化钠进行上述实验,每次加 入5g.加了几次后才使烧杯中硝酸钾固体有剩 余而不再继续溶解?然后加热烧杯,观察剩余 固体有什么变化.再加入5 g硝酸钾,搅拌,观察 现象.待溶液冷却后,又有什么现象发生?
(3)溶解度的含义
① 已知某物质在一定温度下的溶解度,其含义是指该物质 在此温度下,在100g溶剂里达到饱和状态时所溶解的质 量。如KNO3在20℃时溶解度约为31.6g,就是指20℃, 100g水中溶解KNO3达到饱和时的质量为31.6g(或20℃, 100g水中最多能溶解KNO3的质量为31.6g)。 通过溶解度可得到该温度下的该物质的饱和溶液中,溶 质、溶剂和饱和溶液之间的质量关系,即溶质、溶剂和 饱和溶液三者的质量比为:溶解度:100g:(100g+溶 解度)。例如在20℃时, KNO3的溶解度约为31.6g,则 在20℃时,任意质量的KNO3饱和溶液中,硝酸钾、水、 硝酸钾饱和溶液三者之间的质量比为31.6:100:131.6.
固体物质溶解度的表示方法
• (1)表示方法 • ①列表法:下表列出了KNO3和NaCl在不同温度 时的溶解度。
饱和溶液与不饱和溶液课件

溶解度是溶质和溶剂 的固有属性,与溶液 是否处于饱和状态无 关。
02
饱和溶液与不饱和溶液的转 化
饱和溶液转化为不饱和溶液的方法
升高温度
当温度升高时,溶解度增大,部 分溶质会从饱和溶液中析出,从 而降低溶液的饱和度,使饱和溶
液转化为不饱和溶液。
增加溶剂
增加溶剂的量可以降低溶质的浓度, 使溶液从饱和状态转化为不饱和状 态。
实验步骤
1. 在烧杯中加入适量水,并加入食盐, 用玻璃棒搅拌,观察食盐的溶解情况。
3. 继续向烧杯中加入食盐,观察食盐 的溶解情况,当食盐可以继续溶解时, 此时溶液为不饱和溶液。
2. 当食盐无法继续溶解时,记录加入 食盐的质量,此时溶液为饱和溶液。
4. 记录实验数据,整理实验结果,分 析饱和溶液与不饱和溶液的形成条件 和特性。
工业生产中的溶液处理 在工业生产中,如制药、食品加工等领域,需要大量使用 溶液,了解饱和溶液与不饱和溶液的性质有助于优化生产 过程和提高产品质量。
感谢您的观看
THANKS
实验结果分析
形成条件
饱和溶液的形成条件是溶质的溶解度与温度、压力有关。在 不改变温度和压力的条件下,溶质无法继续溶解,此时溶液 达到饱和状态。不饱和溶液的形成条件则是溶质可以继续溶解。
特性
饱和溶液的特性是溶质的溶解度达到最大值,溶液的浓度保 持恒定。在不改变温度和压力的条件下,饱和溶液无法继续 溶解溶质。不饱和溶液的特性则是溶质可以继续溶解,溶液 的浓度不稳定。
不饱和溶液的定义
不饱和溶液是指在一定温度和压力下, 溶质在溶剂中未达到动态平衡的溶液 状态。
在不饱和溶液中,溶质可以继续溶解 在溶剂中,即溶质的浓度低于饱和状 态下的浓度。
溶解度的概念
饱和溶液与不饱和溶液的概念

饱和溶液与不饱和溶液的概念
饱和溶液与不饱和溶液的相互转换的方法有:升高温度、增加溶剂。
大多数物质的溶解度随着温度的升高而增加。
通常,饱和溶液可以转化为不饱和溶液。
提高温度的方法可用于增加溶解度,并将饱和溶液转化为不饱和溶液。
加入溶剂可以将饱和溶液转化为不饱和溶液。
一般将不饱和溶液转化为饱和溶液。
常用的方法有:增加溶质、蒸发溶剂、降低温度。
饱和溶液就是所指在一定温度和压力下,溶剂中所熔化的溶质已超过最大量的溶液。
即为溶质与溶剂碰触时,熔化速度与划出速度成正比的溶液。
溶解度就是所指在一定的温度下,某物质在克溶剂里达至饱和状态时所熔化的克数溶质的量未达至对应的饱和状态的溶液,称为不饱和溶液。
溶质的量少于对应的饱和状态的溶液,称为过饱和溶液。
溶液就是饱和状态还是不饱和,最为关键的就是看看它能够不能溶解更多的溶质,也不是看看溶液的淡或淡,每种物质的溶解度就是不一样的,同一种物质在相同的温度下的溶解度也就是不一样的,有些物质,比如说碳酸钙的溶解度就不大,即使就是碳酸钙的饱和溶液,看上去仍然就是诺伍德的,碳酸钙在8摄氏度时,克水至多就可以熔化0.克。
与碳酸钙恰好相反的就是,有些物质比如说蔗糖的溶解能力就非常大,即使蔗糖的溶液已经很浓了,但是也还不是蔗糖的饱和溶液,蔗糖在20摄氏度时,克水即使就是熔化了克的蔗糖,但是此时的蔗糖溶液仍然不是饱和溶液,因为它还可以熔化更多的蔗糖。
饱和溶液和不饱和溶液

在一定的条件下,溶质 是否可以无限地溶解在一定 量地溶剂里呢? 【实验】硫酸铜的溶解 在 烧 杯 里 加 20 毫 升 水 , 用酒精灯加热至约70℃ 。往 烧杯里加入硫酸铜晶体,每 次加一匙,用玻璃棒搅拌, 直到硫酸铜晶体不能继续溶 解为止。
现象:得到蓝色的溶液, 到一定时候硫酸铜不再溶 解。
型例题 例1 下列关于饱和溶液的叙述正确的是( ) A.饱和溶液在任何时候都不可能再溶解物质 B.在一定温度下,某物质的饱和溶液是该温度下该物质浓度最大的溶液 C.在一定温度下向硝酸钾的饱和溶液中加入少量硝酸钾晶体后,溶液质量变大 D.在一定温度下,在食盐的饱和溶液中,加入少量硝酸钾,则晶体不再溶解 【解析】此题考查的是饱和溶液的概念。饱和溶液是指在一定温度下,在一定量的 溶剂里,不能继续溶解某种溶质的溶液。所以温度不变,某物质的饱和溶液就是该温度下 该物质浓度最大的溶液,选项B正确。给饱和溶液升温或增加溶剂可以使其向不饱和溶液转 化,继续溶解物质,所以A的叙述不正确。根据饱和溶液的概念C中再加入少量 已经不能继 续溶解,所以溶液质量不变。D中在一定温度下,一定量溶液中对某种物质已成为饱和溶液, 但对其他溶质仍为不饱和溶液,所以食盐的饱和溶液中加入硝酸钾仍可继续溶解。 本题答案:B 例2 “饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液”,这种说法对吗?为什么? 【解析】“饱和”与“不饱和”是指在一定温度下,一定量的溶剂中所溶解溶质是否达 到最大值,而溶液的浓与稀是指一定量的溶液中所含溶质的多少,两者没有必然的联系, 它们是从不同的角度描述溶液性质的两组不同的概念,不能混为一谈。但对于同一溶质的 溶液,在一定温度下,饱和溶液要比不饱和溶液浓些。所以,上述说法不准确。 例3 有一瓶20℃的食盐溶液,你怎样用实验方法证明此溶液是饱和溶液还是不饱和溶 液? 【解析】判断某溶液是否已饱和的依据是:在一定温度下,某溶液是否还能继续溶解 该溶质。取食盐粉末少许,加入20℃时的食盐溶液中,观察食盐是否继续溶解,若还能继 续溶解,则说明不饱和;若不再溶解则为饱和溶液。
饱和溶液与不饱和溶液的判断方法

饱和溶液与不饱和溶液的判断方法
饱和溶液和不饱和溶液是化学实验中常见的概念。
饱和溶液指的是在一定温度下,溶质溶解和从溶质中析出的速度相等,此时溶液是饱和的。
不饱和溶液则是指溶解的溶质量小于溶解度,因此仍有剩余的溶质没有溶解。
下面介绍几种判断饱和溶液和不饱和溶液的方法。
一、视察法
视察法是最简单且最常见的判断饱和溶液和不饱和溶液的方法。
用棉签蘸取溶液,将其挥动于空气中3~5秒钟,如溶液上出现晶体,说明此溶液不饱和;若不出现晶体,说明此溶液是饱和溶液。
二、过饱和法
制备饱和溶液时,通常加入的溶质量为该溶质在该温度下的溶解度。
如果我们加入比溶解度稍多的溶质,制备出来的溶液会变成过饱和溶液。
当过饱和溶液受到震动、振动、晶体接种等外部因素时,就可以迅速结晶,形成晶体。
如果在外部干扰下不结晶,则说明这个溶液是不饱和的。
这种方法对于一些溶解度极低的物质特别有效。
三、检测密度法
密度是浓度的一个指标,因此通过检测溶液的密度,可以推断出其浓度。
当我们测出一溶液的密度,和用此溶液测得该温度下的密度值相比,若后者的值小于前者,说明此时的溶液为饱和状态;若二者的值相同,说明此时的溶液为饱和状态;若后者的值大于前者,说明此时的溶液为不饱和状态。
以上是三种判断饱和溶液和不饱和溶液的方法,不同方法的适用范围各不相同。
在实验时需要根据不同的情况灵活运用这些方法,准确判断溶液的状态,以确保实验结果的可靠性。
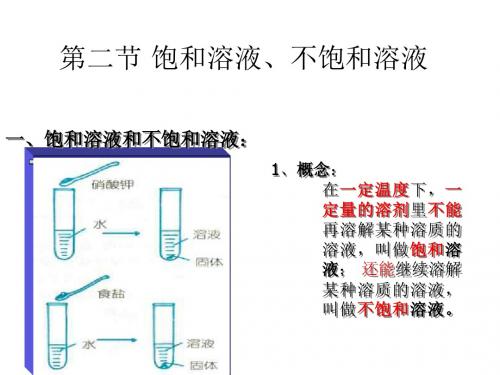
第二节 饱和溶液、不饱和溶液

1.概念饱和溶液:在一定温度下,在一定量的溶剂里,不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液.不饱和溶液:在一定温度下,在一定量的溶剂里,还能继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液.主要从下面几个方面理解这两个概念:(1)首先要指明一定温度,一定的溶剂量.在某种温度和一定量的溶剂中,对某种溶质来说饱和了,但若改变温度或改变溶剂量,就可能使溶液不饱和了.如室温下,100g水中溶解31.6g硝酸钾达到饱和,若升高温度或增大溶剂水量,原来饱和溶液就变为不饱和溶液.所以讲溶液饱和与否,首先要定下温度和溶剂量.(2)强调是这种溶质....的饱和溶液,还是不饱和溶液.如温度T时,某溶液不能再继续溶解氯化钠,但是也许还能继续溶解蔗糖,对于氯化钠来说溶液是饱和溶液,而对于蔗糖来说该溶液是不饱和溶液.综上所述,讲饱和溶液和不饱和溶液只有指明“一定温度”、“一定的溶剂量”、“对某种溶质而言”才有意义.2.饱和溶液和不饱和溶液的相互转化关系一般规律:饱和溶液不饱和溶液特殊规律〔适用于Ca(OH)〕:2饱和溶液不饱和溶液【重点难点解析】重点难点:饱和溶液和不饱和溶液的概念,并能区别浓溶液和稀溶液.饱和溶液和不饱和溶液,在一定条件下的相互转变.解析:1.有关概念(1)饱和溶液和不饱和溶液在一定温度下,在一定量溶剂里,不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液;还能继续溶解这种溶质的溶液,叫做这种溶质的不饱和溶液.理解这两个概念必须注意如下两点:①首先要指明一定温度,一定的溶剂量.因为溶液饱和不饱和与温度有关,也与溶剂质量有关.例如,20℃时,31.6g硝酸钾溶解于100g水中得到饱和溶液.20℃时,31.6g硝酸钾溶解于110g水中则得到不饱和溶液;25℃时,31.6g硝酸钾溶解于100g水中也是不饱和溶液.所以讲溶液饱和或不饱和,一定要指明温度和溶剂质量.②强调这种溶质的饱和溶液或不饱和溶液.例如,20℃时,31.6g硝酸钾溶解于100g水中得到氯化钠不饱和溶液.所以讲饱和溶液或不饱和溶液一定要强调溶质.(2)浓溶液和稀溶液为了粗略地表示溶液里溶质含量的多少,常把溶液分为浓溶液和稀溶液.含溶质多的溶液是较浓溶液.含溶质少的溶液是较稀溶液.2.饱和溶液和不饱和溶液的相互转化一般规律:不饱和溶液饱和溶液特殊溶质Ca(OH)2不饱和溶液饱和溶液3.饱和溶液和不饱和溶液与浓溶液和稀溶液的辨析溶液的浓和稀,溶液的饱和和不饱和是在两个不同角度来认识溶液的性质.溶液的浓稀,是指一定质量的溶液中含溶质的多少,多的则浓,少的则稀.溶液的饱和和不饱和,是指一定温度下,一定量溶剂里能否溶解溶质,能溶的为不饱和溶液,不能溶的为饱和溶液.例如,20℃时,100g水中溶解31.6g硝酸钾,所得溶液既是饱和溶液,又是较浓溶液,若将30g 硝酸钾在此温度下溶解在100g水中,所得溶液是不饱和溶液但仍为较浓溶液.在20℃时,,此时所得溶液显然很稀,但它却是饱和溶液,若取100g水中最多能溶解0.00024gBaSO40.0002gBaSO在此温度下溶于100g水中,所得溶液既是不饱和溶液,也是稀溶液.4由此可见,浓溶液不一定是饱和溶液,稀溶液不一定是不饱和溶液.若同一温度下,同一种溶质溶解在同一种溶剂中,饱和溶液一定比不饱和溶液浓度高.例1下列说法中,正确的是( )A.某物质X的饱和溶液不能再溶解物质YB.某物质的饱和溶液一定是浓溶液C.在一定温度下,稀溶液一定是不饱和溶液D.饱和溶液和不饱和溶液之间可以相互转化分析 A的说法不正确,该溶液不能再溶解X,但未溶解Y,对Y而言,该溶液是不饱,在一定温度时其饱和溶液就和的,能继续溶解Y.B的说法不正确,如微溶于水的Ca(OH)2是稀溶液.C的说法不正确,易溶于水的物质如NaCl、KNO等,其溶液可能是不饱和溶液但3是浓溶液.D的说法正确,改变温度、改变溶剂或溶质的质量,可以使饱和溶液和不饱和溶液之间相互转化.例2在30℃时,某试管中盛有一定量的硝酸钾溶液,怎样用实验方法证明它是饱和溶液还是不饱和溶液?分析一定温度、一定质量的溶液,是否饱和应看它能否继续溶解该溶质.答案取少许硝酸钾固体加入该溶液中,观察硝酸钾是否溶解,若溶解,则原溶液是该条件下的不饱和溶液;若不溶解,则原溶液是该条件的饱和溶液.例3饱和溶液是指( )A.含溶质较多的溶液B.还能继续溶解某种溶质的溶液C.不能继续溶解某种溶质的溶液D.在一定温度下,在一定量的溶剂里,不能再溶解某种溶质的溶液叫做这种溶质的饱和溶液解析饱和溶液的前提条件是:①一定温度;②一定量溶剂.改变两条件其中之一,饱和溶液将发生变化.因此只有指明“在一定的温度下”和“在一定量的溶剂里”,溶液的“饱和”和“不饱和”才有确定的意义.例4下列说法中正确的是( )A.确定某一溶液是否是饱和溶液,只要看溶液里是否有溶质即可B.饱和溶液就是浓溶液C.KNO3的饱和溶液比不饱和溶液中溶质的质量分数大D.硝酸钾的饱和溶液和不饱和溶液存在着转化关系解析对于硝酸钾饱和溶液和不饱和溶液存在下列关系:不饱和溶液饱和溶液,故选D。
饱和溶液和不饱和溶液PPT课件

加入溶质或溶剂对饱和溶液与不饱和溶液的影响
加入溶质
如果加入的溶质能溶于溶剂,则不饱和溶液可能变成饱和溶液;如果加入的溶质不能溶于溶剂,则饱 和溶液可能变成过饱和溶液。
加入溶剂
如果加入的溶剂能与溶质互溶,则饱和溶液和不饱和溶液都可能变得更稀;如果加入的溶剂不能与溶 质互溶,则对溶液的浓度没有影响。Biblioteka 饱和溶液和不饱和溶液的基本概念
饱和溶液
在一定温度和压力下,溶质在溶剂中 达到溶解平衡状态,即溶质无法再溶 解,称为饱和溶液。
不饱和溶液
未达到溶解平衡状态,即溶质可以继 续溶解的溶液,称为不饱和溶液。
02
饱和溶液
饱和溶液的定义
01
饱和溶液是指在一定温度下,当 溶质在溶剂中的溶解度达到最大 值时,溶液达到平衡状态,不能 再溶解更多的溶质。
VS
实验原理
饱和溶液是指在一定温度下,溶质在溶剂 中达到动态平衡的状态,此时溶质无法继 续溶解;不饱和溶液则是指溶质仍可继续 溶解的状态。
实验步骤和实验过程
01
准备实验器材:烧杯、 玻璃棒、温度计、食盐、 水。
02
在室温下,将食盐加入 烧杯中,加入适量水, 用玻璃棒搅拌至食盐完 全溶解。
03
升高温度至沸腾,继续 加入食盐,观察溶解情 况。
感谢您的观看
THANKS
05
实际应用
在化学工业中的应用
01
02
03
化学反应介质
饱和溶液和不饱和溶液是 许多化学反应的重要介质, 如溶解、沉淀、萃取等。
物质分离提纯
通过控制溶液的饱和度, 可以对混合物进行分离和 提纯,如盐析、重结晶等。
饱和溶液、不饱和溶液与溶解度

饱和溶液、不饱和溶液与溶解度一、饱和溶液和不饱和溶液 1.饱和溶液与不饱和溶液在一定温度下,在一定量的溶剂里不能再溶解某种溶质的溶液,叫这种溶质的饱和溶液;能继续溶解某种溶质的溶液,叫这种溶质的不饱和溶液。
2.饱和溶液与不饱和溶液的转化条件3.判断溶液是否饱和的方法在一定温度下,该溶液中有没有不能继续溶解的剩余溶质存在,如果有且溶质的量不再减少,溶质与溶液共存,那么这种溶液就是这种溶质的饱和溶液,否则就是不饱和溶液。
4.浓溶液和稀溶液为粗略地表示溶液中溶质含量我多少,常把溶液分为浓溶液和稀溶液。
浓溶液和稀溶液是一组概念。
浓溶液不一定是饱和溶液,稀溶液不一定就是不饱和溶液。
二、溶解度1.固体物质的溶解度定义:在一定温度下,某固态物质在100g 溶剂里达到饱和状态时所溶解的质量,叫这种物质在这种溶剂里的溶解度。
如果不指明溶剂,通常所说的溶解是物质在水中的溶解度。
(1)溶解度表示一种物质溶解在另一种物质里的能力。
(2)影响因素:溶解度与溶质、溶剂的性质和温度有关。
(3)举例:盐易溶于水却不易溶于汽油,油脂易溶于汽油而不易溶于水.蔗糖和食盐都易溶于水,但在同温同量溶剂情况下,所能溶解的最大量不同。
注:1.目前我们所学的所有的固体物质(熟石灰即氢氧化钙除外)的溶解度都随温度的升高而升高;所有的气体物质的溶解度都随温度的升高而降低。
2.比较溶解度时一定要在同温度下比较,否则不具可比性。
三.溶解度曲线及其意义1、定义:用纵坐标表示物质的溶解度,横坐标表示温度,用描点法在直角坐标系中画出溶解度随温度变化的曲线,这种曲线叫溶解度曲线。
2、意义:(1)在溶解度曲线图上,曲线上任何一点表示的都是某温度的溶解度。
(2)曲线上任何一点都恰好是饱和溶液,曲线以上的各点,表示的都是有未溶溶质的过饱和溶液,曲线以下的各点表示的都是不饱和溶液。
四、溶解度等级五、溶解度公式溶解性易溶 可溶 微溶 难溶 C 20溶解度/g大于10g大于1g小于1g小于0.1g饱和溶液增加溶剂或升高温度 不饱和溶液降低温度、蒸发溶剂、增加溶质一定温度下,一定量的溶剂中所溶解物质的质量是一定的,反之,任意量的饱和溶液里溶质质量与溶剂质量或溶质质量与溶液的质量比是一定的,如果把一定温度下溶剂的量规定为100g ,此时所溶解溶质形成饱和溶液时的质量称为溶解度。
人教版初三化学下册 第九单元 课题2 饱和溶液与不饱和溶液的相互转化

1. 饱和溶液与不饱和溶液● 定义:在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得到的溶液叫做饱和溶液;还能继续溶解的溶液,叫做不饱和溶液。
● 判断溶液是否饱和的方法:继续加入该种溶质,如果该物质的质量减少,那么溶液是不饱和溶液;如果该物质的质量不变,那么溶液是饱和溶液。
● 由于水可以和酒精以任意比例互溶,所以水和酒精不可以形成饱和溶液。
● 不饱和溶液与饱和溶液的转化① 氢氧化钙和气体的溶解度随着温度升高而降低。
所以若把氢氧化钙和气体的不饱和溶液变成饱和溶液,在改变温度时要升高温度。
② 最可靠的方法是蒸发溶剂、加溶质、加溶剂。
③ 若想把氢氧化钙的饱和溶液变成不饱和溶液,可以通入适量的二氧化碳并过滤。
④ 若想把氢氧化钙的不饱和溶液变成饱和溶液,也可以加入CaO 并冷却。
⑤ 氢氧化钙不是晶体,从氢氧化钙溶液也不会析出晶体,所以只能称作“澄清的石灰水变浑浊”。
● 浓、稀溶液与饱和、不饱和溶液之间的关系:① 饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液。
② 在一定温度时,同一种溶质的饱和溶液要比它的不饱和溶液浓。
不饱和溶液降温、恒温蒸发溶剂、加溶质饱和溶液1.欲使任意一种物质的不饱和溶液变为饱和溶液,一定可行的方法是()A.降低温度B.升高温度C.倒出一些溶液D.再加入该溶质2.某溶液将达到饱和,要使其转变成饱和溶液,最可靠的方法是()A.加热蒸发B.增加溶质C.降低温度D.升高温度3.现有一接近饱和的溶液,下列方法中一定能使之成为饱和溶液的是()①蒸发溶剂,②增加溶质,③降低温度,④加热升温A.只有①②B.只有②③C.①②③D.①②④4.小乐同学欲使一不饱和硝酸钾溶液变成饱和溶液但不改变其浓度,正确的方法是()A.加热蒸发溶剂后再降至原温度B.加入一定量的硝酸钾C.降温后使其析出部分晶体D.降温至溶液刚好达到饱和5.现有一瓶某温度下接近饱和的硝酸钾溶液,欲将其转化为饱和溶液,下列措施不正确的是()A.降低温度B.蒸发一定量水,在恢复到原温度C.温度不变时增加溶质D.升高温度6.室温下,将盛有接近饱和的硝酸钾溶液的小烧杯放在盛水的大烧杯中,如图所示,欲使硝酸钾溶液变为饱和溶液,可向大烧杯中加入的固体物质是()A.氧化钙B.氯化钠C.硝酸铵D.氢氧化钠7.下列叙述正确的是()A.加溶剂可以使饱和溶液变成不饱和溶液B.某物质的饱和溶液就是不能再溶解该物质的溶液C.饱和溶液比不饱和溶液含溶质更多D.一种物质的饱和溶液中,不能再溶解其他溶质8.现有一杯60℃的不饱和硝酸钾溶液,欲使其达到饱和,下列方法一定不可行的是()A.加一定量的水B.恒温蒸发部分水C.降低温度D.加一定量的硝酸钾固体9.要使50℃时不饱和的硝酸钾溶液变成饱和溶液,下列措施中错误的是()A.升高温度B.降低温度C.补充硝酸钾D.蒸发水分10.将20℃时氢氧化钙饱和溶液转变为不饱和溶液可采用()A.升高温度B.加入溶剂C.加入溶质D.倒掉一半溶液11.要使一杯氢氧化钙的不饱和溶液变为饱和溶液,不能采用的方法是()A.升高温度B.加入溶质C.降低温度D.蒸发水12.要将一瓶接近饱和的石灰水变成饱和溶液,下列的方法不可行的是()A.加入CaO B.加入Ca(OH)2C.升高温度D.降低温度13.将接近饱和的石灰水变成饱和溶液,不可行的方法是()A.加入CaO B.加入Ca(OH)2C.升高温度D.加入CaCO314.氢氧化钙的溶解度随着温度的升高而降低。
饱和溶液和不饱和溶液

饱和溶液和不饱和溶液
1、定义
⑴饱和溶液:一定温度下,一定量的溶剂中,不能继续溶解的溶液叫这种溶质的饱和溶泼
⑵不饱和溶液:一定温度下,一定量的溶剂中,能继续溶解的溶液叫这种溶质的不饱和溶液
⑶2个一定:一定温度下,一定量溶剂
饱和溶液的特征:有余物且不变
证明溶液恰好饱和:继续添加该溶质,若不能溶解为恰好饱和
2.饱和溶液与不饱和溶液的转化:
t℃
饱和溶液→不饱和溶液:增加溶剂(所有).升温(部分)
不饱和溶液→饱和溶液:降温(大部分.)、蒸发溶剂,增加溶质
3.结晶
⑴定义:形成晶体的过程(溶质从饱和溶液中以晶体形式析出)
⑵晶体:具有规则的几何外形的固体
NaCl立方体kNO3针状明矾: 八面体
(3)结晶方法:
蒸发结晶:海水晒盐
降温结晶:大部分物质: KNO3. Na2CO3
4.溶液的分类
(1)定温定剂分:饱和溶液,不饱和溶液
(2)一定量溶液中含溶质的多少分:浓溶液,稀溶液
★饱和溶液不一定是浓溶夜,不饱和溶液不一定是稀溶浓。
★当同温、同质,同剂时,饱和溶液一定比不饱和溶液要浓。
饱和溶液和不饱和溶液的概念

饱和溶液和不饱和溶液的概念1. 饱和溶液的概念饱和溶液是指在特定温度和压力下,溶质的浓度达到最大值,不能再溶解更多溶质的溶液。
当溶质的浓度达到最大值时,溶液中的溶质和溶剂的比例也达到最大,溶质和溶剂的比例称为溶质的摩尔比例,也称为溶质的摩尔浓度。
当溶质的摩尔浓度达到最大值时,溶液就是饱和溶液。
:2. 不饱和溶液的概念不饱和溶液是指溶液中的溶质没有完全溶解,溶液中的溶质仍有一部分沉淀在底部,因此溶液中的溶质浓度小于其平衡浓度,即溶液不能再溶解更多的溶质,这种溶液就是不饱和溶液。
3. 饱和溶液的特征:饱和溶液是指溶质的溶解度达到最大,不能再溶解更多溶质的溶液。
它的溶质浓度是固定的,不会随温度的变化而变化,温度越高,溶质的溶解度越大。
饱和溶液的溶质浓度是与温度有关的,温度越高,溶质的溶解度越大,溶质浓度也越大。
饱和溶液中的溶质极不容易再溶解出更多溶质,即使加入更多的溶质,溶质也不会溶解出更多的溶质。
4. 不饱和溶液的特征:不饱和溶液中,溶质的浓度低于其平衡浓度,溶质会继续溶解,直到溶质的浓度达到平衡浓度。
不饱和溶液的沸点比纯液体低,比饱和溶液的沸点高,溶液的密度也比纯液体低,比饱和溶液的密度高。
不饱和溶液可以通过蒸馏或滤过等方法分离出溶质。
饱和溶液和不饱和溶液是溶解度的两种概念,它们之间有着明显的区别。
饱和溶液是指溶质在溶剂中达到平衡状态时所形成的溶液,其中溶质的浓度不再发生变化。
而不饱和溶液则是指溶质在溶剂中未达到平衡状态时所形成的溶液,其中溶质的浓度还可以继续发生变化。
另外,饱和溶液的溶质浓度是固定的,而不饱和溶液的溶质浓度则是可变的。
此外,饱和溶液的溶质分子不会再溶解,而不饱和溶液的溶质分子还可以继续溶解。
最后,饱和溶液的溶质溶解度是固定的,而不饱和溶液的溶质溶解度则是可变的。
饱和溶液与不饱和溶液课件

溶解度是指在一定温度和压力下,溶质在溶剂中的最大溶解量。溶解过程包括溶质向溶剂中的扩散和溶解。扩散 是指溶质在溶剂中的均匀分布,而溶解则是指溶质与溶剂之间的相互作用,形成新的物质状态。溶解度的变化受 到温度、压力和溶剂性质等因素的影响。
PART 02
饱和溶液
饱和溶液的定义
01
饱和溶液是指在一定温度和压力 下,溶质在溶剂中溶解达到平衡 状态,不能再溶解更多的溶质。
溶质可继续溶解
在一定条件下,不饱和溶液中的 溶质可以继续溶解。
流动性好
由于溶质未达到最大溶解度,不 饱和溶液流动性好。
不饱和溶液的溶解度
溶解度
在一定温度和压力下,溶 质在溶剂中的最大溶解量。
影响因素
温度、压力和溶剂的性质 影响溶质的溶解度。
溶解度曲线
描述温度与溶解度之间关 系的曲线图。
不饱和溶液的转化与制备
比较两个烧杯中食盐的质量,发现饱和溶液中的食盐质 量较大,这是因为饱和溶液中的溶质已经达到溶解平衡, 不能再溶解更多的食盐。 2. 实验结论
通过实验操作可以更直观地理解饱和与不饱和溶液的制 备方法和性质特点。
2023 WORK SUMMARY
THANKS
感谢观看
REPORTING
食品保鲜
通过控制食品包装内的气体浓度, 利用饱和与不饱和溶液的性质, 延长食品保鲜期。
食品加工
在食品加工过程中,利用饱和与 不饱和溶液的性质,进行物质的
提取、分离和纯化。
在医疗领域中的应用
药物制备
利用饱和溶液的溶解度特性,制备药物制剂,如注射剂、片剂等。
药物输送
通过控制药物溶解度,利用饱和与不饱和溶液的性质,实现药物的 稳定输送。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二课时饱和溶液与不饱和溶液
教学目标:
1、通过对硝酸钾在一定量的水中的溶解现象,得到饱和溶液与不饱和溶液的概念。
2、通过对硝酸钾饱和与不饱和溶液的转化,得到饱和溶液与不饱和溶液转化的一般方法。
教学过程:
像氯化钠一样,硝酸钾也是易溶于水的物质。
然而,如果向一杯水中不断加入硝酸钾,能无限溶解吗?
1、活动天地1-3 观察硝酸钾能否在一定量的水中无限溶解
学生填写实验现象,回答思考问题。
通过上述操作和现象,你能得出什么结论?
结论:一定量的水中不能无限地溶解硝酸钾。
2、饱和溶液和不饱和溶液
我们把在一定温度下不能继续溶解硝酸钾的溶液称为硝酸钾的饱和溶液。
把还能继续溶解硝酸钾的溶液称为硝酸钾的不饱和溶液。
上述实验中当我们在20ml水中第一次加入5克硝酸钾时,得到的是硝酸钾的不饱和溶液。
第二次加入5克硝酸钾时,得到的是硝酸钾的饱和溶液。
3、如何判断一杯溶液是不是饱和的溶液呢?
如果烧杯底部有未溶解的物质,且物质不再减少。
如果烧杯底部没有未溶解的物质,那么继续加入这种物质,看是否减少。
4、实验探究1-2 探究饱和溶液与不饱和溶液相互转化的方法
学生观察实验现象,填好课本表格
思考:本次试验中采用了那些方法实现了饱和溶液与不饱和溶液之间的转化?你还能想到其他方法吗?
→不饱和溶液←
可见,改变外部条件,可以实现饱和溶液与不饱和溶液之间的转化。
本节课练习:课本P8 挑战自我。
