第五章配位化合物
5第五章 配位化合物

上页 下页 回主目录 返回
(4)中心离子的空轨道杂化时,若有次外层d轨 道参加,则形成的配合物属内轨型;若均为最外 层轨道参加杂化,则形成的配合物属外轨型。内 轨型配合物的配位键更具有共价键性质所以叫共 价配键,外轨型配合物的配位键更具有离子键性 质所以叫电价配键,但本质上两者均属共价键范 畴。
医学化学
上页
下页
回主目录
返回
配位数
● 与中心离子(或原子)成键的配位原子的总数 配位数=配位原子的个数×齿数
单齿配体
[Cu(NH 3 )4 ]2 PtCl 3 (NH 3 )
4 3 1 4 2 22 6 32 6 1 6 6
2
多齿配体
CoCl 2 (en) 2 Al(C2O 4 ) 3
医学化学
上页
下页
回主目录
返回
第二节
•
配合物的价键理论
一、配合物配位键理论的基本要点 • 配位键理论又叫配价键理论,其基本要点可归纳为 三点:
•
(1)中心离子和配位原子间是以配位键结合的, 具有孤对电子的配位原子提供电子对,填入中心离 子的外层空轨道形成配位键。
医学化学
上页
下页
回主目录
返回
(2)为提高成键能力,中心原子提供的空轨道 必须首先进行杂化,形成数目相等、能量相同、 具有一定方向性的杂化轨道。这些杂化轨道分别 与配位原子的孤对电子在一定方向上互相接近, 发生最大程度的重叠,形成配位键。 (3)配位个体的空间构型、中心原子的配位数 和配位个体的稳定性等主要取决于中心原子提供 的杂化轨道的数目和类型。
医学化学
上页
下页
回主目录
返回
配位体和配位原子
第五章配位化合物

湖 “合”字→中心离子名称→中心离子氧化数(加括号,用罗马 南 数字Ⅰ、Ⅱ、Ⅲ等注明) 农 业 2、 配体的命名顺序 大 ⑴ 先无机配体,后有机配体。如: 学 应 K[PtCl3(C2H4)] 三氯 · 乙烯合铂(Ⅱ)酸钾 用 化 ⑵ 同是无机配体或有机配体,先阴离子,后中性分子。如: 学 [Co(NO2)4(NH3)2]- 四硝基 · 二氨合钴(Ⅲ)离子 系
第五章 配位化合物
无 机 及 分 析 化 学 湖 南 农 业 大 学 应 用 化 学 系
[Cu(NH3)4]SO4
中 心 离 子 配 配 位 位 原 体 子
配 位 数
外 界
内 界 配离子 配位化合物
第五章 配位化合物
无 机 及 分 析 化 学
5.1.2 配合物的命名
1、配合物的命名原则 一般无机物命名的原则 配位体数(用一、二、三等数字表示)→ 配位体名称 →
第五章 配位化合物
无 机 及 分 析 化 学
3)配位数:配位原子的总数。 单基配体,配位数=配体数 多基配体,配位数=配体数×配位原子数 影响配位数的因素
湖 中心离子:电荷高、半径大,配位数越大; 南 配体: 越小,所带负电荷越少,配位数越大。 农 业 同时也受到配体浓度和温度的影响。 大 配位数一般为2、4、6的较多。 学 应 特征配位数 Cu+、Ag+为2,Cu2+为4,Fe3+、Fe2+为6。 用 化 4)配离子的电荷: 学 系 配离子的电荷等于中心离子的电荷和配体电荷的代数和。
配体与金属离子形成的环状配合物
7、多酸配合物: 这是一种含有氧桥的多核配合物。它是由一 定数目 的酸酐和原酸组成的,原酸中的金属或非金属离子作 中心离子,酸酐为配体。多酸配合物,包括同多酸和 杂多酸两类
无机化学第五章

受配位体孤对电子能力的原子或离子。
可以是金属离子,也可以是电中性的金属原子),周期表中
几乎所有的金属(特别是过渡金属离子)都可作为中心离子,少数 非金属高氧化态离子也可作为中心离子,如[Ni(CO)4]及[Cr(CO)6] 中的Ni,Cr均为中性原子。又如[SiF6]2–中的Si(Ⅳ) 。
6
--
--
作为配位体的物质可以是简单离子,如Cl– ; 也可以是复杂 的离子或分子,如CN– 、 SCN-、NH3 。可以是有机分子如 乙二胺、乙二胺四乙酸根离子。 配位体中直接与中心离子(或原子)成键的原子为配位原子。
常见的配位原子:N、O、S、C、卤素原子
配位原子的特点是:电负性大、有孤对电子的非金属原子。
1) 单齿配体 一个配体中只能提供一个配位原子与中心离子成键的叫单 8 齿配体。
常见单齿配体 中性分子 H2O NH3 CO CH3NH2 配体 水 氨 羰基 甲胺 O N C N 配位原子 阴离子 F- Cl- Br- I- OH- CN- NO2配体 氟 氯 溴 碘 羟基 氰 硝基 O C N 配位原子 F Cl Br I SCNNCS阴离子 ONO配体 亚硝酸根 硫氰酸根 异硫氰酸根 O S N 配位原子
顺反异构体
NO2 NO2 O2N O2N
面式
经式
光活异构体 ,镜面 对称 (弯线表示en)
26
键合异构体:连接的原子不同
O N H3N H3N Co NH3 NH3 NH3
O N O H3N Co H3N NH3 NH3 NH3
O
硝基配合物(黄色)
亚硝酸Байду номын сангаас配合物(红色)
27
二、 配合物的化学式和命名
[Cu(NH3)4]SO4溶液 Cu(OH)2沉淀 CuSO4溶液
5配位化合物

+
+
2CN
-
[Ag(CN)2]-
+
2NH3
其反应方向可以根据平衡常数的大小来判断。 通过计算平衡常数得到,k=1.2×1014,说明此配位反应向右进行 的趋势很大。
第三节 螯合物和螯合滴定
一、螯合物和螯合效应
由中心原子与多齿配体所形成的具有环状结构的配合物称为 螯合物。 能与中心原子形成螯合物的多齿配体称为螯合剂。 例: α-氨基丙酸和铜离子形成的螯合物,含有两个五元环
第二节
配合平衡
一 、 配离子的稳定常数 二、 配位平衡的移动
第三节 螯合物和螯合滴定
一、螯合物和螯合效应 二、螯合滴定
第四节 配合物在医学上的应用
第一节 配合物的基本概念
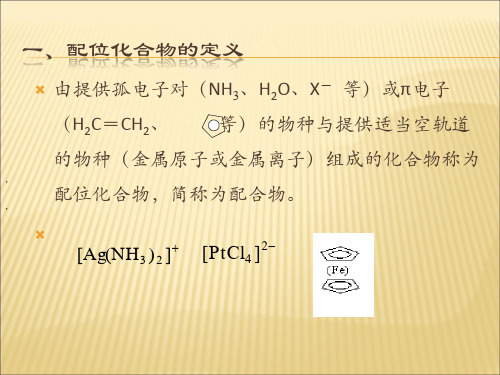
一、配合物的定义
由阳离子(或原子)和一定数目的中性分子或阴离子所组 成的不易解离的分子或离子称为配位分子或配离子。 配位分子 配合物 配阳离子 配离子 配阴离子
来排列。原子数少的排前面,原子数多的排后面。若配位 原子相同,配位中所含原子数也相同,则按在结构 式中与 配位原子相连的原子的元素符号的英文字母顺序排列。
(4)有些配体具有相同的化学式,配位原子不同时,则按配位 原子的元素符号的英文字母顺序排列并给予不同的命称。如 - NO2- (以N原子为配位原子)硝基,-ONO- (以O原子为 配位原子)亚硝酸根,- SCN - (以S原子为配位原子)硫氰 酸根,- NCS- (以N原子为配位原子)异硫氰酸根。
顺式二氯二铂(II) 卡铂(又名碳铂) CBDCA
二、螯合滴定
(一)EDTA的结构和配位特点
常用的螯合剂: EDTA(乙二胺四乙酸 或其二纳盐)
_
51第五章 配位化合物
26
例1
命名下列配合物和配离子: (1)(NH4)3[SbCl6] (2)[Co(en)3]Cl3 (3)[Cr(H2O)4Br2]Br· 2O 2H (4)[Cr(OH)(H2O)(C2O4)(en)]
(5)[Co(NH3)4(NO2)Cl]+
27
解:
(1) 六氯合锑(Ⅲ)酸铵 (2) 三氯化三(乙二胺)合钴(Ⅲ) (3) 二水合溴化二溴· 四水合铬(Ⅲ) (4) 羟基· 草酸根· 水· 乙二胺合铬(Ⅲ)
8
配位体:
在配合物中与中心离子结合的具有孤电子对的离 子或中性分子称为配位体,简称配体,如 [Cu(NH3)4]2+ 中的 NH3、[Fe(CN)6]3- 中的 CN- 等。
常见配体: :NH3、H2O:、:Cl-、:I-、:CN:、 :CNS:-、 :NH2—CH2—CH2—H2N:、 CH2=CH2 。 在配体中提供孤对电子与中心离子形成配位键的 原子称为配位原子,如配体 NH3 中的 N 原子。常见 的配位原子为电负性较大的非金属原子 N、O、S、C 和卤素等原子。
(5) 氯· 硝基· 四氨合钴(Ⅲ)配阳离子
28
一些习惯 叫法
[Cu(NH3)4] 2+ [Ag(NH3)2]+ K2[PtCl6] K3[Fe(CN)6] K4[Fe(CN)6]
铜氨配离子 银氨配离子 氯铂酸钾 俗名赤血盐 俗名黄血盐
29
§5.3
配位化合物的价键理论
基本要点
中心离子 中心离子(或原子)有空的价电子轨道可接受由 配位体的配原子提供的孤对电子而形成配位键。 配位体 配位体的配位原子必须有孤对电子可提供,常 见的配位原子有C、N、S、O、Fˉ、Clˉ、Brˉ、Iˉ 等。 常见的配体: F-,Cl-,Br-,I-,OH-, SCN-, CN-, S2O32- , H2O, NH3 :NH3 、 :CN:30
配位化合物

dsp2
5 6 d2sp3 dsp3 sp3d2
正方形
三角双锥形
[Ni(CN)4]2[Fe(CO)5] [CoF6]3[Co(CN)6]320
正八面体形
(二)内轨型和外轨型 内轨配键:由次外层 (n-1)d 与最外层 ns、np 轨道杂化 所形成的配位键。 内轨型配合物:由内轨配键形成的配合物。
如 [Fe(CN)6]3-、[Co(NH3)6]3+、[Ni(CN)4]2外轨配键:全部由最外层 ns、np、nd 轨道杂化所形成的 配位键。
9
(三)配位数
1 个中心原子所具有的配位键数目,称为该中心原子的 配位数。常见配位数是 6 和 4。
若配合物中的所有配体都是单齿配体,则配位数等于配 体数;若其中某些配体含有 2 个或 2 个以上配位原子,则 配位数大于配体数。例如: [Cr(NH3)6]3+ 配位数 6,配体数 6
[Cr(H2NCH2CH2NH2)3]3+ 配位数 6,配体数 3
11
2. 若配体不止一种,则先无机,后有机;在无机或有机配 体中,先离子,后分子;不同配体之间可用圆点隔开。 化学式书写方式为:[M-无机阴离子-无机分子-有机物]
其命名方式为:无机阴离子-无机分子-有机物-合-金属(氧 化数)
例如:[CoCl(NH3)3en]2+ 一氯· 三氨· 乙二胺合钴(Ⅲ)离子 同类配体按配位原子元素符号的英文字母顺序排列。 例如:[Co(NH3)5H2O]3+ 五氨· 一水合钴(Ⅲ)离子
28
例 已知 [Mn(CN)6]4- 的磁矩 实测=1.57 B.M.,请推测这 个配合物的空间构型和稳定性。 解 由配位数为 6 可知,需要 6 个空杂化轨道,杂化方式 可能为 d 2s p 3 或 s p 3d 2 已知 Mn2+ 3d 5 根据表 实测=1.57 B.M.,与 1 个单电子相当
配位化合物的几何构型

2 三配位配合物(ML3) 这种配位数的金属配合物是比较少的。
已经确认的如 KCu(CN)2, 它是一 个聚合的阴离子, 其中每个Cu (I)原子 与两个C原子和一个N原子键合。
[Cu(Me3PS)3]Cl 中的Cu也是三配 位的。
在所有三配位的情况下, 金属原 子与三个直接配位的配位原子都是共 平面的, 有平面三角形的结构。
d8组态的过渡金属离子或原子一般是形成平面正方形配合物, 但具有d8组态的金属若因原子太小, 或配位体原子太大, 以致不可 能形成平面正方形时, 也可能形成四面体的构型。
4 五配位化合物(ML5)
五配位有两种基本构型, 三角 双锥和四方锥, 它们分别属于D3h和 C4v对称群。此外,还存在变形的三 角双锥和变形的四方锥构型,
3.2 配位化合物的异构现象
配位化合物有两种类型的异构现象: 立体异构 化学结构异构
立体异构是化学式和原子排列次序都相同, 仅原子在空间的排 列不同的异构体。包括几何异构和光学异构。 化学结构异构是化学式相同, 原子排列次序不同的异构体。包 括电离异构、键合异构、配位异构、配位体异构、构型异构、 溶剂合异构和聚合异构;
Cl
Cl
Pt
Cl
NH3
最典型的是Pt(NH3)2Cl2, 其中顺式结构的溶解度较大, 为 0.25 g/ 100g水, 偶极矩较大, 为橙黄色粉末, 有抗癌作用。反式难溶, 为
0.0366 g/100g, 亮黄色, 偶极矩为0, 无抗癌活性。
② 含有四个不同配体的[MABCD]配合物有三种异构体, 这是因 为B、C、D都可以是A的反位基团。
过渡金属离子是很好的中心形成体。这是因为: ①过渡金属离子的有效核电荷大; ②电子构型为9-17构型, 这种电子构型的极化能力和变形
E 第五章 配位反应

e、配原子同,原子数同,则按结构式中与配原子相连的原子的元素
符号的字母顺序排列: [Pt(NH3)2(NO2)(NH2-)] 氨基硝基二氨合铂( II )
类
型
配位酸
化学式 H[BF4] H3[AlF6] [Zn(NH3)4](OH)2 [Cr(OH)(H2O)5](OH)2 K[Al(OH)4] [Co(NH3)5(H2O)]Cl3 [Pt(NH3)6][PtCl4] [Ni(CO)4]
NH4[Cr(NH3)2 (CNS-)4] 四硫氰二氨合钴( II )酸氨
c、同类配位体的命名,按配位原子元素符号的拉丁字母顺序排列
[Co(NH3)5 H2O]Cl3 三氯化五氨一水合钴( III )
d、同类配体,若配原子相同,则将含较少原子数的配位体放在前面。
K3[Co(CN-)2(SCN-)4] 二氰四硫氰根合钴( III )酸钾
氯化二氯·三氨·一水合钴(Ⅲ)
氨基·硝基·二氨合铂(II) 六(异硫氰酸根)合铬(Ⅲ)酸铵 六(硫氰酸根)合铂(Ⅳ)酸铵 四氯合铂(II)酸四氨合铜(II)
自测题:
1. 下列配合物系统命名错误的是( C ) A、 K2 [HgI4 ] 四碘合汞(Ⅱ)酸钾 B、 [Al(OH)4]四羟基合铝(Ⅲ)配离子 C、 [Ni (CO)4]2+ 四羰基合镍(Ⅱ) D、 [Pt (NH3)2Cl2] 二氯二氨合铂(Ⅱ)
Cu NH3 4
中心离子 配体
配离子(内界) 配合物
SO 4
外界
1、中心离子 配离子中带正电荷的离子称为中心离子。中心离子大多数为 过渡金属元素。
2、配位体(配体)
在配离子中,同中心离子形成配位键的分子或阴离子称作配位体。 如: NH3 、H2O、CO、OH-、CN-、X- etc.
配位化合物——精选推荐

第五章配位化合物第一节配位化合物的基本概念(一)配位共价键由一个原子单方面提供l对电子与另一个有空轨道的原子(或离子)共用而形成的共价键,称为配位共价键(coordinate bond),简称配位键。
在配位键中,提供电子对的原子称为电子对的给予体;接受电子对的原子称为电子对的接受体。
配位键常用“→”表示,箭头指向电子对的接受体。
例如,铵离子(NH4)可看作是氨NH3分子与H+离子结合形成的。
在氨分子中,氮原子的2p轨道上有一对没有与其他原子共用的电子,这对电子称为孤对电子,氢离子上具有1s空轨道。
在氨分子与氢离子作用时,氨分子上的孤对电子进入氢离子的空轨道,与氢共用,形成配位键。
N HHH H+++H NHHH+结构式为在铵离子中,虽然1个N→H键和其他3个N-H键的形成过程不同,但一旦形成了铵离子,这4个氮氢键的性质完全相同。
配位键是一种特殊的共价键,广泛存在于无机化合物中。
凡一方有空轨道,另一方有未共用电子对时,两者就可能形成配位键。
例如:HNO3、H2SO4及其盐中均存在着配位键。
(二)配位化合物配位化合物简称配合物,是一类组成复杂、发展迅速、应用广泛的化合物。
1.配位化合物的概念配位化合物是一类含有配位单元的复杂化合物。
通常以酸、碱、盐形式存在,也可以电中性的配位分子形式存在。
如[Cu(NH3)4]SO4、K4[Fe(CN)6]、[Fe(CO)5]等。
配位单元一般是指由金属原子或金属离子与其他分子或离子以配位键结合而形成的复杂离子或化合物。
如[Cu(NH3)4]2+、[Fe(CN)6]4-、[Fe(CO)5]、[PtCl2(NH3)2]等。
离子型配位单元又称为配离子。
根据配离子所带电荷的不同,可分为配阳离子和配阴离子,如[Cu(NH3)4]2+、[Fe(CN)6]4-。
含有配位单元的化合物称为配位化合物(coordination compound)。
习惯上把配离子也称为配合物。
2.配位化合物的组成配位化合物的核心是配位单元。
配位化合物
配位数
2 3 4 4 5 5 6 6
中心 杂化方式
构型
实例
sp sp2 sp3 dsp2 dsp3 sp3d sp3d2 d2sp3
直线形 [ Ag( NH3)2 ]+ 三角形 [ Cu(CN)3 ]2- 四面体 [ Zn(NH3)4 ]2+ 正方形 [ N(i CN)4 ]2-
三角双锥 [ F(e CO)5 ] 三角双锥 [ Fe(SCN)5 ]2-
2 溶剂合异构
当溶剂分子取代配位基团而进入配离子的内界所
产生的溶剂合异构现象。与电离异构极为相似, 最熟悉 的例子是:
[Cr(H2O)6]Cl3 [Cr(H2O)5Cl]Cl2·H2O [Cr(H2O)4Cl2]Cl·2H2O 在配合物的内界,各含有6、5、4个配位水分子 和0、1、2个配位氯离子, 在配合物的外界各含有0、1 、2个溶剂合水分子和3、2、1个可电离的氯离子。这 些异构体在物理和化学性质上有显著的差异,如它们的 颜色分别为绿、蓝绿、蓝紫。
4p 4s
dsp2杂化
Ni(CN)24
八面体构型
对于F-,H2O等配体而言,配位原子F,O的电负性大, 不易给出孤对电子对,所以对中心体的3d轨道上的 电子不发生明显的影响,因此3d轨道上的电子排布 情况不发生改变 ,形成外轨型配合物。
对于CN-,CO等配位体而言,配位原子C的电负性小, 较易给出孤对电子对,对中心体的3d轨道发生重大 影响,从而使3d发生了电子重排,腾出能量较低的 内层(n-1)d轨道与ns,np轨道杂化,形成内轨型配合 物。
en
en
AACoe Nhomakorabea enCo
en
en
[Co(en)3])
A M
配位化合物

六氨合钴(Ⅲ)配离子 配位原子: N 配位数: 6
[Co(ONO)(NH3)5]SO4 硫酸亚硝酸根•五氨合钴(Ⅲ)
配体: NH3,ONO配位原子: N,O 配位数: 6
2.命名下列配离子和配合物: 1、[Zn(NH3)4]2+ 四氨合锌(Ⅱ)离子 2、[Hg(CN)4]2 3、[Ag(NH3)4]Cl4、K3[FeF6] 四氰合汞(Ⅱ)离子 氯化四氨合银(Ⅰ) 六氟合铁(Ⅲ)酸钾
[Fe(CN)6]4平衡移动方向
Fe2+ +6CN+ 6H+ 6HCN Fe(OH )2+ +H+ Fe(OH )2+ +H+ Fe(OH )3 +H+
பைடு நூலகம்
pH较大时,金属离子存在不同 程度的水解,即水解效应。
例: Fe 3+ +H2O Fe(OH )2+ +H2O Fe(OH )2+ +H2O
(二)配位平衡与沉淀的生成和溶解
(2)同类配体按配位原子元素符号的英文字母顺序排列。 (3)不同配体名称之间以中园点分开,相同的配体个数用倍数 词头二、三、四等数字表示。
A. 配离子是阴离子的配合物 K4[Fe(CN)6] 六氰合铁( Ⅱ )酸钾 K[PtCl3NH3] 三氯•一氨合铂( Ⅱ)酸钾 H2[PtCl6] 六氯合铂( IV )酸
二、配合物的组成
配离子是配合物的核心部分,而配位键则是其结构的基本特征。配 合物一般可分为内界和外界两个组成部分。内界是由配离子组成的,写 在方括号内,与配离子带相反电荷的其它离子为外界。 如:
硫酸四氨合铜(Ⅱ) 六氰合铁(Ⅲ)酸钾
[Cu(NH3)4] SO4
第五章 配位化学基础

o 同类配体的名称,按配位原子元素符号的英文字母顺序排列 同类配体的名称, [Co(NH3)5(H2O)]3+ 五氨·一水合钴 五氨 一水合钴(III)离子 一水合钴 离子
配合物的命名 服从一般无机物的命名原则。 服从一般无机物的命名原则。 若与配位阳离子结合的负离子是简单酸根, 若与配位阳离子结合的负离子是简单酸根,则该配合物 叫做“某化某” [Ag(NH3)2]Cl 叫做“某化某”;
配合物命名示例
H[AuCl4] K[PtCl3(C2H4)] [CoCl(NH3)3(H2O)2]Cl2 Fe(CO)5 [Ag(NH3)2](OH) [Co(NO2)3(NH3)3] 四氯合金(III)酸 酸 四氯合金 三氯•乙烯合铂 酸钾 三氯 乙烯合铂(II)酸钾 乙烯合铂 二氯化一氯•三氨 二水合钴 二氯化一氯 三氨•二水合钴 三氨 二水合钴(III) 五羰基合铁 氢氧化二氨合银( ) 氢氧化二氨合银(I) 三硝基•三氨合钴( ) 三硝基 三氨合钴(III) 三氨合钴
Cu2++4NH3 + HCl → Cl- + H+ = NH4+
5.2.3 稳定常数的应用
(1)配离子溶液中的离子浓度计算 ) 例5-1:计算含有 ×10-3mol·L-1[Zn(NH3)4]2+和0.1mol·L-1 :计算含有1.0× NH3的混合溶液中 2+的浓度。(已知 i=3.48×10-10) 的混合溶液中Zn 的浓度。 已知K × [Zn2+]=3.48×10-9mol·L-1 × (2)判断配离子与沉淀之间的相互转化 ) 溶液与10mL 6.0mol·L-1 例5-2:10mL 0.1mol·L-1 CuSO4溶液与 : NH3·H2O混合并达到平衡,计算溶液中 2+、NH3及 混合并达到平衡, 混合并达到平衡 计算溶液中Cu [Cu(NH3)4]2+的浓度各为多少?若向此溶液中加入 的浓度各为多少? 0.010molNaOH固体,问是否有Cu(OH)2沉淀生成?(已知 固体,问是否有 沉淀生成? 固体 K稳([Cu(NH3)4]2+)=2.09×1013,Ksp [Cu(OH)2]=5.6×10-20) × ×
第五章 配合物的基本概念

第五章 配位化合物
第一节 配合物的基本概念
第一节 配合物的基本概念
(三)配位体
与中心原子以配位键相结合的中性分子或阴离子简称配体。
配 体 阴离子 X− SCN− NH3 C2O42− CO CN−等 en 等 中性分子 H2O
根据配体中所含配位原子数,可将配体分为:
配 体 单齿配体 :配体中只含有一个配原子 如:SCN− 、CN−等 多齿配体:配体中含有两个或两个以上配原子。如 :en 等
关键词 概念 知 识 点 配离子,配合物,螯合物,配位滴定,生物配体
组成
区分
命名
稳定性 影响因素 滴定原理 意义
中心原子与配位体以配位键结合形成内界,内界与外界通过离 子键结合组成中性配合物 配位数与配体数,单齿配体与多齿配体,内界与外界,酸效应 与水解效应,螯合物与配合物 同无机物命名原则。配离子命名顺序:配体数-配体名称-“ 合”-中心原子 (氧化数) 配位数相同的配合物,K稳越大,越稳定;配位数不同的配合 物,通过计算比较其稳定性 影响配合物稳定的因素:酸效应,水解效应,沉淀反应等 ①滴定前: M+In MIn;②终点前: M+Y MY;③终点 时: MIn+Y MY+In 生物活性物质,解毒,抗炎抗癌,定性和定量分析
硫酸四氨合铜
形成条件:中心原子有空轨道,配位体有孤对电子 明矾KAl(SO4)2·12H2O、铬钾矾KCr(SO4)2·12H2O是复盐。 区别:复盐中金属都是以离子键结合;而配合物的配离 子中含有配位键,配离子与外界以离子键结合
第五章 配位化合物
第一节 ቤተ መጻሕፍቲ ባይዱ合物的基本概念
第一节 配合物的基本概念
二、配合物的组成 ●核心:中心原子
配位化合物

3
配合物的发展概况 • 1704年,Diesbach偶然得到普鲁士兰 • 1798年,Tassert(法国)首次报道了氯化六氨合 钴配合物 • 1893年,Werner A(瑞士)提出配合物的主副价理 论(1913年获诺贝尔奖) • 20世纪四十年代后,化学键理论的发展,系列相关 理论提出,如配合物的VB法(鲍林提出),晶体 场理论,分子轨道理论等的提出
23
(五) 配离子的电荷
配离子的电荷数等于中心原子和配体总电荷 的代数和。 例如,在[Cu(NH3)4]2+中,NH3是中性分子, 所以配离子的电荷就等于中心原子的电荷数,为+2。 而在[HgI4]2-中,配离子的电荷数= 1×(+2)+4×(-1) = -2。 由于配合物是电中性的,因此,外层离子的电 荷总数和配离子的电荷总数相等,而符号相反。因 此由外层离子的电荷可以推断出配离子的电荷及中 心原子的氧化数。 如[Cu ( NH3 )4 ] SO4
由阳离子(或原子)与一定数目的阴离子或分子以配 位键形成的不易解离的复杂离子(或分子)称为配离子(或 配位分子)。
配位化合物是中心原子(阳离子或原子)与一定数目
的配体(离子或分子) ,通过配位键结合,形成具有一定 组成和空间构型的不易解离复杂离子(分子) 为特征的化 合物。
10
一、定义
Cu Cu2+2OH Cu(OH)Cu( +2+++2OHCu(OH)2 Cu 2OH 2 + + + 4NH 3 direction ofof the direction the 4NH 3 平衡向左移动 direction of 4NH3 equilibrium equilibrium movement movement 2+ equilibrium 2+ [Cu(NH )4] [Cu(NH33)4] movement 中心原子M (阳离子或原子)和一组配位体 加乙醇有蓝色晶体[Cu(NH ) ]SO · O析出 H L(阴离子或分子)通过配位键结合而形成 2+ [Cu(NH3)[Cu(NH ) ] 溶液 的复杂离子(或分子)称为配离子(或配位 4]
配位化合物

常见金属离子的配位数
1价离子 Cu+ 2,4 Ag+ 2 Au+ 2,4
2价离子 3价离子 Mg2+ 6 Al3+ 4,6 Fe2+ 6 Cr3+ 6 Co2+ 4, 6 Fe3+ 6 Cu2+ 4, 6 Co3+ 6 Zn2+ 4, 6 Au3+ 4
②配体性质 ●负电荷数↑,配位数↓(互斥作用↑) 负电荷数↑ 配位数↓ 互斥作用↑ [HgCl4]2[HgS2]2配位数↓ 空间位阻) ●半径r↑,配位数↓(空间位阻)
氢氧化羟基⋅五水合铬(Ⅲ 配碱 [Cr(OH)(H2O)5](OH)2 氢氧化羟基⋅五水合铬 Ⅲ) 配 位 盐 中性 分子
4. 配位数 直接与中心原子配合的配位原子的数目 直接与中心原子配合的配位原子的数目 中心原子
配位数的大小,主要取决于中心离子和配位体的性质。 配位数的大小,主要取决于中心离子和配位体的性质。
配合物
内界 外界
*配离子与配合物在
[Ag(NH3 ) 2 ] OH
中心离子 配位体
概念上是不同的,但 习惯上却不严格区分
配阴离子:[FeF6]3-、[Ag(S2O3)2]3-、[AlCl6]3配阳离子:[Cu(NH3)4]2+、[Fe(H2O)6]3+ 中性配合物 :[Co(NH3)3Cl3]、[Fe(CO)4] 、[PtCl2(NH3)2] *中性无外界
镜像
F H Cl Br
Br Cl F
转 180o
H
手性:实物和其镜像不 手性: 能重叠的现象 手性分子: 手性分子:有手性现象 的分子
两者不 能重合
Cl H
F
Br
《医用化学》第五章

二、螯合滴定 (三)基准物质与标准溶液
基准物质应具备如下条件:
1
试剂的组成与化学式完全符合。
2
一般纯度应在99.9%以上。
3
保存或称量过程中不分解、不吸湿、不风化、不易被氧化等。
4
具有较大的摩尔质量。
5
反应定量进行,没有副反应。
二、螯合滴定 (三)基准物质与标准溶液
符合基准物质条件的试剂,可用直接法配 制成标准溶液。
三、配合物的命名
1 配合物的命名服从一般无机化合物的命名原则,即阴离子名 称在前,阳离子名称在后,分别称为某化某、某酸某、氢氧化某 等。
2 配合物的命名比无机化合物的命名相对复杂,主要原因是配 离子的结构比较复杂。
三、配合物的命名
配离子的命名方式一般遵循如下顺序: 配体数目(二、三、四……)— 配体名称(不同配体名称
二、配合物的组成
(二)配位体
在配合物中,与中心离子(或原子) 结合的中性分子或阴离子,称为配位体 (简称配体)。配体中直接同中心离子 (或原子)结合的原子,称为配位原子 (简称配原子)。
二、配合物的组成 (二)配位体
常见的配原子
如N、O、C、S、P和X(卤素)等。
常见的配体
H2O、NH3、X -、OH -、CN -、SCN- 等。
溶液的碱性越强,水解效应越强。
二、配位平衡的移动 (二)沉淀溶解平衡和配位平衡的相互转化
Ag+ + Cl +
2NH3
AgCl
[Ag(NH3)2]+
[Ag(NH3)2]+
Ag+ + 2NH3 + Br
AgBr↓
沉淀溶解平衡和配位平衡的相互转化,实际上是沉淀剂与配位剂之间 争夺金属离子而形成更稳定物质的过程。
第5章 配位化合物

5.1 配位化合物的定义、组成和命名
⑴ 内、外界之间以离子键相结合, 在水中几乎完全解 离. 如: [Cu(NH3)4]SO4 = [Cu(NH3)4]2+ + SO42⑵ 内界具有一定的稳定性, 在水中难以解离,可作为一个 整体,象一个简单离子那样参加反应.
2016/12/5
5.1 配位化合物的定义、组成和命名
多齿配体:
含有多个配位原子的配位体.
2016/12/5
5.1 配位化合物的定义、组成和命名
二齿配体: 乙二胺(en):
NH2–CH2 –CH2 –NH2 O O 2C C O O
乙二酸根(草酸根):
六齿配体: 乙二胺四乙酸根 EDTA (Y4-)
OOC– H2C
N–CH2 –CH2 –N OOC– H2C
2016/12/5
5.1 配位化合物的定义、组成和命名
4. 配离子的电荷: 配离子的电荷等于中心离子和配位体所带 的电荷的代数和. (1) 根据中心离子和配位体的电荷数, 可以确定 配离子的电荷数.
中心离子 Cu2+ Fe2+ Co3+ Pt4+
2016/12/5
配离子的电荷 2+ [Cu(NH3)4] [Fe(CN)6] 42+ [Co(NH3)5Cl] [PtCl6]2-
2016/12/5
5.1 配位化合物的定义、组成和命名
⑵ 内界的命名原则
配位体放前面,配位体数用一、二……表示 中心离子的氧化数用罗马数字表示,用括号标出, 放在中心离子之后
中心离子和配位体之间用“合”字连接起来
即: 配位体数-配位体名称-合-中心离子名称(中心离 子氧化数)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
[Ag(S2O3)2]3-, [Fe(CN)6]4-, [Fe(SCN)6]3-, [HgI4]2- , [Fe(CN)6]3-等 或原子)和一定数目 配位单元:由中心离子(或原子 配位单元:由中心离子 或原子 和一定数目 的中性分子或阴离子以配位键结 合而成的中性分子或复杂离子。 合而成的中性分子或复杂离子。 [Ni(CO)4], [Co(NH3)3F3], [Pt(NH3)2Cl2], K3[Fe(SCN)6], [Ag(NH3)2]NO3。 配合物: 含配位单元的化合物。 配合物 含配位单元的化合物。
6
{
多齿配体数≠( ) 多齿配体数 (<) 配位数 中心离子的配位数一般等于其电荷数的二倍 如:M+——2、M2+——4、M3+——6 、 、 ④.配离子的电荷数 a. 配离子的电荷数等于中心原子的氧化数 和配体总电荷数的代数和。 和配体总电荷数的代数和。 b. 外层电荷数的相反数。 外层电荷数的相反数。 K3[Fe(SCN)6] [Ag(NH3)2]NO3 中心离子的电荷数: 中心离子的电荷数 +3(Ⅲ) +1(Ⅰ) [Pt(NH3)2NO2NH2 Cl2] +4(Ⅳ) Ⅳ
13
[Co(NH3)5(ONO)]Cl2 氯化亚硝酸根•五氨合钴 Ⅲ) 氯化亚硝酸根 五氨合钴(Ⅲ 五氨合钴 六氯合铂( 六氯合铂(Ⅳ)酸 H2[PtCl6] Na3[Ag(S2O3)2] [Cu(NH3)4](OH)2 K3[Fe(SCN)6] 二硫代硫酸根合银(Ⅰ 酸钠 二硫代硫酸根合银 Ⅰ)酸钠 氢氧化四氨合铜(Ⅱ 氢氧化四氨合铜 Ⅱ) 六硫氰合铁(Ⅲ 酸钾 六硫氰合铁 Ⅲ)酸钾
12
首页 上页 下页 返回
[Ag(S2O3)2]3[Cr(NH3)5(H2O)]3+ [Cu(NH3)4]2+ [Fe(NH3)2(en)2]3+ [Co(NH3)5(ONO)]2+ [Cr(NH3)3Cl3]
二硫代硫酸根合银(Ⅰ 二硫代硫酸根合银 Ⅰ) 五氨•一水合铬(Ⅲ) 五氨 一水合铬(Ⅲ) 一水合铬 四氨合铜(Ⅱ 四氨合铜 Ⅱ) 二氨•二 乙二胺)合铁(Ⅲ) 二氨 二(乙二胺)合铁(Ⅲ) 亚硝酸根•五氨合钴 Ⅲ) 亚硝酸根 五氨合钴(Ⅲ 五氨合钴
(命名口诀:先无后有,先阴后中,先A后B,先少后多。) 命名口诀:先无后有,先阴后中, 命名口诀 后 ,先少后多。
8
2.一些配体的名称 一些配体的名称: 一些配体的名称 NCS- 异硫氰酸根 OH- 羟基 CO 羰基 SCN- 硫氰酸根 NO2- 硝基 ONO- 亚硝酸根 S2O32- 硫代硫酸根 NH2- 氨基 C2O42- 草酸根 NH2OH 羟胺 en (H2N-CH2-CH2-NH2) 乙二胺 edta: 乙二胺四乙酸 HOOC-H2C CH2-COOH N-CH2-CH2-N HOOC-H2C CH2-COOH
11
首页 上页 下页 返回
配
合
物
命
名
举
例
[Cu(NH3 )4 ] SO4 K3 [Fe(NCS) ] 6 H2 [PtCl6 ] [Cu(NH3 )4 ](OH)2 K[PtCl5 (NH3 )] [Zn(OH)(H2O)3 ] NO3 [Co(NH3 )5 (H2O)]Cl3 [Co(NO2 )3 (NH3 )3 ] [Ca(EDTA)]2−
16
首页 上页 下页 返回
× 1.在配合物中,配位数就是配体的数目。( ) 在配合物中,配位数就是配体的数目。( 在配合物中 2.下列配体中,属于多齿配体的是( d ) 下列配体中, 下列配体中 属于多齿配体的是( a. NH3 b. H2O c. SCN- d. EDTA 3.[Fe(NH3)2(en)(H2O)Cl]Cl2的名称是_________, 的名称是 中心原子是____,配位数是 配位数是____,加入 加入AgNO3溶液 中心原子是 Fe3+ 配位数是 6 加入 -)是其总量的 2 被沉淀的氯(Cl 是其总量的 3 填几分之几 。 是其总量的___(填几分之几 填几分之几)。 后,被沉淀的氯 被沉淀的氯 4.配合物:硝酸一羟基•一硫氰 四水合钴 Ⅲ)的化 配合物:硝酸一羟基 一硫氰 四水合钴(Ⅲ 一硫氰•四水合钴 配合物 [Co(H2O)4 SCN (OH)]NO3 学式是___________________________ ___________________________。 学式是___________________________。 5.实验式为 实验式为CrCl3 •6H2O的配合物中加入 实验式为 6H 的配合物中加入AgNO3溶液 的氯沉淀析出, 配合物的化学式为— 后,有1/3的氯沉淀析出,则该配合物的化学式为 有 的氯沉淀析出 则该配合物的化学式为 [Cr(H2O)4Cl2 ]Cl •2H2O 。 2H ———————————。 × 6.在[Cu(en)2]2+中,Cu2+的配位数是 。( ) 的配位数是2。( 在 17
14பைடு நூலகம்
指出配合物[Cu(NH3)4]SO4、K4[Fe(CN)6]的内界、 的内界、 指出配合物 的内界 外界、中心离子、配体、配位原子及配位数。 外界、中心离子、配体、配位原子及配位数。 解:
[Cu(NH3)4]SO4 内界 [Cu(NH3)4]2+ 中心离子 Cu2+ 配体 (NH3)4 配位原子 配位数 外界 SO42K4[Fe(CN)6] 外界 (K+)4 内界 [Fe(CN)6]4中心离子 Fe3+ 配体 (CN-)6 配位数
7
1-2 配位化合物的命名 1. 内界命名: 内界命名: 配体数—配体名称 合 中心原子名称 中心原子名称( 配体数 配体名称—合—中心原子名称(用 配体名称 罗马数字表示的氧化数) 罗马数字表示的氧化数) 不同配体间以( 隔开; ① 不同配体间以(• )隔开; 多种配体时先无机配体,后有机配体; ② 多种配体时先无机配体,后有机配体; 先阴离子配体,后中性分子配体; ③ 先阴离子配体,后中性分子配体; ④ 同类配体按配原子元素符号的英文字母顺 序排列。 序排列。
15
配位原子
命名下列配合物和配离子: 命名下列配合物和配离子: 六氯合锑(Ⅲ 酸铵 六氯合锑 Ⅲ)酸铵 (1) (NH4)3[SbCl6]; (2)[Co(en)3]Cl3 三氯化三(乙二胺 合钴 三氯化三 乙二胺)合钴 Ⅲ) 乙二胺 合钴(Ⅲ 二水合溴化二溴·四水合铬 四水合铬(Ⅲ (3)[Cr(H2O)4Br2]Br·2H2O 二水合溴化二溴 四水合铬 Ⅲ) 写出下列配合物的化学式: 写出下列配合物的化学式: (1) 羟基 水·草酸根 乙二胺合铬 Ⅲ) 羟基·水 草酸根 乙二胺合铬(Ⅲ 草酸根·乙二胺合铬 (2) 氯·硝基 四氨合钴 Ⅲ)配阳离子 硝基·四氨合钴 硝基 四氨合钴(Ⅲ 配阳离子 解: (1) [Cr(OH)(H2O)(C2O4)(en)]; (2) [Co(NH3)4(NO2)Cl]+
第五章
配位化合物
1
第五章
配位化合物
配合物、络合物,组成较复杂的一类化合物。 配合物、络合物,组成较复杂的一类化合物。 应用广泛: 分析检验, 黄血盐)、 应用广泛 分析检验,如K4[Fe(CN)6](黄血盐 、 黄血盐 K3[Fe(CN)6](赤血盐 ;药物;酶等。 赤血盐); 赤血盐 药物;酶等。 第一节 配位化合物的基本概念
Fe(CO)5
硫酸四氨合铜(Ⅱ 硫酸四氨合铜 Ⅱ) 六异硫氰根合铁(Ⅲ 六异硫氰根合铁 Ⅲ) 六氯合铂(Ⅳ 酸 六氯合铂 Ⅳ)酸 氢氧化四氨合铜(Ⅱ 氢氧化四氨合铜 Ⅱ) 五氯·氨合铂 Ⅳ 酸钾 五氯 氨合铂(Ⅳ)酸钾 氨合铂 硝酸羟基·三水合锌 Ⅱ 硝酸羟基 三水合锌(Ⅱ) 三水合锌 (三)氯化五氨 水合钴 Ⅲ) 三 氯化五氨 水合钴(Ⅲ 氯化五氨·水合钴 五羰(基 合铁 五羰 基)合铁 三硝基·三氨合钴 Ⅲ 三硝基 三氨合钴(Ⅲ) 三氨合钴 乙二胺四乙酸根合钙(Ⅱ 乙二胺四乙酸根合钙 Ⅱ)
[Fe(NH3)2(en)2] 2(SO4)3 硫酸二氨•二 乙二胺)合铁(Ⅲ) 硫酸二氨 二(乙二胺)合铁(Ⅲ) [Pt(NH3)4(OH)2]Cl2 氯化二羟基 四氨合铂(Ⅳ) 氯化二羟基·四氨合铂 Ⅳ 四氨合铂 中心原子(离子)的氧化数必须用罗马数字表示! 中心原子(离子)的氧化数必须用罗马数字表示!
3
2、配合物的结构与组成 、
配配配配 [ Cu ( NH3 ) 4 ]
2+ 2SO 4
中中中配 配配配 配配配配 内内( 配中配) 配配配
4
外内
①.中心原子(离子): 中心原子(离子) 配合物形成体,位于配离子中心。 配合物形成体,位于配离子中心。 一般为金属离子或金属原子( 过渡金属) 一般为金属离子或金属原子 ( 过渡金属 ) , 也有一些高氧化数的非金属元素。 也有一些高氧化数的非金属元素。 如:Ag+、Fe3+、Co 、Si(Ⅳ)、 (Ⅲ) ( )、B( ②.配位体:与中心原子以配位键结合的中性分 配位体: 子或阴离子。 子或阴离子。 配位原子: 配位原子: 配体中提供孤对电子的原子,也叫键 配体中提供孤对电子的原子, 合原子。 合原子。 多为电负性较大的非金属原子。 多为电负性较大的非金属原子。如:C、 、 5 O、S、N、P、X。 、 、 、 、 。
三氯•三氨合铬(Ⅲ) 三氯 三氨合铬(Ⅲ) 三氨合铬 [Ni(CO)5] 五羰基合镍(0) 五羰基合镍(0) [PtCl6]2六氯合铂( 六氯合铂(Ⅳ) 4.配合物的命名 与无机化合物命名相同。 配合物的命名: 4.配合物的命名:与无机化合物命名相同。 如:某化某、某酸某、某某酸、氢氧化某 某化某、某酸某、某某酸、
首页 上页 下页
10
返回
(2)先阴离子类配体,后阳离子类配体,最后分子类配体 。 先阴离子类配体,后阳离子类配体, 先阴离子类配体 K [ PtCl3(NH3)] 三氯 · 氨合铂 II )酸钾 氨合铂( 酸钾 同类配体中, (3)同类配体中,按配位原子的元素符号在英文字母表中的 同类配体中 次序分出先后。 次序分出先后。 [Co(NH3)5H2O]Cl3 三氯化五氨 · 水合钴 水合钴(III) (4)配位原子相同,配体中原子个数少的在前 。 配位原子相同, 配位原子相同 [Pt(Py)( NH3)(NO2)(NH2OH)]Cl 吡啶合铂( 氯化硝基 · 氨 · 羟氨 · 吡啶合铂 II ) (5)配体中原子个数相同,则按和配位原子直接相连的配体中 配体中原子个数相同, 配体中原子个数相同 的其它原子的元素符号的英文字母表次序, 的其它原子的元素符号的英文字母表次序,NH2-和 NO2- , NH2- 在前 。 命名口诀:先无后有,先阴后中,先A后B,先少后多 命名口诀:先无后有,先阴后中,
