第七章配位化合物
第七章 配位化合物

第七章
配位化合物
二、螯合物的一般性质
1.具有很高的稳定性(五原子或六原子环) 很少有逐级电离现象。 2.一般具有特征颜色、难溶于水、易溶于
有机溶剂。
第七章
配位化合物
这些特性被广泛用于金属离子的沉淀、 溶剂萃取分离、比色及定量分析、医疗 上的解毒剂等。
例如: 1、10—邻二氮菲与 Fe2+形成橘红色的螯合物, 用于鉴定Fe2+ 。
第七章
配位化合物
如果内界有多种配位体时,其顺序: 简单离子—复杂离子—有机酸根离子— 中性无机分子(按配位原子在字母表中 的顺序)—有机分子。
返回本章目录
第七章
配位化合物
第二节 配位化合物的价键理论
本节为选讲内容。
返回本章目录
第七章
配位化合物
第三节 配位与离解平衡 一、配位平衡
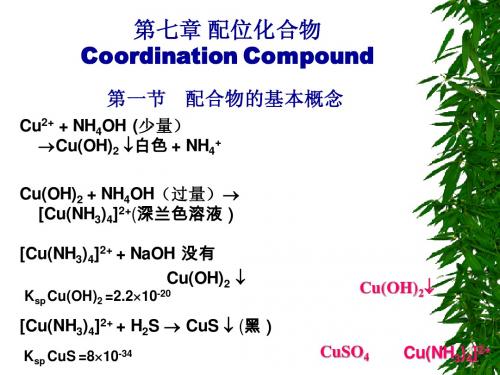
Cu2++4NH3 [Cu(NH3)4]2+ 加 Na2S有黑色CuS↓。
第七章
配位化合物
第七章 配位化合物
第一节 配合物的基本概念
第二节 配位化合物的价键理论 第三节 配位平衡
第四节 螯合物
第七章
配位化合物
第一节 配合物的基本概念
一、配合物的定义
1. 在CuSO4溶液中加入过量的NH3· 2O,再加入酒精, H
有深兰色的晶体 [Cu(NH3)4]SO4析出。[Cu(NH3)4]2+ 能稳定存在于[Cu(NH3)4]SO4的晶体和溶液中。
第七章
配位பைடு நூலகம்合物
2. HgCl2 + 2KI = HgI2↓(橘红色)+ 2KCl HgI2 + 2KI = K2[HgI4](无色溶液) [HgI4]2-能稳定存在于K2[HgI4]的晶体和溶液中。 此外,Ni(CO)4、 [PtCl2(NH3)2]等也是配合物。
无机化学7配位化合物

第七章 配位化合物
二、配位化合物的组成 1.配合物的内界和外界 配合物根据其化学键特点和在水溶液中的离解方式不同 而分成两大部分:内界和外界。内界是配位键结合的配离子 部分,通常用方括号括起。外界是与配离子以离子键结合的 带相反电荷的离子,写在方括号外面。配位分子是只有内界 没有外界的反离子,内界配离子部分是由中心离子和配位体 组成。
第七章 配位化合物
2.中心离子(或中心原子) 中心离子是在配位个体中提供空轨道的金属离子或原子, 是配合物的核心部分,是孤对电子的接受体,如[Cu(NH3)4] 2+中的Cu2+就是中心离子。常见的中心离子多是过渡元素金属 离子如Fe2+、Cu2+、Zn2+等,这些离子的半径小,电荷多,吸 引孤对电子能力强。少数金属原子和少数高氧化态的非金属 元素也可作配合物的形成体,如Fe(CO)5]、Ni(CO)4中的Fe、 Ni及[SiF6]2-、[BF4]-中的Si(Ⅳ)、B(Ⅲ)等。
第七章 配位化合物
4.配位数 配合物中直接与中心离子配位键结合的配位原子的总数 称为该中心离子的配位数,即中心离子与配体形成配位键的 数目。中心离子的配位数取决于配离子所含配体的种类和数 目。 单齿配体形成配位键的数目等于配体的个数,多齿配体 形成配位键的数目等于配体数乘以配体中所含配位原子的数 目。如[Co(en)2(NH3)2]3+ 中的Co3+ 的配位数是6而不是4, 因为每个乙二胺配体含有两个N配位原子。通常中心离子的 配位数是2、4、6。有些中心离子在特定条件下具有一定的 特征配位数。
第七章 配位化合物
根据配位体中所含有配位原子的数目和与中心离子配位情况,配位体 还可分为以下几种。 单啮配位体:在一个配位体中,能与金属离子配位的点称为配位点, 只有一个配位点的配位体叫单啮配位体,如NH3,H2O,配位后阻碍了正 负离子间的吸引而使溶解度增大。 非螯合多啮配位体:配位体有多个配位点,但由于空间位阻使同一配 位体的几个配位点不能直接与同一个金属离子配位,例如PO43-,一般情况 下,每个配位体要和一个以上金属离子配位,而每个金属离子为了满足配 位要求又要与若干个这样的配位体配位,这样形成的多核配位化合物,往 往是不溶性的沉淀,所以非螯合多啮配位体在化学中常作沉淀剂。 螯合配位体:一个配位体中的几个配位点能直接相同一个金属离子配 位,称为螯合配位体,如EDTA。不带电的单核螯合分子一般在水中的溶 解度很小,但能溶于有机溶剂中,这种配位体在水溶液中是一种沉淀剂, 在有机溶液中能起萃取络合剂的作用,如乙酰丙酮。带电的单核螯合离子 一般很难从水溶液中沉淀出来,这种配位体可作掩蔽剂,如酒石酸盐、 EDTA。
第七章 配位化合物

螯合物中的环称为螯环。多基配位体又 称为螯合剂。 螯合物具有特殊的稳定性,其中又以 五员环、六员环最稳定,环越多越稳定。 例:稳定性 [Cu(EDTA)]2- > [Cu(en)2]2+ >[Cu(NH3)4]2+
7.1.2 配合物的命名
1.习惯名 K4[Fe(CN)6] K3[Fe(CN)6] Fe4[Fe(CN)6]3 Na3[AlF6] [Ag(NH3)2]+ 亚铁氰化钾(黄血盐) 铁氰化钾(红血盐) 亚铁氰化铁(普鲁士蓝) 冰晶石 银氨离子
配合物 由一个离子(或原子)与几个相同的
或不同的离子(或分子)以配位键相结合的 复杂结构单元 AgCl· 3 2NH CuSO4· 3 4NH 溶于水后: AgCl· 3 → [Ag(NH3)2]+ + Cl2NH CuSO4· 3 →[Cu(NH3)4]2++SO424NH
[ NH3 Ag+ NH3 ]+
Ag+ + 2CN初始: 0 平衡: y 0 2y
[Ag (CN)2 ]0.1 0.1- y mol· -1 L
0.1-y ≈ 0.1
y3
所以
0.1 8 1 2.68 10 mol L 21 4 1.3 10
[Ag(CN)2]- 比[Ag(NH3)2]+ 稳定性
7.3.3 配位平衡的移动
1. 离解程度 内轨型配离子比外轨型配离子更稳定,
离解程度小。
2. 磁性 物质的磁性的大小可用磁矩μ来表示, 它与所含成单电子数n的近似关系如下:
B
n(n 2)B
称为Bohr(玻尔)磁子,是磁矩单位.
磁性实验可以用来测定是外轨型还是内 轨型配合物。外轨型未成对电子数不变,而 内轨型未成对电子数发生了变化。
第七章_配位化合物

第七章 配位化合物第一节 配合物的组成及命名一、配合物的组成 一、配合物配离子:由两种不同离子或一种离子与一种分子形成的复杂离子称之。
如:[]+23)(NH Ag 、[]+243)(NH Cu 、[]-36)(CN Fe 、[]-46)(CN Fe配合物:含配离子的化合物。
如:[]Cl NH Ag 23)(、[]443)(SO NH Cu 、[]63)(CN Fe K 、[]64)(CN Fe K 有时也把配离子笼统称为配合物。
二、配合物的组成配合物结构较复杂,但一样都有一个成份作为配合物的核心,其它部份围绕这一核心有规那么地排列。
(1)中心离子(配合物的形成体):位于配合物中心的离子或原子。
多为具有空轨道的过渡元素的金属离子(d 区、s d 区)。
少数为高氧化数非金属原子,如:[]-26SiF 、[]-6PF 。
个别为中性原子,如:[]4)(CO Ni 、[]5)(CO Fe 。
(2)配位体★含义:与中心原子结合的分子或离子。
多为含孤对电子的分子或离子。
如3NH 、O H 2、-Cl 、-CN 、-SCN 等。
★分类:依照一个配体中所含配位原子数量的不同,可将配体分为单齿配体和多齿配体。
单齿配体:一个配位体只含一个配位原子。
多齿配体:一个配位体只含两个或两个以上的配位原子。
(3)配位原子:配位体中直接与中心离子结合的原子。
配位原子大多为电负性较大的非金属原子,如:N 、O 、F 、C 、S 、x 等。
(4)配位数:★含义:直接与中心原子结合的配位原子数。
单齿配体:配位数=配位体数。
多齿配体:配位数=配位体数×一个配位体所含配位原子的个数(齿数)。
如:[]+22)(en Pt★阻碍因素中心离子正电荷:电荷数↑,配位数↑ 半径:中心离子半径↑,配位数↑配体半径↑,配位数↓外界因素:浓度,配体浓度高有利于形成高配位数。
温度,温度低有利于形成高配位数。
★体会:中心离子 +1 +2 +3 +4 配位数 2 4(6) 6(4) 6(8)(5)内界:即配离子,用“[ ]”括起。
第七章 配位化合物

1 1.73
2 2.83
3 3.87
4 4.90
5 5.92
如:实验测出 [FeF6]3﹣的µ= 5.9 → n = 5 可知它是外轨型配合物 再如: 再如:实验测出 [Fe(CN)6]3﹣的µ= 1.9 → n = 1 可知它是内轨型配合物 外轨型,中心离子电子结构未变, 外轨型,中心离子电子结构未变,单电子数未变 内轨型,中心离子电子结构改变, 内轨型,中心离子电子结构改变,单电子个数改变
配
配
4
7.1.2 配位化合物的组成
[Cu(N 配 [Cu(NH3)4] SO4
中 心 离 子 配 位 原 子 界 位 体
配 离 子 电 荷
2+
配 位 数
外 界
配位化合物
5
中心离子(原子) ① 中心离子(原子):位于配位化合物的中心位置的离子 或原子,是配合物的核心, 或原子,是配合物的核心, 通常是某些金属阳离子或金属原子以及高 氧化态的非金属元素
和中心离子配合的负离子或分子, ② 配位体: 和中心离子配合的负离子或分子,简称配体
③ 配位原子:直接与中心原子配位的原子。配位原子上均 配位原子:直接与中心原子配位的原子。
有孤对电子, 有孤对电子,N、O、S、Cl、C、F、Br、I等 Cl、 Br、 直接与中心离子(或原子) ④配位数:直接与中心离子(或原子)结合成键的配位原子 数目,常见的为2 数目,常见的为2、4、6。
14
§7.2 配合物的化学键理论
中心离子和配位体之间是怎样结合的? 中心离子和配位体之间是怎样结合的? 关于配合物的化学键理论主要有: 关于配合物的化学键理论主要有: 价键理论√ 晶体场理论 配位场理论 分子轨道理论
15
第七章_配位化合物

第七章 配位化合物
•(2)配体命名次序: • 简单负离子-复杂负离子-有机酸根离子-中性分子 (H2O - NH3 -有机分子);不同配体之间用中圆点分开。 例如:H2[PtCl6] 六氯合铂(Ⅳ)酸 [Cr(H2O)4Cl2]Cl 一氯化二氯· 四水合铬(Ⅲ) (3)配体数用中文数字“一、二、三·· ·”表示,标在配体名 · 称之前。 (4)中心离子的电荷数用罗马数字“Ⅰ、Ⅱ 、 Ⅲ 、 Ⅳ” 标明,用圆括号括起来标在中心离子名称之后。
课本220页:表7-2 杂化轨道类型与配合物
–14 –
第七章 配位化合物
第七章 配位化合物
2、d 2sp3杂化:
[Fe(CN)6]3-,Fe3+:3d 5 与CN-配位时,Fe3+采取的是d2sp3杂化。
[Zn(NH3)4]2+, Zn:3d 104s2 →Zn2+:3d 10(4s04p0) 在NH3作用下,Zn2+采取了sp3杂化,形成正四 面体型的杂化空轨道,与配体中NH3中N原子的4对 孤对电子形成四个配位键。空间构型:正四面体 再如: [Ni(NH3)4]2+、 [CoCl4]2-、 [HgI4]2-
夹心配合物示意图
Fe
根据成环原子数目,可以分成四元环、五元环、六元 环、七元环,其中五元环和六元环最稳定,而且,环数 越多越稳定,[Cu(en)2]2+中有两个五元环,[CaY]2-有五 个五元环。 大多数螯合物都有特征颜色,难溶于水,所以分析中 常用EDTA来做配位滴定,其二钠盐易溶于水。
第七章 配位化合物
第七章 配位化合物
第七章
配位化合物 P208
1、掌握配合物的定义、组成及命名
2、掌握配合物价键理论的要点,并能运用杂化轨道理 论解释配离子的空间构型;
大学化学 第七章 配位化合物''

College Chemistry
3.配体类型相同,按配位原子元素符号英文字母顺 序排列;[Co(H2O)(NH3)5]Cl3 三氯化五氨·一水合钴(Ⅲ) 4.配体类型、配原子都相同,原子数少的在前;
[Pt(Py)2(en)2]Cl2 氯化二吡啶·二乙二胺合铂(Ⅱ)
第七章 配位化合物
大 学 化 学
(二)螯合物(chelate)
多齿配体与中心离子形成的具有环状结构的 配合物。 最常见的螯合剂:en,EDTA
第七章 配位化合物
大 学 化 学
College Chemistry
五个五元环
第七章 配位化合物
大 根据成环原子数目,可以分成四元环、五元 学 环、六元环、七元环,其中五元环和六元环最稳 化 定,而且环数越多越稳定。[Cu(en)2]2+中有两个五 学 2-
元环, [CaY] 有五个五元环。分析中常用 EDTA 来做配位滴定。 大多数螯合物都有特征颜色,难溶于水。
College Chemistry
第七章 配位化合物
大 学 化 学
(三)金属有机化合物: 金属原子与有机配体中的C原子结合而形成的 配合物。
1973 年 慕 尼 黑 大 学 的 恩 斯 特 ·奥 托 ·菲舍尔及伦敦帝国学院的杰弗 里 ·威尔金森爵士被授予诺贝尔化 学奖,以表彰他们在有机金属化学 领域的杰出贡献。
2
College Chemistry
反过来,根据配离子的电荷数和配体的电荷 数,也可以推算出中心离子的电荷数。
第七章 配位化合物
大 配合物的种类非常多,主要有两大类: 学 化 (一)简单配合物(complex) 学
单齿配体与中心离子形成的配合物。
三、配合物的类型
College Chemistry
第七章 配位化合物

sp 3d 2杂杂 sp3d 2杂杂杂杂
3d
3d 7
NH3 NH3 NH3 NH 3 NH 3 NH 3
8
外轨型配合物,高自旋 µ = 3.87B.M. 八面体构型
说明 Co(CN)64–不稳定,易被氧化
4d 4p 4s 3d 7
激激 3d6
d 2 sp 杂杂 3d
CN
-
Co(CN)64 –氧化成Co(CN)63–
(3).多核配合物 一个配位原子与二个中心离子结合所成的配合物称多核 配合物,例如:
(4).金属有机配合物 有机基团与金属原子 之间生成碳—金属键 的化合物。A)金属与 碳直接以σ键合的配合 物;B)金属与碳形成 不定域配键的配合物。
7-2 配合物的化学键理论
用来解解释配合物化学键的本质,配合物的结构、稳定性以及一 般特性(如磁性、光譜等)的主要理论有①价键理论、②晶体场理 论、③分子轨道理论。 一,价键理论
4d 4p 4s
4d
CN CN - CN
-
-
CN - CN -
(3).磁性——可通过磁矩来判断内轨型配合物或外轨型的 配合物
形成外轨型的配合物,中心离子电子结构未发生变化,单电子数 与原来自由离子相同; 而形成内轨型的配合物,中心离子的成单电 子数一般会减少,比自由离子的磁矩相应降低,所以可通过磁矩来判 断内、外轨型配合物。. 物质的永磁矩主要是电子的自旋造成的,永磁矩µ与原子或分子中 未成对电子数n有如下关系式:
第七章--配位化合物PPT课件

投入到中心离子的内层空轨道中,所以一般形成外轨型配
合物;CN-、CO等电负性小、变形性大的配位原子,提供
的电子易于投入到内层空轨道中,形成内轨型配合物(螯
合物一般为内轨);NH3、Cl-没有明显的规律;
.
13
• B、配合物的稳定性:指水溶液中的解离程度, 用K不稳或K稳来衡量。价键理论认为(定性): 对同一中心离子或同一配体,配位数相同时,内 轨型配合物较外轨型配合物更稳定,如Co(NH3)62+ + O2 Co(NH3)63+,解释:内轨型配合物极性小, 外轨型配合物极性大,所以外轨型配合物易为水 拆 散 而 解 离 。 例 如 FeF63- ( 外 轨 , 2×1015 ) 、 Fe(CN)63-(内轨1042),FeF63- + 6CN- Fe(CN)63+ 6F-。
.
1
第二节 配合物的基本概念
• 一、配合物的定义
• 它是由形成体(中心体)与配体以配位键结合而成的复杂化合物。
• 二、配合物的组成
• 以[Cu(NH3)4]SO4和K3[Fe(CN)6]为例说明其组成和一些基本概念。 • 1、内、外界:内界(配离子)――[Cu(NH3)42+]、[Fe(CN)6]3-;外界
.
+1
+2
+3
+4
(Ag+、Cu+) (Cu2+、Zn2+、Hg2+) (Fe3+、Co3+) (Si4+、Pt4+)
CN
2
4、6
6、4
6、8
• 6、配离子的电荷:中心离子与配体电荷的代数和,如 [Pt(NH3)4][PtCl4]、[Fe(C2O4)3]3-。
第七章配位化合物(简)案例

CH2—COOH
CH2—COOH
多齿配体与中心离子配位后形成的配合物具有环
状结构,例:[Cu(en)2]2+
H2C—H2N Cu NH2—CH2CO 两个五原环
O CH 2 H2C—H2N NH2—CH2 CO — CH 22 例:[Zn(EDTA)] O N (五个五原环) Zn CH2 O N CH2 CO CH2 CH2 O CO
[Ag(NH3)2]OH H2[SiF6] Na[Pt(NH3)Cl5] [Ag(NH3)2]Cl Na3[AlF6] Ni(CO)4
氢氧化二氨合银(I) 六氟合硅(Ⅳ)酸 五氯•氨合铂(Ⅳ)酸钠 氯化二氨合银(I) 六氟合铝(Ⅲ)酸钠 四羰基合镊(0)
四、 配离子的空间构型 例:[Ag(NH3)2]+ 配位数为2, 直线型 H3N——Ag——NH3
x= 1.4×10 -9
三、配位平衡的计算(略)
例:分别计算0.1mol/L [Ag(NH3)2]+中和0.1mol/L[Ag(CN)2]中Ag+ 的浓度,并说明 [Ag(NH3)2]+ 和 [Ag(CN)2]- 的稳定性。
解: Ag+ + 2NH3 初始: 0 0 平衡: x 2x [Ag (NH3)2 ]+ 0.1 mol· L-1 0.1- x x 0 . 1 7 1 . 1 10 2 x(2x)2 0.1-x ≈ 0.1
三、配合物的命名
1、习惯名称 K4[Fe(CN)6]: 黄血盐
Fe(C5H5)2: 二茂铁
K3[Fe(CN)6]: 红血盐 K[PtCl3(C2H4)]:蔡斯盐
2、系统命名
• 遵循无机化合物命名规则: 阴离子在先,阳离子在后 酸、 碱、 盐 配酸、配碱、配盐
07第七章 配位化合物
4H+ 4NH4+
[Cu(NH3)4]2+
溶液的酸度越强,配离子越不稳定; 保持溶液的酸度不变,配体的碱性越强,配离子 越不稳定; 配离子的Ks越大,抗酸能力越强
配位平衡与溶液酸度的关系
水解效应:因[OH-]浓度增加,金属离子与OH结合致使配离子解离的作用
在不产生氢氧化物沉淀的前提下,适当提高溶液的pH 以保证配离子的稳定性
[Cu(en)2]2+:[Cu2+]=6.3×10-8mol· -1 L CuY2-:[Cu2+]=1.4×10-10mol· -1 L
Cu2+ +
NH3
Ka1
[Cu(NH3)]2+
[Cu(NH 3 )]2 K a1 [Cu 2 ][ NH 3 ]
[Cu(NH3)]2+ +
NH3
Ka2
[Cu(NH3)2]2+
四硝基二氨合钴(Ⅲ)酸钾
NH4[Cr(NCS)4 (NH3)2] 四(异硫氰酸根) 二氨合铬(Ⅲ)酸铵 K2[Pb(SNC)2Cl4] [Ni(CO)4 ] H2[PtCl6 ] [PtNH2(NO2)(NH3)2]
四氯二(硫氰酸根)合铅(Ⅳ)酸钾
四羰基合镍(0) 六氯合铂(Ⅳ)酸 氯基硝基二氨合铂(Ⅱ)
外 层
注:内外层靠离子键结合,相当于盐。当向 [Cu(NH3)4]SO4溶液加入BaCl2时,有BaSO4 白色沉淀生成
(一)中心原子 离子—— 原子—— (二)配体和配位原子 中性分子—— 负离子——
Cu2+、Ni2+、Zn2+ Ni
中心离子或原子的价电子层有空轨道
第七章 配位化合物

7.1 配合物的组成
1.配合物的组成
配合物由中心离子(原子)和配体组成。 中心离子主要是金属离子。 配体是指与中心离子有化学键作用的
分子或基团。 配体与中心离子间的化学键称为配位键。
例如在右图中, Fe2+离子是中心离子, H2O分子是配体, SO42-离子NH4+离子都不是配体。 (硫酸根与配合物阳离子之间存在氢键(虚线))
每个硫酸根离子同时连接着两个Cu2+离子。 同时与两个或多个中心离子形成配位键的配体,称为桥配体, 意思是指它像桥梁连接着相邻的中心离子。
3.配体的配位方式
1)单齿配位 配体的一个配原子与一个中心离子
配位,称为单齿配位。
2)螯合配位(双齿,多齿)
吡啶与铜的单齿配位
多齿配体可采取螯合配位方式与一个中心离子配位,
实例
2
sp
直线型
A g (C N )2-
3
sp2
平面三角型
H
g
I
3
4
sp3
正四面体型
Z
Байду номын сангаас
n (N
H
) 2+
34
4
dsp2
平面正方型
P
tC
l
2 4
-
6
sp3d2
正八面体
F e(H
2O
)
2 6
6
d2sp3
正八面体
F
e (C
N
)
4 6
3)碳-金属配位键 碳原子上含孤对电子的原子轨道(杂化轨道),也可以与
金属离子的空轨道重叠,形成碳-金属配位键。 含有碳-金属配位键的化合物称为金属有机化合物
2)金属离子的杂化轨道
第七章 配位化合物

第一节 配位化合物的基本概念 第二节 配位化合物的价键理论简介 第三节 配位平衡 第四节 螯合物 第五节 与医药学有关的配位化合物
第一节 配合物的基本概念
例如:
(1)单齿配体 NH3 Ag+ + 2NH3 → [H3N:→ Ag ←:NH3]+ (2)多齿配体 乙二胺NH2 - CH2-CH2-NH2 (en)(2
个),EDTA(6个)
有少数配体虽含有两个配原子,但两个配原 子距离太近,只能选择其中一个配原子与中 心原子形成一个配位键,故仍属于单齿配体。
如:[Ag(NH3)2]+ 、 [Cu(NH3)4]2+、 [ Fe(CN)6]3- 、Ni(CO)4 、[Co(NH3)3Cl3 ] 配离子电荷 分别为 +1、+2、-3 、0 、0
三、配合物的命名
内界的命名次序是: 配位体数—配位体名称—合—中心离子(中心离子氧化数)
配体命名原则:
(1)先无机配体,后有机配体
cis - [PtCl2(Ph3P)2] 顺-二氯 ·二 (三苯基磷)合铂(II)
(2)先阴离子配体,后中性分子配体;
K[PtCl3NH3] 三氯·一氨合铂(II)酸钾
(3) 同类配体(同为阴离子配体或同为中性分子配体) 按配位原子元素符号的英文字母顺序排列。
[Co(NH3)5H2O]Cl3 三氯化五氨·一水合钴(III)
第七章 配位化合物
配位化合物在生命过程中的重要作用
1、生物体内各种酶都是金属螯合物 。
2、生物体内许多蛋白质是金属螯合物 。如 铁是血红蛋白和肌红蛋白的组成成份 ,在体内 参与氧的运输和贮存。铁在血红蛋白、肌红 蛋白和细胞色素分子中都以 Fe2+ 与原卟啉环 形成配合物的形式存在。
第七章 配位化合物

b
b a c c a
b
a b
a
一反二顺: 3 种
b
c b 总之,配体数目越多,种类越多,异构现象则越复杂。 -18-
2°旋光异构
配体的相互位置关系不一致形成几何异构,当相
互位置的关系一致时,也可能不重合。比如人的 两只手,各手指、手掌、手背的相互位置关系一 致,但不能重合,两者互为镜像。 配体相互位置关系相同,两者互为镜像但又 不能重合, 则互为旋光异构。
可重合,不存在旋光异构
不能重合,互为旋光异构
-19-
旋光异构体的熔点相同,但光学性质不同。
自然光
起偏镜
偏振光
旋光物
发生偏转
-20-
互为旋光异构体的两种物质, 使偏振光偏转的方向不同。使偏振光向左(逆
时针)旋转的称左旋异构体;使偏振光向右旋转(顺时针)的称左旋异构体。 例如:存在于烟草 中左旋尼古丁的毒 性要比人工合成出 来的右旋尼古丁毒 性大得多。
不同的旋光异构体在生物体内的作用不同。
顺式 Ma2b2c2 有旋光异构体,如下图所示:
b b
a a c c
a
a a c c b b
a b c b c d
-21-
4 配位的正四面体: Mabcd 旋光异构体:
d
7.1.2 配合物的命名
基本遵循一般无机化合物的命名原则
1.整体命名:先阴离子,后阳离子
配离子为阳离子 外界是简单阴离子(OH-、Cl-),“某化某” [Ag(NH3)2]OH [Pt(NH3)6]Cl4
-9-
常见单齿配体 单击此处编辑母版标题样式 中性分子 H2O NH3 CO CH3NH2 配体 水 氨 羰基 甲胺 单击此处编辑母版文本样式 O N C N 配位原子 第二级 1. 镧系、锕系元素通性 阴离子 F Cl- Br- I- OH- CN- NO2第三级 配体 氟 氯 溴 碘 羟基 氰 硝基 第四级 2. 我国稀土元素资源和提取 O C N 配位原子 F Cl Br I 第五级 SCNNCS阴离子 ONO3. 核反应类型 配体 亚硝酸根 硫氰酸根 异硫氰酸根 O S N 配位原子
基础化学第七章 - 配位化合物ppt课件

30Zn2+
[Ar]3d104s04p0
1. [Zn(NH3)4]2+3d Zn2+:3d10
3d [Zn(NH3)4]2+:
4s
4p
sp3
NH3中N提供
[Zn(NH3)4]2+ 特点:中心原子d电子不变化 中心原子杂化情况: sp3杂化 空间构型:正四面体
[Zn(NH3)4]2+ NH3
Zn2+
配体:
NH3 ,配位原子: N
配位数:
6
K4[Fe(CN)6] 六氰合铁(Ⅱ)酸钾 配体: CN- ,配位原子: C 配位数: 6
H2[PtCl6] 六氯合铂(Ⅳ)酸 配体: Cl- ,配位原子: Cl 配位数: 6
[Co(ONO)(NH3)5]SO4 硫酸亚硝酸根•五氨合钴(Ⅲ)
配体: NH3,ONO-
[PtCl5(NH3)] 五氯•氨合铂(V) 配体 Cl-,NH3 配位原子 Cl,N 配位数 6
例题:p110,2-6
[ Pt (NH3) 4(NO2) Cl ]
氯•硝基•四氨合铂(II)
配体
Cl-,NO2 - , NH3
配位原子 Cl,N,N 配位数 6
例题:p110,2-7
[Co(ONO)(NH3)5]SO4 硫酸亚硝酸根•五氨合钴(Ⅲ) 配体 NH3 , ONO配位原子 N , O 配位数 6
2 、稳定常数Ks
Ks Cu 2+ + 4 NH3
[Cu (NH3)4]2+
Ks=
[Cu (NH3)42+] [Cu 2+] [NH3]4
例题:
请判断[Fe(H2O)6]3+( µ =5.70 ) 中 Fe3+
第七章 配位化合物

n(n 2)
波尔磁子(μB)。
分别测定自由离子和配合物的磁矩,确定各 自的单电子数n,若二者单电子数一致则为 从外轨型,不同则为内轨型。例如[FeF6]3配离子,实验测得磁矩为5.88μB,与根据 上式n = 5时所计算出磁矩理论值5.92μB接 近,由此可推知[FeF6]3-保留着5个单电子, 属于外轨型配离子。
1. 中心原子与配体中的配位原子之间以配位 键结合,即配位原子提供孤对电子,填入中心原 子的价电子层空轨道形成配位键。配体为电子对 给予体 ( Lewis碱 ),中心原子为电子对接受体 (Lewis酸),二者的结合物——配离子或配位分子 是酸碱配合物。
2. 为了增强成键能力和形成结构匀称的配 合物,中心原子所提供的空轨道首先进行杂化, 形成数目相等、能量相同、具有一定空间伸展 方向的杂化轨道,中心原子的杂化轨道与配位 原子的孤对电子轨道在键轴方向重叠成键。
[Ni(NH3)4]2+
3d
sp3
[Ar]
电子由 NH3 中N提供
外轨配合物
dsp2
-
[Ni(CN)4]2-
3d
4p
[Ar]
电子由 CN 中C提供
内轨配合物
4. 26Fe2+的价层电子组态为3d6,磁矩μ=4.9μB, 说明有4个单电子。形成6配位化合物时有2种不 同的杂化类型:[Fe(CN)6]4-,μ=0 μB。说明 配体CN-对中心原子d电子产生较强的排斥作用, 致使其重排,空出2个3d轨道,然后进行d2sp3杂 化,d2sp3杂化轨道接受来自CN-中C原子提供的 6对孤对电子,形成六个配位键,空间构型为正 八面体。由于该配离子无未成对电子,具有反 磁性,内轨型。过程如下所示:
3d
第七章 配位化合物

2. 内界命名 (1) 内界命名顺序:
配体数目+配体名称 + 合 + 中心体名称 + (中心体氧化数)
配体数目:一、二、三表示 配体名称:不同配体用“•”分开 中心体氧化数:用罗马数字I、II、III等表示。
[Ag(NH3)2 ] + 二氨合银(I)(配离子) [Fe(CN)6]3- 六氰合铁(Ⅲ)(配离子) [Cu(NH3)4] 2+ 四氨合铜(Ⅱ)(配离子) [PtCl2(NH3)(C2H4)]:???
2. d2sp3杂化 [Fe(CN)6]3-,Fe属第VIIIB 族,第四周期
Fe:3d64s2 → Fe3+:3d5(4s04p04d0)
例7.4 实验测定配合物 K3FeF6 的磁矩为5.88 B.M, 而配合物 K3Fe(CN)6 的磁矩为2.4 B.M。 判断上述两种配合物是内轨型还是外轨型。
c
配位数相同时,解离常数越大,配合物越不稳定。 为了反映配离子解离平衡的特殊性和书写方便, 把解离常数称作不稳定常数。
第六章作业
2. 分子中只存在σ键的有:SiH4、CH4、 SiO2、NH3
7. 化合物
中心原子的 杂化轨道类型
分子的空 分子有 间构型 无极性
OF2 sp3(2)不等性杂化 V型
有
SiH4
sp3等性杂化 正四面体
无
HgCl2 sp等性杂化
直线型
无
SiHCl3
sp3杂化
四面体
有
PCl3 sp3(1)不等性杂化 三角锥
1. 解离常数 K不稳 (dissociation constant)
配离子在水溶液中解离成中心体和配体两部分,
070 第七章(配位化合物)

硫酸四氨合铜(Ⅱ) 六氰合铁( Ⅱ )酸钾 六氯合铂(Ⅳ)酸 二氢氧化四氨合铜(Ⅱ) 五氯•一氨合铂(Ⅳ)酸钾 硝酸一羟基•三水合锌(Ⅱ) 三氯化五氨•一水合钴(Ⅲ)
五羰基合铁
三硝基•三氨合钴(Ⅲ)
乙二胺四乙酸根合钙(Ⅱ)
(1) (NH4+)3[SbCl6]; (2) [Co(en)3]Cl3;
Kf =Kf1 Kf2 Kf3 Kf4 10
12.59
多重平衡规则的运用
1.2 累积平衡常数
1 =Kf1
2 =Kf1 Kf2
……
n =Kf1 Kf2 Kf3
Kfn
等于逐级稳定常数的乘积
1.3 配离子的不稳定常数( K d 或 K不稳 )
解: AgI(s) + 2S2 O3
2
[Ag(S2O3 )2 ] I
3
K Kf
([Ag(S O ) ] 2 3 2
3
)
Ksp ( AgI )
17
2.9 10 8.3 10
13
2.4 10
3
[Ag(S2 O3 )23 ][I ] 0.01 0.01 3 K = 2.4 10 2 2 2 2 [S2 O3 ] [S2 O3 ]
因为:K=9.1×10-10,说明AgI在NH3· H2O 中的溶解度很小,即x 很小。 2
x 10 9.110 所以:6.0-2x≈6.0 则: 2 (6.0)
x 1.8 10 mol L
4
1
(2) 平衡时
K Kf
AgI(s) + 2CN 0.010-2y
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2. 配位化合物 含有配离子或形成配分子的化合物叫配合物。 配合物和配离子无严格区分,配离子也可叫配合物。 维尔纳 Werner, Alfred 1866—1919 “无机化学中的凯库勒” “真正的雄心壮志几乎全是智慧、辛勤、 学习、经验的积累,差一分一毫也不可能达到 目的。至于那些一鸣惊人的专家学者,只是人 们觉得他们一鸣惊人。其实他们下的功夫和潜 在的智能,别人事前是领会不到的。”
三. 配合物的类型
1. 简单配合物 单齿配体与中心离子配位形成的配合物。 [Ag(NH3)2]Cl [Co(NH3)5(H2O)]Cl3 2. 螯合物 多齿配体与中心离子配位形成的具有环状结构 的配合物。 根据成环原子数目,可以分成四~七元环, 其中五元环和六元环最稳定,环数越多越稳定。 大多数螯合物都有特征颜色,难溶于水, 易溶于有机溶剂。
例7.4 实验测定配合物 K3FeF6 的磁矩为5.88 B.M, 而配合物 K3Fe(CN)6 的磁矩为2.4 B.M。 判断上述两种配合物是内轨型还是外轨型。 提示:比较杂化前后中心离子单电子数是否相同,判断杂化类型。
基态Fe3+:3d5(4s04p04d0) K3FeF6是外轨型配合物,Fe3+采取sp3d2杂化; 同理可求得K3Fe(CN)6中有1个未成对电子, 即K3Fe(CN)6中Fe3+的原子轨道发生了重排。 K3Fe(CN)6是内轨型配合物,Fe3+ 采取d2sp3杂化。
(三)配位数为6的配合物:正八面体型 1. sp3d2杂化
[FeF6]3-, Fe属第VIIIB 族,第四周期
Fe:3d64s2 → Fe3+:3d5(4s04p04d0)
2. d2sp3杂化 [Fe(CN)6]3-,Fe属第VIIIB 族,第四周期
Fe:3d64s2 → Fe3+:3d5(4s04p04d0)
① 多数中心体可用上述方法判断内、外轨型; 但中心体为d1、d2、d3时,一般为内轨型杂化。 ② 卤素离子、 OH-、 H2O配位时常成外轨型配合物; CN-、CO配位时常形成内轨型配合物。 ③ 内轨型配合物次外层d轨道参与杂化,能量较低, 内轨型配合物比外轨型配合物稳定。 如稳定性[Fe(CN)6]3- > [FeF6]3-
配合物常见杂化类型
配位数 杂化轨道 空间构型 类型 示例 2 sp 直线型 外轨型 Ag(NH3)2+ sp3 正四面体 外轨型 Ni(NH3)42+ 4 dsp2 平面四方 内轨型 Ni(CN)426 sp3d2 d2sp3 正八面体 外轨型 正八面体 内轨型 FeF63Fe(CN)63-
§7.3 配合物在溶液中的解离平衡
(2) 内界多种配体共存时命名顺序
① 先无后有 无机配体与有机配体共存时,无机在前; K[Pt PyCl3] 三氯· 一吡啶合铂(Ⅱ)酸钾 ② 先阴后中 多种无机配体共存时,阴离子配体在前; K[Pt NH3Cl3] 三氯· 一氨合铂(Ⅱ)酸钾 ③ 同类配序 配体类型相同,按配位原子元素符号的英文 字母顺序排列; [Co(H2O)(NH3)5]Cl3 三氯化五氨· 一水合钴(Ⅲ)
配体数目:一、二、三表示 配体名称:不同配体用“•”分开 中心体氧化数:用罗马数字I、II、III等表示。
[Ag(NH3)2 ] + 二氨合银(I)(配离子) [Fe(CN)6]3六氰合铁(Ⅲ)(配离子) [Cu(NH3)4] 2+ 四氨合铜(Ⅱ)(配离子) [PtCl2(NH3)(C2H4)]:???
(2) 配酸:外界是H+: 某酸
H2[PtCl6] 六氯合铂(IV)酸 (3) 配碱:外界是OH-:氢氧化某 [Ag(NH3)2]OH 氢氧化二氨合银 (4) 配分子: 无外界。命名如配离子。
2. 内界命名 (1) 内界命名顺序: 配体数目+配体名称 + 合 + 中心体名称 + (中心体氧化数)
第六章作业
2. 分子中只存在σ键的有:SiH4、CH4、 SiO2、NH3 7. 化合物 OF2 中心原子的 杂化轨道类型 sp3(2)不等性杂化 分子的空 间构型 V型 分子有 无极性 有
SiH4 HgCl2
SiHCl3 PCl3
sp3等性杂化 sp等性杂化
sp3杂化 sp3(1)不等性杂化
正四面体 直线型
1. 解离常数 K不稳 (dissociation constant) 配离子在水溶液中解离成中心体和配体两部分, 如: [Ag(NH3)2]+ = Ag+ + 2NH3
cAg
c c 解离常数: K = cAg(NH )
(
cNH3
3 2
)2
K不稳=
cAg c NH cAg(NH
二、配合物的组成
配合物一般由内界和外界两部分组成。 中性配位分子只有内界,没有外界。 外界 内界 内界 外界
Na3[AlF6]
中心离子
[Cu(en)2] SO4 配位体数 中心离子 配位体 配位体数 配位体
[Ni(CO)4] 中心原子
四羰基合镍只有内界, 称为内配盐(内络盐)。
1. 中心体 (Metal) :中心离子或原子,也称形成体。 中心离子必须具有空轨道, 一般是带正电荷的过渡金属离子, 高氧化态的非金属元素也较常见。 如:[SiF6]2-、BF4-。
§7.2 配合物的结构 ——价键理论和空间构型
Valence bond theory and geometrical structure
一、价键理论要点
配位键是中心离子通过空轨道接受配位原子 提供的孤对电子,形成的一类特殊的共价键。
中心离子空轨道
配位键
配体含孤对电子的轨道
M ←∶L
配位键的形成 1. 条件:中心体M有空轨道(主要是长周期过渡元素); 配体L至少含有一对孤对电子对。 2. 杂化:中心体所提供的空轨道 (s-p,d-s-p或s-p-d) 必须先进行杂化,形成能量相同的与配位 原子数目相等的新杂化轨道。 杂化轨道再与配位原子重叠成键, 从而产生不同空间构型的配离子。
四面体 三角锥
无 无
有 有
内轨型配合物:dsp2、d 2sp3 内层轨道参加杂化形成的配合物叫内轨型配合物; 外轨型配合物:sp、 sp2、 sp3、sp3d 2 外层轨道参加杂化形成的配合物叫外轨型配合物。 [Ni(H2O)6]2+
[Co(NH3)6]3+
二、内轨型配合物与外轨型配合物
1. 通过空间构型判断 (只适于四配位)
普鲁士蓝/柏林蓝/贡蓝/铁蓝
血红素
§7.1 配合物的基本概念
一、配合物的定义 1. 配离子 由一个简单正离子或原子与一定数目的中性 分子或负离子通过配位键结合在一起形成的 复杂离子即配位离子,简称配离子或络离子。
AgCl + 2NH3 FeCl3 + KSCN
[Ag(NH3)2]Cl K3[Fe(NCS)6]
[Zn(NH3)4]2+
Zn:属第IIB 族,第四周期
Zn:3d104s2
Zn2+:3d10(4s04p0)
sp3杂化:
2. dsp2杂化:平面四方型
[Ni(CN)4]2-,Ni属第VIIIB 族,第四周期
Ni :3d84s2 → Ni 2+ :3d8(4s04p0)
[
NC Ni
CN CN
NC
]
2-
乙二胺四乙酸 (EDTA) 六齿配体
3. 配位体数与配位数
① 配位体数:配位体的个数 ② 配位数:直接同中心离子或原子配位的原子数目。 单齿配体:配位数=配体数 [Cu(NH3)4]2+ [Ag(S2O3)2]3- [Co(H2O)2Cl4]2- 多齿配体:配位数=配体数×齿数 [Cu(en)2]2+ 2×2=4 [Ag(NH3)2]Cl 配位体数 = 2 配位数 = 2 配位数 = 6 [PtCl2(en)2]Cl2 配位体数 = 4
④ 同配先少 配体类型、配原子都相同,原子数少的在前; [Pt (Py)2 (en)2 ]Cl2 Py:C5H 5N en : C2H8N2
氯化二吡啶· 二乙二胺合铂(Ⅱ)
⑤ 同数连序 配体类型、配原子、原子数都相同, 按结构式中与配原子相连的原子的元素符号的 英文字母顺 序排列; [Pt (NH3)2(NO2) (NH2)]
NH3
3+
[Co(NH3)6]3+
H3 N Co H3 N
NH3 NH3
NH3
2. 配体 (Ligand) 与配位原子
① 配体:配离子中与中心离子或原子以配位键结合 的有孤对电子的中性分子或负离子。 含π(键)电子的化合物也可作为配体: H2C=CH2 ② 配位原子:直接与中心离子或原子键合的原子。 配位原子必须具有孤电子对, 一般为电负性较大的非金属元素原子。 如:C、N、O、S、X-。
第七章 配位化合物
The Coordination Compounds
本章要点
1. 掌握配合物的定义、组成及命名 2. 掌握配合物价键理论要点, 并能用杂化理论解释配离子的空间构型; 掌握外轨型、内轨型配合物的概念及判断方法 3. 掌握配离子稳定常数的意义及配位平衡的有关计算 4. 熟悉一些常见配合物及在分析化学中的应用
三、配合物的空间构型
(一) 配位数为2的配合物:sp杂化,直线型
[Ag(NH3)2]+
Ag:属第ⅠB 族,第五周期
Ag:4d105s1
Ag+:4d10(5s05p0)
+ [H N Ag NH ] sp 杂化: 3 3
与前面介绍的sp杂化基本相同,但杂化轨道是空轨道。
(二)配位数为4的配合物 1. sp3杂化:四面体型
常见配位数为2、4、6。 也有少数奇数的,如:Fe(CO)5、[TiF5]3-
4. 配离子的电荷
中心离子电荷和配体电荷的代数和。
[Fe (CN)6 ]
