双线桥单线桥
(课件)双线桥和单线桥-课件培训资料

04
电路分析方法
电路分析的基本步骤
观察电路结构,确定电路由哪些元件组成,并了 解各元件的连接关系。
根据电路图和数据表,列出各元件的电流、电压 、电功率等物理量。
根据电路元件的连接关系,判断出电路是串联、 并联还是混联,并选择合适的分析方法。
根据电路元件的连接关系和物理量的关系,运用 欧姆定律、基尔霍夫定律等基本原理,推导出所 需的结果。
03
比较双线桥和单线桥
电路结构和连接方式的比较
双线桥的电路结构和连接方式
双线桥的电路结构是两个线圈互相串联,两个线圈的中间抽 头接正极,另外两个头接信号源和地。连接方式为两头接信 号源和地的线圈与另一条线形成回路。
单线桥的电路结构和连接方式
单线桥的电路结构是一个线圈跨接在正负极之间,抽头接信 号源,另外一头接地。连接方式为信号源一头接抽头,另一 头接地形成回路。
(课件)双线桥和单线桥-课件培训 资料
目录
• 双线桥 • 单线桥 • 比较双线桥和单线桥 • 电路分析方法
01
双线桥
双线桥的原理和作用
原理
双线桥是利用电子的跃迁来工作的。当电子从高能级向低能 级跃迁时,会释放出能量,这些能量以光子的形式被释放出 来。通过调整能量,可以激发电子从低能级向高能级跃迁, 从而实现信息的传输。
了解非线性元件的特性,采用等效电路法进 行分析。
电路分析的实际应用案例
1 2
直流电路分析
对简单的直流电路进行分析,如手电筒电路、 电池组电路等。
交流电路分析
对常见的交流电路进行分析,如日光灯电路、 变压器电路等。
3
复杂电路分析
对复杂的电路进行分析,如音频放大器电路、 数字电路等。
THANKS
双线桥和单线桥

+5
-1
失 升 氧
0
得 降 还
练习:
1、Cl2 + 2 NaOH = NaCl + NaClO + H2O
2、3Cu +8 HNO3(稀)=3Cu(NO3)2 + 2 NO↑ + 4 H2O
3、2KMnO4==K2MnO4 +MnO2 +O2↑
6、氧化还原反应的表示方法:
(2)单线桥法:表示的是电子转移的情况, 反映了化学反应的本质。 • 步骤:①标出有化合价变化的元素的化合价; • ②箭头从反应物中失电子的元素指向 • 得电子的元素。 • ③在桥线上注明电子转移的数目。 • 注意:只写数目,不标“得”或“失”。
3CO + Fe2O3
3CO2 + 2Fe
得到2×3e-
随堂练习
3Cu +8 HNO3(稀)=3Cu(NO3)2 + 2 NO↑ + 4 H2O
2H2S+Biblioteka O2=3S ↓ +2H2O
WO3+3H2=W+3H2O
• • (发生价态变化的原子个数×有价态变化元素 的一个原子转移电子数,“1”可省去);
• •
④将转移电子数标在线上, 一定要注明“得”或“失”。
氧化还原反应的表示方法
(1)、双线桥法
-
得到5 e ,化合价降低,被还原
KClO3+6HCl===KCl+3Cl2↑+3H2O
失去5 e
,化合价升高,被氧化
双线桥法
失去1×2e-
单线桥法
2e- 点燃
Cu + Cl2
点燃
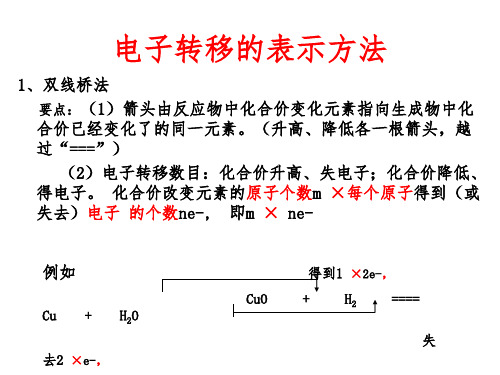
电子转移的表示方法

2、单线桥法
要点:(1)线桥从反应物中化合价升高的元素出发,指向
反应物中化合价降低的元素,箭头对准氧化剂中化合价降低的 元素,箭头不过“=”
(2)在线桥上标明转移电子总数,不写得到或失去。
例如
12e-
4NH3 + 6NO ==== 5N2 + 6H2O
注意:电子转移总数指反应中还原剂失去电子总数或氧 化剂得到电子总数,并非加和。
3Cu + 8HNO3===3Cu(N O3)2 + 2NO↑ + 4H2O MnO2 + 4HCl(浓)===MnCl2+ Cl2↑ + 2H2O 2KMnO4 + 16HCl === 2KCl + 2MnCl2 +5Cl2 ↑ + 8H2O
2020/4/1
电子转移的表示方法
1、双线桥法 要点:(1)箭头由反应物中化合价变化元素指向生成物中化合 价已经变化了的同一元素。(升高、降低各一根箭头,越过 “===”) (2)电子转移数目:化合价升高、失电子;化合价降低、 得电子。 化合价改变元素的原子个数m ×每个原子得到(或 失去)电子 的个数ne-, 即m × ne-
2020/4/1
课堂练习
用单线桥表示不同种元素的电子转移
6e-
0
0
+3 -1
2 Fe + 3 Cl2 = 2 FeCl3
不标得与失。 箭号起点为失电子元素, 终点为得电子元素。
课堂练习 用单线桥表示不同种元素的电子转移
12e-
+5 -2
-1
0
2 KClO3 = 2 KCl +3 O2
箭号起点为失电子元素, 终点为得电子元素。
双线桥和单线桥

用单线桥分析氧化还原反应 2e-
2Fe3++2I- = 2Fe2+ + I2
Fe3+ 氧化剂___________ I2 氧化产物__________
+3
-1
+2
0
I- 还原剂___________ Fe2+ 还原产物_________
2e转移的电子数____________
用双线桥和单线桥表示下列氧化 还原反应电子转移情况。
2.箭头总是从反应物指向生成物;
用双线桥分析氧化还原反应
化合价升高,失5e-,被氧化 0 +5 -1 3Cl2 + 6KOH = KClO3 + 5KCl + 3H2O 化合价降低,得5×e-,被还原
Cl2 氧化剂___________ Cl2 还原剂___________ 还原产物_________ KCl
写出C, F, Mg 原子结构示意图
氧化还原反应的表示方法: 双线桥
用于表示反应中元素化合价变化情况的双箭头
化合价升高,失4e-,被氧化
2CuO + C == 2Cu + CO2
化合价降低,得2×2e-,被还原
+2
0高温
0
+4
1.标出变化了的元素化合价; 书写步骤: 3.箭头指向同种元素; 4.升价在上,降价在下。
KClO3 氧化产物__________
5e- 转移的电子数____________
(2)单线桥法
2Hale Waihona Puke +200+1
CuO+H2==Cu+H2O
双线桥与单线桥的方法归纳

双线桥与单线桥的方法归纳在交通工程中,桥梁是连接两个相对岸边的重要构筑物,为了满足交通需求,人们采用不同的桥梁设计和建设方案。
其中,双线桥和单线桥是常见的两种类型。
本文将对双线桥和单线桥的方法进行归纳总结,以便更好地了解和应用这两种桥梁设计。
一、双线桥的方法归纳双线桥是指在桥梁上设置两条行车线,分别供来往车辆通行。
为了提高桥梁的通行能力和安全性,设计师采用了一系列的方法。
1. 桥梁结构设计:双线桥的结构设计非常重要,需要考虑桥梁跨度、桥墩的布置、梁体材料等因素。
常见的结构形式包括梁式桥、拱桥、斜拉桥等,每种结构都有其适用的场景。
2. 车道划分与交通规划:在双线桥上,合理的车道划分和交通规划是必不可少的。
通过科学的交通规划,可以分流车流量,提高通行效率,并确保交通安全。
例如,可以划分左右两侧车道,设置交通信号灯和标线,保证车辆安全有序地通行。
3. 考虑行人和非机动车通行:在设计双线桥时,也要考虑到行人和非机动车的通行需求。
可以在桥梁两侧设置人行道或非机动车道,提供安全便捷的通行条件。
4. 引入智能交通系统:随着科技的发展,智能交通系统在双线桥的应用越来越广泛。
例如,可使用智能交通信号灯、远程监控和道路导航系统等,提高交通管理的效率和安全性。
二、单线桥的方法归纳单线桥是指在桥梁上只设置一条行车线,车辆通过时需要交替通行。
在设计和使用单线桥时,需要采取一些方法来保证交通的流畅和安全。
1. 设定优先通行规则:为了保证车辆在单线桥上有序通行,可以制定优先通行规则。
例如,可以规定交替通行的车辆交替让行,或者设立交通信号灯和指示标志来指导交通。
2. 信号控制和监测系统:在单线桥上,可以设置交通信号控制系统来调节车辆的通行。
利用传感器和监测设备,及时了解桥上车辆的情况,可以更好地控制交通流量,保证交通的顺畅和安全。
3. 合理的通行流程和时间:在单线桥上,合理的通行流程和时间安排是至关重要的。
可以根据交通量的变化,灵活调整通行的时间,避免交通拥堵和事故的发生。
(课件)双线桥和单线桥-课件培训资料

制作步骤
确定桥宽、跨度和材料规格,根据地形和承载能力设 计桥面结构。
按照设计要求架设钢丝绳,调整桥面高度和张力,安 装护栏和警示标志。
选定合适的支撑点位置,建立支撑塔架,安装固定锚 锭。
进行承载试验,确保桥面承载能力符合要求,完成架 设。
03
单线桥
定义
单线桥是一种常见的桥梁结构,其特点是采用单根承重梁支撑桥面,车辆和行人 可以在同一桥面上通行。
02
双线桥
定义
双线桥是一种架桥方式,适用于跨度较大、水流较急的河道 或峡谷。
它利用两个钢丝绳和多个支撑点组成桥面,供行人或车辆通 行。
原理
双线桥采用悬索桥的原理,通过两端的支撑塔架和钢丝绳 承受桥面重力,实现桥面平整、安全的通行。
桥面两侧的钢丝绳通过固定在两岸的锚锭固定,使桥面得 以保持稳定。
(课件)双线桥和单线桥-课 件培训资料
xx年xx月xx日
目录
• 概述 • 双线桥 • 单线桥 • 比较双线桥与单线桥 • 应用实例
01
概述
简介
• 双线桥和单线桥是电力系统中常见的两种输电线路结构,主要用于输送电能。双线桥通常指双回路输电线路,具有较高 的可靠性,而单线桥则指单回路输电线路,具有简单经济的优点。
01
按照图纸要求进行钢筋骨架的加工和焊接, 确保承重梁的质量和稳定性。
03
铺设桥面并完成桥面排水设施的建设,确保 桥梁的使用寿命和安全性。
05
பைடு நூலகம்
02
进行现场勘测和测量,确定桥墩和桥面位置 ,并按照图纸进行挖掘作业。
04
安装承重梁并进行固定,确保其位置和高度 符合设计要求。
06
进行验收并交付使用,确保桥梁符合相关标 准和规范。
2-3-3《单线桥法双线桥法表示电子转移》

反映氧化还原反应中电子转移情况有两种表示法:单线桥和双线桥。
(1) 单线桥(也叫单箭号)意义:表示电子转移的方向和总数(或:表示不同元素原子或离子间电子得失情况)。
它体现了“谁给谁”。
表示法:箭号一定在等式左边,箭头上只标明电子转移总数。
如:该表示法的特点是:箭头指向的物质为氧化剂。
(对于自身氧化还原反应,则箭头指向的元素起氧化作用)(2) 双线桥(也叫双箭号)意义:表示同一元素原子或离子间电子得失情况(或:表示电子得与失及氧化、还原过程)。
它体现了“谁变谁”。
表示法:箭号一定横跨等式两边,且不少于两根箭号。
在箭号上要标上“得到”或“失去”,也可以用“+”或“-”来表示,然后写出具体的电子数目。
对于分子内的氧化还原反应,特别是歧化反应,使用单线桥不方便,用双线桥好。
双线桥易画,但麻烦;单线桥简单,能看出氧化剂。
双线桥可用在氧化还原反应方程式配平上。
在考试评分中,回答表示氧化还原反应的电子转移方向和数目(或总数)时,使用任一种表示法都算正确。
其实,单线桥和双线桥并不以线桥的多少来划分,有两根或三根线桥的不一定是单线桥,但双线桥却不可能只有一根线桥。
因此,要判断是哪种线桥,关键是看线桥是在等式的左边,还是横跨了等式的两边。
如:双线桥单线桥双线桥单线桥两种表示法也有多种形式,如硫铁矿燃烧的氧化还原反应方程式:以上分析可以看出,双线桥是分析法,可理解为是微观的;单线桥是综合法,可理解为宏观的。
要注意,以下容易标错的氧化还原反应方程式。
如铝与NaOH溶液反应,把NaOH当成氧化剂,且标示如下是错的:因为该化学方程式是总反应方程式,反应过程是铝先与水反应生成氢氧化铝和氢气,然后氢氧化铝和碱反应生成偏铝酸钠和水,前者是置换反应,水是氧化剂;后者是复分解反应,NaOH作为碱与酸反应,并不是氧化剂。
正确的应是如下表示法:又如浓硫酸与硫化氢反应,如下表示是错的:因为氧化还原反应是逐步氧化和逐步还原的,即-2价的S首先变成0价的S,再氧化才升高到+4价的S,直到氧化为+6价的S;同理,+6价的S首先被还原,变成+4价的S,再还原降到0价的S,直至还原到-2价的S。
《双线桥法和单线桥法》PPT课件

高效课堂
重新设置学习目标:
1、学会计算氧化还原反应中的电子得失; 2、会使用双线桥法和单线桥法; 2、巩固四组基本概念:氧化剂和还原剂;氧化 产物和还原产物;氧化反应和还原反应;被氧 化和被还原。
宜川中学
高效课堂
回忆旧知 导入新课
1、氧化还原反应的实质是什么?
2、指出下面反应的氧化剂、还原剂、被氧化物质 、被还原物质、氧化产物、还原产物、氧化反应、 还原反应
2Fe + 3Cl2 === 2FeCl3
2KMnO4 === K2MnO4 + MnO2 + O2↑ 2H2S + SO2 === 3S ↓ + 2H2O
要求:先独立思考,在练习本上完成,然后小组讨论 ,形成一致答案,板书展ห้องสมุดไป่ตู้。
课堂检测一
用双线桥法表示下面反应,并指出 氧化剂、还原剂、 氧化产物、还原产物。
Zn + 2HCl = ZnCl2 + H2
要求:独立思考 随机抽查
合作探究一 双线桥法(10分钟)
内容:通过对导学二中双线桥法的研究,总结双线桥法的使用
步骤和注意事项(口头展示),并用双线桥法表示下列反应 (并指出氧化剂、还原剂、氧化产物、还原产物):
Zn + CuSO4 === Cu + ZnSO4
(希望本课件对您有所帮助)
MnO2 + 4HCl(浓)==∆= MnCl2 + Cl2 + 2H2O
宜川中学
高效课堂
合作探究一 单线桥法(5分钟)
内容:通过对导学二中单线桥法的研究,总结单线桥法的使用
步骤和注意事项(口头展示),并用单线桥法表示下列反应 (并指出氧化剂、还原剂、氧化产物、还原产物):
电子转移的表示方法
2、单线桥法
要点:(1)线桥从反应物中化合价升高的元素出发,指
向反应物中化合价降低的元素,箭头对准氧化剂中化合价降低 的元素,箭头不过“=”
(2)在线桥上标明转移电子总数,不写得到或失去。
12e-
例如
4NH3 + 6NO ==== 5N2 + 6H2O
注意:电子转移总数指反应中还原剂失去电子总数或氧 化剂得到电子总数,并非加和。
得到电子2e-,
还原剂 氧化剂 还原产物 氧化产物
随堂检测
• 下列化学方程式中电子转移不正确的是 ()
随堂检测
• 用双线桥标出电子得失,指出氧化剂、还 原剂;哪种物质被氧化,哪种物质被还原? ①2Na+Cl2=2NaCl ②MnO2+4HCl=MnCl2+Cl2↑+2H2O ③Cl2+H2O=HCl+HClO ④2H2S+SO2=3S↓+2H2O
课堂练习
用单线桥表示不同种元素的电子转移
6e-
0
0
+3 -1
2 Fe + 3 Cl2 = 2 FeCl3
不标得与失。
素,
箭号起点为失电子元
终点为得电子元素。
课堂练习
用单线桥表示不同种元素的电子转移
12e-
2
+5 -2
KClO3
=
2
-1
KCl
+3 0O2
素,
箭号起点为失电子元
终点为得电子元素。 不标得与失。
随堂检测
用单线桥标出电子转移,指出氧化剂、还原剂; ቤተ መጻሕፍቲ ባይዱ种物质被氧化,哪种物质被还原?
① H2O+C=CO+H2 ② Zn+2HCl = ZnCl2+H2 ③ Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O ④Cl2+2NaOH=NaCl+NaClO+H2O
优质课件人教版高一化学必修一氧化还原反应第二课时单线桥双线桥讲解

+2 0 高温 0 +4 2CuO + C ==== 2Cu + CO2
用双线桥法标出下列反应电子转移的方向和数目:
(1) Mg+H2SO4 ===MgSO4+H2↑
(2)
高温 Fe2O3+3CO===2Fe+3CO2
(3)Cl2+2NaOH===NaCl+NaClO+H2O
0 +1
+2
0
Mg + H2SO4 === MgSO4+H2↑
失去1×e-,化合价升高,被氧化
2、单线桥法
4e+2 0 高温 0 +4 2CuO + C ==== 2Cu + CO2
用单线桥法标出下列反应电子转移的方向和数目:
(1) Mg+H2SO4 ===MgSO4+H2↑
(2)
高温 Fe2O3+3CO===2Fe+3CO2
(3)Cl2+2NaOH===NaCl+NaClO+H2O-20S
S
+4 +6
S
S
-2 +6 0 +4
如:H2S+H2SO4=S+SO2+2H2O 价态靠近
0 +6
+4
S+2H2SO4(浓)=3SO2↑+2H2O
价态归中
失6 ×e-
+5
-1
-1 0
(A) KClO3+6HCl====KCl+3Cl2 +3H2O
得1 ×6e-
√ 失5 ×e-
不交叉
+5
-1
电子转移的表示方法完整版本

2KMnO4 + 16HCl === 2KCl + 2MnCl2 +5Cl2 ↑ + 8H2O
此课件下载可自行编辑修改,供参考! 部分内容来源于网络,如有侵权请与我联系删除!
失 2e-x2x3
+5 -2
-1
0
2KClO3 = 2KCl + 3 O2
双箭号从反应物指向生成物 且起止为同一元素。
得 6e-x2
注明得与失。
分析氧化还原反应中化合价变化的关系,标出电子 转移方向和数目,并指出氧化剂和还原剂;氧化产物 以及还原产物并指出反应类型。
失去e-×2
--1
+4
+2
0
4HCl(浓)+MnO2===MnCl2 + Cl2↑+ 2H2O
不标得与失。
随堂检测
用单线桥标出电子转移,指出氧化剂、还原剂; 哪种物质被氧化,哪种物质被还原?
① H2O+C=CO+H2 ② Zn+2HCl = ZnCl2+H2 ③ Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+
2H2O ④Cl2+2NaOH=NaCl+NaClO+H2O
3Cu + 8HNO3===3Cu(N O3)2 + 2NO↑ + 4H2O
电子转移的表示方法
1、双线桥法 要点:(1)箭头由反应物中化合价变化元素指向生成物中化合 价已经变化了的同一元素。(升高、降低各一根箭头,越过 “===”) (2)电子转移数目:化合价升高、失电子;化合价降低、 得电子。 化合价改变数ne-, 即m × ne-
【知识解析】氧化还原反应中电子转移的表示方法

氧化还原反应中电子转移的表示方法1 双线桥法表明反应前后同一元素原子或离子间的电子转移情况。
(1)双线桥法的基本步骤(2)一般模型如:2 单线桥法表明反应前后元素原子间的电子转移情况。
(1)单线桥法的基本步骤(2)一般模型如:辨析比较双线桥法与单线桥法的比较1.双线桥法的“线桥”从反应物到产物,单线桥法的“线桥”只连反应物。
2.表示氧化还原反应中电子转移、化合价升降、物质被氧化或被还原等关系时,用双线桥法较方便;表示电子转移的方向和数目时,用单线桥法较方便。
典例详析例3-16(四川成都七中期中)下列氧化还原反应方程式中所标电子转移方向与数目错误的是()A.B.C.D.解析◆A反应中,铁元素的化合价升高(0→+2),失去2e-;氢元素的化合价降低(+1→0),得到2×e-,电子转移方向和数目均符合反应事实,A项正确。
B反应中,氮元素的化合价升高(+2→+5),失去4×3e-;氧元素的化合价降低(0→-2),得到6×2e-,电子转移方向和数目均符合反应事实,B项正确。
C反应中,氯元素的化合价由Cl2中的0价变为反应后Ca(ClO)2中的+1价,化合价升高,失去2×e-;氯元素的化合价由Cl2中的0价变为反应后CaCl2中的-1价,化合价降低,得到2×e-,电子转移方向和数目均符合反应事实,C项正确。
D反应中,氯元素的化合价由HCl中的-1价变为反应后Cl2中的0价,化合价升高,失去5×e-;氯元素的化合价由KClO3中的+5价变为反应后Cl2中的0价,化合价降低,得到5e-,题目中电子转移数目不符合反应事实,D项错误。
答案◆D例3-17(河南中原名校期中联考)工业上常用氨气为原料制备硝酸,其中有一步非常重要的反应为4NH3+5O24NO+6H2O,该反应的氧化剂为________,还原剂为________。
用单线桥法表示该氧化还原反应中电子转移的方向和数目:________________。
知识点1:双线桥和单线桥2014121资料

4e-
还原剂 氧化剂
6e-
还原剂 氧化剂
知识点1:氧化还原反应中的电子 转移的方向和数目的表示方法:
一、双线桥法
1、在反应物中变价原子到生成物同 种原子之间画一条桥线,箭头指向产 物中的同种原子;
2、箭头表示原子的去向;不表示电 子转移的方向;
3、用汉字、双线桥法
• 4、用变价原子个数乘以单个原子得失的电
子数;
失 2×e-
• (1)
H0 2+C+2uO=+H1 2O+C0 u~转移2e-
得1×2e失 4×5e-
(2)
0
0
4P + 5O2=
+5 -2
2P2O5 ~
转移20e-
得10×2e-
• 二、单线桥法
• 1、在反应物原子之间,从失去电子的原子 出发到得到电子的原子画出一条桥线,箭 头指向得到电子的原子,箭头就表示电子 转移的方向。
2e-
• (1) H2+CuO=H2O+Cu~转移2e-
20e-
(2)
0
0
+5 -2
4P + 5O2= 2P2O5
~
转移20e-
练习1:
2、用单线桥法标出电子转移方向和数 目,并指出氧化剂和还原剂
4e-
2e-
2e-
还原剂 氧化剂
e-
还原剂
氧化剂 4e-
还原剂 氧化剂
2e-
还原剂 氧化剂
氧化还原反应 双线桥、单线桥 课件【新教材】人教版高中化学必修一

系数)
NaNO2在此反应中为?氧化产物和还原产物的物质的量之比? 氧化产物是由什么物质而来?还原产物呢?
失去2×2e-
(1)2H2S + SO2 = 3S + 2H2O
得到1×4e得到1×5e-
(2)KClO3 + 5KCl +3H2SO4= 3K2SO4 + 3Cl2↑+ 3H2O
失去5×e-
氧化还原反应的一些规律
0 +1
+3
0
例如:2Al+3H2SO4=Al2(SO4)3 +3H2↑
步骤: 1.正确判断各反应物、生成物各元素的化合价及其变化。
◆◆◆ §2-1-3.氧化还原反应◆◆◆
一、氧化还原反应得失电子的表示方法——双线桥法
步骤:
0 +1
+3
0
例如:2Al+3H2SO4=Al2(SO4)3 +3H2↑
2.两个线桥一个在上、一个在下,线桥的方向是从反应物一 方指向生成物一方,首尾都必须对应与发生化合价发生变化 的同种元素。
3Cl2 + 6KOH == 5KCl + KClO3 + 3H2O
得到5×e-
Cl2在此反应中起到什么作用?氧化剂和还原剂的物质的量之比为?
失去1×e-
(1) Cl2 + H2O ⇌ HCl + HClO
得到1×e-
失去1×4e-
(2) 3S + 6KOH = 2K2S + K2SO3 + 3H2O
注得失——标出得失电子的总数目 注意事项: Ⅰ.单线桥表示反应物中变价元素原子得失电子的情况; Ⅱ.不需标明“得”或“失”,只标明电子转移数目; Ⅲ.箭头标明电子转移的方向;
《化学》必修1讲练测第20课时单线桥、双线桥法表示氧化还原反应

第20课时单线桥、双线桥法表示氧化还原反应●目标导航学习内容:氧化还原反应的表示方法学习重点:氧化还原反应的表示方法:双线桥法和单线桥法。
学习难点:电子转移数目的计算。
学习方法:讨论法、分析法、练习法●名师引领一. 氧化还原反应的表示方法(1)双线桥法:此法不仅能表示出电子转移的方向和总数,还能表示出元素化合价升降和氧化、还原的关系。
双线桥的箭头始于反应物有关元素的原子或离子,箭头指向发生化合价变化后生成物中对应元素的原子或离子。
在线上要标明“失去”或“得到”电子总数,化合价的升降以及该元素“被氧化”或“被还原”。
双线桥法的表示方法。
MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O(2)单线桥法:在氧化剂和还原剂之间表示电子转移关系。
在线上标出电子转移总数,箭头指出转移的方向。
电子转移的表示方法MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O注意两类特殊的化学反应。
①歧化反应,同种元素同价态在反应中部分原子化合价升高,部分原子化合价降低。
例:3Cl2+6KOHKClO3+5KCl+3H2O②归中反应。
不同价态的同种元素的原子在反应中趋于中间价态,解此类题最好将该元素的不同价态用数轴标出,变化的区域只靠拢,不重叠。
二.四种基本反应类型与氧化还原反应的关系(1)置换反应都是氧化还原反应。
(2)复分解反应都不是氧化还原反应。
(3)化合反应与分解反应部分是氧化还原反应,其中有单质参加的化合反应与有单质生成的分解反应肯定是氧化还原反应。
对氧化还原反应经历了由得氧失氧到化合价升降,再到电子转移这样一个逐步深化的过程。
通过这部分内容的学习,我们要重点理解氧化还原反应的实质是化学反应中发生了电子的得失或偏移,要学会从有无化合价升降的变化来判断一个反应是否是氧化还原反应,并能用单线桥或双线桥表示电子转移的方向和数目。
师生互动共解难题1.下列类型的反应,一定发生电子转移的是A.化合反应B.分解反应C.置换反应D.复分解反应答案:C[解析]:置换反应中肯定有单质参加,一定属于氧化还原反应,即一定有电子转移,C项正确。
氧化还原反应专题——单双线桥-高一化学课件

+4 -2
8SO2
得到6×2e得到16×2e-
40e4e-
4FeS2 + 11O2
CHEMISTRY
感谢聆听!
失去2×e0 0 点燃 +1 -1
2Na + Cl2 ==== 2NaCl
得到2×e-
四查 检查得失电子数是否相等。
表示方法——单线桥
点燃
2Na + Cl2 ==== 2NaCl
一标 标出反应前后变价元素的化合价。
二画
画出一个桥,从失电子的元素指向得电 子的元素,只针对反应物。
三写
在桥的外侧写ne-,n代表得到/失去 电子总数。
四查 进一步计算检查。
基本步骤
2e0 0 点燃 +1 -1
2Na + Cl2 ==== 2NaCl
表示方法——单线桥&双线桥
失去4e-
①
+2
2CuO
+
0
C
△
===
0
2Cu
+
+4
CO2↑
得到2×2e-
失去6×2e-
②
+5-2
2KClO3
=M△=nO=2
-1
2KCl
+
0
3O2↑
得到2×6e-
4e-
2CuO + C
CHEMISTRY
高中化学
微课堂
“ 氧化还原反应专题“
单双线桥
表示方法——双线桥
点燃
2Na + Cl2 ==== 2NaCl
基本步骤
一标 标出反应前后变价元素的化合价。
二画 三写
画出两个桥,从反应物指向生成物。桥 两端连接同种元素。
双线桥单线桥
氧化还原反应的表示法唐荣德反映氧化还原反应中电子转移情况有两种表示法:单线桥和双线桥。
(1) 单线桥(也叫单箭号)意义:表示电子转移的方向和总数(或:表示不同元素原子或离子间电子得失情况)。
它体现了“谁给谁”。
表示法:箭号一定在等式左边,箭头上只标明电子转移总数。
如:该表示法的特点是:箭头指向的物质为氧化剂。
对于自身氧化还原反应,则箭头指向的元素起氧化作用(2) 双线桥(也叫双箭号)意义:表示同一元素原子或离子间电子得失情况(或:表示电子得与失及氧化、还原过程)。
它体现了“谁变谁”。
表示法:箭号一定横跨等式两边,且不少于两根箭号。
在箭号上要标上“得到”或“失去”,也可以用“+”或“”来表示,然后写出具体的电子数目。
对于分子内的氧化还原反应,特别是歧化反应,使用单线桥不方便,用双线桥好。
双线桥易画,但麻烦;单线桥简单,能看出氧化剂。
双线桥可用在氧化还原反应方程式配平上。
在考试评分中,回答表示氧化还原反应的电子转移方向和数目或总数时,使用任一种表示法都算正确。
其实,单线桥和双线桥并不以线桥的多少来划分,有两根或三根线桥的不一定是单线桥,但双线桥却不可能只有一根线桥。
因此,要判断是哪种线桥,关键是看线桥是在等式的左边,还是横跨了等式的两边。
如:双线桥单线桥双线桥单线桥两种表示法也有多种形式,如硫铁矿燃烧的氧化还原反应方程式:以上分析可以看出,双线桥是分析法,可理解为是微观的;单线桥是综合法,可理解为宏观的。
要注意,以下容易标错的氧化还原反应方程式。
如铝与NaOH溶液反应,把NaOH当成氧化剂,且标示如下是错的:因为该化学方程式是总反应方程式,反应过程是铝先与水反应生成氢氧化铝和氢气,然后氢氧化铝和碱反应生成偏铝酸钠和水,前者是置换反应,水是氧化剂;后者是复分解反应,NaOH作为碱与酸反应,并不是氧化剂。
正确的应是如下表示法:又如浓硫酸与硫化氢反应,如下表示是错的:因为氧化还原反应是逐步氧化和逐步还原的,即2价的S首先变成0价的S,再氧化才升高到+4价的S,直到氧化为+6价的S;同理,+6价的S首先被还原,变成+4价的S,再还原降到0价的S,直至还原到2价的S。
单线桥怎么写,呵呵讲解

单线桥怎么写,呵呵讲解
(1)单线桥(也叫单箭号)
意义:表示电子转移的方向和总数(或:表示不同元素原子或离子间电子得失情况)。
它体现了“谁给谁”。
表示法:箭号一定在等式左边,箭头上只标明电子转移总数。
氧化还原反应的表示法:单线桥和双线桥解析
该表示法的特点是:箭头指向的物质为氧化剂。
(对于自身氧化还原反应,则箭头指向的元素起氧化作用)
(2)双线桥(也叫双箭号)
意义:表示同一元素原子或离子间电子得失情况(或:表示电子得与失及氧化、还原过程)。
它体现了“谁变谁”。
表示法:箭号一定横跨等式两边,且不少于两根箭号。
在箭号上要标上“得到”或“失去”,也可以用“+”或“-”来表示,然后写出具体的电子数目。
氧化还原反应的表示方法

1、氧化还原反应的表示方法(1)双线桥法双线桥法是用两条线桥来表示氧化还原反应中化合价变化或电子转移方向和数目的方法。
方法如下:双线桥的箭头始于________有关元素,箭头指向发生________变化后生成物中对应元素。
在线上要标明“失去”或“得到”电子总数,化合价的升降以及该元素“被氧化”或“被还原”。
例如:(2)单线桥法单线桥法是用一条线桥来表示氧化还原反应中电子转移的方向和数目的方法。
箭号起点为________(失电子)元素,终点为________(得电子)元素,在线上只标转移电子总数,不标得与失。
例如:2、氧化剂和还原剂(1)氧化剂和还原剂的概念①从化合价角度定义:在氧化还原反应中,所含元素的化合价降低的反应物,称为氧化剂;所含元素的化合价升高的反应物称还原剂。
②从电子转移角度定义:在氧化还原反应中,得到电子(或电子偏向)的反应物,称为氧化剂;失去电子(或电子偏离)的反应物,称为还原剂。
(2)常见的氧化剂氧化剂是在化学反应中化合价容易________(或容易________)的物质。
常见的氧化剂有:①典型的非金属单质,如:F2、O2、Cl2、Br2(非金属活动性超强其氧化性就超强)。
②有变价元素的高价态化合物或离子,如:KMnO4、浓H2SO4、HNO3、H+。
③金属阳离子,如:Fe3+、Cu2+。
(3)常见的还原剂还原剂是在化学反应中化合价容易________(或容易_________)的物质。
常见的还原剂有:①典型的金属单质,如:K、Ca、Na、Mg(金属活动性超强其还原性就超强)。
②某些非金属单质及其化合物。
如:H2、C、CO。
③有变价元素的最低价态化合物或离子,如:H2S、HI、HBr、S2-、I-、Br-。
3、氧化产物和还原产物在氧化还原反应中,氧化剂得电子具有氧化性,起氧化作用,本身被还原后的生成物叫还原产物。
还原剂失电子具有还原性,起还原作用,本身被氧化,氧化后的生成物叫氧化产物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氧化还原反应的表示法
唐荣德
反映氧化还原反应中电子转移情况有两种表示法:单线桥和双线桥。
(1) 单线桥(也叫单箭号)
意义:表示电子转移的方向和总数(或:表示不同元素原子或离子间电子得失情况)。
它体现了“谁给谁”。
表示法:箭号一定在等式左边,箭头上只标明电子转移总数。
如:
该表示法的特点是:箭头指向的物质为氧化剂。
(对于自身氧化还原反应,则箭头指向的元素起氧化作用)
(2) 双线桥(也叫双箭号)
意义:表示同一元素原子或离子间电子得失情况(或:表示电子得与失及氧化、还原过程)。
它体现了“谁变谁”。
表示法:箭号一定横跨等式两边,且不少于两根箭号。
在箭号上要标上“得到”或“失去”,也可以用“+”或“-”来表示,然后写出具体的电子数目。
对于分子内的氧化还原反应,特别是歧化反应,使用单线桥不方便,用双线桥好。
双线
桥易画,但麻烦;单线桥简单,能看出氧化剂。
双线桥可用在氧化还原反应方程式配平上。
在考试评分中,回答表示氧化还原反应的电子转移方向和数目(或总数)时,使用任一种表示法都算正确。
其实,单线桥和双线桥并不以线桥的多少来划分,有两根或三根线桥的不一定是单线桥,但双线桥却不可能只有一根线桥。
因此,要判断是哪种线桥,关键是看线桥是在等式的左边,还是横跨了等式的两边。
如:
双线桥单线桥
双线桥
单线桥
两种表示法也有多种形式,如硫铁矿燃烧的氧化还原反应方程式:
以上分析可以看出,双线桥是分析法,可理解为是微观的;单线桥是综合法,可理解为宏观的。
要注意,以下容易标错的氧化还原反应方程式。
如铝与NaOH溶液反应,把NaOH当成氧化剂,且标示如下是错的:
因为该化学方程式是总反应方程式,反应过程是铝先与水反应生成氢氧化铝和氢气,然后氢氧化铝和碱反应生成偏铝酸钠和水,前者是置换反应,水是氧化剂;后者是复分解反应,NaOH作为碱与酸反应,并不是氧化剂。
正确的应是如下表示法:
又如浓硫酸与硫化氢反应,如下表示是错的:
因为氧化还原反应是逐步氧化和逐步还原的,即-2价的S首先变成0价的S,再氧化才升高到+4价的S,直到氧化为+6价的S;同理,+6价的S首先被还原,变成+4价的S,再还原降到0价的S,直至还原到-2价的S。
故应如下表示才正确:
再如HCl和KClO3反应,如下表示也是错的:
因为氧化还原反应有条规律是:只有同一种元素发生的氧化还原反应时,该元素的化合价变化是“只相撞,不相交”。
故下列表示法才是正确的。
学生在书写这两种表示法时常出现以下的问题:
①没有箭头,或两边都打上箭头。
这是因为没有弄清楚箭头指向表示了电子转移的方向,或从元素的什么价态变成了什么价态。
②在单线桥上标“得到”或“失去”(或用“+”、“-”表示),或在双线桥上又不写出“得到”或“失去”(或用“+”、“-”表示)。
这反映了学生没有理解两种线桥的含义。
③在双线桥中,箭头和箭尾指向了不同的元素。
这也是没有理解双线桥的含义。
④涉及多个元素发生氧化还原反应时,得电子和失电子的情况没分开在上下标出,不容易看出得电子总数和失电子总数的情况,给自己造成不必要的麻烦。
以下化学方程式可作配平练习:
2Na2O2+2CO2=2Na2CO3+O2
3Fe(NO3)2+9HNO3=3Fe(NO3)3+NO+2H2O
2Mn(NO3)2+5PbO2+6HNO3=2HMnO4+5Pb(NO3)2+2H2O
2Ag3AsO4+11Zn+11H2SO4=6Ag↓+11ZnSO4+2AsH3+3H2O
8KMnO4+11NaOH+PH3=4K2MnO4+4NaMnO4+Na3PO4
K2Cr2O7+6Fe3O4+31H2SO4=Cr2(SO4)3+9Fe(SO4)3。
