western blot 相关试剂及步骤
Westernblot试剂配制及操作流程

Westernblot试剂配制及操作流程Western-Blot操作流程试剂配制1.RIPA裂解液:10mM Tris(,)1%NP40%TritonX-100%脱氧胆酸钠2 mM EDTA1 mM PMSF20%⽢油调pH值⾄。
混匀后4℃保存,长期保存于-20℃。
使⽤时,加⼊蛋⽩酶抑制剂cooktail。
制胶⽤(1-6):1.L Tris·HCl ()Tris 12.114g蒸馏⽔ 100ml溶解后,(⽤浓盐酸调pH⾄),室温下保存。
2.L Tris·HCl()Tris 18.671g蒸馏⽔ 100ml溶解后,(⽤浓盐酸调pH⾄),室温下保存。
3.10%SDSSDS 10g蒸馏⽔⾄ 100ml如溶解困难,可在50℃⽔浴下溶解,室温保存。
如在长期保存中出现沉淀,⽔浴溶化后,仍可使⽤。
4.10%过硫酸胺(AP)过硫酸胺蒸馏⽔ 1ml(现⽤现配,可先将过硫酸胺⼲粉称好分量后放在管中,⼀次性多装⼏管,使⽤时加⼊蒸馏⽔⽔即可,溶解后,4℃保存,保存时间为1周)5.四甲基⼄⼆胺原液(TEMED): 4?C保存。
6.30%丙稀酰胺: 4?C保存。
10%下层胶,即分离胶(两块胶,15ml):胶的浓度根据⾃⼰所做蛋⽩的⼤⼩确定依次加⼊去离⼦⽔30%丙烯酰胺 5ml1.5M Tris-HCl()10%SDS 150µl10%AP 150µlTEMED 6µl每加⼀种成分随即摇匀,为了加快凝胶,可以将过硫酸胺和TEMED量加⼤,根据实验当时的温度适当调整,加⼊TEMED混匀后应即刻灌胶。
灌胶后加异丙醇(1ml)消泡5%上层胶(两块胶,6ml):依次加⼊去离⼦⽔30%丙烯酰胺 1ml1M Tris-HCl()10%SDS 60µl10%AP 60µlTEMED 6µl每加⼀种成分随即摇匀,为了加快凝胶,可以将过硫酸胺和TEMED量加⼤,根据实验当时的温度适当调整,加⼊TEMED混匀后应即刻灌胶。
Western blot 试剂与操作步骤

[主要试剂]1、SDS-PAGE 试剂:2、匀浆缓冲液:1.0M Tris-HCl(pH 6.8)1.Oml;10%SDS 6.0ml;β-巯基乙醇0.2ml;ddH2O2.8ml。
3、转膜缓冲液:甘氨酸2.9g;Tris 5.8g;SDS 0.37g;甲醇200ml;加ddH2O 定容至1000ml。
4、0.01M PBS(pH7.4):NaCl 8.0g;KCl 0.2g;Na2HPO4 1.44g;KH2PO4 0.24g;加ddH2O 至1000ml。
5、膜染色液:考马斯亮兰0.2g;甲醇80ml;乙酸2ml;ddH2O118 ml。
包被液(5%脱脂奶粉,现配):脱脂奶粉1.0g 溶于20ml 的0.01M PBS 中。
6、显色液:DAB 6.0mg;0.01M PBS 10.0ml;硫酸镍胺0.1ml;H202 1.0μl。
7、兔抗猪R 蛋白抗体、HRP 标记羊抗兔IgG(二抗)。
[操作步骤]1、蛋白质样品获得:细菌诱导表达后,可通过电泳上样缓冲液直接裂解细胞,真核细胞加匀浆缓冲液,机械或超声波室温匀浆0.5-1min。
然后4℃,13,000g 离心15min。
取上清液作为样品。
2、电泳:制备电泳凝胶,进行SDS-PAGE。
3、转移(半干式转移):(1)电泳结束后将胶条割至合适大小,用转膜缓冲液平衡,5min×3 次。
(2)膜处理:预先裁好与胶条同样大小的滤纸和NC 膜,浸入转膜缓冲液中10min。
(3)转膜:转膜装置从下至上依次按阳极碳板、24 层滤纸、NC 膜、凝胶、24 层滤纸、阴极碳板的顺序放好,滤纸、凝胶、NC 膜精确对齐,每一步去除气泡,上压500g 重物,将碳板上多余的液体吸干。
接通电源,恒流1mA/cm2,转移1.5hr。
转移结束后,断开电源将膜取出,割取待测膜条做免疫印迹。
将有蛋白标准的条带染色,放入膜染色液中50s 后,在50%甲醇中多次脱色,至背景清晰,然后用双蒸水洗,风干夹于两层滤纸中保存,留与显色结果作对比。
Western-blot实验操作步骤

Western-blot实验操作步骤Western blot实验步骤一、制备蛋白样品(单层贴壁细胞总蛋白提取)1.倒掉细胞培养液,加3ml预冷的PBS洗涤细胞,重复两次,弃掉PBS 后将细胞培养瓶置于冰上。
2.裂解液RIPA(强)1ml +PMSF10ul(100:1),两者混匀后加入培养瓶中裂解细胞,冰上裂解30min,为使细胞充分裂解,培养瓶要经常来回摇动。
3.裂解完后,用细胞刮将细胞刮于一侧(动作要快),转移至ep管中.4.4度,12000rpm,离心5min.离心后取上清至新的ep管中,用于后续实验(-80保存)常用蛋白收样:倒掉细胞培养基后,预冷PBS洗涤细胞2次,弃去,再加入1ml PBS,用细胞刮轻轻刮取细胞,转移至1.5ml ep管中,12000rpm,离心5min,尽量吸净上清,沉淀于-80保存,用于后续实验。
融化蛋白样品,加入RIPA+PMSF细胞裂解液(200ul/ep管),充分混匀,冰上裂解20min,4度离心,5min ,12000rpm,小心吸取上清至新的ep管中。
二、蛋白浓度测定(BCA法)BCA(碧云天)蛋白浓度测定试剂盒灵敏度高,检测浓度下限达到25ug/ml,最小检测蛋白量达到0.5ug,待测样品体积为1-20ul。
在50-2000ug/ml浓度范围内有较好的线性关系。
标准蛋白BSA浓度:5mg/ml (-20保存) ,完全溶解蛋白标准品,取10ul 稀释至100ul,使终浓度为0.5mg/ml(ug/ul)。
蛋白样品在什么溶液中,标准品也宜用什么溶液稀释。
但为了简便起见,也可以用0.9%NaCl 或PBS稀释标准品。
1.配置BCA工作液A液: B液= 50 : 1 ,混匀 A液+B液=200ul (每个样本) 样本数量: 7个标准品 + N 个待测蛋白样本2.先将每孔加入200ul BCA工作液,再加入蛋白样本。
(96孔板),总体积为10ul.待测蛋白样本先10倍稀释。
western-blot常用试剂及步骤

Western印迹法这种技术是把电泳分离的组分从凝胶转移到一种固相支持体,并以针对特定氨基酸序列的特异性试剂作为探针检测之。
Western使用的探针是抗体,它与附着于固相支持体的靶蛋白所呈现的抗原表位发生特异性反应。
这种技术的作用是对非放射性标记蛋白组成的复杂混合物中的某些特异蛋白进行鉴别和鉴定。
仪器:高压锅、玻璃匀浆器、高速离心机、分光光度仪、—20℃低温冰箱、垂直板电泳转移装置、恒温水浴摇床、多用脱色摇床。
试剂:单去污剂裂解液、0.01mol/L PBS (pH7.3)、10%分离胶、4%浓缩校、G250考马斯亮蓝溶液、0.15mol/L NaCl 溶液、2X(5X)SDS上样缓冲液、电泳缓冲液、转移缓冲液、10X丽春红染液、封闭液、TBST、TBS、洗脱抗体缓冲液、显影液、定影液、抗体、化学发光试剂。
杂品与耗材:各种规格的吸头、离心管和加样器;各种规格的烧杯、量筒和平皿等玻璃器材;硝酸纤维素膜,乳胶手套,保鲜膜,搪瓷盘(>20×20cm),X-光片夹,X-光片,玻棒长短各一根,计时器,吸水纸,试剂配制:(一)母液1.0mol/L Tris·HClTris (MW121.14) 30.29g蒸馏水200ml溶解后,用浓盐酸调pH至所需点(见下所示),最后用蒸馏水定容至250ml,高温灭菌后室温下保存。
PH HCl7.4 约17ml7.5 约16m7.6 约15ml8.0约10ml1.74mg/ml (10mmol/L)PMSFPMSF 0.174g异丙醇100ml溶解后,分装于1.5ml离心管中,-20℃保存。
0.2mol/L NaH2PO4NaH2PO4(MW119.98)12g蒸馏水至500ml溶解后,高压灭菌,室温保存。
0.2mol/LNa2HPO4Na2HPO4·12H2O(MW 358.14)71.6g蒸馏水至1000ml溶解后,高压灭菌,室温保存。
WesternBlot相关试剂配方及详细实验步骤

WesternBlot相关试剂配方及详细实验步骤Western Blot详细实验步骤及试剂配方1. 溶液配置1.1 5×SDS-PAGE上样缓冲液(Loading buffer)药品用量1 M Tris-HCl (PH=6.8) 1.25 mLSDS 0.5 gBPB(溴酚蓝,有毒)25 mg甘油 2.5 mL去离子水up to 5 mL分装至1.5 mL离心管中,每管500 μL,室温保存,使用前每管加入25 μL的β-巯基乙醇。
1.2 10×SDS-PAGE电泳缓冲液(Running buffer 母液)药品用量Tris 30.3 gGlycine (甘氨酸) 144.2 gSDS 10 gddH2O up to 1 L室温保存即可,使用时稀释为1×的工作液,可回收反复使用4~5次。
1.3 Tris-HCl缓冲液(1)1.5 M Tris-HCl (PH=8.8)→制分离胶Tris (MW: 121.14) 45.43 gH2O up to 250 mL浓盐酸调PH 8.8(2)1.0 M Tris-HCl (PH=6.8)→制浓缩胶Tris (MW: 121.14) 30.29 gH2O up to 250 mL浓盐酸调PH 6.8二者高压灭菌后,置于室温保存即可。
1.4 10% SDS (十二烷基硫酸钠)SDS 10 gddH2O up to 100 mL室温保存即可。
1.5 10% AP (过硫酸铵)→1.5 mL 离心管配制过硫酸铵(刺激性,腐蚀性) 0.1 g超纯水up to 1 mL混匀后,锡箔纸包住,避光处理,置于-20℃保存。
1.6 30% 丙烯酰胺溶液丙烯酰胺 150 g甲叉双丙烯酰胺 4 gMilli-Q水 30 mL滤纸过滤,Milli-Q水定容至500 mL,装入棕色瓶子中,4℃保存。
1.7 10×转膜缓冲液(Trans buffer 母液)Tris (MW: 121.14) 30.3 gGlycine (甘氨酸) 144 g去离子水 up to 1 L室温保存即可,其1×的工作液配制为:100 mL母液+200 mL甲醇(有毒)+700 mL水。
Westernblot试剂配制及操作流程

Westernblot试剂配制及操作流程试剂配制:1.电泳缓冲液:a. 准备1×蛋氨酸-甘氨酸缓冲液(Tris-Glycine缓冲液):每一升缓冲液中加入30.3g Tris base、288g glycine,并调节pH至8.3±0.1b. 准备3×SDS-凝胶缓冲液:每一升缓冲液中加入30g Tris base、144g glycine、10g SDS,并调节pH至8.3±0.12.蛋白提取缓冲液:a. 准备RIPA缓冲液:每一升缓冲液中加入5g Tris base、15g NaCl、5g sodium deoxycholate、1g NP-40,并将pH调节至7.4b.按需添加蛋白酶抑制剂和磷酸酶抑制剂。
操作流程:1.样品制备:a. 收集细胞或组织样品,加入适量的蛋白提取缓冲液,并使用超声波细胞破碎仪或玻璃Dounce破碎器破碎细胞,释放蛋白。
b.在4℃下离心细胞提取物,收集上清液,并在离心后尽快使用或存储在-80℃的冰箱中。
2.SDS-凝胶制备:a. 准备15%缩胆凝胶:加入7.5mL 30%丙烯酰胺、10mL 10×SDS-凝胶缓冲液、7.5mL去离子水和20uL 10%Tetramethylethylenediamine (TEMED),混合均匀。
b.将混合液倒入立方形凝胶模具中,插入两根不锈钢导电丝作为电极,并进一步注入10%胶解剂。
c.待凝胶定形后,用1×蛋氨酸-甘氨酸缓冲液冲洗凝胶表面。
3.蛋白电泳:a.加载样品:将样品加入离心管中,加入1×电泳缓冲液以使样品浓度均匀。
b. 加载样品:将样品加入凝胶孔中,通常每孔加入20-30ug样品。
c.进行电泳:将装有凝胶的电泳槽放入电泳缓冲液中,将蛋白电泳至凝胶顶部。
d.转移凝胶:根据需求选择湿式或半湿式转印方式,将蛋白转移到PVDF或NC膜上。
4.免疫印迹:a.封闭膜:将转印膜放入封闭溶液中(如5%脱脂奶粉或3%BSA)封闭非特异性结合位点。
Western blot(蛋白印迹法)详细步骤

Western blot(蛋白印迹法)详细步骤一、组织的研磨准备:研钵、研磨棒、EP管、药匙、液氮、液氮匙、自封袋、一次性手套、棉手套步骤:①用研磨棒将装有冻存组织的EP管敲碎,取出组织,在研钵中盛满液氮,用力敲碎组织,研磨。
②研磨过程中一旦液氮干了,立即加入液氮,保持研磨在液氮中进行,直至组织呈干粉状。
③用在液氮中浸泡过的药匙将研磨好的粉末盛入新的EP管中。
④装有组织粉末的EP管现在液氮中保存,待所有组织都研磨结束后装入自封袋,于-80℃保存。
注意:1.研钵使用前要用锡纸包口、研磨棒用锡纸包头,在烘箱中烘烤180℃至少3h 以上。
2.组织研磨成粉末后待液氮全部挥发后再将组织粉末装管。
3.每种样品都最好留有副管,备用。
二、裂解提蛋白准备:裂解液配制比例RIPA:PMSF=1000:10=100:1若需要加入蛋白酶抑制剂,则比例一般为1:1000(即1ml裂解液加1μl蛋白酶抑制剂)步骤:①将RIPA和PMSF按比例混匀,加入到装有组织粉末的EP管中,一般加入300~500μl左右(浓度尽量高点)。
②盖好盖子,在冰上裂解30~40min.③到时间后于4℃,12000rpm离心10min,取上清液转移到新的离心管中,于-20℃保存。
注意:1.裂解液加入后用手指弹一下混匀,当加入量很少时,成粘稠状,有必要时应用枪头混匀。
三、BCA法测定蛋白浓度(BCA试剂盒)准备:BCA试剂盒(BCA试剂A、BCA试剂B、蛋白标准液)、酶标板、酶标仪、摇床步骤:①按1:15或1:30稀释待测样品,即取1μl样品+14μl水。
③按50体积BCA试剂A加1体积BCA试剂B(50:1)根据样品数量配制BCA工作液。
④每个标准品孔加入200μl BCA工作液,样品孔加入待测样品10μl和200μlBCA工作液,充分混匀,在摇床上震荡30s,37℃放置30min,于492nm下测定OD值。
⑤标准曲线以蛋白含量(μg)为横坐标,吸光度为纵坐标,根据样品的吸光度可以在标准曲线上查得相应的蛋白含量。
western blot实验步骤

一、提取组织蛋白新鲜肺组织取20-30mg,减去气管,组织匀浆机研磨,100W超声3S,12000r/min离心37℃孵育30min,测OD562。
按所得结果定量到50微升计算上样量,将20微升上清分装到一个1.5ml的EP管,加5微升上样缓冲液,-20℃冻存。
二、煮样95℃,煮10min,待温度降到室温关闭机器,煮后的组织离心7500r/min,1min备用三、安装玻璃板,倒入电泳缓冲液,拔梳子,用进样针吸取计算的上样量上样,装好正负极,倒满电泳液,设置80V,30min跑条带,结束后100V,60min,没跑到底酌情延长时间(30min),准备转膜所需工具:1.剪好6片滤纸,转膜液湿润海绵及滤纸,赶气泡。
2.PVDF膜,准备甲醇激活膜2min,蒸馏水5min电泳时间到关闭电源,取出玻璃板,准备切胶,切好后,按形状切稍大一圈的PVDF膜,覆盖到切好的胶上,标记好上下。
安好夹子,放入电泳槽准备转膜,转膜需冰浴。
四、转膜结束后,将膜取下,TBST清洗3遍,每遍5min。
五、7%牛奶(1.75g,加TBST 25毫升),封闭2小时,慢摇。
六、封一抗内参:β-actinα-SMA:1:10000配制波形蛋白:1:5000制备杂交袋,放入膜,滴入抗体,封口,4℃过夜七、将过夜的膜放入37℃恒温箱中孵育30min,结束后回收一抗,标记好第几次用,TBST清洗膜3遍,每遍10min。
八、封二抗:羊抗兔HRP(1:5000)稀释,配制10ml,慢摇1小时后回收二抗,标记好第几次。
TBST清洗膜3遍,每遍15min。
九、1:1配制发光液(避光保存),准备眼科镊、滤纸、托盘、曝光,先曝背景再报条带,先自动后手动。
western-blot步骤

western-blot实验流程:一、裂解细胞:1、收集细胞。
1000rpm,5min.弃上清,加1ml PBS,混匀,移至EP管。
2、4℃,1000rpm,5min。
弃上清,加1ml PBS,4℃,1000rpm,5min再洗一次。
3、配制裂解液(见附录一):WB buffer 500μlNa3VO4 5μl配方一:Na4P2O7 5μlPMSF 5μlCocktail 5μl1×107/ml裂解液,冰上孵育15min(每隔3~5分钟混匀一次),13000rpm(或16000rpm),4℃,离心10min.分装上清液(裂解蛋白),-20℃保存。
(一般另取5μl,作蛋白定量用)配方二:RIPA配方三:Nuc Buster TM protein extraction Kit二、蛋白定量(BCA法,Bio-Rad):1、工作液的准备每ml A试剂中加入20ul的S试剂(此工作液在1周之内稳定,但在配制1天后会形成沉淀。
若有沉淀形成,加热并旋涡混匀使沉淀溶解,勿用Tip吸取沉淀)若样品中不含去垢剂,此步骤可省略,直接使用试剂A。
2、将蛋白标准液稀释,浓度从0.2mg/ml至1.5mg/ml。
稀释液与样品的溶解液相同。
3、待测蛋白做相应的稀释。
(一般稀释2.5或5倍)4、每孔加入5ul标准蛋白溶液和待测蛋白溶液。
5、每孔加入25ul的试剂A或试剂A’6、每孔200ul试剂B,轻轻混匀,室温放置15分钟,650-750NM检测吸光度。
三、配胶:10% (10ml,1小板) 8% (50ml,1大板) 分离胶:40% Acr-Bis 2.5ml 10. ml1.5M Tris-HCl PH8.82.5ml 12.5 mlH2O 4.8ml 26.5 ml10%SDS 100ul 500ul10% AP(H2O现配)100ul 500ulTEMED 4ul 30ul 注:大板——> 0.3cm梳子(大齿)50ml;0.5cm梳子(小孔)65ml.浓缩胶:(5ml, 1小板)40% Acr-Bis 625ul1.0M Tris-HCl PH6.8 625ulH2O 3.7ml10%SDS 50ul10%AP 50ulTEMED 5ul四、样品处理:配方一:sample buffer:0.5M Tris-HCl, PH6.8 1.0ml5×Glyceral 0.8ml(8ml)10%SDS 1.6ml二巯基乙醇0.4ml0.05%溴酚兰(用水配)0.4mlH2O 3.8ml配方二(常用):电泳样品:25μg/孔。
WB操作步骤-自己整理

Western Blot 相关实验方法与试剂(湿转法)人工肝实验室学习姚瑶(一)目的蛋白提取:(1)单层贴壁细胞总蛋白的提取:1、倒掉细胞培养液,加入Hanks液洗涤一次后倒掉,根据所用细胞决定是否用胰酶消化,加入适量(约5ml)新鲜细胞培养液后,将贴壁细胞吹起,并转移至4支离心管内,配平后,1500转离心10min。
2、倒掉上清,用4度预冷PBS溶液洗涤沉淀,1500转离心10min。
共洗三次,每次十分钟。
3、倒掉上清,吸净,每管加入50ul 细胞裂解液RIPA,吹散,加入后由于DNA的释放可迅速变粘稠,故应尽快转移至1.5ml EP 管内,-20℃裂解30min。
4、超声波细胞裂解仪上将各管裂解15s。
(可不做)5、4℃,12000转离心10min。
6、将上清转移至0.5ml EP管中,每管100ul,冰浴待用。
(2)组织中总蛋白的提取:1、取约100mg肝组织于研磨器内,加入500ul 细胞裂解液RIPA,研磨后吸出于1.5ml EP管内,再加入500ul RIPA,研磨后吸出于上EP管内。
冰上裂解30min。
2、配平后,4℃,14000转离心10min。
3、将上清分装于0.5ml EP管内,每管100ul,冰浴待用(二)蛋白含量的测定:1、稀释标准品:10ul标准品C液+90ul PBS溶液,混匀。
2、按0、1、2、4、8、12、16、20ul将稀释后的标准品加入于96孔板内,并用PBS将各孔补足20ul。
3、将第2、3排96孔板分别加入样品1ul、0.5ul,(可采用倍比稀释法),并用PBS将各孔补足20ul。
4、配制工作液:按A液:B液=50:1配制适量工作液,每孔加入200ul。
5、37℃水浴30min。
6、酶标仪测定各孔OD值(A570,Mode1)。
7、绘制标准曲线,计算样品蛋白浓度。
(三)SDS-PAGE电泳:(1)清洗玻璃板(2)灌胶与上样:1、配胶:根据目的蛋白的大小,决定分离胶的浓度。
WesternBlot(免疫印迹法)步骤

WesternBlot(免疫印迹法)步骤主要包括以下4 个基本步骤:样品制备;电泳分离;蛋白的膜转移;免疫杂交与显色――蛋白检测。
溶液和试剂1. 1X 磷酸盐缓冲液(PBS)2. ModifiedRIPAbuffer:Tris-HCl:50 mM, pH 7.4; NP-40: 1%;Na-deoxycholate: 0.25%;NaCl: 150 mM;EDTA:1 mM;PMSF: 1 mM;Aprotinin,leupeptin,pepstatin:1 microgram/ml each;Na3VO4: 1 mM;NaF: 1 mM3. 1X SDS 样品缓冲液:62.5 mMTris-HCl(pH 6.8 于25° C), 2% w/v SDS, 10%甘油,50 mMDTT, 0.01% w/v溴酚蓝4. 转移缓冲液:25 mM Trisbase, 0.2 M 甘氨酸, 20%甲醇 (pH 8.3)5. 10X Tris缓冲盐 (TBS):准备1L 10X TBS:24.2 g Trisbase, 80g NaCl;用1N HCl调pH为 7.67. 甲醇8. TBS/T缓冲液:1X TBS, 0.1% Tween-209. 封闭缓冲液(TBS/T):1X TBS,0.1% Tween-20加5% w/v脱脂奶粉或BSA10. 一抗的稀释:1X TBS,0.1% Tween-20 加 5% BSA ( 多抗) 或5%脱脂奶粉( 单抗)。
Note:一般来说,BSA被推荐用于多克隆抗体,脱脂奶粉用于单克隆抗体,这样可得到较高的信噪比。
预染的蛋白质marker,可用于监测转膜的效率。
样品制备原始样品可为细胞、组织、培养上清、免疫沉淀或亲和纯化的蛋白,以下为定性检测目的蛋白时细胞样品的处理方法,其余的样品制备方法参阅相关文献。
1.培养细胞或药物处理。
2.弃培养基,用1X PBS漂洗细胞2次,去尽残留培养基。
Westernblot实验所需试剂配制方法

Westernblot实验所需试剂配制⽅法⼀.Western blot实验所需试剂配制⽅法制胶试剂:1.30%(W/V)丙烯酰胺溶液:名称⽤量备注Acrylamide 29g1g 充分搅拌溶解N-甲叉双丙烯酰胺(N,N-methylene-bisacylamide,BIS)去离⼦⽔80ml 定容⾄100ml,0.45µm滤膜过滤除杂,置于棕⾊瓶中4℃保存,(注意:丙烯酰胺具有强烈的神经毒性,通过⽪肤吸收并具有累积性,配制时应戴⼿套操作)2.10%(W/V)过硫酸铵:名称⽤量备注过硫酸铵0.1g去离⼦⽔1ml 现配现⽤(注意:10%过硫酸铵溶液在4℃保存能使⽤两周左右,过期会失去催化效果)3. 1M Tris-HCL, pH=6.8 (36%的浓盐酸) :名称⽤量备注Tris 12.1去离⼦⽔80ml浓盐酸8.8-9ml 预实验已确定去离⼦⽔加⼊去离⼦⽔定容⾄100ml后,室温保存4. 1.5M Tris-HCL, pH=8.8 (36%的浓盐酸) :名称⽤量备注Tris 18.17去离⼦⽔80ml浓盐酸 2.8-3ml 预实验已确定去离⼦⽔加⼊去离⼦⽔定容⾄100ml后,室温保存5. 10%SDS:名称⽤量备注SDS 10g去离⼦⽔80ml 加⼊去离⼦⽔定容⾄100ml后,室温保存缓冲液配置:6. 5ⅹTris-Glycine Buffer(SDS-PAGE电泳缓冲液)名称⽤量备注pH=8.3Tris 15.1gGlycine 94.0gSDS 5.0g去离⼦⽔800ml 加⼊去离⼦⽔定容⾄1L后,室温保存7. 1ⅹ膜转移缓冲液:名称⽤量备注Glycine 2.9g 2.9gTris 5.8g 5.8gSDS 0g 0.37g甲醇⽤前加200ml甲醇⽤前加200ml甲醇去离⼦⽔定容到1000ml 定容到1000ml 室温保存8. 1ⅹ膜转移缓冲液:名称⽤量备注Glycine 2.9g 2.9gTris 5.8g 5.8gSDS 0g 0.37g甲醇⽤前加200ml甲醇⽤前加200ml甲醇去离⼦⽔定容到1000ml 定容到1000ml 室温保存9. 5×SDS-PAGE Loading Buffer:名称⽤量备注1MTris-HCL, pH=6.8 1.25ml 2.5mlSDS 0.5g 1g⽢油 2.5ml 5mlBPB(溴酚蓝)25mg 50mg超纯⽔⾄5ml 10ml 分装200ul/管50℃充分溶解,30min,离⼼取上清,0.45uM过滤2ME 10ul/200ul 使⽤前添加,添加后可室温保存⼀个⽉10. 封闭缓冲液:名称⽤量备注脱脂奶粉5gTBST 100ml 充分溶解后,4 ℃保存其它:(备⽤)11. 考马斯亮蓝R-250染⾊液:名称⽤量备注考马斯亮蓝R-250 0.1g异丙醇25ml 搅拌溶解冰醋酸10ml 搅拌均匀去离⼦⽔65ml 搅拌均匀,滤纸除去颗粒物,室温保存12. 考马斯亮蓝染⾊脱⾊液:名称⽤量备注冰醋酸100ml甲醇100ml去离⼦⽔800ml 充分混匀后使⽤13. 2%的丽春红贮备液(20mL):名称⽤量备注丽春红5g三氯⼄酸0.4g磺基⽔杨酸6g 充分溶解,定容20ml 制胶:14、分离胶的制备(pH 8.8)15、浓缩胶的制备(5%Acrylamide)。
Westernblot试剂配制及操作步骤(最新整理)

Western blot试剂配制1.30%丙稀酰胺储存液丙稀酰胺29gN,N’-亚甲双丙稀酰胺1g双蒸水定容到100ml,经高压蒸汽灭菌的滤纸过滤避光,4℃保存于棕色瓶中2.1.5 M Tris-HCl (MW=121.1)pH 8.8Tris碱90.75g双蒸水400ml用浓HCl调pH至8.8,加双蒸水定容至500ml。
4℃冰箱保存3.1.0 M Tris pH6.8Tris碱12g双蒸水60ml用浓HCl调pH至6.8,加双蒸水定容至100ml。
4℃冰箱保存4.10%SDS(w/v)SDS 10g溶于加水至100ml,室温放置5.10%过硫酸胺(10%APS)过硫酸胺1g溶于10ml双蒸水中。
可在密闭的管子里4℃保存一周6.10×Tris-甘氨酸电泳缓冲液Tris 30.3g甘氨酸144gSDS 10g定容至1000ml室温放置。
临用时稀释成1×电泳缓冲液7.1%溴酚蓝(w/v)溴酚蓝Tris-base MilliQ 水100 mg60 mg定容至10 ml8.TEMED原液,4℃冰箱保存9.2×sample buffer(2×样品缓冲液)1.0 M Tris pH6.82.5mlSDS 0.8gDTT 0.3085g甘油3ml溴酚蓝0.004g加双蒸水至10ml,分装—20℃保存10. 4×SDS加样缓冲液10ml1M Tris-HCl(ph:6.8) 2.5mlSDS 0.8g溴酚蓝0.004g甘油4mlTakara5x buffer 总5ml1M Tris-HCl(ph:6.8) 1.25mlSDS 0.5g溴酚蓝BPB 25mg甘油 2.5ml500ul每管分装,使用前将25ul的2-ME加到没管中11.转膜缓冲液Tris 碱 5.8g甘氨酸 2.9gSDS 0.37g甲醇200ml加双蒸水至1000ml,临用前配制,4℃冷却12.1×TBSTTris 碱 3.0285 g氯化钠8.766gTween-20 500ul加双蒸水至1000ml,现配现用。
westernblot操作规程-相关试剂配制
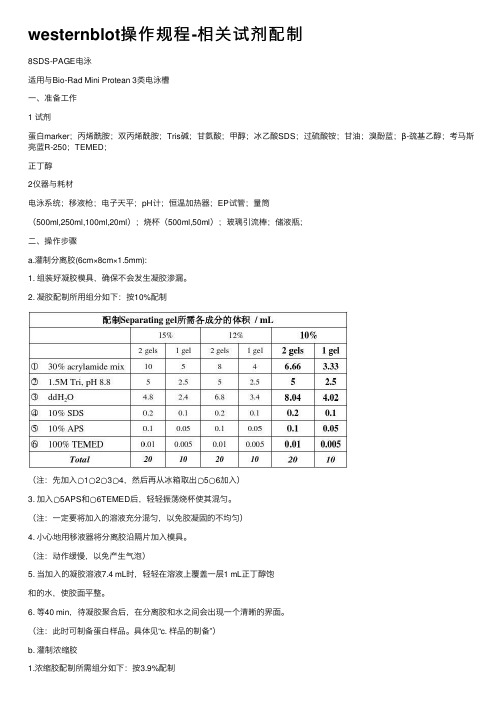
westernblot操作规程-相关试剂配制8SDS-PAGE电泳适⽤与Bio-Rad Mini Protean 3类电泳槽⼀、准备⼯作1 试剂蛋⽩marker;丙烯酰胺;双丙烯酰胺;Tris碱;⽢氨酸;甲醇;冰⼄酸SDS;过硫酸铵;⽢油;溴酚蓝;β-巯基⼄醇;考马斯亮蓝R-250;TEMED;正丁醇2仪器与耗材电泳系统;移液枪;电⼦天平;pH计;恒温加热器;EP试管;量筒(500ml,250ml,100ml,20ml);烧杯(500ml,50ml);玻璃引流棒;储液瓶;⼆、操作步骤a.灌制分离胶(6cm×8cm×1.5mm):1. 组装好凝胶模具,确保不会发⽣凝胶渗漏。
2. 凝胶配制所⽤组分如下:按10%配制(注:先加⼊○1○2○3○4,然后再从冰箱取出○5○6加⼊)3. 加⼊○5APS和○6TEMED后,轻轻振荡烧杯使其混匀。
(注:⼀定要将加⼊的溶液充分混匀,以免胶凝固的不均匀)4. ⼩⼼地⽤移液器将分离胶沿隔⽚加⼊模具。
(注:动作缓慢,以免产⽣⽓泡)5. 当加⼊的凝胶溶液7.4 mL时,轻轻在溶液上覆盖⼀层1 mL正丁醇饱和的⽔,使胶⾯平整。
6. 等40 min,待凝胶聚合后,在分离胶和⽔之间会出现⼀个清晰的界⾯。
(注:此时可制备蛋⽩样品。
具体见“c. 样品的制备”)b. 灌制浓缩胶1.浓缩胶配制所需组分如下:按3.9%配制2.倒出并⽤滤纸吸⼲覆盖在分离胶表⾯的⽔层。
(注:先加⼊○1○2○3○4,然后倒出⽔,最后再从冰箱取出○5○6加⼊)3.加⼊○5APS和○6TEMED后,轻轻振荡烧杯使其混匀。
4.⼩⼼地⽤移液器将浓缩胶沿隔⽚加⼊模具,直⾄凝胶到达模具的顶部。
5.斜着插上梳⼦。
(注:动作缓慢,尽量不要产⽣⽓泡)6.放置30 min左右,待凝胶聚合后,⼩⼼拔出梳⼦。
(注:拔出梳⼦时,要垂直拨出,以免损坏制好的泳道)7.将凝胶放⼊电泳槽中,在槽中加⼊1×电泳缓冲液。
western blot 试剂配制

1 制胶材料(试剂配制)(1)浓缩胶缓冲液:称取 6 g Tris溶于40 mL双蒸水中,用l moL /L HCI调至pH 6.8,再加水稀释到100 mL的终体积,即成pH 6.8,0.5 moL/L tris-HCL缓冲液。
过滤后于4℃保存。
(2)分离胶缓冲液:称取36.6 g的Tris和48 mL l mol/L HCL混合,加水稀释至100 mL的终体积。
即成pH 8.8,3 moL/L tris-HCL缓冲液。
过滤后于4℃保存。
(3)5*SDS-PAGE缓冲液储液:称取15.1 g Tris(0.125M),94 g甘氨酸(1.25M),10 g SDS(0.5M),用蒸馏水溶解至800 mL,加水至1L,即成0.125 moL/L Tris-1.2 5 moL/L甘氨酸-0.5M SDS电泳缓冲储液,室温保存。
临用前稀释5倍。
(4)10% SDS溶液:称取l g SDS溶于10 mL双蒸水中,即成10% SDS溶液。
(5)10% 过硫酸胺:l mL双蒸水加入0.1 g过硫酸胺,宜当天配制,最多不超过一周。
(6)TEMED原溶液。
(7)(样品缓冲液)按下方配制:①pH 6.8,0.5 moL/L Tris-HCL缓冲液液8 mL;②甘油 6.4mL;③10% SDS溶液液12.8 mL;④二疏基乙醇3.2 mL;⑤0.05% 溴酚蓝1.6mL;⑥蒸馏水32 mL,混匀备用。
(8)转膜缓冲液:3 g Tris碱、1g SDS和14.48 g甘氨酸,再加200 mL甲醇,补充蒸馏水定容至1 L。
(9)封闭缓冲液:含5%脱脂奶粉、0.025% NaN3溶于TBS-T缓冲液。
(10)5×TBS缓冲液:12.1 g Tris碱,40 g NaCL溶于双蒸水中,用浓HCL调H 值至7.6后,用双蒸水定容至1 L。
(11)TBS-T漂洗液:含0.1% Tween-20的TBS。
(12)30%丙烯酞胺溶液:称取30g丙烯酞胺,溶解于100 mL双蒸水中, 即成30%丙烯酞胺溶液。
Westernblot试剂与步骤

1.Westernblot试剂储存液2 M Tris-HCl (pH 8.8)将141.2g Tris溶于300ml去离子水,待溶解充分后用浓盐酸调pH值至pH 为8.8(25℃),加入去离子水至500ml,混匀,用0.22μm滤器过滤除菌,室温保存。
1 M Tris-HCl (pH 6.8)将70.6g Tris溶于300ml去离子水,待溶解充分后用浓盐酸调pH值至pH 为6.8(25℃),加入去离子水至500ml,混匀,用0.22μm滤器过滤除菌,室温保存。
10XPBS将80g NaCl、14.4g Na2HPO4、2g KCl、2.4g KH2PO4溶于800ml去离子水中,待充分溶解后加去离子水至1L,混匀,高压蒸汽灭菌,室温保存。
20% TritonX-100将20ml TritonX-100溶于60ml去离子水中,40℃加热溶解,待充分溶解后加去离子水至100ml,混匀,室温保存。
10% SDS将10g SDS溶于60ml去离子水中,40℃加热溶解,待溶解充分后加去离子水至100ml,混匀,室温保存。
10X电泳液将144g甘氨酸、30g Tris、10g SDS溶于600ml去离子水中,待溶解充分后加去离子水至1L,混匀,室温保存。
10X转膜液将90g甘氨酸、19.3g Tris溶于600ml去离子水中,待溶解充分后加去离子水至1L,混匀,室温保存。
工作液30%丙烯酰胺溶液(A液)将29.2g 丙烯酰胺、0.8g双丙烯酰胺溶于40ml去离子水中,待充分溶解后加去离子水至100ml,混匀,用滤纸过滤,保存于4℃。
4×分离胶缓冲液(B液)2 M Tris-HCl(pH 8.8)75 ml,10%SDS 4 ml,加入去离子水至100ml4 ×堆积胶缓冲液(C液)1 M Tris-HCl(pH 6.8)50 ml,10%SDS 4 ml,加入去离子水至100ml10% APS将1g过硫酸铵溶于8ml去离子水中,加入去离子水至10ml,分装至1.5ml离心管,于-20℃保存。
(完整word版)Westernblot试剂配制及操作步骤

Western blot试剂配制1.30%丙稀酰胺储存液丙稀酰胺29gN,N’-亚甲双丙稀酰胺1g双蒸水定容到100ml,经高压蒸汽灭菌的滤纸过滤避光,4℃保存于棕色瓶中2.1.5 M Tris-HCl (MW=121.1) pH 8.8Tris碱90.75g双蒸水400ml用浓HCl调pH至8.8,加双蒸水定容至500ml。
4℃冰箱保存3.1.0 M Tris pH6.8Tris碱12g双蒸水60ml用浓HCl调pH至6.8,加双蒸水定容至100ml。
4℃冰箱保存4.10%SDS(w/v)SDS 10g溶于加水至100ml,室温放置5.10%过硫酸胺(10%APS)过硫酸胺1g溶于10ml双蒸水中。
可在密闭的管子里4℃保存一周6.10×Tris-甘氨酸电泳缓冲液Tris 30.3g甘氨酸144gSDS 10g定容至1000ml室温放置。
临用时稀释成1×电泳缓冲液7.1%溴酚蓝(w/v)8.TEMED原液,4℃冰箱保存9.2×sample buffer(2×样品缓冲液)1.0 M Tris pH6.82.5mlSDS 0.8gDTT 0.3085g甘油3ml溴酚蓝0.004g加双蒸水至10ml,分装—20℃保存10. 4×SDS加样缓冲液10ml1M Tris-HCl(ph:6.8) 2.5mlSDS 0.8g溴酚蓝0.004g甘油4mlTakara5x buffer 总5ml1M Tris-HCl(ph:6.8) 1.25mlSDS 0.5g溴酚蓝BPB 25mg甘油 2.5ml500ul每管分装,使用前将25ul的2-ME加到没管中11.转膜缓冲液Tris 碱 5.8g甘氨酸 2.9gSDS 0.37g甲醇200ml加双蒸水至1000ml,临用前配制,4℃冷却12.1×TBSTTris 碱 3.0285 g氯化钠8.766gTween-20 500ul加双蒸水至1000ml,现配现用。
Western Blot 实验步骤及注意事项

Western Blot 实验步骤及注意事项western blot的实验步骤及注意事项一、实验步骤1.缓冲液配制(1) Transfor Buffer: 2.9g Glycine, 5.8gTris, 0.37g SDS(可不加), 200ml Methanol(临用前加),ddH2O to 1L(2)10×TBS: 1 M Tris・HCl(pH 7.5)100 mL, 88 g NaCl, ddH2O to 1L (3)TBST: 1×TBS中加入1/1000的Tween (4)封闭液:脱脂奶粉5%(w/v),用TBST配制 2. SDS-PAGE电泳电压:积层胶电泳电压80V左右,分离胶电泳电压110V~120V 3.免疫印迹(1) SDS 聚丙烯酞胺凝胶电泳结束后,将胶放至转移缓冲液中浸泡15m in,切6张Whatman 3mm滤纸和1张PVDF膜,与凝胶大小相符合。
将PVDF膜事先用甲醇浸泡,再用转移缓冲液浸泡。
(2) 将凝胶及PVDF膜以“三明治”状(即3层滤纸、凝胶、PVDF膜、3层滤纸)逐层铺于转印仪上,凝胶一面连接阴极,100 V转移40 min(根据转移蛋白的分子量确定转移时间)。
(3) 将膜放入小盒中,加入5 mL封闭液,摇床上温育1 h。
(4) 以1/1000的比例,加入5 μL第一抗体,4 ℃温育过夜。
(5) TBST溶液洗膜10 min,轻倒,重复3次。
(6)加入 5 mL TBST溶液,以1/2000的比例,加入2.5 μL第二抗体,温育1 h。
(7) TBST溶液洗膜5min,轻倒,重复3次。
(8)加入2 mL显色底物温育3 min,将薄膜封入保鲜袋中,压平,尽可能不留空气,滤纸吸干显色底物。
放入夹板中。
(9)配制显影液和定影液。
暗室操作:将X光片放入夹板中,曝光5 s(根据荧光强度确定),然后放入显影液中,至出现明显的条带取出,水洗后放入定影液中,定影一段时间,取出用水冲洗干净。
蛋白质印迹(Western blotting)实验操作步骤

蛋白质印迹/Western blotting实验操作步骤一、总蛋白的提取单层贴壁细胞总蛋白的提取:1)吸除培养液2)每皿细胞加4℃预冷的 PBS。
平放轻轻摇动 1min 洗涤细胞,然后弃去洗液。
重复上操作两次,共洗细胞三次以洗去培养液。
将PBS弃净后把培养瓶置于冰上。
(PBS会降低细胞裂解液的效价和总蛋白的浓度)3)加裂解液于冰上裂解 30 min,为使细胞充分裂解,培养瓶要经常来回摇动(可放置在4℃摇床裂解)。
4)裂解完后,用干净的刮棒将细胞刮于培养瓶的一侧(动作要快),然后用枪将细胞碎片和裂解液移至 1.5mL 离心管中。
(整个操作尽量在冰上进行)5)在EP管中将细胞震碎(10s/次,3次)6)于4℃下 12000rpm 离心 20-30 min。
(离心机提前预冷至4℃)7)将离心后的上清分装转移倒 1.5mL 的离心管中放于-20℃保存。
二、BCA法测蛋白浓度1)将BCA protein assay每孔 A液200μL,B液4μL混合,96孔板每孔加入22.5μLdd水,2.5μL蛋白提取液,200μLA+B混合液2)在烘箱中37℃,90r,孵育30min3)使用酶标仪测出吸光度后,使用公式y=0.9154x-0.118计算出蛋白浓度(浓度需要×10)4)将蛋白配成等浓度等体积(使用配置好的裂解液配),按照4:1加入5X loading buffer然后煮5min(100℃),放入-20℃保存三、SDS-PAGE电泳板子1.5mm,梳子1.5mm1)清洗玻璃板:一只手扣紧玻璃板,另一只手蘸点洗衣粉轻轻擦洗。
两面都擦洗过后用自来水冲洗2)验漏:玻璃板对齐后放入夹中卡紧,然后垂直卡在架子上,加满水验漏3)灌胶:验漏结束后用纸吸干水分,按方法配制下层胶(4mL+4mL+80μLAP),灌胶时,可用 1mL 枪吸取胶沿玻璃放出,待胶面升到绿带中间线高度时即可。
然后胶上加1 mL水,液封后的胶凝的更快。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Western Blot蛋白测定步骤
三蒸水制备后需要高压消毒
一、组织的采集
(一)器材和试剂准备:
镊子、眼科剪、70%乙醇(三蒸水配制)、1.5mL离心管、液氮
(二)步骤(以心脏为例):
1、脱颈椎处死小鼠,读取小鼠编号
2、乙醇消毒胸部,剪开胸腔,剪下心脏(一颗心脏约100mg),排除血液,放入离心管,投入液氮中
3、组织于-80摄氏度冻存
二、组织蛋白的提取:
(一)器材和试剂准备:
4mL离心管、15mL管、研磨机、镊子、冰盒、离心机、RIPA蛋白裂解液(Radio Immunoprecipitation Assay,详见下载的网页)(碧云天公司)、PMSF(Phenylmethanesulfonyl fluoride,苯甲基磺酰氟,详见下载的网页prod号36978,Thermo Scientific)、70%乙醇、三蒸水
(二)步骤
1、准备好三管10mL70%乙醇、一管三蒸水;取出RIPA和PMSF解冻
2、按照1mLPIRA :10uLPMSF :100mg组织的比例,加试剂和组织于4mL离心管
3、按照三管10mL70%乙醇、一管三蒸水的顺序依次洗涤研磨钻头(每管5秒),再研磨组织,上下且圆周运动离心管。
每管研磨的转速和时间保持一致。
当出现大量泡沫时即可停止
4、静置于冰盒30分钟
5、12000rpm,4摄氏度,30分钟
6、先取100uL上清于离心管,再取300uL上清于离心管。
前者用于测试,后者备用。
-80摄氏度冻存。
注意:购置的RIPA不宜反复冻融,需分装-80摄氏度保存;PMSF为晶体状,购置后按照说明书溶于异丙醇,分装-80摄氏度保存
三、蛋白上样量定量
采用BCA法测蛋白(BCA protein assay kit,Prod号23225,详见下载的网页,Thermo Scientific):
(一)器材和试剂准备:
1.5mL离心管、BCA测试试剂盒、提蛋白剩余的RIPA蛋白裂解液
(二)步骤
1、详见BCA Protein Assay Kit.pdf 使用说明书,配制溶液,制作标准曲线,测定蛋白浓度。
(加好各试剂,混合于37摄氏度放置30分钟)
2、使用Amersham Biosciences GeneQuant Pro分光光度计的562nm测试,读数三次,取平均值(ug/mL)
四、SDS聚丙烯酰胺凝胶的配制(各浓度的配制见配方表)
SDS-PAGE试剂配制
1) 30%丙烯酰胺溶液:
丙烯酰胺(Acrylamide) 29.0g
亚甲双丙烯酰胺(Bis-Acrylamide) 1.0g
dddH2O,37℃溶解,定容至100ml,棕色瓶存于4℃。
2) 分离胶缓冲液 1.5mol/L Tris-Hcl ( PH 8.8)
Tris 18.15g
1mol/L HCL 调节PH(可以使用分析纯级别的浓盐酸,下同)
dddH2O 定容至100mL,4℃保存
3) 浓缩胶缓冲液1.0mol/L Tris-Hcl (PH 6. 8):
Tris 12.1g
1mol/L HCL 调节PH
dddH2O 定容至100mL,4℃保存
4) 10% SDS溶液:
SDS 10.0g
dddH2O定容至100ml,室温保存
5) 10%过硫酸铵(AP):
过硫酸铵 0.1g
dddH2O定容至1.0ml,4℃保存,要在一周内使用,最好新鲜配制6)TEMED 遮光保存,分装于EP管冻存
五、电泳
(一)器材和试剂准备:
电泳仪、电磁锅、浮板、离心机、1.5mL离心管、Marker、5×上样缓冲液(loading buffer)、生理盐水、电泳液
5×SDS-PAGE Loading Buffer配制方法(20mL体系总体积):
DTT(DL-Dithiothreitol,二硫苏糖醇)(0.1M) 1.54g
SDS(sodium dodecyl sulfate) 2.0g
1M Tris-CL(pH6.8) 8.0mL
溶解后加入10mL甘油及少量溴酚蓝定容至20mL
(二)步骤
1、电泳上样体系总25uL(即每孔加25uL):(下表的列表示凝胶孔一个孔所加的试剂)
Marker管(泳道)蛋白样品管(泳道)空白管(泳道)
蛋白无?无
5×loading buffer 5uL 5uL 5uL
Marker 7uL 无无
生理盐水13uL 补齐至25uL 20uL
体系总体积25uL 25uL 25uL
Marker条带依次是170、130、95、72(red)、55、43、34、26、17、10(green)KD 大小的梯度。
蛋白样品管的上样量的计算:40ug(这个值不一定的,可以根据算出的体积来改变。
比如超过20uL则需要减少上样量。
而且如果内参不齐时也需要调整)除以依据分光光度计的读数算出的蛋白浓度ug/mL(根据说明书蛋白以1:20被稀释),再转换成uL的单位。
空白管的设置是因为,当蛋白样品少于9个样品时,空出的孔需要加入物质,以免蛋白跑偏。
2、根据上表加好各试剂后,于270摄氏度水浴5分钟,离心,再上样,倒入电泳液
3、上层胶80V跑,下层胶120V跑(一般至少1个半小时)
六、转膜
(一)器材和试剂准备:
电转仪、电转液、冰块
(二)步骤
1、准备夹板、滤纸、NC膜(浸泡于电转液)
2、取出凝胶切下蛋白和marker所在的凝胶,制成由下到上依次是:滤纸、凝胶、NC膜、滤纸的夹板。
放置各层时注意要加电转液湿润并排出气泡,以免干扰电转效果。
3.放入电转仪,加入冰块和电转液,300mA恒流电转1小时。
七、封闭
(一)器材和试剂准备:
丽春红染料、脱脂牛奶、TBST、塑料盒、镊子、剪刀、摇床
(二)步骤
1、取出夹板,用镊子夹出NC膜置于丽春红染料中3-5分钟
2、取出NC膜可以观察一下条带是否均匀、有无跑偏,用剪刀剪去周围空白,并在左下角剪一斜角。
用蒸馏水洗去丽春染料。
3.TBST配置5%脱脂牛奶,放入NC膜于摇床上慢摇1小时
八、一抗孵育
(一)器材和试剂准备:
塑料膜、封塑机、一抗、TBST
(二)步骤
1、根据NC膜的大小剪出一张双层的塑料膜,取出NC膜置于塑料膜中,封闭塑料膜的三边,制成一个袋子
2、按照一定比例稀释一抗后,加入塑料膜袋,排气泡,封闭塑料膜开口
3、NC膜正面朝下,放置于慢摇的摇床30分钟,再放入4摄氏度的慢摇摇床过夜
九、二抗孵育
(一)器材和试剂准备:
二抗、TBST、剪刀、摇床
(二)步骤
1、取出NC膜于常温慢摇的摇床30分钟,剪开塑料膜,用TBST洗涤3次
每次10分钟(调节摇床至快摇)
2、按照说明书准备二抗的稀释液,一种是目的蛋白的,一种是内参的。
3、洗完NC膜后,将膜剪开,分别放入目的蛋白和内参的二抗稀释液,于慢摇的摇床孵育1小时。
十、显色曝光(采用辣根过氧化物酶HRP_ECL发光法)
(一)器材和试剂准备:
Western Blotting Luminol Reagent测试剂盒(SANTA CRUZ BITECHNOLOGY Int.,sc-2048)、片盒、柯达x-omat Bt医用x射线胶片(型号:xbt-1 规格(cm):12.7x17.8cm)、Kodak X-OMAT 2000 PROCESSOR(洗片机)
(二)步骤
1、取出NC膜用TBST洗涤3次,每次10分钟(调节摇床至快摇)
2、用TBS润洗NC膜,放入有保鲜膜的片盒中
3、将A、B发光液1:1比例混合,加入NC膜,盖上保鲜膜和片盒的盖子
4、到暗室,打开片盒擦去保鲜膜周边的发光液,放入胶片盖上片盒盖子,分别压10秒、30秒、1分钟,胶片放入洗片机
5、取出胶片后对着NC膜标上marker的位置
丽春红染液
丽春红 5g
冰醋酸 1mL
dH2O 定容至100mL
Western blot中三种溶液的配制:
电泳液:
10×储备液(pH 8.3):Tris 30.3g 1×工作液:10×储备液100mL 甘氨酸144g H2O 900mL
SDS 10g
H2O定容至1L
电转液:
10×储备液:Tris 30.3g 1×工作液:10×储备液100mL 甘氨酸144g H2O 700mL
H2O定容至1L 甲醇200mL
TBST:
10×储备液:Tris 24.2g 1×工作液:10×储备液100mL NaCL 87.6g H2O 900mL
调节pH到7.6(1L约加8mLHCL)Tween-20 1mL
H2O定容至1L
TBS:不加Tween-20。
