《药物合成反应》第1章 卤化反应
药物合成反应 卤化反应

X
OH C C X
O O CR C C X
C C
+ X2
C
C
O R C O
RO
OR C C X
一方面:
在非极性非质子性溶剂中进行(CS2、CF4) 增加卤化物,提高二卤代物比例。
H3C H AcOH/ Cl2 H C 3 LiCl H Cl C Cl C H C2H5 Cl OAc C H C2H5
C
H
C
C2H5
+
H3C H
C
相反:
利用一些方法可以制备β -卤代醇或衍生物
CH3CH CH2
I2 / KIO3 H2SO4 / H2O
H H3C C CH2I OH
+
H H3C C I
CH2OH
92%
I2 / CH3CO3H / CH3CO2H Et2O
8%
H H3C C CH2I OCOCH3
80%
C C X2 +H2O C C + HX X2=Cl2, Br2
OH X
E. 加硼烷 ( 硼氢化-卤解 )
第一节 不饱和烃的卤加成反应
一、不饱和烃加卤素
X2
一、不饱和烃加卤素
1. X2对烯烃的加成
C C
C X
C X
活性:F> CI> Br> I CH2=CH2 + Br2 → BrCH2CH2Br
2、N-卤代酰胺为卤化剂 ① 较常用的卤化剂
N-卤代乙酰胺
O H3C C NH Br :NBA
O H3C C NH Cl :NCA
N-溴代琥珀酰亚胺
O N Br O
O N Cl O
:NBS
药物合成反应课件 中国药科大学

醋酸去氢 表雄酮
炔雌醇合成 的第一步
卤素外 的基团 来自溶剂
注意 区域 选择 性?
N-卤代酰胺
Nu=H2O, ROH, DMSO, DMF
选择性???
Dalton 反应
a-溴酮
高选择性对
向加成产物
不影响其它官能团
不饱和烃的硼氢化-卤解反应
首先将烯烃进行硼氢化,然后用卤解反应转
化成卤代烃,具立体和区域选择性的。定位 属反马氏规则。 烯烃的硼氢化常用的试剂为二硼烷(B2H6), BH3/THF和BH3/Me2S(DMS)。 炔烃的硼氢化试剂常用儿茶酚硼烷。 属顺式硼氢化加成机理,硼原子优先处于位 阻较小的位置。 若硼原子连接的碳原子为手性中心,在置换 过程中发生构型反转现象。
3-羰基甾体
Py的作 用??
酮的选择性 ketoselectivity
减少双键加成
取代,快,可逆 加成,慢,不可逆
四溴环己二烯酮
特点:亲电活性大,无需催化剂,只得到单取代产物, 反应中不生成卤化氢,适用于对酸、碱敏感的酮。 区域选择性高,取代反应主要在烷基取代较多的α位。 对αβ不饱和酮也较好,还可用于醛的α-溴代反应。
还有什 么方 法??
与前页比较
芳环上有吸电子取代基时,卤取代反应一
般需用lewis酸催化,反应温度也较高。
含吸电 子基团
二溴异氰尿酸
98%
含多余π-电子的芳杂环:吡咯﹥呋喃﹥ 噻吩﹥>苯,且2位比3位活泼。
对于缺π-电子的芳杂环如吡啶,卤 取代反应相当困难,条件苛刻。
20~50℃
氟和碘取代反应
第二节 卤加成反应
一、不饱和烃的卤加成反应
卤素的活性次序为F>Cl>Br>I
卤化反应 药物合成反应课件

O
CH3 + Cl Si CH3
CH3
Et3N
CH3 O Si CH3
CH3
CH3 Cl Si CH3
Cl Si
O Si Br2
Cl Si Ar2 3
CH3
O Br
3 烯胺卤化
O
H3C
O
N H
or
N H
N H3C
O
or N
H3C
N H3C
室温
-60℃
N
H3C
Br
O CH3 Br
O
H3C
Br
第四节 醇酚醚的卤素置换反应
CH3-CH=CH-CH2OH
CH3CH-CH=CH3
Cl
5.6 molSOCl2/Et2O
76%
0.7 molSOCl2/Et2O
99%
+ CH3-CH=CH-CH2Cl 24% 1%
SOCl2
Py
o CH2OH
o
CH2Cl
3 与卤代磷反应
R-OH + PX3
X RO P X
CH3CH2CH2OH
ON
H
Et
第三代喹诺酮类杀菌药物 HN N
N
F
COOH
O
诺氟沙星
丙胺类抗组胺药
Br CHCH2CH2NMe2 溴苯那敏
N
抗心律失常药
CO O C4H9
I
OCH2CH2N
C2H5 C2H5
I
胺碘酮
第一节 卤化反应机理
一、电子反应机理
亲电加成
R1 R3
Q
R1 R3 CC
R2 X R4
Q R1 R3
药物合成反应-2卤化反应

二、用途
《药物合成反应》
(一)制备特定活性化合物;
二、用途
《药物合成反应》
(二)制备官能团转化的中间体;
二、用途
《药物合成反应》
(三)引入卤素原子作为保护基、阻断基等。
CH3O A BzlO NH
1 6 较活泼 2 Br 2 / H OA c / H 2O 5。 C , 30min
CH3O BzlO
C
B
A
五、反应机理
《药物合成反应》
(2)双分子亲核取代反应(SN2)
五、反应机理
《药物合成反应》
(2)双分子亲核取代反应(SN2)
较强亲核剂直 接由背面进攻 碳原子,并形 成不稳定的一 碳五键的反应 中间体,随后 离去基团离去, 完成取代反应。
五、反应机理
《药物合成反应》
(2)双分子亲核取代反应(SN2)
《药物合成反应》
第一章 卤化反应 (Halogenation Reaction)
一、定义
《药物合成反应》
有机化合物分子中引入卤素原子(X) (建立碳-卤键)的反应称为卤化反应。 X= F,Cl,Br,I 分类:
1)根据所引入卤原子的不同,可分为 氟化、氯化、溴化及碘化反应; 2)根据引入卤原子的方法,可分为加 成卤化、取代卤化和置换卤化。
不稳定,需新制 ;条件温和,但有副 产物。
与不饱和键、环醚加成 与醇羟基发生置换
与不饱和双键加成 • 芳环上取代卤化
七、常用卤化剂及其特点
《药物合成反应》
含硫 卤化 试剂
氯化亚砜 SOCl2
活性较高,选择性 高,无残留物,副 反应少。
醇羟基、羧羟基的氯 置换反应。
含氮 卤化 试剂
药物合成反应_第一章_卤化反应

O H HN
N H H HH N
N
1)HCA/THF/-78 2)HCl/H2O 3)NaHCO3/H2O
Cl O
HCA:六氯代丙酮(氯化试剂)
3
醇/酚的卤置换 醚的卤置换 羧羟基的卤置换 脱羧卤置换 卤素的交换 磺酸酯的卤置换
芳香重氮盐的卤置换
卤化氢与醇的反应机理:亲核叐代
活性较大的烯丙位或苄位常为单 分子亲核叐代,其他醇类多为双 分子机理。
反应机理:自由基叐代
X2
hv 或其它引发剂
2X
主要収生在烯丙位或苄位 等活性位置。
C C CH
X
C C C
HX
C C C
X2
C C C X
X
影响因素
由于吸电子基不利于自由基的稳定,所以它会影响反应难易以及区域选择性。
CH3 CH3 2 mol Br2 hv, 123 ℃, 2 h CH2Br CH2Br
CH3 CH3
Cl
N O
针对醛,醛基氢原子也能被叐代,还能収生其他副反应。经典的做法是先形成烯醇醋酸酯
,再卤代、水解。
C4H9 CHO + Ac2O
1.Br2
OMe
C3H7-CH=CH-OAc
H+ C3H7-C CHO Br
C3H7CHCH OMe 2.MeOH Br
3
针对羧酸,由于羧基α氢活性弱,一般需要先转化为酰氯或酸酐,再卤代。
三种机理的选择:
R C C H H HBr hv
或其它 自由基引发剂
H
Br
H Br
R C C H
H Br H
HBr
R C C
H Br
药物合成反应(全) PPT

H2N
COOCH2CH2N(C2H5)2 . HCl
二氢吡啶钙离子拮抗剂的合成
➢ 具有很强的扩血管作用,适用于冠脉痉挛、高血压、 心肌梗死等症。
➢ 本品化学名为1,4-二氢-2,6-二甲基-4-2-硝基苯基)-吡
啶-3,5-二羧酸二乙酯
NO2
➢ 化学结构式为:
CH 3CH 2OOC
COOCH 2CH 3
药物合成反应(全) PPT
药物合成反应教学内容
绪论 第1章 卤化反应 第2章 烃化反应 第3章 缩合反应 第4章 氧化反应 第5章 还原反应 第6章 重排反应 第7章 官能团保护反应 第8章 药物合成反应路线设计
Chapter 1 概论
水杨酰苯胺(Salicylanilide)的合成
➢ 水杨酸类解热镇痛药 ➢ 用于发热、头痛、神经痛、关节痛及活动性风湿症 ➢ 作用较阿司匹林强,副作用小 ➢ 化学名为邻羟基苯甲酰苯胺 ➢ 化学结构式为:
巴比妥(Barbital)的合成
➢ 巴比妥为长时间作用的催眠药。 ➢ 主要用于神经过度兴奋、狂躁或忧虑引起的失眠。 ➢ 学名为5,5-二乙基巴比妥酸,化学结构式为:
O
C2H 5 C2H 5
O
NH O
NH
合成路线如下
H2C
COOC2H5
COOC2H5+C2H5Br
C2H5ONa
C2H5 C2H5
C
CONH
OH
合成路线如下:
OH
OH
COOH
+
PCl3
OH COO
OH COO
NH2
+
CONH OH
苯妥英钠(PHenytoin Sodium)的合成
药物合成反应(08级)(卤化)

CH3 CH2 CH2 CH2Br (亲核置换)
三、卤化反应的应用
1、制备具有不同生理活性的含卤素药物。
2、在官能团转换中,卤化物常常是重要的中间体。
3、为提高反应的选择性,卤原子可作为保护基、
阻断基等。
第一节 卤化反应机理
一、电子反应机理(P1-3)
1、亲电反应
(1)亲电加成 ① 桥型卤正离子或离子对的过渡态形式 ② 三分子协同亲电加成 (2)亲电取代
CH3(CH2)4 CH
CH2
NBA/HF/Et 2O
CH3(CH2)4 CHCH2Br F
四、卤化氢对不饱和烃的加成反应 1、卤化氢对烯烃的加成反应 (1)反应通式 生成卤素取代的饱和烃。反应时可采用卤化氢 气体或其饱和有机溶剂,或用浓的卤化氢水溶液, 或用无机碘化物/磷酸等方法。
H C R2 C X R4
(3)卤化试剂(P16)
常用卤化剂为卤素、 N-卤代酰胺(NBS和
NCS)、次卤酸酯等,其中N-卤代酰胺最好,
无芳核取代和羰基α位取代(亲电取代)等副反
应,特别适用于苄位和烯丙位的卤取代。 (4)溶剂(P16) 常用惰性溶剂,如CCl4、CHCl3、苯等。 (5)作用物结构(P13-15)
主要取决于中间体自由基的稳定性。
① 芳烃的卤取代反应
② 羰基α位的卤取代反应
③ 炔烃的卤取代反应
2、亲核反应:亲核取代
二、自由基反应机理(P3-4)
1、自由基加成
2、自由基取代
第二节 不饱和烃的卤加成反应
一、不饱和烃和卤素的加成反应 1、卤素对烯烃的加成反应
(1)反应通式
生成邻二卤化物。其中,氯化和溴化最常用,
氟化和碘化的应用受到限制(P5)。
药物合成反应(闻韧_第三版)第一章课后答案Chapter_1_Halogenation_Reaction
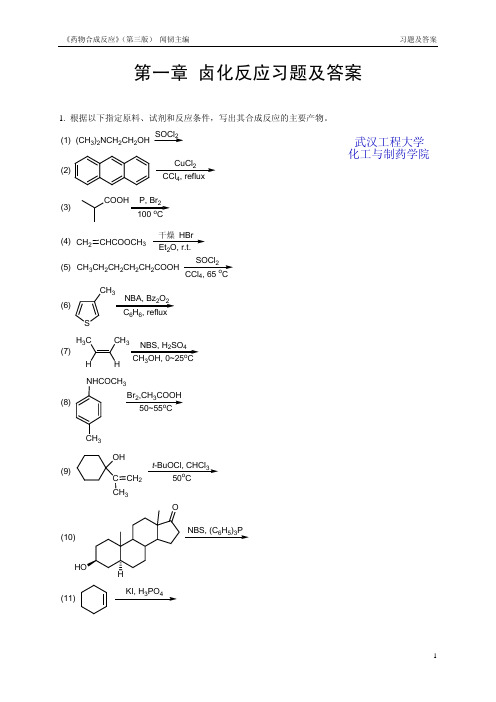
第一章 卤化反应习题及答案1. 根据以下指定原料、试剂和反应条件,写出其合成反应的主要产物。
(1)(CH 3)2NCH 2CH 2OHSOCl 2(2)CuCl 24(3)P, Br 2o(4)CH 2CHCOOCH 3干燥 HBr 2 (5)CH 3CH 2CH 2CH 2CH 2COOHSOCl 24o(6)S CH 32266(7)H 3C CH 3NBS, H 2SO 43o(8)NHCOCH 3CH 3Br 2,CH 3COOH o(9)OHC CH 3CH 2t -BuOCl, CHCl 3o(10)NBS, (C 6H 5)3P(11)KI, H 3PO 4武汉工程大学化工与制药学院(12)C 6H 5H 3Br 2,Cl 4o (13)CH 3CH CH CH 3232(14)(CH 3)3CCH 2OHHBr(15)OOP2(16)NBS, Et 3N ·3HF 22o(17)OHBr 24o(18)O23o2. 在下列指定原料和产物的反应式中分别填入必需的化学试剂(或反应物)和反应条件。
(1)CH 3CH 2CH 2CH 2CH CHCH 3CH 3CH 2CH 2CHCHCHCH 3Br(2)COOHBr(3)(4)OHBr(5)2CH 2BrBr(6)(7)(CH 3)3CCH 2OH(CH 3)3CCH 2Br(8)OOBocHNO OBocHNBr(9)OOBr OO BrBr2. 在下列指定原料和产物的反应式中分别填入必需的化学试剂(或反应物)和反应条件。
(参考答案)题号答案注释(1) NBS/(PhCO)2O, CCl4, △(2) Br2/HgO/tetrachloroethaneNaNO2, HCl, H2O; 2. HPF6; 3. △ (168℃)(3) 1.(4) Ph3P, Br2, CH3CN, △ (200-340℃)(5) NBS/(PhCO)2O, CCl4refluxing (10min. )acetone,(6) NaI,(7) Bu3P, Br2, DMF(8) NBS/hv, CCl4(9) NBS/(PhCO)2O, CCl4, reflux3. 阅读(翻译)以下有关反应操作的原文,请在理解基础上写出:(1)此反应的完整反应式(原料、试剂和主要反应条件);(2)此反应的反应机理(历程)。
《药物合成反应》第1章卤化反应

1. 醇和卤化氢或氢卤酸的反应 反应机理:
R1
R1
R2
H+ C OH
R2
C
+
OH2
R3
R3
R1
-H2O 慢
R2
C+
R3
R1 R2 C X
R3
(SN1机理)
X慢
R1
R1
XR2
C
+ -H2O
OH2 R3
XC R2
R3
(SN2机理)
主要影响因素: ①水
加入去水剂除去生成的水使反应向有机氯化物 方向移动 ②醇的结构
CH3 – CH = CH2 + Br2 CH2Br
Hλ 或(PhCOO)2
CH3 – CH2 –
例如,11-溴十一酸乙酯的制备及消炎镇痛药苄 达明合成原料的制备:
(过氧苯甲酸酐)
HBr,2 (,N Ph aC BrOO)
C2 = HC2 C Hl-- C 5 oH C
Br2 C C 2 C H H 2 C Hl (8% 5 )
σ键 :原子轨道重叠部分对键轴(两原子 的核间连线)具有圆柱形对称时所 形成的键;
π键 :原子轨道重叠部分对键轴所在的某 一平面具有反对称性时所形成的键。
p原子轨道的角度分布剖面图:
z(或y)
+
x
-
y(或z)
注:其中+、-号不表示正、负电荷,而是表示原子轨道角度分布图形 的对称关系
若两原子成键是由p轨道重叠形成的,且形成的是σ 键,则成键图形为:
③向反应介质中加入含卤素负离子的添加剂,可减
少溶剂引起的副反应。如:
④具有季碳取代基的烯烃加成反应中,还可能存在 重排反应。例如:
《药物合成反应》第一章 卤化反应

精品课程
药物合成反应
材料与化学工程系
药物合成反应
医药工业与制药工程
• 医药行业是按国际标准划分的15类国际化 产业之一,被称为“永不衰落的朝阳产业”
• 包括医药工业和医药商业
• 医药工业按原材料来分,又可分为化学制 药业、中药业、生物制药业及医疗器械业
药物合成反应
医药工业发展前景
• 随着社会的的现代化发展要求,对药的品 种、质量、效果等相应地提出了越来越高 的要求
• 随着中国步入老龄化社会,对医药的需求 带来相当大的机会
• 医药产业已成为世界经济强国竞争的焦点, 世界上许多国家都把建立制药学科视为国 家强盛的现状
• 中国医药工业的现状
药物合成反应
一 不饱和烃卤加成反应 1.卤素对烯烃的加成
(加成)
药物合成反应
F2:加成反应激烈,副产物多,实用性小; I2:C-I键不稳定,易消除,不实用; Cl2和Br2常用,重要,资源丰富,且活泼
程度适中,反应相对易控制; Cl2来自于氯碱工业,Br2来自于海洋。
药物合成反应
• (2)反应机理(两种机理,形成两类产品) • 以anti为主,但比例影响因素较多
• 在1999年制药工程专业招生时,全国共有 34所高等院校设置制药工程专业,其中医 药类院校13所,理工类院校12所,综合性 大学9所,招生人数为1165人。
• 2004年5月,国内已有121所高校设置了制 药工程专业,
药物合成反应
分布状况
• 制药工程专业在各省市的分布不是十分均衡的
• 最多的江苏省有10所以上的高校设置了制药工程 专业,但是全国却有近1/5的省、自治区则没有设 置该专业。
药物合成反应 第一章 卤化反应

对于环烯、桥卤正离子在位阻小的一面形成:
Me Br
OH H Br
甾体化合物
Me
Br
OH
H Br
84-85%
④有重排产物生成,生成更稳定的C 离子 +
Br2 Ph3CCHCH2 CCl4
Ph3CCH CH2Br+Ph2C C CH2BrBrPh70%23%
δ+ δ δ+ δ Ph3CCH CH2+Br Br
N B S /D M S O
O
r.t
(90%)
O g lu A c 4
OAc Br
O
O
O g lu A c 4
四、卤化氢对不饱和烃的加成反应
• 1. 卤化氢对烯烃的加成 • (1)反应通式
• 通卤化氢气体或其饱和有机溶剂,若困难 ,可加Lewis Acid或密封管加热。
• (2)反应机理 • ①离子对过渡态 • ②三分子协同 • ③自由基加成
• (3)影响因素 • 同离子效应,可减少副反应
• (4)应用特点
• 应用烯烃直接制备二卤代烯,困难。炔烃 的卤加成,方便。
二、不饱和羧酸的卤内酯化反应
• (1)反应通式
(2)反应机理
I2 /K I/N a H C O 3 C H2C O 2H H2O /r.t.4h
O
C
H2C
O
I HH
** O O
目录
第一章 第二章 第三章 第四章 第五章 第六章 第七章
卤化反应 烃化反应 酰化反应 缩合反应 重排反应 氧化反应 还原反应
第一章 卤化反应
有机化合物分子中引入碳—卤键 的反应。包括: 亲电加成、亲电取 代、亲核取代及自由基反应(从 机理上考虑)
药物合成反应-第一章-卤化反应讲课讲稿

E tOO
t-B u O C l/R O H
C l R O H
C l
E tOO
O R
E tOO
与 次 卤 酸 酯 的 加 成
3
反应机理: N-卤代酰胺只提供卤正离子,环状卤桥正离子需要靠溶剂去进攻以完成加成。
应用特点
常见的N-卤代酰胺
O
O
O H3C C NHBr
(NBA)
O H3C C NHCl
卤 素
对向加成比例
对
碳正离子越稳定,环状卤桥正离子的比重
Br
烯
越低,对向加成相对越低;
烃
Br Br
的
溴的极化能力比氯强,更容易形成环状卤桥正离子,对向加成更多;
加
无位阻时,环状卤桥上下朝向概率相
Br Br
成
同,加成产生外消旋体混合产物。有 位阻时,依位阻来确定三元环朝向;
Br Br
1
次要反应机理:自由基加成
实际上是自身酸根负离子替代了
卤素负离子完成对环状卤桥正离
子的进攻,最终完成加成。
应用特点
O H X2/K I/N aH C O 3 O H 2O /r.t.
可制造五~六元环状内酯,进一步还可还原为半缩醛。
X O
O
X
O O
X 2 /K I/N a H C O 3
XD IB A H
X
H 2 O /r .t . C H 2 C O O H
OO
- 7 2 ℃H OO
不 饱 和 羧 酸 的 卤 内 酯 化
2
反应机理:与卤素加成类似
δ+δXOH
反应条件 次卤酸很不稳定,需现制现用。可用 氯气或溴与中性或含汞盐的碱性水溶 液反应而得到。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
③向反应介质中加入含卤素负离子的添加剂,可减
少溶剂引起的副反应。如:
④具有季碳取代基的烯烃加成反应中,还可能存在 重排反应。例如:
CH – CH3 OAc
(19%)
注意两种不符合马氏规则的情况: ①当烯烃双键上带有吸电基时;
②当卤化氢与烯烃在光照或过氧化物引发下 进行自身基加成时。
例如,丙烯与HBr在光或引发剂作用下的加成反应:
3R-CH=CH2 + 1/2B2H6 → (RCH2CH2)3B ②卤解反应:用碘、溴素等将硼基置换出来,得到相
应的碘代烷或溴代烷。
2、炔烃的硼氢化-卤解反应 常用的硼氢化试剂:儿茶酚硼烷(由儿茶酚和BH3/THF 制得);
反应机理:
第二节 烃类的卤取代反应
一、 脂肪烃的卤取代反应 1. 饱和脂肪烃的卤取代反应 反应条件:高温、紫外光照或过氧化物引发 反应历程:自由基反应 烷基氢原子的活性: 叔C-H> 仲C-H > 伯 C-H
第烃和卤素的加成反应
1. 卤素对烯烃的加成 反应活性: F2>Cl2>Br2>I2 氟化反应和碘化反应较特殊 氯化和溴化:四氯化碳、氯仿、二硫化碳作溶剂
(1)反应机理:
对向(anti)加成 同向(syn)加成
注:
①共价键根据原子轨道重叠部分所具有的 对称性进行分类:
-
++ -
如果形成的是π键, 则:
zz
+
+
x
--
yy
②共轭: 在不饱和化合物中,如果与C=C 相邻的碳原子上有P电子,则此P电子可与C=C 形成一个包括两个原子核以上的π键,这种体 系即为共轭体系。
例如:1,3-丁二烯(CH2=CH-CH=CH2),其中每个C原子都是sp2杂化C 原子。碳原子的电子分布式为1s22s22p2,价层电子用原子轨道表示:
故卤化氢的反应活性次序为:HI﹥ HBr ﹥HCl ﹥HF
1. 卤化氢对烯烃的加成 ——亲电加成
反应机理:
离子对机理(同向加成)
三分子协同反应机理(对向加成)
①卤化氢与不对称烯烃的加成符合马氏规则。
②在反应中加入Lewis酸,可促进反应。例如:
HCl + FeCl3
[H+ ·FeCl4-] H+ + FeCl4-
第一章 卤化反应
[目的要求]
熟悉卤化反应的类型、反应机理。掌握各种卤化 反应的特征和影响因素及常见卤化剂。了解卤化反 应在药物合成中的应用。
[教学内容]
1. 不饱和烃的卤加成反应 2. 烃类的卤取代反应 (烯丙位、苄基位碳原子上的卤取代反应和芳烃的卤 取代反应 ) 3. 醇、酚和醚的卤置换反应 4. 羧酸的卤置换反应 5. 其它官能团化合物的卤置换反应 (卤素交换、磺酸脂和芳香重氮盐化合物的卤置换反 应等)
对于无α-氢的芳醛,用卤素可直接取代醛基C上 的氢。如:
3. 羧酸及其衍生物的α-卤取代反应 羧酸α-氢不如醛、酮α-氢活泼,需在硫、磷等
催化剂作用下进行α-卤取代。但其衍生物,如酰卤、 酸酐、腈、二羧酸及其酯等,可用卤素直接进行α卤取代。如:
第四节 醇、酚和醚的卤置换反应
一、 醇的卤置换反应
②次卤酸酯对烯烃的加成
反应机理与次卤酸反应相似,只是亲核基团由溶剂 提供,且反应可在非水溶液中进行。如:
2. N-卤代酰胺为卤化剂 常用卤代酰胺:N-溴(氯)代乙酰胺(NBA,
NCA)、N-溴(氯)代丁二酰亚胺(NBS,NCS)。
①反应机理:
例:
②Dalton反应:
α-溴代酮
β-溴醇
四、 卤化氢对不饱和烃的加成反应 卤化氢的键能大小顺序:H-F﹥ H-Cl ﹥H-Br ﹥H-I,
a. 催化剂(可以是质子酸,也可以是路易斯酸) 反应初加入少量氢卤酸可缩短诱导期。
b. 碱 帮助脱去α-氢原子。其中没有质子化的羰基化物
可作为有机碱发挥作用,例如P21苯乙酮的溴化。
c. 酮的结构
ⅰ. 对于不对称酮,若仅一个α-碳上有氢原子,产 品较单一。如:
O2N
C — CH 3 O
Br2 , PhCl 26-28℃
成时,可加入少量的路易斯(Lewis)酸进行催化。
ⅲ)温度
不宜太高,否则可能引起二卤化物脱卤化氢。
⑤光照或自由基引发:自由基加成
2. 卤素对炔烃的加成: 与烯烃加成机理类似 得到反式二卤烯烃
与SOCl2和BBr3的卤代:
二、 不饱和羧酸(酯)的卤内酯化反应
——不饱和羧酸的C=C双键上形成三元环卤正离子
另:N-卤代仲胺也可作为卤化剂,例如,
2. 不饱和烃的卤取代反应 烯氢的卤代不常见,主要为炔氢的卤代。例如:
3. 烯丙位和苄位碳原子上卤取代反应 反应历程:
反应的关键所 在
讨论: ①当苄位、烯丙位或苄位上连有吸电子基时,
自由基稳定性下降,反应减慢;可通过提高卤素浓度、 反应温度或选用活性更大的卤化剂,进行反应。 例如:
CH 2Br
抗心律失常药
Br 溴苄胺托西酸盐中间体
hλ
Cl
CH 3
回流
Cl
CH2Cl 抗疟药乙胺嘧啶中间体
Cl 2,CCl 4 N CH 3 hλ, 60-65℃
N CH 2Cl
抗组胺药扑尔敏中间体
二、 芳烃的卤取代反应
1. 反应机理
①亲电试剂的形成
③苯型卤化物的形成
②σ – 络合物的形成
2.主要影响因素 ①芳烃的结构
(2)讨论: ①氯和溴与烯烃的加成常以对向加成机理为主,但同向加 成比例会因作用物的结构、试剂及反应条件不同而发生较 大的变化。
ⅰ)当双键上有苯基时,且当苯基上有释电子基时,同向 加成产物的比例随之增加。例如:
ⅱ)在氯加成反应中,同向加成的倾向比溴加成更为明 显。如:
②卤素加成产物的立体化学,主要取决于烯烃的结构及 反应中空间阻碍因素,见P6。
COOH
OH H 氯霉素
NH
N
诺 氟 沙 星 C2H5
2. 将卤化物作为中间体通过进一步转化,生成其他 产品,如:糖皮质激素醋酸可的松的制备
CH3
CO OH
CH2I CO
OH
O CH2OCCH3
CO OH
I2/CaO
CH3COOK
CH3OH/CaCl2
DMF
O
O
O
催眠镇静药巴比妥中间体二乙基丙二酸二乙酯的制 备:
2. 卤化氢对炔烃的加成: 离子型加成:与烯烃的情况类似
五、不饱和烃的硼氢化-卤解反应 硼氢化反应:硼氢化物对π 键加成的反应。 反应历程:经过烯烃的硼氢化反应,再通过卤解
反应转化成卤代饱和烃或烯烃。
1、烯烃的硼氢化-卤解反应 常用的硼氢化试剂:二硼烷(B2H6)、BH3/THF和BH3/ Me2S(TMS)等; ①烯烃的硼氢化反应
σ键 :原子轨道重叠部分对键轴(两原子 的核间连线)具有圆柱形对称时所 形成的键;
π键 :原子轨道重叠部分对键轴所在的某 一平面具有反对称性时所形成的键。
p原子轨道的角度分布剖面图:
z(或y)
+
x
-
y(或z)
注:其中+、-号不表示正、负电荷,而是表示原子轨道角度分布图形 的对称关系
若两原子成键是由p轨道重叠形成的,且形成的是σ 键,则成键图形为:
O2N
C — CH 2Br O
ⅱ. 对于不对称酮,若两个α-碳上均有氢原子,卤
素优先取代连有推电子基的α-碳上的氢。如:
ⅲ. 当羰基α-碳上连有卤素等吸电基时,反应受 阻,若羰基另一α-碳上有氢,则第二个卤原子优先 进攻此α-碳上的氢。如:
d. 溴化氢 ——可加快烯醇化速度,但同时会消除α-溴。 在反应介质中加入适量的醋酸钠或吡啶,可中
卤化反应的概念:向有机化合物分子中引入卤素原子 (建立碳-卤键)的反应。
分类:1)根据所引入卤原子的不同,可分为氟化、 氯化、溴化及碘化反应; 2)根据引入卤原子的方法,可分为加成卤化、 取代卤化和置换卤化。
目的:
1. 制备具有不同生理活性的含卤素有机药物;
H NHCOCHCl2
O
F
H2N
CC
CH2OH
②连有供电子基时,则自由基的稳定性增加。 ③对于开链烯烃,烯键α位亚甲基一般比α位甲基 容易卤代。如:
α位亚甲基
α位甲基
④NBS、NCS对烯丙位及苄位卤取代的选择性高。
应用:
CH3 COOH
Br2, PhCl 微微回流
CH 3 Br,hλ
Br 160-180℃
CH2Br
防晒药对氨苯甲酸的中间体
COOH
当α-碳原子上连有卤素等吸电子基时,可促进反 应。 如:
卤仿反应,可合成少 一个C原子的羧酸。
c. 碘化氢 常需加入碱性物质除去还原性的碘化氢。 如抗炎激素氢化可的松的中间体合成,P21。
2. 醛的α-卤取代反应 可在酸、碱催化下卤取代,但易发生副反应 解决办法:先将醛转化成烯醇酯,再与卤素反应。如:
NaBr C2H5OH H2SO4 C2H5Br
CH2(COOC 2H5)2 C2H5ONa
(C2H5)2C(COOC 2H5)2
3. 卤素原子作为保护基等,提高反应的选择 性。
常用卤化剂:
1. 卤素:Cl2、Br2、I2; 2. 卤素的酸和氧化剂:HCl+NaOCl、HBr+NaOBr 、HBr+NaBrO3等; 3. 其它卤化剂:SO2Cl、HOCl、COCl2、NaF、KF 、HF等。
③当双键上有季碳取代基进,除正常的对向加成产物 外,常常会发生重排和消除反应。如:
④反应条件的影响 ⅰ)溶剂
当反应在亲核性溶剂(H20、RCO2H、ROH 等)中进行时,会生成β-卤醇或酯等加成物;但若 添加无机卤化物,可提高二卤化物的生成比例。如:
