药物合成反应 第三版 闻韧
武大药学院考研参考书目

武大药学院考研参考书目生物化学:王镜岩等:《生物化学》(上下第三版),高等教育出版社(武大药学院11级学生用书)沈同等:《生物化学》(第三版),高等教育出版社(10级学生用书)[推荐任选其一]张楚富:《生物化学原理》,高等教育出版社(09级学生用书)有机化学:邢其毅主编:《基础有机化学》(上下第三版),高等教育出版社王礼琛主编:《有机化学》,中国医药科技出版社(学生用书)倪沛洲/陆涛主编: 《有机化学》,人民卫生出版社[推荐]天然药化与生药学:天然药物化学:吴立军主编:《天然药物化学》(第五版),人民卫生出版社生药学:郑汉臣等:《生药学与药用植物学》(第五版),人民卫生出版社制药工程:闻韧:《药物合成反应》(第三版),化学工业出版社崔福德主编:《药剂学》(第六版),人民卫生出版社药品生产质量管理规范(2010年修订)(中华人民共和国卫生部令第79号)中药学专业基础综合中药学(新世纪全国高等中医药院校规划教材)(第二版),高学敏主编,中国中医药出版社中药化学(新世纪全国高等中医药院校规划教材)(第二版),匡海学主编,中国中医药出版社次要参考:中药药剂学(新世纪全国高等中医药院校规划教材),张兆旺主编,中国中医药出版社中药鉴定学(新世纪全国高等中医药院校规划教材)(第二版),康廷国主编,中国中医药出版社药学专业基础综合《药理学》、《药物分析》、《生物化学》----------------------药学综合/中药学综合参考书目(各研究方向仅参考本方向用书)药物化学:《药物化学》为主,辅助参考闻韧:《药物合成反应》(第三版),化学工业出版社药剂学:崔福德主编:《药剂学》(第六版),人民卫生出版社生药学:蔡少青主编: 《生药学》第六版,人民卫生出版社药物分析学:《分析化学》(仪器分析部分,不包括四大光谱),《药物分析》(第六版),人民卫生出版社微生物与生化药学:何忠效等:《现代生物技术概论》,北京师范大学出版社药理学、临床药学、药事管理学、制药工程:李端主编:《药理学》(第六版)人民卫生出版社中药学:药用植物学(新世纪全国高等中医药院校规划教材),(第二版),姚振生主编,中国中医药出版社同等学历加试参考书目:药物分析:刘文英:《药物分析》(第六版),人民卫生出版社药理学:李端等:《药理学》(第六版),人民卫生出版社药用植物学:艾铁民主编:《药用植物学》,北京大学医学出版社中药资源学:王文全、沈连生主编:《中药资源学》,学苑出版社关于博士生入学考试,学生可以参考:1)荣国斌的《高等有机化学》。
《药物合成》课程教学大纲

《药物合成》课程教学大纲课程编号:02035英文名称:The reaction of Drug sythesis一、课程说明1. 课程类别专业课程2. 适应专业及课程性质制药工程专业、制药基地班必修3.课程目的通过本课程的学习使学生能系统地掌握化学药物(包括某些精细化工产品)及其中间体制备中重要有机合成反应和合成设计原理,以利于培养学生在实际药物合成工作中的观察分析、思维理解和独立解决问题的能力。
4. 学分与学时学分为2.学时为405. 建议先修课程有机化学6. 推荐教材或参考书目推荐教材:(1)药物合成反应(第2版).闻韧主编.化学工业出版社.2003年参考书目:(1)新编有机合成化学(第1版).黄宪,王彦广主编.化学工业出出版社.2002年(2)新编药物合成手册(上下).朱宝泉主编.化学工业出出版社.2003年7. 教学方法与手段本课程采用多媒体进行教学,有利于提高课堂教学的信息密度,便于教师突出重点,展开难点分析。
8. 考核及成绩评定考核方式:考试成绩评定:(1)平时成绩占30% ,形式有:作业、实验(2)考试成绩占70%,形式有:闭卷或开卷考试9. 课外自学要求(1)完成课后习题(2)一些浅显易懂的需要了解的内容学生自己看书二、课程教学基本内容及要求第一章绪论基本内容:(1)“药物合成反应”课程讲授内容共讲授七章即酰化反应、卤化反应、烃化反应、氧化反应、还原反应(包括化学还原和氢化还原两部分)、环合反应及重排反应(2)“药物合成反应”课程的学习方法在学好有机化学的基础上,掌握重要药物合成反应,将官能团反应性,试剂活性、反应条件之间的关系进行联系、比较、以达到牢固掌握药物合成的方法及其重要反应(3)“药物合成反应”课程讲课的要求和安排课堂讲授为主、自学为辅。
课堂上的重点突出,讲解主要内容及难点,因课时有限,有部分内容要求同学自学,但仍属大纲要求掌握的内容。
本课程进行期终考试基本要求:(1)掌握重要药物合成反应、反应的影响因素,如作用物和试剂活性,主要反应条件,反应的选择性等及其药物合成的应用,并了解其反应机理(2)掌握重要人名反应在药物合成中的应用(3)熟悉一些新试剂,新反应的特点、应用范围,并与类似反应进行比较第二章卤代反应基本内容:(1)卤代反应的定义,反应机理及其在药物合成中的应用(2)不饱和烃卤加成反应的立体化学及常用的卤代剂(3)烃类、羰基化合物的卤取代反应的特点、反应类型及立体化学(4)其它官能团化合物的卤置换反应(5)醇、酚、醚及羧酸的卤置换反应中常用的卤代剂、反应条件及应用基本要求:(1)了解卤代反应的定义,反应机理及其在药物合成中的重要性。
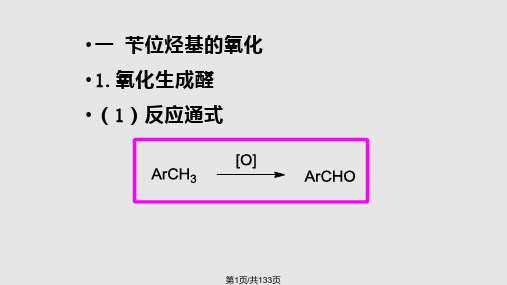
《药物合成反应》闻韧主编第二章烃化反应-知识点总结

#2.10打卡# 李骅轩完成学习目标烃化反应定义:用烃基取代有机分子中的某些功能基上的氢原子得到烃化产物的反应都称为烃化反应。
烃基:饱和、不饱和、脂肪、芳香分类1)按被烃化物不同C-OH(醇或酚羟基)变为-OR醚;C-N(NH3) 变为伯、仲、叔胺;C-C2)按烃化剂的种类分类卤代烷:RX 最常用;硫酸酯、磺酸酯;醇;烯烃;环氧烃:发生羟乙基化;CH2N2:很好的重氮化试剂3)按反应历程分类:SN1 SN2 亲电取代一醇的O-烃化1 卤代烷为烃化剂2 磺酸酯3 环氧乙烷类作烃化剂4 烯烃作为烃化剂5 醇作为烃化剂6 其它烃化剂二酚的O-烃化1 烃化剂2 多元酚的选择性烃化一醇的O-烃化1 卤代烷为烃化剂在碱的条件下与卤代烷生成醚:SN1伯卤代烷RCH2X按SN2历程;随着与X相连的C的取代基数目的增加越趋向SN1。
影响因素 a RX的影响ii)活性:RI>RBr>RCl>RFb 醇的影响苯海拉明合成可采用的两种方法。
可以看到,由于醇羟基氢原子的活性不同,进行烃化反应时所需的条件也不同。
前一反应醇的活性低,要先制成醇钠;而二苯甲醇中,由于苯基的吸电子效应,羟基中氢原子的活性增大,在反应中加入氢氧化钠作除酸剂即可。
显然后一反应优于前一反应,因此苯海拉明的合成采用了后一种方式c催化剂的影响催化剂:醇钠、Na、NaH、NaOH、KOH有机碱:六甲基磷酰胺(HMPA)、N,N-二甲基苯胺(DMA)有些有旋光活性的醇,如果加金属钠制成醇钠,再与卤代烃反应,产物比较复杂,如用氢化钠,则可立体专一性地得到相应的甲醚。
d溶剂影响溶剂: 过量醇(既是反应物又是溶剂)非质子溶剂:苯、甲苯(Tol)、二甲苯(xylene)、DMF、DMSO无水条件下质子性溶剂:有助于R-CH2X 解离,但是与RO-易发生溶剂化,因此通常不用质子性溶剂。
副反应消除反应2 磺酸酯为烃化剂:主要指芳磺酸酯,引入较大的烃基3环氧乙烷类作烃化剂:反应机理:a 酸催化R为供电子基或苯,在a处断裂R'为吸电子基得b处断裂产物b 碱催化SN2 双分子亲核取代,开环单一,立体位阻原因为主,反应发生在取代较少的碳原子上。
《药物合成反应》-闻韧主编第三章酰化反应-知识点总结

#2.11打卡# 完成学习目标第三章酰化反应Acylation Reaction1 定义:有机物分子中O、N、C原子上导入酰基的反应.2 分类:根据接受酰基原子的不同可分为:氧酰化、氮酰化、碳酰化3 用途:药物本身有酰基活性化合物的必要官能团结构修饰和前体药物羟基、胺基等基团的保护。
酰化机理:加成-消除机理加成阶段反应是否易于进行决定于羰基的活性:若L的电子效应是吸电子的,不仅有利于亲核试剂的进攻,而且使中间体稳定;若是给电子的作用相反。
根据上述的反应机理可以看出,作为被酰化物质来讲,无疑其亲核性越强越容易被酰化。
具有不同结构的被酰化物的亲核能力一般规律为;RCH2->R—NH->R—O->R—NH2>R—OH。
在消除阶段反应是否易于进行主要取决于L的离去倾向:L-碱性越强,越不容易离去,Cl- 是很弱的碱,-OCOR的碱性较强些,OH-、OR-是相当强的碱,NH2-是更强的碱。
RCOCl>(RCO)2O>RCOOH 、RCOOR′ >RCONH2>RCONR2′R: R为吸电子基团利于进行反应;R为给电子基团不利于反应R的体积若庞大,则亲核试剂对羰基的进攻有位阻,不利于反应进行酸碱催化碱催化作用是可以使较弱的亲核试剂H-Nu转化成亲核性较强的亲核试剂Nu-,从而加速反应。
酸催化的作用是它可以使羰基质子化,转化成羰基碳上带有更大正电性、更容易受亲核试剂进攻的基团,从而加速反应进行。
氧原子的酰化反应是一类形成羧酸酯的反应,是羧酸和醇的酯化反应,是羧酸衍生物的醇解反应醇的结构对酰化反应的影响伯醇(苄醇、烯丙醇除外)>仲醇>叔醇1) 羧酸为酰化剂:提高收率:(1)增加反应物浓度(2)不断蒸出反应产物之一(3)共沸除水、添加脱水剂或分子筛除水。
(无水CuSO4,无水Al2(SO4)3,(CF3CO)2O,DCC。
)加快反应速率:(1)提高温度(2)催化剂(降低活化能)催化剂(1)质子酸催化法: 无机酸:浓硫酸,氯化氢气体,有机酸:苯磺酸,对甲苯磺酸等。
药物合成反应(第三版_闻韧)第四章 缩合反应总结

R
CH C OH
R'
R
-H
R' R R CH2 C OH
O R'
Hale Waihona Puke CH C- H2O
R'
O C C CR'
CH2R R
Organic Reactions for Drug Synthesis
1)自身缩合 (一般用碱性催化剂)
NaOH 25℃ 2CH3CH2CH2CHO NaOH 80℃ CH3CH2CH2CH OH CH3CH2CH2CH CH CHO CH2CH3 C CHO
试解释上述反应中为什么使用镁?
Organic Reactions for Drug Synthesis
1)
-卤代酸酯的活性顺序为:
R1 R1
ICH2COOC2H5>BrCH2COOC2H5 >ClCH2COOC2H5
X CCOOC2H5 > X CHCOOC H > X CH2COOC2H5 2 5 R2
2) 无水操作:Et2O、THF等。Zn需活化(用20%HCl 处理)
Organic Reactions for Drug Synthesis
Reformatsky反应的应用:
•合成-羟基羧酸酯 •合成-羟基羧酸
•醛、酮增长碳链的方法之一
Organic Reactions for Drug Synthesis
C O Y
Nu
C O Nu
+ Y
Organic Reactions for Drug Synthesis
羰基化合物的结构与反应特征
羰基化合物的结构特征之二: ——羰基C=O的吸电子作用使得a-H具有明显 的酸性,在碱性条件下可以离解,生成烯醇 负离子,从而成为亲核试剂,进攻羰基碳或 卤代烃,发生亲核加成反应、亲核取代反应。
药物合成反应卤化反应

和影响因素 5 芳香环的卤置换反应的卤化剂的种类、反应历程和影响因素 6 醛酮羰基α-位的卤置换反应的反应历程及其影响因素 7 用于醇酚羟基的卤置换反应的卤化剂的种类、反应历程及影
响因素 8 用于羧酸的卤置换反应的卤化剂种类、特点及使用条件
授课人:孙斌
课程简介 Organic Reaction of
Drugs Synthesis
➢本课程共48学时。 ➢主要介绍各类基本有机合成反应及其在
药物合成中的应用。
教材及参考书
• 教材:药物合成反应,第三版 闻韧主编, 化学工业出版社。
• 参考书:药物合成反应,张胜建编,化学工 业出版社 2010.
次卤酸及其酯对不饱和烃的加成反应 N-卤代酰胺对不饱和烃的加成反应 卤化氢对不饱和烃的加成反应
一、 卤素对烯烃的加成反应
烯烃和卤素加成,得到1,2-二卤代物。
CC X2
X CC
X
F> Cl> Br> I RF<RCl<RBr<RI
❖氟与烯烃的加成在有机合成上无实用意义(副反应多)。 ❖碘与烯烃的反应不容易发生,应用亦很少。 ❖氯、溴与烯烃的加成是精细化工领域普遍应用的单元反 应技术之一,我们将重点介绍。
过多种途径发挥作用,其中最主要的作用方 式是作为胸苷酸合成酶抑制剂,阻断DNA复 制的必需原料——胸腺嘧啶的合成
溴苯那敏(Brompheniramine)是一种 用于过敏症状的药物,属于第一代组 胺H1受体拮抗剂(又称抗组织胺药)
溴苯那敏(Brompheniramine)
学习重点
1 不饱和烃与卤素加成反应的历程 2 次卤酸(酯)和N-卤代酰胺对于不饱和烃反应的历程及影响
最新《药物合成反应(闻韧主编第三版)》人名反应整理资料

《药物合成反应(闻韧主编第三版)》人名反应整理一、卤化反应1、Hunsdriecke反应(汉斯狄克反应):羧酸银盐和溴或碘反应,脱去二氧化碳,生成比原反应物少一个碳原子的卤代烃。
2、Sandmeyer反应(桑德迈尔反应):用氯化亚铜或溴化亚铜在相应的氢卤酸存在下,将芳香重氮盐转化成卤代芳烃。
3、Gattermann反应(加特曼反应):将Sandmeyer反应条件改为铜粉和氢卤酸。
4、Schiemann反应(席曼反应):将芳香重氮盐转化成不溶性的重氮氟硼酸盐或氟磷酸盐,或将芳胺直接用亚硝酸钠和氟硼酸进行重氮化,此重氦盐再经热分解(有时在氟化钠或铜盐存在下加热),就可以制得较好收率的氟代芳烃。
二、烃化反应5、Willamson合成(威廉姆森合成):醇在碱(钠,氢氧化钠,氢氧化钾等) 存在下与卤代烃反应生成醚的反应。
6、Gabriel合成(盖布瑞尔合成):将氨先制备成邻苯二甲酰亚胺,利用氮上氢的酸性,先与氢氧化钾形成钾盐,然后与卤代烃作用,得N-烃基邻苯二甲酰亚胺,肼解或酸水解即可得纯伯胺。
7、Delepine反应(德勒频反应):用卤代烃与环六亚甲基四胺(乌洛托品Methenamine)反应得季铵盐,然后水解可得伯胺。
8、Leuckart-Wallach反应(鲁卡特-瓦拉赫反应):用甲酸及其铵盐可以对醛酮进行还原烃化,得各类胺。
9、Ullmann反应(沃尔曼反应):卤代芳烃与芳香伯胺在铜或碘化铜及碳酸钾存在并加热的条件下可得二苯胺及其同系物。
三、酰化反应10、Friedel-Crafts反应(傅列德尔-克拉夫茨反应,也称傅-克酰基化反应):羧酸及羧酸衍生物在质子酸或Lewis酸的催化下,对芳烃进行亲电取代生成芳酮的反应。
11、Hoesch反应(赫施):腈类化合物与氯化氢在Lewis 酸催化剂ZnCl2的存在下与烃基或烷氧基取代的芳烃进行反应可生成相应的酮亚胺,再经水解则羟基或烷氧基取代的芳香酮。
12、Gattemann反应(伽特曼反应):将羟基或烷氧基取代的芳烃在AlCl3、ZnCl2催化下与氰化氢及氯化氢反应生成牙胺盐酸盐,再经水解生成相应芳香醛的反应。
《药物合成反应(闻韧主编第三版)》人名反应整理(新)

《药物合成反应(闻韧主编第三版)》人名反应整理一、卤化反应1、Hunsdriecke反应(汉斯狄克反应):羧酸银盐和溴或碘反应,脱去二氧化碳,生成比原反应物少一个碳原子的卤代烃。
☆☆☆☆☆2、Sandmeyer反应(桑德迈尔反应):用氯化亚铜或溴化亚铜在相应的氢卤酸存在下,将芳香重氮盐转化成卤代芳烃。
☆☆3、Gattermann反应(加特曼反应):将Sandmeyer反应条件改为铜粉和氢卤酸。
☆☆4、Schiemann反应(席曼反应):将芳香重氮盐转化成不溶性的重氮氟硼酸盐或氟磷酸盐,或直接将芳胺用亚硝酸钠和氟硼酸进行重氮化,此重氮盐再经热分解(有时在氟化钠或铜盐存在下加热),就可以制得较好收率的氟代芳烃。
☆二、烃化反应5、Willamson合成(威廉姆森合成):醇在碱(钠、氢氧化钠、氢氧化钾等)存在下与卤代烃反应生成醚的反应。
☆☆☆☆6、Gabriel合成(盖布瑞尔合成):将氨先制备成邻苯二甲酰亚胺,利用氮上氢的酸性,先与氢氧化钾形成钾盐,然后与卤代烃作用,得N-烃基邻苯二甲酰亚胺,再经过肼解或酸水解即可得纯伯胺。
☆☆☆☆☆7、Delepine反应(德勒频反应):用卤代烃与环六亚甲基四胺(乌洛托品Methenamine)反应得季铵盐,然后水解即可得伯胺。
8、Leuckart-Wallach反应(鲁卡特-瓦拉赫反应):用甲酸及其铵盐可对醛酮进行还原烃化,得各类胺。
☆9、Ullmann反应(沃尔曼反应):卤代芳烃与芳香伯胺在铜或碘化铜及碳酸钾存在并加热的条件下可得二苯胺及其同系物。
三、酰化反应10、Friedel-Crafts反应(傅列德尔-克拉夫茨反应,也称傅-克酰基化反应):羧酸及羧酸衍生物在质子酸或Lewis酸的催化下,对芳烃进行亲电取代生成芳酮的反应。
☆☆☆☆☆11、Hoesch反应(赫施反应):腈类化合物与氯化氢在Lewis酸催化剂ZnCl2等的存在下与烃基或烷氧基取代的芳烃进行反应可生成相应的酮亚胺,再经水解则得到羟基或烷氧基取代的芳香酮。
药物合成反应(第三版)第一章课后翻译

About 216–224 g. (1.62–1.68 moles) of powdered anhydrous aluminum chloride is added to a 1Lthree-necked flask.在1L的三口烧瓶中加入大约216-224g(1.62–1.68 moles)的无水三氯化铝。
While the free-flowing catalyst is stirred (Note 3), 81 g. (0.67 mole) of acetophenone is added from the dropping funnel in a slow stream over a period of 20–30 minutes.自由流动的催化剂边搅拌边用滴液漏斗缓慢滴加81g苯乙酰。
Considerable heat is evolved, and, if the drops of ketone are not dispersed, darkening or charring occurs. 放热反应,假如滴加的酮不能被分散,就会变黑或是碳化。
When about one-third of the acetophenone has been added, the mixture becomes a viscous ball-like mass that is difficult to stir.当三分之一的乙酰苯被滴加,反应混合物变成一个很难搅拌的粘性的球状团块。
Turning of the stirrer by hand or more rapid addition of ketone is necessary at this point. 在这时,改用手动搅拌或快速滴加酮是非常必要的。
The addition of ketone, however, should not be so rapid as to produce a temperature above 180°. 然而,速度不能太快,当反应温度超过180℃时。
《药物合成反应》绪论课的教学体会

《药物合成反应》绪论课的教学体会作者:霍丽妮何春玲邓超澄李培源来源:《读写算》2012年第63期药物合成反应是药学、制药工程等本科专业的专业主干课之一。
随着药物及其医药中间体的发展,学好并能系统地掌握药物制备中重要的有机合成反应和合成设计原理,对于培养学生在实际药物合成工作中设计、分析问题和解决问题的能力具有重要意义[1],并为今后《药物化学》的学习奠定基础。
本课程采用的教材是闻韧主编的药物合成反应,主要内容是学习各类药物合成反应及在合成中的应用。
但是教材没有编排绪论章节,从第一章起就直接介绍常见的药物合成单元反应,忽略绪论,显得有点突兀,学生普遍感到难学、难懂、枯燥,学习积极性难以调动,对后面的学习失去兴趣和信心。
因此,为消除学生厌学的情绪,笔者非常重视第一堂课的讲授。
一、通过启发和诱导让学生明确药物合成的内涵及研究意义什么是药物合成?笔者没有采取硬灌的方法,而是用一个简单的合成实例启发学生自己去体会。
在ppt中首先以大家熟悉的药物阿司匹林切入,介绍它的来源。
最初从柳树皮中提取出一种有机化合物--------水杨酸,该物质也具有解热镇痛的作用,但是由于结构中酚羟基和羧酸的存在,药物酸性较强,对肠胃刺激较大,因而产生副作用。
随后让学生在课堂上自行讨论解决方案,学生通过思考得出两种方案,一种方案是使羧酸与氢氧化钠反应生成水杨酸钠,另一种方案是将酚羟基乙酰化生成乙酰水杨酸。
前者因为具有极不愉快的甜味已不再使用,后者即为阿司匹林。
学生通过自己讨论很自然得出药物合成的概念,所谓药物合成就是从简单易得的原料,通过一步或多步化学反应制备出比较复杂的药物分子的过程。
笔者通过ppt给学生展示一些复杂天然药物的结构,如紫杉醇、海葵毒素等,解释现今许多药物都像阿司匹林一样最初由植物中提取分离出来,再经由化学家全合成或进行改良而进一步开发成为合成药,即西药。
最后通过一个问题,“如果没有化学合成,单纯从植物中提取药物,可想而知在中药资源匮乏的今天,药物的价格将会怎么样呢?”使学生立即明确了药物合成的研究意义,也初步意识到了药物合成反应这门课程的重要性。
药物合成反应(第三版_闻韧)第三章 酰化反应

Organic Reactions for Drug Synthesis
例:抗胆碱药溴美喷酯(宁胃适)的合成
O C OH
HO CH3CH2ONa N CH3
60-80℃,45min
C-OCH2CH3 +
C OH
O C-O N CH3
O CH3Br C OH C-O N CH3 · Br CH3 (77%)
n-C4H9 CH Zn 175℃
2+
R'OH
O RCOR'
n-C4H9 n-C18H37 C COOH + H3C C
CH2 CH3
n-C18H37 C
COO C
n-C7H15 n C18H37 OH/H △ ,6min
+
n-C7H15 n-C4H9 COO C18H37-n + O H3C C CH3
Organic Reactions for Drug Synthesis
叔醇的酯化:SN1机理。
Organic Reactions for Drug Synthesis
SN1
O ' R-C-L
慢
O R-OH + R'-C
O R'-C + L O 快 R'-C-OR
SN2
O ' R-OH + R-C-L O ' + L R-O--C-R H
n-C18H37 C
n-C7H15
Organic Reactions for Drug Synthesis
3、酸酐为酰化剂
•与酸和酯作酰化剂相比,酸酐的酰化活性较强, 而且酰化反应是不可逆的。 •酰化反应过程可以被酸(硫酸等质子酸以及三氟 化硼等Lewis酸)和碱(主要为醋酸钠以及三乙胺 等有机碱)所催化。 •当酸酐难于制备时,也可采用混酸酐法。常用 的混酸酐有磺酸酐、磷酸酐和碳酸酐。
卤化反应

OH
Cl
Ar-CH CH2
HClO水中 收率较低
(有机溶剂中)
C OCl
OH -
AcOH
Ar-CH-CH2 70%
OH Cl
Ar-CH - CH2 Cl
+
Cl
t-BuOCl/ROH
Cl EtO
O
ROH EtO
O OR
EtO
O
O
NBS (N-溴代琥珀酰亚胺),NCS NBA (N-溴代乙酰胺),NCA
教材: 药物合成反应 闻韧 主编 化学工业出版社 2010年, 第3版
参考书:
【1】新编有机合成化学 黄宪 王彦广 陈振初 编 化学工业出版社 2005年
【2】基础有机化学 邢其毅 徐瑞秋 周政 编
高等教学出版社 2005年
有机反应类型按反应时键的断裂方式: 1.均裂方式: 2.异裂方式: 1)亲电反应 : 2)亲核反应: 3.协同方式
NBS/(PhCO) 2O 2 CCl4
CH 3(CH 2 )2 -CH-CH=CH-CH3 Br
(58~64%)
从机理上解释为何在亚 甲基上进行取代?
Cl2 /CCl4 N CH 3 Na2CO3 , hv N CH 2 Cl
(60%)
合成芳香酸
Ar-CH3 3Br2
水解
Ar-CBr3
Ar-COOH
HBr H2O2或光照
第二节 烃类的卤代反应 一、脂肪烃的卤取代反应
CH4
CH3Cl(g)
CH2 Cl2
CHCl3
CCl4
1、炔烃碳原子的卤取代
Ph-C CH NaOH/Br2/H2O r. t, 60 h
1. EtMgBr/Et2O C5H11-C CH 2. Br2/-32℃
药物合成教学资料 药物合成反应(第三版_闻韧)第七章_还原反应

影响多相氢化因素
a 催化剂:活性高 稳定性 不易中毒,再生 用量 Ni 10%~15%被催化物质质量 Pd/C 1%~5%被催化物质质量 Pt 0.5%~1%被催化物质质量
b 氢压 收率
a
23
催化剂钝化和中毒
抑制剂:引入少量物质使催化剂活性在某一方面 受到抑制,但经过适当的处理之后可以恢复,则 称为阻化,使催化剂阻化的物质称为抑制剂。 如Lindlar 催化剂 Pd/CaCO3 + 喹啉
(C=C取代基增多,氢化明显下降)
a
31
5.硼氢化反应
CC +B H 3
CC
CC
CC B
3
H
HB H 2
δδ
HB H 2
H3O
(饱和烃)
3 C C + B(OH)3
HH
H2O2 / NaOH H2O
C C OH(醇) H
a
32
硼氢化反应
位阻对反应的影响:
B H 3 n - B u C a H = C H 2 n - B u C H 2 C H 2 B H 2 n - B u C b H = C H 2
分类
催化氢化 多相催化氢化(d轨道Co,Rh,Pd,Pt…)H2↑
均相催化氢化(将催化剂变为络合物)两相H2↑/液相TTC
转移氢化(采用有机氢源H2NNH2·H2O
)HN NH
无机还原剂 KBH4 NaBH4
化学还原
O
有机还原剂 HC NH2
生物还原反应
O
意 义 : N O 2 N H 2 C
O H C H C C
a
2
第一节、氧化还原反应概述
• 氧化反应和还原反应共同存在 • 一个物质被氧化,另一个物质被还原
闻韧 药物合成反应 氧化反应PPT课件
环氧化机理:
此键可旋转,最终生成比较稳定的E型环氧 化合物
第75页/共133页
如:
两个较大基团在环的两侧
第76页/共133页
(氧环在位阻小的一侧形成)
第77页/共133页
PH值有影响:
第78页/共133页
2.不与羰基共轭的烯键的环氧化
O
CH3 H
CH3 + CH3CO3H
第38页/共133页
第39页/共133页
以铬试剂为基础的氧化方法
• Jones: CrO3/H2SO4/Acetone, 条件太剧烈,对酸 敏感则
•
不适用。
• Sarrat:CrO3/Py, 条件相对温和, 但催化剂制备危 险,
•
伯醇难于氧化,产物分离困难。
• Collins: CrO3/Py/CH2Cl2, 解决了伯醇氧化的问题, 分
第49页/共133页
4. Oxidation related DMSO • Swern Oxidation
第50页/共133页
第51页/共133页
Example
第52页/共133页
• Moffatt Oxidation
Moffatt 氧化中的问题: 1. 脲的除去-加入草酸。 2. 共轭醇异构化-加入三氟醋酸吡啶盐。 3. DCC/DMSO需过量-DMSO不做共溶剂, 以乙酸乙酯 代替亦可。
34 : 1
第24页/共133页
③当上述两规则有矛盾时,一般遵循(1)
CH3 H3C C CH CH2CH3 SeO2
CH2OH H3C C CH CH2CH3
④双键在环内时,双键碳上取代基较多一边的
环上烯丙位碳氢键被氧化;
药物合成 书籍

药物合成书籍
对于药物合成领域的书籍,以下是一些建议:
1. 《药物化学》(第二版)- 周有骏、王东凯、李元、李红戈著,人民卫生出版社。
2. 《药物合成反应》(第五版)- 施心路、赵建平著,化学工业出版社。
3. 《药物合成原理》(第二版)- 曾昭瑞、吴昊、赵建平著,化学工业出版社。
4. 《药物合成》(第二版)- 尤启冬著,化学工业出版社。
5. 《药物合成进展》(第四版)- 尤启冬、吴昊、王东凯著,化学工业出版社。
以上书籍都是药物合成领域的经典之作,对于初学者和有经验的从业者都有一定的帮助。
当然,也可以根据自己的需求和兴趣选择其他相关书籍进行阅读。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
COOHP,Br2
100oC
(4)CH2CHCOOCH3
干燥HBr
Et2O,t.
SOCl2
(5)CH3CH2CH2CH2CH2COOH
CH3
CCl4,65oC
(6)
S
NBA,Bz2O2
C6H6,reflux
(7)
H3CCH3
NBS,H2SO4
CH3OH,0~25oC
HH
(8)
NHCOCH3
药物合成反应药物不良反应药物合成药物不良反应杂志高原反应药物抗高原反应的药物抗高原反应药物药物的不良反应药物过敏反应药物不良反应事件
第一章卤化反应习题及答案
1.根据以下指定原料、试剂和反应条件,写出其合成反应的主要产物。
SOCl2
(1)(CH3)2NCH2CH2OH
(2)
CuCl2
CCl4,reflux
HBr
100oC,封管
(15)
P
OOBr2,△
(16)
NBS, Et3N·3HF
CH2Cl2,20oC
(17)
O
EtO
O
HBr2
CCl4,70oC
(18)
2Br2,PBr3(Cat.)
-10~0oC
1.根据以下指定原料、试剂和反应条件,写出其合成反应的主要产物。(参考答案)
题号
答案
注释
(1)
(CH3)2NCH2CH2Cl·HCl
1968:664.
(15)
Br
O O
(16)
Br
F
(17)
O
Br
EtO
HBr
(18)O
BrBr
2.在下列指定原料和产物的反应式中分别填入必需的化学试剂(或反应物)和反应条件。(参考答案)
题号
答案
注释
(1)
NBS/(PhCO)2O, CCl4,△
(2)
Br2/HgO/tetrachloroethane
(10)
O
Cl
H
BoseA.K.,etal.Tetrahedron
Lett., 1973,40:3937.
(11)
I
(12)
BrO
PhCH3
Br
In darkstate.
(13)
Cl
OH
WilsonC.E.J.Am.Chem.Soc.,
1936,58:2396.
(14)
Br
HudsonH.R.,J.Chem.Soc.B,
(9)
NBS/(PhCO)2O, CCl4, reflux
3.阅读(翻译)以下有关反应操作的原文,请在理解基础上写出:(1)此反应的完整反应式(原料、试剂和主要反应条件);(2)此反应的反应机理(历程)。(参考答案)
(翻译略)反应式:
反应机理:亲电取代(略)
(3)
1. NaNO2, HCl,H2O;2.HPF6;3.△(168℃)
(4)
Ph3P,Br2,CH3CN,△(200-340℃)
(5)
NBS/(PhCO)2O, CCl4
(6)
NaI, acetone,refluxing (10min. )
(7)
Bu3P,Br2, DMF
(8)
NBS/hv,CCl4
(2)
Cl
(3)
(CH3)2CHBrCOBr
(4)
O
BrOMe
(5)
Br
CH3CH2CH2CH2CHCOCl
(6)
CH2Br
S
(7)
BrBr
MeHMeH
MeHMeH OMeOMe
与参考答案不符!
(8)
NHAc
Br
CH3
(9)
O
Me
CH2Cl
Johnson J. R., et al. J. Org. Chem.,1964, 29:3320.
Br2,CH3COOH
50~55oC
CH3
(9)
OH
CCH2
t-BuOCl,CHCl3
50oC
CH3
O
(10)
NBS,(C6H5)3P
HO
(11)
H
KI,H3PO4
(12)
C6H5H
Br2,Cl4
10~20oC
HCOCH3
(13)CH3CHCHCH3
Ca(ClO)2
CHCOOH,HO
32
(14)(CH3)3CCH2OH
