最新版滴定液配制标定记录
滴定液配制及标定记录表模板

滴定液名称:标示浓度:配制日期:年月日配制标定依据:基准试剂名称:基准试剂来源:基准试剂批号:基准试剂含量:指示剂:标定日期:年月日天平编号:滴定管编号:室温:℃湿度:复标日期:年月日天平编号:滴定管编号:室温:℃湿度:配制记录:配制者:计算公式:TVWF=⨯式中W 为基准试剂量(mg);V 为滴定液校正后的体积(ml);T=mg/ml基准物恒重编号1234基准物第一次干燥后重(g )基准物第二次干燥后重(g )基准物第三次干燥后重(g )基准物称量编号1234称量瓶+基准物重(g)倾出基准物后称量瓶重(g)称取的基准物重W(g)滴定滴定管初读数(ml)滴定管终读数(ml)滴定液消耗体积(ml)体积校正(ml)滴定液实际消耗体积V(ml)计算:1、――――――――――――――=3、――――――――――――――=2、――――――――――――――=4、――――――――――――――=F 值平均值:――――――――――――――――――=相对偏差:%100⨯-xx x i =――――――――――――――×100%=%标定人:复核人:年月日年月日复标基准物恒重编号1234基准物第一次干燥后重(g)基准物第二次干燥后重(g)基准物第三次干燥后重(g)基准物称重编号1234称量瓶+基准物重(g)倾出基准物后称量瓶重(g)称取的基准物重W(g)滴定编号1234滴定管初读数(ml)滴定管终读数(ml)滴定液消耗体积(ml)体积校正(ml)滴定液实际消耗体积V(ml)计算:1、――――――――――――――=3、――――――――――――――=2、――――――――――――――=4、――――――――――――――=F 值平均值:――――――――――――――=相对偏差:%100⨯-xx x i =――――――――――――――×100%=%标定值(F)复标值(F)标定与复标的平均值(F)――――――――――=标定与复标的相对偏差:%标定值+复标值值标定值-复标100⨯=――――――――――――×100%=%使用期限:年月日至年月日复标者:复核者:年月日年月日。
滴定液配制与标定记录(全新经典模版)

第一次称量
第二次称量
Hale Waihona Puke 结论备注规定:连续两次干燥后称重的差异在0.3mg以下
5.标定方法
第 1 页
6标定记录
6.1 标定记录(相对平均偏差≤0.1%;)
基准物质量(g)
VNaOH(ml)
计算公式
结果(mol/l)
相对平均偏差
6.2 复标记录
基准物质量(g)
VNaOH(ml)
计算公式
结果(mol/l)
相对平均偏差
6.3 相对误差计算标定平均值与复标平均值相对偏差(应为≤0.1%):
7.最终结果
结论
该滴定液溶液的浓度为,F值为
标定人: 复标人:
滴定液配制与标定记录(一)
环境条件:温度:℃ 相对湿度:% 记录编号:NSJC/JL-JS-011
溶液名称
配制数量
配制日期
标定日期
复标日期
有效期
配制依据
1.仪器信息:
仪器名称
型号
厂家
仪器编号
2.滴定管信息:
编号
校准值
校准日期
3.试剂信息:
试剂名称
规格
批号
厂家
4. 基准物质恒重记录:
恒重温度
恒重起止时间
常见标准滴定液的配置及标定

1氢氧化钠标准滴定溶液1.1配制称取110 g氢氧化钠, 溶于100 ml无二氧化碳的水中,摇匀,注入聚乙烯容器中,密闭放置至溶液。
按表1的规定,用塑料管量取上层清液,用无二氧化碳的水稀释至1000ml,摇匀表11.2 标定按表 2 的规定称取于 105℃~110℃电烘箱中干燥至恒重的工作基准试剂邻苯二甲酸氢钾,加无二氧化碳的水溶解,加2滴酚酞指示液(10 g/L),用配制好的氢氧化钠溶液滴定至溶液呈粉红色,并保持30 s。
同时做空白试验。
表2氢氧化钠标准滴定溶液的浓度〔c(NaOH)],数值以摩尔每升(mol/ L)表示,按以下公式计算:c(NaOH)=m×1000/(V1-V2)M式中 :m —邻苯二甲酸氢钾的质量的准确数值,单位为克(g)V1—氢氧化钠溶液的体积的数值,单位为毫升(ml)V2一空白试验氢氧化钠溶液的体积的数值,单位为毫升(ml)M 一邻苯二甲酸氢钾的摩尔质量的数值,单位为克每摩尔(g/mol)=204.222 盐酸标准滴定溶液2.1 配制按表3的规定量取盐酸,注入1000ml水中,摇匀表32.2 标定按表4的规定称取于270℃~300℃高温炉中灼烧至恒重的工作基准试剂无水碳酸钠,溶于50ml水中,加10滴溴甲酚绿一甲基红指示液,用配制好的盐酸溶液滴定至溶液由绿色变为暗红色,煮沸2 min,冷却后继续滴定至溶液再呈暗红色。
同时做空白试验。
表4盐酸标准滴定溶液的浓度c(HCI)].数值以摩尔每升表示按以下公式计算C(HCl)=m ×1000/(V1-V2)M 式 中 :m 一 无水碳酸钠的质量的准确数值,单位为克(g) V1一盐酸溶液的体积的数值,单位为毫升(ml)V2一 空白试验盐酸溶液的体积的数值,单位为毫升(ml) M 一 无水碳酸钠的摩尔质量的数值,单位为克每摩尔=52.9943.重铬酸钾标准滴定溶液C(61K 2Cr 2O 7)=0.1mol/L3. 1 方法一 3. 1. 1 配制称取5g 重铬酸钾,溶于1000ml 水中,摇匀。
滴定液(标准液)配制、标定、使用管理规程

滴定液(标准液)配制、标定、使用管理规程.doc滴定液(标准液)配制、标定、使用管理规程第一章总则第一条目的为确保实验室滴定液(标准液)的准确性和稳定性,特制定本管理规程。
第二条适用范围本规程适用于实验室内所有滴定液(标准液)的配制、标定及使用管理。
第三条管理原则滴定液(标准液)的配制、标定及使用应遵循准确性、稳定性、安全性和可追溯性原则。
第二章配制管理第四条配制环境配制滴定液(标准液)应在清洁、干燥、无尘的实验室环境中进行。
第五条配制设备使用校准合格的量器、天平、磁力搅拌器等设备进行配制。
第六条配制材料使用分析纯或更高纯度的化学试剂,去离子水或蒸馏水。
第七条配制方法按照标准操作程序(SOP)进行配制,确保配制过程的准确性。
第八条配制记录详细记录配制日期、试剂批号、配制浓度、配制人等信息。
第三章标定管理第九条标定目的通过标定确保滴定液(标准液)的准确浓度。
第十条标定方法采用标准物质或已知浓度的标准液进行标定。
第十一条标定频率根据使用频率和稳定性要求,定期进行标定。
第十二条标定记录记录标定日期、标定结果、标定人等信息,并进行数据分析。
第四章使用管理第十三条使用条件滴定液(标准液)应在规定的条件下储存和使用。
第十四条使用方法严格按照操作规程使用滴定液(标准液),避免污染和误差。
第十五条使用记录记录使用日期、使用量、使用人等信息。
第十六条异常处理发现滴定液(标准液)异常时,应立即停止使用,并进行调查处理。
第五章储存管理第十七条储存条件滴定液(标准液)应储存在干燥、阴凉、避光的环境中。
第十八条储存期限根据滴定液(标准液)的稳定性,设定合理的储存期限。
第十九条储存记录记录储存日期、储存条件、有效期等信息。
第六章质量控制第二十条质量标准制定滴定液(标准液)的质量标准,并进行定期审核。
第二十一条质量检测定期对滴定液(标准液)进行质量检测,确保其稳定性和准确性。
第二十二条质量记录记录质量检测结果,并进行数据分析。
滴定液的配制与标定

滴定液的配制与标定0.1mol/L 氢氧化钠滴定液的配制与标定【配制】取氢氧化钠40.00g ,加水1000ml 振摇使溶解成饱和溶液,冷却后,置聚乙烯塑料瓶中,静置数日,澄清后备用。
取澄清的氢氧化钠饱和溶液5.6ml ,加新沸过的冷水使成1000ml,摇匀。
【标定】取在105C干燥至恒重的基准邻苯二甲酸氢钾约0.6g,精密称定,加新沸过的冷水50ml,振摇,使其尽量溶解;加酚酞指示液2 滴,用本液滴定;在接近终点时,应使邻苯二甲酸氢钾完全溶解,滴定至溶液显粉红色。
每1ml 氢氧化钠滴定液(0.1mol/L) 相当于20.42mg的邻苯二甲酸氢钾。
根据本液的消耗量与邻苯二甲酸氢钾的取用量,算出本液的浓度,即得。
如需用氢氧化钠滴定液(0.05mol/L 、0.02mol/L 或0.01mol/L) 时,可取氢氧化钠滴定液(0.1mol/L) 加新沸过的冷水稀释制成。
必要时,可用盐酸滴定液(0.05mol/L 、0.02mol/L 或0.01mol/L) 标定浓度【贮藏】置聚乙烯塑料瓶中,密封保存;塞中有2 孔,孔内各插入玻璃管1 支,1 管与钠石灰管相连,1 管供吸出本液使用。
0.1mol/L、0.2mol/L、0.5mol/L 和 1.0mol/L 氢氧化钠标准溶液配制与标定一、配制:将氢氧化钠配成饱和溶液,注入塑料桶中密闭放置至溶液清亮,使用前以塑料管虹吸上层清液。
浓度氢氧化钠饱和溶液注入不含CO2的水0.1mol/L量取5ml1000中摇匀0.2mol/L 量取10ml1000 中摇匀0.5mol/L 量取26ml1000 中摇匀1.0mol/L 量取52ml1000 中摇匀二、标定:1、原理:KHC8H4O4 +NO出KNaC8H4O4 + H2O酸式酚酞碱式酚酞HIn —In -+H+(无色)(红色)酚酞为一有机弱酸,在酸性溶液中为无色,当碱色离子增加到一定浓度时,溶液即呈粉红色。
2、仪器:滴定管50ml;三角瓶250ml。
滴定液配制标定及复标记录

编号:REG-ZL-0003-00
名称: 第页
标示浓度: mol/L 配制标定依据:《中华人民共和国兽药典》2005年版一部附录 页
基准试剂名称: 基准试剂来源: 基准试剂批号:
指示液名称:
标定
日期: 年 月 日
天平型号/编号:
滴定管编号:
室温: ℃
复标
日期: 年 月 日
天平型号/编号:
使用期限: 年 月 日 至 年 月 日
标定者: 复标者:
滴定管编号:
室温: ℃
配制记录:
配制日期 年 月 日 配制者:
计算公式:F= 式中W为基准试剂量(mg);V为滴定液校正体积(ml), T= mg
标定基准物称量、滴定记录
编号1234称量瓶+基准物重(g)
称量瓶+基准物重(g)
称量瓶重(g)
基准物重W(g)
滴定管初读数(ml)
滴定管终读数(ml)
滴定液体积(ml)
2、―――――――― ――――――――――= 4、―――――――― ――――――――――=
F值平均值( ):――――――――――――――――――――=
相对平均偏差: =
标定值(F)
复标值(F)
标定与复标的平均值(F)
――――――――――=
标定与复标的相对偏差:
=――――――― ―――――×100% = %
第页
复标基准物称量、滴定记录
编号
1
2
3
4
称量瓶+基准物重(g)
称量瓶+基准物重(g)
称量瓶重(g)
基准物重W(g)
滴定管初读数(ml)
滴定管终读数(ml)
滴定液体积(ml)
标准溶液的配置标定记录

标准溶液的配置标定记录氢氧化钠标准滴定溶液的配置滴定记录① 配制:将氢氧化钠配成饱和溶液,注入塑料桶中密闭放置至溶液清亮,使用时用塑料管虹吸上层清液。
氢氧化钠标准溶液:量取毫升氢氧化钠饱和溶液,注入毫升不含二氧化碳的水中,摇匀。
② 标定:称取克于105℃--110℃电烘箱中干燥至恒重的工作基准试剂邻苯二甲酸氢钾,称准至0.0002克。
溶于毫升不含二氧化碳的水中,加2滴1酚酞指示液,用氢氧化钠溶液滴定至溶液呈粉红色,并保持30s。
同时做空白试验。
③ 计算:氢氧化钠标准滴定溶液的浓度[c(NaOH)],数值以摩尔每升(mol/L)表示,按下列公式计算:c(NaOH)=m 1000(V1 V2)M式中:m-----邻苯二甲酸氢钾的质量的准确数值,单位为克(g); V1----氢氧化钠溶液的体积的数值,单位为毫升(mL); V2---空白试验氢氧化钠溶液的体积的数值,单位为毫升(mL);M----邻苯二甲酸氢钾的摩尔质量的数值,单位为克每摩尔(g/mol)[M(*****4)= 204.22 ]容量分析原始记录检验:审核:检验日期:① 配制:盐酸标准溶液,量取毫升盐酸,注入毫升水中。
② 标定:称取克于270℃--300℃高温炉中灼烧至恒重的工作基准试剂无水碳酸钠,称准至0.0002克。
,溶于50mL水中,加10滴溴甲酚绿一甲基红指示液,用配制好的盐酸溶液滴定至溶液由绿色变为暗红色,煮沸2min,冷却后继续滴定至溶液再呈暗红色,同时做空白试验。
③ 计算:盐酸标准滴定溶液的浓度[c(HCl)]数值以摩尔每升(mol/L)表示,按下列公式计算:c(HCl)=m 1000(V1 V2)M式中:m----无水碳酸钠的质量的准确数值,单位为克(g) V1---盐酸溶液的体积的数值,单位为毫升(mL)V2---空白试验盐酸溶液的体积的数值,单位为毫升(mL) M---无水碳酸钠的摩尔质量的数值,单位为克每摩尔(g/mol)[M (12 Na2CO3)=52.994]容量分析原始记录检验:审核:检验日期:① 配制:硫酸标准溶液,量取毫升硫酸,注入毫升水中。
滴定液配制与标定记录

滴定液配制与标定记录
编号:
滴定液名称:
配制及标定依据:配置批号:
配
制
过
程
配制人:配制日期:
基准
试剂
恒重
基准试剂:恒重温度(℃):
称量瓶第一次
干燥后重量(g)
称量瓶第二次
干燥后重量(g)
称量瓶+基准试剂
第一次干燥后重量(g)
称量瓶+基准试剂
第二次干燥后重量(g)
标
定
过
程
标定温度(℃):湿度(%):
基准试剂恒重后称重W(g):
(1) (2)(3)
消耗滴定液体积V(ml):
(1) (2)(3)
计算公式:
计算结果(mol/L):
(1)
(2)
(3)
相对偏差:
(1)பைடு நூலகம்
(2)
(3)
初标浓度(mol/L):
标定温度(℃):湿度(%):
基准试剂恒重后称重W(g):
(1)(2)(3)
消耗滴定液体积V(ml):
(1) (2)(3)
计算公式:
计算结果(mol/L):
(1)
(2)
(3)
相对偏差:
(1)
(2)
(3)
复标浓度(mol/L):
初标人:初标日期:
复标人:复标日期:
结
论
初标与复标之间的相对偏差:
滴定液浓度(mol/L):
复核人:
复核日期:
有效期:
标准溶液‘配制’及‘标定’原始记录【范本模板】
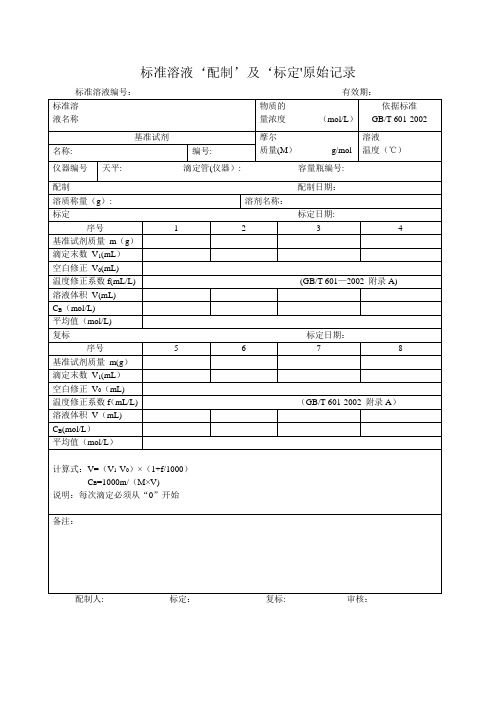
标准溶液‘配制’及‘标定'原始记录配制人: 标定:复标: 审核:标准物质配制(标定)记录编号: CHEC/QBG-075名称:、配制方法:使用天平型号编号室温℃、湿度%RH 配制:取定溶mL 标定:取份:⑴⑵⑶⑷用溶液滴定,滴定消耗量(mL) V1= 、V2= 、V3= 、V4= 、V0= 。
标准溶液浓度计算公式:C=计算结果():C1= C2= C3= C4= C =相对偏差(%):S1= S2= S3= S4=备注:.配制人:复核人:配制日期:年月日有效期年月日标准溶液配制记录编号: CHEC/QBG—147标准溶液名称:规格:配制方法:仪器名称:溯源标准:温度: ℃、湿度:%RH标准溶液拟配浓度:配制或稀释过程:配制日期:年月日有效期:年月日配制人:复核人:0。
1mol/L盐酸标准滴定溶液的标定编号:JL/LJ-001-01一、标定方法:GB/T5009。
1-2003二、使用仪器:AEL—200电子天平(仪器编号:JYB001)马弗炉(仪器编号:JYC009)三、操作1、量取9ml盐酸,加适量水并稀释至1000ml。
混匀,待标定.2、标定:精密称取约0.15g在270~300℃干燥至恒量的基准无水碳酸钠,加50ml水使之溶解,加10滴溴甲酚绿-甲基红混合指示液,用本溶液滴定至溶液由绿色转变为紫红色,煮沸2min,冷却至室温,继续滴定至溶液由绿色变为暗紫色.四、记录和结果1、计算公式:c(HCl)=m/[(V1-V2)×0。
0530]0。
0530……与1.00ml盐酸标准滴定溶液[c(HCl)=1mol/L]相当的基准无水碳酸钠的质量,g配制人: 复核人:配制日期:复核日期:标准溶液(滴定液)管理工作的基本要求关键词(必填项目):标准溶液、滴定液目的(必填项目):对标准溶液的使用等制定统一的要求,便于统一的管理.背景知识(选填项目):无。
原理(选填项目):无主体内容(操作步骤,必填项目):1 内容1.1 标准溶液的配制1.1。
滴定液的配制与标定

0.1mol/L氢氧化钠滴定液的配制与标定【配制】取氢氧化钠40.00g,加水1000ml振摇使溶解成饱和溶液,冷却后,置聚乙烯塑料瓶中,静置数日,澄清后备用。
取澄清的氢氧化钠饱和溶液5.6ml,加新沸过的冷水使成1000ml,摇匀。
【标定】取在105℃干燥至恒重的基准邻苯二甲酸氢钾约0.6g,精密称定,加新沸过的冷水50ml,振摇,使其尽量溶解;加酚酞指示液2滴,用本液滴定;在接近终点时,应使邻苯二甲酸氢钾完全溶解,滴定至溶液显粉红色。
每1ml氢氧化钠滴定液(0.1mol/L) 相当于20.42mg的邻苯二甲酸氢钾。
根据本液的消耗量与邻苯二甲酸氢钾的取用量,算出本液的浓度,即得。
如需用氢氧化钠滴定液(0.05mol/L、0.02mol/L或0.01mol/L)时,可取氢氧化钠滴定液(0.1mol/L)加新沸过的冷水稀释制成。
必要时,可用盐酸滴定液(0.05mol/L、0.02mol/L或0.01mol/L)标定浓度【贮藏】置聚乙烯塑料瓶中,密封保存;塞中有2孔,孔内各插入玻璃管1支,1管与钠石灰管相连,1管供吸出本液使用。
0.1mol/L、0.2mol/L、0.5mol/L和1.0mol/L氢氧化钠标准溶液配制与标定一、配制:将氢氧化钠配成饱和溶液,注入塑料桶中密闭放置至溶液清亮,使用前以塑料管虹吸上层清液。
浓度氢氧化钠饱和溶液注入不含CO2的水0.1mol/L量取5ml1000中摇匀0.2mol/L量取10ml1000中摇匀0.5mol/L量取26ml1000中摇匀1.0mol/L量取52ml1000中摇匀二、标定:1、原理:KHC8H4O4+NOH→KNaC8H4O4+H2O酸式酚酞碱式酚酞HIn→In-+H+(无色)(红色)酚酞为一有机弱酸,在酸性溶液中为无色,当碱色离子增加到一定浓度时,溶液即呈粉红色。
2、仪器:滴定管50ml;三角瓶250ml。
3、标定过程0.1mol/LNOH标准溶液称取0.4-0.6克;0.2mol/L称1-1.2克;0.5mol/L称取3克于105-110℃烘至恒重的苯二甲酸氢钾,称准至0.0002克,分别溶于50ml;80ml不含二氧化碳水中,加2滴1%酚酞指示剂,用配好的待标定溶液至溶液呈粉红色与标准色相同。
硝酸银滴定液配制、标定记录

第二次称量
称量瓶
g
g
称量瓶+样
g
g
用减重法分取四分:ag;bg;cg;dg.各加水ml使溶解,再加糊精溶液(1→50)ml,碳酸钙g与荧光黄指示液滴,用本液滴定至浑浊液由色变为色。消耗本液体积分别为aml;bml;cml;dml.〔每1ml硝酸银滴定液(0.1mol/L)相当于5.844mg的氯化钠〕
Ca=---------------------------------------=mol/L
Cb=---------------------------------------=mol/L
Cc=---------------------------------------=mol/L
Cd=---------------------------------------=mol/L
=---------------------------------------=mol/L
相对平均偏差(%)=-------------------------------×100%= %
F=-----------=
相对偏差%
标定浓度
配制人:
标定人:
复核人:
标准液(滴定液)配制、标定记录
配液名称
硝酸银滴定液
浓度
mol/L
配制日期
年月日
标定日期
年月日
配制总量
ml
使用截止日期
年月日
所用试剂
碳酸钙、荧光黄指示液等
基准试剂
基准氯化钠
【配制】称取硝酸银g,置烧杯中,加水适量使溶解,移至1ห้องสมุดไป่ตู้00ml容量瓶中,加水至刻度,摇匀,即得。
标准溶液配置记录表

第 页
标准溶液名称: 规定浓度: 配 制
计算公式:
20℃时的标准溶液浓度:
mol/L 配制方法: 试中:
mol/L
标 定
序 号 标定人(1): 1 标定时温度: 2 3 ℃ 4 标定人(2): 5 标定时温度 8 ℃
6
7
标准物质质量 m(g) 待标溶液用量V1(mL) 温度补正值(mL) 滴定管补正值(mL) 空白滴定用量V0(mL)
配制日期:年月源自日有效期:注:标准溶液浓度以标定结果为准。注意控制配制溶液浓度与规定浓度相对误差≤5%;当溶液出现浑浊、沉淀、颜色变化等现象时禁止使用。
第
页
待标溶液补正到20℃时 空白溶液补正到20℃时
计算结果 平均值(单位) 总平均值(单位) 测定结果极差 总极差
每人四平行测定结果极差的相对值不得大于重复性临界极差CrR95(4)的相对值0.15%,两人共八平行测定结果极差的相对值不得大于重复性临界极差 CrR95(8)的相对值0.18% 。如不符合,重新标定。取两人 八平行测定结果的平均值为测定结果。在运算过程中保留五位有效数字,浓度值报出结果 取四位有效数字。
标准溶液配制标定记录

溶液名称:
最终浓度:
配制时间:
配制方法:
标定方法:
配制人:
有效期限:
基准物质名称:
称取样重W= W1-W2g
滴定消耗标准溶液体积mL
滴定管校正值mL
校正为20℃时滴定消耗标准溶液体积mL
溶液浓度Cmol/L
溶液平均浓度Cmol/L
标定人:
复核记录
平行样序号
1
2
3
4
相对极差
第一次称量W1g
第二次称量W2g
称取样重W= W1-W2g
滴定消耗标准溶液体积mL
滴定管校正值mL
校正为20℃时滴定消耗标准溶液体积mL
基准物质批号:
加热仪器名称:
加热后基准物质量:g
滴定管检定编号:
仪器型号:
恒重基准物质量:g
温度计检定编号:
仪器编号:
计量仪器名称:
标准溶液温度:℃
仪器温度设定:℃
仪器型号:
温度补正值:
空白消耗标准溶液体积:mL
仪器编号:
标定时环境温度:℃
标定记录
平行样序号
1
2
3
4
相对极差
第一次称量W1g
第二次称量W2g
溶液浓度Cmol/L
溶液平均浓度Cmol/L
复核人:
备注:
edta标准溶液的配制和标定数据记录

edta标准溶液的配制和标定数据记录 EDTA(乙二胺四乙酸)是一种常用的配位试剂,广泛应用于化学分析和环境监测等领域。
为了准确测定目标物质的含量,必须配制和标定EDTA标准溶液。
本文将详细描述EDTA标准溶液的配制过程和标定数据记录方法,以期为读者提供准确、可靠的实验结果。
一、EDTA标准溶液的配制1. 根据实验需求确定所需浓度和体积。
2. 准备清洁、干燥的容器,精确称量所需质量的EDTA固体。
注:应使用分析纯的EDTA以确保溶液的纯度和精确度。
3. 将EDTA固体加入容器中,加入适量的去离子水溶解,定容至所需体积。
注:在溶解过程中应充分搅拌,确保EDTA充分溶解并均匀分布。
二、EDTA标准溶液的标定1. 标定前的准备工作:a. 清洁、干燥容器,准备所需量的标定溶液。
b. 根据实验需求,选择相应的指示剂和溶剂。
c. 准备一定浓度的化学指示剂溶液(例如:钙碳酸盐指示剂等)。
d. 准备一定浓度的酸溶液(例如:0.1 mol/L盐酸溶液)用于调节溶液的pH值。
e. 清洁、干燥滴定管和滴定管架。
2. 标定过程: a. 取一定体积的待测样品(例如:10 mL)加入滴定瓶中。
b. 加入适量的酸溶液调节待测样品的pH值。
确保待测样品中没有其他影响滴定反应的离子。
c. 加入一定体积的化学指示剂溶液,使其与待测样品反应产生可观察的颜色变化。
d. 使用滴定管分次向待测样品中滴定EDTA标准溶液,直至颜色变化,记录滴定所用的EDTA标准溶液的体积(V1)。
e. 等颜色变化稳定后,再缓慢滴定,直到颜色消失,记录滴定所需的EDTA标准溶液的体积(V2)。
f. 重复上述滴定步骤2-3次,计算平均用量,提高测量结果的准确性。
三、标定数据记录 1. 记录待测样品用量、酸溶液浓度、化学指示剂体积以及EDTA 标准溶液滴定数据。
例如:待测样品用量:10 mL,酸溶液浓度:0.1 mol/L,化学指示剂体积:2 mL,EDTA标准溶液滴定体积:V1 = 8.5 mL,V2 = 12.3 mL。
盐酸滴定液(0.1mol/L)配制及标定记录
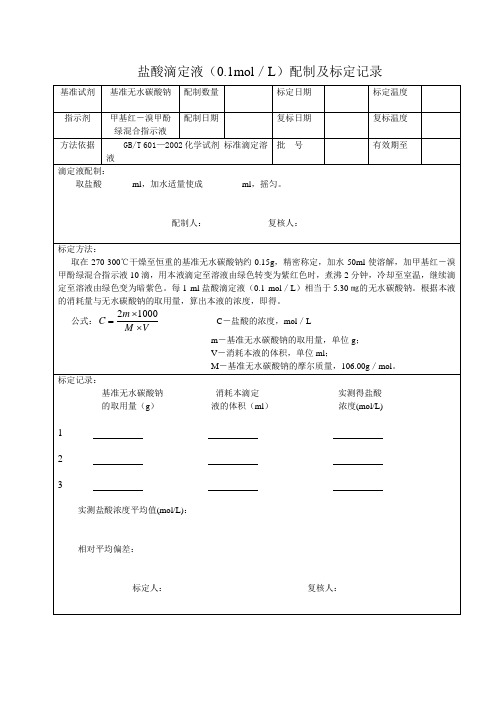
基准试剂
基准无水碳酸钠
配制数量
标定日期
标定温度
指示剂
甲基红-溴甲酚绿混合指示液
配制日期
复标日期
复标温度
方法依据
GB/T 601—2002化学试剂 标准滴定溶液
批号
有效期至
滴定液配匀。
配制人:复核人:
标定方法:
取在270-300℃干燥至恒重的基准无水碳酸钠约0.15g,精密称定,加水50ml使溶解,加甲基红-溴甲酚绿混合指示液10滴,用本液滴定至溶液由绿色转变为紫红色时,煮沸2分钟,冷却至室温,继续滴定至溶液由绿色变为暗紫色。每1ml盐酸滴定液(0.1mol/L)相当于5.30㎎的无水碳酸钠。根据本液的消耗量与无水碳酸钠的取用量,算出本液的浓度,即得。
相对平均偏差:_____________________________________
标定人:复核人:
复标记录:
基准无水碳酸钠消耗本滴定实测得盐酸
的取用量(g)液的体积(ml)浓度(mol/L)
1
2
3
实测盐酸浓度平均值(mol/L):________________
相对平均偏差:________________________________
公式: C-盐酸的浓度,mol/L
m-基准无水碳酸钠的取用量,单位g;
V-消耗本液的体积,单位ml;
M-基准无水碳酸钠的摩尔质量,106.00g/mol。
标定记录:
基准无水碳酸钠消耗本滴定实测得盐酸
的取用量(g)液的体积(ml)浓度(mol/L)
1
2
3
实测盐酸浓度平均值(mol/L):_________________
标准滴定溶液的配制与标定

标准滴定溶液的配制与标定一、乙二胺四乙酸二钠标准滴定溶液1、配制按表1的规定量称取乙二胺四乙酸二钠,加1000mL 水,加热溶解,冷却,摇匀。
表1乙二胺四乙酸二钠标准滴定溶液的浓度[c(EDTA)]/(mol/L)乙二胺四乙酸二钠的质量m/g0.1400.05200.0282、标定(1)乙二胺四乙酸二钠标准滴定溶液[c(EDTA)=0.1mol/L]、[c(EDTA)=0.05mol/L]按表2的规定量称取于800℃±50℃的高温炉中灼烧至恒重的工作基准试剂氧化锌,用少量水湿润,加2mL 盐酸溶液(20%)溶解,加100mL 水,用氨水溶液(10%)调节溶液pH 至7~8,加10mL 氨-氯化铵缓冲溶液甲(pH ≈10)及5滴铬黑T 指示液(5g/L ),用配制好的乙二胺四乙酸二钠溶液滴定至溶液由紫色变为纯蓝色。
同时做空白试验。
表2乙二胺四乙酸二钠标准滴定溶液的浓度[c(EDTA)]/(mol/L)工作基准试剂氧化锌的质量m/g0.10.30.050.15乙二胺四乙酸二钠标准滴定溶液的浓度[c(EDTA)],数值以摩尔每升(mol/L )表示,按式(1)计算:c(EDTA)= (1)m ×1000(V 1‒V 2)M 式中:m —氧化锌的质量的准确数值,单位为克(g );V 1—乙二胺四乙酸二钠溶液的体积的数值,单位为毫升(mL );V 2—空白试验乙二胺四乙酸二钠溶液的体积的数值,单位为毫升(mL );M —氧化锌的摩尔质量的数值,单位为克每摩尔(g/mol )[M(ZnO)=81..39]。
(2) 乙二胺四乙酸二钠标准滴定溶液[c(EDTA)=0.02mol/L]称取0.42g 于800℃±50℃的高温炉中灼烧至恒重的工作基准试剂氧化锌,用少量水湿润,加3mL 盐酸溶液(20%)溶解,移入250mL 容量瓶中,稀释至刻度,摇匀。
取35.00mL ~40.00mL ,加70mL 水,用氨水溶液(10%)调节溶液pH 至7~8,加10mL 氨-氯化铵缓冲溶液甲(pH ≈10)及5滴铬黑T 指示液(5g/L ),用配制好的乙二胺四乙酸二钠溶液滴定至溶液由紫色变为纯蓝色。
滴定液配制标定操作规程及记录

有效期
3个月
配制日期
年月日
配制人
配制方法
取乙二胺四醋酸二钠19g,加适量的水使溶解成1000ml,摇匀。
标定方法
标定物名称:基准氧化锌处理条件:约800℃灼烧至恒重
步骤:取于约800℃灼烧至恒重的基准氧化锌约0.12g,精密称定,加稀盐酸3ml使溶解,加水25ml,加0.025%甲基红的乙醇溶液1滴,滴加氨试液至溶液显微黄色,加水25ml与氨-氯化铵缓冲液(pH10.0)10ml,再加铬黑T指示剂少量,用本液滴定至溶液由紫色变为纯蓝色,并将滴定的结果用空白试验校正。每1ml乙二胺四醋酸二钠滴定液(0.05mol/L)相当于4.069mg的氧化锌。
2.相对平均偏差d = ×100%
要求:1.校正因子应为0.95~1.05
2.相对偏差应≤0.1%
初标记录
i
邻苯二甲酸氢钾重Wi(g)
消耗滴定液
体积Vi(ml)
校正因子Fi
校正因子
平均值Fa
相对平均偏差d(%)
1
2
3
初标日期
年月日
初标人
复标记录
i
邻苯二甲酸氢钾重Wi(g)
消耗滴定液
体积Vi(ml)
校正因子Fi
步骤:取在105℃干燥至恒重的基准邻苯二甲酸氢钾约0.16g,精密称定,加无水冰醋酸20ml使溶解,加结晶紫指示液1滴,用本液缓缓滴定至蓝色,并将滴定的结果用空白试验校正。每1ml高氯酸滴定液(0.1mol/L)相当于20.42mg的邻苯二甲酸氢钾。
计算:1.校正因子F =(W×1000)/(V×20.42)
计算:1.校正因子Fi=(Wi×1000)/(Vi×4.069)
滴定液配制、标定及复标记录
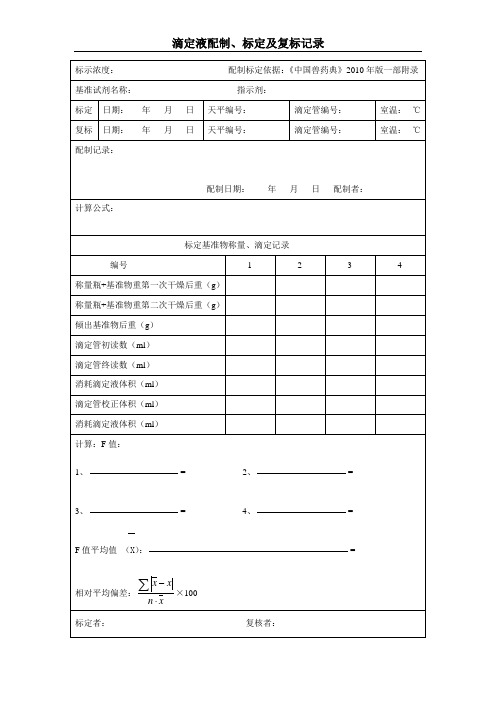
标示浓度:配制标定依据:《中国兽药典》2010年版一部附录
基准试剂名称:指示剂:
标定
日期:年月日
天平编号:
滴定管校正体积(ml)
消耗滴定液体积(ml)
计算:F值:
1、 = 2、 =
3、 = 4、 =
F值平均值(X): =
相对平均偏差: ×100
标定者:复核者:
复制标基准物称量、滴定记录
编号
1
2
3
4
称量瓶+基准物重第一次干燥后重(g)
称量瓶+基准物重第二次干燥后重(g)
倾出基准物后重(g)
滴定管初读数(ml)
滴定管编号:
室温:℃
复标
日期:年月日
天平编号:
滴定管编号:
室温:℃
配制记录:
配制日期:年月日配制者:
计算公式:
标定基准物称量、滴定记录
编号
1
2
3
4
称量瓶+基准物第一次干燥后重(g)
称量瓶+基准物重第二次干燥后重(g)
倾出基准物后重(g)
滴定管初读数(ml)
滴定管终读数(ml)
消耗滴定液体积(ml)
滴定管终读数(ml)
消耗滴定液体积(ml)
滴定管校正体积(ml)
消耗滴定液体积(ml)
计算:F值:
1、 = 2、 =
3、 = 4、 =
F值平均值( ): =
相对平均偏差: ×100%=
标定值(F)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
滴定液配制及标定记录
5、计算公式:
□.C= C= □.C1= C1=
上式中:C为待标滴定液的浓度,mol/L, M为基准物称样量,g;
c为预标定液的预配浓度,mol/L; V为滴定中本滴定液的用量,ml; T为滴定度,mg/ml。
上式中:C1为待标滴定液的浓度,mol/L; V1为消耗本滴定液的用量,ml; C2为已知滴定液的浓度,mol/L; V2为已知滴定液的体积,ml。
6、滴定液的标定:
第一人标定温度:℃相对湿度 %
编号0(空白) 1 2 3 取样量□M(g)□ V (ml)
滴定管起始读数(ml)
滴定管终点读数(ml)
实际消耗滴定液体积V(ml)
滴定液标定浓度C(mol/L)
滴定液平均浓度⎺C1F值
相对平均偏差标定人/日期
第二人标定温度:℃相对湿度 %
编号0(空白) 1 2 3 取样量□M(g)□ V (ml)
滴定管起始读数(ml)
滴定管终点读数(ml)
实际消耗滴定液体积V(ml)
滴定液标定浓度C(mol/L)
滴定液平均浓度⎺C2F值
相对平均偏差标定人/日期
6、最终浓度计算:
C=C= mol/L
F值两人标定相对偏差d= % 本滴定液的最终标定浓度为 mol/L。
标定人:复核人:
年月日年月日。
