标准滴定溶液配制及标定原始记录 (2)
标准溶液的配置及标定方法

标准溶液的配置及标定方法1、0.1moL/L 氢氧化钠的配制及标定(1) 配制:将氢氧化钠配制成饱和溶液(约为52%),贮存于乙烯塑料瓶内,密闭放置数日,使碳酸钠沉淀。
小心吸取8.2mL上清液,加无二氧化碳的纯水稀释为1000mL。
(2)标定:准确称取0.5~0.6g于105~110℃烘干至恒重的基准邻苯二甲酸氢钾,共称三份。
分别置于250mL三角瓶内,加入不含二氧化碳的纯水使邻苯二甲酸氢钾溶解。
加2滴1%酚酞指示剂溶液,用0.1moL/L氢氧化钠溶液滴定至溶液显淡粉红色,即到终点。
同时作空白。
按下式计算氢氧化钠溶液的准确浓度:C=m×1000/(V-V)×204.22 21式中:C-----氢氧化钠溶液的浓度,moL/L;m----邻苯二甲酸氢钾质量,g;V----滴定邻苯二甲酸氢钾氢氧化钠用量,mL;1V----空白试验氢氧化钠用量,mL;2204.22--邻苯二甲酸氢钾的式量。
(3)贮存于塑料瓶中,如需要其它浓度的氢氧化钠溶液,可取浓氢氧化钠溶液照上法稀释后标定,或直接以0.1moL/L标准溶液稀释即得。
2、0.1moL/L盐酸标准溶液配制及标定(1)配制:量取9mL浓盐酸,用纯水稀释为1000mL,混匀。
此溶液的浓度为0.1moL/L。
(2)标定:准确称取0.15~0.2g于270~300℃灼烧至恒重的基准无水碳酸钠。
共称三份,分别于250mL三角烧瓶中,各加50mL纯水使之溶解,加1~2滴甲基橙指示剂,用上述盐酸滴定至溶液由黄色变为橙色。
同时作空白试验。
按下式计算HCL溶液的准确浓度:C= 2m×1000/(V-V)*M21 1式中:C-----盐酸溶液的浓度,moL/L;m---无水碳酸钠的质量,g;V---滴定碳酸钠消耗的盐酸溶液体积,mL;1V---空白试验消耗盐酸的体积,mL;2M(106.0)--碳酸钠的式量。
3、0.02moL/L乙二胺四乙酸二钠标准溶液配制及标定(1)配制:称取7.5g乙二胺四乙酸二钠(即EDTA—2Na),溶于纯水中,并稀释为1000mL,摇匀即得。
标准溶液(滴定液)管理规程

1.目的:建立一个药品分析化验室标准溶液管理规程,保证检验工作质量。
2.范围:药品分析用标准溶液。
3.责任:标准溶液配制人、复核人、中心化验室负责人。
4.内容:4.1 标准溶液的配制要求和配制前准备工作◆定义:标准溶液系指已知标准浓度的溶液,用来滴定被测物质。
●标准溶液化验室要求:应设在避光房间,室内阴凉、通风良好。
室内须空调设施,温湿度保持恒定,一般控制在20±5℃,相对湿度50-75%。
◆配制前准备工作●所有品种均有批准的试剂配制操作规程,严格执行标准操作规程。
●配制前:首先检查所领试剂的瓶签完好、包装完整、封口严密、无污染,在规定的使用期内,符合其规格要求。
●试剂恒重。
基准试剂在存放期间可能吸湿,配制前必须严格干燥至恒重。
恒重操作按《中国药典》(2010年版)执行。
●称重●称重是决定所配试剂准确性的关键步骤,必须准确无误。
●天平的称量范围及精度必须与所称样品要求相符,必须有计量部门签发的计量合格证,且在规定的期限内。
●称量样品所放的容器及所有操作过程所用容器均须洁净、无污迹、无残留物。
4.2 标准溶液的配制◆滴定液应由专人配制及标定,标定工作宜在要求下进行,并应在记录中注明标定时的室内温度。
◆标定用玻璃仪器必须是校验合格的玻璃仪器(A级),所用试剂为基准物质或优级纯物质。
◆标定中,滴定液宜从滴定管的起始刻度开始;滴定液的消耗量,除另有特殊规定外,应大于20ml,读数应估计到0.01ml。
◆标定工作应由初标者(一般为配制者)和复标者在相同条件下各作平行试验3份;各项原始数据经校正后,根据计算公式分别进行计算;3份平行试验结果的相对平均偏差,除另有规定外不得大于0. 1%;初标平均值和复标平均值的相对偏差也不得大于0. 1%,标定结果按初、复标的平均值计算,取4位有效数字;标定值应在名义值的±5%之间◆配好的标准溶液须放在与溶液性质相适应的洁净瓶中,贴好状态标记。
◆复核后合格的标准液须贴上标签。
实验二 酸碱标准溶液的配制与标定

实验二酸碱标准溶液的配制与标定一、实验目的:1.掌握间接法配制HCl、NaOH标准溶液的方法。
2. 熟练掌握差减称量法称取基准物的方法及滴定操作基本技能。
3.学习酸碱标准溶液的标定方法。
二、实验原理:在酸碱滴定法中,常用到盐酸或氢氧化钠标准溶液,它们都不宜直接配制,因为浓盐酸易挥发,浓度和纯度不一,固体氢氧化钠中常因吸收空气中的二氧化碳和水蒸气,而含有碳酸钠和水分,因此,只能先将它们配制成近似浓度的溶液。
然后通过标定来确定它们的准确浓度。
1.标定盐酸的基准物质:硼砂Na2B4O7·10H2O和无水碳酸钠Na2CO3。
(1)硼砂(四硼酸钠,Na2B4O7·10H2O):易制得纯品,不易吸水,性质比较稳定,而且摩尔质量较大(381.37g/mol),称量误差小,是标定HCl溶液常用的基准物质,但硼砂易风化失水,需保存在相对湿度为60%密闭容器中。
1︰2反应,其标定反应为:Na2B4O7·10H2O + 2HCI =2NaCI + 4H3BO3 + 5H2O 在化学计量点时,由于生成的硼酸是弱酸,溶液pH=5.1,可用甲基橙作指示剂。
(2)无水碳酸钠(Na2CO3):容易制得纯品,摩尔质量为105.99g/mol,但易吸湿,使用前应在3000C干燥1小时,保存在干燥器中,用时称量要快,以免吸水而引入误差。
1︰2反应,其标定反应为:Na2CO3 + 2HCI =2NaCI + CO2+ H2O计量点时,溶液pH =3.9,可用甲基红作指示剂。
本实验采用的方法是:称取硼砂后直接用盐酸滴定的方法进行操作,根据所称硼砂的质量和滴定所用盐酸溶液的体积,求出盐酸溶液的准确浓度。
2.标定氢氧化钠的基准物质:邻苯二甲酸氢钾和草酸。
(1)邻苯二甲酸氢钾(KHC8H4O4):易制得纯品,在空气中不吸水,易保存,且摩尔质量较大(204.23g/mol),称量误差小,是标定NaOH溶液较为理想的基准物质。
实验二 盐酸标定溶液的配制和标定

实验二 盐酸标准溶液的配制和标定,NaOH 溶液浓度的测定一、原理首先配制约0.1mol/L 的盐酸溶液,然后以甲基橙作指标剂,用已知准确浓度的22CO Na 标准溶液来标定盐酸的准确浓度。
利用此HCl 溶液测定NaOH 溶液的浓度。
↑+++22222CO O H NaCl CO Na二、试剂22CO Na 基准物:分析纯; 浓盐酸(比重1.19,):分析纯; 0.1%甲基橙:称取0.1g 甲基橙,溶于100mL 蒸馏水中。
三、测定步骤(一)22CO Na 标准溶液的配制——直接法在分析天平上,用差减法称取22CO Na 约1.2g~1.4g (准确至0.0001g )于小烧杯中,加入约50mL 蒸馏水,用玻璃棒搅拌,使其完全溶解,然后全部转移到250mL 容量瓶中,用水稀释到刻度。
盖好瓶塞,摇匀。
NaCO3m 1000C M V⨯=(mol/L ) 式中: m ——22CO Na 的重量(g ) M ——22CO Na 的分子量;V ——22CO Na 的溶液的体积,即容量瓶的体积(mL ) (二)0.1mol/L HCl 溶液的配制及标定——间接法 HCl 溶液的配制:用小量筒量取浓盐酸约4.5mL 于500mL 清洁的试剂瓶,加蒸馏水至500mL 。
HCl 溶液浓度的标定:用移液管准确吸取25.00mL 已知准确浓度的22CO Na 溶液于250ml 锥形瓶中,加入甲基橙指标剂两滴,用HCl 溶液滴定至溶液颜色由黄色变为橙红色且摇动不消失即为滴定终点,记录滴定管的终点读数,终点读数与起始读数之差,即为滴定所用HCl 溶液的体积。
平行做三份,滴定的相对平均偏差不应超过0.2%。
(三)NaOH溶液的浓度的测定取25.00mlNaOH溶液三份分别置于250ml锥形瓶中,加入1~2滴甲基橙指示剂,用HCl标准溶液滴定至橙色即为终点。
滴定的相对平均偏差不应超过0.2%。
四、原始数据及数据处理1.HCl溶液浓度的计算2.NaOH溶液浓度的计算(要计算结果的平均值及相对平均偏差)请大家注意,做《HCl溶液的配制、标定及测定NaOH浓度》这个实验时,要求一个大桌四个组的数据(NaOH浓度,4*3=12个)集中起来做数据处理,计算结果包括平均值、标准偏差、置信区间,还要考虑可疑值的剔除。
标准溶液滴定液管理规程(含表格)

文件制修订记录1.目的:建立标准溶液(滴定液)的标定、贮存、发放和使用管理规程,加强对标准溶液(滴定液)的管理,保证分析结果的准确性。
2.适用范围:适用于标准溶液(滴定液)的管理。
3.职责:标准溶液(滴定液)配制人、复标人、质量管理部对本规程的实施负责。
4.控制要求:4.1标准溶液(滴定液)的配制4.1.1标准溶液(滴定液)实验室要求:4.1.1.1应设在避光房间,室内阴凉、干燥、通风良好。
4.1.1.2室内须有空调设施,温湿度保持相对恒定,一般控制在温度20±5℃,相对湿度50%~75%。
4.1.2配制前准备工作:4.1.2.1所有品种均有批准的试剂配制操作规程。
4.1.2.2严格执行标准操作规程。
4.1.2.3配制前:首先检查所领试剂瓶签完好、包装完整、封口严密、无污染,在规定的使用期内,符合其规格要求。
4.1.2.4试剂恒重。
为防止基准试剂在存放后可能吸湿,配制前必须严格执行恒重的相关规定。
4.1.3称重:4.1.3.1称重是决定所需试剂准确性的关键步骤,必须准确无误。
4.1.3.2称量基准试剂所用天平应为灵敏度在万分之一的专用分析天平,且计量合格证在有效期内。
4.1.3.3称量样品所放的容器及所有操作过程所用容器均须洁净、无痕迹、无残留物。
4.1.4配制:4.1.4.1所有使用的玻璃量器,如容量瓶、滴定管、移液管均选用一等(A级)品,并经过校正,有校正合格证或附有校正值。
4.1.4.2严格按配制方法进行操作,实验操作规范,符合要求。
室内温度不符合要求时不得进行标定和复标。
4.1.4.3配好的标准溶液(滴定液)须放在与溶液性质相适应的洁净试剂瓶中,贴好标签。
4.1.4.4按规定程序进行标定,相对偏差应≤0.1%;由第二人进行复标,其相对偏差应≤0.1% 。
标定的份数和复标的份数均不得少于3份,二者的相对偏差≤0.1%,否则重标。
4.1.4.5标定结果按初、复标的平均值计算,取4位有效数字。
标准溶液的配置标定记录

标准溶液的配置标定记录氢氧化钠标准滴定溶液的配置滴定记录① 配制:将氢氧化钠配成饱和溶液,注入塑料桶中密闭放置至溶液清亮,使用时用塑料管虹吸上层清液。
氢氧化钠标准溶液:量取毫升氢氧化钠饱和溶液,注入毫升不含二氧化碳的水中,摇匀。
② 标定:称取克于105℃--110℃电烘箱中干燥至恒重的工作基准试剂邻苯二甲酸氢钾,称准至0.0002克。
溶于毫升不含二氧化碳的水中,加2滴1酚酞指示液,用氢氧化钠溶液滴定至溶液呈粉红色,并保持30s。
同时做空白试验。
③ 计算:氢氧化钠标准滴定溶液的浓度[c(NaOH)],数值以摩尔每升(mol/L)表示,按下列公式计算:c(NaOH)=m 1000(V1 V2)M式中:m-----邻苯二甲酸氢钾的质量的准确数值,单位为克(g); V1----氢氧化钠溶液的体积的数值,单位为毫升(mL); V2---空白试验氢氧化钠溶液的体积的数值,单位为毫升(mL);M----邻苯二甲酸氢钾的摩尔质量的数值,单位为克每摩尔(g/mol)[M(*****4)= 204.22 ]容量分析原始记录检验:审核:检验日期:① 配制:盐酸标准溶液,量取毫升盐酸,注入毫升水中。
② 标定:称取克于270℃--300℃高温炉中灼烧至恒重的工作基准试剂无水碳酸钠,称准至0.0002克。
,溶于50mL水中,加10滴溴甲酚绿一甲基红指示液,用配制好的盐酸溶液滴定至溶液由绿色变为暗红色,煮沸2min,冷却后继续滴定至溶液再呈暗红色,同时做空白试验。
③ 计算:盐酸标准滴定溶液的浓度[c(HCl)]数值以摩尔每升(mol/L)表示,按下列公式计算:c(HCl)=m 1000(V1 V2)M式中:m----无水碳酸钠的质量的准确数值,单位为克(g) V1---盐酸溶液的体积的数值,单位为毫升(mL)V2---空白试验盐酸溶液的体积的数值,单位为毫升(mL) M---无水碳酸钠的摩尔质量的数值,单位为克每摩尔(g/mol)[M (12 Na2CO3)=52.994]容量分析原始记录检验:审核:检验日期:① 配制:硫酸标准溶液,量取毫升硫酸,注入毫升水中。
标准溶液‘配制’及‘标定’原始重点学习的记录.docx
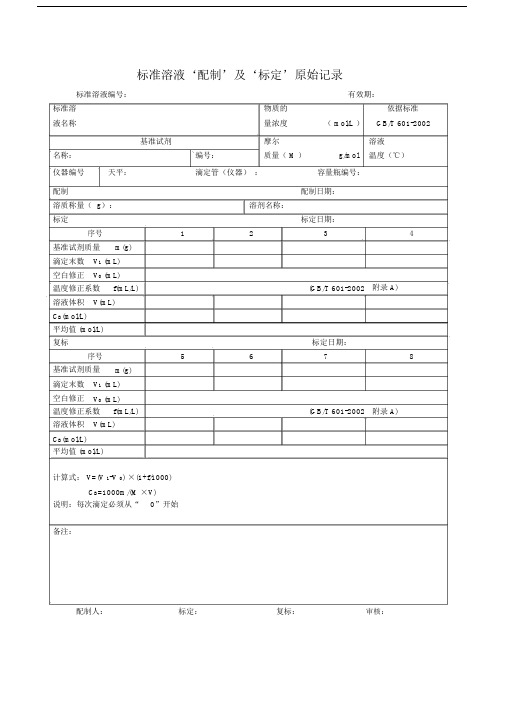
标准溶液‘配制’及‘标定’原始记录标准溶液编号:有效期:标准溶物质的依据标准液名称量浓度( mol/L )GB/T 601-2002基准试剂摩尔溶液名称:编号:质量( M )g/mol温度(℃)仪器编号天平:滴定管(仪器):容量瓶编号:配制配制日期:溶质称量( g):溶剂名称:标定标定日期:序号1234基准试剂质量m(g)滴定末数V1 (mL)空白修正V0 (mL)温度修正系数f(mL/L)(GB/T 601-2002附录 A)溶液体积V(mL)C B(mol/L)平均值 (mol/L)复标标定日期:序号5678基准试剂质量m(g)滴定末数V1 (mL)空白修正V0 (mL)温度修正系数f(mL/L)(GB/T 601-2002附录 A)溶液体积V(mL)C B(mol/L)平均值 (mol/L)计算式: V=(V 1-V 0) ×(1+f/1000)C B=1000m/(M ×V)说明:每次滴定必须从“0”开始备注:配制人:标定:复标:审核:标准物质配制(标定)记录编号: CHEC/ QBG-075名称:、配制方法:使用天平型号编号室温℃、湿度%RH配制:取定溶mL标定:取份:⑴⑵⑶⑷用溶液滴定,滴定消耗量( mL)V1=、 V2=、 V3=、V4=、V0=。
标准溶液浓度计算公式: C=计算结果():C1=C2=C3=C4= C =相对偏差( %):S1=S2=S3=S4=备注:。
配制人:复核人:配制日期:年月日有效期年月日标准溶液配制记录编号: CHEC/QBG-147标准溶液名称:规格:配制方法:仪器名称:溯源标准:温度:℃、湿度:%RH标准溶液拟配浓度:配制或稀释过程:配制日期:年月日有效期:年月日配制人:复核人:0.1mol/L盐酸标准滴定溶液的标定编号: JL/LJ-001-01一、标定方法: GB/T5009.1-2003二、使用仪器: AEL-200 电子天平(仪器编号: JYB001)马弗炉 (仪器编号:JYC009)三、操作1、量取 9ml 盐酸,加适量水并稀释至 1000ml 。
EDTA标准溶液的配制和标定

实验十八EDTA标准溶液的配制和标定1.实验目的(1)掌握络合滴定的原理,了解络合滴定的特点;(2)学习EDTA标准溶液的配制和标定方法;(3)了解金属指示剂的特点,熟悉二甲酚橙、钙黄绿素指示剂的使用及终点颜色的变化。
2.实验原理乙二胺四乙酸(简称EDTA),难溶于水,通常用EDTA二钠盐,并采用间接法配制标准溶液。
标定EDTA溶液的基准物有Zn、ZnO、CaCO3、Cu 、MgSO4·7 H2O等。
用于测定Pb2+、Bi3+含量的EDTA溶液可用ZnO或金属Zn作为基准物进行标定。
以二甲酚橙作指示剂,在pH=5~6的溶液中,二甲酚橙指示剂(XO)本身显黄色,而与Zn2+的络合物呈紫红色。
EDTA与Zn2+形成更稳定的络合物,当用EDTA溶液滴至近终点时。
EDTA会把与二甲酚橙络合的Zn2+置换出来而使二甲酚橙游离,因此溶液由紫红色变为黄色。
其变色原理可表达如下:XO(黄色)+ Zn2+__ZnXO(紫红色)ZnXO(紫红色)+EDTA__ZnEDTA(无色)+XO(黄色)EDTA溶液若用于测定石灰石或白云石中CaO、MgO的含量及测定水的硬度,最好选用CaCO3做基准物标定。
这样基准物和被测组分含有相同的组分,使得测定条件一致,可以减少误差。
首先将CaCO3用盐酸溶解后,制成Ca2+标准溶液,调节酸度至pH>12.5时,以钙黄绿素-百里酚酞作混合指示剂,用EDTA标准溶液滴至由绿色荧光色消失。
3.仪器和药品仪器:电子天平、酸式滴定管、移液管、锥形瓶、容量瓶、烧杯、试剂瓶。
药品:(1)以ZnO为基准物时所用试剂:ZnO(A.R)、乙二胺四乙酸二钠(A.R)、六次甲基四胺:20%(m/v)、二甲酚橙指示剂(0.2%)、盐酸(1+1)。
(2)以CaCO3为基准物时所用试剂:碳酸钙:固体,一级试剂(G.R);盐酸(1+1);钙黄绿素-百里酚酞混合指示剂(1g钙黄绿素和1g百里酚酞与50g固体硝酸钾(A..R)磨细,混匀后,贮于小广口瓶中);氢氧化钾溶液:20%(m/v);乙二胺四乙酸二钠(A..R); 4.实验步骤(1)0.015mol/LEDTA标准溶液的配制称取5.6g乙二胺四乙酸二钠(A.R)置于400ml烧杯中,加入约200mL水及2小片氢氧化钠(A..R)加热溶解(必要时过滤),冷却后,用水稀释至1L,摇匀;(2)以ZnO为基准物标定EDTA溶液Zn2+标准溶液的配制准确称取ZnO基准物0.35~0.5g于150mL烧杯中,用数滴水润湿后,盖上表面皿,从烧杯嘴中滴加10mL1+1盐酸,待完全溶解后冲洗表面皿和烧杯内壁,定量转移至250mL容量瓶中,加水稀释至刻度,摇匀,计算其准确浓度。
溶液配制与滴定操作实验报告

溶液配制与滴定操作实验报告(文章一):实验报告_酸碱标准溶液的配制和标定实验一酸碱标准溶液的配制和标定实验目的1. 掌握标准溶液的配制方法。
2. 掌握滴定法定量测定溶液浓度的原理,熟悉滴定管、移液管的准备、使用及滴定操作。
3. 熟悉甲基橙和酚酞指示剂的使用和终点的确定。
实验原理酸碱滴定法是化学定量分析中最基本的分析方法。
一般能与酸或碱直接(或间接)发生酸碱反应的物质大多可用酸碱滴定法测定他们的浓度。
按酸碱反应方程式中的化学计量系数之比,酸与碱完全中和时的pH值称为化学计量点,达到化学计量点时,应满足如下基本关系:cA V A ?cBVB ?A?B 式中,cA、V A、?A分别为酸的“物质的量”浓度、体积、化学计量系数;cB、VB、?B分别为碱的“物质的量”浓度、体积、化学计量系数。
其中,酸、碱的化学计量系数由酸碱反应方程式决定。
由于酸、碱的强弱程度不同,因此酸碱滴定的化学计量点不一定在pH=7处。
通常,酸碱溶液为无色,酸碱中和是否完全,需用指示剂的变色来判断。
指示剂往往是一些有机的弱酸或弱碱,它们在不同pH值条件下颜色不同。
用作指示剂时,其变色点(在化学计量点附近)的pH值称为滴定终点。
选用指示剂要注意:①变色点与化学计量点尽量一致;②颜色变化明显;③指示剂用量适当。
酸碱滴定中常用HCl和NaOH溶液作为标准溶液,但由于浓HCl容易挥发,NaOH固体容易吸收空气中的H2O和CO2,直接配成的溶液其浓度不能达到标准溶液的精度,只能用标定法加以标定。
基准物质H2C2O4的分子式确定,化学性质稳定,不易脱水或吸水,可以准确称量,所以,本实验采用(H2C2O4·2H2O,摩尔质量为126.07g·mol-1)为基准物质,配成H2C2O4标准溶液。
以酚酞为指示剂,用H2C2O4标准溶液标定NaOH溶液;再以甲基橙为指示剂,用标定后的NaOH标准溶液滴定HCl溶液,从而得到HCl标准溶液。
标准滴定溶液标定原始记录表
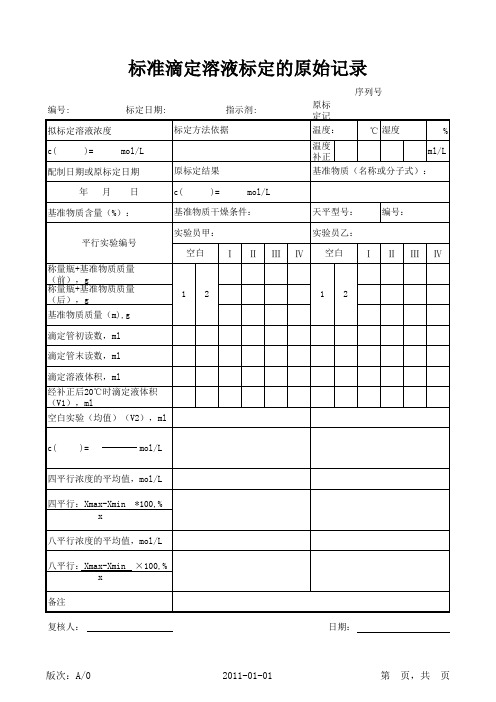
四平行浓度的平均值,mol/L 四平行:Xmax-Xmin x *100,%
八平行浓度的平均值,mol/L 八平行:Xmax-Xmin x 备注 复核人: 日期: ×100,%
版次:A/0
2011-01-01
第
页,共
页
版次:A/0
2011-01-01
第
页,共
页
版次:A/0
2011-01-01原始记录
序列号 编号: 拟标定溶液浓度 c( )= mol/L 原标定结果 c( )= mol/L 天平型号: 实验员乙: Ⅰ Ⅱ Ⅲ Ⅳ 空白 Ⅰ Ⅱ Ⅲ Ⅳ 编号: 标定日期: 指示剂: 标定方法依据 原标定记录编号: 温度: 温度补正值: ℃ 湿度 % ml/L
配制日期或原标定日期 年 月 日
页
版次:A/0
2011-01-01
第
页,共
页
基准物质(名称或分子式):
基准物质含量(%): 平行实验编号
基准物质干燥条件: 实验员甲: 空白
称量瓶+基准物质质量(前),g 称量瓶+基准物质质量(后),g 1 基准物质质量(m),g 滴定管初读数,ml 滴定管末读数,ml 滴定溶液体积,ml 经补正后20℃时滴定液体积 (V1),ml 空白实验(均值)(V2),ml c( )= mol/L 2 1 2
标准溶液配制记录

定
直接 滴定
反滴定
I
II
I
II
称 样 量
溶 剂
定容体积
待标定溶液 取用量
被滴定标液 (II)加 入量
标液 (I)消 耗量 (ml)
始点
终点 用量
标 定
配制浓度
是否标定 是 配制温度
(℃)
否复 核
配制人 配制日期 标定人
复核人
标定温度(℃) 标定后浓度 标定日期 复核日期
备注
校正标定消耗标准溶液的体积(ml) 标准溶液的浓度(mol/L) A、B 均值相对偏差(%) A B 相对偏差(%)
比对记录
容器编号
A1 A2 A3 A4 B1 B2 B3 B4
移取比较溶液的体积(ml)
校正移取比较溶液的体积(ml)
标定消耗标准溶液的体积(ml)
校正标定消耗标准溶液的体积(ml)
标准溶液的浓度(mol/L)
A、B 均值相对偏差(%)
A B 相对偏差(%)
标定溶液浓度与比较溶液浓度相对偏差
%
标示溶液浓度与标定溶液浓度相对偏差
%
配制标准液的浓度:
配制者:甲(A)
乙(B)
审核者:
配制时间:
年 月 日 时至
年
月
日
时
标准溶液配制与标定原始记录表
标准溶液名称:
配
制
标物名称
质量等级
化学式 及式量
标 滴定方式
标定用 标液名称
标准溶液配制记录
配制标准液的名称:
实验室条件: 温度 ℃ 相对湿度
配制标准液的浓度: 比对标准液的名称和浓度: 基准物质名称:
容器编号 称量瓶质量(g)
硫代硫酸钠标准溶液配制与标定硫代硫酸钠滴定液

0.1mol/L硫代硫酸钠标准溶液配制与标定1.配制硫代硫酸钠滴定液(0.1mol/L)配制称取26g硫代硫酸钠(Na2S2O3·5H2O)(或无水硫代硫酸钠16g),溶于1000ml纯水中,缓缓煮沸10分钟,冷却,放置两周后滤过备用。
2.标定(1)标定方法称取在120℃干燥至恒重的基准重铬酸钾0.15g,称准至0.0001g,置于碘量瓶中,加水25ml使溶解,加碘化钾2.0g,轻轻振摇使溶解,加20%硫酸20ml,摇匀,密塞;在暗处放置10分钟后,加水150ml稀释,用配制好的硫代硫酸钠滴定液(0.1mol/L)滴定,至近终点时,加淀粉指示液3ml(5g/L),继续滴定至蓝色消失而显亮绿色,同时作空白实验。
(2)计算:C=M/mvm————重铬酸钾g;c(Na2S2O3)——硫代硫酸钠标准溶液的量浓度,mol/L;V1————滴定时硫代硫酸钠标准溶液的用量ml;V2————空白滴定时硫代硫酸钠标准溶液的用量ml;0.04903——与1.00ml(0.1mol/L)硫代硫酸钠标准溶液相当的以克表示的重铬酸钾的质量。
称取13g结晶硫代硫酸钠(Na2S2O3·5H2O)或8g无水硫代硫酸钠,溶于500 mL水中,缓缓煮沸10 min,冷却。
放置2周后过滤,待标定。
称取基准重铬酸钾0.15g(称准至0.0001g)于碘量瓶中,加25 mL水使其溶解。
加2g碘化钾及20 mL硫酸溶液,盖上瓶塞轻轻摇匀,以少量水封住瓶口,于暗处放置10 min。
取出,用洗瓶冲洗瓶塞及瓶内壁,加入150 mL水,用配制的Na2S2O3溶液滴定,接近终点时(溶液为浅黄绿色),加入3 mL淀粉指示液,继续滴定至溶液由蓝色变为亮绿色为终点。
平行标定三份。
同时做空白实验淀粉溶液:称取1g可溶性淀粉,用冷水调成悬浮浆,然后加入约80mL煮沸水中,边加边搅拌,稀释到100mL;煮沸几分钟后放置沉淀过夜,取上清液使用,如需较长时间保存可加入1.25g水杨酸或0.4g氯化锌取30-35毫升的溶液于250毫升的碘量瓶中,加2克的碘化钾和20%的硫酸溶液20毫升,摇匀后放在暗处10分钟。
标准溶液配制管理制度

标准溶液配制管理制度1.目的保证标准滴定溶液在保质期内浓度的可靠性以及被测样品分析结果的准确与真实性。
2.1基本要求从事标准溶液配制的人员需持相应的上岗合格证。
所用化学药品试剂无异常现象。
标准溶液制备水,除另有规定外,均系指纯化水。
制备标准溶液所用的玻璃计量器具必须经过严格校正,或用一等品滴定管、容量瓶及移液管等容量仪器。
天平经检定合格。
制备标准溶液的容器应清洁,与溶液无反应。
2.2标准溶液的配制采用直接法配制滴定液时,应用基准试剂,并按规定条件干燥至恒重,并精密称定,即精确至四位数,并在1000ml量瓶中配制。
采用间接法配制的滴定液的浓度应为名义值的0.950-1.050,如超出范围应用溶质或溶剂调整。
具体的配制根据中国药典中相应滴定液的配制方法进行,并作好配制登记(见附录表1、2)。
2.3标准溶液的标定标定所用基准试剂,必须按规定条件干燥至恒重,并精密称定,再依据药典规定方法进行标定;除另有规定外,所用的试液及指示液,均按中国药典附录方法配制;根据中国药典规定,配制及标定操作一般在室温中进行,但若标定时的温度与滴定时的温度相差过多时,应记录下来,以便必要时可以校正;每次标定应做几份平行滴定,一般为3份或5份,取其算术平均值,几份结果要求最大相对偏差不得超过0.1%;复标必须经第二操作人在同一实验室进行,校对无误后方可使用,两个人平均结果的相对偏差不得超过0.15%,否则要重标。
溶液标定完毕后,做好标定登记(见附录表1、2)。
2.4标准溶液的管理超过有效期的标准溶液应停止使用,重新标定或改作非标准溶液使用。
配制好的标准溶液应贮存在阴凉、干燥、通风良好的贮藏室内分类摆放,取拿方便,避免阳光直射。
2.5标准溶液的发放与领用所发放的标准溶液必须在有效期内,使用者应在有效期内进行使用。
贵重、有毒标准溶液的发放与领用应做好登记。
滴定液配制登记表滴定液名称:浓度:配制及标定依据:配置日期标定日期室温℃校正因子F配制者标定者复标者有效期至滴定液配制及标化记录配制者:标化者:审核(复标)者:。
标准滴定溶液配制及标定原始记录-(2)
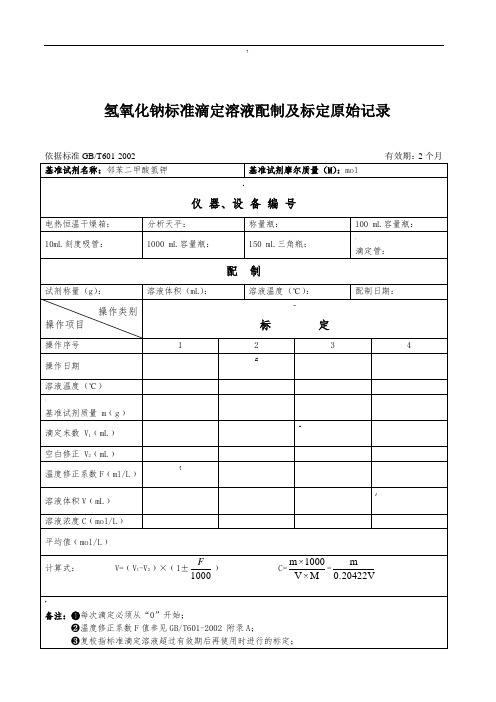
1000 mL棕色容量瓶:
150 mL三角瓶:
50mL棕酸滴定管:
|
配制
试剂称量(g):
溶液体积(mL):
溶液温度(℃):
配制日期:
操作类别
操作项目
标 定
.
复 标
复 校
操作序号
1
2
3
4
5
?
6
操作日期
溶液温度(℃)
;
基准试剂质量 m﹙g﹚
\
滴定末数 V1﹙mL﹚
温度修正系数F﹙ml/L﹚
?
溶液体积V﹙mL﹚
'
备注:❶每次滴定必须从“0”开始;
❷温度修正系数F值参见GB/T601-2002 附录A;
❸复校指标准滴定溶液超过有效期后再使用时进行的标定;
❹计算时保留五位有效数字,平均值报出结果并保留四位有效数字。
配制人: 标定人:
!
\
硫酸标准滴定溶液配制及标定原始记
依据标准GB/T601-2002 有效期:3个月
溶液体积(mL):
溶液温度(℃):
配制日期:
操作类别
操作项目
-
标 定
操作序号
1
2
3
4
操作日期
&
溶液温度(℃)
|
基准试剂质量 m﹙g﹚
滴定末数 V1﹙mL﹚
~
空白修正 V2﹙mL﹚
温度修正系数F﹙ml/L﹚
{
溶液体积V﹙mL﹚
)
溶液浓度C﹙mol/L﹚
平均值﹙mol/L﹚
计算式: V=﹙V1-V2﹚×﹙1± ﹚ C= =
?
氢氧化钠标准滴定溶液配制及标定原始记录
实验三十三 碘标准滴定溶液的配制与标定

化学分析实验报告(Ⅱ)专业:工业分析与检验班级:1432班实训人员:第一项目组指导教师:张华君检测日期:2015-11-19验三十三 碘标准滴定溶液的配制与标定一、实验目的1、掌握碘标准滴定溶液的配制方法与保存方法。
2、掌握碘标准滴定溶液的标定方法、基本原理、反应条件和操作技术。
二、实验原理碘可以通过升华法制得纯试剂,但因其升华及对天平有腐蚀性,故不宜用直接法配制I 2标准溶液而采用间接法。
可以用基准物质As 2O 3来标定I 2溶液。
As 2O 3难溶液于水,可溶于碱溶液中,与NaOH 反应生成亚砷酸钠,用I 2溶液进行滴定。
反应式为:O H O A N OH N O A 233323s a 2a 6s +→+HI O A N O H I O A N 2s a s a 432233+⇔++该反应为可逆反应,在中性或微碱性溶液中(pH ≈8),反应能定量地向右进行,可加固体NaHCO 3以中和反应生成的H +,保持pH=8左右。
在酸性溶液中,反应向左进行,即AsO 43-氧化I -析出I 2。
由标定反应式可知,As 2O 3和I 2的基本单元分别为1/4As 2O 3和1/2I 2。
也可以用Na 2S 2O 3标准溶液“比较”,用I 2溶液滴定一定体积的Na 2S 2O 3标准溶液反应为: I 2+2S 2O 32-→2I-+S 4O 62-以淀粉为指示剂,终点由无色到蓝色。
三、试剂固体试剂I 2(分析纯)、固体试剂KI (分析纯)、固体试剂NaHCO 3(分析纯)、H 2SO 4溶液、淀粉试剂(10g/L )、酚酞指示剂(10g/L )、硫代硫酸钠标准滴定溶液。
四、实验步骤1、配制c (1/2I2)=0.1mol/L 的碘溶液500mL 。
称取6.5gI 2放于小烧杯中,称取17gKI ,准备蒸馏水500mL ,将KI 分4~5次放入装有I 2的小烧杯中,每次加水5~10mL ,用玻璃棒轻轻研磨,使碘逐渐溶解,溶解部分转入棕色试剂瓶中,如此反复直至碘片全部溶解为止。
标准溶液的配制和标定方法

标准溶液的配制和标定方法品控中心一、氢氧化钠标准溶液的配制和标定(依据国标GB/T5009.1-2003)C(NaOH)= 1mol/LC(NaOH)= 0.5mol/LC(NaOH)= 0.313mol/LC(NaOH)= 0.1mol/L(一)氢氧化钠标准溶液的配制:称取 120gNaOH,溶于 100mL无 CO2的水中,摇匀,注入聚乙烯容器中,密闭放置至溶液清亮。
用塑料管吸取下列规定体积的上层清液,注入用无 CO2的水稀释至1000mL,摇匀。
C(NaOH), mol/L NaOH饱和溶液, mL1560.5280.31317.5280.1 5.6(二)氢氧化钠标准溶液的标定:1.测定方法:称取下列规定量的、于 105—110。
C电烘箱烘至恒重的工作基准试剂邻苯二甲酸氢钾,称准至 0.0001 g ,溶于下列规定体积的无 CO2的水中,加 2 滴酚酞指示液( 10 g/L ),用配制好的 NaOH溶液滴定至溶液呈粉红色并保持 30S。
同时做空白试验。
C(NaOH),mol/L基准邻苯二甲酸氢钾 ,g无 CO水 ,mL21 6.0800.5 3.0800.313 1.878800.10.6802.计算:氢氧化钠标准溶液浓度按下式计算:MC( NaOH)= ------------------------(V—V0)× 0.2042式中: C(NaOH)——氢氧化钠标准溶液之物质的浓度,mol/L ;V——消耗氢氧化钠的量,mL;V0——空白试验消耗氢氧化钠的量,mL;M——邻苯二甲酸氢钾的质量,g;0.2042 ——邻苯二甲酸氢钾的摩尔质量。
Kg/ mol 。
二、盐酸标准溶液的配制和标定(依据国标 GB/T5009.1-2003)C(HCl)= 1mol/LC(HCl)= 0.5mol/LC(HCl)= 0.1mol/L(一)盐酸标准溶液的配制:量取下列规定体积的盐酸,注入1000 mL 水中,摇匀。
标准溶液的配制和标定方法

标准溶液的配制和标定方法(总27页)-CAL-FENGHAI.-(YICAI)-Company One1-CAL-本页仅作为文档封面,使用请直接删除标准溶液的配制和标定方法品控中心一、一、氢氧化钠标准溶液的配制和标定(依据国标GB/T5009.1-2003)C(NaOH)= 1mol/LC(NaOH)= 0.5mol/LC(NaOH)= 0.313mol/LC(NaOH)= 0.1mol/L(一)氢氧化钠标准溶液的配制:称取120gNaOH,溶于100mL无CO2的水中,摇匀,注入聚乙烯容器中,密闭放置至溶液清亮。
用塑料管吸取下列规定体积的上层清液,注入用无CO2的水稀释至1000mL,摇匀。
C(NaOH),mol/L NaOH饱和溶液,mL12 560.5 280.313 17.5280.1 5.6(二)氢氧化钠标准溶液的标定:1.2.测定方法:称取下列规定量的、于105—110。
C电烘箱烘至恒重的工作基准试剂邻苯二甲酸氢钾,称准至0.0001 g,溶于下列规定体积的无CO2的水中,加2滴酚酞指示液(10 g/L),用配制好的NaOH溶液滴定至溶液呈粉红色并保持30S。
同时做空白试验。
C(NaOH),mol/L 基准邻苯二甲酸氢钾,g 无CO2水,mL1 6.0 800.5 3.0 800.313 1.878 800.1 0.6 803.4.计算:氢氧化钠标准溶液浓度按下式计算:MC(NaOH)= ------------------------(V—V0)×0.2042式中:C(NaOH)——氢氧化钠标准溶液之物质的浓度,mol/L;V——消耗氢氧化钠的量,mL;V0——空白试验消耗氢氧化钠的量,mL;M——邻苯二甲酸氢钾的质量,g;0.2042——邻苯二甲酸氢钾的摩尔质量。
Kg/ mol。
二、盐酸标准溶液的配制和标定(依据国标GB/T5009.1-2003)C(HCl)= 1mol/LC(HCl)= 0.5mol/LC(HCl)= 0.1mol/L(一)(二)盐酸标准溶液的配制:量取下列规定体积的盐酸,注入1000 mL水中,摇匀。
EDTA标准溶液的配制和标定

EDTA标准溶液的配制和标定实验⼗⼋EDTA标准溶液的配制和标定1.实验⽬的(1)掌握络合滴定的原理,了解络合滴定的特点;(2)学习EDTA标准溶液的配制和标定⽅法;(3)了解⾦属指⽰剂的特点,熟悉⼆甲酚橙、钙黄绿素指⽰剂的使⽤及终点颜⾊的变化。
2.实验原理⼄⼆胺四⼄酸(简称EDTA),难溶于⽔,通常⽤EDTA⼆钠盐,并采⽤间接法配制标准溶液。
标定EDTA溶液的基准物有Zn、ZnO、CaCO3、Cu 、MgSO4·7 H2O等。
⽤于测定Pb2+、Bi3+含量的EDTA溶液可⽤ZnO或⾦属Zn作为基准物进⾏标定。
以⼆甲酚橙作指⽰剂,在pH=5~6的溶液中,⼆甲酚橙指⽰剂(XO)本⾝显黄⾊,⽽与Zn2+的络合物呈紫红⾊。
EDTA与Zn2+形成更稳定的络合物,当⽤EDTA溶液滴⾄近终点时。
EDTA会把与⼆甲酚橙络合的Zn2+置换出来⽽使⼆甲酚橙游离,因此溶液由紫红⾊变为黄⾊。
其变⾊原理可表达如下:XO(黄⾊)+ Zn2+__ZnXO(紫红⾊)ZnXO(紫红⾊)+EDTA__ZnEDTA(⽆⾊)+XO(黄⾊)EDTA溶液若⽤于测定⽯灰⽯或⽩云⽯中CaO、MgO的含量及测定⽔的硬度,最好选⽤CaCO3做基准物标定。
这样基准物和被测组分含有相同的组分,使得测定条件⼀致,可以减少误差。
⾸先将CaCO3⽤盐酸溶解后,制成Ca2+标准溶液,调节酸度⾄pH>12.5时,以钙黄绿素-百⾥酚酞作混合指⽰剂,⽤EDTA标准溶液滴⾄由绿⾊荧光⾊消失。
3.仪器和药品仪器:电⼦天平、酸式滴定管、移液管、锥形瓶、容量瓶、烧杯、试剂瓶。
药品:(1)以ZnO为基准物时所⽤试剂:ZnO(A.R)、⼄⼆胺四⼄酸⼆钠(A.R)、六次甲基四胺:20%(m/v)、⼆甲酚橙指⽰剂(0.2%)、盐酸(1+1)。
(2)以CaCO3为基准物时所⽤试剂:碳酸钙:固体,⼀级试剂(G.R);盐酸(1+1);钙黄绿素-百⾥酚酞混合指⽰剂(1g 钙黄绿素和1g百⾥酚酞与50g固体硝酸钾(A..R)磨细,混匀后,贮于⼩⼴⼝瓶中);氢氧化钾溶液:20%(m/v);⼄⼆胺四⼄酸⼆钠(A..R); 4.实验步骤(1)0.015mol/LEDTA标准溶液的配制称取5.6g⼄⼆胺四⼄酸⼆钠(A.R)置于400ml烧杯中,加⼊约200mL⽔及2⼩⽚氢氧化钠(A..R)加热溶解(必要时过滤),冷却后,⽤⽔稀释⾄1L,摇匀;(2)以ZnO为基准物标定EDTA溶液Zn2+标准溶液的配制准确称取ZnO基准物0.35~0.5g于150mL烧杯中,⽤数滴⽔润湿后,盖上表⾯⽫,从烧杯嘴中滴加10mL1+1盐酸,待完全溶解后冲洗表⾯⽫和烧杯内壁,定量转移⾄250mL容量瓶中,加⽔稀释⾄刻度,摇匀,计算其准确浓度。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
硝酸银标准滴定溶液配制及标定原始记录
依据标准GB/T5009.1-2003有效期:3个月
基准试剂名称:氯化钠
基准试剂摩尔质量(M):58.442g/mol
仪器、设备编号
实验电阻炉:检41
分析天平:检25
称量瓶:
1000 mL棕色容量瓶:
150 mL三角瓶:
50mL棕酸滴定管:
配制
试剂称量(g):
溶液体积(mL):
溶液温度(℃):
配制日期:
操作类别
操作项目
标定
复标
复校
操作序号
1
2
3
4
5
6
操作日期
溶液温度(℃)
基准试剂质量m﹙g﹚
滴定末数V1﹙mL﹚
温度修正系数F﹙ml/L﹚
溶液体积V﹙mL﹚
溶液浓度C﹙mol/L﹚
平均值﹙mo复校
复校
操作序号
7
8
9
10
11
12
操作日期
氢氧化钠标准滴定溶液配制及标定原始记录
依据标准GB/T601-2002有效期:2个月
基准试剂名称:邻苯二甲酸氢钾
基准试剂摩尔质量(M):204.22g/mol
仪器、设备编号
电热恒温干燥箱:
分析天平:
称量瓶:
100 mL容量瓶:
10mL刻度吸管:
1000 mL容量瓶:
150 mL三角瓶:
滴定管:
配制
试剂称量(g):
❷温度修正系数F值参见GB/T601-2002附录A;
❸复校指标准滴定溶液超过有效期后再使用时进行的标定;
❹计算时保留五位有效数字,平均值报出结果并保留四位有效数字。
配制人:标定人:
硫酸标准滴定溶液配制及标定原始记
依据标准GB/T601-2002有效期:3个月
基准试剂名称:无水碳酸钠
基准试剂摩尔质量(M):52.994g/mol
温度修正系数F﹙ml/L﹚
溶液体积V﹙mL﹚
溶液浓度C﹙mol/L﹚
平均值﹙mol/L﹚
计算式:
V=﹙V1-V2﹚×﹙1± ﹚C= =
备注:❶每次滴定必须从“0”开始;
❷温度修正系数F值参见GB/T601-2002附录A;
❸复校指标准滴定溶液超过有效期后再使用时进行的标定;
❹计算时保留五位有效数字,平均值报出结果并保留四位有效数字。
仪器、设备编号
实验电阻炉:
分析天平:
乳钵:
称量瓶:
50 ml量筒:
1000 mL容量瓶:
150 mL三角瓶:
50mL酸式滴定管:
配制
试剂称量(g):
溶液体积(mL):
溶液温度(℃):
配制日期:
操作类别
操作项目
标定
操作序号
1
2
3
4
操作日期
溶液温度(℃)
基准试剂质量m﹙g﹚
滴定末数V1﹙mL﹚
空白修正V2﹙mL﹚
❹计算时保留五位有效数字,平均值报出结果并保留四位有效数字。
配制人:标定:复标:复校:
溶液体积(mL):
溶液温度(℃):
配制日期:
操作类别
操作项目
标定
操作序号
1
2
3
4
操作日期
溶液温度(℃)
基准试剂质量m﹙g﹚
滴定末数V1﹙mL﹚
空白修正V2﹙mL﹚
温度修正系数F﹙ml/L﹚
溶液体积V﹙mL﹚
溶液浓度C﹙mol/L﹚
平均值﹙mol/L﹚
计算式:V=﹙V1-V2﹚×﹙1± ﹚C= =
备注:❶每次滴定必须从“0”开始;
溶液温度(℃)
基准试剂质量m﹙g﹚
滴定末数V1﹙mL﹚
温度修正系数F﹙ml/L﹚
溶液体积V﹙mL﹚
溶液浓度C﹙mol/L﹚
平均值﹙mol/L﹚
计算式:V=﹙1± ﹚×V1C= =
备注:❶每次滴定必须从“0”开始;
❷温度修正系数F值参见GB/T601-2002附录A;
❸复校指标准滴定溶液超过有效期后再使用时进行的标定;
