气体的等温变化、玻意耳定律典型例题
2021年高考物理专题复习:气体的等温变化和玻意耳定律
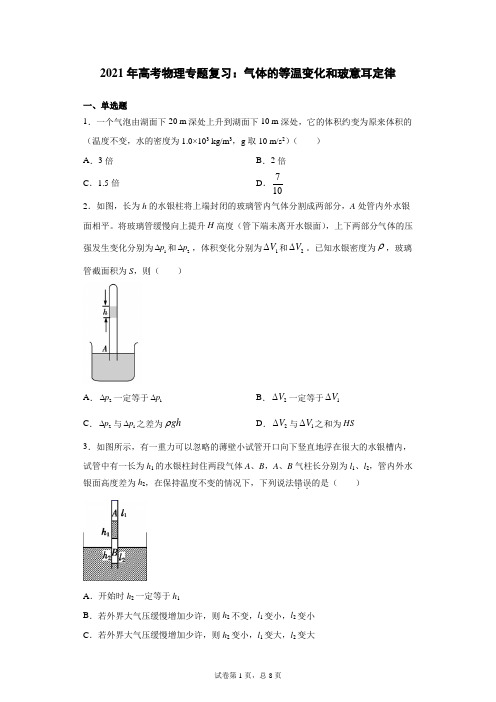
2021年高考物理专题复习:气体的等温变化和玻意耳定律一、单选题1.一个气泡由湖面下20 m 深处上升到湖面下10 m 深处,它的体积约变为原来体积的(温度不变,水的密度为1.0×103 kg/m 3,g 取10 m/s 2)( )A .3倍B .2倍C .1.5倍D .7102.如图,长为h 的水银柱将上端封闭的玻璃管内气体分割成两部分,A 处管内外水银面相平。
将玻璃管缓慢向上提升H 高度(管下端未离开水银面),上下两部分气体的压强发生变化分别为1p ∆和2p ∆,体积变化分别为1V ∆和2V ∆。
已知水银密度为ρ,玻璃管截面积为S ,则( )A .2p ∆一定等于1p ∆B .2V ∆一定等于1V ∆C .2p ∆与1p ∆之差为gh ρD .2V ∆与1V ∆之和为HS 3.如图所示,有一重力可以忽略的薄壁小试管开口向下竖直地浮在很大的水银槽内,试管中有一长为h 1的水银柱封住两段气体A 、B ,A 、B 气柱长分别为l 1、l 2,管内外水银面高度差为h 2,在保持温度不变的情况下,下列说法错误..的是( )A .开始时h 2一定等于h 1B .若外界大气压缓慢增加少许,则h 2不变,l 1变小,l 2变小C .若外界大气压缓慢增加少许,则h 2变小,l 1变大,l 2变大D .若用手轻按试管,使试管竖直向下移少许,则h 2变大,l 1变小,l 2变小4.一定质量的理想气体,经历如图所示的状态变化,A B C →→,则这三个状态的热力学温度之比::A B C T T T 为( )A .1:3:5B .3:2:1C .5:6:3D .3:6:5 5.有同学在做“用DIS 研究温度不变时气体的压强跟体积的关系”实验时,缓慢推动活塞,在使注射器内空气体积逐渐减小的过程中,多次从注射器的刻度上读出体积值并输入计算机,同时由压强传感器将对应体积的压强值通过数据采集器传送给计算机。
实验完成后,计算机屏幕上显示出如图所示的p —V 图线(其中实线是实验所得图线,虚线为一根参考双曲线)。
等温变化-玻意耳定律练习题

等温变化玻意耳定律练习题一、选择题1.将一端封闭的玻璃管插入水银槽内,内封一定质量的气体。
若将管略压下一些,下述说法正确的是[ ]A.玻璃管内气体体积扩大B.玻璃管内气体体积缩小C.管内外水银面高度差减小D.管内外水银面高度差增大2.一定质量的气体,温度不变体积减小时,气体压强增大是由于[ ]A.单位体积内分子数变大,单位时间对器壁的碰撞次数变多B.气体密度变大,分子对器壁排斥力变大C.每个分子对器壁平均撞击力变大D.气体分子密度变大,单位体积内分子的重量变大3.将长1m一端封闭、内径均匀的玻璃管开口向下插入水银槽内25cm深,当时大气压为75cmHg,则进入管内的水银柱高为[ ]A.11.6cm B.13.4cm C.25cm D.38.4cm4.一定质量的气体,经过状态变化,欲使它的终态温度与始态温度相同,下列过程可以实现的是[ ].A.先保持压强不变,使其体积膨胀,接着保持体积不变,使其压强减小B.先保持压强不变,使其体积减小,接着保持体积不变,使其压强减小C.先保持体积不变,使其压强增大,接着保持压强不变,使其体积膨胀D.先保持体积不变,使其压强减小,接着保持压强不变,使其体积膨胀5.将一试管管口朝下压入水中,若管内2/3进水,则管内空气的压强为[ ]A.3/2atm B.2/3atm C.2个大气压D.3个大气压6.一肥皂泡悬浮在充满空气带有活塞的封闭气缸内(图1),若向上则肥皂泡的[ ]7.一定质量的理想气体在等温压缩时,体积减少1L,则压强增加20%,如果体积减少2L,那么气体的压强将增加[ ]A.40%B.50%C.60%D.80%8.在水面下30m深处有一个体积为V1的气泡(设水温均匀,大气压为10m水柱高),则该气泡升到水面时的体积V将为[ ]A.2V1 B.3V1C.4V1 D.5V19.两端封闭、粗细均匀、水平放置的玻璃管正中有一段水银柱,如图2所示,两边是压强为76cmHg的空气。
高考物理复习:气体的等温变化、玻马定律

高考物理复习:气体的等温变化、玻马定律1.已知湖水深度为20m ,湖底水温为4℃,水面温度为17℃,大气压强为1.0×105Pa 。
当一气泡从湖底缓慢升到水面时,其体积约为原来的(取g =10m/s 2,ρ=1.0×103kg/m 3) A .12.8倍 B . 8.5倍 C .3.1倍 D .2.1倍答案:C解析:湖底压强大约为3个大气压,由气体状态方程,当一气泡从湖底缓慢升到水面时,其体积约为原来的3.1倍,选项C 正确。
2. 如图,竖直放置、开口向下的试管内用水银封闭一段气体,若试管自由下落,管内气体( )A .压强增大,体积增大B .压强增大,体积减小C .压强减小,体积增大D .压强减小,体积减小 【答案】B【解析】初始时,水银处于静止状态,受到重力和封闭气体的压力之和与外界大气压力等大反向;当试管自由下落时,管中水银也处于完全失重状态,加速度为g 竖直向下,所以封闭气体的压强与外界大气压等大;由此可知封闭气体的压强增大,根据玻马定律可知,气体的体积减小,B 项正确。
3.如图,长L =100cm ,粗细均匀的玻璃管一端封闭。
水平放置时,长L 0=50cm 的空气柱被水银封住,水银柱长h =30cm 。
将玻璃管缓慢地转到开口向下的竖直位置,然后竖直插入水银槽,插入后有Δh =15cm 的水银柱进入玻璃管。
设整个过程中温度始终保持不变,大气压强p 0=75cmHg 。
求: (1)插入水银槽后管内气体的压强p ; (2)管口距水银槽液面的距离H 。
解析:(1)设当转到竖直位置时,水银恰好未流出,管截面积为S ,此时气柱长l =70cm 由玻意耳定律:p =p 0L 0/l =53.6cmHg ,由于p +ρgh =83.6cmHg ,大于p 0,因此必有水银从管中流出, 设当管转至竖直位置时,管内此时水银柱长为x , 由玻意耳定律:p 0SL 0=(p 0-ρgh )S (L -x ), 解得:x =25cm ,设插入槽内后管内柱长为L',L'=L -(x +∆h )=60cm ,由玻意耳定律,插入后压强p =p 0L 0/ L'=62.5cmHg , (2)设管内外水银面高度差为h', h'=75-62.5=12.5cm ,管口距槽内水银面距离距离H =L -L'-h'=27.5cm ,4.如图,长为h 的水银柱将上端封闭的玻璃管内气体分隔成两部分,A 处管内外水银面相平。
最新-气体的等温变化、玻意耳定律·能力测试 精品

气体的等温变化、玻意耳定律·能力测试A卷1.在标准大气压下进行托里拆利实验,测得水银柱高度h=75cm.将托里拆利管竖直向上提起一些(下端不露出水银面),管内水银的高度将 [ ] A.不变.B.增大.C.减小.D.不能确定.2.一定质量的气体,在等温变化过程中,下面物理量中发生改变的有[ ]A.分子的平均速率.B.单位体积内的分子数.C.气体的压强.D.分子总数.3.一个气泡从水面下40m深处升到水面上,假定水的温度一定,大气压强为76cmHg,则气泡升到水面时的体积约为原来的 [ ]A.3倍.B.4倍.C.5倍.D.5.5倍.E.55倍.4.一定质量气体分别保持在两个不同温度作等温变化,测得的等温线如图8-16所示.则两图线对应的温度T1______T2(填>、=、<),其原因是______.5.用托里拆利实验测大气压强时,管内混入少量空气,因此示数不准.当大气压强为75cmHg时,示数为74.5cmHg,这时水银柱上部空气柱长22cm.当气压计示数为75.5cmHg时,实际大气压强多大?B卷1.一玻璃瓶内装有空气,瓶口向下竖直接入水中.若它在水下5m处恰能平衡,则将它按到水下6m深处后撤去外力,这个瓶子将 [ ] A.加速上浮.B.加速下沉.C.仍保持平衡.D.向上浮到5m深处后静止不动.2.用抽气机对容器抽气,已知容器的容积是抽气机最大活动容积的两倍,则在完成两次抽气动作后,容器中气体的压强降为原来的(设抽气时温度不变) [ ]3.保持温度不变,把一根长100cm、上端封闭的均匀玻璃管竖直插入水银槽中(图8-17).当管口到槽内水银面的距离是管长一半时,求水银进入管内的高度?已知大气压为p0=75cmHg.4.如图8-18所示,截面积S=0.01m2的气缸内有一定质量的气体被光滑活塞封闭.已知外界大气压p0=118Pa,活塞重G=100N.现将气缸倒过来竖直放置,设温度保持不变,气缸足够长.求气缸倒转后气体的体积是倒转前的几倍?5.一个潜水艇位于水面下200m.艇上有一个容积V1=2m3的贮气钢筒,筒内贮有压缩空气.将筒内一部分空气压入水箱(水箱有排水孔和海水相连)排出海水10m3.此时筒内剩余气体的压强是95atm.设在排水过程中温度不变,求贮气钢筒内原来的压缩空气的压强.(计算时取1atm=10N/cm2,海水密度取1.0×103kg /m3)参考答案与提示A卷1.B.2.B,C.3.C.4.<.5.约76cmHg.B卷1.B.2,D.3.25cm.4.1.22.5.200atm.。
气体的等温变化、玻意耳定律典型例题

气体的等温变化、玻意耳定律典型例题【例1】一个气泡从水底升到水面时,它的体积增大为原来的3倍,设水的密度为P=1X 103kg /m ,大气压强P 0=1.O1 X 105Pa,水底 与水面的温度差不计,求水的深度。
取g=10n / S 2。
【分析】气泡在水底时,泡内气体的压强等于水面上大气压与水 的静压强之和。
气泡升到水面上时,泡内气体的压强减小为与大气压 相等,因此其体积增大。
由于水底与水面温度相同,泡内气体经历的 是一个等温变化过程,故可用玻意耳定律计算。
【解答】设气泡在水底时的体积为VI 、压强为:VflM K 'R = lt )狀im “1即B LAp i=p)+ p gh气泡升到水面时的体积为V2,则V2=3V1压强为p2=p o。
由玻意耳定律p i V1= pV2,即(p o+ p gh) V1= p - 3V1得水深込/XI嘗卅pg IXIO^XIO ■【例2】如图1所示,圆柱形气缸活塞的横截面积为S,下表面与水平面的夹角为a,重量为G当大气压为P0,为了使活塞下方密闭气体的体积减速为原来的1/2,必须在活塞上放置重量为多少的一个重物(气缸壁与活塞间的摩擦不计)图1【误解】活塞下方气体原来的压强S Geos a设所加重物重为G ,则活塞下方气体的压强变为G + G'' (G + GO cos a卩厂內+丽右*厂--------- S—•••气体体积减为原的1/2,则p2=2pG,=G+-^cos Cl【正确解答】据图2,设活塞下方气体原来的压强为P1,由活塞的平衡条件得P1 二• 2 a =P D S+G cos U同理,加上重物G后,活塞下方的气体压强变为G + G「Pa = Po +——气体作等温变化,根据玻意耳定律:得p 2=2p i•I G’ up o S+G【错因分析与解题指导】【误解】从压强角度解题本来也是可以的,但%将活塞产生的压强算成发生了錯误,这个压强值应该是G0为避cos a免发生以上关于压强计算的错误,相似类型的题目从力的平衡入手解题比较好。
人教版高中物理选修3-3等温变化,玻意耳定律 同步练习

高中物理学习材料(灿若寒星**整理制作)等温变化,玻意耳定律同步练习1.(多选)右图中玻璃管A和B的下端用橡皮管连通,管内装有水银,A管上端封闭,内有部分气体,B管上端开口。
如果将B管提起,则()WLD4A.A管内气体体积增大B.A管内气体体积减小C.A和B管内水银液面的高度差减小D.A和B管内水银液面的高度差增大2.(多选)如右图所示,用一段水银柱将管内气体与外界隔绝,管口朝下竖直放置,今将玻璃管倾斜,下列叙述正确的是()A.封闭端内的气体压强增大B.封闭端内的气体压强减小C.封闭端内的气体体积增大D.封闭端内的气体体积减小3.在验证“玻意耳—马略特定律”的实验中,下列四个因素中对实验的准确性影响最小的是()A.针筒封口处漏气B.采用横截面积较大的针筒C.针筒壁与活塞之间存在摩擦D.实验过程中用手去握针筒4.(多选)一定质量的理想气体的p—V图如右图所示,a、b、c三点所表示的状态温度分别为T a、T b、T c,那么()A. T a=T bB. T b=T cC. T c=T aD.可能T c>T a5.定质量理想气体发生等温变化时,其体积和压强的乘积是一个恒量,以下对恒量的讨论正确的有()A.同一份理想气体,无论在温度保持t1的情况下实现等温变化,还是在温度保持为t2的情况下完成等温变化,这个恒量都是同一个量B.如T1<T2,同一份理想气体在温度保持T1的情况下实现等温变化,这个恒量较小C.如T1<T2,同一份理想气体在温度保持为T1的情况下实现等温变化,这个恒量较大D.如T1<T2,同一份理想气体在温度保持为T1的情况下实现等温变化,这个恒量相同6.一根两端封闭粗细均匀的直玻璃中有一段长57厘米的水银柱,在水银柱两边各有一段空气柱(如右图)。
当玻璃管水平放置,两段空气柱长度均为30厘米,压强都是一个标准大气压,现将玻璃管缓慢竖立起来,则上下两段空气柱的长度分别为()A.30厘米,30厘米B.35厘米,25厘米C.40厘米,20厘米D.45厘米,15厘米7.关于摄氏温标与开氏温标,它们之间的关系有()A.100℃比100K的温度高B.-119℃比54K的温度高C.-273℃比2K的温度高D.摄氏温标1`度的温差和开氏温标1度的温差相等8.右图中,容器A的容器是容器B容积的4倍,开始时A中是真空,B中有20×105帕压强的气体,打开开关,A、B相通后,温度不变,B中气体压强为_________帕。
气体的等温变化—玻马定律练习题(含答案)

气体的等温变化—玻马定律(含答案)1、在一端封闭、长100cm且内径均匀的细直玻璃管中, 用25cm长的水银柱封住一部分空气. 当玻璃管水平放置时, 被封闭的气柱长为30cm. 这时外界的大气压为75cmHg产生的压强. 现将玻璃管缓慢旋转到管口朝下后, 再将它逐渐插入水银槽中, 在恒温条件下, 使气柱长又重新恢复到30cm( 见图) , 这时管口没入到槽中水银面下多少厘米深? 从管口进入的水银柱的高度是多少厘米?2、在标准大气压下,把75cm长两端开口的玻璃管全部插入深槽的水银中,封闭上端,将玻璃管缓慢地竖直提出水银面,管中留有的水银柱长度为_____cm.若将此管竖直插入水银中,使下中没入银63cm时封闭上端,再将玻璃管缓慢地竖直提出水银面,则管中留有的水银柱长是_____cm .3、如图所示, 两臂竖直放置的U形细管, 内径均匀, 两臂等长、左端开口、右端封闭, 其水平管的长度为L, 静止时其中正好充满水银, 两臂的高P、水银密度为ρ、温度H<2L, 右管中全是被封住的空气. 设大气压强为保持不变. 若使水银面上升到封闭竖直管的一半高度, 应以多大的角速度ω使整个装置绕开口竖直臂的轴线OO’匀速转动?4、如下图所示,在一玻璃容器中竖直放置一个水银压强计—即一端封闭、内径均匀的U形管,管内充有水银,并将一段l=20cm长的空气封在管内,两管臂竖直放置,其中的水银面封闭端比开口端高h=10cm,现将玻璃容器抽成真空,则压强计的开口端管内水银面将比封闭端管内水银面高出______cm.(设抽气前容器中空气压强支持75cmHg,U形管内空气温度保持一定)5、有一根两端开口的较长的玻璃管,竖直插在较深的水银槽中,玻璃管内有一段水银柱把一部分空气封闭在下方,这时系统处于静止,在环境温度不变的条件下,缓慢将玻璃管竖直往下插,则玻璃管内外的水银面的高度差将______,空气柱上方的水银柱相对于玻璃管将_____,空气柱的长度_____。
气体的等温变化_玻马定律练习试题(含答案解析)

气体的等温变化—玻马定律(含答案)1、在一端封闭、长100cm且内径均匀的细直玻璃管中, 用25cm长的水银柱封住一部分空气. 当玻璃管水平放置时, 被封闭的气柱长为30cm. 这时外界的大气压为75cmHg产生的压强. 现将玻璃管缓慢旋转到管口朝下后, 再将它逐渐插入水银槽中, 在恒温条件下, 使气柱长又重新恢复到30cm( 见图) , 这时管口没入到槽中水银面下多少厘米深? 从管口进入的水银柱的高度是多少厘米?2、在标准大气压下,把75cm长两端开口的玻璃管全部插入深槽的水银中,封闭上端,将玻璃管缓慢地竖直提出水银面,管中留有的水银柱长度为_____cm.若将此管竖直插入水银中,使下中没入银63cm时封闭上端,再将玻璃管缓慢地竖直提出水银面,则管中留有的水银柱长是_____cm .3、如图所示, 两臂竖直放置的U形细管, 内径均匀, 两臂等长、左端开口、右端封闭, 其水平管的长度为L, 静止时其中正好充满水银, 两臂的高P、水银密度为ρ、温度H<2L, 右管中全是被封住的空气. 设大气压强为保持不变. 若使水银面上升到封闭竖直管的一半高度, 应以多大的角速度ω使整个装置绕开口竖直臂的轴线OO’匀速转动?4、如下图所示,在一玻璃容器中竖直放置一个水银压强计—即一端封闭、内径均匀的U形管,管内充有水银,并将一段l=20cm长的空气封在管内,两管臂竖直放置,其中的水银面封闭端比开口端高h=10cm,现将玻璃容器抽成真空,则压强计的开口端管内水银面将比封闭端管内水银面高出______cm.(设抽气前容器中空气压强支持75cmHg,U形管内空气温度保持一定)5、有一根两端开口的较长的玻璃管,竖直插在较深的水银槽中,玻璃管内有一段水银柱把一部分空气封闭在下方,这时系统处于静止,在环境温度不变的条件下,缓慢将玻璃管竖直往下插,则玻璃管内外的水银面的高度差将______,空气柱上方的水银柱相对于玻璃管将_____,空气柱的长度_____。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
气体的等温变化、玻意耳定律典型例题【例1】一个气泡从水底升到水面时,它的体积增大为原来的3倍,设水的密度为ρ=1×103kg/m3,大气压强p0=1.01×105Pa,水底与水面的温度差不计,求水的深度。
取g=10m/s2。
【分析】气泡在水底时,泡内气体的压强等于水面上大气压与水的静压强之和。
气泡升到水面上时,泡内气体的压强减小为与大气压相等,因此其体积增大。
由于水底与水面温度相同,泡内气体经历的是一个等温变化过程,故可用玻意耳定律计算。
【解答】设气泡在水底时的体积为V1、压强为:p1=p0+ρgh气泡升到水面时的体积为V2,则V2=3V1,压强为p2=p0。
由玻意耳定律 p1V1=p2V2,即(p0+ρgh)V1=p0·3V1得水深【例2】如图1所示,圆柱形气缸活塞的横截面积为S,下表面与水平面的夹角为α,重量为G。
当大气压为p0,为了使活塞下方密闭气体的体积减速为原来的1/2,必须在活塞上放置重量为多少的一个重物(气缸壁与活塞间的摩擦不计)【误解】活塞下方气体原来的压强设所加重物重为G′,则活塞下方气体的压强变为∵气体体积减为原的1/2,则p2=2p1【正确解答】据图2,设活塞下方气体原来的压强为p1,由活塞的平衡条件得同理,加上重物G′后,活塞下方的气体压强变为气体作等温变化,根据玻意耳定律:得 p2=2p1∴ G′=p0S+G【错因分析与解题指导】【误解】从压强角度解题本来也是可以的,但免发生以上关于压强计算的错误,相似类型的题目从力的平衡入手解题比较好。
在分析受力时必须注意由气体压强产生的气体压力应该垂直于接触面,气体压强乘上接触面积即为气体压力,情况就如【正确解答】所示。
【例3】一根两端开口、粗细均匀的细玻璃管,长L=30cm,竖直插入水银槽中深h0=10cm处,用手指按住上端,轻轻提出水银槽,并缓缓倒转,则此时管内封闭空气柱多长?已知大气压P0=75cmHg。
【分析】插入水银槽中按住上端后,管内封闭了一定质量气体,空气柱长L1=L-h0=20cm,压强p1=p0=75cmHg。
轻轻提出水银槽直立在空气中时,有一部分水银会流出,被封闭的空气柱长度和压强都会发生变化。
设管中水银柱长h,被封闭气体柱长为L2=L-h。
倒转后,水银柱长度仍为h不变,被封闭气体柱长度和压强又发生了变化。
设被封闭气体柱长L3。
所以,管内封闭气体经历了三个状态。
由于“轻轻提出”、“缓缓倒转”,意味着都可认为温度不变,因此可由玻意耳定律列式求解。
【解】根据上面的分析,画出示意图(图a、b、c)。
气体所经历的三个状态的状态参量如下表所示:由于整个过程中气体的温度不变,由玻意耳定律:p1V1=p2V2=p3V3即75×20S=(75-h)(30-h)S=(75+h)L3S由前两式得:h2-105h+750=0取合理解 h=7.7cm,代入得【说明】必须注意题中隐含的状态(b),如果遗漏了这一点,将无法正确求解。
【例4】容器A的容积是10L,用一根带阀门的细管,与容器B 相连。
开始时阀门关闭, A内充有10atm的空气,B是真空。
后打开阀门把A中空气放一些到B中去,当A内压强降到4atm时,把阀门关闭,这时B内压强是3atm。
求容器B的容积。
假设整个过程中温度不变。
【分析】对流入容器B的这部分空气,它后来的状态为压强p′B=3atm,体积VB(容器B的容积)。
为了找出这部分空气的初态,可设想让容器A中的空气作等温膨胀,它的压强从10atm降为4atm时逸出容器A的空气便是进入B内的空气,于是即可确定初态。
【解答】先以容器A中空气为研究对象,它们等温膨胀前后的状态参量为:V A=10L,p A=10atm;V'A=?,p'A=4atm。
由玻意耳定律 p A V A=p'A V'A,得如图1所示。
再以逸出容器A的这些空气为研究对象,它作等温变化前后的状态为:p1=p'A=4atm,V1=V'A-V A=15Lp'1=3atm,V'1=VB同理由玻意耳定律 p1V1=p'1VB,得所以容器B的容积是20L。
【说明】本题中研究对象的选取至关重要,可以有多种设想。
例如,可先以后来充满容器A的气体为研究对象(见图2)假设它原来在容器A中占的体积为Vx,这部分气体等温变化前后的状态为:变化前:压强p A=10atm、体积Vx,变化后:压强p′A=4atm 体积V′x=V A=10L。
由 p A Vx=p′A V′x由此可见,进入B中的气体原来在A内占的体积为VA-Vx=(10-4)L=6L。
再以这部分气体为研究对象,它在等温变化前后的状态为:变化前:压强p1=10atm,体积V1=6L,变化后:压强p2=3atm,体积V2=VB.由玻意耳定律得容器B的容积为:决定气体状态的参量有温度、体积、压强三个物理量,为了研究这三者之间的联系,可以先保持其中一个量不变,研究另外两个量之间的关系,然后再综合起来。
这是一个重要的研究方法,关于气体性质的研究也正是按照这个思路进行的。
【例5】一容积为32L的氧气瓶充气后压强为1300N/cm2。
按规定当使用到压强降为100N/cm2时,就要重新充气。
某厂每天要用400L氧气(在1atm下),一瓶氧气能用多少天(1atm=10N/cm2)?设使用过程中温度不变。
【分析】这里的研究对象是瓶中的氧气。
由于它原有的压强(1300N/cm2),使用后的压强(100N/cm2)、工厂应用时的压强(10N/cm2)都不同,为了确定使用的天数,可把瓶中原有氧气和后来的氧气都转化为1atm,然后根据每天的耗氧量即可算出天数。
【解】作出示意图如图1所示。
根据玻意耳定律,由p1V1=p′1V′1,p2V2=p′2V′2得所以可用天数为:【说明】根据上面的解题思路,也可以作其他设想。
如使后来留在瓶中的氧气和工厂每天耗用的氧气都变成1300N/cm2的压强状态下,或使原来瓶中的氧气和工厂每天耗用的氧气都变成100N/cm2的压强状态下,统一了压强后,就可由使用前后的体积变化算出使用天数。
上面解出的结果,如果先用文字代入并注意到p′1=p′2=p0,即得或p1V1=p2V2+np0V0这就是说,在等温变化过程中,当把一定质量的气体分成两部分(或几部分),变化前后pV值之和保持不变(图2)。
这个结果,实质上就是质量守恒在等温过程中的具体体现。
在气体的分装和混合等问题中很有用。
【例6】如图所示,容器A的容积为VA=100L,抽气机B的最大容积为VB=25L。
当活塞向上提时,阀门a打开,阀门b关闭;当活塞向下压时,阀门a关闭,阀门b打开。
若抽气机每分钟完成4次抽气动作,求抽气机工作多长时间,才能使容器A中气体的压强由70cmhg 下降到7.5cmHg(设抽气过程中容器内气体的温度不变)?【误解】设容器中气体等温膨胀至体积V2,压强由70cmHg下降到7.5cmHg,根据p A VA=p2V2得所需时间【正确解答】设抽气1次后A中气体压强下降到p1,根据p A VA=p1(VA+VB)得第二次抽气后,压强为p2,则同理,第三次抽气后,抽气n次后,气体压强代入数据得:n=10(次)【错因分析与解题指导】【误解】的原因是不了解抽气机的工作过程,认为每次抽入抽气机的气体压强均为7.5cmHg。
事实上,每次抽气过程中被抽气体体积都是VB,但压强是逐步减小的,只是最后一次抽气时,压强才降低至7.5cmHg。
因此,必须逐次对抽气过程列出玻意耳定律公式,再利用数学归纳法进行求解。
【例7】有开口向上竖直安放的玻璃管,管中在长h的水银柱下方封闭着一段长L的空气柱。
当玻璃管以加速度a向上作匀加速运动时,空气柱的长度将变为多少?已知当天大气压为p0,水银密度为ρ,重力加速度为g。
【误解】空气柱原来的压强为p1=p0+h当玻璃管向上作匀加速动时,空气柱的压强为p2,对水银柱的加速运动有p2S-p0S-mg=ma即 p2=p0+ρ(g+a)h考虑空气的状态变化有p1LS=p2L′S【正确解答】空气柱原来的压强为p1=p0+ρgh当玻璃管向上作匀加速运动时,空气柱的压强为p2,由水银柱加速度运动得p2S-p0S-mg=ma∴ p2=p0+ρ(g+a)h气体作等温变化p1LS=p2L′S【错因分析与解题指导】本题是动力学和气体状态变化结合的综合题。
由于牛顿第二定律公式要求使用国际单位,所以压强的单位是“Pa”。
【误解】中p1=p0+h,由动力学方程解得p2=p0+ρ·(g+a)h,在压强的表示上,h和ρ(g+a)h显然不一致,前者以cmHg作单位是错误的。
所以在解答此类习题时,要特别注意统一单位,高为h的水银柱的压强表达为p=ρgh是解题中一个要点。
[例8]如图所示,内径均匀的U型玻璃管竖直放置,截面积为5cm2,管右侧上端封闭,左侧上端开口,内有用细线栓住的活塞。
两管中分别封入L=11cm的空气柱A和B,活塞上、下气体压强相等为76cm水银柱产生的压强,这时两管内的水银面的高度差h=6cm,现将活塞用细线缓慢地向上拉,使两管内水银面相平。
求(1)活塞向上移动的距离是多少?(2)需用多大拉力才能使活塞静止在这个位置上?[分析]两部分气体是靠压强来联系U型玻璃管要注意水银面的变化,一端若下降xcm另一端必上升xcm,两液面高度差为2xcm,由此可知,两液面相平,B液面下降h/2,A管液面上升h/2在此基础上考虑活塞移动的距离[解答](1)对于B段气体p B1=76-6=70(cmHg) p B2=pV B1=11S(cm3) V B2=(11+3)S(cm3)根据玻意耳定律 p B1V B1=p B2V B2对于A段气体p A1=76(cmHg) p A2=p B2=55(cmHg) V A1=11s(cm3) V A2=L'S(cm3)根据玻意耳定律p A1V A1=p A2V A2对于活塞的移动距离:h'=L'+3-L=15.2+3-11=7.2(cm)(2)对于活塞平衡,可知F+p A2S=P0SF=P0S-PS[说明]U型管粗细相同时,一侧水银面下降hcm,另一侧水银面就要上升hcm,两部分液面高度差变化于2hcm,若管子粗细不同,应该从体积的变化来考虑,就用几何关系解决物理问题是常用的方法。
[例9]如图所示,在水平放置的容器中,有一静止的活塞把容器分隔成左、右两部分,左侧的容积是1.5L,存有空气;右侧的容积是3L,存有氧气,大气压强是76cmHg。
先打开阀门K,当与容器中空气相连的U形压强计中左、右水银面的高度差减为19cm时,关闭阀K。
求后来氧气的质量与原来氧气的质量之比(系统的温度不变,压强计的容积以及摩擦不计)。
