分析化学06 络合平衡和络合滴定法
[法学]络合平衡和络合滴定法
![[法学]络合平衡和络合滴定法](https://img.taocdn.com/s3/m/563a1bf605087632311212c0.png)
1
K1= Ka6 = 1010.26 1=K1= 1010.26
1
K2= Ka5 = 106.16 2=K1K2= 1016.42
1
K3= Ka4 = 102.67 3=K1K2K3= 1019.09
1
K4= Ka3 = 102.00 4=K1K2K3K4= 1021.09
1
K5= Ka2 = 101.60 5=K1K2..K5= 1022.69
EDTA在溶液中的存在形式
在高酸度条件下,EDTA可再接受两个H+,形成一 个六元弱酸,在溶液中存在有六级解离平衡:
有七种存在形式: 分布曲线见书170 1)在pH >12时, 以Y 4-形式存在; 2)Y4-形式是配位的有效形式;
EDTA在水溶液中存在六级电离,七 种型体
H6Y2+ =H+ + H5Y+ H5Y+ =H+ + H4Y
● ● ●
[MLn ]= n [M] [L]n
cM=[M]+[ML]+[ML2]+…+[MLn]
=[M](1+ 1 [L]+ 2 [L]2+…+ n [L]n)
分布分数
δM=[M]/cM = 1/(1+1[L]+2[L]2+…+n[L]n)
δML=[ML]/cM = 1[L]/(1+1[L]+2[L]2+…+n[L]n) = δM1[L]
Ka1=
[H+][H5Y]
[H6Y]
Ka2=
[H+][H4Y] [H5Y]
= 10-0.90 = 10-1.60
分析化学 络合平衡与络合滴定0.

OH-
① M的羟基效应系数(M(OH))
M(OH)= 1 + ∑i[OH]i
L
MOH
● ● ●
ML
● ● ●
② M的络合效应系数(M(L))
M(L)= 1 + ∑i[L]i ③ M的总副反应系数(M) M= ∑M(i)-(n-1)
0.02 12.50 123.2 103 250 100% 15.4% 1.0 50
ZrO
2
(2)加浓HNO3使Fe2+氧化到Fe3+后,由于是Zr已经滴定完全, 而lgKFe(III)Y/=25.10-18.10>>6,所以在此情况下滴定的是Fe。 Fe2O3的含量为:
pM=lgKMY-3.0
[MY] ≈cMsp
二、络合滴定
——滴定过程中各组分浓度的计算
(4)滴定突越范围的影响因素 滴定突跃范围 (3.0+pcMsp, lgKMY-3.0)
金属离子浓度: 增大10倍,突跃增加1个pM单位(下限) KMY: 增大10倍,突跃增加1个pM单位(上限)
M的副反应系数
MY
M
Y
一、络合平衡
(1)副反应系数( ) ① 副反应系数的定义 未参加主反应组分的浓度[X] 与平衡浓度[X]的比值 =
没有参与主反应的该组分的总浓度 组分的平衡浓度
[x] = [x] 1
应用
组分的平衡浓度 反应的条件平衡常数
一、络合平衡
② 滴定剂EDTA的副反应及副反应系数 M + Y = MY
H+
① EDTA的酸效应系数(Y(H))
分析化学 络合平衡和络合滴定法(2)

最低酸度
金属离子的水解酸度-避免生成氢氧化物沉淀 对 M(OH)n
[OH-]=
n
Ksp [M]
例 0.02mol/LZn2+ Zn(OH)2 Ksp=10-15.3
可求得:pH≤7.2
? 可在pH10的氨性缓冲液中用Zn2+标定EDTA 最佳酸度 金属指示剂也有酸效应,与pH有关 pMep=pMsp 时的pH ?
络合掩蔽注意事项:
1. 不干扰待测离子: 如pH10测定Ca2+、Mg2+, 用F-掩蔽Al3+, 则 CaF2 ↓、MgF2 ↓
2. 掩蔽剂与干扰离子络合稳定:
3. 合适pH F-, pH>4; CN-, pH>10)
b 沉淀掩蔽法
加沉淀剂,降低[N]
例:Ca2+ Mg2+混合溶液中Ca2+的测定 lgKCaY=10.7, lgKMgY=8.7
b 单一金属离子滴定的适宜pH范围
最高酸度
csp=0.01mol· L-1, lgKMY≥8 lgKMY= lgKMY-lg Y(H)≥8, (不考虑 M) 有 lgαY(H) ≤lgK(MY) - 8 对应的pH即为pH低,
例如: KBiY=27.9 lgY(H)≤19.9 pH≥0.7 KZnY=16.5 lgY(H)≤8.5 pH≥4.0 KMgY=8.7 lgY(H)≤0.7 pH≥9.7
6.4 络合滴定基本原理
络合滴定曲线:溶液pM随滴定分数(a)变化的曲线 在络合滴定中,随着EDTA滴定剂的不断加入,被滴定 金属离子的浓度不断减少, 以被测金属 离子浓度的负对数pM(pM=-lg[M])对 加入滴定剂体积作图,可得络合滴定曲 线即pM~V曲线。 见书P186
第6章_络合平衡和络合滴定法-1

例 用EDTA滴定Zn
2+
例1:计算pH=5.00时EDTA的
Y(H)
lg Y(H)~pH图
其它络合剂的酸效应系数
b 金属离子的副反应系数
M
M(NH3)
= 1+[NH3]1+[NH3] 3 4 2+[NH3] 3+[NH3] 4 两个副反应同时存在时: 若有n个副反应: 金属离子的副反应系数小结
不同pH下EBT的(pMg)t
-1
= 16.5 -
1.4 - 3.2 = 11.9
滴定突跃的计算
0.02000 mol· L-1EDTA滴定20.00 2+ mL同浓度的Zn , pH=9.0,c(NH3)= 0.2 mol · L-1, lgK (ZnY)=11.9
EDTA滴定同浓度的Zn 的滴 定曲线
2+
EDTA滴定不同浓度的金属 离子 不同稳定性的络合体系的 滴定
显色剂
EDTA的性质
溶解度 EDTA络合物的特点
广泛,EDTA几乎能与所有的金
属离子形成络合物; 稳定,lgK > 15; 络合比简单, 一般为1:1; 络合反应速度快,水溶性好; EDTA与无色的金属离子形成无 色的络合物,与有色的金属离子 形成颜色更深的络合物。
铜氨络合物生成函数图
一些浓度关系 络合滴定处理思路
HIn+M M 色A 色B 常用金属离子指示剂 MIn + MY + HIn
EBT(铬黑T) EBT本身是酸碱物质
二甲酚橙 (XO)
二甲酚橙(XO)可作滴定 ZrO2+, Bi3+, Th4+, Zn2+, Pb2+, 2+ 2+ Cd , Hg , 稀土等金属离子 时的指示剂, 在pH<6时使 用,络合物颜色为红色。
分析化学第六章配位滴定法

第一节 概述
➢ 配位滴定法: 又称络合滴定法
以生成配位化合物为基础的滴定分析方法
➢ 滴定条件:
定量、完全、迅速、且有指示终点的方法
➢ 配位剂种类:
无机配位剂:形成分级络合物,简单、不稳定 有机配位剂:形成低络合比的螯合物,复杂而稳定 ➢ 常用有机氨羧配位剂 ——乙二胺四乙酸
乙二胺四乙酸:EDTA
➢ 结论:pH, [H] Y(H), [Y4] 副反应越严 pH Y( H) ; pH12Y(H) 1,配合物
练习
例:计算pH5时,EDTA的酸效应系数及对数值,若 此时EDTA各种型体总浓度为0.02mol/L,求[Y4 -]
解:
Y(H )1111 0 0 5 .3 04 1 1 0 1.3 0 0 1 4 60 .2
✓ 注:[Y’] ——EDTA 与 N 配合物平衡浓度 和参与配位的Y4-平衡浓度之和
[Y] ——参与配位反应的Y4-的平衡浓度
➢ 结论: Y(N) ,[Y]副反应越严重
3. Y的总副反应系数[同时考虑酸效应和共存离子效应]
Y[[Y Y ']][H 6Y2][H 5Y[ Y ] 4 ][Y4][N]Y
p H 1 1 lg Z ( 0 H n ) 5 .4 , Z ( O n ) H 2 .5 1 50
Z n Z(N n3 )H Z(O n) H 1 5 .6 150
(三)配合物MY的副反应系数
MHY
KMHY MY H
M(OH)Y KM(OH)Y MYOH
M Y (H ) M M Y Y ' M Y M Y M H Y 1 K M H YH
四、指示剂的封闭、僵化现象及消除方法
❖ 指示剂的封闭现象:化学计量点时不见指示剂变色
无机及分析化学06酸碱平衡与酸碱滴定法

无机及分析化学06酸碱平衡与酸碱滴定法酸碱平衡是无机及分析化学中的一个重要概念,它涉及到溶液中酸和碱之间的相互作用和平衡状态。
酸碱滴定法是一种常用于测定溶液中酸碱性质和浓度的分析方法。
本文将对酸碱平衡和酸碱滴定法进行详细介绍。
首先,我们来介绍酸碱平衡的基本概念。
酸碱平衡是指溶液中酸和碱之间的反应和平衡状态。
在溶液中,酸能够释放出H+离子,而碱能够接受H+离子。
这个过程被称为质子(H+)转移反应。
在酸碱平衡中,有两个重要的概念:酸性度(pH)和酸度常数(Ka)。
pH是用来表示溶液酸碱性强弱的指标,它的定义是pH=-log[H+],其中[H+]代表溶液中的氢离子浓度。
pH值越小,表示溶液越酸;pH值越大,表示溶液越碱。
在中性水溶液中,pH值为7酸度常数Ka用来衡量酸的强弱,它的定义是Ka=[H+][A-]/[HA],其中[H+]代表酸溶液中的氢离子浓度,[A-]代表酸的共轭碱的浓度,[HA]代表未解离酸的浓度。
Ka值越大,表示酸越强。
酸碱滴定法是一种常用于测定溶液中酸碱性质和浓度的分析方法。
在酸碱滴定中,通常会使用滴定管、酸度计、酸碱指示剂等实验装置和试剂。
滴定过程中需要滴定剂、指示剂和滴定的原料溶液。
滴定过程中,首先准备好要分析的溶液和滴定剂。
然后,用滴定管滴入适量的滴定剂到容器中,然后再加入适当的指示剂。
当滴定剂反应完全与原料溶液中的酸或碱反应完成时,指示剂的颜色将发生明显的变化。
通过测量滴定剂用量,可以计算出原料溶液中酸或碱的浓度。
酸碱滴定法有许多不同的类型,其中最常见的有酸碱滴定、氧化还原滴定和络合滴定。
酸碱滴定是根据滴定剂对溶液中的酸或碱进行中和反应来测定其浓度。
氧化还原滴定是通过滴定剂与溶液中的氧化还原反应来测定其浓度。
络合滴定是通过滴定剂与溶液中的金属离子形成络合物来测定其浓度。
酸碱滴定法在实际应用中有广泛的用途。
例如,它可以用于测定食品和药品中的酸碱度,以确保其安全和合规性。
此外,酸碱滴定还可以用于水质分析、环境监测和药物分析等领域。
【分析化学】络合滴定法

O C O C CH2 O
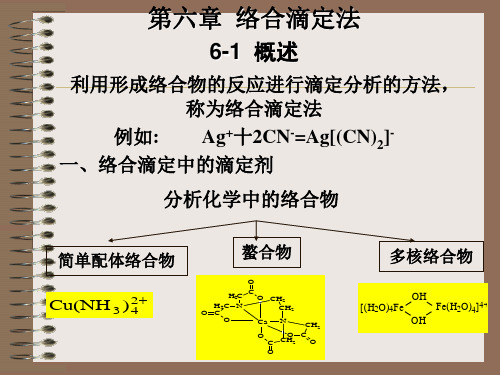
分析化学中的络合物
简单配体络合物 螯合物
O
多核络合物
Cu(NH3 ) 2 4
H2C H2C N O C O
C
O CH2 CH2 Ca O N CH2
[(H2O)4Fe
OH OH
Fe(H2O)4]4+
O C O C CH2 O
简单配体络合物:中心离子和单齿配体(只含有一个配位原子的配体)所 形成,也称为简单络合物。简单络合物不稳定。与多元酸相类似,简单络 合物是逐级形成的。如:Cu2+与单基配位体NH3的反应: Cu2+ + NH3 === Cu(NH3)2+ K1=104.18 Cu(NH3)2+ + NH3 === Cu(NH3)22+ K2=103.48 Cu(NH3)22+ + NH3 === Cu(NH3)32+ K3=102.87 Cu(NH3)32+ + NH3 === Cu(NH3)42+ K4=102.11 正是因为这一性质限制了简单络合物在滴定分析中的应用,仅作为掩蔽剂 、显色剂和指示剂,而作为滴定剂的只有以CN-为络合剂的氰量法和以Hg2 +为中心离子的汞量法具有一些实际意义。 如:①以AgNO3标准溶液测定氰化物,反应如下: 2CN-+Ag+===[Ag(CN)2]- 此反应的累积稳定常数,相当稳定。当滴定到计量点时,稍过量的Ag+ 与Ag(CN)2-结合生成白色AgCN沉淀,使溶液变浑浊而指示终点。 Ag++Ag(CN)2-===2AgCN↓(白色) ②以Hg2+溶液作滴定剂,二苯胺基脲作指示剂,滴定Cl-,反应如下: Hg2++2Cl-===HgCl2 生成的HgCl2是解离度很小的络合物,称为拟盐或假盐。过量的汞盐与指示 剂形成兰紫色的螯合物以指示终点的到达。
第六章 络合滴定法
K n [ML][L] ML+ L
[ML2]
ML2
K2
[ML2] [ML][L]
==
K
[MLn 1][L] [MLn]
MLn-1+
L
MLn
Kn
[MLn] [MLn 1][L]
络合物的形成常数(对MLn型来讲),其一般规律是 K1>K2>K3… 原因:随着络合体数目的增多, 配体间的排斥作用增强,稳定性下降。
M=M(L)+M(OH)-1
(三)络合物MY的副反应 pH<3,形成酸式络合物,MHY; pH>6,形成碱式络合物,MOHY。 由于这两种络合物不稳定,一般情况
下,可忽略不计。
二、MY络合物的条件形成常数
条件形成常数亦叫表观稳定常数或有效稳定
常数,它是在有副反应发生的情况下络合物的 实际稳定常数。
[HY] [Y][H+
]
=
1 Ka
6
β1H=K1H
HY+H+=H2Y ︰
K
H 2
=
[H2Y] [HY][H+
]
=
1 Ka5
︰
β2H=K1H K2H ︰
:
︰
︰
H5Y+H+=H6Y
K6H
=
[H6Y] [H5Y][H+
]
=
1 Ka1
β6H=K1H K2H … K6H
累积质子化常数的应用: 由各级累积质子化常数计算溶液中 EDTA各型体的平衡浓度。
因此,根据上述各式,只要知道β值,就 可以计算出在不同游离氨的浓度下,各型 体的δ值。如图所示。
锌氨络合物各型体的δ- lg [NH3] 相邻两级络合物分布曲线 的交点处有:
分析化学第6章-络合滴定法介绍

§6-2 EDTA与金属离子的配合物及其稳定性 一、EDTA的性质
乙二胺四乙酸 (EDTA) 是含有羧基和氨基的螯合剂, 能与许多阳离子形成稳定的螯合物。 乙二胺
N CH2 CH2 N
ethylenediamine
溶解度 EDTA性质 酸 性 配位性质
12
1、EDTA的溶解度 EDTA 在 水 中 的 溶 解 度 较 小 ( 22℃ 时 溶 解 0.02g/100mL 水),也难溶于酸和有机溶剂,易溶于 NaOH或NH3溶液形成相应的盐。故常把它制成二钠盐 (22℃ 时 溶 解 11.1g/100mL 水 , 约 0.3mol/L ) , 用 Na2H2Y·2H2O表示,一般也简称EDTA,pH约为4.5。
沉淀剂 例如,8-羟基喹啉与镁离子生成螯合物沉淀:
H H O Mg(H2O)62+ + 2 OH N N O Mg O N + 2 H+ + 4 H2O
O H H
掩蔽剂 例如,用 KCN 掩蔽Zn2+,消除其对 EDTA 滴定 Pb2+的干扰。
Zn 2 4CN Zn(CN) 2 4
溶液酸度增大, pH减小,上述平衡向左移动,H6Y2+离子 浓度增加; 反之,若溶液酸度减小, pH 值增大,则上述平衡向右移 动,Y4-浓度增加。 在一定的pH条件下,以其中的一种或两种存在形式为主; 其它型体所占的百分数很少。
18
1.0
pKa1=0.9 pKa2=1.6 pKa3=2.0 pKa4=2.67 pKa5=6.16 pKa6=10.26
20
二、 EDTA与金属离子的配合物
1、EDTA与金属离子配位反应的特点 (1)EDTA通常和金属离子形成1:1的配合物。 M2+ +Y4- = MY2-;M3+ +Y4- = MY-;M4+ +Y4- = MY 所以,反应中无逐级配位现象,反应的定量关系明确。
分析化学06 络合平衡和络合滴定法

EDTA
H6 Y2+ =H+ + H5 Y+
[H+][H5Y] Ka1= [H Y] = 10-0.90 6
H5Y+ =H+ + H4Y H4Y =H+ + H3YH3Y- =H+ + H2Y2-
Ka2=
[H+][H4Y] [H5Y]
= 10-1.60
[H+][H3Y] Ka3= = 10-2.00 [H4Y] [H+][H2Y] Ka4= = 10-2.67 [H3Y]
6.2 络合平衡常数
1 络合物的稳定常数 (K, ) M + Y = MY [MY] KMY= [M][Y]
M + L = ML ML + L = ML2
● ● ●
逐级稳定常数 Ki [ML] K1= [M][L]源自[ML2] K2= [ML][L]
● ● ●
累积稳定常数
1=K1=
[ML] [M][L]
M
OHL
+ Y = MY
ML
● ● ●
MOH
● ● ●
M(OH)n MLn M
M(OH) =1 +1[OH-]+ 2[OH-]2+ …+ n[OH-]n
多种络合剂共存
M = M(L1)+ M(L2) +…+ M(Ln)-(n-1) M(L) =1+1[L] +2[L]2+…+n[L]n
● ● ●
MLn-1 + L = MLn
[MLn ]= n [M] [L]n
cM=[M]+[ML]+[ML2]+…+[MLn]
络合滴定法原理

络合滴定法原理络合滴定法是一种常用的分析化学方法,它通过络合剂和金属离子之间的化学反应来确定金属离子的浓度。
络合滴定法的原理是基于络合剂和金属离子形成络合物的化学平衡反应,通过滴定确定金属离子的浓度。
络合滴定法广泛应用于环境监测、食品安全、药物分析等领域,具有操作简便、准确度高的特点。
在络合滴定法中,络合剂通常是一种具有多个配位基团的有机分子,它可以与金属离子形成稳定的络合物。
络合剂和金属离子之间的络合反应是一个动态的化学平衡过程,滴定过程中,当络合剂的摩尔浓度略大于金属离子的摩尔浓度时,络合剂会与金属离子形成络合物,从而使反应达到化学平衡。
通过滴定时加入的络合剂的体积和金属离子的摩尔浓度之间的关系,可以确定金属离子的浓度。
络合滴定法的原理基于化学平衡反应的定量分析,它要求络合剂和金属离子之间的络合反应是可逆的,并且在一定条件下达到化学平衡。
在实际应用中,选择合适的络合剂对于络合滴定法的准确性和灵敏度至关重要。
另外,滴定过程中的指示剂的选择也会影响络合滴定法的准确性,指示剂的变色点应与络合滴定终点相一致。
络合滴定法的优点在于操作简便、准确度高、适用范围广,因此在分析化学中得到了广泛的应用。
它可以用于测定水样中的金属离子浓度,如铁离子、铜离子、镍离子等。
此外,络合滴定法还可以用于药物分析、环境监测、食品安全等领域。
在实际应用中,需要根据不同的分析对象和需要确定的金属离子种类选择合适的络合剂和指示剂,并严格控制滴定条件,以确保测定结果的准确性和可靠性。
总之,络合滴定法是一种重要的分析化学方法,它通过络合剂和金属离子之间的化学反应来确定金属离子的浓度。
络合滴定法的原理是基于化学平衡反应的定量分析,它具有操作简便、准确度高的特点,广泛应用于环境监测、食品安全、药物分析等领域。
在实际应用中,需要选择合适的络合剂和指示剂,并严格控制滴定条件,以确保测定结果的准确性和可靠性。
通过对络合滴定法原理的深入理解和实践操作,可以更好地应用于实际分析工作中,为科学研究和生产实践提供有力的支持。
络合滴定法——精选推荐

第六章 络合滴定法络合滴定法是以络合反应为基础的滴定分析方法。
从路易斯酸碱理论来说,络合反应也是路斯酸碱反应,所以络合滴定与酸碱滴定法有许多相似之处,学习时可对照比较,但络合滴定中也有自身的特点,内容更复杂。
络合反应在分析化学中应用广泛,有关理论和实践知识是分析化学重要的内容之一。
6.1 络合滴定分析中常用的络合剂和络合平衡 6.1.1 常用的络合剂络合反应中常用的络合剂很多,如测定金属离子的络合滴定剂、掩蔽剂、指示剂和金属缓冲溶液等等。
络合剂的分类方式也很多,按络合剂中的键合原子分类,可分为:(1)氧配位螯合剂:如磺基水扬酸、酒石酸、柠檬酸、乙酰丙酮等;2.氮配位络合剂:如氨、乙二胺、联吡啶、邻二氮菲等;(3)氧、氮配位络合剂:8-羟基喹啉、氨三乙酸及EDTA 氨羧络合剂等;(4)硫配位螯合剂:如铜试剂、2-巯基苯并噻唑等。
1. 氨羧络合剂络合滴定中重要的滴定剂是具有-N(CH 2COOH)2基团氨羧络合剂,常见的氨羧络合剂见下表。
2. 乙二胺四乙酸的性质:(1) 乙二胺四乙酸结构:(ethylenediaminetetreacetic acid )简称EDTA ,具有结构如图所示。
一个分子中含有二个-N(CH 2CO OH)2基团,与金属离子结合时有六个配位原子,可形成五个五元螯合环,具有很强的络合性能,是常用的络合滴定剂和掩蔽剂。
(2) EDTA 性质:EDTA 在水中的溶解度不大,EDTA 的二钠盐溶解度较大,EDTA 是六元酸,可用H 6Y 2+表示,有六级离解常数。
各级解离常数与对应的质子化常数如后。
,,,++++=Y H H Y H 5269.0a H69.02Y 6H Y 5H H a 101,10)()()(11====-+++K K c c c K Y H H Y H 45+=++6.1a H56.1Y 5H Y 4H H a 101,10)()()(22====-++K K c c c K -++=Y H H Y H 340.2H40.2Y 4(H )Y 3(H )(H a 10 ,10)3===--+K c c cK,,,各组分的分布分数如上图所示。
也谈络合平衡和络合滴定基本理论处理方法

也谈络合平衡和络合滴定基本理论处理方法
络合平衡和络合滴定是化学实验中常见的两种技术。
络合平衡是指两个物质之间相互作用形成的络合物的总量是不变的,而络合滴定是指在滴定溶液中,由于络合物的形成而出现的滴定曲线。
络合平衡和络合滴定可以有效地识别物质的化学性质,并对络合物的定义、构建结构和分子量、稳定性和比较性等方面有着重要的应用。
一、络合平衡的基本理论
1. 络合型:络合物由配体和配位子两种物质组成。
配体是参与络合反应的物质分子,主要是具有氧化力或能够负荷交换,如碱性酸类、碱性氨基、硫酸根等,配位子则是参与络合反应的物质物种,如金属离子、离子聚合物等。
2. 络合稳定性:络合物的稳定性与配体和配位子的恵性、外层电荷的数量和结构有关。
当络合物形成时,其稳定性会受到络合剂的影响,其中配合物的稳定性等于配体的稳定性减去配位子系数。
3. 络合反应:络合反应是特定物质形成特定络合物的化学反应,例如:水对碱性离子形成络合离子,某些具有双价的金属离子可以形成新的双金属络合物等。
二、络合滴定的基本理论
1. 络合滴定反应:络合滴定是物质在不同梯度溶液下的滴定反应,其反应模式可以分为络合的溶解与分离,其只受配体的类目和浓度的影响,亦可与对游离态离子比较。
2. 络合滴定反应的步骤:(1)把配体、配位子溶解于反应溶液中;(2)配体和配位子之间形成络合物;(3)加入滴定剂,使测定物质达到滴定状态;(4)测定滴定曲线;
(5)推算结果,得出配位子的浓度及类目。
3. 滴定反应的原理:络合物是由独特的电子配位形成的复合物,在滴定溶液中络合物加入一定浓度的测定剂,由于受到离子场理论的影响,络合物会发生分解,形成其他物质,从而影响滴定曲线的变化。
郑州大学分析化学课件之第六章络合平衡和络合滴定法.ppt

质子平衡 (Proton Balance): 溶液中酸失去质子数目等于碱得到质子数目。
物料平衡
Analytical Chemistry 分析化学
各物种的平衡浓度之和等于其分析浓度。
质量平衡方程(MBE)
2 10-3 mol/L ZnCl2 和 0.2 mol/L NH3
对于Al3+,å=900,依照同样的计算步骤可得
γAl3+= 0.11 aAl3+=0.0055mol/L 通过对比发现离子强度对高价离子影响较大
5.1.2
溶液中的酸碱反应及平衡常数
Analytical Chemistry 分析化学
对于酸碱的定义,分析化学中广泛使用的是1923年 丹麦化学家布朗斯特德(J.N.Bronsted)提出的质子理 论。
如Cl-、Ac-、NH3、PO43-等。
酸失去质子后变成相应的共轭碱;而碱接受质子后变成 相应的共轭酸。如下式表示:
HA ⇌ A- + H+
酸
碱 质子
HA-A-称为共轭酸碱对
共轭酸碱彼此只相差一个质子。
2. 酸碱半反应
Analytical Chemistry 分析化学
酸给出质子形成共轭碱,或碱接受质子形成共
以质子传递反应为基础的滴定分析法。 是滴定分析中最重要的方法之一。 应用的对象:一般酸、碱以及能与酸、碱 直接或间接发生质子转移反应的物质。
基本概念
Analytical Chemistry 分析化学
1. 酸碱定义和共轭酸碱对
酸:凡能给出质子的物质是酸。
如HCl、HAc、NH4+、HPO42-等; 碱:凡能接受质子的物质是碱。
分析化学 第六章 络合滴定法

累积
β1
β2
β3
β4
β5
1023.0
β6
1023.9
28
常数 1010.34 1016.58 1019.38 1021.40
2013-7-29 NWNU-Department of Chemistry
例1 计算 pH5.00时EDTA的αY(H)
1 [H ] 1 [H ] 2 [H ] 6 1 1 1 6 Ka Ka Ka Ka Ka Ka Ka Y(H) 1 [Y']
2 6
6 1 2 3 4 5 6
[Y]
Y(H)
[Y'] [Y] Y(H) 酸效应系数
Ka,3=1.0 ×10-2=10-2.0 Ka,4=2.14×10-3=10-2.67 Ka,5=6.92×10-7=10-6.16 Ka,6=5.50×10-11=10-10.26
15
NWNU-Department of Chemistry
不同pH值下EDTA的主要存在型体
pH <0.9 0.9~1.6 1.6~2.0 2.0~2.7 2.7~6.2 EDTA主要存在型体 H6Y2+ H5Y+ H4Y H3YH2Y2-
NWNU-Department of Chemistry 24
2013-7-29
6.4 副反应系数和条件稳定常数
OH-
M
A
MA
● ● ●
+
H+
● ● ●
Y
N
=
H+
MY(主反应) OH
MOH
● ● ●
HY NY
MH MOHY Y
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Ka1=
[H+][H5Y]
[H6Y]
Ka2=
[H+][H4Y] [H5Y]
Ka3=
[H+][H3Y] [H4Y]
Ka4=
[H+][H2Y] [H3Y]
Ka5=
[H+][HY] [H2Y]
[H+][Y]
Ka6= [HY]
= 10-0.90 = 10-1.60 = 10-2.00 = 10-2.67 = 10-6.16 = 10-10.26
6.3副反应系数和条件稳定常数
M
OH-
L
+Y
H+
=
N
MY
主反应
H+
OH-
MOH
ML
HY
NY
MHY
MOHY
副
●
●
●
●
●
●
●
●
●
●
●
●
●
反 应
M(OH)n
MLn
H6Y
M
Y
MY
1 副反应系数 副反应系数:为未参加主反应组分的浓度[X] 与平衡浓度[X]的比值,用表示。
[M]
M=
[M]
[Y]
Y=
第6章 络合平衡和络合滴定法
6.1 常用络合物 6.2 络合平衡常数 6.3 副反应系数及条件稳定常数 6.4 络合滴定基本原理 6.5 络合滴定条件 6.6 络合滴定的方式和应用
6.1 常用络合物
以络合反应和络合平衡为基础的滴定分析方法 简单络合剂: NH3, Cl-, F-
螯合剂: 乙二胺,EDTA等
● ● ●
MLn-1 + L = MLn
● ● ●
Kn=
[MLn] [MLn-1][L]
K 表示相邻络合 物之间的关系
累积稳定常数
1=K1=
[ML] [M][L]
2=K1K2=
[ML2] [M][L]2
●
●
●
n=K1K2 ···Kn=
[MLn] [M][L]n
表示络合物与
配体之间的关系
酸可看成质子络合物
EDTA在水溶液中的存在形式
在高酸度条件下,EDTA是一个六元弱酸,在溶液中存在有六级离解平衡和七种存 在形式:
不同pH溶液中,EDTA各种存在形式的分布曲线:
(1)在pH<1时,主要以H2Y形式参在 (2)在pH >10.26时, 以Y4-形式存在; Y4-形式是配位的有效形式;
EDTA
H6Y2+ =H+ + H5Y+ H5Y+ =H+ + H4Y H4Y =H+ + H3YH3Y- =H+ + H2Y2H2Y2- =H+ + HY3HY3- =H+ + Y4-
Y4- + H+ = HY3HY3- + H+ = H2Y2H2Y2- + H+ = H3YH3Y- + H+ = H4Y H4Y + H+ = H5Y+ H5Y+ + H + = H6Y2+
1
K1= Ka6 = 1010.26 1=K1= 1010.26
1
K2= Ka5 = 106.16 2=K1K2= 1016.42
分布分数
δM=[M]/cM = 1/(1+1[L]+2[L]2+…+n[L]n)
δML=[ML]/cM = 1[L]/(1+1[L]+2[L]2+…+n[L]n) = δM1[L]
● ● ●
δMLn=[MLn]/cM = n[L]n/(1+1[L]+2[L]2+…+n[L]n) = δMn[L]n
[Y]
MY=
[MY] [MY]
M
OH-
L
+Y
H+
=
N
MY
主反应
H+
OH-
MOH
ML
HY
NY
MHY
MOHY
副
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
●
反 应
M(OH)n
MLn
H6Y
[M]
[Y]
[MY]
a 络合剂的副反应系数
[Y]
Y: Y=
[Y]
Y(H): 酸效应系数 Y(N): 共存离子效应系数
M+
Y
H+
lgK
Hg2+ 21.8 Th4+ 23.2 Fe3+ 25.1 Bi3+ 27.9
6.2 络合平衡常数
1 络合物的稳定常数 (K, ) M + Y = MY
KMY=
[MY] [M][Y]
M + L = ML
逐级稳定常数 Ki [ML]
K1= [M][L]
ML + L = ML2
K2=
[ML2] [ML][L]
平均配位数:金属离子络合配体的平均数
n CL [L] C[ M ]
n ([L] [ML] 2[ML2 ] ... n[MLn ]) [L] [M ] [ML] [ML2 ] ... [MLn ]
n
ii [L]i
i 1 n
1 i [L]i
i 1
ML 2 ML2 ... n MLn
H3N
NH3
Cu 2+
H3N
NH3
Cu2+-NH3 络合物
H2C H2C
H2
H2
N
N
CH2
Cu
CH2
N
N
H2
H2
乙二胺 - Cu2+
:: ::
EDTA
乙二胺四乙酸 (H4Y)
HOOCH2C
CH2COO-
··
· ·
NH+ C
C
NH+
H2 H2
-OOCH2C
CH2COOH
EDTA一般特性
(1) 多元酸,可用 H4Y 表示; (2) 在水中的溶解度很小(22℃, 0.02 g /100 mL 水),也难溶于酸和一般的有机溶剂,但 易溶于氨溶液和苛性碱溶液中,生成相应的盐; (3) 常用其二钠盐 Na2H2Y·2H2O,(22℃, 11.1 g / 100 mL水),饱和水溶液的浓度约为 0.3 mol·L-1,pH 约为 4.5。
2 溶液中各级络合物的分布
M + L = ML
ML + L = ML2
● ● ●
MLn-1 + L = MLn
[ML] = 1 [M] [L]
[ML2] = 2 [M] [L]2
● ● ●
[MLn ]= n [M] [L]n
cM=[M]+[ML]+[ML2]+…+[MLn] =[M](1+ 1 [L]+ 2 [L]2+…+ n [L]n)
N
HY
NY
● ● ●
H6Y
Y
= MY
1
K3= Ka4 = 102.67 3=K1K2K3= 1019.09
1
K4= Ka3 = 102.00 4=K1K2K3K4= 1021.09
1
K5= Ka2 = 101.60 5=K1K2..K5= 1022.69
1
K6= Ka1 = 10 0.90 6=K1K2..K6 = 1023.59
M-EDTA螯合物的立体构型
O
H2C
C O
C H2C O
N
Ca O
O
H2 C CH2
N CH2
O
C
CH2 O
C
O
EDTA 通常与金属离 子形成1:1的螯合物
多个五元环
某些金属离子与EDTA的形成常数
lgK
lgK
Na+ 1.7
Mg2+ 8.7 Ca2+ 10.7
lgK
Fe2+ 14.3 Al3+ 16.1 Zn2+ 16.5 Cd2+ 16.5 Pb2+ 18.0 Cu2+ 18.8
