无机化学简明教程(天津大学)课后习题参考答案汇编
天津大学无机化学第五版习题答案

第1章 化学反应中的质量关系和能量关系 习题参考答案1.解:1.00吨氨气可制取2.47吨硝酸。
2.解:氯气质量为2.9×103g 。
3.解:一瓶氧气可用天数33111-1222()(13.210-1.0110)kPa 32L9.6d 101.325kPa 400L d n p p V n p V -⨯⨯⨯===⨯⨯4.解:pV MpVT nR mR== = 318 K 44.9=℃ 5.解:根据道尔顿分压定律ii n p p n=p (N 2) = 7.6⨯104 Pap (O 2) = 2.0⨯104 Pa p (Ar) =1⨯103 Pa6.解:(1)2(CO )n = 0.114mol; 2(CO )p = 42.87 10 Pa ⨯(2)222(N )(O )(CO )p p p p =--43.7910Pa =⨯ (3)4224(O )(CO ) 2.6710Pa0.2869.3310Pan p n p ⨯===⨯ 7.解:(1)p (H 2) =95.43 kPa (2)m (H 2) =pVMRT= 0.194 g 8.解:(1)ξ = 5.0 mol(2)ξ = 2.5 mol结论: 反应进度(ξ)的值与选用反应式中的哪个物质的量的变化来进行计算无关,但与反应式的写法有关。
9.解:∆U = Q p - p ∆V = 0.771 kJ 10.解: (1)V 1 = 38.3⨯10-3m 3= 38.3L(2) T 2 =nRpV 2= 320 K (3)-W = - (-p ∆V ) = -502 J (4) ∆U = Q + W = -758 J (5) ∆H = Q p = -1260 J11.解:NH 3(g) +45O 2(g) 298.15K−−−−→标准态NO(g) + 23H 2O(g) m r H ∆= - 226.2 kJ ·mol -1 12.解:m r H ∆= Q p = -89.5 kJ m r U ∆= m r H ∆- ∆nRT= -96.9 kJ13.解:(1)C (s) + O 2 (g) → CO 2 (g)m r H ∆ = m f H ∆(CO 2, g) = -393.509 kJ ·mol -121CO 2(g) + 21C(s) → CO(g)m r H ∆ = 86.229 kJ ·mol -1CO(g) +31Fe 2O 3(s) → 32Fe(s) + CO 2(g)m r H ∆ = -8.3 kJ ·mol -1各反应 m r H ∆之和m r H ∆= -315.6 kJ ·mol -1。
无机化学第四版第五章思考题与习题 - 无机化学简明教程 天津大学 杨宏孝 第四版 课后思考题和习题答案

第五章原子结构与元素周期性-思考题1.量子力学的轨道概念与波尔原子模型的轨道有什么区别和联系?解:量子力学的原子轨道是解薛定谔方程得到的,以满足量子化条件为前提的,适用于所有原子;玻尔先假定了一个量子化条件,从经典理论推导出来的,但只适用于氢原子,多电子原子不适用。
2. .量子力学原子模型是如何描述核外电子运动状态的?解:用四个量子数: 主量子数--------描述原子轨道的能级副量子数------ 描述原子轨道的形状角量子数-------描述原子轨道的伸张方向自旋量子数---------描述电子的自旋方向.3. 为什么任何原子的最外层最多只能有8个电子,次外层最多只能有18个电子? 解:根据能量最低原理,泡利不相容原理以及洪特规则,我们就可以推算出各电子层,电子亚层和轨道中最多能容纳多少电子,以及每一个原子的核外电子排布形式,从结果上看,最外层只出现s亚层和p亚层,最都只能有8个电子,而次外层只会出现s、p、d亚层,最有只能有18个电子。
4. 为什么周期表中各周期的元素数目并不一定等于原子中相应电子层的电子最大容量数(2n2)?解:因为存在能级交错现象,比如d区原子,最外层为n,但原子数目取决于n-1的d亚层的电子容量。
如第4-7周期的原子数据远远大于2n2。
5. 量子数n=3,l=1的原子轨道的符号是怎样的?该类原子轨道的形状如何?有几种空间取向?共有几个轨道?可容纳多少个电子?解:原子轨道符号位3p,原子轨道的形状为哑铃形,有3种空间取向,共3个轨道,可容纳6个电子。
6.(1) 试写出s区,p区,d区及ds区元素的价层电子构型.解:s区ns1-2 p区ns2np1-6 d区(n-1)d1-9ns1-2 ds区(n-1)d10ns1-2 (2) 具有下列价层电子构型的元素位于周期表中哪一个区?它们各是金属还是非金属?价层电子构型ns2 ns2np5 (n-1)d2ns2 (n-1)d10ns2所在区s p d ds金属或非金属金属非金属金属金属11. 已知某副元素的A原子,电子最后填入3d,最高氧化数为+4,元素B的原子,电子最后填入4p, 最高氧化数为+5.回答下列问题:(1) 写出A,B元素原子的电子分布式;(2) 根据电子分布,指出它们周期表中的位置(周期,区,族).解:(1)A:1s22s22p63s23p63d24s2B:1s22s22p63s23p63d104s24p3(2) A: 四周期,d区,IVB族元素B:四周期,p区,V A族元素习题1.在26Fe原子核外的3d,4s轨道内,下列电子分布哪个正确? 哪个错误? 为什么?答:(1) 不符合能量最低原理;(2) 不符合能量最低原理和洪特规则;(3) 不符合洪特规则;(4) 不符合泡利不相容原理;(5) 正确。
(精选)无机化学简明教程(天津大学)课后习题参考答案

第1章 化学反应中的质量关系和能量关系 习题参考答案1.解:1.00吨氨气可制取2.47吨硝酸。
2.解:氯气质量为2.9×103g 3.解:一瓶氧气可用天数33111-1222()(13.210-1.0110)kPa 32L9.6d 101.325kPa 400L d n p p V n p V -⨯⨯⨯===⨯⨯4.解:pV MpVT nR mR== = 318 K 44.9=℃ 5.解:根据道尔顿分压定律ii n p p n=p (N 2) = 7.6104 Pap (O 2) = 2.0104 Pa p (Ar) =1103 Pa6.解:(1)2(CO )n = 0.114mol; 2(CO )p = 42.87 10 Pa ⨯(2)222(N )(O )(CO )p p p p =--43.7910Pa =⨯ (3)4224(O )(CO ) 2.6710Pa0.2869.3310Pan p n p ⨯===⨯ 7.解:(1)p (H 2) =95.43 kPa (2)m (H 2) =pVMRT= 0.194 g 8.解:(1) = 5.0 mol(2) = 2.5 mol结论: 反应进度()的值与选用反应式中的哪个物质的量的变化来进行计算无关,但与反应式的写法有关。
9.解:∆U = Q p p ∆V = 0.771 kJ 10.解: (1)V 1 = 38.3⨯10-3m 3= 38.3L(2) T 2 = nRpV 2= 320 K (3)W =(p V ) = 502 J(4) U = Q + W = -758 J (5) H = Q p = -1260 J11.解:NH 3(g) +45O 2(g) 298.15K−−−−→标准态NO(g) + 23H 2O(g) m r H ∆= 226.2 kJ ·mol 1 12.解:m r H ∆= Q p = 89.5 kJ m r U ∆= mr H ∆ nRT =96.9 kJ13.解:(1)C (s) + O 2 (g) → CO 2 (g)m r H ∆ =m f H ∆(CO 2, g) = 393.509 kJ ·mol 121CO 2(g) + 21C(s) → CO(g) m r H ∆ = 86.229 kJ ·mol 1CO(g) +31Fe 2O 3(s) → 32Fe(s) + CO 2(g)m r H ∆ =8.3 kJ ·mol 1各反应m r H ∆之和m r H ∆= 315.6 kJ·mol 1。
无机化学简明教程第2版习题解答

《无机化学简明教程》(第2版) 习题解答第1章物质的状态1-1 解:设需加热至T´∵pV =nRT∴对于23n这部分,pV =23n RT'= 280Rn,即T´= 420 K1-2解:(1)由pV= n RT V=,得V =2×0.500 =1.00 (L)即:在S.T.P. (气体的标准状态:0 ℃, 1 atm)条件下, 该气体的体积为1.00 L,∴ρ=mV== 4.107(g·L-1)(2)pV= n RT=m RT MM =m RTpV= = 91.98 ≈92(g·mol-1)(3) 化合物含氮的个数为9230.5%14⨯= 2, 含氧的个数为()92130.5%16⨯-≈ 4∴该化合物为N2O4.1-3解:在水面上收集到气体与水蒸气的混合,应用分压定律求出该气体的分压:p = p总–2H Op= 101.3 – 5.626 7= 95.673 3 (kPa)在同样的温度下,被压缩为250 mL时该干燥气体具有的压强为:p´= 2 p = 2⨯ 95.673 3=191.3 (kPa)(1)98.6 kPa 压力下4.00 L 空气进入CHCl 3,与CHCl 3蒸汽形成混合气体,此时空气具有的分压为 98.6 –49.3 = 49.3 (kPa )∵温度一定时,pV=常数∴4.00 L 空气缓慢通过CHCl 3其体积膨胀为8.00 L ,即混合气体的体积为8.00 L (每个气泡都为CHCl 3蒸气所饱和,表明CHCl 3的体积也是8.00 L )。
(2)n = pV RT =3CHCl mM∴m =3CHCl M PV RT =33119.549.3108.00108.314313-⨯⨯⨯⨯⨯=18.1(g )1-5 解:设1.0 L 洁净干燥的空气缓慢通过H 3C-O-CH 3液体时体积为 V´,其分压为p –33H C O CH p --pV =(p –33H C O CH p --)V´∴V´= 33H C O CH pVp p --- (1)又 33H C O CH p --V´=33H C O CH m RTM --∴33H C O CH p --= 33H C O CH m RT M V --'(2)将(1)代入(2)式,得33H C O CH p --=3333H C O CH H C O CH ()m RT p p pV M -----整理pV 33H C O CH M --33H C O CH p --=33H C O CH m RT p m RT p ---(pV 33H C O CH M --+ m RT ) 33H C O CH p --= m RT p33H C O CH p --= 33H C O CH m RT p pV M m RT--+33H C O CH p --= = ==1.63⨯103(Pa )另解:从上面的计算知H 3C-O-CH 3液体的饱和蒸汽压比大气压小2个数量级, p –33H C O CH p --=1.01325⨯105 –1.61⨯103 ≈ 1.01325⨯105= p因此1.0 L 洁净干燥的空气缓慢通过H 3C-O-CH 3液体后体积增加很小,可忽略不计。
天津大学无机化学第五版习题答案

第1章 化学反应中的质量关系和能量关系 习题参考答案1.解:1.00吨氨气可制取2.47吨硝酸。
2.解:氯气质量为2.9×103g 。
3.解:一瓶氧气可用天数33111-1222()(13.210-1.0110)kPa 32L9.6d 101.325kPa 400L d n p p V n p V -⨯⨯⨯===⨯⨯4.解:pV MpVT nR mR== = 318 K 44.9=℃ 5.解:根据道尔顿分压定律ii n p p n=p (N 2) = 7.6⨯104 Pap (O 2) = 2.0⨯104 Pa p (Ar) =1⨯103 Pa6.解:(1)2(CO )n = 0.114mol; 2(CO )p = 42.87 10 Pa ⨯(2)222(N )(O )(CO )p p p p =--43.7910Pa =⨯ (3)4224(O )(CO ) 2.6710Pa0.2869.3310Pan p n p ⨯===⨯ 7.解:(1)p (H 2) =95.43 kPa (2)m (H 2) =pVMRT= 0.194 g 8.解:(1)ξ = 5.0 mol(2)ξ = 2.5 mol结论: 反应进度(ξ)的值与选用反应式中的哪个物质的量的变化来进行计算无关,但与反应式的写法有关。
9.解:∆U = Q p - p ∆V = 0.771 kJ 10.解: (1)V 1 = 38.3⨯10-3m 3= 38.3L(2) T 2 =nRpV 2= 320 K (3)-W = - (-p ∆V ) = -502 J (4) ∆U = Q + W = -758 J (5) ∆H = Q p = -1260 J11.解:NH 3(g) +45O 2(g) 298.15K−−−−→标准态NO(g) + 23H 2O(g) m r H ∆= - 226.2 kJ ·mol -1 12.解:m r H ∆= Q p = -89.5 kJ m r U ∆= m r H ∆- ∆nRT= -96.9 kJ13.解:(1)C (s) + O 2 (g) → CO 2 (g)m r H ∆ = m f H ∆(CO 2, g) = -393.509 kJ ·mol -121CO 2(g) + 21C(s) → CO(g)m r H ∆ = 86.229 kJ ·mol -1CO(g) +31Fe 2O 3(s) → 32Fe(s) + CO 2(g)m r H ∆ = -8.3 kJ ·mol -1各反应 m r H ∆之和m r H ∆= -315.6 kJ ·mol -1。
无机化学简明教程课后习题答案

x = p(NH3,平)=18.8725kpa
② NH4HS(s) = NH3(g) + H2S(g) P起(kpa) 6.666 pH2 S 要使反应逆向进行,则J>Kθ 即 PNH PH S 6.666 PH S J K 0.3333 2 P P 100 100 PH S 166.65kpa
6
2
2 2 3 MnO 4 5 Fe 8 H = Mn 5 Fe 4H 2 O (l) (aq) (aq) (aq) (aq) (aq)
5 ( C / C )( C / C ) Mn 2 Fe3 (3) K (C MmO 4 / C )(C Fe 2 / C ) 5 (C H / C ) 8
f Hm kJ mol 1 / 298 K
-393.509 213.74
-241.818 188.825
-235.1 282.7
1
0 205.138
sm kJ mol1 / 298K
r H m 6 f Hm (O2 , g ) 2 f Hm (C2 H 5OH , s) 4 f Hm (CO2 ) 6 f Hm ( H 2O)
解:①熵减,从溶液中析出晶体是混乱度降低。 ②熵减,分子数目在减少。 ③熵增,气体分子数加倍了,混乱度增加。 ④熵减,气体总分子数减少很多。 ⑤熵增,从无气体分子转化为气体分子。
9、能否用下列反应合成酒精?(温度范围是多少?) 4CO2(g)+ 6H2O(g) = 2C2H5OH(g)+ 6O2(g) 解: 4CO2(g) + 6H2O(g) = 2C2H5OH(g)+ 6O2(g)
(完整版)无机化学(天津大学第四版答案)

化学反应中的质量关系和能量关系习题参考答案1.解:1.00吨氨气可制取2.47吨硝酸。
2.解: 氯气质量为 2.9 X 103g 。
3.解: 一瓶氧气可用天数n (p pjy (13.2 103-1.01 103)kPa 32L n 2 P 2V 2 101.325kPa 400L__d^4•解:TM PVnR mR=318 K 44.9 C5. 解:根据道尔顿分压定律n ip(N 2)= 7.6 104 Pa p(O 2)= 2.0 104 Pa p(Ar) =1 103 Pa 6.解:(1) n(CO 2)0.114mol; p(C02) 2.87 104 Pa(2) p(N 2) p PQ 2) p(CO 2)3.79 104Pa (3) 迥以空 267 10:Pa 0.286n p 9.33 104Pa7. 解:(1) p(H 2)=95.43 kPa9. 解: U = Q P p V = 0.771 kJ 10. 解: (1) V 1 = 38.3 10-3 m 3= 38.3LpV 2(2) T 2 = - = 320 KnR(3) W =( p V) = 502 J(4) U = Q + W = -758 J (5)H = Q p = -1260 J538.解:(1)=5.0 mol(2)=2.5 mol结论:反应进度()的值与选用反应式中的哪个物质的量的变化来进行计算无关,但与反应式的与法有关。
(2) m(H 2)= pVM RT=0.194 g11. 解:NH3(g) + 4O2© 2标8辔NO(g) + 空山。
^) 屮皿=226.2 kJ mol12. 解:r H m= Q p = 89.5 kJr U m = r H m nRT=96.9 kJ13. 解:(1) C (s) + O2 (g) T CO2 (g)r H m = f H m (CO2, g) = 393.509 kJ mol 11 12 CO2(g) + 护(s) T CO(g)r H m = :86.229 kJ mol 1CO(g) +1 21Fe2O3(s) T 2 Fe(s) + CO2(g) r H m=:8.3 kJ mol 1各反应r H m之和r H m= 315.6 kJ mol 1o(2)总反应方程式为3 1 3 22 C(s) + O2(g) +3 Fe2O3(s) T CO2(g) + - Fe(s)r H m= 315.5 kJ mol 1由上看出:⑴与⑵计算结果基本相等。
天津大学无机化学第五版习题答案解析

第1章 化学反应中的质量关系和能量关系 习题参考答案1.解:1.00吨氨气可制取2.47吨硝酸。
2.解:氯气质量为2.9×103g 。
3.解:一瓶氧气可用天数 4.解:pV MpVT nR mR== = 318 K 44.9=℃ 5.解:根据道尔顿分压定律p (N 2) = 7.6⨯104 Pa p (O 2) = 2.0⨯104 Pa p (Ar) =1⨯103 Pa6.解:(1)2(CO )n = 0.114mol; 2(CO )p = 42.87 10 Pa ⨯(2)222(N )(O )(CO )p p p p =--43.7910Pa =⨯ (3)4224(O )(CO ) 2.6710Pa0.2869.3310Pan p n p ⨯===⨯7.解:(1)p (H 2) =95.43 kPa (2)m (H 2) =pVMRT= 0.194 g 8.解:(1)ξ = 5.0 mol(2)ξ = 2.5 mol结论: 反应进度(ξ)的值与选用反应式中的哪个物质的量的变化来进行计算无关,但与反应式的写法有关。
9.解:∆U = Q p - p ∆V = 0.771 kJ 10.解: (1)V 1 = 38.3⨯10-3m 3= 38.3L(2) T 2 =nRpV 2= 320 K (3)-W = - (-p ∆V ) = -502 J (4) ∆U = Q + W = -758 J (5) ∆H = Q p = -1260 J11.解:NH 3(g) +45O 2(g) 298.15K−−−−→标准态NO(g) + 23H 2O(g) m r H ∆= - 226.2 kJ ·mol -1 12.解:m r H ∆= Q p = -89.5 kJ m r U ∆= m r H ∆- ∆nRT= -96.9 kJ13.解:(1)C (s) + O 2 (g) → CO 2 (g)m r H ∆ =m f H ∆(CO 2, g) = -393.509 kJ ·mol -121CO 2(g) + 21C(s) → CO(g)m r H ∆ = 86.229 kJ ·mol -1CO(g) +31Fe 2O 3(s) → 32Fe(s) + CO 2(g)m r H ∆ = -8.3 kJ ·mol -1各反应 m r H ∆之和m r H ∆= -315.6 kJ ·mol -1。
最新-天津大学无机化学第五版习题答案 精品

第1章 化学反应中的质量关系和能量关系 习题参考答案1.解:1.00吨氨气可制取2.47吨硝酸。
2.解:氯气质量为2.9×103g 。
3.解:一瓶氧气可用天数33111-1222()(13.210-1.0110)kPa 32L9.6d 101.325kPa 400L d n p p V n p V -⨯⨯⨯===⨯⨯4.解:pV MpVT nR mR== = 318 K 44.9=℃ 5.解:根据道尔顿分压定律ii n p p n=p (N 2) = 7.6⨯104 Pap (O 2) = 2.0⨯104 Pa p (Ar) =1⨯103 Pa6.解:(1)2(CO )n = 0.114mol; 2(CO )p = 42.87 10 Pa ⨯(2)222(N )(O )(CO )p p p p =--43.7910Pa =⨯ (3)4224(O )(CO ) 2.6710Pa0.2869.3310Pan p n p ⨯===⨯ 7.解:(1)p (H 2) =95.43 kPa (2)m (H 2) =pVMRT= 0.194 g 8.解:(1)ξ = 5.0 mol(2)ξ = 2.5 mol结论: 反应进度(ξ)的值与选用反应式中的哪个物质的量的变化来进行计算无关,但与反应式的写法有关。
9.解:∆U = Q p - p ∆V = 0.771 kJ 10.解: (1)V 1 = 38.3⨯10-3m 3= 38.3L(2) T 2 =nRpV 2= 320 K (3)-W = - (-p ∆V ) = -502 J (4) ∆U = Q + W = -758 J (5) ∆H = Q p = -1260 J11.解:NH 3(g) +45O 2(g) 298.15K−−−−→标准态NO(g) + 23H 2O(g) m r H ∆= - 226.2 kJ ·mol -1 12.解:m r H ∆= Q p = -89.5 kJ m r U ∆= m r H ∆- ∆nRT= -96.9 kJ13.解:(1)C (s) + O 2 (g) → CO 2 (g)m r H ∆ = m f H ∆(CO 2, g) = -393.518 kJ ·mol -121CO 2(g) + 21C(s) → CO(g)m r H ∆ = 86.229 kJ ·mol -1CO(g) +31Fe 2O 3(s) → 32Fe(s) + CO 2(g)m r H ∆ = -8.3 kJ ·mol -1各反应 m r H ∆之和m r H ∆= -315.6 kJ ·mol -1。
无机合成化学简明教程课后习题参考答案

第一章概论1现代无机合成的内容和方法与旧时代相比有哪些变化?答:2为什么说无机合成化学往往是一个国家工业发展水平的标志?无机合成化学与国民经济的发展息息相关,在国民经济中占有重要的地位。
工业中广泛使用的三酸两破”,农业生产中必不可少的化肥、农药,基础建设中使用的水泥、玻璃、陶瓷,涂料工业中使用的大量无机料等无一不与无机合成有关。
这些产品的产量和质量几乎代表着一个国家的工业水平。
3.为什么说合成化学是化学学科的核心,是化学家改造世界、创造社会財富的最有力的手段?答:作为化学学科中当之无愧的核心,合成化学已成为化学家改造世界创造未来最有力的工具。
合成化学领域的每一次进步都会带动产业的一次革命。
发展合成化学,不断创造和开发新的物种,不仅是研究结构、性能及其相互关系,揭示新的规律与原理的基础,也成为推动化学学科与相关学科发展的主要动力。
4您能举出几种由p区元素合成的无机材料吗?碳纳米管、5为什么从某种意义上讲,合成化学的发展史就是化学的发展史?6.无机合成有哪些热点领域?(1)特种结构无机材料的制备(2)软化学合成(3)极端条件下的合成(4)无机功能材料的制备(5)特殊聚集态材料的合成(6)特种功能材料的分子设计(7)仿生合成(8)纳米粉体材料的制备(9)组合化学(10)绿色化学。
7.什么是极端条件下的合成?能否举一例说明。
极端条件是指极限情况,即超高温、超高压、超真空及接近绝对零度、强磁场与电场、激光等离子体等。
例如,在模拟宇宙空间的情况下,可能合成出没有位错的高纯度品体。
8查阅文献,找出一例绿色合成原理在无机合成化学中的应用。
9何谓软化学合成方法?与所谓的“硬化学法”相比有什么特点?软化学是相对于硬化学而言的。
它是指在较温和条件下实现的化学反应过程。
特点:1.不需用高纯金属作原料2.制得的合金是有一定颗粒度的粉末,不需在使用时再磨碎3.产品本身具有高活性4.产品具有良好的表面性质和优良的吸放氢性能5.合成方法简单6.有可能降低成本7.为废旧储氢合金的回收再生开辟了新途径第二章低温合成1温度与物性有怎样的关系?什么是物质的第五态?温度与物性的关系:对于一般液体来说,随着温度降低,密度会逐渐增加。
《无机化学》答案天津大学无机化学教研室编写高等教育出版社出版第8单元
[Ag(CN)2] − y
+ I− y
\ (AgI) = (1.26×1021) × (8.52×10−17) = 1.07×105 K \ = K f\ ( [Ag (CN) 2 ] − ) · K sp
y = 0.49
可见 KCN 可溶解较多的 AgI。
10.解:设 1.0 L 1.0 mol·L−1 氨水可溶解 x mol AgBr,并设溶解达平衡时 c([Ag(NH3)2]+) = x mol·L−1(严格讲应略小于 x mol·L−1)c(Br− ) = x mol·L−1 AgBr(s) + 2NH3·H2O 平衡浓度/(mol·L ) 6.0 − 2 x
配体 NH3 -H2O OH― OH―、-H2OCl―、NH3-
配位原子 N OOO -Cl、N
配位数 664 -6 6-
四氯合铂(Ⅱ)酸四氨合铜(Ⅱ) +2、―2 六氟合硅(Ⅳ)酸铜 六氟合铬(Ⅲ)酸钾 硝酸一羟基·三水合锌(Ⅱ) 一氯化二氯· 三氨· 一水合钴 (Ⅲ) 二氯·一乙二胺合铂(Ⅱ)
[CoF6]3-
8. 解:混合后未反应前: c(Cu2+) = 0.050 mol·L−1 c(NH3) = 3.0 mol·L−1 Cu2+ + 4NH3·H2O
达平衡时: 平衡浓度/(mol·L−1)
2+ 3
[Cu(NH3)4]2+ + 4H2O 0.050 − x
K f\ =
{c ([Cu (NH ) ] )} {c (Cu )} { c (NH ) }
−1
[Ag(NH3)2]+ + Br− + 2H2O x x
\ K \ = K f\ ( [Ag (NH 3 ) 2 ]+ ) · K sp (AgBr) = 5.99×10−6
天津大学无机化学第五版习题答案解析

第1章 化学反应中的质量关系和能量关系 习题参考答案1.解:1.00吨氨气可制取2.47吨硝酸。
2.解:氯气质量为2.9×103g 。
3.解:一瓶氧气可用天数33111-1222()(13.210-1.0110)kPa 32L9.6d 101.325kPa 400L d n p p V n p V -⨯⨯⨯===⨯⨯4.解:pV MpVT nR mR== = 318 K 44.9=℃ 5.解:根据道尔顿分压定律ii n p p n=p (N 2) = 7.6⨯104 Pa p (O 2) = 2.0⨯104 Pa p (Ar) =1⨯103 Pa6.解:(1)2(CO )n = 0.114mol; 2(CO )p = 42.87 10 Pa ⨯(2)222(N )(O )(CO )p p p p =--43.7910Pa =⨯ (3)4224(O )(CO ) 2.6710Pa 0.2869.3310Pan p n p ⨯===⨯7.解:(1)p (H 2) =95.43 kPa (2)m (H 2) =pVMRT= 0.194 g 8.解:(1)ξ = 5.0 mol(2)ξ = 2.5 mol结论: 反应进度(ξ)的值与选用反应式中的哪个物质的量的变化来进行计算无关,但与反应式的写法有关。
9.解:∆U = Q p - p ∆V = 0.771 kJ 10.解: (1)V 1 = 38.3⨯10-3m 3= 38.3L(2) T 2 =nRpV 2= 320 K (3)-W = - (-p ∆V ) = -502 J (4) ∆U = Q + W = -758 J (5) ∆H = Q p = -1260 J11.解:NH 3(g) +45O 2(g) 298.15K−−−−→标准态NO(g) + 23H 2O(g) m r H ∆= - 226.2 kJ ·mol -1 12.解:m r H ∆= Q p = -89.5 kJ m r U ∆= m r H ∆- ∆nRT= -96.9 kJ13.解:(1)C (s) + O 2 (g) → CO 2 (g)m r H ∆ =m f H ∆(CO 2, g) = -393.509 kJ ·mol -121CO 2(g) + 21C(s) → CO(g) m r H ∆ = 86.229 kJ ·mol -1CO(g) +31Fe 2O 3(s) → 32Fe(s) + CO 2(g)m r H ∆ = -8.3 kJ ·mol -1各反应 m r H ∆之和m r H ∆= -315.6 kJ ·mol -1。
天津大学无机化学教研室《无机化学》(第4版)配套题库名校考研真题+课后习题+章节题库+模拟试题下册

1.完成并配平反应方程式:硼砂(N2B4O7)溶液与稀硝酸混合[北京航 空航天大学2010研]
答:Na2B4O7 + 2HNO3(稀) + 5H2O=4H3BO3 + 2NaNO3
2.完成并配平反应方程式:在碱性条件下,红磷与次氯酸钠反应,生 成连二磷酸二氢根离子[中国科学技术大学2008研] 答: 3.完成并配平反应方程式:五氯化磷的氢解[中国科学技术大学2008研] 答:
目 录
第一部分 名校考研真题 第9章 氢、稀有气体 第10章 碱金属和碱土金属元素 第11章 卤素和氧族元素 第12章 氮族、碳族和硼族元素 第13章 过渡金属(一) 第14章 过渡金属(二) 第15章 元素化学综述(自学为 主)
第16章 无机物合成 第17章 生态环境与无机化学 第二部分 课后习题 第9章 氢及稀有气体 第10章 碱金属和碱土金属元素 第11章 卤素与氧族元素 第12章 氮族、碳族和硼族元素 第13章 过渡元素(一) 第14章 过渡元素(二) 第15章 元素化学综述(自学为
2.下面哪个说法是错误的( )。[首都师范大学2010研]
A.碳纳米管具有半导体性
B.碳纳米管具有金属导电性
C.金刚石具有半导体性
D.硅具有半导体性
【答案】B
【解析】碳纳米管具有导电性,是非金属导电性。
3.天然硅酸盐的结构复杂,其基本结构单元为( )。[首都师范大 学2010研] A.SiO2分子 B.SiO32平面三角形 C.SiO4四面体 D.Si2O76-共其用顶点的两个四面体 【答案】C 4.石墨、金刚石、碳纳米管皆为碳单质,其中在碳纳米管中碳原子的 杂化类型 ( )。[电子科技大学2010研] A.与石墨相同 B.与金刚石相同 C.部分与石墨相同部分与金刚石相同 D.与石墨金刚石皆不相同 E.无正确答案可选 【答案】A 【解析】在碳纳米管中,碳原子的杂化轨道类型与石墨相同,皆为sp2 杂化。
天津大学无机化学第五版习题答案

第1章 化学反应中的质量关系和能量关系 习题参考答案1.解:1.00吨氨气可制取2.47吨硝酸。
2.解:氯气质量为2.9×103g 。
3.解:一瓶氧气可用天数33111-1222()(13.210-1.0110)kPa 32L9.6d 101.325kPa 400L d n p p V n p V -⨯⨯⨯===⨯⨯4.解:pV MpVT nR mR== = 318 K 44.9=℃ 5.解:根据道尔顿分压定律ii n p p n=p (N 2) = 7.6⨯104 Pap (O 2) = 2.0⨯104 Pa p (Ar) =1⨯103 Pa6.解:(1)2(CO )n = 0.114mol; 2(CO )p = 42.87 10 Pa ⨯(2)222(N )(O )(CO )p p p p =--43.7910Pa =⨯ (3)4224(O )(CO ) 2.6710Pa0.2869.3310Pan p n p ⨯===⨯ 7.解:(1)p (H 2) =95.43 kPa (2)m (H 2) =pVMRT= 0.194 g 8.解:(1)ξ = 5.0 mol(2)ξ = 2.5 mol结论: 反应进度(ξ)的值与选用反应式中的哪个物质的量的变化来进行计算无关,但与反应式的写法有关。
9.解:∆U = Q p - p ∆V = 0.771 kJ 10.解: (1)V 1 = 38.3⨯10-3m 3= 38.3L(2) T 2 =nRpV 2= 320 K (3)-W = - (-p ∆V ) = -502 J (4) ∆U = Q + W = -758 J (5) ∆H = Q p = -1260 J11.解:NH 3(g) +45O 2(g) 298.15K−−−−→标准态NO(g) + 23H 2O(g) m r H ∆= - 226.2 kJ ·mol -1 12.解:m r H ∆= Q p = -89.5 kJ m r U ∆= m r H ∆- ∆nRT= -96.9 kJ13.解:(1)C (s) + O 2 (g) → CO 2 (g)m r H ∆ = m f H ∆(CO 2, g) = -393.509 kJ ·mol -121CO 2(g) + 21C(s) → CO(g)m r H ∆ = 86.229 kJ ·mol -1CO(g) +31Fe 2O 3(s) → 32Fe(s) + CO 2(g)m r H ∆ = -8.3 kJ ·mol -1各反应 m r H ∆之和m r H ∆= -315.6 kJ ·mol -1。
《无机化学》答案天津大学无机化学教研室编写高等教育出版社出版第6单元
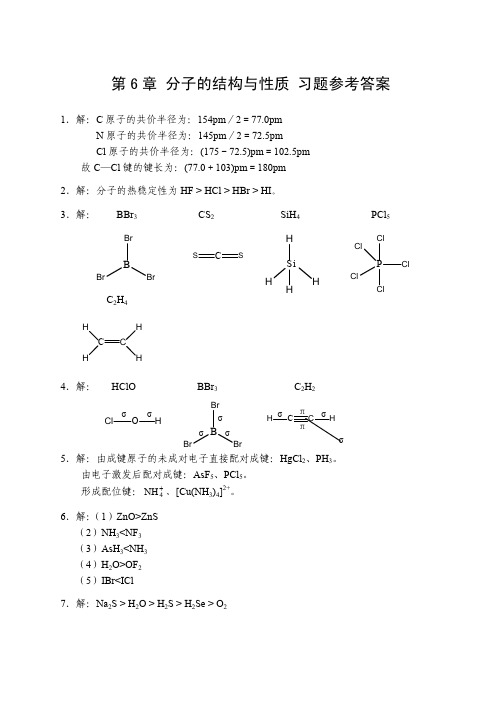
第6章 分子的结构与性质 习题参考答案1.解:C 原子的共价半径为:154pm /2=77.0pm N 原子的共价半径为:145pm /2=72.5pm Cl 原子的共价半径为:(175-72.5)pm =102.5pm 故C —Cl 键的键长为:(77.0+103)pm =180pm 2.解:分子的热稳定性为HF > HCl > HBr > HI 。
3.解: BBr 3 CS 2 SiH 4 PCl 5C 2H 44.解: HClO BBr 3 C 2H 2 5.解:由成键原子的未成对电子直接配对成键:HgCl 2、PH 3。
由电子激发后配对成键:AsF 5、PCl 5。
形成配位键:、[Cu(NH 3)4]2+。
+4NH 6.解:(1)ZnO>ZnS (2)NH 3<NF 3 (3)AsH 3<NH 3 (4)H 2O>OF 2 (5)IBr<ICl7.解:Na 2S > H 2O > H 2S > H 2Se > O 2BBr B Si H H HP Cl ClCl S r BrC C H H H B BrBr Brσ σ σC C H H σ σ O Cl Hππ σ σ σ8.解:4NH +分子或离子 中心离子杂化类型分子或离子的几何构型BBr 3 等性sp 2 平面正三角形 PH 3 不等性sp 3 三角锥形 H 2S 不等性sp 3 V 形 SiCl 4 等性sp 3 正四面体形 CO 2 等性sp直线形等性sp 3正四面体形9.解:分子或离子 价层电子对数成键电子对数孤电子对数 几何构型 PbCl 3 3 2 1 V 形 BF 3 3 3 0 平面正三角形 NF 3 4 3 1 三角锥形 PH 4+4 4 0 正四面体 BrF56 5 1 正四棱锥形24SO −4 4 0 正四面体 3NO − 3 2 1 V 形XeF 4 6 4 2 四方形CHCl 3 4 4 0 四面体﹡10.解:+2O 2O 2O− 2O 211.解: 分子或离子−2O 3−键级2.5 2 1.5 1 0.5结构稳定性的次序为:O >>O >+22−2O 2O 2−>O 23−12.解:(1)He 2的分子轨道表示式为(σ1s)2(σ*1s)2,净成键电子数为0,所以He 2分子不存在;(2)N 2的分子轨道表示式为(σ1s)2(σ*1s)2(σ2s)2(σ*2s)2 (π2p y )2(π2p z )2(σ2p x )2,形成一个σ键,两个π键,所以N 2分子很稳定,并且电子均已配对,因而具有反磁性; (3)的分子轨道表示式为:(σ1s)2(σ*1s)2(σ2s)2(σ*2s)2(σ2p x )2(π2p y )2(π2p z )2 (π*2p y )2(π*2p z )1,形成—个叁电子π键,所以2O −2O −具有顺磁性。
天大无机化学第四版_思考题和习题答案

第八章配位化合物思考题1. 以下配合物中心离子的配位数为6,假定它们的浓度均为0.001mol·L-1,指出溶液导电能力的顺序,并把配离子写在方括号内。
(1) Pt(NH3)6C14(2) Cr(NH3)4Cl3(3) Co(NH3)6Cl3 (4) K2PtCl6解:溶液导电能力从大到小的顺序为[Pt(NH3)6]C14>[Co(NH3)]6Cl3>K2[PtCl6]>[Cr(NH3)4Cl2]Cl2. PtCl4和氨水反应,生成化合物的化学式为Pt(NH3)4Cl4。
将1mol此化合物用AgN03处理,得到2molAgCl。
试推断配合物内界和外界的组分,并写出其结构式。
解:内界为:[PtCl2(NH3)4]2+、外界为:2Cl-、[PtCl2(NH3)4]Cl23.下列说法哪些不正确? 说明理由。
(1) 配合物由内界和外界两部分组成。
不正确,有的配合物不存在外界。
(2) 只有金属离子才能作为配合物的形成体。
不正确,有少数非金属的高氧化态离子也可以作形成体、中性的原子也可以成为形成体。
(3) 配位体的数目就是形成体的配位数。
不正确,在多齿配位体中配位体的数目不等于配位数。
(4) 配离子的电荷数等于中心离子的电荷数。
不正确,配离子电荷是形成体和配体电荷的代数和。
(5) 配离子的几何构型取决于中心离子所采用的杂化轨道类型。
正确4.实验测得下列配合物的磁矩数据(B.M.)如下: 试判断它们的几何构型,并指出哪个属于内轨型、哪个属于外轨型配合物。
5.下列配离子中哪个磁矩最大?[Fe(CN)6]3-[Fe(CN)6]4-[Co(CN)6]3-[Ni(CN)4]2-[Mn(CN)6]3-可见[Mn(CN)6]4的磁矩最大6.下列配离子(或中性配合物)中,哪个为平面正方形构型? 哪个为正八面体构型? 哪个为正四面体构型?*7. 用价键理论和晶体场理论分别描述下列配离子的中心离子的价层电子分布。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第1章 化学反应中的质量关系和能量关系 习题参考答案1.解:1.00吨氨气可制取2.47吨硝酸。
2.解:氯气质量为2.9×103g 3.解:一瓶氧气可用天数33111-1222()(13.210-1.0110)kPa 32L9.6d 101.325kPa 400L d n p p V n p V -⨯⨯⨯===⨯⨯4.解:pV MpVT nR mR== = 318 K 44.9=℃ 5.解:根据道尔顿分压定律ii n p p n=p (N 2) = 7.6⨯104 Pap (O 2) = 2.0⨯104 Pa p (Ar) =1⨯103 Pa6.解:(1)2(CO )n = 0.114mol; 2(CO )p = 42.87 10 Pa ⨯(2)222(N )(O )(CO )p p p p =--43.7910Pa =⨯ (3)4224(O )(CO ) 2.6710Pa0.2869.3310Pan p n p ⨯===⨯ 7.解:(1)p (H 2) =95.43 kPa (2)m (H 2) =pVMRT= 0.194 g 8.解:(1)ξ = 5.0 mol(2)ξ = 2.5 mol结论: 反应进度(ξ)的值与选用反应式中的哪个物质的量的变化来进行计算无关,但与反应式的写法有关。
9.解:∆U = Q p - p ∆V = 0.771 kJ 10.解: (1)V 1 = 38.3⨯10-3 m 3= 38.3L(2) T 2 =nRpV 2= 320 K (3)-W = - (-p ∆V ) = -502 J (4) ∆U = Q + W = -758 J (5) ∆H = Q p = -1260 J11.解:NH 3(g) +45O 2(g) 298.15K−−−−→标准态NO(g) + 23H 2O(g) m r H ∆= - 226.2 kJ·mol -1 12.解:m r H ∆= Q p = -89.5 kJ m r U ∆= m r H ∆- ∆nRT= -96.9 kJ13.解:(1)C (s) + O 2 (g) → CO 2 (g)m r H ∆ =m f H ∆(CO 2, g) = -393.509 kJ·mol -121CO 2(g) + 21C(s) → CO(g) m r H ∆ = 86.229 kJ·mol -1CO(g) +31Fe 2O 3(s) → 32Fe(s) + CO 2(g)m r H ∆ = -8.3 kJ·mol -1各反应m r H ∆之和m r H ∆= -315.6 kJ·mol -1。
(2)总反应方程式为23C(s) + O 2(g) + 31Fe 2O 3(s) → 23CO 2(g) + 32Fe(s) m r H ∆ = -315.5 kJ·mol -1由上看出:(1)与(2)计算结果基本相等。
所以可得出如下结论:反应的热效应只与反应的始、终态有关,而与反应的途径无关。
14.解: m r H ∆(3)= m r H ∆(2)×3-m r H ∆(1)×2=-1266.47 kJ·mol -115.解:(1)Q p =m r H ∆== 4 m f H ∆(Al 2O 3, s) -3 m f H ∆(Fe 3O 4, s) =-3347.6 kJ·mol -1(2)Q = -4141 kJ·mol -116.解:(1) m r H ∆ =151.1 kJ·mol -1 (2) m r H ∆ = -905.47 kJ·mol -1(3) m r H ∆ =-71.7kJ·mol -117.解: m r H ∆=2 m f H ∆(AgCl, s)+ m f H ∆(H 2O, l)- m f H ∆(Ag 2O, s)-2 m f H ∆(HCl, g) m f H ∆(AgCl, s) = -127.3 kJ·mol -118.解:CH 4(g) + 2O 2(g) → CO 2(g) + 2H 2O(l)m r H ∆ = m f H ∆(CO 2, g) + 2 m f H ∆(H 2O, l) - m f H ∆(CH 4, g)= -890.36 kJ·mo -1 Q p = -3.69⨯104kJ第2章 化学反应的方向、速率和限度1.解: m r H ∆ = -3347.6 kJ·mol -1;m r S ∆ = -216.64 J·mol -1·K -1;m r G ∆ = -3283.0kJ·mol -1 < 0该反应在298.15K 及标准态下可自发向右进行。
2.解: m r G ∆ = 113.4 kJ·mol -1 > 0该反应在常温(298.15 K)、标准态下不能自发进行。
(2) m r H ∆ = 146.0 kJ·mol -1;m r S ∆ = 110.45 J·mol -1·K -1;m r G ∆ = 68.7 kJ·mol -1 > 0该反应在700 K 、标准态下不能自发进行。
3.解: m r H ∆ = -70.81 kJ·mol -1 ;m r S ∆ = -43.2 J·mol -1·K -1;m r G ∆ = -43.9 kJ·mol -1(2)由以上计算可知:m r H ∆(298.15 K) = -70.81 kJ·mol -1; m r S ∆(298.15 K) = -43.2 J·mol -1·K -1m r G ∆ =m r H ∆ - T ·m r S ∆ ≤ 0 T ≥K)(298.15K) (298.15m r m rS H ∆∆ = 1639 K4.解:(1)c K = {}O)H ( )(CH )(H (CO) 2432c c c c p K = {}O)H ( )(CH )(H (CO) 2432p p p pK = {}{}{}{}p p p p p p p p / O)H ( /)(CH / )(H / (CO) 2432(2)c K ={}{})(NH )(H )(N 3232212c c c p K ={}{})(NH )(H )(N 3232212p p pK ={}{}pp p p p p / )(NH/)(H/)(N3232212(3)c K =)(CO 2c p K =)(CO 2p K = p p /)(CO 2 (4)c K ={}{}3232 )(H O)(H c c p K ={}{}3232 )(H O)(H p pK ={}{}3232 /)(H/O)(Hpp p p5.解:设 m r H ∆、m r S ∆基本上不随温度变化。
m r G ∆ =m r H ∆ - T · m r S ∆m r G ∆(298.15 K) = -233.60 kJ·mol -1 m r G ∆(298.15 K) = -243.03 kJ·mol -1K lg (298.15 K) = 40.92, 故 K (298.15 K) = 8.3⨯1040 K lg (373.15 K) = 34.02,故 K (373.15 K) = 1.0⨯10346.解:(1) m r G ∆=2m f G ∆(NH 3, g) = -32.90 kJ·mol -1 <0该反应在298.15 K 、标准态下能自发进行。
(2) K lg (298.15 K) = 5.76, K (298.15 K) = 5.8⨯1057. 解:(1) m r G ∆(l) = 2 m f G ∆(NO, g) = 173.1 kJ·mol -11lgK =RTG 303.2)1(m f∆- = -30.32, 故1K = 4.8⨯10-31(2) m r G ∆(2) = 2m f G ∆(N 2O, g) =208.4 kJ·mol -12lgK =RTG 303.2)2(m f∆- = -36.50, 故2K = 3.2⨯10-37(3) m r G ∆(3) = 2m f G ∆(NH 3, g) = -32.90 kJ·mol -1 3lg K = 5.76, 故 3K = 5.8⨯105由以上计算看出:选择合成氨固氮反应最好。
8.解: m r G ∆ = m f G ∆(CO 2, g) - m f G ∆(CO, g)-m f G ∆(NO, g)= -343.94 kJ·mol -1< 0,所以该反应从理论上讲是可行的。
9.解: m r H ∆(298.15 K) = m f H ∆(NO, g) = 90.25 kJ·mol -1 m r S ∆(298.15 K) = 12.39 J·mol -1·K -1m r G ∆(1573.15K)≈ m r H ∆(298.15 K) -1573.15 m r S ∆(298.15 K)= 70759 J ·mol -1K lg (1573.15 K) = -2.349, K (1573.15 K) = 4.48⨯10-3 10. 解: H 2(g) + I 2(g)2HI(g)平衡分压/kPa 2905.74 -χ 2905.74 -χ 2χ22)74.2905()2(x x -= 55.3χ= 2290.12p (HI) = 2χkPa = 4580.24 kPan =pVRT= 3.15 mol11.解:p (CO) = 1.01⨯105 Pa, p (H 2O) = 2.02⨯105 Pa p (CO 2) = 1.01⨯105 Pa, p (H 2) = 0.34⨯105 PaCO(g) + H 2O(g) → CO 2(g) + H 2(g)起始分压/105 Pa 1.01 2.02 1.01 0.34J = 0.168, p K = 1>0.168 = J,故反应正向进行。
12.解:(1) NH 4HS(s) → NH 3(g) + H 2S(g)平衡分压/kPa x xK ={}{}/ S)(H / )(NH 23 p p p p = 0.070 则 x = 0.26⨯100 kPa = 26 kPa 平衡时该气体混合物的总压为52 kPa(2)T 不变, K 不变。
