力生制药:关于子公司中央药业药品盐酸维拉帕米片通过仿制药一致性评价的公告
抗HN禽流感新药帕拉米韦诞生记

的研制合作。 但随后爆发的H5N1人感染禽流感病毒,改变了 帕拉米韦的命运。在H5N1病毒持续爆发的2007 年,美国卫生及公共服务部与BioCryst签订了为 期
4年的合同,资助1亿多美元,以促进帕拉米韦的 开发。 在这一过程中,帕拉米韦改变了给药方式,即从 口服改为静脉注射。上述药理学专业人士对本报 记者分析称,给药方式往
不过,该公司人士表示,公司要实现量产帕拉米 韦注射液“尚需时日”。 “按照规定,公司应等到CFDA生产批文报下来 之后,才能进行量产,而公司在4月5日刚刚获得 批准
,”南新制药北京区域舒姓销售经理称,“在获 得生产批文之前,公司仅先试生产一批帕拉米韦 进行验收,而现在试制的产品已经验收合格,说 明量产已经没有太评待批上市。 根据规定,凯铂生物只有在4月5日获得正式生产 批文后,才能对帕拉米韦进行量产,因此目前帕 拉米韦还未能达到凯铂生物的
设计生产容量。 “公司的帕拉米韦距离实现量产还有一段时间, 具体时间目前生产部门正在确认中。”南新制药 北京区域舒姓销售经理透露称。 2009年,凯铂生物收购南
上海海尼药业有限公司时任信息部主任苏红曾撰 文透露,由于帕拉米韦的化合物专利早已过期, 中国人民解放军军事医学科学院在中国申请了帕 拉米韦三水合物晶型专利。而这一专
利也属于帕拉米韦静脉注射剂的一种。 据了解,军事医学科学院是在2007年申报帕拉米 韦化合物发明专利的。 2007年10月,军事医学科学院提出了帕拉米韦 临床申
请,2008年6月被批准进行临床试验,至2009年 5月左右,军事医学科学院对外宣布成功研制帕 拉米韦,这也是国务院确定的16个重大科技专项 中的一项。 2009年
5月15日,湖南有色集团与军事医学科学院签署 技术转让协议,由湖南有色集团生产抗甲型流感 新药帕拉米韦三水合物,项目总投资5亿元。而 按照投产计划,一旦湖南有色集团下
仿制药一致性评价289种基药名录

193 194 195 196 197 198 199 200 201 202 203 204 205 206 207 208 209 210 211 212 213 214 215 216 217 218
布洛芬颗粒 富马酸比索洛尔胶囊 枸橼酸铋钾片 华法林钠片 磷酸伯氨喹片 马来酸氨氯地平片 奈韦拉平片 齐多夫定片 双氯芬酸钠缓释胶囊 盐酸吗啡片 佐匹克隆片 法莫替丁胶囊 磷酸可待因片 羟基脲片 石杉碱甲片 头孢呋辛酯胶囊 盐酸左氧氟沙星胶囊 吲达帕胺缓释片 硫唑嘌呤片 阿莫西林克拉维酸钾颗粒 白消安片 布洛芬缓释片 富马酸喹硫平片 硫酸亚铁缓释片 氯化钾颗粒 鞣酸小檗碱片
2018年底前须完成仿制药一致性评价的289种药品名录
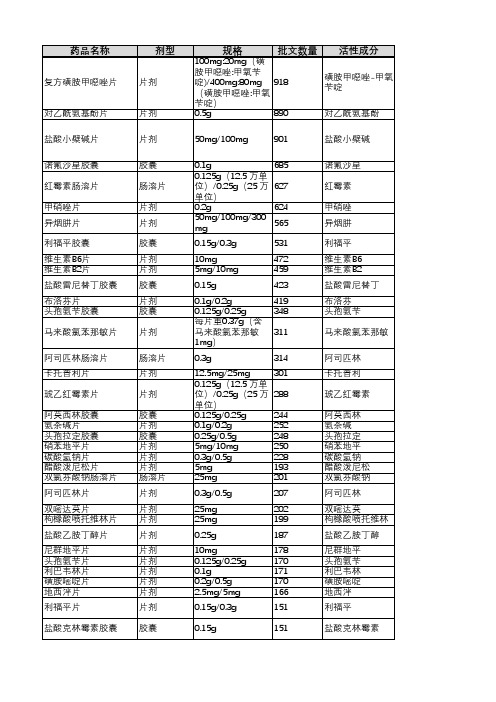
序号 1 2 3 4 5 药品通用名称 复方磺胺甲噁唑片 盐酸小檗碱片 诺氟沙星胶囊 甲硝唑片 红霉素肠溶片 规格 100mg:20mg(磺胺甲唑:甲氧苄啶) 400mg:80mg(磺胺甲唑:甲氧苄啶) 每片含盐酸小檗碱30mg 0.1g 0.2g 0.125g(12.5 万单位) 0.25g(25 万单位) 50mg 6 异烟肼片 100mg 300mg 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 利福平胶囊 维生素B6片 维生素B2片 盐酸雷尼替丁胶囊 布洛芬片 对乙酰氨基酚片 头孢氨苄胶囊 马来酸氯苯那敏片 阿司匹林肠溶片 卡托普利片 硝苯地平片 氨茶碱片 头孢拉定胶囊 碳酸氢钠片 阿莫西林胶囊 0.15g 0.3g 10mg 5mg 10mg 0.15g 0.1g 0.2g 0.5g 0.125g 0.25g 每片重0.37g(含马来酸氯苯那敏1mg) 0.3g 12.5mg 25mg 5mg 10mg 0.1g 0.2g 0.25g 0.5g 0.3g 0.5g 0.125g 0.25g
药物一致性评价介绍

确定参比制剂遴选原则
参比制剂原则上首选原研药品,也可以选用国际公认的同种药品。 仿制药是指与被仿制药具有相同的活性成分、剂型、给药途径和治疗作
用的药品。
参比制剂是指用于仿制药质量和疗效一致性评价的对照药品,通常为被
仿制的对象,如原研药品或国际公认的同种药物。参比制剂应为处方工 艺合理、质量稳定、疗效确切的药品。
化学药品新注册分类实施前批准上市的其他仿制药,自首家品种通过 一致性评价后,其他药品生产企业的相同品种原则上应在3年内完成一致 性评价;逾期未完成的,不予再注册。
8 | Presentation Title | Presenter Name | Date | Subject | Business Use Only
各国对于生物等效性的评价标准不同主要国家/地区 对于药代动力学参数的规定
国家/地区 90% CI
AUC0-t % Cmax%
加拿大 90-112
美国
80-125
欧盟90-1Leabharlann 1 澳大利亚 80-125
日本
80-125
中国
80-125
80-125 80-125 90-111 80-125 80-125 70-143
同品种药品通过一致性评价的生产企业达到3家以上的,在药品集中采
购等方面不再选用未通过一致性评价的品种。
通过一致性评价药品生产企业的技术改造,在符合有关条件的情况下,
可以申请中央基建投资、产业基金等资金支持。
7 | Presentation Title | Presenter Name | Date | Subject | Business Use Only
在相似的试验条件下单次或多次 给予相同剂量的试验药物后,受 试制剂中药物的吸收速度和吸收 程度与参比制剂的差异在可接受 范围内。生物等效性研究方法按 照研究方法评价效力,其优先顺 序为药代动力学研究、药效动力 学研究、临床研究和体外研究。
仿制药质量和疗效一致性评价工作介绍

阿托伐他汀钙片 阿莫西林胶囊
苯磺酸氨氯地平片 蒙脱石散
阿法骨化醇片 阿奇霉素片 奥氮平片
厄贝沙坦氢氯噻嗪片 恩替卡韦分散片
富马酸替诺福韦二吡呋酯片 卡托普利片 赖诺普利片
硫酸氢氯吡格雷片 氯沙坦钾片
马来酸依那普利片 恩替卡韦胶囊 福辛普利钠片
富马酸比索洛尔片 格列美脲片 吉非替尼片
BE 试验
受理 立卷审查
基于审 评需要 检查
技术 审评
基于审 评需要 检验
综合 审评
纳入 橙皮书
研究
审评
信息公开
工作程序1——药学研究
工作程序2——BE试验
伦理审查
BE试验合同
BE试验备案
信息登记
开展BE试验
719家药物 临床试验 机构
工作程序3-受理
2016年第105号公告
2017年第100号公告
17
《关于阿莫西林胶囊等7个品种规格
通过仿制药质量和疗效一致性评价的 7
公告(第三批)》(2018年第6号)
《关于蒙脱石散等16个品种通过仿制
药质量和疗效一致性评价的公告(第 五批)》(2018年第49号)
16
《关于瑞舒伐他汀钙片等5个品种通过仿制
5 药质量和疗效一致性评价的公告(第二
批)》(2018年第20号)
关于仿制药质量和疗效一 致性评价工作有关事项的 公告(2017年第100号)
关于规范使用“通过一致 性评价”标识的通知
关于阿托伐他汀钙片等12 个品种规格通过仿制药质 量和疗效一致性评价的公 告(第四批)(2018年第 24号) 附件2关于“通过一致性评 价”标识使用有关事宜的 说明
工作成效——推动供给侧结构性改革
2024年盐酸维拉帕米片市场前景分析

2024年盐酸维拉帕米片市场前景分析引言盐酸维拉帕米片是一种常用的钙通道阻滞剂药物,用于治疗高血压和心绞痛等心血管疾病。
随着人们生活水平的提高和健康意识的增强,心血管疾病的患病率逐年上升,对盐酸维拉帕米片的需求也随之增加。
本文将对盐酸维拉帕米片的市场前景进行分析。
当前市场情况目前盐酸维拉帕米片市场存在以下情况:1.市场规模扩大:随着心血管疾病患者数量的增加,盐酸维拉帕米片的市场需求也在逐年增长。
根据相关数据统计,盐酸维拉帕米片市场的年均复合增长率超过10%。
2.市场竞争激烈:随着市场规模的扩大,盐酸维拉帕米片的生产和销售企业也在逐渐增多。
市场竞争日趋激烈,企业需要通过产品质量、价格和服务等方面来提高竞争力。
3.品牌影响力差异:盐酸维拉帕米片市场中,一些知名制药企业的品牌影响力较强,产品销量较高。
同时,一些中小制药企业也在积极推进盐酸维拉帕米片的开发和销售,品牌影响力有待提升。
市场前景分析基于当前市场情况,对盐酸维拉帕米片的市场前景进行分析如下:1.市场需求持续增长:随着心血管疾病患者数量的增加和人们健康意识的提高,对盐酸维拉帕米片的需求将持续增长。
预计未来几年盐酸维拉帕米片市场的年均复合增长率将保持在10%以上。
2.市场竞争进一步加剧:随着盐酸维拉帕米片市场规模不断扩大,竞争压力也将进一步加剧。
企业需要增加产品创新研发力度,加强与医疗机构的合作,提高产品质量和服务水平,以增强市场竞争力。
3.品牌影响力成为关键:品牌影响力在盐酸维拉帕米片市场中不容忽视。
知名制药企业通过多年的品牌积累和市场推广,拥有一定的竞争优势。
中小制药企业应加强品牌建设,提高产品知名度和市场份额。
4.市场监管力度加大:随着整个医药市场监管力度的增强,对盐酸维拉帕米片等心血管药物的质量和安全要求也将提高。
企业需要加强质量管理,保证产品质量合规,并积极参与相关政策法规的修订和执行。
结论综上所述,盐酸维拉帕米片市场具有较好的发展前景。
国家药品监督管理局药品行政保护公告第153号(终止公告)

国家药品监督管理局药品行政保护公告第153号(终止
公告)
文章属性
•【制定机关】国家药品监督管理局
•【公布日期】2002.06.19
•【文号】国家药品监督管理局药品行政保护公告第153号
•【施行日期】2002.06.19
•【效力等级】部门规范性文件
•【时效性】现行有效
•【主题分类】药政管理
正文
国家药品监督管理局药品行政保护公告
(第153号终止公告)
申请人所在国:爱尔兰
申请人:杨森制药有限公司
申请药品名称:
通用名:西沙必利混悬剂(Cisapride Suspension)
商品名:普瑞博思混悬剂(Prepulsid Suspension)
授权号:B-IE94121924
授权日:1994年12月19日
该药品于1994年12月19日在中国获得的药品行政保护,已于2002年6月19日期限届满。
特此公告。
国家药品监督管理局药品行政保护办公室
二00二年六月十九日。
仿制药一致性评价289种基药名录

序号 1 2 3 4 5
6
7 8 9 10 11 12 13 14 15 16
17
18
19
20
21
药品通用名称 复方磺胺甲噁唑片
盐酸小檗碱片 诺氟沙星胶囊
甲硝唑片 红霉素肠溶片
异烟肼片
利福平胶囊 维生素B6片 维生素B2片 盐酸雷尼替丁胶囊
布洛芬片 对乙酰氨基酚片 头孢氨苄胶囊 马来酸氯苯那敏片 阿司匹林肠溶片
胶体果胶铋胶囊
50mg(以铋计)
104
磷酸氯喹片
75mg 250mg
105
复方地芬诺酯片
盐酸地芬诺酯2.5mg,硫酸阿托品25μg
106
替硝唑片
0.5g
1mg
107
盐酸哌唑嗪片
2mg
108
口服补液盐散(Ⅰ)
已批准的所有规格
109
吲达帕胺片
2.5mg
110
乳酶生片
0.15g 0.3g
111
盐酸胺碘酮片
86
布洛芬胶囊
87
茶碱缓释片
88
阿奇霉素胶囊
89
螺内酯片
90
阿苯达唑胶囊
91
辛伐他汀片
92
制霉素片
30mg 已批准的所有规格
0.4mg 5mg 0.1g 25mg 5mg 10mg 20mg
0.25g 每袋含0.11g 铋
5mg 0.25g(25 万单位)
0.1g 2mg 4mg 50mg 100mg 0.25g 0.5g 8mg 40mg 10mg 20mg 0.1g 0.2g 0.1g 0.25g(25 万单位) 4mg 12mg 20mg 0.1g 0.2g 10mg 20mg 10 万单位 25 万单位 50 万单位
2024年盐酸维拉帕米片市场发展现状

2024年盐酸维拉帕米片市场发展现状简介盐酸维拉帕米片是一种钙离子拮抗剂,用于治疗心绞痛和高血压等心脑血管疾病。
随着人们健康意识的增强和心脑血管疾病患者的增加,盐酸维拉帕米片在市场上的需求也不断增长。
本文将对盐酸维拉帕米片市场的发展现状进行分析。
市场规模根据市场调研数据显示,盐酸维拉帕米片市场在过去几年里持续增长。
2019年,全球盐酸维拉帕米片市场规模达到X亿美元。
其中,亚太地区占据了最大的市场份额,其次是欧洲和北美地区。
市场驱动因素1. 人口老龄化随着人口老龄化程度的加深,心脑血管疾病的患病率也在不断增加。
盐酸维拉帕米片作为常见的心血管药物,在老年人群体中的需求量大大提高。
2. 健康意识增强现代社会人们的健康意识不断增强,越来越多的人开始关注心脑血管健康。
盐酸维拉帕米片由于其良好的药效和安全性受到许多人的青睐。
随着医疗技术的不断进步,对心脑血管疾病的诊断和治疗手段也在不断提升。
盐酸维拉帕米片作为一种常用药物,得到了更多医生的推荐和应用。
市场竞争态势盐酸维拉帕米片市场竞争激烈,主要的竞争企业包括诺和诺德、辉瑞等。
这些企业在产品研发、生产技术和市场推广方面投入巨大,形成了一定的市场竞争壁垒。
同时,市场上还有一些中小型制药企业涉足盐酸维拉帕米片市场,它们通过价格战和市场细分等策略来获取一定市场份额。
市场前景盐酸维拉帕米片市场未来的发展前景仍然广阔。
以下几个方面将有助于推动市场的增长:1. 政策支持政府对心脑血管疾病的关注和政策支持将进一步促进盐酸维拉帕米片市场的发展。
2. 新的应用领域随着盐酸维拉帕米片在心脑血管领域的广泛应用,它也有望在其他疾病领域发现新的应用价值,进一步扩大市场规模。
随着制药技术的进步,盐酸维拉帕米片的制剂和给药方式将更加先进和便捷,这将进一步提高使用者的体验和满意度。
结论综上所述,盐酸维拉帕米片市场目前正处于增长阶段,未来发展前景广阔。
尽管市场竞争激烈,但通过政策支持、新的应用领域和制药技术进步等因素的驱动,盐酸维拉帕米片市场将继续保持快速发展。
前须完成仿制药一致性评价品种 共 个品种 参比制剂 对照药品
0.1g/0.2g
419
0.125g/0.25g
348
每片重0.37g(含
马来酸氯苯那敏 311
1mg)
0.3g
314
12.5mg/25mg
301
0.125g(12.5 万单
位)/0.25g(25 万 288
单位)
0.125g/0.25g
244
0.1g/0.2g
252
0.25g/0.5g
248
5mg/10mg
45
0.1g
45
2mg/4mg
44
0.25g/0.5g
45
8mg
41
40mg
42
0.1g
41
50mg
38
4mg/12mg/20mg 38
40mg
37
0.1g/0.2g
38
0.4mg/5mg
37
0.1g/0.2g
36
50mg/100mg
36
0.5g
36
10mg/20mg
34
5mg/10mg
35
已批准的所有规格 34
片剂
肠溶片剂 片剂
红霉素肠溶胶囊
肠溶胶囊
秋水仙碱片
米非司酮片
酒石酸美托洛尔片 硫酸亚铁片 碳酸锂片 丙戊酸钠片
片剂
片剂
片剂 片剂 片剂 片剂
1mg
29
0.15g/0.3g
28
10 万单位/25 万单 位/50 万单位
29
0.2g
25
50mg/100mg
24
50mg/100mg
25
30mg
26
2mg
24
仿制药一致性评价

仿制药一致性评价一:背景信息1) 2016年2月6日,国务院颁布了国办发【2016】8号文件“国务院办公厅关于开展仿制药质量和疗效一致性评价的意见”,随后国家又在短时间内连续颁布了一系列关于仿制药一致性评价工作的相关文件和指南,真正拉开了仿制药产品质量和疗效一致性评价工作的序幕。
2) 根据国家仿制药一致性评价政策和时限要求,289种基本药物要求在2018年底完成评价,其他仿制药产品若能成为“首名”或“前三名”,对市场和经济意义重大。
否则,则存在较大风险失去市场甚至文号不保。
二:认识与建议虽然国家提出了明确的时间要求和评价原则,但当前的法规并不具体,企业左右为难。
公司基于长期从事药政法规研究的工作经验,我们对本轮要求的认识如下:1) 不等不靠、主动研究。
2) 要充分重视对产品的信息回顾与整理,重视仿制药评价的整体策划,为开展研究工作打基础。
3) 重视药学研究。
仿制药研究的重点是药学部分,也是国家评价仿制药质量的重要内容,CMC是重中之重,必须先行。
4) 时间紧迫仿制药一致性评价,尤其是基本药物的评价看起来还有2年多时间,实际分解后留给企业的时间已经非常紧张,即使一切顺利也需要20-25个月。
5) 逐步开展,分段进行。
仿制药一致性评价是一个综合工程,链条长,费用高。
尤其是早年完成注册的产品,注册研究与申报资料更加薄弱,适合先初步摸索产品质量现状再进行系统深入的研究。
6) 仿制药一致性评价应分为四个阶段开展三:优势与业绩仿制药一致性评价工作是一个系统工程,需要完整的服务链条和资源配置,包括CMC研发实验室、动物GLP实验室、BE临床实验基地、生化分析实验室和注册服务团队,以及良好的公共资源,并且各个环节都要有经验丰富的技术团队与完善的质量管理体系,要经得起注册现场核查与临床现场核查。
1) 咨询拥有的优势包括以下几方面:✔建立了高水平配置的国家级CMC研发实验室,拥有专业的研发人员和十多年药品研发经验,为中国三大医药技术研究成果转化平台之一,国家基本药物标准溶出度曲线制作承担单位之一;✔合作动物GLP实验室,比格犬等大动物试验不是问题;✔集团内拥有BE临床试验基地与通过FDA审计的生化分析实验室(海口、长春、南京3个BE基地),BE试验优先快速安排;✔18年丰富经验的注册团队,轻松化解技术难题。
2024年维拉帕米缓释片市场发展现状

2024年维拉帕米缓释片市场发展现状导言维拉帕米缓释片属于一种钙通道阻滞剂药物,主要用于治疗高血压、心绞痛等心血管疾病。
随着人们生活水平的提高和心血管疾病的日益严重,维拉帕米缓释片市场逐渐扩大。
本文将对维拉帕米缓释片市场的发展现状进行分析和讨论。
1. 维拉帕米缓释片市场概述维拉帕米缓释片市场是指维拉帕米缓释片在全球范围内的销售状况和市场规模。
维拉帕米缓释片具有广泛的应用领域,包括高血压、心绞痛、冠心病等。
市场上存在多家生产和销售该药物的制药企业,市场竞争激烈。
2. 维拉帕米缓释片市场规模维拉帕米缓释片市场规模呈现逐年增长的趋势。
根据市场调研数据,2019年全球维拉帕米缓释片市场规模达到XX亿美元,预计未来几年将保持稳定增长。
3. 维拉帕米缓释片市场竞争格局目前,维拉帕米缓释片市场存在多家主要制药企业,包括公司A、公司B、公司C 等。
这些企业通过创新研发、扩大生产规模和拓展销售渠道来争夺市场份额。
市场竞争主要表现在产品质量、价格和市场推广等方面。
4. 维拉帕米缓释片市场驱动因素4.1 人口老龄化和心血管疾病患者增加:随着人口老龄化程度的加深和心血管疾病患者数量的增加,对维拉帕米缓释片的需求也随之增加。
4.2 医疗水平提高:医疗技术和诊断手段的进步,使得对心血管疾病的认识和治疗水平得以提高,同时对维拉帕米缓释片市场的发展提供了机遇。
4.3 健康意识增加:人们对健康问题的关注度不断提高,对心血管疾病的防治重视程度逐渐增强,这也对维拉帕米缓释片市场的发展起到推动作用。
5. 维拉帕米缓释片市场面临的挑战5.1 市场竞争加剧:维拉帕米缓释片市场存在多家制药企业,竞争激烈,企业之间为了争夺市场份额,进行价格战和市场营销竞争,这对企业利润空间带来一定的挑战。
5.2 法规政策影响:医药行业受到严格的法规政策管制,包括药品审批、生产质量控制等方面,这可能增加企业的成本和风险。
5.3 面临新药物竞争:随着新药物的不断研发和上市,对维拉帕米缓释片市场构成了一定的竞争压力。
已通过一致性评价药品名录(持续更新)

否
否
2018/11/6
85
0国药准字 H2002039
苯磺酸氨 氯地平片
片剂
N53mOg5S (以
否
否
2018/11/13
86
0国药准字 H2010012
恩替卡韦 分散片
片剂
C02.05Hm2g5 (以
否
否
2018/11/6
87
9国药准字 H2002020
阿卡波糖 片
片剂 C5102mHg15 否
否
制江药苏有恒限瑞公医 药股份有限
57
6国药准字 H2014333
瑞舒伐他 汀钙片
片剂 10mg
2018.07.06
公海司正辉瑞制 药有限公司
58
8国药准字 H2014333
瑞舒伐他 汀钙片
片剂 5mg
2018.07.06
海正辉瑞制 药有限公司
59
7国药准字 H1097021
盐酸特比 萘芬片
片剂
0.125g (按
N1300m5gS (按瑞
否
否
2018/10/8 药有限公司
76
6国药准字 H4402077
盐酸二甲 双胍片
舒伐他 片剂 0.25g 否
否
2018/10/27
77
5国药准字 H2005039
盐酸坦索 罗辛缓释
胶囊 剂
0.2mg
2018/8/23
78
2国药准字 H2013003
胶恩囊替卡韦 胶囊
胶囊 剂
公江司苏豪森药 业集团有限
2018/5/15
公正司大天晴药 业集团股份
2018/5/14
有浙限江公华司海药 业股份有限
国家药品监督管理局关于发布仿制药参比制剂目录(第四十二批)的通告

国家药品监督管理局关于发布仿制药参比制剂目录(第四十二批)的通告文章属性•【制定机关】国家药品监督管理局•【公布日期】2021.06.22•【文号】国家药品监督管理局通告2021年第41号•【施行日期】2021.06.22•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文国家药品监督管理局通告2021年第41号国家药监局关于发布仿制药参比制剂目录(第四十二批)的通告经国家药品监督管理局仿制药质量和疗效一致性评价专家委员会审核确定,现发布仿制药参比制剂目录(第四十二批)。
特此通告。
附件:仿制药参比制剂目录(第四十二批)国家药监局2021年6月22日附件仿制药参比制剂目录(第四十二批)序号药品通用名称英文名称/商品名规格持证商备注1备注242-1 依折麦布辛伐他汀片Ezetimibe andSimvastatin Tablets/葆至能每片含依折麦布10mg,辛伐他汀20mgMerck Sharp &Dohme B.V.国内上市的原研药品原研进口42-2 依折麦布辛伐他汀片Ezetimibe andSimvastatin Tablets/葆至能每片含依折麦布10mg,辛伐他汀40mgMerck Sharp &Dohme B.V.国内上市的原研药品原研进口42-3 格拉司琼透皮贴片GranisetronTransdermal Patches34.3mg/52cm2(释药量3.1mg/24h)ProStrakan国内上市的原研药品原研进口42-4 ω-3鱼油脂肪乳注射液ω-3 Fish Oil FatEmulsionInjection/Omegaven50ml:5g(精制鱼油):0.6g (卵磷脂)Fresenius KabiAustria GmbH国内上市的原研药品原研进口42-5 盐酸奥布卡因滴眼液OxybuprocaineHydrochloride EyeDrops / Benoxil(倍诺喜)0.4%(0.5ml:2mg)SantenPharmaceuticalCo., Ltd.国内上市的原研药品原研进口42-6 10%脂肪乳(OO)/5.5%氨基酸(15)/葡萄糖(20%)注射液10% Fat Emulsion(OO)/5.5%Amino Acids(15)/Glucose(20%)Injection/Oliclinomel(克林玫)1500ml:10%橄榄油脂肪乳300ml+5.5%复方氨基酸注射液(15)600ml+20%葡萄糖注射液600mlBaxter S.A.国内上市的原研药品原研进口42-7 10%脂肪乳(OO)/5.5%氨基酸(15)/葡萄糖(20%)注射液10% Fat Emulsion(OO)/5.5%Amino Acids(15)/Glucose(20%)Injection/Oliclinomel(克林玫)1000ml:10%橄榄油脂肪乳200ml+5.5%复方氨基酸注射液(15)400ml+20%葡萄糖注射液400mlBaxter S.A.国内上市的原研药品原研进口42-8 苯甲酸钠苯乙酸钠注射液SodiumPhenylacetate andSodium BenzoateInjection /Ammonul10%;10%(5g/50mL;5g/50mL)Bausch HealthUs LLC未进口原研药品美国橙皮书42-9 苯丁酸甘油酯口服液GlycerolPhenylbutyrate OralLiquid/Ravicti1.1 g/mLHorizonTherapeuticsLLC未进口原研药品美国橙皮书42-10 盐酸西替利嗪注射液CetirizineHydrochlorideInjection/Quzyttir10mg/mlJDPTherapeuticsLLC未进口原研药品美国橙皮书42-11 拉莫三嗪缓释片LamotrigineExtended ReleaseTablets / LamictalXR25mgGlaxoSmithKlineLLC未进口原研药品美国橙皮书42-12 拉莫三嗪缓释片LamotrigineExtended ReleaseTablets / LamictalXR50mgGlaxoSmithKlineLLC未进口原研药品美国橙皮书42-13 拉莫三嗪缓释片LamotrigineExtended ReleaseTablets / LamictalXR100mgGlaxoSmithKlineLLC未进口原研药品美国橙皮书42-14 拉莫三嗪缓释片LamotrigineExtended ReleaseTablets / LamictalXR200mgGlaxoSmithKlineLLC未进口原研药品美国橙皮书42-15 拉莫三嗪缓释片LamotrigineExtended ReleaseTablets / LamictalXR250mgGlaxoSmithKlineLLC未进口原研药品美国橙皮书42-16 拉莫三嗪缓释片LamotrigineExtended ReleaseTablets / LamictalXR300mgGlaxoSmithKlineLLC未进口原研药品美国橙皮书42-17 氢溴酸安非他酮缓释片BupropionHydrobromideExtended-ReleaseTablets/Aplenzin174mgValeantPharmaceuticalsNorth AmericaLLC未进口原研药品美国橙皮书42-18 氢溴酸安非他酮缓释片BupropionHydrobromideExtended-ReleaseTablets/Aplenzin348mgValeantPharmaceuticalsNorth AmericaLLC未进口原研药品美国橙皮书42-19 氢溴酸安非他酮缓释片BupropionHydrobromideExtended-ReleaseTablets/Aplenzin522mgValeantPharmaceuticalsNorth AmericaLLC未进口原研药品美国橙皮书42-20 核黄素磷酸钠滴眼液Riboflavin 5’-PhosphateOphthalmicSolution/ Photrexa0.146%GlaukosCorporation未进口原研药品美国橙皮书42-21 壬二酸凝胶Azelaic Acid Gel /Finacea15%Leo Pharma AS未进口原研药品美国橙皮书42-22 盐酸吉西他滨注射液GemcitabineHydrochlorideInjection200mg/5.26ml(38 mg/ml)Hospira, Inc.未进口原研药品美国橙皮书42-23 盐酸吉西他滨注射液GemcitabineHydrochlorideInjection1g/26.3ml(38 mg/ml)Hospira, Inc.未进口原研药品美国橙皮书42-24 盐酸伊达比星注射液IdarubicinHydrochlorideInjection/IdamycinPfs1 mg/ml Pfizer Inc未进口原研美国橙皮书42-25 盐酸氟西汀口服溶液FluoxetineHydrochloride OralSolution/ Prozac20mg/5ml Lilly France未进口原研药品欧盟上市42-26 曲安奈德益康唑乳膏TriamcinoloneAcetonide andEconazole NitrateCream每克含硝酸益康唑10mg、曲安奈德1.0mgJanssen-Cilag未进口原研药品欧盟上市42-27 特比萘芬凝胶TerbinafineGel/LamisilDermGel1%GlaxosmithklineSante GrandPublic未进口原研药品欧盟上市42-28 ω-3鱼油中长链脂肪乳/氨基酸(16)/葡萄糖(16%)注射液ω-3 Fish OilMedium and LongChain FatEmulsion/AminoAcids (16)/Glucose (16%)Injection /NuTRIflex Omegaperi1250mlB.BraunMelsungen AG未进口原研药品欧盟上市42-29 复方α-酮酸片Compound α-Ketoacid Tablets0.63gFresenius KabiDeutschlandGmbH未进口原研药品欧盟上市42-30 盐酸头孢卡品酯颗粒Cefcapene PivoxilHydrochlorideGranules /Flomox10%(1g含盐酸盐水合物100mg,50mg/袋)塩野義製薬株式会社未进口原研药品日本上市42-31 儿童褪黑素颗粒Melatonin granulesfor pediatric /Melatobel1g:2mgノーベルファーマ株式会社未进口原研药品日本上市42-32 注射用盐酸尼非卡兰NifekalantHydrochloride forInjection / Shinbit50mgトーアエイヨー株式会社未进口原研药品日本上市42-33 枸橼酸铁片Ferric Citrate Tablet/Riona Tab 250mg250mg(以枸橼酸铁计)鳥居薬品株式会社未进口原研药品日本上市42-34 巴氯芬口服溶液Baclofen OralSolution/Lioresal5mg/5mlNovartisPharmaceuticalsUK Limited未进口原研药品英国上市42-35 阿替洛尔注射液AtenololInjection/Tenormin10ml:5mg AstraZeneca未进口原研药品英国上市42-36 盐酸帕罗西汀片ParoxetineHydrochlorideTablets/赛乐特20mg(以C19H20FNO3计)中美天津史克制药有限公司经审核确定的国外原研企业在中国境内生产的药品原研地产化42-37 硫酸沙丁胺醇吸入气雾剂Salbutamol SulfateInhalationAerosol/Proventil-Hfa90μg/揿(以沙丁胺醇计)Kindeva DrugDeliveryLP/Merck Sharp& DohmeCorp./3M DrugDeliverySystems未进口原研药品美国橙皮书42-38 注射用泮托拉唑钠Pantoprazole SodiumFor Injection/Pantoprazole Sodium40mgHikmaPharmaceuticalsLLC未进口原研药品美国橙皮书42-39 别嘌醇片Allopurinol Tablets/Zyloprim0.3gCasper ParmaLLC未进口原研药品美国橙皮书42-40 马来酸依那普利片Enalapril MaleateTablets/Vasotec5mgBausch HealthUS LLC未进口原研药品美国橙皮书42-41 马来酸依那普利片Enalapril MaleateTablets/Vasotec10mgBausch HealthUS LLC未进口原研药品美国橙皮书42-42 马来酸依那普利片Enalapril MaleateTablets/Vasotec20mgBausch HealthUS LLC未进口原研药品美国橙皮书42-43 卡巴他赛注射液CabazitaxelInjection/Jevtana60mg/1.5ml(40mg/ml)Sanofi-AventisUS INC未进口原研药品美国橙皮书42-44 奥拉帕利片OlaparibTablets/Lynparza100mgAstraZenecaPharmaceuticalsLP未进口原研药品美国橙皮书42-45 奥拉帕利片OlaparibTablets/Lynparza150mgAstraZenecaPharmaceuticalsLP未进口原研药品美国橙皮书42-46 曲氟尿苷替匹嘧啶片Trifluridine andTipiracilHydrochlorideTablets/Lonsurf曲氟尿苷15mg,盐酸替匹嘧啶7.065mg(相当于替匹嘧啶6.14mg)Taiho OncologyInc.未进口原研药品美国橙皮书42-47 曲氟尿苷替匹嘧啶片Trifluridine andTipiracilHydrochlorideTablets/Lonsurf曲氟尿苷20mg,盐酸替匹嘧啶9.420mg(相当于替匹嘧啶8.19mg)Taiho OncologyInc未进口原研药品美国橙皮书42-48 盐酸帕罗西汀片ParoxetineHydrochlorideTablets / Paxil10mgApotexTechnologies Inc未进口原研药品美国橙皮书42-49 盐酸帕罗西汀片ParoxetineHydrochlorideTablets / Paxil30mgApotexTechnologies Inc未进口原研药品美国橙皮书42-50 布立西坦注射液BrivaracetamSolution forInjection/Briviact10mg/ml UCB Inc未进口原研药品美国橙皮书42-51 丙酸氟替卡松乳膏FluticasonePropionate Cream0.05%Perrigo IsraelPharmaceuticalsLtd国际公认的同种药品美国橙皮书42-52 拉坦前列素滴眼液Latanoprost EyeDrops/Xalatan0.005%Upjohn US 2LLC未进口原研药品美国橙皮书42-53 卡前列素氨丁三醇注射液CarboprostTromethamineInjection/Hemabate1ml:250μg Pfizer Inc未进口原研药品美国橙皮书42-54 枸橼酸托法替布缓释片Tofacitinib CitrateExtended Releasetablets/Xeljanz Xr22mg Pfizer Inc未进口原研药品美国橙皮书42-55 注射用头孢哌酮钠舒巴坦钠CefoperazoneSodium andSulbactam SodiumforInjection/Sulperazon1g(头孢哌酮0.5g:舒巴坦0.5g)Pfizer Polska Sp.z o.o.未进口原研药品欧盟上市42-56 依替巴肽注射液EptifibatideInjection/Integrilin20mg/10mLGlaxoSmithKline(Ireland)Limited未进口原研药品欧盟上市42-57 依替巴肽注射液EptifibatideInjection/Integrilin75mg/100mLGlaxoSmithKline(Ireland)Limited未进口原研药品欧盟上市42-58 利伐沙班片RivaroxabanTablets/Xarelto2.5mg Bayer AG未进口原研药品欧盟上市42-59 利伐沙班片RivaroxabanTablets/Xarelto10mg Bayer AG未进口原研药品欧盟上市42-60 利伐沙班片RivaroxabanTablets/Xarelto15mg Bayer AG未进口原研药品欧盟上市42-61 利伐沙班片RivaroxabanTablets/Xarelto20mg Bayer AG未进口原研药品欧盟上市42-62 钆特酸葡胺注射液Gadoteric AcidMeglumine SaltInjection/Dotarem0.5 mmol/mL(10ml、15ml、20ml/瓶)Guerbet未进口原研药品欧盟上市42-63 盐酸伐地那非口崩片VardenafilHydrochlorideOrally disintegratingTablets/Levitra10mg Bayer AG未进口原研药品欧盟上市42-64 甲泼尼龙片Methylprednisolon/Medrol16mg Pfizer Italia s.r.l未进口原研药品欧盟上市42-65 卡络磺钠注射液Carbosulfan Sodiuminjection/Adona20ml:100mgニプロESファーマ株式会社未进口原研药品日本上市42-66 托拉塞米片TorasemideTablets/Torem5mgMylan ProductsLtd.未进口原研药品英国上市42-67 托拉塞米片TorasemideTablets/Torem10mgMylan ProductsLtd.未进口原研药品英国上市6-12硫酸羟氯喹片HydroxychloroquineSulfateTablets/Plaquenil0.2gAventis PharmaLimited/ Sanofi-aventis IrelandLtd. T/ASANOFI原研进口持证商变更,增加持证商Sanofi-aventis IrelandLtd. T/A SANOFI10-223克唑替尼胶囊CrizotinibCapsules/XALKORI0.25gPfizer Ltd./PFIZEREUROPE MAEEIG原研进口持证商变更,增加持证商PFIZEREUROPE MAEEIG10-224克唑替尼胶囊CrizotinibCapsules/XALKORI0.2gPfizer Ltd./PFIZEREUROPE MAEEIG原研进口持证商变更,增加持证商PFIZEREUROPE MAEEIG17-7盐酸贝尼地平片BenidipineHydrochlorideTablets/可力洛4mg协和发酵麒麟株式会社/KyowaKirin Co., Ltd.原研进口持证商变更,增加持证商KyowaKirin Co., Ltd.17-8盐酸贝尼地平片BenidipineHydrochlorideTablets/可力洛8mg协和发酵麒麟株式会社/KyowaKirin Co., Ltd.原研进口持证商变更,增加持证商KyowaKirin Co., Ltd.17-15盐酸西那卡塞片CinacalcetHydrochlorideTablets/盖平25mg协和发酵麒麟株式会社/KyowaKirin Co., Ltd.原研进口持证商变更,增加持证商KyowaKirin Co., Ltd.17-16盐酸西那卡塞片CinacalcetHydrochlorideTablets/盖平75mg协和发酵麒麟株式会社/KyowaKirin Co., Ltd.原研进口持证商变更,增加持证商KyowaKirin Co., Ltd.23-18甲磺酸仑伐替尼胶囊Lenvatinib MesilateCapsules/Lenvima(乐卫玛)4mgEisai EuropeLtd./EisaiGmbH国内上市的原研药品持证商变更,增加持证商EisaiGmbH24-179他氟前列素滴眼液Tafluprost EyeDrops/Tapros(泰普罗斯)0.0015%(2.5ml:37.5μg)SantenPharmaceuticalCo.,Ltd.国内上市的原研药品规格更新为0.0015%(2.5ml:37.5μg)27-235贝前列素钠片Beraprost SodiumTablets40μg武田テバファーマ株式会社(TevaPharma JapanInc)国际公认的同种药品规格修订为40μg备注1.目录中所列尚未在国内上市品种的通用名、剂型等,以药典委核准的为准。
289种药品列入一致性评价目录

289种药品列入一致性评价目录CFDA今日发布关于落实《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》有关事项的公告(2022年第106号),指出289种化学药品仿制药口服固体制剂原则上应在2022年底前完成一至性评价。
以下全文:为贯彻落实《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》(国办发〔2022〕8号),提高仿制药质量,现将有关事项公告如下:一、评价对象和实施阶段(一)化学药品新注册分类实施前批准上市的仿制药,包括国产仿制药、进口仿制药和原研药品地产化品种,均须开展一致性评价。
(二)凡2007年10月1日前批准上市的列入国家基本药物目录(2022年版)中的化学药品仿制药口服固体制剂(附件),原则上应在2022年底前完成一致性评价。
(三)上述第(二)款以外的化学药品仿制药口服固体制剂,可以自行组织一致性评价;自第一家品种通过一致性评价后,三年后不再受理其他药品生产相同品种的一致性评价申请。
二、参比制剂的选择和确定(四)药品生产企业对拟进行一致性评价的品种,参照《普通口服固体制剂参比制剂选择和确定指导原则》(食品药品监管总局公告2022年第61号)要求选择参比制剂。
(五)药品生产企业按照《仿制药质量和疗效一致性评价参比制剂备案与推荐程序》(食品药品监管总局公告2022年第99号),将选择的参比制剂向食品药品监管总局仿制药质量一致性评价办公室(以下简称一致性评价办公室)备案。
行业协会可向一致性评价办公室推荐参比制剂,原研药品生产企业、国际公认的同种药物生产企业可向一致性评价办公室申报参比制剂。
一致性评价办公室主动对参比制剂的备案、推荐和申报信息向社会公开。
食品药品监管总局及时公布推荐和确定的参比制剂信息,药品生产企业原则上应选择公布的参比制剂开展一致性评价。
(六)企业找不到且无法确定参比制剂的,由药品生产企业开展临床有效性试验。
三、一致性评价的研究内容(七)在开展一致性评价过程中,药品生产企业须以参比制剂为对照,全面深入地开展比对研究。
2023年盐酸维拉帕米片行业市场调查报告

2023年盐酸维拉帕米片行业市场调查报告盐酸维拉帕米片是一种钙离子通道阻滞剂,用于治疗心绞痛和高血压。
这种药物在全球范围内广泛使用,并且在市场上有着稳定的需求。
本文将对盐酸维拉帕米片行业市场进行调查分析。
市场规模及增长趋势:盐酸维拉帕米片市场是一个庞大的市场,其规模不断扩大。
根据市场调查数据显示,全球盐酸维拉帕米片市场在2019年达到了100亿美元,预计到2025年将增长至150亿美元。
这主要是由于心血管疾病的普遍增加以及人口老龄化导致的心血管疾病患者人数的增加。
市场竞争分析:全球盐酸维拉帕米片市场竞争激烈,市场主要被一些大型制药公司占据。
其中,诺华、辉瑞、默克等公司是市场上的主要参与者。
这些公司通过不断进行研发和创新来提高产品的质量和效果,以在竞争中保持领先地位。
同时,市场上也存在一些中小型制药公司,它们通过提供具有竞争力的价格来吸引消费者。
地理区域分析:盐酸维拉帕米片市场在不同地理区域存在一定的差异。
根据市场调查显示,亚洲地区是盐酸维拉帕米片市场最大的消费者。
亚洲地区的市场占据了全球市场的30%以上。
这主要是由于亚洲地区的人口数量庞大以及亚洲国家在心血管疾病患者人数上的增长。
此外,北美和欧洲地区也是盐酸维拉帕米片市场的重要地区。
市场驱动因素:盐酸维拉帕米片市场的增长得益于多种因素的驱动。
首先,全球范围内心血管疾病的患病率逐渐增加,这导致了对心血管药物的需求的增加。
其次,人口老龄化也是市场增长的重要因素,老年人群体更容易患有心血管疾病,因此对盐酸维拉帕米片的需求增加。
此外,不断改善的医疗设施和保险覆盖范围的扩大也是市场增长的推动因素。
市场挑战及风险:尽管盐酸维拉帕米片市场前景广阔,但也面临着一些挑战和风险。
首先,市场上存在一些仿制药和替代品的竞争,这对原始产品的销售构成一定的压力。
其次,一些地区存在政府对药品价格的管制,这可能对市场造成一定的限制。
此外,药物的副作用和安全性问题也是市场风险的一个因素。
2023年盐酸维拉帕米片行业市场分析现状

2023年盐酸维拉帕米片行业市场分析现状盐酸维拉帕米片是一种钙通道阻滞剂,可用于治疗心律失常和高血压等疾病。
在行业市场分析中,我们可以从市场规模、竞争格局、市场需求和发展趋势等方面对盐酸维拉帕米片的现状进行研究。
市场规模:盐酸维拉帕米片市场规模庞大。
根据相关报告数据显示,盐酸维拉帕米片市场在过去几年中一直保持稳定增长。
主要是受到人口老龄化、心血管疾病患者增多等因素的影响。
预计在未来几年中,盐酸维拉帕米片市场规模还将继续扩大。
竞争格局:盐酸维拉帕米片市场竞争激烈。
目前市场上有多家生产和销售盐酸维拉帕米片的企业。
这些企业之间主要通过产品质量、价格、销售渠道等方面展开竞争。
同时,由于盐酸维拉帕米片市场的发展潜力巨大,新的企业也不断进入市场,增加了市场竞争的强度。
市场需求:盐酸维拉帕米片市场需求旺盛。
随着社会发展和人们生活水平的提高,心血管疾病的发病率逐年增加。
盐酸维拉帕米片作为治疗心律失常和高血压的药物,受到了广大患者的青睐。
此外,随着人口老龄化的加剧,心血管疾病患者数量也在不断增加,进一步推动了盐酸维拉帕米片市场的需求增长。
发展趋势:盐酸维拉帕米片市场有多个发展趋势。
首先,随着科技的进步,新的药物研发技术和治疗方法不断涌现,可能会对盐酸维拉帕米片的市场带来一定的冲击。
其次,随着社会医疗保障制度的完善,患者对药物的价格和疗效要求越来越高。
因此,企业需要不断提高产品质量和服务,以满足患者的需求。
此外,随着人们健康意识的增强,预防心血管疾病的重要性也逐渐被人们认识到,预防和治疗并重的发展战略可能是盐酸维拉帕米片市场的一个重要发展方向。
综上所述,盐酸维拉帕米片市场目前处于一个快速发展的阶段。
尽管市场竞争激烈,但由于市场需求旺盛,仍然存在着大量的市场机会。
企业应加强创新能力,优化产品结构,不断提高产品质量和服务,以赢得竞争优势,稳定市场份额。
同时,也应关注科技进步和行业发展趋势,积极寻找新的发展机遇。
2023年维拉帕米缓释片行业市场需求分析

2023年维拉帕米缓释片行业市场需求分析维拉帕米缓释片是一种针对心脏疾病的药物,主要用于治疗心律不齐、高血压、冠心病等症状。
随着心脏疾病患者数量的增加和医疗技术的进步,维拉帕米缓释片的市场需求也在逐渐增长。
一、市场需求1. 心脏疾病患者数量增加近年来,随着人们生活水平的提高和生活方式的改变,心脏疾病的发病率逐渐上升。
据统计,我国心脏病患者人数已经达到1.5亿人,其中冠心病已经成为我国患病率最高的疾病之一。
而维拉帕米缓释片正是针对这类心脏疾病进行治疗的药物,因此市场需求也在逐渐增加。
2. 医疗技术进步医疗技术的不断进步,也是维拉帕米缓释片市场需求增长的重要原因之一。
随着心脏病的研究不断深入,针对心脏病的治疗方案也不断更新,维拉帕米缓释片在这个过程中起到了重要的作用。
随着医疗技术的不断提高,维拉帕米缓释片的应用范围也在不断扩大,市场需求也随之增长。
3. 市场后劲充足维拉帕米缓释片市场的后劲也十分充足。
首先,随着人们生活水平的提高和医疗保障制度的完善,人们对于心脏疾病的治疗需求也越来越强烈。
其次,随着维拉帕米缓释片的不断研究和开发,该药物的疗效和安全性也得到了不断提升,客户的信任也在相应提高。
因此,维拉帕米缓释片市场的前景也十分广阔。
二、市场竞争1、口碑优良的品牌随着市场规模的扩大,竞争也越来越激烈。
目前,维拉帕米缓释片市场上存在着多个知名品牌,其中一些品牌已经具有了较高的知名度和较好的口碑。
这些品牌不仅拥有优质的产品和完善的服务,还能够提供比较优惠的价格,因此在市场上具有极高的竞争力。
2、保持创新力在市场竞争激烈的情况下,维拉帕米缓释片生产厂家需要不断提高创新力,推出具有独特性的产品。
在推广产品时,宣传重点也需要放在独特性能够给消费者带来的体验和效果上。
同时,生产厂家也需要加强与国内外的学术机构和专业团体的合作,共同开展研究和推广工作。
三、市场前景总体而言,维拉帕米缓释片市场的前景是非常广阔的。
随着人们生活方式的改变和心脏疾病患者数量的不断增加,维拉帕米缓释片的市场需求也在逐渐增大。
仿制药一致性评价-仿制药一致性评价的盐酸氨溴索片共76页PPT

END
仿制药一致性评价-仿制药一致性评价的 盐酸氨溴索片
•
46、寓形宇内复几时,曷不委心任去 留。
•
47、采菊东篱下,悠然见南山。
•
48、啸傲东轩下,聊复得此生。
•
49、勤学如春起之苗,不见其增,日 有所长 。
•
50、环堵萧然,不蔽风日;短褐穿结 ,箪瓢 屡空, 晏如也 。
16、业余生活要有意义,不要越轨。——华盛顿 17、一个人即使已登上顶峰,也仍要自强不息。——罗素·贝克 18、最大的挑战和突破在于用人,而用人最大的突破在于信任人。——马云 19、自己活着,就是为了使别人过得更美好。——雷锋 20、要掌握书,莫被书掌握;要为生而读,莫为读而生。——布尔沃
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
证券代码:002393 证券简称:力生制药公告编号:2020-030
天津力生制药股份有限公司
关于子公司中央药业药品盐酸维拉帕米片
通过仿制药一致性评价的公告
一、概况
近日,天津力生制药股份有限公司(以下简称“本公司”)的子公司天津市中央药业有限公司(以下简称“中央药业”)收到国家药品监督管理局颁发的关于盐酸维拉帕米片(以下简称“该药品”)40mg规格的《药品补充申请批件》(批件号:2020B02655),该药品通过仿制药质量和疗效一致性评价,中央药业为全国首家通过该品种一致性评价的企业。
二、该药品的基本情况
药品名称:盐酸维拉帕米片
剂型:片剂
规格:40mg
注册分类:化学药品
药品生产企业:天津市中央药业有限公司
原批准文号:国药准字H12020051
申请事项:国产药品注册一致性评价
受理号:CYHB1950140
审批结论:通过仿制药质量和疗效一致性评价。
三、该药品的相关信息
盐酸维拉帕米片,适应症为:
1.心绞痛:变异型心绞痛,不稳定性心绞痛,慢性稳定性心绞痛。
2.心律失常:与地高辛合用控制慢性心房颤动和/或心房扑动(除WPW综合征或L-G-L 综合征外)时的心室率,预防阵发性室上性心动过速的反复发作。
3.原发性高血压。
四、对本公司的影响及风险提示
中央药业该药品通过仿制药质量和疗效一致性评价,有利于提升该药品市场竞争力。
由于医药产品的行业特点,各类产品/药品的具体销售情况可能受到市场环境变化等因素影响,具有较大不确定性,敬请广大投资者注意投资风险。
特此公告。
天津力生制药股份有限公司
董事会
2020年4月23日。
