载体与表达系统
细菌的重组蛋白质表达系统

细菌的重组蛋白质表达系统蛋白质是构成生物体及细胞的重要组成部分,也是细胞功能的核心执行者。
为了研究和应用不同类型的蛋白质,科学家发展出了各种蛋白质表达系统。
其中,细菌的重组蛋白质表达系统是最常用的一种方法之一。
本文将详细介绍细菌重组蛋白质表达系统的原理、优势和应用。
一、原理细菌重组蛋白质表达系统利用细菌作为宿主来表达外源蛋白质。
这个系统主要包括以下几个重要组成部分:表达载体、宿主菌株、诱导系统和纯化方法。
1. 表达载体表达载体是指带有外源蛋白质编码序列的质粒。
这些质粒通常包括启动子、反义密码子和终止子等参与蛋白质表达的元件。
其中,启动子通过结合转录因子来启动蛋白质合成的过程。
反义密码子则能够增强蛋白质的长效稳定性,并促进其在细菌中的高效表达。
2. 宿主菌株宿主菌株在蛋白质表达系统中起到重要的作用,通常选择大肠杆菌作为宿主,主要因为大肠杆菌具有较高的生长速度、易于培养和常用的遗传工具。
此外,大肠杆菌本身产生的内切酶活性较低,有利于保护外源蛋白质的稳定性。
3. 诱导系统诱导系统是细菌重组蛋白质表达系统中的一个重要组成部分。
通常使用化学诱导或者温度诱导来启动表达载体中蛋白质编码序列的转录和翻译。
化学诱导通常通过添加一种诱导剂,如异丙基-β-D-硫代半乳糖苷(IPTG),来激活载体中的启动子。
温度诱导则是通过改变培养温度来调节蛋白质表达。
4. 纯化方法纯化是细菌重组蛋白质表达系统中最关键的环节之一。
常用的纯化方法包括亲和纯化、碳水化合物基负载层析和凝胶过滤等。
这些方法能够根据蛋白质的特性和亲和性实现高效纯化。
二、优势与其他蛋白质表达系统相比,细菌重组蛋白质表达系统具有以下优势:1. 高效性细菌重组蛋白质表达系统是目前各种表达系统中最高效的一种方法之一。
通过优化表达条件和使用高效的诱导系统,可以实现高产量的蛋白质表达。
此外,细菌本身的生长速度也有助于高效表达。
2. 便捷性相比其他表达系统,细菌重组蛋白质表达系统的操作更为简便。
真核细胞表达系统的类型与常用真核细胞表达载体

真核细胞表达系统的类型与常用真核细胞表达载体标签:真核细胞酵母表达系统细胞表达载体真核表达系统昆虫表达系统动物表达系统摘要 : 原核表达系统是常被用来研究基因功能的成熟系统,由于原核表达系统具有包涵体蛋白不易纯化、蛋白修饰不完整等缺陷,人们也开始利用真核细胞表达系统来研究基因。
原核表达系统是常被用来研究基因功能的成熟系统,由于原核表达系统具有包涵体蛋白不易纯化、蛋白修饰不完整等缺陷,人们也开始利用真核细胞表达系统来研究基因。
自上世纪70年代基因工程技术诞生以来,基因表达技术已渗透到生命科学研究的各个领域。
并随着人类基因组计划实施的进行,在技术方法上得到了很大发展,时至今日已取得令人瞩目的成就。
随着人类基因组计划的完成,越来越多的基因被发现,其中多数基因功能不明。
利用表达系统在哺乳动物细胞内表达目的基因是研究基因功能及其相互作用的重要手段。
在各种表达系统中,最早被采用进行研究的是原核表达系统,这也是目前掌握最为成熟的表达系统。
该项技术的主要方法是将已克隆入目的基因DNA段的载体(一般为质粒)转化细菌(通常选用的是大肠杆菌),通过iptg诱导并最终纯化获得所需的目的蛋白。
其优点在于能够在较短时间内获得基因表达产物,而且所需的成本相对比较低廉。
但与此同时原核表达系统还存在许多难以克服的缺点:如通常使用的表达系统无法对表达时间及表达水平进行调控,有些基因的持续表达可能会对宿主细胞产生毒害作用,过量表达可能导致非生理反应,目的蛋白常以包涵体形式表达,导致产物纯化困难;而且原核表达系统翻译后加工修饰体系不完善,表达产物的生物活性较低。
为克服上述不足,许多学者将原核基因调控系统引入真核基因调控领域,其优点是:①根据原核生物蛋白与靶DNA间作用的高度特异性设计,而靶DNA与真核基因调控序列基本无同源性,故不存在基因的非特异性激活或抑制;②能诱导基因高效表达,可达105倍,为其他系统所不及;③能严格调控基因表达,即不仅可控制基因表达的“开关”,还可人为地调控基因表达量。
克隆载体与表达载体
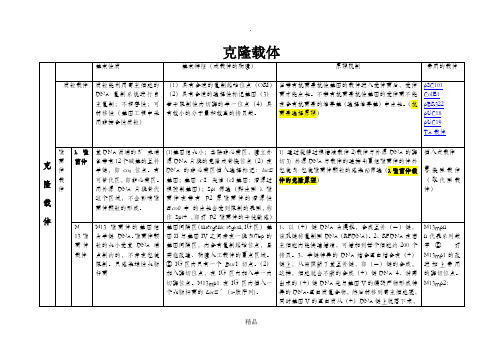
染色体具有复制功能,利用染色体的复制元件来驱动外源DNA片段复制的载体称为人工染色体载体
其装载外源DNA的容量比质粒、噬菌体和噬菌体-质粒杂合载体等有很大的拓展,甚至可以跟染色体的大小相媲美。
人工染色体载体拷贝数少,制备困难,通常采取“穿梭载体”的策略来解决
含有质粒载体所必备的第一受体(大肠杆菌)质粒复制起始位点,这样的载体在大肠杆菌内可以按质粒复制形式进行高拷贝复制,含有第二受体(如酵母)端粒(TEL)、DNA复制起始位点(ARS)和着丝粒(CEN)以及合适的选择标记。载体在体外与目的DNA重组后转化到第二受体细胞,按照染色体复制的形式进行复制和传递。筛选第一受体的克隆子一般采用抗生素抗性选择标记;筛选第二受体的克隆子常用与受体互补的营养缺陷型。
克隆载体
基本性质
基本特征(或载体的构建)
原理机制
常用的载体
克隆载体
质粒载体
质粒能利用寄主细胞的DNA复制系统进行自主复制;不相容性;可转移性(基因工程中采用非接合性质粒)
(1)具有合适的复制起始位点(ORI)(2)具有合适的选择性标记基因(3)若干限制性内切酶的单一位点(4)具有较小的分子量和较高的拷贝数。
M13噬菌体产生单双链DNA的机制)
LacZ’ 5’端的第13个核苷酸G突变成A,产生了一个EcoR I切点
一类人工构建的含有λ-DNA cos序列和质粒复制子的的特殊类型载体。能像l-DNA那样进行体外包装,并高效转染受体细胞;能像质粒那样在受体细胞中自主复制具有较高容量的克隆能力:45kb;具有与同源性序列的质粒进行重组的能力
当带有抗菌素抗性基因的载体进入受体菌后,受体菌才能生长。不带有抗菌素抗性基因的受体菌不能在含有抗菌素的培养基(选择培养基)中生长。(抗菌素选择原理)
原核蛋白表达流程

原核蛋白表达是一种常用的蛋白质生产方法,可以通过大肠杆菌等原核细菌表达目标蛋白。
以下是一个典型的原核蛋白表达流程:1. 选择表达系统和载体:选择适合的原核表达系统和载体。
常用的原核表达系统包括大肠杆菌系统(如E.coli),常用的载体包括pET、pGEX等。
2. 构建重组质粒:将目标基因克隆到选定的表达载体上,通常采用限制性内切酶切割和连接方法,确保目标基因正确插入载体。
3. 转化宿主菌:将构建好的重组质粒转化入宿主菌中,一般选择适当的大肠杆菌菌株,如BL21(DE3)等。
4. 培养菌液:将含有重组质粒的宿主菌接种到适当的培养基中,进行菌液的培养。
培养条件可根据所选的菌株和载体进行优化,包括温度、培养时间、培养基成分等。
5. 诱导表达:在适当的生长阶段,向培养基中加入适量的诱导剂,常用的诱导剂包括异丙基-β-D-硫代半乳糖苷(IPTG)。
6. 细胞破碎:经过一定时间的表达后,收集培养菌液并将细菌进行破碎,释放目标蛋白。
破碎方法可以选择超声波破碎、高压破碎等。
同时添加适量的蛋白酶抑制剂,避免蛋白质的降解。
7. 蛋白纯化:通过一系列的蛋白纯化步骤,如亲和层析、离子交换层析、凝胶过滤层析等,分离纯化目标蛋白。
此步骤可以根据目标蛋白的特性和需求进行优化。
8. 鉴定和确认:对纯化得到的蛋白进行鉴定和确认,如SDS-PAGE凝胶电泳、Western blot等。
确保表达的目标蛋白符合预期。
9. 储存和应用:将纯化好的目标蛋白进行适当的保存和储存,确保其稳定性和活性。
根据需要,可以进行后续的功能研究、结构分析、制备抗体等应用。
需要注意的是,原核蛋白表达流程可以根据实验目的和具体要求进行调整和优化。
不同的表达系统和载体可能需要适应性调整。
此外,对特定蛋白的表达可能需要进一步优化培养条件和蛋白纯化步骤。
真核细胞表达系统的类型与常用真核细胞表达载体

真核细胞表达系统的类型与常用真核细胞表达载体标签:真核细胞酵母表达系统细胞表达载体真核表达系统昆虫表达系统动物表达系统摘要: 原核表达系统是常被用来研究基因功能的成熟系统,由于原核表达系统具有包涵体蛋白不易纯化、蛋白修饰不完整等缺陷,人们也开始利用真核细胞表达系统来研究基因。
原核表达系统是常被用来研究基因功能的成熟系统,由于原核表达系统具有包涵体蛋白不易纯化、蛋白修饰不完整等缺陷,人们也开始利用真核细胞表达系统来研究基因。
自上世纪70年代基因工程技术诞生以来,基因表达技术已渗透到生命科学研究的各个领域。
并随着人类基因组计划实施的进行,在技术方法上得到了很大发展,时至今日已取得令人瞩目的成就。
随着人类基因组计划的完成,越来越多的基因被发现,其中多数基因功能不明。
利用表达系统在哺乳动物细胞内表达目的基因是研究基因功能及其相互作用的重要手段。
在各种表达系统中,最早被采用进行研究的是原核表达系统,这也是目前掌握最为成熟的表达系统。
该项技术的主要方法是将已克隆入目的基因DNA段的载体(一般为质粒)转化细菌(通常选用的是大肠杆菌),通过iptg诱导并最终纯化获得所需的目的蛋白。
其优点在于能够在较短时间内获得基因表达产物,而且所需的成本相对比较低廉。
但与此同时原核表达系统还存在许多难以克服的缺点:如通常使用的表达系统无法对表达时间及表达水平进行调控,有些基因的持续表达可能会对宿主细胞产生毒害作用,过量表达可能导致非生理反应,目的蛋白常以包涵体形式表达,导致产物纯化困难;而且原核表达系统翻译后加工修饰体系不完善,表达产物的生物活性较低。
为克服上述不足,许多学者将原核基因调控系统引入真核基因调控领域,其优点是:①根据原核生物蛋白与靶DNA间作用的高度特异性设计,而靶DNA与真核基因调控序列基本无同源性,故不存在基因的非特异性激活或抑制;②能诱导基因高效表达,可达105倍,为其他系统所不及;③能严格调控基因表达,即不仅可控制基因表达的“开关”,还可人为地调控基因表达量。
原核表达系统的工作原理

原核表达系统的工作原理原核表达系统是指利用原核生物(如大肠杆菌等)来表达外源蛋白质的工具,在生物技术和基因工程领域应用十分广泛。
原核表达系统通过重组DNA技术将目标基因插入原核细胞的表达载体中,并利用细胞自身的代谢机制,将目标蛋白质大量表达出来。
本文将详细介绍原核表达系统的工作原理。
1. 原核表达系统的基本构成原核表达系统的基本构成包括表达载体和宿主细胞两部分。
表达载体是一种重组DNA分子,通常包括以下基本组成成分:(1)起始位点(起始密码子):在大肠杆菌中通常为AUG。
(2)表达基因:包括编码目标蛋白质的DNA序列和转录启动子、转录终止子等序列。
(3)选择标记:旨在筛选出带有目标基因的细胞,并提高表达效率。
常用的选择标记有抗生素抵抗基因和荧光标记基因等。
(4)复制起点:能够使表达载体在宿主细胞内进行自我复制,提高表达效率。
宿主细胞则是一种能够实现表达载体遗传信号转录、翻译和合成目标蛋白质的生命体。
2. 原核表达系统的工作流程原核表达系统通过以下几个步骤来实现目标蛋白质的表达:(1)制备表达载体将目标基因插入表达载体中,构建成重组DNA分子。
(2)转化宿主细胞将制备好的表达载体转化(transform)到宿主细胞内。
转化过程中,表达载体通过电击、热激或溶菌酶处理等方法,被宿主细胞吞噬并与其细胞质融合。
(3)表达基因转录和翻译转录因子识别插入表达载体的启动子序列,调节基因在宿主细胞内能够合成被表达的mRNA。
转录后的mRNA与核糖体结合,开始翻译,合成蛋白质。
(4)目标蛋白质的后处理和纯化将宿主细胞内表达的蛋白质从培养基或细胞酶中提取出来。
通常采用离心、过滤或柱层析等方法,对蛋白质进行分离和纯化。
3. 原核表达系统的优缺点原核表达系统在生物技术和基因工程领域应用广泛,主要因为其有以下的优缺点。
(1)优点①高效:能够表达大量的目标蛋白质,通常能够达到10%以上的蛋白质总产量。
②简便:操作简便,不需要昂贵的设备,很容易进行规模化操作。
三种病毒转染的异同点

三种病毒转染的异同点一、病毒表达系统简介病毒载体是指以病毒为基础的载体,也是目前最常用的基因导入方式之一.通过对病毒基因组的遗传改造,使之能够携带外源目的基因和相关的病毒元件,并被包装成病毒颗粒。
病毒进而侵染宿主,使携带的外源基因在宿主体内表达.病毒的基因组可分为编码区和非编码区.其中,编码区包含病毒的必需基因和非必需基因,可分别表达产生病毒的结构蛋白和非结构蛋白;非编码区则含有病毒复制和包装所需的全部顺式作用元件。
由于野生型病毒常常具有致病性,为了避免实验或治疗中使用的病毒恢复成野生型,必须对病毒载体进行一系列的遗传改造。
譬如删除病毒基因组的非必需区,将顺式作用元件和反式作用元件分开连接至不同的载体上,或结合利用不同种病毒的必需蛋白等,最大程度地保证实验的安全性.哺乳动物病毒表达系统常常包含一到多个载体,将所需的载体转染包装细胞后,在反式因子的作用下,病毒复制、包装所需的顺式作用元件和外源基因表达盒即可被包装,最终产生带有外源基因的病毒颗粒。
经浓缩和纯化后的病毒液即可用于侵染目标宿主细胞或动物体,实现外源目的基因在宿主体内的表达。
二、病毒表达系统的优势病毒的转导效率比常规真核表达载体高很多,因此特别适合于介导外源基因在难转染甚至无法转染的哺乳动物细胞中表达。
三、辉骏生物病毒服务简介辉骏生物的病毒产品包括慢病毒、腺病毒和逆转录病毒,服务项目包括:各类病毒载体的构建和病毒包装,以及慢病毒介导的稳定表达株建立等。
慢病毒表达系统:一种很常用的哺乳动物病毒表达系统;慢病毒感染宿主细胞时,可将携带的外源基因随机、稳定地整合入宿主细胞基因组中,实现目的基因稳定、长期的表达,非常适合于基因过表达稳定细胞株的建立和RNAi研究。
图1 慢病毒感染宿主细胞原理图腺病毒表达系统:一种很常用的哺乳动物病毒表达系统;但与慢病毒不同的是,腺病毒基因组及其携带的外源基因不会整合入宿主细胞的基因组中,而是游离于宿主基因组外独立表达,因此可实现目的基因瞬时、高丰度的表达,同时还避免了因整合而引发的潜在的基因突变和随机效应,安全性和可控性高。
双元表达载体系统

双元表达载体系统双元表达载体系统主要包括两个部分:一部分为卸甲Ti质粒,这类Ti质粒由于缺失了T-DNA 区域,完全丧失了致瘤作用,主要是提供Vir基因编码表达Vir蛋白的功能,VIR基因编码的virD2蛋白相当于反式作用元件,能够识别农杆菌转运DNA(T-DNA)两端24bp序列,进而将T-DNA以单链的形式切割下来,同时,VIR基因编码的virE2能够与单链T-DNA结合,形成T-复合物,在核定位序列的作用下,经过宿主细胞T4SS转运体系进入宿主细胞质。
之后便是宿主细胞的转运过程,激活处于反式位置上的T-DNA的转移。
另一部份是微型Ti质粒(Mini-Ti plasmid),它在T-DNA左右边界序列之间提供植株选择标记如NPTII基因以及Lac Z基因等。
双元载体系统的构建的原理是Ti质粒上的Vir基因可以反式激活T-DNA 的转移。
与共整合载体所不同的是,它不依赖两个质粒之间的同源序列,不需要共整合过程就能在农杆菌内独立复制。
原理1.一般植物表达载体是成套使用的,一套中有两个,一个是带有可以供插入外源表达基因的MCS和筛选标签的融合蛋白(通常是GFP或Gus)的普通载体。
另一个载体就是双元载体(binary-vector)了。
通常我们是先将外源基因插入带有筛选标记的载体,然后将此载体上的35S promoter-expression gene-gfp这段全部切下,然后构建亚克隆,其过程就是将上述的片断插入双元载体的LB和RB之间,其插入方向是可以任意的。
然后将带有35S promoter-expression gene-gfp的双元载体转化农杆菌,在通过农杆菌转染植物,最后可以通过农杆菌特有的ti-DNA转染机制,将双元载体的LB和RB之间的片段融合进宿主的基因组上。
我以前用的是pCAMBIA3101+pUC-35S-GFP以及pZPZ211和pAA等2.双元表达载体系统主要包括两个部分3.一部分为辅助Ti质粒,这类Ti质粒由于缺失了T-DNA 区域,完全丧失了致瘤作用,主要是提供ir基因功能,激活处于反式位置上的T-DNA的转移。
枯草芽孢杆菌表达系统的原理

枯草芽孢杆菌表达系统的原理枯草芽孢杆菌表达系统是一种重要的重组蛋白表达系统,广泛地应用于生物技术研究和工业生产中。
本文将详细介绍枯草芽孢杆菌表达系统的原理。
一、枯草芽孢杆菌的特点及表达机制枯草芽孢杆菌是一种革兰氏阳性菌,常生长在土壤和泥土中。
其表达机制为在细胞内部产生大量的蛋白质,并通过生长期间的细胞泀水产生的孢子释放到外界。
枯草芽孢杆菌天然含有的一些基因表达产物可以抑制其他微生物的生长,所以被认为是一种潜在的生物农药。
二、枯草芽孢杆菌表达系统的结构组成枯草芽孢杆菌表达系统主要是由表达载体、诱导剂和宿主菌三部分组成。
1.表达载体枯草芽孢杆菌表达载体一般包括以下几个部分:(1)选择标记基因:该基因能够方便地筛选出已经转化成功的细胞。
(2)启动子和调控元件:用于调节目标基因的表达量。
(3)多克隆位点:利用该位点可以方便地克隆多个目标基因。
(4)信号肽:可将目标蛋白导向到特定的细胞部位或细胞外界面。
2.诱导剂枯草芽孢杆菌表达系统的诱导剂主要分为两类:化学诱导剂和温度诱导剂。
对于许多表达载体而言,利用化学诱导剂可以实现目标蛋白的高效表达,而利用温度诱导剂则可以实现目标蛋白的原生态表达。
3.宿主菌枯草芽孢杆菌作为表达宿主菌,其优点是生长速度快、能量来源可靠、产量高等。
此外,枯草芽孢杆菌具有良好的内源性分泌系统,可以使得目标蛋白得到有效的分泌和表达。
三、枯草芽孢杆菌表达系统原理的实现过程枯草芽孢杆菌表达系统主要的实现流程如下:1.构建表达载体根据需要表达的目标蛋白的类型和结构,进行载体的构建和改造。
2.将表达载体转化至宿主菌将经过改造的表达载体转化至宿主菌中,利用下合子实现转化效率的控制。
3.诱导表达目标蛋白根据诱导剂的类型和浓度,在不同的条件下引导宿主菌表达目标蛋白。
4.分离和纯化目标蛋白根据目标蛋白的性质和重量,利用不同的纯化技术将目标蛋白分离纯化出来。
四、枯草芽孢杆菌表达系统的应用情况枯草芽孢杆菌表达系统的应用不仅局限于基础生物学研究领域,同时也广泛应用于医学、环保、工业等诸多领域。
基因工程的表达载体——原核细胞表达载体(2)-PL和PR启动子表达载体系统

基因⼯程的表达载体——原核细胞表达载体(2)-PL和PR启动⼦表达载体系统PL和PR启动⼦表达载体系统P L和P R启动⼦是⼤肠杆菌λ噬菌体中控制早期转录的启动⼦, P L和P R表达载体系统是以该启动⼦构建的⾼效表达载体。
在野⽣型λ噬菌体中,P L和P R启动⼦的转录与否决定λ噬菌体进⼊裂解循环或溶原循环。
λ噬菌体P E启动⼦控制的CI基因表达产物是P L和P R启动⼦转录的阻遏物,⽽CI阻遏物的表达和在细胞中的浓度,取决于⼀系列宿主与噬菌体因⼦之间的复杂平衡关系。
由于通过细胞因⼦调节CI在细胞中含量的途径很难操作,因⽽在构建表达系统时,选⽤温度敏感突变体CIts857的基因产物来调控P L和P R启动⼦的转录, 在较低温度(30)下阻遏物以活性形式存在,在较⾼温度(42)下阻遏作⽤失活。
因此,改变⼯程菌的培养温度即可控制⽬的基因的表达,这⽐⽤诱导剂诱导表达的系统要节省操作步骤和成本,在⼤规模基因表达中优点尤其明显。
由于普通的⼤肠杆菌中不含CI基因表达产物,因此必须对表达载体或⼤肠杆菌进⾏遗传改造,将CIts857基因组装在表达载体上或整合在宿主染⾊体上。
本⾝带有CIts857基因的表达载体,能⾃⾝编码CIts蛋⽩,对宿主的选择范围较宽;本⾝不带CIts857基因的表达载体,选择宿主菌时,要求宿主是有缺陷的原噬菌体溶源化的菌株(如M5219)。
前⼀类载体表达效率往往更⾼。
图⽰为pBV220表达载体的结构⽰意图。
⾎管⽣长素(ANG)基因插⼊pB220载体多克隆位点中,转化到⼤肠杆菌JM103内,便能通过温度的变换控制CI阻遏蛋⽩的活性,继⽽调节P L和P R启动⼦的活性,使ANG基因连同其5′端上游所带的SD 序列转录成mRNA (SD序列与起始密码ATG的间距为6bp),mRNA作为模板使核糖体⾼效翻译出ANG产物,并终⽌于rrnB位点。
EEF1A2基因慢病毒表达载体的构建及慢病毒表达系统的建立

D N A s e q u e n c e a n a l y s i s , t h e p G L V 5 / E E F 1 A 2 p l a s mi d a n d t h r e e p a c k a g i n g p l a s mi d s( p V S V — G, p G a g / P o l , p R e v )w e r e e o t r a n s f e e t e d
P u e 上 。构建的重组质粒 p r G L V 5 / E E F 1 A 2经 P C R、 酶切及测序鉴定正确后 , 利 用慢病毒表达 系统 ( p G L V 5 L e n t i v i r a l E x p r e s s i o n S y s t e ms ) , 将重组质粒与 包装 系统质粒 ( p V S V — G, p G a g / P o l , p R e v )4质粒共 转染 2 9 3 T细胞 , 收 集培养上 清并感染人胰腺癌 S W1 9 9 0细胞 , 经嘌呤 霉素 筛选 出稳 定过表 达细胞株 E E F 1 A 2 / S w1 9 9 0 。R e a 1 . t i m e P C R和 We s t .
第3 0卷第 2期 2 0 1 3年 4月
双质粒表达系统的原理

双质粒表达系统的原理双质粒表达系统是一种常用的基因表达技术,在生物医学研究和产业生产中被广泛应用。
其原理是利用两个不同的质粒,一个是表达载体质粒,另一个是辅助质粒,同时转染到细胞中,利用宿主细胞的核质双原生质体系统实现两个质粒的互作。
表达载体质粒是双质粒系统中的主要质粒,用于携带目标基因并将其转移到宿主细胞中。
它通常包含一个起始子、一个终止子和一个启动子,以及必要的调节序列和启动子,用于调节目标基因的表达和转录。
载体质粒的起始子和终止子分别能将目标基因的转录和翻译过程控制在一个完整的基因中,从而确保表达的准确性和完整性。
辅助质粒是双质粒系统中的辅助质粒,用于增加表达载体质粒在宿主细胞内存在的数量和增强表达载体质粒的表达效率。
这通常是通过添加可受规范化的辅助质粒实现的,在转染过程中,它能够及时增加表达载体质粒和持续表达的数量和质量。
双质粒表达系统利用细胞的双原生质体,将两个质粒同时转染到细胞中。
一旦两个质粒被转染到细胞中,它们就能够相互作用,并共同发挥作用。
此时,表达载体质粒将目标基因传送到宿主细胞中,并被转录和翻译成蛋白质,辅助质粒则能够增强表达载体质粒的表达效率,并保证其在细胞中的表达水平。
双质粒表达系统的优点在于具有非常高的表达效率和灵活的表达调节能力。
通过合理地选择表达载体质粒和辅助质粒,可以实现稳定和高水平的目标基因表达,并控制其在不同环境和时期的表达状况,从而满足不同研究和生产的需要。
此外,双质粒表达系统也具有较为简单和成熟的操作方法和常规流程,容易为技术人员所掌握。
总而言之,双质粒表达系统是一种实用而灵活的基因表达技术,已被广泛应用于生物医学研究和产业生产中,为研究和开发新药物、基因治疗和工业生产提供了有效的技术手段。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
载体与表达系统0001--pIRES --BD Co--真核表达--yshu35070002--pECFP-C1--BD Co--真核表达--yshu35070003--pShuttle--/--/--victoh0004--pSBR322--/--/--chujun_hust0005--pcDNA3.1(+)/CAT--invitrogen--真核表达--wangjun2002274 0006--pQEx--Qiagen--原核表达--wangjun20022740007--pIVEX2.3--Roche--体外转录翻译--wangjun20022740008--pIRES-EGFP--/--/--luoqingli20030009--pET-28a(+)--Novagen--原核表达--wangjun2002274 0010--pSUPER Vector--oligoengine--siRNA--zyh9611710011--pET-32a(+)--novagen--原核表达--Crazyvirus0012--pBK-CMV--/--原核表达、真核表达--zrzhong65190013--pcDNA3.1/Zeo (+)--invitrogen--原核表达--Crazyvirus 0014--pcDNA3--invitrogen--真核表达--kras0015--pfastbac1--invitrogene--昆虫表达--cox2wj0016--pEGFP-C3--clontech--真核表达--smilely0017--pSecTag2--invitrogen--真核表达--kenmed0018--PYX212--/--真核表达--Gmail0019--pET20b--Novagen--原核表达--Gmail0020--pEGFP-1--BD BIO--转录调控--wyh0021--pEGFP/U6 --/--siRNA--songbinn0022--pThioHisA--invitrogen--原核表达--xuezhishui0023--pRSET--invitrogen--原核表达--xuezhishui0024--pcDNA3.1-Myc-His-A---invitrogen--真核表达--whz_dxy 0025--pSUPER.neo--/--siRNA--令令冲0026--pTYB1--IBM--原核表达--ayan0027--pTWIN1--IBM--原核表达--ayan0028--pLPC-hTERT--Clontech--原、真核表达--fishisfish 0029--pGEM-T--Promega--T-A克隆--小迷糊0030--pEGFP-N1--Clontech--真核表达--小迷糊0031--pSilencer1.0-siRNA--Ambion--siRNA--med_light0032--pSilencer2.0-U6siRNA--Ambion--siRNA--whz_dxy 0033--pSilencer 3.1-H1 neo Vector--Ambion--siRNA--mlluo 0034--pTrchisA--invitrogen--原核表达--erik0035--pOK12--构建--T-A克隆--intron0036--pET22b(+)--Novagene-原核表达--令令冲0037--pQE9--Qiagen--原核表达--jpsgf0038--pCANTAB5E--Phamcia--噬菌体抗库--yanBaggio0039--pET-24a--Novagene--原核表达--yanBaggio0040--pGBKT7 和pGADT7--CLOTE--酵母表达--小迷糊0041--PTXB1--BIOLABS--原核表达--小迷糊0042--pET-43.1 Ek/LIC--Novagene--原核表达--mcli0043--PIRES--BD BIOSCIENCES--穿梭载体---joeys0080044--pBAD/Thio-TOPO--invitrogen--原核表达--mcli0045--pESC-HIS--Stratagene--酵母表达--zhangqiongyu82 0046--pcDNA3.1/V5-His-TOPO--invitrogen--真核表达--mcli 0047--pMSCVneo--Clontech--真核表达--intron0048--pCDNA6 /V5 HisB--invitrogen--真核表达--linct97 0049--pcDNA3.1(+)--invitrogen--真核表达--kinase0050--pSecTag2--invitrogen--真核表达--sssusu0051--pIRESneo--Clontech--真核表达--sssusu0052--pBudCE4.1--invitrogen--真核表达--barbie0053--pGEX-4T-3--amershambio--原核表达--linct970054--PESC-TRP--startgene--真核表达--zhangqiongyu82 0055--pPICZ--invitrogen--毕赤酵母表达--yshu35070056--pTrc99a--novogen--原核表达--Gmail0057--pGEX-6p-1--amershambio--原核表达--erik0058--pSFV1--invitrogen--真核表达--syfnet0059--pSCA1--赠送--真核表达--syfnet0060--pUC18--/--克隆--syfnet0061--pshuttleCMV--KRACKELER--穿梭质粒--renke3333 0062--pdc315--microbix--shuttle--renke33330063--pBluescript SK(+)--tianwei--原核表达--fenqinzhuhe 0064--pPIC3.5K--Invitrogen--真核表达--mcli0065--pFB-hrGFP--Stratagene--真核表达--zhangqiongyu820066--pSG5--Stratagene--真核表达--zhangqiongyu820067--pCMV-Tag4B--Stratagene--真核表达--小迷糊0068--pET11a--invitrogen--原核表达--pinghw0069--pET30a--invitrogen--原核表达--seasider0070--pCI-NEO--PREMOGA--真核表达--syfnet0071--phRL-null--PREMOGA--真核表达--kenmed0072--pBC1--invitrogen--真核表达--竹影烟雨0073--pGEMEX-1--Promega--体外转录--palmyard0074--pGEM-T Easy--Promega--克隆--laohu2003810075--pGEX-5x-1--Pharmacia--原核表达--laohu2003810076--pshuttle--qbiogene--穿梭质粒--renke33330077--pet9c--promega--原核表达--renke33330078--trans-vector--qbiogene--穿梭质粒--renke33330079--PQBI PGK--QBIOGENE--真核表达--renke33330080--PQBI T7 GFP--QBIOGENE--真核表达--renke33330081--pcDNA5/FRT/CAT—INVITROGEN--真核表达--renke3333 0082--pBABE Hygro—Geron--真核表达--Jeffrey880083--pBABE puro--Geron--Jeffrey880084--pMSCV puro—Clontech—RNAi--tuterhu0085--质粒名--PEGFPN3—Clontech--真核GFP--renke3333 0086--质粒名称—PSHTULLE—Clontech--穿梭---renke3333 0087--pkk223-3--哈佛大学Brosius等构建--原核表达--kingtsh0088--pcdna3-c-myc—invitroge--真核表达--giyon0089—pSG-cmv--新基因--stevenvin0090--PGEX-3x--BD Co--融合型蛋白原核表达载体--kingtsh0091--PEGFPc2—Clontech--真核GFP0092--PEGFP-N2—Clontech--真核GFP0093—PMECA--不详--克隆载体0094--PGEX 4T-2--不详--克隆载体0095--si STRIKE™ U6—PROMEGA--RNAi载体0096--pSilencer™ neo—Ambion--RNAi载体0097--pSilencer™ hygro—Ambion--RNAi载体0098--pSilencer™ puro—Ambion--RNAi载体0099--pGE-1—Stratagene--RNAi载体0100--pSUPER.p53—OligoEngine--RNAi载体0101--palter-ex1--promega0102--pACYCDuet-1--NOV AGEN0103--pEX lox(+) Vector—NOV AGEN--原核表达0104--质粒名称:pBACgus-8 Transfer Plasmid—NOV AGEN--CHUANSUO0105--pSCREEN™-1b(+) Vector Map—novagen--筛选0106--PGEX-2T--BD Co--pDsRed2--Clontech0107--pbgal-Basic—Clontech--mammalian reporter vector 0108—pBI—Clontech--express two genes of interest from a bidirectionaltet-responsive promoter0109--质粒名称:pbgal-Control—Clontech--mammalian reporter vector 0110-- pGEX-5X-1--原核表达0111--pBI-EGFP—Clontech--pBI-EGFP-- coexpress0112--pBI-G—Clontech--pBI-G--express b-galactosidase0113--pBI-GL—Clontech--pBI-GL --express luciferase and b-galactosidase0114--pCMS-EGFP—Clontech--mammalian expression vector0115--pd2EYFP-1—Clontech--启动子测定0116--质粒名称--pd2EYFP-N1—Clontech--融合表达0117--pd4EGFP-Bid—Clontech--融合表达Bid0118--pDNR-CMV—Clontech--pDNR-CMV0119--pDNR-EGFP Vector—Clontech0120--pDNR-LacZ –Clontech0121--pECFP-Endo—Clontech--真核表达-0122--pECFP-ER—Clontech--真核表达-0123--pEGFP-Actin—Clontech--真核表达-0124--pGAD GH--Clontech--酵母表达0125--pGADT7-Rec –Clontech--酵母表达0126--pGADT7-RecAB—Clontech--酵母表达0127--pGADT7-Rec2—Clontech--酵母表达0128--pGBKT7—Clontech--酵母表达0129--pHAT 10/11/12—Clontech0130--pHAT20—Clontech0131—pHygEGFP—Clontech0132—pLacZi—Clontech0133—pM—Clontech--pM is used to generate a fusion of the GAL4 DNA-BD0134--pPKCa-EGFP—Clontech0135--pPKCb-EGFP—Clontec0136--pSIREN-DNR Vector—Clontech--RNAi0137--pSIREN-DNR-DsRed-Express Vector—Clontech--RNAi0138--pSIREN-RetroQ—Clontech--RNAi0139--pIRES-EYFP—Clontech--RNAi0140--pSRE-Luc—Clontech--RNAi0141--pTK-neo—novagen--原核表达0142--pZsGreen Vector—Clontech--pZsGreen is a pUC19-derived prokaryotic expression vector0143--pTandem-1—novagen--原核表达0144--pZsGreen1-C1Vector—Clontech----真核表达0145--质粒名称:M13mp18—novagen--原核表达0146--pZsGreen1-DR Vector—Clontech--真核表达0147--PZsGreen1-N1 Vector—Clontech --真核表达0148--T7Select415-1b—novagen----真核表达0149--pZsYellow Vector—Clontech --真核表达0150—pTimer—Clontech --真核表达0151--pTA-Luc—Clontech --真核表达0152--pTAL-Luc—Clontech --真核表达0153--pTA-SEAP—Clontech --真核表达0154--pTAL-SEAP—Clontech --真核表达0155--pTet-On—Clontech --真核表达0156--pTet-Off—Clontech --真核表达0157--pTet-ATF—Clontech --真核表达0158--pTet-CREB—Clontech --真核表达0159--pTet-ELK—Clontech--真核表达0160--PGEX-1λT--BD Co--融合型蛋白表达载体原核0161--pBACsurf-1—novagen--原核表达0162--pCITE-2c(+)—novagen--原核表达0163--pFX-E24.2-15--不详--该载体可用于构建植物突变体库0164--pACYCDuet-1—Novagene--表达载体0165--pETDuet-1—Novagen--表达载体0166--p IRES2-EGFP—invitrogen--真核表达0167--PGL3Basic—romega--Luciferase0168--pAdTrack-CMV;pAdEasy-不详--基因治疗0169--phrGFP-1—Stratagene--真核表达0170--pAdEasy-1--Stratagene--腺病毒表达载体0171--pShuttle-CMV vector–Stratagene--腺病毒载体0172--pIRES-hrGFP-2a—Stratagene--真核表达载体0173—pSos—Stratagene--双杂交0174--pSos Col 1--Stratagene --双杂交0175-- pSos MAFB--Stratagene--双杂交0176--pBD_GAL4_Cam—Stratagene--酵母双杂交0177--SuperCOSI--stragtagene--可以克隆更大的片段0178--pMD18-T Vector—TaKaRa--T/A cloning0179--pCAMBIA 1301—CAMBIA--Agrobacterium-mediated and direct transformation0180--pCAMBIA 1200 –CAMBIA--真核表达0181--pCAMBIA 1300--CAMBIA--Agrobacterium-mediated and direct transformation0182--pCAMBIA 1305--CAMBIA--Agrobacterium-mediated and direct transformation0183-pMCG161 --chromdb--binary vector for producing dominant negative RNAi mutants0184--pFGC1008--chromdb--binary vector for producing dominant negative RNAi mutants0185--pLEGFP-C1--逆转录病毒表达载体0186--pd2EGFP-N1--BD--增强绿色荧光蛋白真核表达载体0187--p3XFLAG-CMV-10—SIGMA--真核表达0188--p3XFLAG-CMV-14--SIGMA--真核表达0189--pET-32a--novagen--原核表达0189--pET-32a --novagen--—原核表达0190--pET-39b--novagen--expression of DsbA fusion proteins.0192--pPIC9K—invitrogen--酵母中表达筛选。
