临床试验用药入库申请单
药物临床试验申请表 (2)
试验药物是否免费提供:□是□否
是否进口注册:□否□是,进口许可证批号:
申办单位:
电话:
传真:
CRO公司:
电话:
传真:
CRO联系人:
电话:
邮箱:
组长单位:
组长单位主要研究者:
整个试验计划完成例数:
本机构计划完成例数:
本机构计划试验开始时间:年月日
本机构计划试验完成时间:年月日
主要研究者意见:
签名: 日期: 年 月 日
专业负责人意见:
签名: 日期: 年 月 日
机构办公室审查意见:
签名: 日期: 年 月 日
机构负责人审批意见:
签名: 日期: 年 月 日
药物临床试验申请表
申请号:()申请第()号
试验名称:
CFDA批件号:
方案编号:
试验设计:□对照□非对照/□单盲□双盲□开放/□随机□非随机
□平行□交叉/□优效性□非劣性□等效性/□其它
药物类别:□化药类□中药、天然药物类□治疗用生物制品类
□预ቤተ መጻሕፍቲ ባይዱ用生物制品类□其他
试验分期:□Ⅰ期□Ⅱ期□Ⅲ期□Ⅳ期□上市后再评价 □生物等效性
药物临床试验申请表

药物临床试验申请表填表日期:年月日编号:(由机构填写)有时候想拼命的攀登,但总是力不从心。
可是,每个人境况是不同的,不要拿别人的标准,来塑造自己的人生。
太多的失望,太多的落空,纯属生活的常态。
岁月告诉我:挫败,总会袭人,并且,让你承受,但也,负责让你成长。
人生漫长,却又苦短,幽长的路途充满险阻,谁不曾迷失,谁不曾茫然,谁不曾煎熬?多少美好,毁在了一意孤行的偏执。
好也罢,坏也罢,人生的路,必须自己走过,才能感觉脚上的泡和踏过的坑。
因为懂得,知分寸;因为珍惜,懂进退。
最重要的是,与世界言和,不再为难自己和别人。
《菜根谭》中说:花看半开,酒饮微醉。
就是说,做事不必完美,享乐不可享尽,这是一种含苞待放的人生状态。
即使是最美的月亮,也会有盈亏的自然之道。
否则便是过犹不及,弄巧成拙。
心灵松绑了,活着才自由。
半生已过,走走停停,看透了生活,选择了顺流的方式,行走。
流水今日,明月前身。
感谢每一粒种子,每一缕清风,每一个阳光的日子,于时光的碎屑中,静品一盏流年的香茗。
撕开浮云的遮掩,其实,每个人心中都有各自的山水,都有一段难捱的时光,好在,总有一天,你的淡然低调,你的暗自努力,你的理性豁达,终将点燃你的整个世界,让故事的结局,美好而温柔。
苏轼在《水调歌头》里写道:人有悲欢离合,月有阴晴圆缺,此事古难全。
是的,层次越高的人,越懂得,人生本就不是尽善尽美,也正因为有了缺憾,才显得是那么的多姿多彩。
心情平和,与是非渐行渐远,再多的兵荒马乱,也抵不过时光的洪流,唯有日常才惊天动地。
夫切菜,妻拌菜,菜菜交缠,洒在热腾腾的面条上,剥头蒜就着,哧啦哧啦的,心里爽透了。
这世间最美的,不就是这样的烟火么。
人生,是一个苏醒的过程。
一首经典,低徊吟唱,年少不知歌者意,再听已是曲中人。
用药申请书

尊敬的[医院/药品采购部门]领导:您好!我是[科室名称]的[医生/护士/药剂师]姓名,特此提交用药申请书,申请采购以下药品用于临床治疗。
一、申请药品信息1. 药品名称:[药品名称]2. 剂型:[剂型]3. 规格:[规格]4. 生产厂家:[生产厂家]5. 采购数量:[采购数量]6. 采购金额:[采购金额]二、申请理由1. 适应症:[药品适应症]本药品适用于[疾病名称]的治疗,根据患者的病情评估,该药品可以有效缓解患者的症状,提高患者的生活质量。
2. 药效特点:该药品具有以下药效特点:(1)[药效特点1](2)[药效特点2](3)[药效特点3]这些特点使得该药品在同类药品中具有明显的优势。
3. 药品供应情况:目前,我院[药品名称]库存紧张,无法满足临床用药需求。
为确保患者得到及时有效的治疗,特申请采购。
4. 经济效益:该药品在我院同类药品中价格合理,采购后可降低患者的医疗费用,提高医院的经济效益。
三、采购流程1. 请贵部门按照《药品采购管理办法》等相关规定,对本次申请进行审批。
2. 经审批通过后,请将药品采购至我院药剂科。
3. 药剂科将严格按照药品管理相关规定,对采购的药品进行验收、储存、发放等工作。
四、保障措施1. 我院将严格按照药品管理相关规定,对采购的药品进行全程监管,确保药品质量。
2. 药剂科将加强药品采购、验收、储存、发放等环节的管理,确保药品安全。
3. 医生在开具处方时,将严格按照药品说明书及临床指南进行,确保患者用药安全。
特此申请,恳请领导审批。
申请人:[科室名称] [医生/护士/药剂师]姓名联系电话:[联系电话]申请日期:[年月日]附件:1. 药品说明书2. 药品采购预算表3. 药品供应情况说明敬请审批!。
药物临床试验申请表

深圳市南山区人民医院药物临床试验机构
药物临床试验申请表
申请日期机构受理号
临床试验名称
新药临床研究批准文号注册证号/专利证号
试验药物中英文名称
注册分类□国产□进口
□化学类□中药类
□治疗用生物制品类□预防用生物制品类剂型、剂量、规格
研制单位
申办者/CRO
临床研究分类□Ⅰ期□Ⅱ期□Ⅲ期□Ⅳ期□临床验证
□生物等效性
试验设计总例数本机构拟承担例数
本机构预期时间
组长单位负责人
伦理委员会审批意见□有,中心伦理名称
□无,申请本院伦理委员会审批
国际多中心□是□否
申办单位联系人联系方式
指定监查员姓名联系方式
本机构申请专业主要研究者
主要研究者E-mail 联系电话
主要研究者签名:日期:
机构受理人签名:日期:。
药品临床试验申请书

4.本申請書如由藥商申請時,應附藥商執照影本;如由醫院申請時,應加蓋院戳。
此致
行政院衛生署
審查意見:
備註:一式三聯第一聯:送行政院衛生署第二聯:送憑以向海關提貨
第三聯:送藥商(醫院)收執聯
1.本臨床試驗用途□藥品查驗登記□學術研究□其他( )
2.本署核准臨床試驗之進行,並不代表本署對該藥品之療效與安全之認可,有關試驗責任概由醫院及提供樣品之廠商負責。
3.本試驗應確實依照臨床試驗計劃書執行,如有更動應事先報.本署同意,不得擅自變更試驗內容、地點。
4.本申請書如由藥商申請時,應附藥商執照影本;如由醫院申請時,應加蓋院戳。
4.本申請書如由藥商申請時,應附藥商執照影本;如由醫院申請時,應加蓋院戳。
此致
行政院衛生署
審查意見:
備註:一式三聯第一聯:送行政院衛生署第二聯:送憑以向海關提貨
第三聯:送藥商(醫院)收執聯
藥品臨床試申請書
第二聯:送憑以向海關提貨年月日
藥品名
申請者:
地址:
說明:
藥品臨床試驗申請書
第一聯:送行政院衛生署年月日
藥品名稱、劑型
主成分、含量
包裝、數量
製造廠、國別
申請者:
地址:
說明:
1.本臨床試驗用途□藥品查驗登記□學術研究□其他( )
2.本署核准臨床試驗之進行,並不代表本署對該藥品之療效與安全之認可,有關試驗責任概由醫院及提供樣品之廠商負責。
3.本試驗應確實依照臨床試驗計劃書執行,如有更動應事先報.本署同意,不得擅自變更試驗內容、地點。
此致
行政院衛生署
審查意見:
药物临床试验申请表【模板】

□中心化检测□标本出口
数据处理单位
机构意见(本意见为拟参与意见,最终参与以签署研究协议为准)
专业负责人及主要研究者意见
□拟同意
□不同意,原因
签名:日期:
机构办公室意见
□拟同意
□不同意,原因
签名:日期:
承接情况
未承接□承接□通过伦理审查,签署研究协议后请填写下方内容
研究项目本中心编号YYSYDT _ _ _ _ _ _ _
附件1:药物临床试验申请表
机构受理号:填表日期:年月日
试验项目名称
药物类别
□化学药品
□中药、天然药物
□治疗用生物制品
□预防用生物制品
CFDA批件号
药品注册分类
药物名称及剂型
试验方案编号
试验设计总例数
本机构计划承担例数
是否进口药
□是□否
是否国际多中心临床试验
□是□否
组长单位
组长单位主要研究者
本机构参与专业
本机构主要研究者(PI)
申办者
CRO
联系人
联系方式(电话/邮箱)
临床试验适应症
试验用药品
规格及用法用量
试验设计
□对照□单盲□随机□平行□开放□非劣性
□非对照□双盲□非随机□交叉□优效性□等效性□其它:__________
试验类型
□I期□II期III期□IV期□生物等效性试验□其它:__________
研究协议签署时间
院内启动会时间
药物临床试验申请表【模板】
数据统计单位:
数据统计软件:
组长单位:
组长单位主要研究者:
整个试验计划完成例数:
本机构计划完成例数:
本机构计划试验开始时间:年 月日
本机构计划试验完成时间:年 月 日
试验用药物数量:
是否赠送:□是 □ 否
专业组:
主要研究者签名:
QA签名:
科主任签名:
申办者监查员:
监查员电话:
机构负责人签名:
主管院长签名:
药物临床试验申请表
填表日期:年月日编号:(由机构填写)
试验名称:
CFDA批准文号:
方案编号:
是否涉及人类遗传资源采集、收集、研究、开发、买卖、出口、出境等□是□否
试验设计:□对照 □非对照 / □单盲 □双盲 □开放 / □随机 □非随机
□平行 □交叉 / □优效性 □非劣性 □等效性 / □其它
中文药名:英文药名:商名:药物类别:□化药类□中药、天然药物类□治疗用生物制品类
□预防用生物制品类□其他
试验分期:□Ⅰ期 □Ⅱ期 □Ⅲ期 □Ⅳ期 □生物等效性
药物剂型:
药物规格:
药物适应症:
药物批号:
有效期:
生产日期:
是否进口注册:□否 □是,进口许可证批号:
是否国际多中心:
□是□否
申办者:
CRO:
数据处理人员:□委托专业医学统计人员统计□由经过统计培训的研究者统计
药物(器械、诊断试剂)临床试验申请表(申办者用)
联系人
通信地址
邮政编码ห้องสมุดไป่ตู้
电话
传真
研究时间
年月日至年月日
CFDA批件/
备案证明
□有□无□不适用
批件号:
组长单位
现阶段项目的进度
(注:多中心临床试验分中心参与情况:如多少家中心已签合同)
本研究项目的优势
试验药物储存条件
机构办公室意见:
办公室主任(签字):
年月日
药物(器械、诊断试剂)临床试验申请表(申办者用)
尊敬的办公室主任:
现有一项临床研究拟在贵院进行,题目是:
现将有关资料送上,请予以审批。
申请人:申请日期:
试验用药物
(器械、诊断
试剂)名称
中文名称:
剂型
英文名称:
类别
□中药□化学药□生物制品□器械□其他
第类
临床研究分期
□I期□II期□III期□IV期□生物等效性□临床验证□国际多中心□其它
药物临床试验申请表
(签字) 年 月日
临床试验机构 办公室意见
(签字) 年月日
临床试验机构 负责人意见
(签字) 年月日
申请书 递交日期
接收人 签字
注:盖章单位为与临床试验机构签署合同单位(申办单位或合同研究组织)
北京中医药大学东方医院
YLJD-R(SOP)-05-202006
北京中医药大学东方医院药物临床试验申请表
项目名称
批件号或备案号 申办单位/合同
研究组织
联系人
注册分类 联系电话
所属专业 (盖章)
联系传真
联系地址 任务性质
计划合作 研究单位
相关技术 资料清单 (盖章确认)
□牵头□参加
计划研究 病例总数
邮政编码 计划研究 开始时间
1
7
2
8
3
9
4
10
5
11
6
12
□ 国家药品监督管理局临床研究批件/备案通知书
□ 申办单位委托函Biblioteka □ 委托研究单位法人营业执照
□生产许可证
□ 临床试验受试者保险(中文版)
□ 药学研究资料 □ 药理毒理研究资料 □ 临床试验资料
□ 试验方案
□ 知情同意书
招募广告
□ 病例报告表
□ 研究者手册
□ 其他:
科室主任/主要 研究者
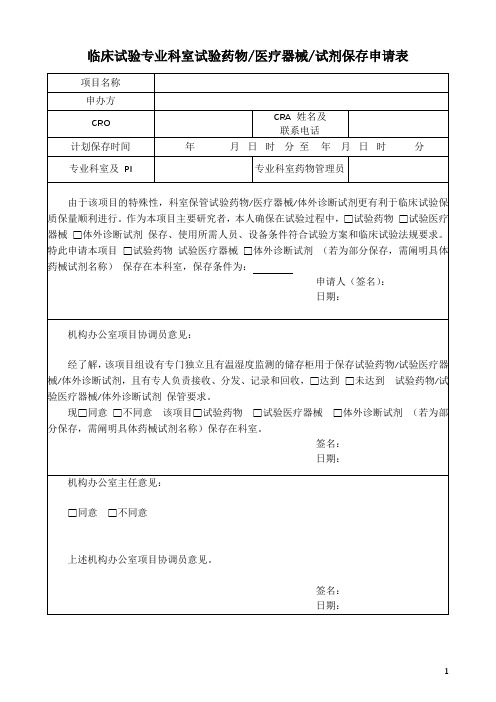
临床试验专业科室试验药物、医疗器械、试剂保存申请表
日期:
机构办公室主任意见:
□同意□不同意
上述机构办公室项目协调员意见。
签名:
日期:
临床试验专业科室试验药物/医疗器械/试剂保存申请表
项目名称
申办方
CRO
CRA姓名及
联系电话
计划保存时间
年
月
日
时
分至
年
月
日
时
分
专业科室及PI
专业科室药物管理员
由于该项目的特殊性,科室保管试验药物/医疗器械/体外诊断试剂更有利于临床试验保质保量顺利进行。作为本项目主要研究者,本人确保在试验过程中,□试验药物□试验医疗器械□体外诊断试剂保存、使用所需人员、设备条件符合试验方案和临床试验法规要求。特此申请本项目□试验药物试验医疗器械□体外诊断试剂(若为部分保存,需阐明具体药械试剂名称)保存在本科室,保存条件为:
申请人(签名):
日期:
机存柜用于保存试验药物/试验医疗器械/体外诊断试剂,且有专人负责接收、分发、记录和回收,□达到□未达到试验药物/试验医疗器械/体外诊断试剂保管要求。
现□同意□不同意该项目□试验药物□试验医疗器械□体外诊断试剂(若为部分保存,需阐明具体药械试剂名称)保存在科室。
药物临床试验申请表

()否
⑤方案中的疗效指标、安全性指标检查是否有条件完成;
()是
()否
⑥方案中合并用药的规定能否遵守;
Hale Waihona Puke ()是()否⑦是否能在方案要求的时间内完成临床研究;
()是
()否
⑧是否有同病种的在研项目(包括科研课题)。
()是
()否
⑨其它:
综合意见:同意()不同意()
签名:
年
月
日
机构负责人意见:同意()不同意()
药物临床试验申请表
机构受理号:填表日期:年月日
项目名称
中文药名:
英文药名:
商品名:
注册分类
临床分期
试验预计起止时间
年月~年月
药理作用
受试病种
用法用量
剂型、剂量、规格
申办者
CRO(如适用)
进药方式
□免费□其他(请注明)
CFDA临床试验批件号
批准文号/注册证号
临床试验目的
组长单位
主要研究者
参加单位
主要研究者
主要研究者
主要研究者
主要研究者
主要研究者
主要研究者
主要研究者
申办方/CRO项目联系人
联系电话
专科负责人意见:
请专业组负责人认真审核以下内容:
①方案是否具有科学性;
()是
()否
②方案是否符合伦理学要求;
()是
()否
③是否有足够的病例符合方案的入选标准;
()是
()否
④是否能保证专业组内有足够的研究者和研究时间;
签名:(公章)
年
月
日
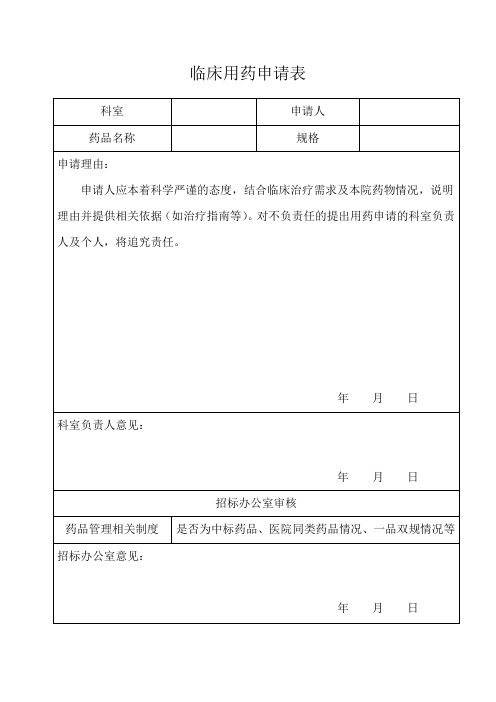
临床用药申请表
临床用药申请表
科室
申请人着科学严谨的态度,结合临床治疗需求及本院药物情况,说明理由并提供相关依据(如治疗指南等)。对不负责任的提出用药申请的科室负责人及个人,将追究责任。
年月日
科室负责人意见:
年月日
招标办公室审核
药品管理相关制度
是否为中标药品、医院同类药品情况、一品双规情况等
招标办公室意见:
年月日
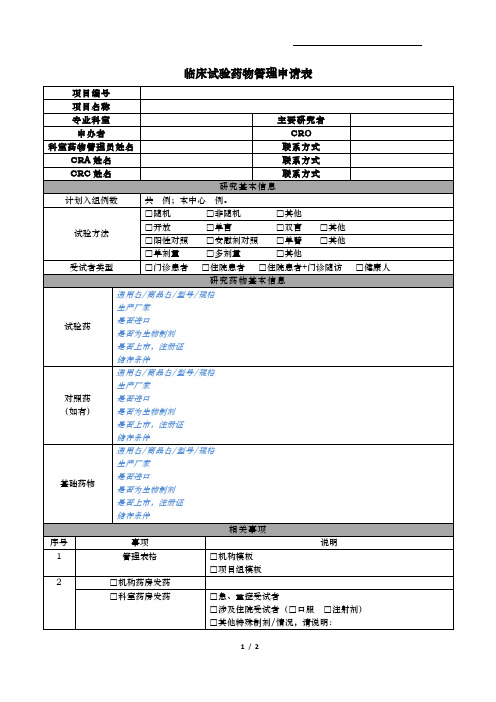
临床试验药物管理申请表
□门诊患者 □住院患者 □住院患者+门诊随访 □健康人
研究药物基本信息
试验药
通用名/商品名/型号/规格
生产厂件
对照药
(如有)
通用名/商品名/型号/规格
生产厂家
是否进口
是否为生物制剂
是否上市,注册证
储存条件
基础药物
通用名/商品名/型号/规格
生产厂家
□温湿度计
□温湿度记录仪
□校准文件
6
药物是否有唯一编码
□是□否
7
药物发放规则/随机方法
提供相关SOP作为附件
□无规则
□按药物编码大小
□按IWRS系统
□其他
8
给药计划
简述访视期、给药剂量等
9
用法用量注意事项
简述
10
是否需PIVAS调配
□是□否
11
是否回收
□是,
回收方:□科室 □机构药房
回收内容:□包装 □剩余药物 □其他:
临床试验药物管理申请表
项目编号
项目名称
专业科室
主要研究者
申办者
CRO
科室药物管理员姓名
联系方式
CRA姓名
联系方式
CRC姓名
联系方式
研究基本信息
计划入组例数
共 例;本中心 例。
试验方法
□随机 □非随机 □其他
□开放 □单盲 □双盲 □其他
□阳性对照 □安慰剂对照 □单臂 □其他
□单剂量 □多剂量 □其他
是否进口
是否为生物制剂
是否上市,注册证
储存条件
相关事项
序号
事项
说明
1
管理表格
□机构模板
