临床评估流程图-
临床评估流程图

;
/或安全性;
/与预期
• 文献检索&/或
• 临床经验&/或
• 临床调查
;
Yes
产生临床报告
注:蓝字为MEDDEV.2.7.1 Rev.3指南中Annex F部分;黑字部分为MEDDEV.2.7.1 Rev.3指南中非Annex F部分;红字部分为93/42/EEC,Annex部分
•·不
F, 4.1, 4.2)
以下文件化:
技术文档中应包括临床评估报告和完整的临床数据(MEDDEV.2.7.1 Rev.3/Annex F, 1.2);
制造商文件化临床评估的目的和范围,并规定所符合的临床基本要求<例如:临床功能、副作用、安全、风
险和受益/与预期用途有关的风险比、目标群体和指示>;(MEDDEV.2.7.1 Rev.3/Annex F, 1.3; 93/42/EEC,
Annex X, 1.1)
临床评估的实施阶段和程序(特别是第5~9章节),对于偏差给出了充分的理由;(MEDDEV.2.7.1
Rev.3/Annex F, 1.4);
临床评估报告参考格式(MEDDEV.2.7.1 Rev.3/Annex E)
93/42/EEC,Annex部分
7.1 Rev.3/6.2)
中的重大更新。
临床路径实施流程图
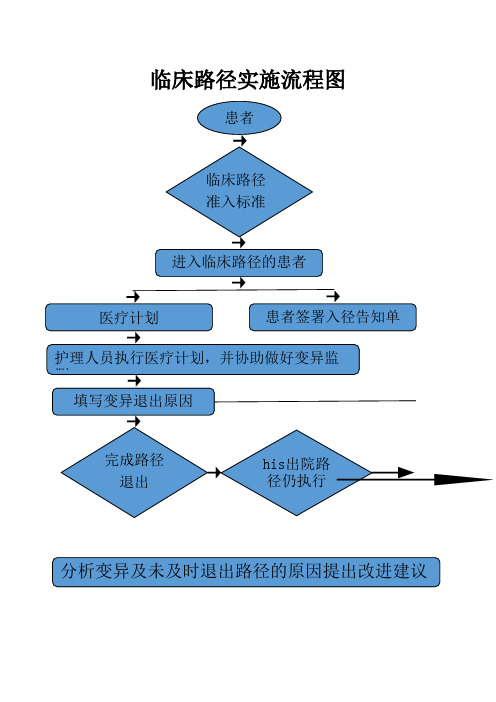
临床路径实施流程图临床路径实施流程一、实施流程1、经治医师完成患者的检诊工作,与上级医师对住院患者进行临床路径的准入评估。
2、符合准入标准的,按照临床路径确定的诊疗流程实施诊疗,根据医师版临床路径表开具诊疗项目,向患者介绍住院期间为其提供诊疗服务的计划,并将评估结果和实施方案通知相关护理组;3、相关护理组在为患者及家属作入院介绍时,向他们详细介绍其住院期间的诊疗计划以及需要给予配合的内容;4、经治医师根据当天诊疗服务完成情况及病情的变化,对当日的变异情况进行分析、处理,并做好记录;5、医师版临床路径中的服务项目完成后,执行(负责)人应在相应的签名栏签名。
◆进入临床路径的患者应满足以下条件:诊断明确、没有严重的合并症、能够按临床路径设计流程和预计时间完成诊疗项目的患者。
◆出现以下情况时,患者应当退出临床路径:(1)在实施临床路径的过程中,患者出现了严重的并发症,需要转入其它科室实施治疗的;(2)在实施临床路径的过程中,患者要求出院、转院或改变治疗方式而需退出临床路径的;(3)发现患者因诊断有误而进入临床路径的;(4)患者出现严重的医疗相关感染等情况不适应继续完成临床路径的.◆设立紧急情况警告值管理制度:警告值是指患者在临床路径治疗过程中出现严重异常情况,处于危险边缘,应迅速给予患者有效干预措施和治疗。
二、变异的管理:是临床路径管理的重点1、变异的定义:指病人在接受诊疗服务的过程中,出现偏离临床路径程序或在根据临床路径接受诊疗过程中出现偏差的现象。
2、变异的分类:变异有正负之分,负变异是指计划好的活动没有进行(或结果没有产生),或推迟完成,如延迟出院、CT检查延迟;正变异是指计划好的活动或结果提前进行或完成,如提前出院、CT检查提前等。
3、按照变异产生的原因分为:疾病转归造成的变异,医院系统造成的变异;医务人员造成的变异;病人需求造成的变异,退出五种情况。
4、变异的处理的遵循以下步骤:(1)记录医务人员应及时将变异情况记录在变异记录单内;记录应当真实、准确、简明;经治医师应与个案管理员交换意见,共同分析变异原因并制订处理措施。
临床路径实施流程图

临床路径实施流程图临床路径实施流程一、实施流程1、经治医师完成患者的检诊工作,与上级医师对住院患者进行临床路径的准入评估。
2、符合准入标准的,按照临床路径确定的诊疗流程实施诊疗,根据医师版临床路径表开具诊疗项目,向患者介绍住院期间为其提供诊疗服务的计划,并将评估结果和实施方案通知相关护理组;3、相关护理组在为患者及家属作入院介绍时,向他们详细介绍其住院期间的诊疗计划以及需要给予配合的内容;4、经治医师根据当天诊疗服务完成情况及病情的变化,对当日的变异情况进行分析、处理,并做好记录;5、医师版临床路径中的服务项目完成后,执行(负责)人应在相应的签名栏签名。
◆进入临床路径的患者应满足以下条件:诊断明确、没有严重的合并症、能够按临床路径设计流程和预计时间完成诊疗项目的患者。
◆出现以下情况时,患者应当退出临床路径:(1)在实施临床路径的过程中,患者出现了严重的并发症,需要转入其它科室实施治疗的;(2)在实施临床路径的过程中,患者要求出院、转院或改变治疗方式而需退出临床路径的;(3)发现患者因诊断有误而进入临床路径的;(4)患者出现严重的医疗相关感染等情况不适应继续完成临床路径的。
◆设立紧急情况警告值管理制度:警告值是指患者在临床路径治疗过程中出现严重异常情况,处于危险边缘,应迅速给予患者有效干预措施和治疗。
二、变异的管理:是临床路径管理的重点1、变异的定义:指病人在接受诊疗服务的过程中,出现偏离临床路径程序或在根据临床路径接受诊疗过程中出现偏差的现象。
2、变异的分类:变异有正负之分,负变异是指计划好的活动没有进行(或结果没有产生),或推迟完成,如延迟出院、CT检查延迟;正变异是指计划好的活动或结果提前进行或完成,如提前出院、CT检查提前等。
3、按照变异产生的原因分为:疾病转归造成的变异,医院系统造成的变异;医务人员造成的变异;病人需求造成的变异,退出五种情况。
4、变异的处理的遵循以下步骤:(1)记录医务人员应及时将变异情况记录在变异记录单内;记录应当真实、准确、简明;经治医师应与个案管理员交换意见,共同分析变异原因并制订处理措施。
临床路径实施流程及流程图

临床路径实施流程图r f医疗计划护理人员下发患者版临床路径告知单护理人员执行医疗计划,并协助做好变异监测提出改进建议—路径实施流程、实施流程部分退出临床路径进入临床路径的患者变异分析与记录1、经治医师完成患者的检诊工作,与上级医师对住院患者进行临床路径的准入评2、符合准入标准的,按照临床路径确定的诊疗流程实施诊疗,根据医师版临床路径表开具诊疗项目,向患者介绍住院期间为其提供诊疗服务的计划,并将评估结果和实施方案通知相关护理组;3、相关护理组在为患者及家属作入院介绍时,向他们详细介绍其住院期间的诊疗计划以及需要给予配合的内容;4、经治医师根据当天诊疗服务完成情况及病情的变化,对当日的变异情况进行分析、处理,并做好记录;5、医师版临床路径中的服务项目完成后,执行(负责)人应在相应的签名栏签名。
♦进入临床路径的患者应满足以下条件:诊断明确、没有严重的合并症、能够按临床路径设计流程和预计时间完成诊疗项目的患者。
♦出现以下情况时,患者应当退出临床路径:(1)在实施临床路径的过程中,患者出现了严重的并发症,需要转入其它科室实施治疗的;(2)在实施临床路径的过程中,患者要求出院、转院或改变治疗方式而需退出临床路径的;(3)发现患者因诊断有误而进入临床路径的;(4)患者出现严重的医疗相关感染等情况不适应继续完成临床路径的。
♦设立紧急情况警告值管理制度:警告值是指患者在临床路径治疗过程中出现严重异常情况,处于危险边缘,应迅速给予患者有效干预措施和治疗。
二、变异的管理:是临床路径管理的重点1、变异的定义:指病人在接受诊疗服务的过程中,出现偏离临床路径程序或在根据临床路径接受诊疗过程中出现偏差的现象。
2、变异的分类:变异有正负之分,负变异是指计划好的活动没有进行(或结果没有产生),或推迟完成,如延迟出院、CT 检查延迟;正变异是指计划好的活动或结果提前进行或完成,如提前出院、CT 检查提前等。
3、按照变异产生的原因分为:疾病转归造成的变异,医院系统造成的变异;医务人员造成的变异;病人需求造成的变异,退出五种情况。
临床评估流程图

;
/或安全性;
/与预期
• 文献检索&/或
• 临床经验&/或
• 临床调查
;
Yes
产生临床报告
注:蓝字为MEDDEV.2.7.1 Rev.3指南中Annex F部分;黑字部分为MEDDEV.2.7.1 Rev.3指南中非Annex F部分;红字部分为93/42/EEC,Annex部分
•·不
F, 4.1, 4.2)
以下文件化:
技术文档中应包括临床评估报告和完整的临床数据(MEDDEV.2.7.1 Rev.3/Annex F, 1.2);
制造商文件化临床评估的目的和范围,并规定所符合的临床基本要求<例如:临床功能、副作用、安全、风
险和受益/与预期用途有关的风险比、目标群体和指示>;(MEDDEV.2.7.1 Rev.3/Annex F, 1.3; 93/42/EEC,
Annex X, 1.1)
临床评估的实施阶段和程序(特别是第5~9章节),对于偏差给出了充分的理由;(MEDDEV.2.7.1
Rev.3/Annex F, 1.4);
临床评估报告参考格式(MEDDEV.2.7.1 Rev.3/Annex E)
93/42/EEC,Annex部分
7.1 Rev.3/6.2)
中的重大更新。
临床路径实施流程及流程图

临床路径实施流程图临床路径实施流程一、实施流程1、经治医师完成患者的检诊工作,与上级医师对住院患者进行临床路径的准入评估。
2、符合准入标准的,按照临床路径确定的诊疗流程实施诊疗,根据医师版临床路径表开具诊疗项目,向患者介绍住院期间为其提供诊疗服务的计划,并将评估结果和实施方案通知相关护理组;3、相关护理组在为患者及家属作入院介绍时,向他们详细介绍其住院期间的诊疗计划以及需要给予配合的内容;4、经治医师根据当天诊疗服务完成情况及病情的变化,对当日的变异情况进行分析、处理,并做好记录;5、医师版临床路径中的服务项目完成后,执行(负责)人应在相应的签名栏签名。
◆进入临床路径的患者应满足以下条件:诊断明确、没有严重的合并症、能够按临床路径设计流程和预计时间完成诊疗项目的患者。
◆出现以下情况时,患者应当退出临床路径:(1)在实施临床路径的过程中,患者出现了严重的并发症,需要转入其它科室实施治疗的;(2)在实施临床路径的过程中,患者要求出院、转院或改变治疗方式而需退出临床路径的;(3)发现患者因诊断有误而进入临床路径的;(4)患者出现严重的医疗相关感染等情况不适应继续完成临床路径的。
◆设立紧急情况警告值管理制度:警告值是指患者在临床路径治疗过程中出现严重异常情况,处于危险边缘,应迅速给予患者有效干预措施和治疗。
二、变异的管理:是临床路径管理的重点1、变异的定义:指病人在接受诊疗服务的过程中,出现偏离临床路径程序或在根据临床路径接受诊疗过程中出现偏差的现象。
2、变异的分类:变异有正负之分,负变异是指计划好的活动没有进行(或结果没有产生),或推迟完成,如延迟出院、CT检查延迟;正变异是指计划好的活动或结果提前进行或完成,如提前出院、CT检查提前等。
3、按照变异产生的原因分为:疾病转归造成的变异,医院系统造成的变异;医务人员造成的变异;病人需求造成的变异,退出五种情况。
4、变异的处理的遵循以下步骤:(1)记录医务人员应及时将变异情况记录在变异记录单内;记录应当真实、准确、简明;经治医师应与个案管理员交换意见,共同分析变异原因并制订处理措施。
临床路径流程图

v1.0可编写可改正
临床路径诊断流程
录入患者住院诊断,出现入径提示
不切合入径条切合入径条件,
件,选择不入径。
按临床路径要求
照实填写不入径履行入径
患者出现其余严重患者无特别情并发症,或许初步诊况,按要求履行履行过程中患者自己出治疗过程中患者原来次现并发症,或许因为医要的疾病诊断渐渐演变
断发生变化造成原完全部疗程,正院某些客观要素,在不成主要疾病诊断,需优治疗停止的,或许在影响路径持续履行的情先办理,或许最后诊断未治愈前要求出院、况下,造成患者治疗时与初步诊断不一致,且转院而停止治疗的
依据患者诊断和相应疾病诊断原则,选择适合的治疗方案进行治疗患者治疗成效好于预期,提早患者治疗成效比预期要差,某一达成全部诊断疗程,发生正变治疗疗程时间延伸致使住院时异,提早达成路径间延伸,高出标准住院日,发生
负变异,延后达成路径
1、路径跳转的状况一般发生在病人出现切合临床路径诊断的其余专科性疾病,持续在本科
室治疗时使用(本科室有新疾病的路径表单)。
如需要转科治疗或许新疾病无临床路径表单,则履行停止路径。
1
1 / 21 / 2
v1.0可编写可改正2、三甲医院标准规定:对切合进入临床路径标准的患者,入组率≥ 50%,入组达成率≥70%。
2
2 / 22 / 2。
住院患者VTE综合评估及治疗流程图

住院患者VTE综合评估及治疗流程图引言近年来,深静脉血栓形成(DVT)和肺部栓塞(PE)已成为住院患者中常见的并发症之一。
为了提高VTE(静脉血栓栓塞)的早期识别和预防,本文将介绍住院患者VTE综合评估及治疗流程图。
流程图VTE流程图](VTE_flowchart.png)评估阶段1.识别高危患者:年龄≥60岁高龄且有活动受限接受创伤或手术多个并发症静脉导管置入具有家族病史孕妇或产后患者2.完善VTE风险评估:积分评估模型(如Caprini评分或Padua评分)测定D-dimer水平考虑使用VTE风险评估模型App3.临床特征:双下肢深静脉触诊临床症状评估(疼痛、水肿等)血栓相关标志物评估4.影像学检查:下肢超声检查螺旋CT肺动脉造影(CTPA)放射性核素肺通气/灌注扫描(VQ扫描)预防策略1.机械性减压:弹力袜或深静脉穿刺装置(DVT袜)心脏功能监测装置2.药物预防:肝素或低分子肝素口服抗凝药物(特比萘芬、华法林)3.其他预防措施:营养支持,控制体重促进患者活动,避免长时间卧床提供抗炎药物提前移除静脉导管不推荐使用压力垫或按摩治疗阶段1.初始治疗:抗凝治疗:肝素或低分子肝素诱导剂:___2.长期抗凝治疗:___:INR控制在2-3之间3.手术治疗:IVC滤器置入血栓摘除血管成形术4.支持措施:患者教育和心理支持定期复查和随访___复发风险评估和预防结论住院患者VTE综合评估及治疗流程图是为了规范VTE的预防和治疗而设计的。
通过实施该流程图,能够提高VTE的早期识别和干预,减少VTE相关的并发症和死亡风险。
注:文档中的VTE流程图需自行添加和插入。
NSTEMI UA初步评估及再次评估的流程图

NSTEMI UA初步评估及再次评估的流程图NSTEMI(非ST段抬高型心肌梗死)和UA(不稳定型心绞痛)是急性冠状动脉综合征(ACS)的两种常见类型。
针对这两种疾病,进行初步评估和再次评估的流程图可以帮助医生进行准确的诊断和治疗决策。
以下是针对NSTEMI和UA的初步评估及再次评估的流程图的标准格式文本:1. 初步评估流程图:步骤一:患者就诊- 患者主动就诊或被送往急诊室。
- 患者提供病史和主诉。
步骤二:临床评估- 医生进行身体检查,包括测量血压、心率和体温。
- 医生询问患者疼痛的性质、持续时间和放射部位。
- 医生评估患者的心电图(ECG)结果,寻找ST段抬高或ST段压低的迹象。
步骤三:血液检查- 医生进行血液检查,包括心肌标志物如肌钙蛋白(cTn)和肌酸激酶(CK-MB)等。
步骤四:影像学检查- 医生进行胸部X射线检查,以排除其他心脏病或肺部疾病。
步骤五:进一步评估- 根据临床评估、血液检查和影像学检查结果,医生判断是否需要进一步评估。
- 如果初步评估结果显示可能存在NSTEMI或UA的风险,医生将决定是否进行冠状动脉造影(CAG)。
2. 再次评估流程图:步骤一:冠状动脉造影(CAG)- 医生进行冠状动脉造影,以评估冠状动脉的狭窄程度和血流情况。
- 医生使用造影剂注入冠状动脉,通过X射线监测血流情况。
步骤二:决策树- 根据CAG结果,医生根据特定的决策树来确定进一步的治疗方案。
- 如果存在严重冠状动脉狭窄,可能需要进行血管成形术(PCI)或冠状动脉搭桥术(CABG)。
- 如果冠状动脉狭窄不严重,医生可能会选择药物治疗。
步骤三:药物治疗- 医生根据患者的具体情况,开具适当的药物治疗方案。
- 药物治疗可能包括抗血小板药物、抗凝药物、β受体阻滞剂和血脂调节剂等。
步骤四:康复计划- 医生制定康复计划,包括生活方式改变、药物依从性和定期随访等。
- 医生向患者提供相关的教育和指导,以促进康复和预防再发。
病人病情评估流程图

病人病情评估流程图标题:病人病情评估流程图引言概述:病人病情评估是医疗工作中至关重要的一环,通过评估可以及时了解病人的病情变化,为医生制定治疗方案提供重要依据。
在医疗流程中,病人病情评估流程图是一种直观、清晰的工具,可以帮助医护人员系统地进行病情评估,提高工作效率和准确性。
一、患者信息收集1.1 患者基本信息:包括姓名、年龄、性别、联系方式等,为后续评估提供基本背景。
1.2 病史采集:详细了解患者的病史,包括既往疾病、手术史、过敏史等,有助于评估病情发展趋势。
1.3 症状描述:询问患者主诉的症状、病程等,帮助医护人员初步了解病情。
二、生命体征检查2.1 体温测量:通过测量体温了解患者是否发热,是常规评估指标之一。
2.2 血压测量:血压是评估患者循环系统功能的重要指标,可以反映患者的病情严重程度。
2.3 心率检查:心率异常可以提示患者是否存在心脏疾病或其他疾病,是评估病情的重要依据之一。
三、实验室检查3.1 血常规:通过检查血常规了解患者的血液情况,包括白细胞计数、红细胞计数等指标。
3.2 生化指标:检查患者的生化指标,如血糖、肝功能等,可以帮助医护人员了解患者的器官功能状况。
3.3 影像学检查:如X光、CT、MRI等检查,可以帮助医生了解患者内部器官的情况,对病情评估有重要作用。
四、专科评估4.1 心电图检查:对于心脏疾病患者,心电图检查是必不可少的评估手段。
4.2 神经系统评估:对于神经系统疾病患者,需要进行神经系统评估,了解患者的神经功能状况。
4.3 其他专科评估:根据患者病情需要,进行其他专科评估,如内分泌科、消化科等。
五、综合评估和制定治疗方案5.1 综合评估:将患者的患者信息、生命体征、实验室检查和专科评估结果进行综合分析,确定患者的病情严重程度和治疗方向。
5.2 制定治疗方案:根据综合评估结果,制定个性化的治疗方案,包括药物治疗、手术治疗等。
5.3 随访和监测:治疗开始后,需要进行定期随访和监测,了解治疗效果和病情变化,及时调整治疗方案。
临床试验流程图

申办者提岀药物临床试验申请
申办者提供SFDA 签发的临床
药物临床试验机构办公室审查、登记
探讨试验方案
专业组了解试验背景等情况
专业组根据情况决定是否接受试验, 填写《药物临床试验申请表》 药物临床试验机构办公室评估试验可行性,审核专业组的申请。
机构主任评估,决定是否接受试验
组织或参与试验方案研讨会
商讨试验费用,起草研究合同
机构主任与申办者签定合同
召开伦理委员会
伦理委员会表决通过
进行试验
药物临床试验流程
:专业组 I :
机构办公室组织 试验启动会 匚 :申办者、协作科室
:检查场地、抢救设施
L : 专业组启动会议 :确定本次试验SOP 、流程 J _ _ _ _ _ _ -1
研究者手册、初步
试验药物检验报告
进行试验
机构办公室向申办者提交 CRF 第一联,退回试验用药物 项目负责人根据统计结果撰写小结 报告,组长单位撰写总结报告
机构办公室审核小结报告,最
后交申办者,小结报告归档
E
组长单位与申办者组织召开临床试验总结会
总结报告归档,与申办者办理相关手续
机构办公室提交财务报告,机构主任
审批,财务科发放劳务费或统一划帐 知情同意过程、签知情同意书 中期试验 协作会 <—[文件收集、归档 ' F 及进程责人监督试验质量 试验数据记录 监查员、机构办公室的监查 <=1不良事件监查、处理、记录。
临床路径实施流程图

临床路径实施流程图临床路径实施流程一、实施流程1、经治医师完成患者的检诊工作,与上级医师对住院患者进行临床路径的准入评估。
2、符合准入标准的,按照临床路径确定的诊疗流程实施诊疗,根据医师版临床路径表开具诊疗项目,向患者介绍住院期间为其提供诊疗服务的计划,并将评估结果和实施方案通知相关护理组;3、相关护理组在为患者及家属作入院介绍时,向他们详细介绍其住院期间的诊疗计划以及需要给予配合的内容;4、经治医师根据当天诊疗服务完成情况及病情的变化,对当日的变异情况进行分析、处理,并做好记录;5、医师版临床路径中的服务项目完成后,执行(负责)人应在相应的签名栏签名。
◆进入临床路径的患者应满足以下条件:诊断明确、没有严重的合并症、能够按临床路径设计流程和预计时间完成诊疗项目的患者。
◆出现以下情况时,患者应当退出临床路径:(1)在实施临床路径的过程中,患者出现了严重的并发症,需要转入其它科室实施治疗的;(2)在实施临床路径的过程中,患者要求出院、转院或改变治疗方式而需退出临床路径的;(3)发现患者因诊断有误而进入临床路径的;(4)患者出现严重的医疗相关感染等情况不适应继续完成临床路径的。
◆设立紧急情况警告值管理制度:警告值是指患者在临床路径治疗过程中出现严重异常情况,处于危险边缘,应迅速给予患者有效干预措施和治疗。
二、变异的管理:是临床路径管理的重点1、变异的定义:指病人在接受诊疗服务的过程中,出现偏离临床路径程序或在根据临床路径接受诊疗过程中出现偏差的现象。
2、变异的分类:变异有正负之分,负变异是指计划好的活动没有进行(或结果没有产生),或推迟完成,如延迟出院、CT检查延迟;正变异是指计划好的活动或结果提前进行或完成,如提前出院、CT检查提前等。
3、按照变异产生的原因分为:疾病转归造成的变异,医院系统造成的变异;医务人员造成的变异;病人需求造成的变异,退出五种情况。
4、变异的处理的遵循以下步骤:(1)记录医务人员应及时将变异情况记录在变异记录单内;记录应当真实、准确、简明;经治医师应与个案管理员交换意见,共同分析变异原因并制订处理措施。
临床试验流程图
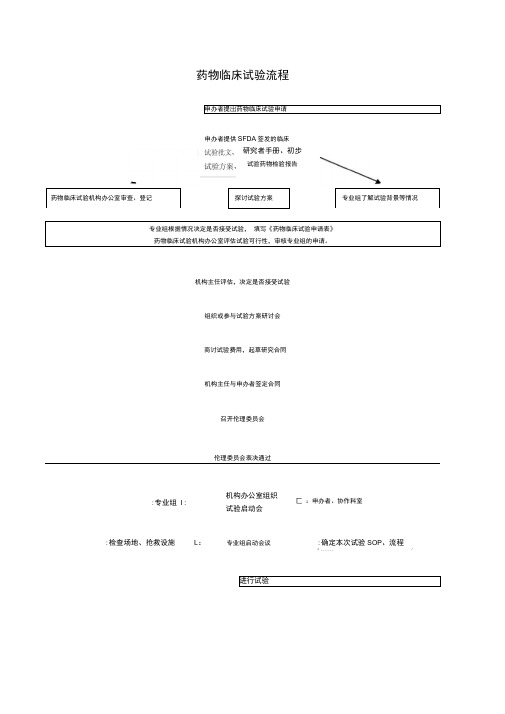
药物临床试验流程 申办者提岀药物临床试验申请
申办者提供SFDA 签发的临床
药物临床试验机构办公室审查、登记
探讨试验方案
专业组了解试验背景等情况
专业组根据情况决定是否接受试验, 填写《药物临床试验申请表》 药物临床试验机构办公室评估试验可行性,审核专业组的申请。
机构主任评估,决定是否接受试验
组织或参与试验方案研讨会
商讨试验费用,起草研究合同
机构主任与申办者签定合同
召开伦理委员会
伦理委员会表决通过
进行试验
:专业组 I :
机构办公室组织 试验启动会 匚 :申办者、协作科室
:检查场地、抢救设施
L : 专业组启动会议 :确定本次试验SOP 、流程 J _ _ _ _ _ _ -1
研究者手册、初步
试验药物检验报告
进行试验
机构办公室向申办者提交 CRF 第一联,退回试验用药物 项目负责人根据统计结果撰写小结 报告,组长单位撰写总结报告
机构办公室审核小结报告,最
后交申办者,小结报告归档
E
组长单位与申办者组织召开临床试验总结会
总结报告归档,与申办者办理相关手续
机构办公室提交财务报告,机构主任
审批,财务科发放劳务费或统一划帐 知情同意过程、签知情同意书 中期试验 协作会 试验数据记录 监查员、机构办公室的监查 <—[文件收集、归档 [ * "1 <3- 1项目负责人监督试验质量 <= 不良事件监查、处理、记录。
新药临床申请技术审评流程图及说明

新药临床申请技术审评流程图及说明新药临床申请技术审评是指针对新药研发企业提交的新药临床试验申请材料进行技术审查和评估。
审评的主要目的是评价新药的安全性、有效性和合理性,并确定是否符合上市注册要求。
下面是新药临床申请技术审评的流程图及详细说明。
流程图:1.申请提交:新药研发企业将临床试验申请材料提交给相关药品监管部门。
2.初审:药品监管部门对申请材料进行初步审查,确认材料是否齐全、符合法规要求。
3.受理:药品监管部门确认符合要求的申请材料,并颁发受理通知书。
4.技术审查:药品监管部门指派专家进行技术审查,评估新药的质量、有效性、安全性等方面的数据。
5.专家会议:独立的专家团队就新药的技术审评结果进行讨论和评估。
6.缺陷通知:如果审评中存在不符合要求或需要补充材料的情况,药品监管部门向申请人发出缺陷通知,并要求补充或修正材料。
7.补正材料:申请人根据缺陷通知要求,补充或修正相关材料。
8.二次审查:药品监管部门对补正后的材料进行二次审查。
9.复审:药品监管部门组织复审专家对新药的技术审评结果进行终审。
10.审评报告:药品监管部门形成审评报告,并将结果告知申请人。
11.上市注册:如果审评结果符合上市注册要求,药品监管部门颁发准入证书,允许新药上市。
详细说明:1.申请提交:新药研发企业向药品监管部门提交新药临床试验申请材料,包括药物化学、制剂工艺、药理毒理、临床试验等方面的数据。
2.初审:药品监管部门对申请材料进行初步审查,确认材料是否齐全、符合法规要求。
如果申请材料不完整或不符合要求,药品监管部门将要求申请人进行补充或修正。
3.受理:药品监管部门确认符合要求的申请材料,并颁发受理通知书。
受理后,新药临床申请正式开始。
4.技术审查:药品监管部门指派专家进行技术审查,评估新药的质量、有效性、安全性等方面的数据。
专家会通过阅读申请材料、讨论研究结果、与申请人交流等方式进行审查评估。
5.专家会议:专家团队就新药的技术审评结果进行讨论和评估。
病人病情评估流程图

病人病情评估流程图病人病情评估是医疗护理中非常重要的一环,它可以匡助医护人员全面了解病人的病情和健康状况,以便制定合适的治疗方案和护理计划。
下面是一个标准的病人病情评估流程图,详细介绍了评估的各个环节和步骤。
1. 病人信息登记- 采集病人的基本信息,包括姓名、性别、年龄、联系方式等。
- 记录病人的主诉,即病人自己所述的症状和不适。
2. 生命体征评估- 测量病人的体温、脉搏、呼吸、血压等生命体征。
- 观察病人的意识状态和疼痛程度。
3. 病史采集- 问询病人的既往病史、家族病史和个人生活习惯等。
- 了解病人的过敏史和药物使用情况。
4. 症状评估- 详细问询病人的症状,包括浮现时间、程度、频率等。
- 观察病人的体征,如皮肤颜色、黏膜湿润度、呼吸音等。
5. 系统评估- 对病人的各个系统进行评估,包括呼吸系统、心血管系统、消化系统等。
- 评估病人的神经系统和肌肉骨骼系统。
6. 实验室检查- 根据病人的病情需要,进行相应的实验室检查,如血常规、尿常规、血糖等。
- 分析实验室检查结果,辅助判断病人的病情。
7. 专科评估- 根据病人的病情需要,安排相应的专科医生进行评估和诊断。
- 与专科医生沟通,了解病人的专科检查结果和诊断意见。
8. 综合评估- 将以上各个环节的评估结果进行综合,形成对病人病情的综合评估。
- 根据评估结果,制定相应的治疗方案和护理计划。
9. 评估记录- 将病人病情评估的结果进行详细记录,包括病人信息、生命体征、病史、症状、系统评估、实验室检查等。
- 记录评估的时间和评估者的姓名。
10. 评估结果交流- 将评估结果与病人本人或者家属进行交流,解释评估结果和治疗方案。
- 向病人或者家属提供相关的健康教育和护理指导。
以上是一个标准的病人病情评估流程图,通过这个流程图,医护人员可以系统地进行病人的病情评估,全面了解病人的病情,为病人提供更加精准的治疗和护理服务。
这个流程图可以根据具体的医疗机构和病情需要进行调整和补充,以适应不同的临床情况。
临床路线流程图

临床路线流程图简介本文档旨在提供一个临床路线流程图,帮助临床医生和医护人员在临床实践中进行准确和高效的病例处理。
该流程图根据常见疾病的诊断和治疗步骤进行设计,结合临床指南和专业知识,以确保医疗决策的准确性和可靠性。
流程图示例下面是一个示例的临床路线流程图,涵盖了常见的疾病处理步骤。
具体的步骤可能因疾病种类和临床现象的差异而有所调整。
流程步骤以下是一个概括性的示例,展示了疾病处理的一般流程。
具体步骤应根据疾病的特点和临床指南进行调整。
1. 临床评估:对患者进行详细的身体检查,了解病史、症状和体征,进行初步判断。
2. 疾病诊断:通过实验室检查、影像学和其他诊断方法来确定疾病的类型和严重程度。
3. 制定治疗计划:根据疾病诊断结果,制定个性化的治疗计划,包括药物治疗、手术治疗和其他治疗手段。
4. 治疗实施:根据治疗计划,对患者进行相应的治疗措施,包括药物给予、手术操作和生活方式干预等。
5. 治疗反馈:根据患者的治疗反应和病情变化,评估治疗效果并对治疗计划进行调整。
6. 综合评估:对治疗效果进行综合评估,并与患者进行沟通,提供必要的支持和指导。
7. 随访管理:定期随访患者,了解病情变化,并根据需要进行进一步的治疗调整和管理。
请注意,以上流程仅为示例,具体的临床路线流程应根据不同疾病和临床指南进行调整和优化。
结论临床路线流程图是临床医生和医护人员的重要工具,可以帮助他们在繁忙的医疗环境中进行准确和高效的病例处理。
根据临床指南和专业知识,制定合理的治疗计划,并根据患者的情况进行调整,可以提高疾病治疗的成功率和患者的生活质量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
;
/或安全性;
/与预期
• 文献检索&/或
• 临床经验&/或
• 临床调查
;
Yes
产生临床报告
注:蓝字为MEDDEV.2.7.1 Rev.3指南中Annex F部分;黑字部分为MEDDEV.2.7.1 Rev.3指南中非Annex F部分;红字部分为93/42/EEC,Annex部分
·不 F, 4.1, 4.2)
•
以下文件化:
技术文档中应包括临床评估报告和完整的临床数据(MEDDEV.2.7.1 Rev.3/Annex F, 1.2);
制造商文件化临床评估的目的和范围,并规定所符合的临床基本要求<例如:临床功能、副作用、安全、风
险和受益/与预期用途有关的风险比、目标群体和指示>;(MEDDEV.2.7.1 Rev.3/Annex F, 1.3; 93/42/EEC,
Annex X, 1.1)
临床评估的实施阶段和程序(特别是第5~9章节),对于偏差给出了充分的理由;(MEDDEV.2.7.1
Rev.3/Annex F, 1.4);
临床评估报告参考格式(MEDDEV.2.7.1 Rev.3/Annex E)
93/42/EEC,Annex部分
7.1 Rev.3/6.2)
中的重大更新。
