《化学中的铜》课件
专题3.6 铜及其化合物的性质和应用(优质课件)-2021年高考化学大一轮复习紧跟教材

AgNO3 _C_u_+__2_A__g_N_O__3=_=_=_C__u_(N__O_3_)_2+__2_A__g_ 溶液
盐 FeCl3 _C_u_+__2_F_e_C__l3_=_=_=_C_u__C_l2_+__2_F_e_C_l_2_ 溶液
2021年高三大一轮复习——铜及其化合物的性质和应用
2021年高三大一轮复习 第三章——金属及其化合物
第十四讲 铜及其化合物的性质和应用
2021年高三大一轮复习——铜及其化合物的性质和应用
内容索引
要点一 铜元素及其化合物知识主线 要点二 金属铜的性质 要点三 铜的化合物性质及应用
【2020高考真题赏析】
【2020 新课标Ⅱ】北宋沈括《梦溪笔谈》中记载:“信州铅山有苦泉,流以 为涧。挹其水熬之则成胆矾,烹胆矾则成铜。熬胆矾铁釜,久之亦化为铜”。 下列有关叙述错误的是() A.胆矾的化学式为 CuSO4 B.胆矾可作为湿法冶铜的原料 C.“熬之则成胆矾”是浓缩结晶过程 D.“熬胆矾铁釜,久之亦化为铜”是发生了置换反应
2021年高三大一轮复习——铜及其化合物的性质和应用 要点一 铜元素及其化合物知识主线
【性质表征】从两个维度分析下列转化原理,至少各写出一个反应的方程式。
• Cu → CuCl2 • Cu → Cu2S • Cu → CuSO4 • Cu → Cu(NO3)2 • CuO → Cu • Cu(OH)2 → Cu2O • CuCl2 → Cu
3. Cu2+ 的性质
铜盐溶液有毒,主要是因为铜离子能与蛋白质作用,使蛋白质变 性失去生理活性,因此人们利用这一性质用胆矾、熟石灰、水配 成了波尔多液,用来杀灭植物的病毒。
3. Cu2+ 的性质
(1)碱式碳酸铜 碱式碳酸铜的化学式为 Cu2(OH)2CO3,是铜绿的成分,是铜在潮 湿的空气中被锈蚀的结果,其受热分解的化学方程式为 __C_u_2_(_O_H_)_2_C_O_3_=_=△_=_=_=_2_C_u_O_+__C_O__2↑__+__H_2_O__________。
《铜及铜合金》课件

火法冶金
• 火法冶金是指将矿石或精矿在高温下进行熔炼,以提取有价金 属的冶金过程。火法冶金包括烧结、熔炼、吹炼、精炼等工序 ,铜的火法冶金通常采用反射炉、鼓风炉、电炉等设备。
湿法冶金
• 湿法冶金是指利用溶液中不同金属离子化学性质的差异,通过化学反应将有价金属从溶液中提取出来的方法。湿法冶金包 括浸出、净化、萃取、电解等工序,铜的湿法冶金通常采用硫酸浸出、氨浸出等方法。
铜及铜合金在某些环境中具有 良好的耐腐蚀性,如海洋环境
、大气环境等。
抗氧化性
铜及铜合金在高温环境下容易 氧化,生成氧化铜或碱式碳酸 铜。
化学反应活性
铜及铜合金在某些化学反应中 具有较高的反应活性,如氧化 还原反应等。
与酸、碱的反应
铜及铜合金与酸、碱等物质反 应,生成相应的盐类物质。
力学性能
强度与硬度
中国铜及铜合金市场现状
中国铜及铜合金消费量
01
中国是全球最大的铜及铜合金消费国,消费量占全球总消费量
的比例逐年上升。
中国铜及铜合金生产量
02
中国是全球最大的铜及铜合金生产国,生产量占全球总生产量
的比例逐年上升。
中国铜及铜合金进出口情况
03
中国铜及铜合金的进出口量较大,进出口市场受国内外经济形
势、汇率波动等多种因素影响。
05
铜及铜合金的腐蚀与防护
腐蚀类型和机理
电化学腐蚀
应力腐蚀
铜合金中的不同金属元素具有不同的电位 ,在电解质溶液中形成原电池,导致电化 学腐蚀。
在应力和特定环境因素的共同作用下,如 腐蚀介质和拉伸应力,铜合金容易发生应 力腐蚀开裂。
摩擦腐蚀
接触腐蚀
在摩擦过程中,由于机械作用和接触表面 间的相对运动,导致金属表面损伤和腐蚀 。
铜的组成元素

铜的组成元素
铜是一种常见的金属元素,其化学符号为Cu,原子序数为29。
铜是一种优良的导电和导热材料,具有良好的延展性和可塑性,因此在工业和日常生活中广泛应用。
铜的组成元素是由铜原子组成的。
在自然界中,铜主要以氧化物和硫化物的形式存在。
铜矿石中含有大量的铜,经过矿石的提炼和冶炼过程,可以得到纯净的铜金属。
铜的组成元素中,最重要的是铜原子。
铜原子的核心由29个质子和中子组成,围绕核心的电子云中有29个电子。
这些电子以不同的能级和轨道分布,形成了稳定的原子结构。
除了铜原子,铜合金也是铜的重要组成部分。
铜合金是将铜与其他金属元素混合而成的材料。
常见的铜合金有青铜、黄铜和白铜等。
青铜是铜和锡的合金,具有较高的硬度和耐腐蚀性,常用于制作器具和艺术品。
黄铜是铜和锌的合金,具有良好的可塑性和导电性,广泛应用于制造电器和五金配件。
白铜是铜、锌和镍的合金,具有较高的强度和耐蚀性,常用于制作钟表零件和装饰品。
铜的组成元素不仅仅是物质的组成,也反映了铜在人类社会中的重要地位。
铜作为一种重要的工业原材料,广泛应用于电子、建筑、交通等领域。
铜的导电和导热性能使其成为电线、电缆和散热器的理想材料。
铜合金的优良性能使其成为制造工具、机械零件和装饰
品的首选材料。
铜的组成元素主要是由铜原子和铜合金组成。
铜的优良性能和广泛应用使其成为人类社会不可或缺的重要物质。
通过深入了解铜的组成元素,我们可以更好地认识和利用这一宝贵的资源。
《铜的电解精炼》课件

辅助设备
01
02
03
04
辅助设备包括循环系统、过滤 系统、排污系统等,用于支持
电解过程的正常运行。
循环系统用于将电解液持续循 环流动,以保持电解液成分的
均匀分布和温度的稳定。
过滤系统用于去除电解液中的 杂质和颗粒物,以保持电解液
的清洁度。
排污系统用于定期排放电解槽 底部的沉淀物和杂质,以保持
电解槽的正常运行。
阳极过程
阳极上的粗铜溶解成铜离子进入电解液,同时释放电子。
电能效率
优化电解精炼的电流密度和电压,以提高电能效率和降低能耗。
产物处理
铜饼处理
从电解精炼过程中获得的 铜饼需要进行进一步的处 理,如洗涤、干燥和熔炼 等。
产品纯度
通过控制电解精炼的条件 和后续处理,确保获得高 纯度的电解铜产品。
资源回收
对电解精炼过程中产生的 废弃物进行回收和处理, 实现资源的有效利用。
铜的电解精炼设备
03
电解槽
01
电解槽是铜的电解精炼 过程中的核心设备,用 于实现铜的电解过程。
02
电解槽通常由耐腐蚀、 绝缘性能好的材料制成 ,如聚氯乙烯或玻璃钢 。
03
电解槽内部通常填充有 离子交换剂或导电介质 ,以促进铜离子的迁移 和分离。
04
电解槽的设计和结构需 根据生产规模、电解液 成分和工艺要求进行定 制。
《铜的电解精炼》ppt 课件
目 录
• 铜的电解精炼简介 • 铜的电解精炼工艺流程 • 铜的电解精炼设备 • 铜的电解精炼的优缺点 • 铜的电解精炼的发展趋势和未来展望
铜的电解精炼简介
01
铜的电解精炼的定义
01
铜的电解精炼是一种通过电解的 方法将粗铜提纯为纯铜的过程。
初中化学课件《金属的化学性质》ppt课件

无明显现象,铜不溶解于稀盐酸。
铜与稀硫酸反应
无明显现象,铜不溶解于稀硫酸。
通过实验探究不同金属活动性顺序
实验设计
通过对比不同金属与同一种酸(如稀盐酸或稀硫酸)的反应剧烈 程度,可以判断金属的活动性顺序。例如,将镁、锌、铜分别放 入等浓度的稀盐酸中,观察反应现象。
实验现象
镁与稀盐酸反应最剧烈,产生大量气泡并放出热量;锌与稀盐酸 反应较剧烈,产生气泡并放出热量;铜与稀盐酸无明显反应现象 。
锌(Zn)
常用于镀锌防止钢铁腐蚀,也 用于制造干电池等。
金属分类及性质差异
黑色金属
主要指铁、铬、锰及其合金,如钢、生铁、铁合 金等。
贵金属
包括金、银和铂族元素(钌、铑、钯、锇、铱、 铂)等,具有高密度、高延展性和高稳定性等特 点。
有色金属
除黑色金属外的所有金属,包括铜、铝、锌、铅 、镍等及其合金。
原理阐述
钢铁冶炼过程中涉及到氧化还原反应、热力学和动力学等原理。在高温 条件下,通过合理的原料配比和工艺控制,可以实现铁水中的杂质去除 和合金元素的加入,从而得到符合要求的钢种。
防止金属腐蚀方法探讨
电化学保护法
利用原电池原理进行金属的保 护,设法消除引起电化腐蚀的 原电池反应。电化学保护法分 为阳极保护和阴极保护两大类 ,应用较多的是阴极保护法。
金属在自然界中广泛存在,是人类生活和工业生产 中不可或缺的材料。
常见金属元素介绍
01
02
03
04
铁(Fe)
地壳中含量最丰富的金属元素 之一,广泛用于制造钢铁、铸 铁等。
铜(Cu)
具有良好的导电性和延展性, 用于制造电线、电缆、铜管等 。
铝(Al)
地壳中含量最丰富的金属元素 ,质轻且导电性好,用于制造 飞机、汽车、包装材料等。
宋天佑版无机化学 第19章 铜锌副族PPT课件

2020/11/27 8
三、铜的重要化合物
一、一价化合物-氧化物和氢氧化物
Cu2O:暗红(黄),弱碱性共价化合物,溶于稀酸、氨水,热稳 定性高。CuO分解得到。 Cu2O+2HCl(稀)→ 2CuCl↓(白)+H2O Cu2O+4HCl(浓)→2H[CuCl2]+H2O Cu2O+H2SO4→(Cu2SO4)→CuSO4+Cu+H2O Cu2O+4NH3+H2O→2[Cu(NH3)2]++2OH- (无色,不稳定) 4[Cu(NH3)2]++O2+8NH3+2H2O=4[Cu(NH3)4]2++4OH(深兰色)
2020/11/27 6
⑴ 2CuFeS2+O2=Cu2S+2FeS(焙砂) +SO2↑ ⑵ mCu2S+nFe2S=冰铜
FeO+SiO2=FeSiO3(渣浮上) ⑶ 2Cu2S+3O2=2Cu2O+2SO2 32.ACgu的2O冶+பைடு நூலகம்炼u2S=6Cu+SO2
问题:电解铜时, 为何Ni、Fe、 Zn、Ag、Au、 Pt等不在纯铜板 上沉积?
Cu4HN3(O 浓) Cu(N3)O 2 2NO 2 2H2O Ag2HN3(O 浓) AgN3O NO 2 H2O Cu2H2SO4(浓) CuS4O SO2 2H2O 2Ag2H2SO4(浓) Ag2SO4 SO2 2H2O Au4HC浓 l)(HN3O (浓) H[Au4]CN l O2H2O
Eθ(M+/M) 0.521 0.799 1.68 -2.7~-2.9
电负性
化学沉铜介绍定稿.ppt

.精品课件.
13
化学沉铜(Electroless Copper)
• 反应原理:Cu2++2HCHO+4OH- Pd Cu+
•
2HCOO-+2H20+H2
• 反应特点:1.自身催化反应2.一定时间
•
内沉积一定厚度的铜层
• 工艺控制:温度30-35°C
•
时间14-16 min
.精品课件.
14
化学沉铜(Electroless Copper)
•
时间1-3 mp)
• 目的: 防止前工位处理对催化槽的污染
• 工艺控制:温度 常温
•
时间1-2 min
.精品课件.
11
催化(Catalyst)
• 目的:孔壁吸附沉铜反应所需的催化剂
•
钯胶体(Pd[SnCL3]n -)
• 工艺控制:温度 40-45°C
•
时间 4-6 min
•
2.反应为物理吸附过程,易控制。
•
3.工艺流程简化
•
4.适用于水平或垂直
• 分类:1.Pd导电金属薄层
•
2.导电高分子材料
•
3.炭或石墨导电层
.精品课件.
20
钯系列
• 常见工艺流程: • (去钻污处理) 整孔 预浸 催化
加速 硫化 后处理 微蚀 • 供应商:Shipley、Atotech、Blasberg等 • 适用设备:水平线及垂直线
.精品课件.
5
去钻污(Desmearing)
• 目的:利用KMnO4的强氧化性,将钻污除去 • 反应原理:
• MnO4+C+OH MnO42-+CO2+2H2O
高中化学《铜-锌原电池及其原理》课件ppt
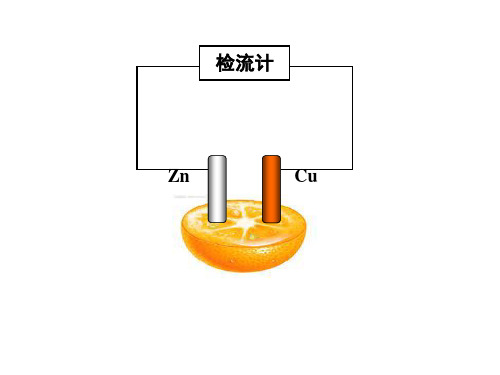
4.根据物理知识,判断上述原电池的正负极。 5.分析实验2的微观过程
探究实验二:原电池的构成条件
提供器材:两根铁钉,纯的锌片,碳棒,带 鳄鱼夹的导线两根,灵敏电流计(小) 第1组:稀硫酸; 第2组:氯化钠溶液; 第3组:乙醇溶液; 第4组:氢氧化钠溶液; 温馨提示:每组成员分工合作,并做好实验 记录,保证高效准确!
Zn-2e-=Zn2+
经外电路
Zn2+ H+
SO42-
流入铜极.
正极 氧化剂(H+)在铜极上 得到电子,发生还 原反应 2H+ +2e-=H2
电流方向
习题:1.下列哪些装置能构成原电池?
2.请你当医生:她的病因是?你能为她开个处方吗?
*格林太太,漂亮、开朗、乐观,身体健康,脸上有 着“永恒的微笑”。只是她在开怀大笑的时候,人们 才可以的—这是格林太太富有的标志;另一 颗是不锈钢做的—这是一次车祸后留下的痕迹。令人 百思不解的是,打从车祸以后,格林太太经常头痛, 夜间失眠,心情烦躁……
普通干电池
手机电池
钮扣电池
笔记本电脑 专用电池
摄像机 专用电池
“神六”用 太阳能电池
比亚迪 秦 荣威
保时捷 特斯拉
1、解释橙子电池的工作原理 2、实验室制备氢气时,含杂质(少量银、 金等)的锌比纯锌产生氢气的快。
3、轮船底部焊接锌块,且需要定期更换。
还原剂失去的 电子从锌极流 出
负极
还原剂(Zn)失去电 子,发生氧化反应
检流计
Zn
Cu
探究实验一:Zn与Cu插入稀硫酸的现象与解释
A
Zn
Cu
稀硫酸
实验1
Zn
Cu
稀硫酸
《铜及铜合金》课件

2
交通工具
铜被广泛用于汽车、火车、船舶等交通工具中的制动系统、散热器、发动机等部件。
3
军事领域
铜被广泛应用于军事装备、导弹等,是军事装备的重要材料。
4
生活用品
铜常被用于制造钱币、首饰、厨具等生活用品。
铜合金
合金的定义、分类
铜合金指铜与其他金属或非金属元素共同组成的合金。常见的铜合金有高黄铜、铜锌合金、 青铜、铜铝合金、铜锡合金等。
铜合金的应用
不同种类的铜合金具有不同的性能和用途,广泛应用于电气、建筑、航空、汽车、机械等领 域。
常见的铜合金
高黄铜是一种重要的铜合金,常用于制造弹簧、连接器等;铜铝合金是一种轻质高强的铜合 金,广泛用于航空航天和汽车制造等领域。
铜及铜合金的环保应用
1
纳米铜的制备及应用
2
纳米铜是指粒径在1-100 nm之间的铜粉末,
具有高比表面积和活性Hale Waihona Puke 可用于催化、电子、涂饰等领域。
3
再生铜的制备及应用
再生铜是通过回收废旧铜制备的铜,具 有环保优势,广泛应用于电子、建筑、 交通等领域。
铜及铜合金回收处理技术
铜及铜合金回收处理技术包括冶金、生 物化学、化学和物理等多种方法,可用 于解决废弃铜的环境污染问题。
总结
铜及铜合金的重要性
铜及铜合金在经济、国防、生活等领域均扮演着重 要角色,是人类社会发展的重要物质基础。
铜及铜合金的发展前景
随着科学技术的不断发展和应用创新,铜及铜合金 在新材料、新能源、智能制造等领域有着广阔的应 用前景。
《铜及铜合金》PPT课件
在这个课程中,我们将一起探讨铜及其合金的基本性质、制备、应用以及环 保技术。
《铜及其化合物》

基础知识:Cu
+
2H2SO4(浓)
△
====
CuSO4
+
SO2↑
+2H2O
核心原理启示: Cu -2e-
强氧化剂
Cu2+
三、硫酸铜的制取问题 以铜为原料制备CuSO4
方案一 浓硫酸直接氧化法
基础知识:Cu
+
2H2SO4(浓)
△
====
CuSO4
+
SO2↑
+2H2O
结合实际:生产缺点:污染,原料利用率低
三、硫酸铜的制取问题 以铜为原料制备CuSO4
方案二 高温灼烧氧化法
三、硫酸铜的制取问题 以铜为原料制备CuSO4
方案二 高温灼烧氧化法
三、硫酸铜的制取问题 以铜为原料制备CuSO4
方案二 高温灼烧氧化法
缺点: 能耗高;固气反应不充分。操作分步进行
三、硫酸铜的制取问题 以铜为原料制备CuSO4
3.CuSO4·5H2O CuSO4·5H2O为蓝色晶体,俗称蓝矾、胆矾。无水 CuSO4为白色粉末,遇水变蓝色(生成CuSO4·5H2O), 可作为水的检验依据。
知识梳理·题型构建
深度思考 波尔多液是一种农业上应用广泛的杀菌剂,它是由硫酸 铜、生石灰和水按一定比例配成的天蓝色胶状悬浊液,思考 下列问题 (1)波尔多液能否用铁桶盛放?为什么?
与H2反应 CuO+H2==Cu+H2O
Cu2O+H2==2Cu+H2O
转化关系
4CuO=高=温==2Cu2O+O2↑
知识梳理·题型构建
铜及其化合物
2.氢氧化铜 (1)物理性质:__蓝__色__不__溶于水的固体。 (2)化学性质及应用
人教版九年级上册化学 《元素》PPT教学课件

原子 结构 示意 图
Be B
氮氧
铝
磷
氩
S
排列元素周期表:
排列元素周期表:
元素周期表的结构:
(1)周期:每一横行叫一个周期,共个周期。每个周期(第 开头的是元素,靠近尾部的是元素,结尾的是元素。 (2)族:每一纵行叫一个族(其中8,9,10三列共同组成一个族 (3)单元格:为了便于查找,元素周期表按数递增的顺序给 了号,叫做。每一种元素占据一格,包括四方面的信息:
尽纡朱紫佩金。银 --白居易
CuCa
铜钙
P
Ag
代表元素种 类
金属元 素
非金属 固 元素 态
非金属 液 元素 态
非金属 气 元素 态
偏旁
“钅” 字旁
“石” 字旁
“氵” 字旁
“气” 字旁
实例
备注
汞是一种
铁、铜、 特殊的
铝等
金 属,呈
磷、碳、
液态
硫等
(1)三类均 为,非金属元素
溴 (2)溴是唯 一的一种液
表示———
8 O———表示。
氧———表示。 16.00———表示。
原子序数与元素原子核电荷数在上相等。由此,我们前面曾学 的一个相等关系“核电荷数=核内质子数=核外电子数”可进 “=核电荷数=核内质子数=核外电子数”。 (4)规律:周期数电子层数,主族数最外层电子数。
第一周期
7 第二周第一期第二
个 周
外电子数
(4)元素周期表与原子结构的关系:
=
= 周期数电子层数主族数最外层电子数
1(2018,河南)下列各元素中,元素符号第一个字母不相同的一 组是()
A.锰、钛B.氩、金C.铅、铂D.氦、汞
2(2017,河南)下列科学家中,发现了元素周期律并编制了元素 周期表的是()
人教版高中化学必修一课件铜及其化合物

CuO
Cu(OH)2
+1
Cu2O
Cu2S
0
Cu
单质
氧化物
碱
盐
类别
如何画好分析流程图?
分析流程图
0.2L,1mol/L 气体A
淀粉、I2
无色溶液
使品红褪色 黄 铜 矿 煅烧
金属B 亮红色,6.4g 滤液 炉渣 NaOH 滤渣 过量 盐酸 凝胶状白色沉淀 沉淀C
①稀硝酸②NaOH ③过滤、洗涤、灼烧
CuO
Cu(OH)2
+1
Cu2O
Cu2S
0
Cu
单质
氧化物
碱
盐
类别
铜及其化合物的二维关系转化图
化合价 +2 Cu2+ Cu2(OH)2CO3
CuO
Cu(OH)2
+1
Cu2O
Cu2S
0
Cu
单质
氧化物
碱
盐
类别
-2
Cu2S+O2=2Cu+SO2
6e-
高温
+4
铜及其化合物的二维关系转化图
化合价 +2 Cu2+ Cu2(OH)2CO3
化合价 +2 Cu2+ Cu2(OH)2CO3
CuO
Cu(OH)2
+1
Cu2O
Cu2S0Cu源自单质氧化物碱
盐
类别
物质成分分析的基本模型
定性(现象 ) 气体 颜色
气味
物质 成分 溶液
定量(测定 ) V
元素种类
溶解性
c、n
微粒数
特征 性质 等
固体
化学式
m
高三化学一轮复习课件:39铜及其化合物 金属材料

3.铜、银、金是人类认识最早的三种金属,因为很早就被人们用作钱 币,因此有“货币金属”之称。由于铁的金属性比铜、银、金强,相对而 言,人类认识铁稍晚。某研究性学习小组为了证明铁的金属活动性比铜强, 他们设计了如下方案:
(1)铁片置于硫酸铜溶液中有铜析出。 (2)铁、铜和氯气反应分别生成 FeCl3 和 CuCl2。 (3)足量的铁粉和铜粉分别与浓硫酸反应生成 FeSO4 和 CuSO4。 (4)铜片置于 FeCl3 溶液中铜片逐渐溶解。 (5)把铁片和铜片置于盛有稀硫酸的烧杯中,并用导线连接,铁片上无 气泡产生,而铜片上有气泡产生。 以上设计合理的有__(_1_)_(5_)__(填序号)。
化学 性质
CuO+2H+===Cu2++H2O △
CuO+H2=====Cu+H2O △
CuO+CO=====Cu+CO2
Cu(OH)2+2H+ ===Cu2++2H2O
△ Cu(OH)2=====CuO+H2O
(2)硫酸铜
①CuSO4·5H2O 为蓝色晶体,俗称 蓝矾或胆矾
,受热易分解为白
色粉末 CuSO4 和水。
酸盐[Na2CO3、K2CO3、(NH4)2CO3],除铵盐外,其余两种受热均不易分解。
对点微练二 铜的冶炼方法 4.孔雀石的主要成分为 Cu2(OH)2CO3。某同学设计的从孔雀石中冶炼 铜的方案如下(假设孔雀石中杂质不溶于水和稀硫酸):
(1)反应①能观察到的现象是_固_体__逐__渐_消__失_,__溶__液_由__无_色__变_成__蓝__色_,__有_气__泡_产__生_, 有关反应的化学方程式为_C_u_2_(O__H_)2_C_O__3+__2_H_2_S_O_4_==_=_2_C_u_S_O__4+__C_O__2↑__+__3H__2O__。
化学中的铜PPT课件

Cu2S
Cu
H2
CuO
HNO3
CuCl2
Cu(OH)2
H2SO4
NaOH
Cu(NO3)2
13
CuSO4
例题
按下图装置,持续通入X气体,可以看到a处有红色 物质生成,b处变蓝,c处得到刺激性气味液体,则 X气体可能是( D )(设各步反应均进行完全)
19
五、电化学中的“铜”
电解 Cl2 O2 S O2 HCl NaOH HCl
Cu2O
CH3CHOCu2SCu NhomakorabeaH2
CuO
HNO3
CuCl2
Cu(OH)2
H2SO4
NaOH
Cu(NO3)2
20
CuSO4
总结电化学中的“铜”
1、要求画出相关装置图,写出电极 反应式 2、要涵盖原电池和电解质原理 3、实现铜和稀盐酸的反应
Cu2O+2H+=Cu2++Cu+H2O
11
硫酸铜溶液与碘化钾溶液反应,生成一 种能使淀粉碘化钾溶液变蓝的单质和 CuI 白色沉淀,写出符合此反应的离子 方程式 2Cu2++4I-=2CuI↓+I2 。当有 0.5molCuSO4参加反应时转移电子数为
0.5NA
。
12
三、有机化学中的“铜” Cu2O
小结电化学中的“铜”
1、原电池
2、电解池 (1)电解精炼铜 (2)电镀铜
22
Cu+2HCl→CuCl2+H2
阳极(铜):Cu - 2e- = Cu2+
阴极(碳):2H+ + 2e- = H2↑
《铜的氧化物》课件

3 实验记录
准确记录实验的观察结果,包括颜色变化、形状、质地等。
铜的氧化物的实验应用和意义
应用
铜的氧化物在化工、材料科学和电子工业等领域具 有广泛的应用,如催化剂、颜料和半导体材料。
意义
对铜的氧化物进行研究有助于深入了解化学反应和 材料性质,促进科学技术的发展。
氧化反应
2
试管、试剂等。
将铜片与氧气反应,在适当条件下形成
铜的氧化物。
3
实验观察
观察铜的氧化物的颜色、形状等特征,
实验总结
4
并记录实验结果。
总结实验的目的、过程和结果,并进行 讨论和分析。
铜的氧化物的实验结果和观察
1 颜色变化
铜片与氧气反应后,铜的氧化物的颜色化物可以与其他化合 物发生多种反应,包括还原 和氧化反应。
铜的氧化物的化学式和结构
化学式
铜的氧化物的化学式由Cu和氧化合物形成,主要有 CuO和Cu2O。
结构
铜的氧化物的结构有多种形式,如矿石中的晶体结 构和粉末形式。
铜的氧化物的实验操作步骤
1
实验准备
准备所需的实验材料和设备,包括铜片、
总结和讨论
总结实验
总结铜的氧化物实验的目的、得出的结果和实验过程中的关键点。
讨论发现
讨论铜的氧化物的性质、化学式和实验结果,并与其他实验进行比较。
未来研究
探索铜的氧化物的其他性质和应用,以及实验的改进方向。
《铜的氧化物》PPT课件
欢迎大家来到本次课程的介绍。在这个课件中,我们将深入了解铜的氧化物, 包括它的性质、化学式和结构,实验操作步骤,实验结果和观察,以及实验 的应用和意义。
课题15:Cu

课题15:铜一、原子结构1、原子序数为29,位于元素周期表中第4周期、第IB族,最外层有1个电子,常见化合价有+1、+2价。
二、物理性质1、纯净的铜为紫红色,属有色金属,密度较大,熔沸点较高,具有良好延展性、导电性、导热性被广泛应用于电器元件、导线等制造。
焰色反应呈绿色。
铜与其他金属能够形成合金,铜合金的主要种类有:Cu~Sn合金称青铜,青铜是我国最早使用的合金;Cu~Zn合金称黄铜;Cu~Ni 合金称白铜。
2、铜在自然界中存在游离单质但很少,主要以化合态,常见的铜矿有辉铜矿(Cu2S)、黄铜矿(CuFeS2)、铜蓝矿(CuS)、赤铜矿(Cu2O)和孔雀石(CuCO3·Cu(OH)2)等,铜主要从黄铜矿中提炼。
三、化学性质:价态:+1(不稳定) +2(稳定)(一)、与某些非金属单质反应1、与氧气反应:2Cu + O22CuO(空气中或氧气中加热,表面变黑)。
2、与硫反应:2Cu + S Cu2S (黑色物质)3、与氯气反应:Cu + Cl2 CuCl2(棕黄色的烟)(二)、与强氧化性酸反应(非强氧化性酸不反应)1、Cu + 2H2SO4(浓)CuSO4+SO2↑+2H2O2、Cu + 4HNO3(浓) Cu(NO3)2 + 2 NO2↑ + 2H2O3、3Cu + 8HNO3(稀) 3Cu(NO3)2 + 2 NO ↑ + 4H2O(三)、与某些盐反应1、Cu + 2AgNO3Cu(NO3)2 + 2 Ag2、2FeCl3 + Cu 2FeCl2 + CuCl2(应用于印刷电路板)。
(四)、铜生锈2Cu + O2 + H2O + CO2 2(OH)2CO3铜锈(铜绿)四、冶炼1、“湿法炼铜”CuSO4+Fe4+Cu2、焦炭法 Cu(OH)2CO32CuO+CO2+H2O ;C+2CuO CO2+2Cu3、工业上采用高温冶炼黄铜矿(CuFeS2)的方法获得Cu.。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1 1 1
学习目标:
1、了解铜及其化合物的主要性质及其应用 2、了解和铜相关的化学反应原理和规律 3、形成知识网络,建构立体框架
一、建构 “铜”网
1、按照“单质—氧化物—氧化物 对应水化物—铜盐”的顺序构建 铜的转化关系 2、各小组展示转化关系图
3
一、建构 “铜”网
Cu2O
思考总结: 工业上对物质制备的基本要求?
16
实验室物质制备的基本要求:
1、原料廉价、用量少 2、污染少 3、对设备要求低 4、操作简单易行
17
在进行研究性学习的过程中,学生发现等质
量 的铜片分别与等体积均过量的浓硝酸或稀
硝酸反应,所得到溶液(体积均相同)前者
呈绿色,后者呈蓝色,针对这种现象,学生
课后作业:
1、总结本节课内容,以表格形式做在作业本上 2、完成学案相关习题
谢谢大家
4、教学必须从学习者已有的经验开始。——杜威 5、构成我们学习最大障碍的是已知的东西,而不是未知的东西。——贝尔纳 6、学习要注意到细处,不是粗枝大叶的,这样可以逐步学习摸索,找到客观规律。——徐特立 7、学习文学而懒于记诵是不成的,特别是诗。一个高中文科的学生,与其囫囵吞枣或走马观花地读十部诗集,不如仔仔细细地背诵三百首诗。——朱自清 8、一般青年的任务,尤其是共产主义青年团及其他一切组织的任务,可以用一句话来表示,就是要学习。——列宁 9、学习和研究好比爬梯子,要一步一步地往上爬,企图一脚跨上四五步,平地登天,那就必须会摔跤了。——华罗庚 10、儿童的心灵是敏感的,它是为着接受一切好的东西而敞开的。如果教师诱导儿童学习好榜样,鼓励仿效一切好的行为,那末,儿童身上的所有缺点就会没有痛苦和创伤地不觉得难受地逐渐消失。——苏霍姆林斯基
Cu2S
O2 Cu
S
O2 CuO HCl
H2
CH3CHO
CuCl2
NaOH HCl
Cu(OH)2
H2SO4 NaOH
HNO3
Cu(NO3)2
13
CuSO4
例题
按下图装置,持续通入X气体,可以看到a处有红色 物质生成,b处变蓝,c处得到刺激性气味液体,则 X气体可能是( D )(设各步反应均进行完全) A、H2 B、CO和H2 C、NH3 D、CH3CH2OH(g)
小结电化学中的“铜” 1、原电池2、电解池 来自1)电解精炼铜(2)电镀铜
22
Cu+2HCl→CuCl2+H2
阳极(铜):Cu - 2e- = Cu2+
阴极(碳):2H+ + 2e- = H2↑
通电
23
总反应:Cu+2H+=Cu2++H2↑
小结: 有 机 化 学
24
氧化还原
铜及其化合物
实 验
电化学 计算······
14
四、化学实验中的“铜”
Cu2O
Cu2S
O2 Cu
S
O2 H2
CuO
HCl
CH3CHO
CuCl2
NaOH HCl
Cu(OH)2
H2SO4 NaOH
HNO3
Cu(NO3)2
CuSO4
15
工业上用铜屑和硝酸为原料制取硝酸铜。在 实际生产中,先把铜屑在空气中灼烧,再与 硝酸反应制取硝酸铜,为什么不用铜屑直接 跟硝酸反应来制取硝酸铜?
53、希望是厄运的忠实的姐妹。 54、辛勤的蜜蜂永没有时间悲哀。 55、领导的速度决定团队的效率。 56、成功与不成功之间有时距离很短只要后者再向前几步。 57、任何的限制,都是从自己的内心开始的。 58、伟人所达到并保持着的高处,并不是一飞就到的,而是他们在同伴誉就很难挽回。 59、不要说你不会做!你是个人你就会做! 60、生活本没有导演,但我们每个人都像演员一样,为了合乎剧情而认真地表演着。 61、所谓英雄,其实是指那些无论在什么环境下都能够生存下去的人。 62、一切的一切,都是自己咎由自取。原来爱的太深,心有坠落的感觉。 63、命运不是一个机遇的问题,而是一个选择问题;它不是我们要等待的东西,而是我们要实现的东西。 64、每一个发奋努力的背后,必有加倍的赏赐。 65、再冷的石头,坐上三年也会暖。 66、淡了,散了,累了,原来的那个你呢? 67、我们的目的是什么?是胜利!不惜一切代价争取胜利! 68、一遇挫折就灰心丧气的人,永远是个失败者。而一向努力奋斗,坚韧不拔的人会走向成功。 69、在真实的生命里,每桩伟业都由信心开始,并由信心跨出第一步。 70、平凡的脚步也可以走完伟大的行程。 71、胜利,是属于最坚韧的人。 72、因害怕失败而不敢放手一搏,永远不会成功。 73、只要路是对的,就不怕路远。 74、驾驭命运的舵是奋斗。不抱有一丝幻想,不放弃一点机会,不停止一日努力。3、上帝助自助者。 24、凡事要三思,但比三思更重要的是三思而行。 25、如果你希望成功,以恒心为良友,以经验为参谋,以小心为兄弟,以希望为哨兵。 26、没有退路的时候,正是潜力发挥最大的时候。 27、没有糟糕的事情,只有糟糕的心情。 28、不为外撼,不以物移,而后可以任天下之大事。 29、打开你的手机,收到我的祝福,忘掉所有烦恼,你会幸福每秒,对着镜子笑笑,从此开心到老,想想明天美好,相信自己最好。 30、不屈不挠的奋斗是取得胜利的唯一道路。 31、生活中若没有朋友,就像生活中没有阳光一样。 32、任何业绩的质变,都来自于量变的积累。 33、空想会想出很多绝妙的主意,但却办不成任何事情。 34、不大可能的事也许今天实现,根本不可能的事也许明天会实现。 35、再长的路,一步步也能走完,再短的路,不迈开双脚也无法到达。
进行了讨论,出现两种意见:甲同学认为是
两溶液中Cu2+浓度不同引起的,
你认为
不正确 (填“正确”或“不
正确”),
18
而乙同学认为前者溶液呈绿色,是因为生成的红 棕断色 乙N同O学2溶是解否于正溶确液。中这引些起方的案,中以可下行4的个是实a验cd来(判选 填序号字母) a 加热该绿色溶液,观察颜色变化 b 加水稀释绿色溶液,观察颜色变化 c 向该绿色溶液中通入氧气,观察颜色变化 d 向饱和硝酸铜溶液中通入浓硝酸与铜反应产生 的气体,观察颜色变化
离子方程式
。
Cu2O+2H+=Cu2++Cu+H2O
11
硫酸铜溶液与碘化钾溶液反应,生成一
种能使淀粉碘化钾溶液变蓝的单质和
CuI白色沉淀,写出符合此反应的离子
方程式 2Cu2++4I-=2CuI↓+I2
。当有
0.5molCuSO4参加反应时转移电子数为
0.5NA 。
12
三、有机化学中的“铜”
Cu2O
8
铜三角
Cu
③
④
+1
+2
Cu
Cu
③ Cu2S + O2高=温 2Cu + SO2
④ H2 + CuO ∆= Cu +H2O
∆
CO + CuO = Cu + CO2
Fe + Cu2+ = Fe2+ + Cu
9
铜三角
Cu
+1
⑤
+2
Cu
⑥
Cu
10
Cu2O中加入稀硫酸,产生红色固体,
溶液变蓝色。写出Cu2O与硫酸反应的
19
五、电化学中的“铜”
Cu2S
O2 Cu
S
电解
Cl2
O2 CuO HCl
H2
Cu2O
CH3CHO
CuCl2
NaOH HCl
Cu(OH)2
H2SO4 NaOH
HNO3
Cu(NO3)2
20
CuSO4
总结电化学中的“铜”
1、要求画出相关装置图,写出电极 反应式 2、要涵盖原电池和电解质原理 3、实现铜和稀盐酸的反应
18、只要愿意学习,就一定能够学会。——列宁 19、如果学生在学校里学习的结果是使自己什么也不会创造,那他的一生永远是模仿和抄袭。——列夫·托尔斯泰
20、对所学知识内容的兴趣可能成为学习动机。——赞科夫 21、游手好闲地学习,并不比学习游手好闲好。——约翰·贝勒斯 22、读史使人明智,读诗使人灵秀,数学使人周密,自然哲学使人精邃,伦理学使人庄重,逻辑学使人善辩。——培根 23、我们在我们的劳动过程中学习思考,劳动的结果,我们认识了世界的奥妙,于是我们就真正来改变生活了。——高尔基 24、我们要振作精神,下苦功学习。下苦功,三个字,一个叫下,一个叫苦,一个叫功,一定要振作精神,下苦功。——毛泽东 25、我学习了一生,现在我还在学习,而将来,只要我还有精力,我还要学习下去。——别林斯基 13、在寻求真理的长河中,唯有学习,不断地学习,勤奋地学习,有创造性地学习,才能越重山跨峻岭。——华罗庚52、若不给自己设限,则人生中就没有限制你发挥的藩篱。
Cu2S
O2 Cu
S
O2 CuO
H2
CH3CHO
HCl
NaOH
CuCl2 HCl
Cu(OH)2
H2SO4 NaOH
HNO3
Cu(NO3)2
4
CuSO4
二、氧化还原中的“铜” ?
铜三角
5
铜三角 Cu
+1
+2
Cu
Cu
6
铜三角
Cu
①②
+1
+2
Cu
Cu
①
2Cu
+
∆
S=
Cu2S
∆
② 2Cu + O2 = 2CuO
11、学会学习的人,是非常幸福的人。——米南德 12、你们要学习思考,然后再来写作。——布瓦罗14、许多年轻人在学习音乐时学会了爱。——莱杰
