naoh化学性质
naoh密度

naoh密度
NaOH(氢氧化钠)是一种非常常见的化学物质,用于家居、工业和医
学用途。
它是一种粉末或晶体,有着极佳的溶解性和卤化性能,因此,被广泛地用于家居用品、仪器仪表和清洁用品等行业中。
一、NaOH的特性
1、性质:NaOH是一种无色结晶体或粉末,有极强的卤性、溶解度和
抗腐蚀性,易溶于水,但不溶于乙醇和乙醚;
2、熔点:NaOH在温度310℃时开始熔化,熔化后变成液态,在熔点433℃时可以蒸发干衣;
3、杂质:NaOH含有一定的杂质,包括水份、硫酸钠、氯化钾和氯化
钠等,杂质含量一般在1-6%左右;
二、NaOH的作用
1、作为碱性金属氧化缓冲剂:NaOH被铝、钢和铜等金属行业广泛用
作碱性金属氧化缓冲剂,以减少氧化过程中铁含量的增加,从而增加
金属的使用寿命;
2、作为清洗剂:NaOH具有极强的卤化性,可以用作家居用品、织物
清洗剂,能有效地去除污渍;
3、溶剂:NaOH有极好的溶解性,在医药、纺织行业中可以用作溶剂,用于搅拌、分散或解决其它问题;
4、电解剂:NaOH可以在细胞电极上形成氢氧化钠溶液,以帮助金属
合金进行电解,获得更高品质的金属;
三、NaOH的密度
NaOH的密度是1.5g/ml,NaOH的泡点为360℃,其相对密度为1.04,折光率为0.43。
NaOH在高温下容易挥发,不同于其它常温下的化学物质, NaOH的溶解度以每100g水中能溶解38.75g NaOH为最大,NaOH在水中的溶质能够在水温50℃以下小幅增长,但是水温大于50℃,NaOH的溶解度将会降低,最高溶解度为50℃时的
91.25g/100ml。
九年级氢氧化钠的知识点

九年级氢氧化钠的知识点一、化学反应中的氢氧化钠氢氧化钠(化学式:NaOH),是一种强碱,具有强烈的腐蚀性。
在化学实验中,氢氧化钠常被用作酸中和剂,也用于制造肥皂、纸浆等工业领域。
九年级化学课程中,学生通常会学习有关氢氧化钠的一些基本知识,如性质、应用以及与其他物质的反应等。
二、氢氧化钠的性质氢氧化钠是以固体形式存在,并且在室温下呈现出无色、结晶性和吸湿性。
它在溶于水时会放出大量热量,是一种强碱。
在空气中,氢氧化钠的固体形式会逐渐吸湿,并变成液态。
这是因为氢氧化钠具有吸湿性,能吸收空气中的水分。
与酸性物质相反,碱性物质可以中和酸,并能使酸和碱达到一定的平衡。
在中学化学实验中,我们通常将氢氧化钠溶液滴加到试管中的酸性物质中,这时会观察到氢氧化钠中和了酸性物质,试管中的液体变得中性或呈碱性。
三、氢氧化钠的应用氢氧化钠具有许多实际应用价值。
它常被用作工业生产中的重要原料。
比如,制造肥皂、纸浆、合成纤维等。
此外,氢氧化钠还可以被用作清洁剂,用于清洗排水管道、溶解油脂等。
因为它具有强腐蚀性,所以在使用时需要小心谨慎,并注意防护措施。
四、氢氧化钠的与其他物质的反应氢氧化钠可以与许多物质发生化学反应,产生不同的产物。
其中一种重要的反应是与酸发生中和反应。
当氢氧化钠与酸反应时,会生成氯化钠、水和二氧化碳等产物。
另外,氢氧化钠与盐酸反应时,生成氯化钠和水。
这个反应是常见的酸碱中和反应,也是氢氧化钠在实际应用中的一种常见反应。
此外,氢氧化钠还可以与硫酸反应,生成硫酸钠和水。
除了与酸反应外,氢氧化钠还可以与金属发生反应。
比如,当氢氧化钠与铝反应时,会生成铝烷和氢气。
在这个反应中,氢氧化钠起到了催化剂的作用,促使反应的进行。
总结:氢氧化钠作为一种强碱,具有强烈的腐蚀性。
在化学实验中,它被用作酸中和剂,常见于制造肥皂、纸浆、合成纤维等工业生产。
氢氧化钠与酸发生反应时能产生氯化钠、水和二氧化碳等产物。
与金属反应时,氢氧化钠能催化反应的进行。
氢氧化钠

中文名: 氢氧化钠;烧碱;火碱;苛性钠英文名: Sodium hydroxide别名: Caustic soda分子结构:分子式: NaOH分子量: 40.00物理化学性质熔点:318ºC沸点:1390ºC水溶性:可溶密度:2.13性质描述:氢氧化钠(1310-73-2)的性状:1.白色半透明块状或粒状固体,无臭。
2.熔点318.4℃,沸点1390℃,相对密度2.13。
3.易溶于水、乙醇和甘油,不溶于乙醚、丙酮。
4.在水中的溶解度:0℃为42%,20℃为109%,100℃为347%。
5.溶于水时,放出大量的热。
6.在空气中极易潮解,并吸收CO2生成碳酸钠。
7.有强碱性和很强的腐蚀性,属于毒药,1.95g可使人致死,兔经口LD50 500mg/kg。
8.ADI不限(No limited,FAO/WHO,1994)。
有强烈的腐蚀性,有吸水性,可用作干燥剂,但是,不能干燥二氧化硫、二氧化碳和氯化氢气体。
且在空气中易潮解(因吸水而溶解的现象,属于物理变化);溶于水,同时放出大量热。
其熔点为318.4℃。
除溶于水之外,氢氧化钠还易溶于乙醇、甘油;但不溶于乙醚、丙酮、液氨。
其液体是一种无色,有涩味和滑腻感的液体。
氢氧化钠在空气中可与二氧化碳反应而变质!2NaOH+CO2=Na2CO3+H2ONa元素与水反应(与水反应时,应用烧杯并在烧杯上加盖玻璃片,反应时钠块浮在水面上,熔成球状,游于水面,有"嘶嘶"的响声,并有生成物飞溅),生成强碱性NaOH溶液,并放出氢气。
固体NaOH中OH以O-H共价键结合,Na与OH以强离子键结合,溶于水其解离度近乎100%,故其水溶液呈强碱性,可使无色的酚酞试液变成红色,或使PH试纸、紫色石蕊溶液等变蓝。
纯的无水氢氧化钠为白色半透明,结晶状固体。
氢氧化钠极易溶于水,溶解度随温度的升高而增大,溶解时能放出大量的热,288K时其饱和溶液浓度可达16.4mol/L(1:1)。
九年级化学常见的碱和碱的通性

九年级化学常见的碱通性(2019年11月整理)

造商——第三仪表厂(成立于1925年),长期作为我国三大仪器仪表制造基地之一。现已 发展为中国工业自动化领域唯一同时具有系统、仪表
和执行器结构最优、系统 成套综合制造能力最强的工业IT企业,上海市高新技术企业、公开发行A、B股的 股份制上市公司。
跟非金属氧化物的反应
跟酸的反应 跟某些盐的反应
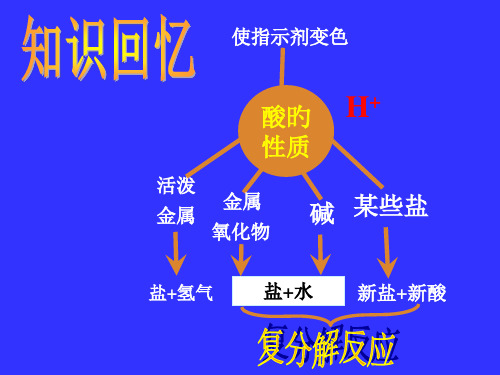
氢氧化钠跟酸类起中和反应, 生成盐和水。
2NaOH+H2SO4=Na2SO4+2H2O 2NaOH+HNO3=NaNO3+H2O
2、化学性质
跟酸碱指示剂的反应 跟非金属氧化物的反应 跟酸的反应 跟某些盐的反应
氢氧化钠跟盐类(含钠、钾或铵等的盐除 外)起反应,新碱(一般不溶于水)和新 盐。 CuSO4+2NaOH=Cu(OH)2↓+Na 2SO4 FeCl3+3NaOH=Fe(OH)3 ↓+3NaCl
④水溶液有涩味,有滑腻 感;
⑤具有强烈的腐蚀性。
在使用氢氧化钠 时必须十分小心, 防止皮肤、衣服 被它腐蚀,更应 防止溅到眼睛里。
2、化学性质
跟酸碱指示剂的反应 跟非金属氧化物的反应 跟酸的反应 跟某些盐的反应
氢氧化钠溶液能够使 紫色石蕊试液变成蓝 色,使无色的酚酞试 液变成红色。
; 上海自动化仪表三厂简称“上海自仪三厂和上海仪表三厂”是上海自动化仪表有限公司分公司 专业研发生产热电阻,热电偶,
2、化学性质
跟酸碱指示剂的反应
跟非金属氧化物的反应
跟酸的反应 跟某些盐的反应
氢氧化钠能跟非金属氧化物反 应,生成盐和水。
氢氧化钠化学性质

氢氧化钠化学性质
氢氧化钠(Sodium Hydroxide)以NaOH的形式用作日常化学工作中的碱性试剂。
它是一
种无色或淡黄色的泥状固体,在湿的情况下易溶于水,极易腐蚀性,质量分数可以高达50%,具有强碱性。
它在25℃时,水溶液密度为1.404g / ml,蒸气密度为6.51x 10-4 g / l。
氢氧化钠的化学反应极易发生,尤其是与强酸发生反应时特别活跃。
它可以与さ及Cl离
子生成氢氯化钠和氯气;与H2S(卤化氢)反应,生成Na2S和H2,也可以与二价酸生成碱性盐。
它还可以与醛(糖醛)发生反应,生成烃,也可以与二羧酸生成代醛。
此外,氢氧化钠的用途也广泛,可以用来生产高级表面活性剂、洗涤用品、防腐剂、抗病毒剂、牙膏等食品加工工业;用于医药、农药、植物激素、染料、润滑油等行业;在制作烟草、制皂等领域也有使用。
此外,它还可以用作水洗房墙壁和地面的漂白剂,用于清洗厕所和垃圾,以及其他分解有机污染物。
氢氧化钠化学性质复杂,具有多种用途。
根据其化学性质,它可用于生产食品加工、防腐剂、抗病毒剂等多种行业,也可用作清洗房间壁面或地面的漂白剂和清水剂,用于清洗厕所和垃圾,以及其他分解有机污染物。
因此,深知氢氧化钠的化学性质和用途是非常重要的,这有助于我们更好地使用它,同时防止有害冲击。
氢氧化钠的性质
加入NaOH溶 液不后反旳应现象
化学方程式
Na2CO3溶液 生成蓝色沉淀
2NaOH + CuCl2 = Cu(OH)2↓+ 2NaCl
CuCl2溶液 生成红褐色沉淀 3NaOH + FeCl3 = Fe(OH)3↓+ 3NaCl
FeCl3溶液
结论:氢氧化钠与某些盐反应,生成新碱和新盐
石灰水中通入二氧化碳有何现象? Ca(OH)2 + CO2 = CaCO3↓+H2O 【思索】NaOH溶液与CO2反应吗?
红褐色不溶于水旳碱_F_e_(O__H_)_3 __;
用烧碱(NaOH)溶液洗涤石油产品中旳残 余硫酸 2NaOH + H2SO4 = Na2SO4 + 2H2O
__3__、____C_____________________________。________________ 4、D应非_密_金_属_封_氧_保化物存反氢应氧,化生钠成固盐体和,水
为何? 因为暴露空气中
①吸水潮解, ②与空气中CO2反应变质!
氢氧化钠旳化学性质( 本课要点 )
① NaOH溶液能使酸碱指示剂变色 ② NaOH溶液能与_非__金_属__氧_化__物_反应,生成__盐__和_水___
易吸水而 白色 _潮__解_,
固体
可作 干__燥__剂_
溶解性
•易___溶于水, • 放出大量旳 • 热____
试验探究2 NaOH溶液与哪些物质发生化学反应?
试验一
2滴管
NaOH溶 液
铁丝
加入NaOH溶液后
化学方程式
旳不现反象应
铁
结论:氢氧化钠不与金属反应
应用:工业上,常用铁桶来储运烧碱
NaOH、Na2CO3、NaHCO3的性质

NaOH、Na2CO3、NaHCO3的性质一、氢氧化钠NaOH的性质氢氧化钠的俗称:烧碱、火碱、苛性钠。
(一)、物理性质白色固体,易溶于水,溶解度随温度的升高而增大,溶解时放出热量。
氢氧化钠的固体易吸收空气中的水分而潮解(物理变化)。
(二)、化学性质1、能使无色酚酞溶液变红色,使紫色石蕊溶液变蓝色。
2、能与酸溶液反应NaOH+HCl=NaCl+H2O2NaOH+H2SO4=Na2SO4+2H2ONaOH+HNO3=NaNO3+H2O3、能与某些盐溶液反应NaOH+CuSO4=Cu(OH)2↓(蓝色沉淀)+Na2SO43NaOH+FeCl3=Fe(OH)3↓(红褐色沉淀)+3NaCl2NaOH+MgCl2=Mg(OH)2↓(白色沉淀)+2NaCl4、能与酸性氧化物反应NaOH+SO2 = Na2SO3NaOH+SO3 = Na2SO4NaOH+CO2(不足)= NaHCO32NaOH+CO2(过量)= Na2CO3+H2ONaOH+SiO2 = Na2SiO3(三)、检验NaOH溶液变质的方法是什么?(区分NaOH和Na2CO3的方法) NaOH溶液长期露置在空气中会变质,且试剂瓶上会出现白色粉末。
原因:2NaOH+CO2 = Na2CO3+H2O1、酸——稀盐酸,有大量气泡产生。
Na2CO3+2HCl = 2NaCl+CO2↑+H2O2、碱——Ca(OH)2溶液,有白色沉淀生成。
Na2CO3+Ca(OH)2= CaCO3↓+2NaOH3、盐——CaCl2溶液或BaCl2溶液,有白色沉淀生成。
Na2CO3+CaCl2= CaCO3↓+2NaOHNa2CO3+BaCl2= BaCO3↓+2NaOH二、Na2CO3和NaHCO3的性质(一)、“①小苏打NaHCO3是细小的白色晶体。
②苏打Na2CO3,工业上又称为“纯碱”,白色粉末。
碳酸钠晶体带有一定量的结晶水,常见的是十水合碳酸钠(Na2CO3•10H2O)。
氢氧化钠性质

氢氧化钠性质
氢氧化钠的性质:
(1)氢氧化钠为白色半透明结晶状固体,其水溶液有涩味和滑腻感。
(2)吸水性(潮解性):氢氧化钠在空气中易潮解,故常用固体氢氧化钠做干燥剂。
但液态氢氧化钠没有吸水性。
(3)溶解性:极易溶于水,溶解时放出大量的热。
易溶于乙醇、甘油。
氢氧化钠的用途:
氢氧化钠主要用于造纸、纤维素浆粕的生产和肥皂、合成洗涤剂、合成脂肪酸的生产以及动植物油脂的精炼。
纺织印染工业用作棉布退浆剂、煮炼剂和丝光剂。
氢氧化钠用作基本试剂时,可作中和剂、配合掩蔽剂、沉淀剂、沉淀掩蔽剂、少量二氧化碳和水的吸收剂,薄层分析法测定酮固醇的显色剂等。
定义:氢氧化钠是无机化合物,化学式NaOH,也称苛性钠、烧碱、固碱、火碱、苛性苏打。
1。
氢氧化钠知识点

氢氧化钠知识点
①物理性质:氢氧化钠是一种白色固体,极易溶于水,并放出大量的热,容易吸收空气中的水而潮解。
②俗名:烧碱、火碱、苛性钠。
③化学性质:a与酸碱指示剂作用;b与非金属氧化物反应;c与酸发生中和反应;d与某些盐发生复分解反应。
④用途:化工原料,应用于肥皂、石油、造纸、纺织和印染工业,生活中可用于去油污,固体可用作干燥剂。
高二化学氢氧化钠知识点(二)氢氧化钠
(俗名:烧碱、火碱、苛性钠化学式:NaOH)
物理性质:白色固体,极易溶于水且放出大量热,有吸水性,易潮解由于氢氧化钠易潮解,称量时必须放在玻璃器皿(如烧杯、表面皿)里称量。
NaOH会吸收空气中的水分,又会跟二氧化碳反应,所以必须密封保存
用途:作中性或碱性气体的干燥剂,不能干燥二氧化硫、二氧化碳、氯化氢,
可干燥H2、O2、N2、CO、NH3 CH4等;用于肥皂、石油、造纸等工业
化学性质:(KOH的化学性质跟NaOH相同)
①二氧化碳、二氧化硫分别通入氢氧化钠溶液里(无明显现象)
CO2+2NaOH=Na2CO3+H2O SO2+2NaOH=Na2SO3+H2O SO2+2NaOH=Na2SO4+H2O。
氢氧化钠 标本

氢氧化钠标本一、氢氧化钠的定义和性质氢氧化钠(化学式:NaOH),又称苛性钠、烧碱,是一种具有极强碱性的无机化合物。
它常见的形态是固体,外观为白色结晶或颗粒状。
氢氧化钠是一种强碱,可以与酸反应并中和其酸性。
氢氧化钠的溶液也是具有强碱性的,可以迅速腐蚀许多物质,包括有机物和无机物。
它的主要性质有以下几个方面:1. 高溶解度:氢氧化钠在水中具有极高的溶解度,它能够快速且充分地溶解在水中,形成钠离子(Na+)和氢氧根离子(OH-)。
2. 强碱性:氢氧化钠是一种强碱,其溶液的pH值通常为14,可以中和和中和酸性物质,产生盐和水。
3. 腐蚀性:氢氧化钠可以腐蚀多种材料,包括金属、纸张、织物等。
在接触皮肤时,氢氧化钠会引起灼伤,严重时可导致溃疡形成。
4. 热稳定性:氢氧化钠在高温下能够稳定存在,但在较高温度下也可发生分解反应,生成氧化钠(Na2O)和水蒸气。
5. 吸湿性:氢氧化钠具有较强的吸湿性,可以吸收大量的水分并形成水合物。
因此,在保存氢氧化钠时需要注意避免与空气中的湿气接触。
二、氢氧化钠的应用1. 工业应用:氢氧化钠是化工行业中重要的原料之一,广泛用于制取肥皂、合成纤维素、造纸等工艺。
它还可用于制备硅酸钠和溴化钠等化学品。
2. 涉及生活:氢氧化钠也在生活中有广泛的应用。
例如,在清洁剂中,氢氧化钠可以去除油污和蛋白质残留;在食品加工中,氢氧化钠用于调整食品的pH值,以及清洗和去除外皮等环节。
3. 水处理:由于氢氧化钠的强碱性,它也被广泛用于水处理和污水处理过程中。
氢氧化钠可以中和酸性废水,调整水体的酸碱平衡。
4. 医药制造:氢氧化钠也被用于医药制造。
在药学中,氢氧化钠可以用作药品的中和剂和调整器,调整药物的pH值和稳定性。
5. 其他应用:此外,氢氧化钠还有一些其他应用,如农业中用作杀菌剂、电解质和电池制造等方面。
三、氢氧化钠的安全注意事项1. 避免接触皮肤:由于氢氧化钠具有强腐蚀性,不能直接接触皮肤。
在操作和储存氢氧化钠时,应佩戴适当的防护手套、护目镜和防护服。
氢氧化钠的理化性质及危险特性(表-)

氢氧化钠的理化性质及危险特性(表-)
氢氧化钠是一种常见的化学物质,也称为烧碱或苛性钠。
它的分子式为NaOH,相对分子质量为40.01.它是一种白色不
透明固体,易潮解,熔点为318.4℃,沸点为1390℃。
它易溶
于水、乙醇和甘油,但不溶于丙酮。
它可以通过吸入、食入和经皮吸收进入人体。
氢氧化钠具有强烈的刺激和腐蚀性,会引起眼睛和呼吸道的刺激,腐蚀鼻中隔,皮肤和眼睛直接接触可引起灼伤,误服可造成消化道灼伤,粘膜糜烂、出血和休克。
因此,当接触到氢氧化钠时,应立即采取急救措施。
对于皮肤接触,应立即用水冲洗至少15分钟,若有灼伤,应就医治疗。
对于眼睛接触,应立即提起眼睑,用流动清水或生理盐水冲洗至少15分钟,
或用3%硼酸溶液冲洗,然后就医。
对于吸入,应迅速脱离现
场至空气新鲜处,必要时进行人工呼吸,然后就医。
对于食入,患者清醒时应立即漱口,口服稀释的醋或柠檬汁,然后就医。
氢氧化钠不会燃烧,但遇水和水蒸气会大量放热,形成腐蚀性溶液。
它与酸发生中和反应并放热。
遇潮时对铝、锌和锡
有腐蚀性,并放出易燃易爆的氢气。
因此,在储存和运输时应注意防潮和雨淋,应与易燃或可燃物及酸类分开存放。
搬运时应轻装轻卸,防止包装和损坏。
在泄漏处理时,应隔离泄漏污染区,周围设警告标志,建议应急处理人员戴好防毒面具,穿化学防护服。
不要直接接触泄漏物,用洁清的铲子收集于干燥净洁有盖的中,以少量加入大量水中,调节至中性,再放入废水系统。
也可以用大量水冲洗,经稀释的洗水放入废水系统。
如大量泄漏,收集回收或无害处理后废弃。
氢氧化钠的理化性质和危险特性

氢氧化钠的理化性质和危险特性
氢氧化钠,化学式为NaOH,是一种无机化合物,常见的名称
为烧碱或苛性钠。
它是一种强碱,在许多工业和实验室应用中被广
泛使用。
理化性质
- 理化性质:氢氧化钠是固体,常见的形式是白色结晶。
它具
有高溶解度,能够迅速溶解在水中。
- pH值:氢氧化钠的溶液呈碱性,具有高pH值。
- 熔点和沸点:氢氧化钠的熔点约为318℃,沸点约为1390℃。
- 密度:氢氧化钠的密度约为2.13 g/cm³。
化学性质
- 可腐蚀性:氢氧化钠是一种强碱,具有强烈的腐蚀性。
它能
与许多物质发生反应,包括酸、金属和大部分非金属。
- 中和反应:氢氧化钠能被酸中和,并产生盐和水。
- 电离能力:氢氧化钠在水中能够完全电离成氢氧根离子和钠
离子。
- 吸湿性:氢氧化钠能吸湿,容易从空气中吸收水分。
危险特性
- 腐蚀性:氢氧化钠具有强烈的腐蚀性,对皮肤、眼睛和呼吸道有刺激和损伤作用。
接触氢氧化钠溶液可能导致化学灼伤。
- 毒性:直接摄入或吸入氢氧化钠溶液可能导致中毒,严重情况下可致命。
- 灼伤危险:氢氧化钠与水反应产生大量热量,可能导致灼伤和火灾危险。
- 氧化性:氢氧化钠与可燃物质接触时可能引发火灾或爆炸。
请注意,这些信息仅提供了氢氧化钠的一般性质和危险特性,具体使用中应遵循相关的安全操作指南和法规。
参考资料:
- Occupational Safety and Health Administration (OSHA). Sodium Hydroxide.。
化学实验氢氧化钠溶液的化学性质作文900字

化学实验氢氧化钠溶液的化学性
质作文900字
化学实验氢氧化钠溶液的化学性质作文900字 2
1、定义:氢氧化钠是无机化合物,化学式NaOH,也称苛性钠、烧碱、固碱、火碱、苛性苏打。
2、氢氧化钠的性质
(1)氢氧化钠为白色半透明结晶固体,其水溶液有涩味和滑腻感。
(2)吸水(潮解):氢氧化钠在空气中易潮解,所以常用固体氢氧化钠作干燥剂。
但是液体氢氧化钠没有吸水性。
(3)溶解性:极易溶于水,溶解时放出大量热量。
溶于乙醇和甘油。
3、氢氧化钠的用途
氢氧化钠主要用于造纸、纤维素纸浆生产、肥皂、合成洗涤剂、合成脂肪酸生产和动植物油精炼。
纺织工业用作棉布的退浆剂、精练剂和丝光剂。
当氢氧化钠用作碱性试剂时,可用作中和剂、匹配掩蔽剂、沉淀剂、沉淀掩蔽剂、少量二氧化碳和水的吸收剂以及薄层分析法测定酮甾醇的显色剂。
化学实验氢氧化钠溶液的化学性质作文900字 3
下列不属于氢氧化钠的物理性质的是___
A、白色固体
B、易潮解
C、易溶于水
D、强腐蚀性
答案:D
解析:氢氧化钠是白色半透明结晶状固体,在空气中易潮解,极易溶于水,腐蚀性极强,对纤维、皮肤、玻璃、陶瓷等有腐蚀作用。
其中只有强腐蚀性属于化学性质,其他均为氢氧化钠的物理性质,故答案为D。
氢氧化钠化学式

氢氧化钠(NaOH)是一种强碱性化合物,常被用于工业、实验室和家庭清洁用途中。
它的物理和化学性质如下:
物理性质:
外观:白色固体
密度:2.13 g/cm³
熔点:318℃
沸点:1388℃
溶解性:易溶于水,产生强热反应,水溶液呈碱性
化学性质:
氢氧化钠与酸反应生成相应的盐和水。
氢氧化钠是一种强还原剂,在空气中会逐渐分解释放氢气。
氢氧化钠在水溶液中呈现强碱性,可以与酸中和反应,产生热量。
俗称:
氢氧化钠有许多俗称,如苛性钠、烧碱、纯碱等。
初中化学考试中常见的氢氧化钠相关题目包括:
计算氢氧化钠溶液的浓度和配制氢氧化钠溶液的方法。
比较氢氧化钠和氢氧化铜的物理和化学性质,并阐述它们的不同之处。
在实验中,如何区分氢氧化钠和氢氧化铜?
确定氢氧化钠的化学式和摩尔质量。
举例解答:
如何计算氢氧化钠溶液的浓度?
答:氢氧化钠溶液的浓度可以用摩尔浓度或质量浓度表示。
如果已知氢氧化钠溶液的摩尔浓度和体积,则可以通过以下公式计算氢氧化钠的质量:
质量= 摩尔浓度×摩尔质量×体积
如果已知氢氧化钠溶液的质量浓度和体积,则可以通过以下公式计算氢氧化钠的质量:
质量= 质量浓度×体积。
氢氧化钠的化学式知识点

氢氧化钠的化学式知识点氢氧化钠,也称为苛性钠,是一种廉价的化学品,在化工、纺织、制药甚至制作肥皂等领域中都有着重要的用途。
下面我们来了解一下氢氧化钠的化学式相关知识。
一、氢氧化钠分子式氢氧化钠的分子式为NaOH。
它是一种由钠阳离子和羟根阴离子组成的离子化合物。
二、氢氧化钠的结构氢氧化钠是由钠离子Na+ 和氢氧根离子OH- 通过离子键结合而成的,具有离子晶体结构。
其晶体结构为立方晶系,每个Na+ 离子被八个OH- 离子包围,每个OH- 离子又被四个Na+ 离子包围,形成了无限的三维网状结构。
在固态下,NaOH是颗粒状物质,是一种无色透明晶体,但因受潮而变为白色固体。
三、氢氧化钠的制备氢氧化钠的制备通常采用电解法或氨法。
其中,电解法是用电流和钠盐水溶液进行电解反应,制备氢氧化钠。
这种方法可以实现工业化生产,但会产生大量的氢气和氯气,需要专门收集和处理。
四、氢氧化钠的性质1. 氢氧化钠是一种极易溶于水的碱性单元化合物,通常制备时需要慢慢加入水中,否则会引起剧烈反应并放出大量热量。
2. 氢氧化钠的水溶液可以将酸中和成盐,是化学实验中常用的常规试剂之一。
3. 氢氧化钠与酸类反应,产生中和反应。
例如:NaOH + HCl → NaCl + H2O氢氧化钠的中和反应是一个高度放热的反应,所产生的热能可以引发爆炸。
4. 氢氧化钠和金属反应,生成相应的氢氧化物和氢气。
例如:2NaOH + 2Al → 2NaAlO2 + H2↑5. 氢氧化钠是一种强碱,能够腐蚀多种材料。
在使用时需要注意防护措施,避免对皮肤产生伤害。
五、氢氧化钠的应用1.用于生产肥皂、合成纤维等领域,氢氧化钠是不可或缺的原料。
2.氢氧化钠是炼油工业中清除硫化氢和二氧化碳的重要原料。
3.化学物质制造过程中,氢氧化钠常用作中和剂、脱色剂、加速剂等。
4.在医学上,氢氧化钠水溶液被用作去除死皮和治疗腐蚀性伤口。
总之,氢氧化钠是一种极其重要的化合物,在工业和医疗领域都有着广泛的应用。
氢氧化钠的化学

氢氧化钠的化学
氢氧化钠为无机化合物,化学式为NaOH,它是一种强碱。
在
水中溶解时,会产生氢氧化钠溶液。
氢氧化钠的主要化学性质如下:
1. 碱性:氢氧化钠是一种强碱,能够与酸反应,产生盐和水。
它可以中和酸的酸性,使溶液的pH值升高。
2. 中和反应:氢氧化钠能够与酸反应,生成相应的盐和水。
例如,它可以与盐酸反应生成氯化钠和水的反应方程式为:NaOH + HCl → NaCl + H2O。
3. 与金属反应:氢氧化钠能够与许多金属反应,生成相应的金属氢氧化物和氢气。
例如,它可以与锌反应生成氢氧化锌和氢气的反应方程式为:2NaOH + Zn → Na2ZnO2 + H2。
4. 与酸性氧化物反应:氢氧化钠可以与酸性氧化物反应,生成相应的盐和水。
例如,它可以与二氧化碳反应生成碳酸钠和水的反应方程式为:2NaOH + CO2 → Na2CO3 + H2O。
5. 与一些有机化合物反应:氢氧化钠可以与一些有机化合物反应,例如与醇反应生成相应的醚。
这种反应叫做醇的脱水反应,反应方程式为:2NaOH + R-OH → R-O-R + 2H2O。
需要注意的是,氢氧化钠是一种强碱,具有腐蚀性,请注意安全使用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
naoh化学性质
NaOH化学名称叫氢氧化钠,俗称烧碱、火碱、苛性钠,为一种
具有很强腐蚀性的强碱。
在空气中可发生反应并冒出大量的热,具有很强的吸水性。
易溶于水,其水溶液呈强碱性,能使酚酞变红。
NaOH 具有强碱性,溶于水时放热,溶解时能使酚酞变红,具备碱的通性。
NaOH,是最常用的氢氧化钠。
但在做试卷时,经常会有人把它写成NaOH。
如果答题者用碱或中和剂来代替氢氧化钠,就是不对的,
也是不合理的。
下面我就给大家总结一下氢氧化钠的一些化学性质吧。
总结: 1、它具有强烈的腐蚀性,有很强的吸水性。
2、有很强的碱性,与酸类起中和作用而生成盐和水,能使酚酞试液变红,有很强的吸水性。
3、溶于水时放热,溶解时能使酚酞变红,具备碱的通性。
NaOH,可与空气中的二氧化碳反应生成碳酸钠、水和二氧化碳,在加热条件下也与许多金属氧化物反应,但反应速率比与二氧化碳的反应速率要慢得多。
4、还具有较强的脱水性和较弱的腐蚀性。
因此实验室制取氢氧化钠多采用电解饱和食盐水的方法。
5、常温下,它是一种白色晶体。
密度2.130g/cm3,熔点318 ℃。
沸点1390 ℃。
工业品含有少量的氯化钠和碳酸钠,是白色不透明的晶体。
有块状,片状,粒状和棒状等。
2、在隔绝空气条件下,会生成碳酸钠和水,故能与空气中的二
氧化碳发生反应。
3、固体氢氧化钠在潮湿空气中会吸收水分和二氧化碳,其溶液在阳光下可发生反应,是一种强碱。
3、浓度超过36%时,它的水溶液会形成碱性溶液,具有碱的通
性。
但是,氢氧化钠只能存在于溶液中,形成这样的溶液需要加热煮沸,所以实验室里制备氢氧化钠的方法是将浓NaOH溶液加热到沸腾,并不断搅拌,可以除去多余的水分。
然后再降温,利用蒸发皿蒸干。
再加水稀释。
将蒸发皿从水中拿出,倒扣在一支试管底部。
