第三章 化学势11990
第三章 化学势

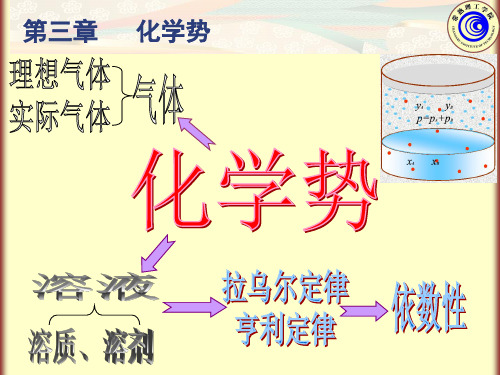
第三章 化学势§3.1 偏摩尔量(1)偏摩尔量的定义多组分系统的任一种容量性质X 可以看作是温度 T 、 压力 p 及各物质的量的函数,X = ƒ(T ,p , n B ,n C ,n D ,…)在定温定压条件下,dT=0,dp=0,则 dX = ΣX B dn BX B 称为物质B 的“偏摩尔量”。
偏摩尔量的物理意义是,在定温定压条件下,往无限大的系统中(可以看作其浓度不变)加入 1mol 物质 B 所引起的系统中某个热力学量 X 的变化,实际上是一偏微商的概念。
§ 3.2 化学势化学势的定义由于等温等压条件下吉布斯自由能的变化值课作为过程方向性的判定,也就是摩尔或偏摩尔吉布斯自由能的降低会推动过程(物质迁移或相变或化学变化)自发进行,故又称偏摩尔吉布斯自由能为化学势。
物质的化学势是决定物质传递方向和限度的强度因素,这就是化学势的物理意义。
§3.3 气体物质的化学势(1)纯组分理想气体的化学势对纯物质系统来说 G B = G mµ = µ θ+ RTln(p/ p θ)此式就是理想气体化学势表达式。
理想气体压力为p θ 时的状态称为标准态, µ θ 称为标准态化学势,它仅是温度的函数。
(2) 理想气体混合物的化学势θθμμpp ln B RT B B += 其中p B 是理想气体混合物中气体B 的分压,μθ是分压p B = p θ 时的化学势,称为气体B 的标准态化学势,它亦仅是温度T 的函数。
§3.4 理想液态混合物中物质的化学势(1)拉乌尔定律一定温度时,溶液中溶剂的蒸气压 p A 与溶剂在溶液中的物质的量分数X A 成正比,其比例系数是纯溶剂在该温度时的蒸气压 pA (上标“*”表示纯物质) ,称为“拉乌尔定律”。
用数学式可表示为p A = p A *X A此式不仅可适用于两种物质构成的溶液,亦可适用于多种物质构成的溶液。
第三章 化学势资料

2020/10/10
-- 11 --
写成一般式有: U nBUB
B
H nB HB B
A nB AB
B
S nBSB B
G nBGB B
U U B ( nB )T , p,nc (cB)
H
HB
( nB
)T
, p,nc
( c B)
A
AB
( nB
)T , p,nc (cB)
S
SB
( nB
其中:
zB
z nB
T , p,nC (CB)
zB 定T、p条件下, 往无限大的系统中(可看 作其浓度不变), 加入 1mol B组分所引起系统容量 性质的改变.
② 指定T、p条件下, 在有限量系统中, 其它组 分不变 (nC不变)的条件下, 加入无限小量 dnB 摩尔 的 B 组分所引起系统容量性质的改变.
-- 2 --
但对于多组分均相系统, 仅规定 T 和 p系统的 状态并不能确定.
100kPa、20℃时不同浓度的100g乙醇水溶液体积的实验结果。
2020/10/10
-- 3 --
从实验数据看, 溶液的体积并不等于各组分纯 态体积之和, 且体积改变随溶液浓度不同而异. 虽然 乙醇和水的 m、T、p 固定, 还必须规定系统中每种 物质的量方可确定系统的状态. 因而得出如下结论:
摩尔Helmholz自由能(molar Helmholz free energy)
A* m ,B
A nB
摩尔Gibbs 自由能(molar Gibbs free energy)
G* m ,B
G nB
这些摩尔热力学函数值都是强度性质。
2020/10/10
第三章化学势效果

K
å 恒温恒压时:dG = midni
i= 1
2019/9/17
长江大学化工学院
7
三. 化学势
结论:以偏摩尔吉布斯函数(自由能)定义
的化学势(mi)表示定温定压下,在无限大量的 体系中加入1moli物质时,所引起的体系的布斯函数 (自由能)的增加值
化学势(mi)的其它定义
K
å dG = - SdT + VdP+ midni
i= 1
U = f (S ,V , n1, n2 ,...nK )
å 抖U
U
K ?U
\ dU = ( 抖S )V ,nK dS + ( V )S ,nK dV + i= 1 ( ? ni )S ,V ,n j¹ i dni ......(4)
对比(3)和(4)得
¶U mi = ( ¶ ni )S ,V ,n j¹ i
又
对纯组份理想气体来说:Gm =
m; V m =
RT P
蝌 \
m
dm=
P RT dP ? m
mq (T ) + R T ln P
mq
P P q
Pq
讨 论 : 规 定 理 想 气 体 的 压 力 为 P q (1 0 5 P a )时 的 状 态
为它的标准态,此状态下物质的化学势称为
标 准 态 的 化 学 势 mq (T )
åK ¶ G
dG
=
-
SdT
+
VdP +
i= 1
( ¶ ni )T ,P ,n j¹ i dni
2019/9/17
长江大学化工学院
6
三. 化学势
将偏摩尔吉布斯函数(自由能)定义为第i种物质
第三章化学势

H2O 1mol H2O (l) + 1mol H2O (l) Vm*水= 18.09 cm3·mol–1 V*= nVm*水= 36.18 cm3
58.35 cm3
C2H5OH
58.35
cm3
=
116.70 cm3
C2H5OH
C2H5OH 1mol C2H5OH(l)+ 1mol C2H5OH(l) Vm*乙醇 = 58.35 cm3·mol-1 V*= nVm*乙醇 = 116.70 cm3
⎛ ∂X ⎛ ∂X ⎞ dX = ⎜ ⎟ dT + ⎜ ⎜ ∂p ⎝ ∂T ⎠ p ,nk ⎝ ⎛ ∂X ⎞ ⎛ ∂X ⎞ ⎞ ⎟ dp + ⎜ dn1 + ⎜ dn2 + ⋅ ⋅ ⋅ ⎟ ⎜ ∂n ⎟ ⎟ ⎜ ∂n ⎟ ⎟ ⎠T , nk ⎝ 1 ⎠T , p , n j ⎝ 2 ⎠T , p , n j
第三章化学势
p/Pa
p = kx,B xB 服从Henry定律
R
p + ρ gh
p
h
W
p+P
稀溶液
纯B
纯溶剂
* pB = pB xB
* μA
μA
半透膜
A
实际曲线 xA xB
B
引言
多组分系统 两种或两种以上的物质(或称为组分)所形 成的系统称为多组分系统。 多组分系统可以是均相的,也可以是多相的。 混合物(mixture) 各组分均可选用相同的方法处理, 有相同的标 准态, 遵守相同的经验定律, 这种系统称为混合物。 混合物有气态、液态和固态之分
′ =0 设有反应 2SO2 + O2 ⎯T , P,W⎯→ 2SO3 ⎯⎯
− 2dn − dn
大学物理化学第三章 化学势

集合公式: 集合公式:
G = ∑ nB µ B = nA µ A + nB µ B (二元体系)
回主目录
上一内容
下一内容
返回
2011-8-11
二、多组分体系的基本关系式
1. dG = − SdT + Vdp 等基本关系式只适用于组成不变的封闭系统 的过程(双变量体系)。 中 W ' = 0 的过程(双变量体系)。 2.对组成可变的封闭系统中 的过程,基本关系式如何表示? 2.对组成可变的封闭系统中 W ' = 0 的过程,基本关系式如何表示? 对多组分均相系统, 对多组分均相系统,令:G = f (T, p, nB, nC,···)
X = X (T , p, nB , nC , nD …)
∂X ∂X ∂X dX = dT + dp + dnB ∂T p , nB , nC … ∂p T , nB , nC … ∂nB T , p , nC , nD…
物理化学(第四版)课件印永嘉等编第3章化学势

表面吸附与化学势的变化
当物质被吸附到界面上时,其化学势 会发生变化,这种变化会影响物质在 界面上的吸附量和吸附状态。
通过研究物质在界面上的吸附和反应 过程中化学势的变化,可以深入了解 这些过程的机理和动力学特征。
对于理想气体,化学势的变化与温度、 压力和物质的量有关;对于液态和固 态物质,还与物质的聚集状态和表面 结构有关。
理等计算溶质的活度和浓度。
溶液的化学势
溶液的化学势是描述溶质在溶液 中的能量状态的参数,可以通过 热力学基本定律和化学反应平衡 常数等计算溶质的活度和浓度。
ห้องสมุดไป่ตู้3 化学势在化学平衡中的应 用
化学平衡的条件与判据
化学平衡条件
在一定温度和压力下,化学反应 达到平衡状态时,正反应和逆反 应速率相等,且各组分浓度保持 不变。
界面
物质的不同聚集状态(固 态、液态、气态)之间接 触的表面。
界面化学
研究物质在界面上的吸附、 反应和传递等现象的化学 分支。
界面张力
液体表面抵抗形变的能力, 与表面分子或离子的排列 紧密程度有关。
界面张力与化学势的关系
化学势与界面张力在数值上存在一定的关系,通常界面张力越低,化学势越高。
在一定温度和压力条件下,物质在界面上的吸附和反应往往受化学势和界面张力的 共同影响。
物理化学(第四版)课件印永嘉等编 第3章化学势
目 录
• 化学势的定义与意义 • 化学势的计算方法 • 化学势在化学平衡中的应用 • 化学势在相平衡中的应用 • 化学势在界面化学中的应用
01 化学势的定义与意义
化学势的定义
化学势定义为在等温、等压条件 下,物质在某特定相中的吉布斯 自由能与该物质在标准态下的吉
第3章 化学势
pB = p x
* B B
( xB = 0 → 1)
微观结构: •各组分分子体积、结构彼此相似。 •各组分分子间作用力相同。FAA=FBB=FAB •在混合时没有热效应和体积变化。
Δmix H = 0,ΔmixV = 0
•光学异构体、同位素、立体异构体、紧邻同系 物混合物属于这种类型。
3、理想液态混合物中物质的化学势
气液两相达平衡时,
pB g, pA, pB µB (sln) = µB (g) = µ ( g ) + RT ln Θ p * pB xB l, xA, xB = µΘ ( g ) + RT ln Θ B p * pB = µΘ ( g ) + RT ln Θ + RT ln xB B p
( ∆G )T,p ≤ 0
( ∆G )T,p > W '
<表示自发 = 表示平衡 >表示不自发 不可能发生
定T、定p,W’=0时,
∑ µ dn
B
B
≤0
<表示自发 = 表示平衡
化学势是决定一切物质传递方向和限度的最普 化学势是决定一切物质传递方向和限度的最普 一切物质传递方向和限度的 遍的强度因素 强度因素。 遍的强度因素。
∂G GB = ∂nB T , p ,nC (C ≠ B)
偏摩尔内能:
偏摩尔焓:
偏摩尔吉布斯 自由能:
§3.1 偏摩尔量
偏摩尔量集合公式
dnA 定T、定p下混合A、B 两物质,保持 nA nB dnB
dnA : dnB = nA : nB
则,dX = X A dnA + X BdnB ,且XA、XB为常数。 积分:
Gm p
第三章 化学势

VB
§3.2 化 学 势
(
化学势与温度的关系 B G
T ) p ,nB ,nc [ (
= SB
( S ) [ ]T , p ,nc nB
)T , p ,nc ] p ,nB ,nc [ ( G ) p , nB , nc ]T , p , nc T nB nB T
第三章 化学势
教 学 内 容
§3.1 偏摩尔量 §3.2 化学势 §3.3 气体物质的化学势
§3.4 理想溶液中物质的化学势
§3.5 稀溶液中物质的化学势
§3.6 不挥发性溶质稀溶液的依数性
§3.7 非理想溶液中物质的化学势
物理化学 第三章 化学势 宁夏大学新华学院
多组分系统 均相 多相 两种或两种以上的物质(或称为组分)所形成的系统
1mol H2O(l)+1mol H2O(l)
* 1 (纯水的摩尔体积) Vm, 18.09 ml mol 水
V nV
*
* m,水
2 18.09 36.18ml
化学势 宁夏大学新华学院
物理化学
第三章
§3.1 偏摩尔量 58.35ml
116.70ml
58.35ml
1mol C2H5OH(l)+1mol C2H5OH(l)
def * m ,B
def * m ,B
def * m ,B
A
def * m ,B
* * * * * Vm,B U m,B H m,B S m,B Gm,B
* Am,B 是强度性质
物理化学
第三章
化学势
宁夏大学新华学院
§3.1 偏摩尔量
物理化学(印永嘉)-第三章-化学势

(3)化学势在化学平衡中的应用
对任一化学反应
§3.3 气体物质的化学势
(1)纯组分理想气体的化学势
对纯物质系统来说, GB = Gm 一定温度下 dGm=Vmdp 若在标准压力p和任意压力p之间积分上式,
Gm(p)-Gm(p) = RTln(p/ p)
µ= µ + RTln(p/ p)
pA pA* xA
如果溶液中只有A,B两个组分,则 xA xB 1
pA
p* A
(1
xB )
p*A pA pA*
xB
拉乌尔定律也可表示为:溶剂蒸气压的降低值与纯
溶剂蒸气压之比等于溶质的摩尔分数。
§3.4 理想液态混合物中物质的化学势
例题:298K时纯CHCl3和纯CCl4的饱和蒸汽压分 别为 2.64×104Pa和1.527×104Pa,若两者形成 理想液态混合物,并由CHCl3和CCl4各为1.00mol 混合而成。 计算 ⑴与溶液呈平衡的气相组成;
⑵ 溶液的总蒸汽压。
例题
解(1)由拉乌尔定律得:
pCHCl3
p x * CHCl3 CHCl3
2.654104 Pa 0.5 1.327104Pa
p =p x CCl4
* CCl4 CCl4
1.527104 Pa 0.5 7.635103Pa
由分压定律得:
p pCHCl3 pCCl 4
yCHCl3 pCHCl3 1.327 104 / 7.635103 1.734
f f*
(3) 实际气体的化学势—逸度的概念
根据题中所给的状态方程
积分
Vm
RT p
由于p*→0,所以dGαm(p V–mpd*p)≈αpRp,T dp
第3章_化学势

slope T , p ,n j
V
ni
19
三、偏摩尔量的集合公式
一系统如图:其偏摩尔体积 分别为VA ,VB 则 ( )T,p
dV=VAdnA+VBdnB 如果由纯物质A(nA), B(nB)配置该系统: 连续 加入A和B,并保持系统组成不变, 即 dnA : dnB = nA : nB 则 V =∫dV=? nA +nB
A Ai ni
iB
k
k
A Ai n i T , p , n j ( j i )
def
S S i ni
iB
S Si n i
def
def
T , p , n j ( j i )
G Gi ni
iB
3
混合物(mixture) 多组分均匀系统中,各组分均可选用相同的方 法处理,有相同的标准态,遵守相同的经验定律, 这种系统称为混合物。 混合物有气相、液相和固相之分。 溶液(solution) 含有一种以上组分的液体相或固体相称之。溶 液有液态溶液和固态溶液之分,但没有气态溶液。 如果组成溶液的物质有不同的状态,通常将液 态物质称为溶剂,气态或固态物质称为溶质。
V V )T , p ,ncB ( )T , p ,ncB 解: VB ( nB m
以m = 0.25 molkg-1和m = 0.50 molkg-1代入,分 别得到在两种浓度时NaBr的偏摩尔体积 。
1 3 23.189 2.197m 2 2 0.178m 2
4
如果都具有相同状态,则把含量多的一种称为 溶剂,含量少的称为溶质。 溶剂和溶质要用不同方法处理,他们的标准态、 化学势的表示式不同,服从不同的经验定律。 溶质有电解质和非电解质之分,本章主要讨 论非电介质所形成的溶液。 如果在溶液中含溶质很少,这种溶液称为稀溶 液,常用符号“∞”表示。 多种气体混合在一起,因混合非常均匀,称为 气态混合物,而不作为气态溶液处理。
3章+化学势

自发过程 平衡,可逆 非自发过程
变量系统。
U=U(S,V); H=H(S,p) ; A=F(T,V); G=G(T,p)
dU = TdS - pdV
dA = -SdT – pdV
dH = TdS +Vdp
dG = -SdT +Vdp
当然,这些热力学基本方程还适用于组成变化 的可逆过程:可逆的相变化和化学变化。
对于组成不定的封闭体系,两个状态函数能确 定系统的状态吗?
引言
溶液(solution)
广义地说,两种或两种以上物质彼此以分子或离
子状态均匀混合所形成的系统称为溶液。 溶液可分为气态溶液、固态溶液和液态溶液。根 据溶液中溶质的导电性又可分为电解质溶液和非电
解质溶液。
本章主要讨论液态的非电解质溶液。
2013-8-12
引言
溶剂(solvent)和溶质(solute) 如果组成溶液的物质原来有不同的状态,通常将
mB
def nB
mA
溶质B的物质的量与溶剂A的质量之比称为溶 质B的质量摩尔浓度,单位是 。这个表示方法 mol kg -1 的优点是可以用准确的称重法来配制溶液,不受 温度影响,电化学中用的很多。
2013-8-12
复习: 多组分系统组成的表示法
3.物质的量浓度cB(molarity)
cB
def
2013-8-12
复习:多组分系统组成的表示法
1.物质的量分数 xB (mole fraction)
xB
def
nB n (总 )
溶质B的物质的量与溶液中总的物质的量之比 称为溶质B的物质的量分数,又称为摩尔分数,单 位为1。
2013-8-12
复习: 多组分系统组成的表示法
物化——化学势

T,PB*
pi pxi
T 是温度T时第i种物质的标准化学势。
p i T RT ln RT ln xi p
i
* i
也就是其分压等于标准压力 p 的状态
i* T , p
T , p 是第i种物质在指定T ,p时的化学势
(3)实际气体的化学势——逸度的概念
p pA p (1 xA )
1 xA xB
pA p pA p x
A
A B
(2)理想液态混合物的定义
理想液态混合物: 溶液的任一组分在整个浓度 范围内 都严格服从拉乌尔定律的溶液。
k
上式称为多组分均相系统中偏摩尔量的集 合公式。
结论:在等T、p条件下, 多组分均相系统的 广度性质的状态函数等于该系统各组分的偏 摩尔量与物质的量的乘积之和。
1.2 mol A物质和3 mol B物质在等温、等压下,混 合形成理想液态混合物,该系统中A和B的偏摩尔体 积分别为1.79×10-5 m3mol-1,2.15×10-5 m3mol-1 , 则混合物的总体积为 (A) 9.67×10-5 m3 (C) 1.003×10-4 m3 (B) 9.85×10-5 m3 (D) 8.95×10-5 m3
∴
B ( ) B ( )
多组分系统多相平衡的条件:温度,压力,化学势
(3)化学势在化学平衡中的应用
2SO2 O2 2SO3
dG B dnB 2 (SO3 )dn 2 (SO2 )dn (O2 )dn
[2 (SO3 ) 2 (SO2 ) (O2 )]dn
§4.3 气体物质的化学势
(1)纯组分理想气体的化学势
对于纯物质,化学势就等于该物质在纯态 时的摩尔吉布斯自由能。
第3章 化学势

∑
k
k
i =1 =1
X i ni
G =
∑Gn
i =1 i
i
偏摩尔量
化学势
(g)
溶液
(sln)
依数性
非理想溶液
习题课
7
X =
注意: 注意:
∑
k
i =1
X i ni
G =
∑Gn
i =1 i
k
i
1.只有容量性质有偏摩尔量; .只有容量性质有偏摩尔量; 2.必须是等温等压条件; .必须是等温等压条件; 3.偏摩尔量本身是强度性质; 3.偏摩尔量本身是强度性质; 4.偏摩尔量除了与 p有关外,还与浓度有关; 有关外, .偏摩尔量除了与T, 有关外 还与浓度有关; 5. 单组分系统 i =Xm(Vi =Vm , Gi =Gm) 单组分系统X
偏摩尔量
化学势
(g)
溶液
(sln)
依数性
非理想溶液
习题课
20
实际溶液中溶质的蒸气压
H. L. pB = Kh,x xB R. L. pB = pB xB Kh,x > pB* p B
pB
当(xB →1)
当(xB →0) 0
Kh,x<pB*
xB
1
偏摩尔量
化学势
(g)
溶液
(sln)
依数性
非理想溶液
习题课
偏摩尔量
化学势
(g)
溶液
(sln)
依数性
非理想溶液
习题课
6
∫
V
0
dV = V A ∫
nA
0
dn A + VB ∫
nB
0
dn B
03章_化学势

ZB
=
Z B ,m
=
( Z n
)T
,P
对多组分体系: Z B ≠ Z B,m
Z ( nB
)T ,P,nC B
≠( Z n
)T ,P
偏摩尔量 摩尔量
3.1偏摩尔量
五.偏摩尔量的集合公式
设一个均相体系由1、2、 、k个组分组成,则体 系任一容量性质Z应是T,p及各组分物质的量的函数,
第三章 化学势
课程内容
3.1 偏摩尔量
3.2 化学势
3.3 气体物质的化学势
3.4 理想溶液中溶质的化学式势 3.5 稀溶液中溶质的化学势
3.6 稀溶液的依数性
3.8 非理想溶液.
本本次次课课内内容容
3.1 偏摩尔量 3.2 化学势
重点与难点:
•偏摩尔量的定义 •偏摩尔量的集合公式
3.1偏摩尔量
一.几个基本概念
1.溶液(solution) 广义地说,两种或两种以上物质彼此以分子或
离子状态均匀混合所形成的体系称为溶液。
溶液以物态可分为气态溶液、固态溶液和液态 溶液。根据溶液中溶质的导电性又可分为电解质溶 液和非电解质溶液。
本章主要讨论液态的非电解质溶液。
3.1偏摩尔量
2.溶剂(solvent)和溶质(solute) 如果组成溶液的物质有不同的状态,通常将液
物质的化学势是决定物质传递方向和限度的强度
因素,这就是化学势的物理意义。(等T , p,W ' 0)
3.2 化学势
四、化学势决定传质过程的方向和限度
1. 传质过程:物质流动,扩散(混合),相变,化学反应
2. 以相变为例:
系统:α+β;等 T, P,W’=0
第三章化学势

对于多组分系统,仅仅规定温度和压力是不能确定系统的 状态的,还必须确定各组分的物质的量。
举例:乙醇和水
200 C
101 . 325 kPa
n 物质的量: n A B
体积:
* Am, A
n n — 不变 A B
n V n V V — 变化
* Bm, B
2、偏摩尔量的定义
多组分系统的任一种容量性质X(X可分别代表V,U,H,S,A,G等),可以 看作是温度T,压力p和各物质的量ni的函数。
d G n id i
n 通过这个式子可知, id i 0时,过程为自发过程。
d n 0 时,过程即达到平衡。
i i
化学势的物理意义:化学势决定物质传递方向和限度的强 度因素(化学势由高向低自发进行)
化学势的广义定义:
i
def
U ni S ,V ,n j
对于封闭体系,单组分系统容量性质的热力 学函数X(v,U,H,S,A,G)都可以表示为: X=f(T,P)
单组分系统的广度性质具有加和性
若1 mol单组分B 物质的体积为 则2 mol单组分B 物质的体积为
V*m,B
2 V
* m,B
* * * V 1 m o l V 1 m o l V 2 m o l V m , B m , B m , B
如果系统由A和B两种组分组成,它们的物质的量分别为nA 和nB,在定温定压下往系统中加入dnA和dnB的A和B时,系 统的某个容量性质X的变化可表示为:
d X X d n X d n A A B B
如果连续不断地向系统中加入dnA和dnB,且保持初始比例, 则上式可积分为:
X X dX dn dn
第三章 化学势

n1 X1 n2 X 2 nk X k
X = nB X B
B=1
k
偏摩尔量的集合公式
4
偏摩尔量的集合公式,说明系统的总的容量性质 等于各组分偏摩尔量的加和。
例如:系统只有两个组分,其物质的量和偏摩尔 体积分别为 n1 ,V1 和 n2 ,V2 ,则系统的总体积为:
*
pg RT ln p
p
这是理想气体化学势的表达式。化学势是T,p的
$ (g) 是温度为T,压力为标准压力时理想气 函数。
体的化学势,这个状态就是气体的标准态。
20
真实气体混合物中任一组分的化学势类似可得:
B g B g RT ln pB p B g RT p V dp
23
例题
解(1)由拉乌尔定律得: * pCHCl3 pCHCl3 xCHCl3 2.654 104 Pa 0.5 1.327 104 Pa 由分压定律得:
yCHCl3 1 yCHCl3 pCHCl3 pCCl4
p pCHCl 3 pCCl 4
* pCCl4 =pCCl4 xCCl4 1.527 104Pa 0.5 7.635 103Pa
2. 享利定律
亨利定律(Henry’s Law) 1803年英国化学家Henry根据实验总结出另一条经 验定律:在一定温度和平衡状态下,气体在液体里 的溶解度(用物质的量分数xB表示)与该气体的平 衡分压pB成正比。用公式表示为:
pB k x ,B xB
或
xB pB / k x ,B
式中 k x 称为亨利定律常数,其数值与温度、压力、 溶剂和溶质的性质有关。若浓度的表示方法不同, 则其值亦不等,即:
物理化学第3章

∂H H= nB HB B H = ∑ ∂nB T , p,n B C≠B
k
∂S S= nB SB B S = ∑ ∂nB T , p,n B C≠B
k
∂G G= nBGB B G = ∑ ∂nB T , p,n B C≠B
∂X ∂X ∂X ∂X dX = dT+ dp+ dn + dn + ... B C ∂p ∂n ∂T p,nB ,nCL ∂nC T, p,n ,n L T,nB ,nCL B T, p,nC ,nDL B D
k
首
页
上一页
下一页
末 页
12
§3.1 偏摩尔量
P90/习题 :25°C和标准压力下,有一物质的量的分数 的甲醇水 习题1: ° 和标准压力下 有一物质的量的分数0.4的甲醇水 和标准压力下, 习题 混合物。 如果往大量的此混合物中加1mol水, 混合物的体积增加 混合物 。 如果往大量的此混合物中加 水 17.35cm3 ; 如果往大量的此混合物中加 如果往大量的此混合物中加1mol甲醇 , 混合物的体积 甲醇, 甲醇 增加39.01cm3。试计算将 试计算将0.4mol甲醇和 甲醇和0.6mol水混合时,此混合物 水混合时, 增加 甲醇和 水混合时 的体积为若干? 此混合过程体积变化了多少? 的体积为若干 ? 此混合过程体积变化了多少 ? 已知此条件下甲醇 的密度为0.7911g·cm-3,水的密度为 水的密度为0.9917g·cm-3。 的密度为 偏摩尔体积V V甲醇=39.01cm3 解:(1)偏摩尔体积 H2O=17.35cm3 偏摩尔体积
首 页 上一页 下一页 末 页
物理化学习题 第三章 化学势

物理化学习题第三章化学势物理化学习题第三章化学势第三章化学势一.基本要求1.了解混合物的特性,熟悉多组分体系中各种组分的表示。
2.掌握偏摩尔量的定义、偏摩尔量的加法公式及其应用。
3.掌握化学势的狭义定义,知道化学势在相变和化学变化中的应用。
4.掌握理想气体化学势的表示式,了解气体标准态的含义。
5.掌握鲁尔特定律和亨利定律的含义和用法,了解它们的适用条件和区别。
6.了解理想液态混合物的通性及化学势的表示方法,了解理想稀溶液中各组分化学势的表示法。
7.理解相对活度的概念,知道如何描述溶剂的非理想度,以及如何描述不同浓度下表示的溶质的非理想度。
8.掌握稀溶液的依数性,会利用依数性来计算未知物的摩尔质量。
二.把握学习要点的建议混合物是多组分体系的一种特殊形式。
所有成分平等共存,遵循相同的经验法则(即劳尔定律),因此处理起来相对简单。
一般来说,先掌握混合物的处理方法,然后扩展到溶剂和溶质的处理方法。
首先是理想状态,然后扩展到非理想状态。
偏摩尔量的定义和化学势的定义有相似之处,都是热力学的容量性质在一定的条件下,对任一物质b的物质的量的偏微分。
但两者有本质的区别,主要体现在“一定的条件下”,即偏微分的下标上,这一点初学者很容易混淆,所以在学习时一定要注意它们的区别。
偏摩尔量的下标是等温、等压和保持除b以外的其他组成不变(c?b)。
化学势的下标是保持热力学函数的两个特征变量和保持除b以外的其他组成不变。
唯独偏摩尔gibbs自由能与狭义化学势是一回事,因为gibbs自由能的特征变量是t,p,偏摩尔量的下标与化学势定义式的下标刚好相同。
多组分体系的热力学基本公式在最后比之前的常组分封闭体系的热力学基本公式多了一项。
该项表示因材料DNB量的变化而引起的相应热力学函数值的变化。
最后一项的化学势?B是一个常数,表明DNB的变化不是任意的,在数量一定的系统中只发生了dnb的变化,或在数量很大的系统中改变了1mol,这样才能维持?b不变。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第三章化学势一、单选题1.二元溶液,B组分的亨利系数等于同温度纯B的蒸汽压。
按Raoult定律定义活度系数()(A)f A > f B (B) f A = f B = 1 (C) f B > f A(D) f A f B 12.两液体的饱和蒸汽压分别为p*A,p*B,它们混合形成理想溶液,液相组成为x,气相组成为y,若p*A > p*B ,则:()(A) y A > x A (B) y A > y B(C) x A > y A(D) y B > y A3.关于亨利系数,下列说法中正确的是:( )(A) 其值与温度、浓度和压力有关(B) 其值与温度、溶质性质和浓度有关(C) 其值与温度、溶剂性质和浓度有关(D)其值与温度、溶质和溶剂性质及浓度的标度有关4.已知373K时液体A的饱和蒸气压为133.24kPa,液体B的饱和蒸气压为66.62kPa。
设A和B形成理想溶液,当溶液中A的物质的量分数为0.5时,在气相中A的物质的分数为:( )(A) 1 (B) 1/2 (C) 2/3 (D) 1/35.298K时,HCl(g,Mr=36.5)溶解在甲苯中的亨利常数为245 kPa·kg·mol-1,则质量分数达2%的HCl-甲苯溶液中HCl(g)的平衡压力为:( )(A) 138kPa (B) 11.99kPa (C) 4.9kPa (D) 49kPa6. 下列说法中正确的是:( )(1) 溶液的化学势等于溶液中各组分的化学势之和(2) 对于纯组分,则化学势等于其Gibbs自由能(3) 理想溶液各组分在其全部浓度范围内服从Henry定律(4) 理想溶液各组分在其全部浓度范围内服从Raoult定律A. (1) (2)B. (2) (3)C. (2) (4)D. (3) (4)7.真实气体的标准态是:( )(A) f = p的真实气体(B) p = p的真实气体(C) f = p的理想气体(D) p = p的理想气体8. 关于偏摩尔量, 下面的说法中正确的是( )A.偏摩尔量的绝对值都可求算B. 系统的容量性质才有偏摩尔量C.同一系统的各个偏摩尔量之间彼此无关D.没有热力学过程就没有偏摩尔量9. 关于理想溶液,下列说法不正确的是:()A.组成理想溶液的几种物质,化学结构和物理性能十分接近;B.理想溶液中各种微粒间的相互作用力可忽略不计;C.理想溶液中各种物质的分子从溶液中逸出难易程度和纯态一样;D. 恒温恒压下,在由纯组分组成理想溶液的过程中既不吸热,也不放热。
10. 在298K、p下,两瓶含萘的苯溶液,第一瓶为2dm3(溶有0.5mol萘),第二瓶为1dm3(溶有0.25mol萘),若以μ1和μ2 分别表示两瓶中萘的化学势,则( )(A) μ1 = 10μ2(B) μ1 = 2μ2 (C) μ1 = 1/2μ2 (D) μ1 = μ211、挥发性溶质溶于溶剂形成的稀溶液,溶液的沸点会:()(A) 降低(B)升高(C)不变(D)可能升高或降低12、下述说法中,正确的是:(1) 自然界中,风总是从化学势高的地域吹向化学势低的地域(2) 自然界中,水总是从化学势高的地方流向化学势低的地方(A) (1) (B) (2) (C) (1) 和(2) (D) 都不对13. 2mol A 物质和3mol B 物质在等温等压下混和形成液体混合物,该系统中A 和B 的偏摩尔体积分别为1.79 10-5 m 3·mol -1, 2.1510-5 m 3·mol -1, 则混合物的总体积为: ( ) (A) 9.6710-5m 3 (B) 9.8510-5m 3 (C) 1.00310-4m 3 (D) 8.9510-5m 314.主要决定于溶解在溶液中粒子的数目,而不决定于这些粒子的性质的特性叫 ( )(A) 一般特性 (B) 依数性特征 (C) 各向同性特征 (D) 等电子特性15.已知水在正常冰点时的摩尔熔化热fus H m =6025J·mol -1,某理想水溶液的凝固点为258.15K, 该溶液的浓度x B 为: ( )(A) 0.8571 (B) 0.1429 (C) 0.9353 (D) 0.064716.已知水在正常沸点时的气化热为40.67kJ·mol -1,某不挥发性物质B 溶于水中,其沸点升高了10K ,则该物质B 在溶液中的物质的量分数为: ( )(A) 0.290 (B) 0.710 (C) 0.530 (D) 0.46717. 下面对标准态的理解中,正确的是( )A 、标准态就是273.15K ,100KPa 下的状态B 、标准态就是不能实现的假想状态C 、标准态就是活度等于1的状态D 、标准态就是人为规定的某些特定状态18.两只各装有1kg 水的烧杯,一只溶有0.01mol 蔗糖,另一只溶有0.01molNaCl ,按同样速度降温冷却,则: ( )(A) 溶有蔗糖的杯子先结冰 (B) 两杯同时结冰(C) 溶有NaCl 的杯子先结冰 (D) 视外压而定19.沸点升高,说明在溶剂中加入非挥发性溶质后,该溶剂的化学势比纯剂的化学势:( )(A) 升高 (C) 相等 (B) 降低 (D) 不确定20.液体B 比液体A 易于挥发,在一定温度下向纯A 液体中加入少量纯B 液体形成稀溶液,下列几种说法中正确的是: ( )(A) 该溶液的饱和蒸气压必高于同温度下纯液体A 的饱和蒸气压。
(B) 该液体的沸点必低于相同压力下纯液体A 的沸点。
(C) 该液体的凝固点必低于相同压力下纯液体A 的凝固点(溶液凝固时析出纯固态A)。
(D) 该溶液的渗透压为负值。
21.在288K 时H 2O(l)的饱和蒸气压为1702Pa,0.6mol 的不挥发性溶质B 溶于0.540kg H 2O 时,蒸气压下降42Pa ,溶液中H 2O 的活度系数f 应该为: ( )(A) 0.9804 (B) 0.9753 (C) 1.005 (D) 0.994822.在300K 时,液体A 与B 部分互溶形成 和 两个平衡相,在 相中A 的摩尔分数为0.85,纯A 的饱和蒸气压是22kPa ,在 相中B 的摩尔分数为0.89,将两层液相视为稀溶液,则A 的亨利常数为: ( )(A) 25.88kPa (B) 200kPa (C) 170kPa (D) 721.2kPa23) 在α,β两种相中均含有A 和B 两种物质,当达到平衡时,下列种哪情况是正确的:( )A.μA α = μB αB.μA α = μA βC.μA α =μB βD. μA β = μB β24) 以下定律中不属于稀溶液依数性的是( ).A.亨利定律;B.沸点升高定律;C.凝固点下降定律;D.渗透压定律.25) 在273.15K,2p 时,水的化学势与冰的化学势之间的关系如何:( )A. 前者高B. 前者低C. 相等D. 不可比较26、B ,C 二组分溶液中组分B 的偏摩尔吉布斯函数:G B =(),,(/)B C C B T P nG n ≠∂∂因此有:( )。
A. G B 与T ,p ,n C 有关,与n B 无关;B. G B 与T ,p ,n C ,n B 都有关;C. G B 与n B 有关,与T ,p ,n C 无关;D. G B 与n B ,n C 有关,与T ,p 无关。
27、在拉乌尔定律表达式 p B =p B *x B 中,p B * :( )。
A.只是温度的函数,与溶质、溶剂的性质无关 B 与溶质、溶剂的性质有关,但与温度无关;C.与温度、溶剂性质有关,与溶质性质无关;D.与温度、溶质的性质有关,与溶剂性质无关。
28、溶液内任一组分的偏摩尔体积A. 等于1mol此组分在溶液中所占的体积B. 总是正值C.可能是正值,也可能是负值D. 必然和纯组分的摩尔体积相等29、在20℃和大气压力下,用凝固点降低法测物质的相对分子质量。
若所选的纯溶剂是苯,其正常凝固点为5.5℃,为使冷却过程在比较接近于平衡状态的情况下进行,冷浴内的恒温介质比较合适的是:()。
A.冰-水;B.冰-盐水;C.干冰-丙酮;D.液氮。
30、稀溶液的凝固点T f与纯溶剂的凝固点T f*比较,T f < T f*的条件是:()。
A.溶质必需是挥发性B.析出的固相是固溶体C.析出的固相是纯溶剂D.析出的固相是纯溶质。
二、填空题1. 正偏差溶液形成的原因是,此时分子逸出液面的倾向增加。
2.在室温、p下,O2比N2在水中有较大的溶解度,两者在水中的Henry系数分别为k(O2)和k(N2) ,则k(O2) ___ k(N2)。
3.二元溶液,P B对Raoult定律发生负偏差,B的Henry系数k B(x) ___ p B*。
(p B*为同温下纯B 的蒸汽压)。
4. 1mol H2由20p、300K进行等温膨胀,终态压力为p。
已知终态的逸度与始态的逸度之比f2/f1 = 0.05058, 则终态与始态的化学势之差值为__________________________。
5. 298K时,纯水的蒸气压为3.43Pa,某溶液中水的物质的量分数x1= 0.98 , 与溶液呈平衡的气相中水的分压为3.07kPa。
以纯水为标准态,则该溶液中水的活度系数f H2O1。
6.由两种液体所形成的溶液,蒸气压对拉乌尔定律产生不大的正偏差,如果浓度用摩尔分数表示,当选取纯液体为参考态时,则组分的活度系数1,当选取组分在极稀溶液中服从亨利定律为参考态时,则组分的活度系数1。
(填> , = ,< )7.A、B二组分形成下列各体系时,物质B的亨利常数K X,B与其饱和蒸气压p B*相比,应该是:(1) 当A、B形成理想液态混合物时,k x,B____ p B*,(2) A、B形成一般正偏差体系,k x,B____ p B* (3) 当A、B形成一般负偏差体系时,k x,B____ p B* (填> , = ,< )8.已知A、B两组分可构成理想液体混合物,且该混合物在p下沸点为373.15K。
若A、B 两组分在373.15K时的饱和蒸气压为106658Pa和79993Pa,则该理想液体混合物的组成为:x A = ,平衡气相的组成为:y B = 。
9.在313K时,液体A的饱和蒸气压是液体B的饱和蒸气压的21倍,A和B形成理想液体混合物,当气相中A和B的物质的量相等时,液相中x A = ______________,x B = ________________________。
10.在溶质为挥发性的理想溶液中,温度T时,平衡气相和液相中,溶剂A的组成为y A=0.89、x A=0.85,纯A的蒸气压为50kPa,则溶质B的亨利系数为kPa。
